Method Article
检测小鼠咳嗽和气道炎症的方法
摘要
在这里,我们描述了使用无创和实时全身体积描记法 (WBP) 系统测量咳嗽以及收集小鼠组织样本的标准程序,并介绍了一些评估气道炎症的方法。
摘要
持续 8 周以上的慢性咳嗽是需要医疗护理的最常见主诉之一,患者承受着巨大的社会经济负担和生活质量的显着下降。动物模型可以模拟咳嗽的复杂病理生理学,是咳嗽研究的重要工具。检测咳嗽敏感性和气道炎症,对于研究咳嗽的复杂病理机制具有重要意义。本文介绍了使用无创和实时全身体积脉搏波 (WBP) 系统测量咳嗽,以及收集小鼠组织样本(包括血液、肺、脾脏和气管)的标准程序。它介绍了一些评估气道炎症的方法,包括苏木精和伊红 (HE) 染色的肺和气管切片的病理变化,支气管肺泡灌洗液 (BALF) 上清液中总蛋白浓度、尿酸浓度和乳酸脱氢酶 (LDH) 活性,以及 BALF 的白细胞和差异细胞计数。这些方法是可重复的,可作为研究咳嗽复杂病理生理学的宝贵工具。
引言
咳嗽是一种重要的防御行为,可以维持气道通畅并保护肺部免受潜在有害物质的侵害。然而,当失调时,咳嗽就会成为一种病理状况1。慢性咳嗽,通常定义为持续八周或更长时间,是需要就医的最常见症状之一2。由于慢性咳嗽经常持续数年,患者承受着巨大的社会经济负担和生活质量的显着下降 3,4,5。慢性咳嗽被广泛认为是一种咳嗽超敏反应综合征,其特征是令人烦恼的咳嗽,通常由低水平的热、机械或化学暴露引发6。咳嗽超敏反应的发生与气道炎症密切相关7。然而,需要进一步阐明调节咳嗽敏感性的病理生理机制。
动物模型可以模拟咳嗽的复杂病理生理学,是咳嗽研究的重要工具 8,9。既往研究发现,病毒感染、肺内干扰素-γ (IFN-γ) 滴注、食管灌注盐酸、污染物暴露、香烟烟雾和柠檬酸可诱发动物咳嗽10、11、12、13、14、15、16、17.为了更好地评估咳嗽和气道炎症,本研究使用非致死剂量的 H1N1 病毒建立了小鼠咳嗽模型。对于咳嗽的检测,临床上已经建立了一些咳嗽测量工具来测量咳嗽,包括主观和客观方法18。评估咳嗽严重程度的主观评价工具主要包括视觉模拟量表、咳嗽评分和生活质量问卷等19,20。然而,它们不太可能用于评估动物的咳嗽。此外,可以通过咳嗽激发试验和咳嗽频率监测客观评估咳嗽。使用全身体积描记法 (WBP) 系统的咳嗽激发试验是一种广泛用于动物研究的客观方法,用于测量咳嗽敏感性并揭示咳嗽的潜在机制13,16。根据咳嗽反射的神经解剖学特征,柠檬酸、辣椒素、5'-三磷酸腺苷 (ATP)、异硫氰酸烯丙酯 (AITC) 和炎症介质缓激肽通常用作诱导咳嗽的镇咳剂21,22。柠檬酸是最早和最广泛使用的触发咳嗽反射的咳嗽剂之一,已被验证可用于测量咳嗽敏感性。此外,柠檬酸激发试验具有良好的安全性、可行性和耐受性,建议评估对咳嗽疗法的咳嗽反射敏感性23。因此,本文将介绍使用无创实时 WBP 系统测量小鼠对柠檬酸反应的咳嗽敏感性的方法。
咳嗽病理生理学的研究需要测试样本,包括来自血液、支气管肺泡灌洗液 (BALF) 以及肺和气管组织的样本,以验证关键因素水平的变化24。目前,缺乏收集小鼠组织样本的规范程序,相关研究采用了不同的方法,使气道炎症的评估复杂化。支气管肺泡灌洗是评估呼吸系统疾病气道炎症的重要方法25。不同的支气管肺泡灌洗方法将导致相关研究之间缺乏可比性。此外,不同的支气管肺泡灌洗方法对 BALF 中的炎性细胞和炎性细胞因子有影响。因此,本文将描述使用非致死剂量的 H1N1 病毒建立小鼠咳嗽模型,使用 WBP 系统测量咳嗽,以及一种可靠、安全且非常成功的小鼠支气管肺泡灌洗方法。
研究方案
所有程序均已获得广州医科大学 (20240248) 动物护理和使用委员会的批准,并严格按照批准的指南执行。本研究使用体重 20-25 g 的雄性无特异性病原体 C57BL/6 小鼠。所有小鼠均在受控温度 (22 ± 2 °C)、湿度 (50% ± 20%) 和照明 (6:30 AM 至 6:30 PM) 下饲养在实心底部笼子中,随意提供食物和水。协议的时间线如图 1 所示。
1. 建立咳嗽小鼠模型
- 使用甲型流感/加利福尼亚/7/2009 (H1N1) 病毒。确定小鼠中 H1N1 病毒的致死剂量。
- 简而言之,用戊巴比妥钠 (80 mg·kg -1) 麻醉小鼠 (n = 10/组),然后鼻内感染 10 倍连续稀释的病毒。
- 在 15 天内监测死亡情况。通过 Reed-Muench 方法26 计算中位致死剂量 (LD50)。
- 用 H1N1 病毒感染小鼠。
- 将 0.8 x LD50 的 H1N1 病毒溶解在 50 μL 磷酸盐缓冲盐水 (PBS) 中。
- 用戊巴比妥钠 (80 mg·kg-1) 麻醉小鼠。
- 当小鼠被深度麻醉时,将小鼠置于仰卧位,鼻孔朝上。
- 使用移液管将 5-10 μL H1N1 病毒溶液或 PBS 溶液(作为对照)鼻内滴入小鼠的一个鼻孔中(图 2A)。
- 然后,用拇指闭上老鼠的嘴巴,使其鼻子用力吸气,使鼻腔中的 H1N1 病毒溶液完全吸入肺部(图 2B)。
- 在小鼠的另一个鼻腔中重复步骤 1.2.4 和 1.2.5。
- 当步骤 1.2.1 中制备的所有 H1N1 病毒鼻内滴入小鼠肺部时,将其置于仰卧位休息(图 2C)。
- 使用 Buxco 小动物全身体积描记系统测量模型建立后小鼠的咳嗽敏感性。第 21 天,用戊巴比妥钠 (150 mg·kg -1) 腹膜内麻醉小鼠。收集和处理血液、脾脏、BALF、肺和气管组织(图 1)。
2. 咳嗽敏感性测量
- 制备柠檬酸 (0.4 M):将 0.1537 mg 柠檬酸放入 5 mL 离心管中,加入生理盐水至体积为 2 mL。
- 仪器检查
- 检查通道:根据制造商的说明连接全身体积描记器腔室,然后单击校准按钮 - 校准按钮由橙色变为绿色,表示校准成功(图 3A)。
- 校准雾化器:
- 连接雾化器后,向雾化器中加入 500 μL 生理盐水,然后单击雾化按钮。
- 当雾化器中的液体完全雾化时,再次点击雾化按钮,可以看到雾化器的功率,一般约为 0.3 mL/min。再次单击 nebulization 按钮以接受当前的雾化电源。
- 检查通道后,确保误差值小于 0.5%。
- 设置参数
- 单击 Create New Study,选择 Cough 选项,选择 Mouse in Species,然后单击 Next。
- 选择 CCnt 参数:将驯化期的持续时间设置为 1 分钟,将响应时间设置为 10 分钟,将气溶胶体积设置为 1 mL,将递送持续时间设置为 10 分钟。
- 将有意识的无拘无束的小鼠放入单独的塑料透明全身体积描记器室中。输入鼠标的 Weight 和 Subject ID ,然后单击 Next。
- 向雾化器中加入 1 mL 柠檬酸 (0.4 M) 溶液,并观察 CCnt 的实时变化(图 3B)。
- 柠檬酸用完后,单击 File and End Session 完成实验。
3. 收获小鼠的血液、脾脏、BALF、肺和气管组织(图 4)
- 采集血液。
- 咳嗽检测后,通过腹膜内注射用戊巴比妥钠 (150 mg·kg-1) 麻醉小鼠。从深度麻醉的小鼠的眼眶收集血液。在 4 °C 下将 1 mL 血液与 0.1 mL 抗凝缓冲液(9.9 mg/mL 肝素钠溶于 PBS)混合(图 4A)。
- 摇动采血管,使血液和抗凝剂充分混合,以防止血液凝固。
- 将收集的血液在 4 °C 下以 800 x g 离心 5 分钟。 收集上清液,将其储存在 -80 °C(用于细胞因子测量),并将沉淀重悬于 1 mL D-Hank 溶液中。将 10 μL 血细胞悬液涂抹在载玻片上以确定细胞谱。
- 收割脾脏。
- 打开小鼠的胸部,收集血液,并通过动脉放血(图 4B)。
- 取出左耳廓,然后用 5 mL 生理盐水灌注肺循环和体循环(图 4C、D)。使用手术钳从小鼠身上去除整个脾脏(图 4E)。
- 测量脾脏的重量后,将其切成两半。在室温 (RT) 下用 4% 多聚甲醛固定前半部分以进行组织病理学分析。将后半部分储存在 -80 °C 用于细胞因子测量。
- 支气管肺泡灌洗
- 使用巴斯德移液管制作支气管肺泡灌洗管。使用酒精灯加热巴斯德移液器。当它变软时,将其拉长以形成细管。支气管肺泡灌洗管的长度为 5 厘米。上径为 5 mm,下径为 1 mm(图 5)。
- 对于 BALF 收集,通过结扎右主支气管来分离右肺。用 0.5 mL 在冰上预冷的 PBS 灌洗 3 次,从左肺收集 BALF。BALF 的回收率超过 80%(图 4F)。
- 将收集的 BALF 在 4 °C 下以 800 x g 离心 5 分钟。 收集上清液并测量总蛋白浓度、尿酸浓度、LDH 活性和细胞因子浓度。
注:根据制造商的指南24,使用检测试剂盒检测 BALF 上清液中的炎症标志物,包括总蛋白浓度、尿酸浓度和 LDH 活性。 - 将沉淀重悬于 200 μL PBS 中,并在计数玻片的帮助下对 BALF 中的白细胞进行计数。
- 要通过差异计数确定细胞图谱,请将 50 μL 细胞悬液涂抹在载玻片上并使其干燥。
- 用 4% 多聚甲醛固定载玻片过夜,然后用苏木精-伊红 (HE) 染色。每张玻片将至少 400 个细胞分为中性粒细胞、巨噬细胞、淋巴细胞或嗜酸性粒细胞。
- 收集肺和气管组织用于组织病理学分析
- BALF 收集后,在 RT 下用 4% 多聚甲醛取出并固定右肺的一半(图 4G)和气管(图 4H)以进行组织病理学分析。将另一半储存在 -80 °C 用于蛋白质印迹、实时定量聚合酶链反应 (qPCR) 和酶联免疫吸附测定 (ELISA)。
结果
图 6 显示了 HE 染色肺(图 6A、B)、气管(图 6C、D)和脾脏(图 6E、F)病理变化的代表性图像。H1N1 病毒感染导致小鼠肺部炎症改变,包括水肿和许多淋巴细胞和中性粒细胞浸润。H1N1 病毒感染还诱导小鼠气管炎症变化,包括纤毛脱落和炎性细胞浸润 (许多淋巴细胞和少量中性粒细胞)。此外,感染还显著增加了小鼠白牙髓面积与整个脾面积的比值。淋巴细胞积聚在脾脏的白色髓中。这种收集组织样本的标准化程序可以更好地评估气道炎症。
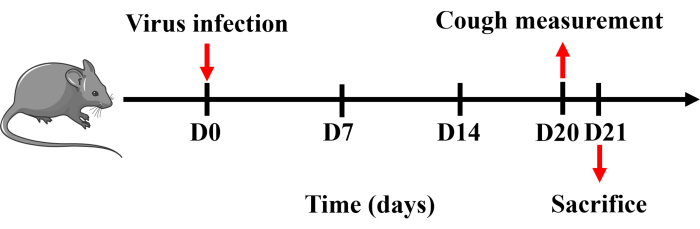
图 1:建立小鼠咳嗽模型的方案。 用戊巴比妥钠麻醉小鼠,并在第 0 天鼻内滴注 0.8 x LD50 溶于 50 μL PBS 中的 H1N1 病毒。第 20 天进行咳嗽测量,第二天处死小鼠。 请单击此处查看此图的较大版本。

图 2:H1N1 病毒的鼻内滴注。 (A) 在 50 μL PBS 中鼻内滴注 0.8 x LD50 的 H1N1 病毒。(B) 用拇指闭上鼠标的嘴巴。(C) 将小鼠置于仰卧位。 请单击此处查看此图的较大版本。

图 3:咳嗽敏感性测量。 (A) 小鼠咳嗽检测设备和 (B) 咳嗽反射曲线。建模后,使用全身体积描记法 (WBP) 系统检测响应雾化柠檬酸溶液 (0.4 M) 的咳嗽事件数量。 请单击此处查看此图的较大版本。

图 4:收获小鼠血液、脾脏、BALF、肺和气管的代表性图像。 (A) 血液采集,(B) 打开胸部,(C) 切断左耳廓,(D) 肺循环灌注,(E) 收获脾脏,(F) 支气管肺泡灌洗,以及 (G) 收获肺叶和 (H) 气管用于组织病理学分析。 请单击此处查看此图的较大版本。

图 5:支气管肺泡灌洗管规格。 支气管肺泡灌洗管的长度为 5 厘米。上直径为 5 毫米,下直径为 1 毫米。 请单击此处查看此图的较大版本。

图 6:H1N1 病毒对小鼠肺、气管和脾脏病理变化的影响。(A,B) (A) 对照组和 (B) H1N1 组 HE 染色肺切片病理变化的代表性图。"↑" 符号表示淋巴细胞(红色)和中性粒细胞(蓝色)的浸润。比例尺:50 μm。(C,D) (C) 对照组和 (D) H1N1 组 HE 染色气管切片病理变化的代表性图。"↑" 符号表示淋巴细胞(红色)和中性粒细胞(蓝色)的浸润。比例尺:20 μm。(E,F) (E) 对照组和 (F) H1N1 组 HE 染色脾切片病理变化的代表性图。"↑"符号标记白色果肉(绿色)。比例尺:500 μm。请单击此处查看此图的较大版本。
讨论
一些慢性难治性咳嗽和感染后咳嗽是与呼吸道病毒感染相关的常见病症 27。为了更好地评估咳嗽敏感性和气道炎症,本研究使用 H1N1 病毒建立了咳嗽小鼠模型。应根据研究目的为其他研究选择合适的小鼠咳嗽模型。以前的大多数研究在咳嗽的机制研究或新药试验中使用豚鼠作为动物模型 28,29,30。最近的研究表明,小鼠可能用于评估咳嗽的病理生理学,因为它们的生殖周期较短,试剂更多,并且准备好进行基因操作,尽管它们的咳嗽行为仍在争论中16,31。在本研究中,柠檬酸被用作催咳的镇咳剂。柠檬酸诱导咳嗽反射的机制可能与颈静脉 C 纤维和结节 Aδ 纤维的激活有关32。此外,WBP 系统以无创方式测量小鼠咳嗽反射的变化,并将心理压力的影响降至最低。当检测到咳嗽敏感性时,应尽量减少外部环境对小鼠的影响。应将鼠标放置在测试室内,然后用塑料袋盖住,以减少外部环境引起的刺激。
本研究详细介绍了收集小鼠血液、脾脏、BALF、肺和气管组织的规范程序,并介绍了一些评估气道炎症的测量方法。为了检测气道炎症,用苏木精和伊红对肺和气管切片进行染色,以评估一般组织病理学24。BALF 上清液中总蛋白和尿酸浓度的增加与气道中的炎症和细胞损伤有关33。BALF 上清液中的 LDH 活性反映了细胞损伤和坏死34。BALF 和血液中的白细胞可以反映疾病的炎症程度35。BALF 的差异细胞计数广泛用于评估慢性气道疾病的气道炎症,并为研究慢性呼吸系统疾病的发病机制、诊断和管理策略提供重要信息36。
本实验的局限性在于,采集大量的组织样本会使小鼠长时间操作,这可能会影响组织样本的活性。因此,小鼠组织样品在采集后需要立即置于冰上。此外,本研究中使用的支气管肺泡灌洗管适用于小鼠,但不适用于大型动物。
综上所述,我们详细介绍了小鼠咳嗽和气道炎症的检测方法。这些方法为研究人员提供了研究咳嗽复杂病理生理学的工具。
披露声明
作者没有什么可披露的。
致谢
这项工作得到了广州市科技规划项目 (202002030151)、广州市国家实验室重大项目 (GZNL2024A02001) 和呼吸疾病国家重点实验室 (SKLRD-Z-202202) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde | Biosharp | BL539A | |
| Buxco Small Animal Whole Body Plethysmography System | DSI | — | |
| Calcium-free and magnesium-free Hank’s Balanced Salt Solution | Beyotime | C0219 | |
| Citric acid | Sigma-Aldrich | C2404 | |
| Hematoxylin-Eosin | BASO Biotechnology | BA-4098 | |
| Heparin sodium | Alfa Aesar | A16198 | |
| Influenza A/California/7/2009 (H1N1) virus | ATCC | VR-1894 | |
| Isoflurane | RWD | R510-22 | |
| Lactate dehydrogenase assay kit | Nanjing Jiancheng Bioengineering Institute | A020-2-2 | |
| Normal saline | Guangzhou Zhongbo Biotechnology | 1234-1 | |
| Pasteur pipet | NEST | 318415 | |
| Pentobarbital sodium | Merck | P3761 | |
| Phosphate buffered saline | Meilunbio | MA0015 | |
| Total protein assay kit | Nanjing Jiancheng Bioengineering Institute | A045-3 | |
| Uric acid assay kit | Thermo Fisher Scientific | A22181 |
参考文献
- Brooks, S. M. Perspective on the human cough reflex. Cough. 7, 10 (2011).
- Lai, K., Long, L. Current status and future directions of chronic cough in china. Lung. 198 (1), 23-29 (2020).
- Zeiger, R. S., et al. Patient-reported burden of chronic cough in a managed care organization. J Allergy Clin Immunol Pract. 9 (4), 1624-1637.e10 (2021).
- Marchant, J. M., et al. What is the burden of chronic cough for families. Chest. 134 (2), 303-309 (2008).
- Chamberlain, S. A., et al. The impact of chronic cough: A cross-sectional european survey. Lung. 193 (3), 401-408 (2015).
- Morice, A. H., et al. Expert opinion on the cough hypersensitivity syndrome in respiratory medicine. Eur Respir J. 44 (5), 1132-1148 (2014).
- Chung, K. F., et al. Cough hypersensitivity and chronic cough. Nat Rev Dis Primers. 8 (1), 45 (2022).
- Deng, Z., et al. Pulmonary IFN-γ causes lymphocytic inflammation and cough hypersensitivity by increasing the number of IFN-γ-secreting t lymphocytes. Allergy Asthma Immunol Res. 14 (6), 653-673 (2022).
- Hiramatsu, Y., et al. The mechanism of pertussis cough revealed by the mouse-coughing model. mBio. 13 (2), e0319721 (2022).
- Lin, L., et al. The duration of cough in patients with H1N1 influenza. Clin Respir J. 11 (6), 733-738 (2017).
- Deng, Z., et al. IFN-γ enhances the cough reflex sensitivity via calcium influx in vagal sensory neurons. Am J Respir Crit Care Med. 198 (7), 868-879 (2018).
- Chen, Z., et al. Dorsal vagal complex modulates neurogenic airway inflammation in a guinea pig model with esophageal perfusion of HCl. Front Physiol. 5, 536 (2018).
- Zhi, H., et al. Gabapentin alleviated the cough hypersensitivity and neurogenic inflammation in a guinea pig model with repeated intra-esophageal acid perfusion. Eur J Pharmacol. 959, 176078 (2023).
- Fang, Z., et al. Traffic-related air pollution induces non-allergic eosinophilic airway inflammation and cough hypersensitivity in guinea-pigs. Clin Exp Allergy. 49 (3), 366-377 (2019).
- Xiang, J., et al. Fructus mume protects against cigarette smoke induced chronic cough guinea pig. J Med Food. 23 (2), 191-197 (2020).
- Chen, Z., et al. A descending pathway emanating from the periaqueductal gray mediates the development of cough-like hypersensitivity. iScience. 25 (1), 103641 (2022).
- Chen, Z., et al. Glial activation and inflammation in the nts in a rat model after exposure to diesel exhaust particles. Environ Toxicol Pharmacol. 83, 103584 (2021).
- Mai, Y., et al. Methods for assessing cough sensitivity. J Thorac Dis. 12 (9), 5224-5237 (2020).
- Lee, K. K., et al. A longitudinal assessment of acute cough. Am J Respir Crit Care Med. 187 (9), 991-997 (2013).
- Birring, S. S., et al. Development of a symptom specific health status measure for patients with chronic cough: Leicester cough questionnaire (LCQ). Thorax. 58 (4), 339-343 (2003).
- Mazzone, S. B., Farrell, M. J. Heterogeneity of cough neurobiology: Clinical implications. Pulm Pharmacol Ther. 55, 62-66 (2019).
- Morice, A. H., Kastelik, J. A., Thompson, R. Cough challenge in the assessment of cough reflex. Br J Clin Pharmacol. 52 (4), 365-375 (2001).
- Nurmi, H. M., Lätti, A. M., Brannan, J. D., Koskela, H. O. Comparison of mannitol and citric acid cough provocation tests. Respir Med. 158, 14-20 (2019).
- Ding, W., et al. Amg487 alleviates influenza a (H1N1) virus-induced pulmonary inflammation through decreasing IFN-γ-producing lymphocytes and IFN-γ concentrations. Br J Pharmacol. 181 (13), 2053-2069 (2024).
- Connett, G. J. Bronchoalveolar lavage. Paediatr Respir Rev. 1 (1), 52-56 (2000).
- Wu, X., et al. Correlation of adhesion molecules and non-typeable haemophilus influenzae growth in a mice coinfected model of acute inflammation. Microbes Infect. 23 (8), 104839 (2021).
- Capristo, C., Rossi, G. A. Post-infectious persistent cough: Pathogenesis and therapeutic options. Minerva Pediatr. 69 (5), 444-452 (2017).
- Kollarik, M., Brozmanova, M. Cough and gastroesophageal reflux: Insights from animal models. Pulm Pharmacol Ther. 22 (2), 130-134 (2009).
- Driessen, A. K., et al. A role for neurokinin 1 receptor expressing neurons in the paratrigeminal nucleus in bradykinin-evoked cough in guinea-pigs. J Physiol. 598 (11), 2257-2275 (2020).
- Ruhl, C. R., et al. Mycobacterium tuberculosis sulfolipid-1 activates nociceptive neurons and induces cough. Cell. 181 (2), 293-305.e211 (2020).
- Chen, L., Lai, K., Lomask, J. M., Jiang, B., Zhong, N. Detection of mouse cough based on sound monitoring and respiratory airflow waveforms. PLoS One. 8 (3), e59263 (2013).
- Wallace, E., Guiu Hernandez, E., Ang, A., Hiew, S., Macrae, P. A systematic review of methods of citric acid cough reflex testing. Pulm Pharmacol Ther. 58, 101827 (2019).
- Ding, W., et al. Intrapulmonary ifn-γ instillation causes chronic lymphocytic inflammation in the spleen and lung through the CXCR3 pathway. Int Immunopharmacol. 122, 110675 (2023).
- Liu, B., et al. Anti-IFN-γ therapy alleviates acute lung injury induced by severe influenza a (H1N1) pdm09 infection in mice. J Microbiol Immunol Infect. 54 (3), 396-403 (2021).
- Domagała-Kulawik, J. Bal in the diagnosis of smoking-related interstitial lung diseases: Review of literature and analysis of our experience. Diagn Cytopathol. 36 (12), 909-915 (2008).
- Miyata, Y., et al. The effect of bronchoconstriction by methacholine inhalation in a murine model of asthma. Int Arch Allergy Immunol. 181 (12), 897-907 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。