Method Article
마우스에서 기침 및 기도 염증을 감지하는 방법
요약
여기에서는 비침습적 및 실시간 전신 혈량측정(WBP) 시스템을 사용한 기침 측정과 생쥐의 조직 샘플을 채취하는 규범적 절차를 설명하고 기도 염증을 평가하는 몇 가지 방법을 소개합니다.
초록
8주 이상 지속되는 만성 기침은 의학적 치료가 필요한 가장 흔한 증상 중 하나이며, 환자들은 사회경제적 부담이 크고 삶의 질이 현저히 저하됩니다. 동물 모델은 기침의 복잡한 병태생리학을 모방할 수 있으며 기침 연구를 위한 중요한 도구입니다. 기침 민감도와 기도 염증의 감지는 기침의 복잡한 병리학적 메커니즘을 연구하는 데 매우 중요합니다. 이 기사에서는 비침습적 및 실시간 전신 혈류측정(WBP) 시스템을 사용한 기침 측정과 마우스의 조직 샘플(혈액, 폐, 비장 및 기관 포함)을 채취하기 위한 규범적 절차에 대해 설명합니다. 헤마톡실린 및 에오신(HE) 염색 폐 및 기관 절편의 병리학적 변화, 총 단백질 농도, 요산 농도, 기관지 폐포 세척액(BALF)의 상층액 내 젖산 탈수소효소(LDH) 활성, BALF의 백혈구 및 감별 세포 수를 포함하여 기도 염증을 평가하는 몇 가지 방법을 소개합니다. 이러한 방법은 재현 가능하며 기침의 복잡한 병태 생리학을 연구하는 데 유용한 도구 역할을 합니다.
서문
기침은 기도 개통을 유지하고 잠재적으로 유해한 물질로부터 폐를 보호하기 위한 중요한 방어 행동입니다. 그러나 기침이 조절되지 않으면 기침은 병리학적 상태가 된다1. 일반적으로 8주 이상 지속되는 것으로 정의되는 만성 기침은 의학적 치료가 필요한 가장 빈번한 증상 중 하나이다2. 만성 기침은 수년간 지속되는 경우가 많기 때문에 환자는 큰 사회경제적 부담과 삶의 질이 현저히 저하되는 고통을 겪게 된다 3,4,5. 만성 기침은 기침 과민성 증후군으로 널리 알려져 있으며, 종종 낮은 수준의 열적, 기계적 또는 화학적 노출로 인해 유발되는 성가신 기침이 특징이다6. 기침 과민증의 발생은 기도 염증과 밀접한 관련이 있다7. 그러나 기침 민감성 조절의 기저에 있는 병태생리학적 메커니즘은 더 해명될 필요가 있습니다.
동물 모델은 기침의 복잡한 병태생리학을 모방할 수 있으며 기침 연구에 중요한 도구입니다 8,9. 이전 연구에서는 바이러스 감염, 폐내 인터페론-γ(IFN-γ) 주입, 염산의 식도 관류, 오염 물질 노출, 담배 연기 및 구연산이 동물에서 기침을 유발할 수 있음을 발견했습니다 10,11,12,13,14,15,16,17. 기침과 기도 염증을 더 잘 평가하기 위해 이 연구에서 치명적이지 않은 용량의 H1N1 바이러스를 사용하여 기침의 마우스 모델을 설정했습니다. 기침을 감지하기 위해, 주관적 및 객관적 방법을 포함하여 기침을 측정하기 위해 일부 기침 측정 도구가 임상적으로 확립되어 있다18. 기침 중증도를 평가하기 위한 주관적 평가 도구에는 주로 시각적 아날로그 척도, 기침 점수, 삶의 질 설문지 등이 포함된다19,20. 그러나 동물의 기침을 평가하는 데 사용될 가능성은 낮습니다. 또한 기침 챌린지 검사와 기침 빈도 모니터링을 통해 기침을 객관적으로 평가할 수 있습니다. 전신 혈량측정법(WBP) 시스템을 이용한 기침 챌린지 검사는 기침 민감도를 측정하고 기침의 기저 기전을 밝히기 위해 동물 연구에서 널리 사용되는 객관적인 방법이다13,16. 기침 반사의 신경 해부학적 특성에 따라 구연산, 캡사이신, 아데노신 5'-삼인산(ATP), 알릴 이소티오시아네이트(AITC) 및 염증 매개체 브라디키닌이 기침을 유발하는 투착제로 일반적으로 사용됩니다21,22. 구연산은 기침 반사를 유발하는 가장 초기에 가장 널리 사용되는 약물 중 하나로, 기침 민감도를 측정하는 것으로 검증되었습니다. 또한, 구연산 챌린지는 안전성, 타당성 및 내약성이 우수하며, 기침 요법에 대한 반응으로 기침 반사 민감도를 평가하는 데 제안된다23. 따라서 이 기사에서는 비침습적 실시간 WBP 시스템을 사용하여 마우스의 구연산에 대한 반응으로 기침 민감도를 측정하는 방법을 설명합니다.
기침의 병태생리학에 대한 연구는 주요 요인 수치의 변화를 확인하기 위해 혈액 샘플, 기관지 폐포 세척액(BALF), 폐 및 기관 조직을 포함한 테스트 샘플이 필요하다24. 현재 생쥐의 조직 샘플을 채취하기 위한 규범적 절차가 부족하며, 관련 연구에서는 기도 염증 평가를 복잡하게 만드는 다양한 접근 방식을 사용합니다. 기관지 폐포 세척은 호흡기 질환에서 기도 염증을 평가하는 중요한 방법이다25. 기관지 폐포 세척 방법이 다르면 관련 연구 간의 비교가 부족합니다. 또한, 다양한 기관지 폐포 세척 방법은 BALF의 염증 세포와 염증성 사이토카인에 영향을 미칩니다. 따라서 이 기사에서는 치명적이지 않은 H1N1 바이러스를 사용한 기침 마우스 모델의 확립, WBP 시스템을 사용한 기침 측정, 신뢰할 수 있고 안전하며 매우 성공적인 마우스의 기관지 폐포 세척 방법에 대해 설명합니다.
프로토콜
모든 절차는 광저우 의과대학(20240248)의 동물 관리 및 사용 위원회의 승인을 받았으며 승인된 지침에 따라 엄격하게 수행되었습니다. 이 연구에는 20-25g 무게의 남성 특이 병원체가 없는 C57BL/6 마우스가 사용되었습니다. 모든 쥐는 온도(22 ± 2 °C), 습도(50% ± 20%) 및 조명(오전 6시 30분부터 오후 6시 30분까지)이 조절된 상태에서 음식과 물을 자유롭게 사용할 수 있는 단단한 바닥 케이지에 수용했습니다. 프로토콜의 타임라인은 그림 1에 나와 있습니다.
1. 기침 마우스 모델 확립
- 인플루엔자 A/California/7/2009(H1N1) 바이러스를 사용합니다. 마우스에서 H1N1 바이러스의 치사량을 측정합니다.
- 간단히 말해서, 펜토바르비탈 나트륨(80mg·kg-1)으로 마우스(그룹당 n=10)를 마취한 다음 10배 연속으로 희석된 바이러스로 비강 내에서 감염시킵니다.
- 15일 동안 사망을 모니터링합니다. Reed-Muench 방법26에 의해 중앙값 치사량(LD50)을 계산합니다.
- 마우스를 H1N1 바이러스에 감염시킵니다.
- 0.8 x LD50 의 H1N1 바이러스를 50μL의 인산염 완충 식염수(PBS)에 용해시킵니다.
- 펜토바르비탈 나트륨(80mg·kg-1)으로 마우스를 마취합니다.
- 생쥐가 깊이 마취되면 콧구멍이 위를 향하도록 생쥐를 누운 자세로 놓습니다.
- 피펫을 사용하여 5-10μL의 H1N1 바이러스 용액 또는 PBS 용액(대조군)을 생쥐의 한쪽 콧구멍에 비강 내 주입합니다(그림 2A).
- 그런 다음 쥐의 입을 엄지손가락으로 닫아 코를 세게 들이마시게 하여 비강 내 H1N1 바이러스 용액이 폐로 완전히 흡입되도록 합니다(그림 2B).
- 생쥐의 다른 비강에서 1.2.4 및 1.2.5 단계를 반복합니다.
- 1.2.1단계에서 준비한 모든 H1N1 바이러스가 쥐의 폐에 비강으로 주입되면 안정을 위해 누운 자세로 놓습니다(그림 2C).
- Buxco 소동물 전신 혈량측정기 시스템을 사용하여 모델 설정 후 마우스의 기침 민감도를 측정합니다. 21일째에 펜토바르비탈 나트륨(150mg·kg-1)으로 마우스를 복강내 마취합니다. 혈액, 비장, BALF, 폐 및 기관 조직을 수집하고 처리합니다(그림 1).
2. 기침 민감도 측정
- 구연산(0.4M) 준비: 0.1537mg의 구연산을 5mL 원심분리 튜브에 넣고 2mL 부피에 생리식염수를 추가합니다.
- 기기 검사
- 채널 확인: 제조업체의 지침에 따라 전신 혈량계 챔버를 연결하고 보정 버튼을 클릭하면 보정 버튼이 주황색에서 녹색으로 바뀌어 보정이 성공했음을 나타냅니다(그림 3A).
- 분무기 보정:
- 분무기를 연결한 후 분무기에 500μL의 생리식염수를 넣고 분무 버튼을 클릭합니다.
- 분무기의 액체가 완전히 에어로졸화되면 분무 버튼을 다시 클릭하여 일반적으로 약 0.3mL/min인 분무기의 전력을 확인합니다. 분무 버튼을 다시 클릭하면 현재 분무된 전력이 적용됩니다.
- 채널을 확인한 후 오류 값이 0.5% 미만인지 확인하십시오.
- 매개 변수 설정
- Create New Study(새 연구 생성)를 클릭하고, Cough(기침) 옵션을 선택하고, Mouse in Species(종의 마우스)를 선택하고, Next(다음)를 클릭합니다.
- CCnt 매개변수 선택: 적응 기간을 1분으로, 응답 시간을 10분으로, 에어로졸 부피를 1mL로, 전달 시간을 10분으로 설정합니다.
- 의식이 있는 제한되지 않은 쥐를 개별 플라스틱, 투명한 전신 혈량계 챔버에 넣습니다. 마우스의 Weight(무게 )와 Subject ID(피사체 ID )를 입력하고 Next(다음)를 클릭합니다.
- 구연산(0.4M) 용액 1mL를 분무기에 넣고 CCnt의 실시간 변화를 관찰합니다(그림 3B).
- 구연산을 완전히 사용한 후 File(파일 )을 클릭하고 세션을 종료 하여 실험을 완료합니다.
3. 쥐의 혈액, 비장, BALF, 폐 및 기관 조직의 채취(그림 4)
- 피를 모으십시오.
- 기침 감지 후 복강 내 주사로 펜토바르비탈 나트륨(150mg·kg-1)으로 마우스를 마취합니다. 심하게 마취된 쥐의 궤도에서 혈액을 채취합니다. 4°C에서 0.1mL의 항응고제 완충액(PBS에 용해된 헤파린 나트륨 9.9mg/mL)에 혈액 1mL를 섞습니다(그림 4A).
- 채혈관을 흔들어 혈액과 항응고제를 완전히 섞어 혈액 응고를 방지합니다.
- 채취한 혈액을 800 x g 에서 4°C에서 5분 동안 원심분리합니다. 상층액을 채취하여 -80°C(사이토카인 측정에 사용)에서 보관하고 펠릿을 D-Hank의 용액 1mL에 재현탁시킵니다. 혈액 세포 현탁액 10μL를 유리 슬라이드에 펴 바르고 세포 프로필을 확인합니다.
- 비장을 수확하십시오.
- 쥐의 가슴을 열고 피를 채취한 다음 동맥을 통해 배출합니다(그림 4B).
- 좌측 귓바퀴를 제거한 다음 폐 및 전신 순환에 5mL의 생리식염수를 관류합니다(그림 4C, D). 수술용 겸자를 사용하여 쥐의 전체 비장을 제거합니다(그림 4E).
- 비장의 무게를 측정한 후 두 부분으로 자릅니다. 조직 병리학적 분석을 위해 실온(RT)에서 4% 파라포름알데히드로 전반부를 고정합니다. 사이토카인 측정을 위해 후반부는 -80 °C에서 보관합니다.
- 기관지 폐포 세척
- 파스퇴르 피펫을 사용하여 기관지 폐포 세척관을 만듭니다. 알코올 램프를 사용하여 파스퇴르 피펫을 가열합니다. 부드러워지면 길게 늘려 얇은 튜브를 만듭니다. 기관지 폐포 세척관의 길이는 5cm입니다. 상부 직경은 5mm이고 하부 직경은 1mm입니다(그림 5).
- BALF 채취의 경우, 우측 주줄기 기관지에서 결찰을 통해 우측 폐를 분리합니다. 얼음 위에서 미리 냉각된 0.5mL의 PBS로 3회 세척하여 왼쪽 폐에서 BALF를 채취합니다. BALF의 회수율은 80% 이상입니다(그림 4F).
- 수집된 BALF를 800 x g 에서 4°C에서 5분 동안 원심분리합니다. 상층액을 채취하여 총 단백질 농도, 요산 농도, LDH 활성 및 사이토카인 농도를 측정합니다.
참고: 총 단백질 농도, 요산 농도 및 BALF 상층액의 LDH 활성을 포함한 염증 마커는 제조업체의 지침24에 따라 분석 키트를 사용하여 검출됩니다. - 펠릿을 200μL의 PBS에 재현탁시키고 계수 슬라이드를 사용하여 BALF의 백혈구를 계수합니다.
- 차등 계수에 의한 세포 프로파일을 측정하려면 세포 현탁액 50μL를 유리 슬라이드에 바르고 건조시킵니다.
- 4 % 파라 포름 알데히드로 슬라이드를 하룻밤 고정한 후 헤마 톡실 린 에오신 (HE)으로 염색합니다. 슬라이드당 최소 400개의 세포를 호중구, 대식세포, 림프구 또는 호산구로 분류합니다.
- 조직병리학적 분석을 위한 폐 및 기관 조직 채취
- BALF 채취 후 조직 병리학적 분석을 위해 RT에서 오른쪽 폐(그림 4G)와 기관(그림 4H)의 절반을 제거하고 4% 파라포름알데히드로 고정합니다. 나머지 절반은 -80°C에서 웨스턴 블로팅, 실시간 정량 중합효소 연쇄 반응(qPCR) 및 효소 결합 면역 흡착 분석(ELISA)을 위해 보관합니다.
결과
그림 6은 HE 염색된 폐(그림 6A,B), 기관(그림 6C,D) 및 비장(그림 6E,F)의 병리학적 변화를 보여주는 대표적인 이미지를 보여줍니다. H1N1 바이러스 감염은 부종과 많은 림프구 및 호중구 침윤을 포함하여 쥐의 폐에 염증성 변화를 일으켰습니다. H1N1 바이러스 감염은 또한 섬모 탈락 및 염증성 세포 침투(많은 림프구 및 적은 수의 호중구)를 포함하여 쥐 기관에서 염증성 변화를 유발했습니다. 또한, 이 감염은 생쥐의 전체 비장 영역에 대한 백색 펄프 영역의 비율을 유의하게 증가시켰습니다. 림프구는 비장의 흰색 펄프에 축적됩니다. 조직 샘플을 채취하기 위한 이 표준화된 절차는 기도 염증을 더 잘 평가할 수 있습니다.
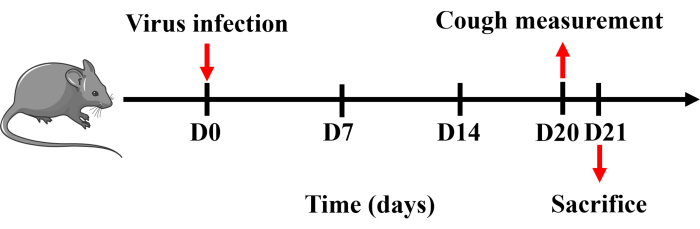
그림 1: 기침의 마우스 모델을 확립하기 위한 프로토콜. 마우스를 펜토바르비탈 나트륨으로 마취하고 0일에 한 번 50μL의 PBS에 용해된 H1N1 바이러스의 0.8 x LD50 을 비강 내 주입했습니다. 기침 측정은 20일째에 실시하였고, 다음 날에 마우스를 희생하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: H1N1 바이러스의 비강 내 점안. (A) PBS 50μL에 H1N1 바이러스 0.8 x LD50의 비강 내 점안. (B) 엄지 손가락으로 쥐의 입을 막습니다. (C) 마우스를 앙와위 위치에 놓습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 기침 민감도 측정. (A) 쥐 기침 감지 장비 및 (B) 기침 반사 곡선. 분무된 구연산 용액(0.4M)에 대한 반응으로 인한 기침 발생 횟수는 모델링 후 전신 혈량측정법(WBP) 시스템을 사용하여 감지되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 쥐의 혈액, 비장, BALF, 폐 및 기관을 채취하는 대표적인 이미지. (A) 혈액 채취, (B) 흉부 열기, (C) 좌측 귓바퀴 절단, (D) 폐 순환 관류, (E) 비장 채취, (F) 기관지 폐포 세척, (G) 폐엽 및 (H) 조직 병리학적 분석을 위한 기관 채취. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 기관지폐포 세척관 사양. 기관지 폐포 세척관의 길이는 5cm입니다. 위쪽 지름은 5mm이고 아래쪽 지름은 1mm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: H1N1 바이러스가 쥐의 폐, 기관 및 비장의 병리학적 변화에 미치는 영향. (A,B) (A) 대조군 및 (B) H1N1 그룹의 HE 염색 폐 절편의 병리학적 변화를 보여주는 대표적인 그림. "↑"의 기호는 림프구(빨간색)와 호중구(파란색)의 침윤을 표시합니다. 눈금자: 50 μm. (C,D) (C) 대조군 및 (D) H1N1 그룹의 HE 염색 기관 절편의 병리학적 변화를 나타내는 대표적인 그림. "↑"의 기호는 림프구(빨간색)와 호중구(파란색)의 침윤을 표시합니다. 눈금자: 20 μm. (E,F) (E) 대조군 및 (F) H1N1 그룹의 HE 염색 비장 절편의 병리학적 변화를 나타내는 대표적인 그림. "↑"의 기호는 흰색 펄프 (녹색)를 표시합니다. 스케일 바: 500 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
일부 만성 난치성 기침 및 감염 후 기침은 호흡기 바이러스 감염과 관련된 흔한 질환이다27. 기침 민감도와 기도 염증을 더 잘 평가하기 위해 이 연구에서 H1N1 바이러스를 사용하여 기침의 마우스 모델을 설정했습니다. 연구 목적에 따라 다른 연구를 위해 적절한 쥐 기침 모델을 선택해야 합니다. 대부분의 이전 연구에서는 기침에 대한 기계론적 연구 또는 신약 시험에서 기니피그를 동물 모델로 사용했습니다 28,29,30. 최근 연구에 따르면 생쥐는 기침 행동이 여전히 논쟁 중임에도 불구하고 생식 주기가 짧고 시약이 많으며 유전자 조작에 대한 준비가 되어 있기 때문에 기침 병태생리학을 평가하는 데 사용될 수 있다고 제안했습니다16,31. 이 연구에서 구연산은 기침을 유발하는 투척제로 사용되었습니다. 구연산에 의해 유발되는 기침 반사의 기전은 경정맥 C-섬유(jugular C-fibers) 및 nodose Aδ-섬유(nodose Aδ-fibers)의 활성화와 관련이 있을 수 있다32. 또한 WBP 시스템은 비침습적 방식으로 마우스의 기침 반사 변화를 측정하고 심리적 스트레스의 영향을 최소화합니다. 기침 민감성이 감지되면 외부 환경이 쥐에 미치는 영향을 최소화해야 합니다. 마우스를 시험실에 넣은 다음 외부 환경으로 인한 자극을 줄이기 위해 비닐 봉지로 덮어야 합니다.
이 연구는 마우스의 혈액, 비장, BALF, 폐 및 기관 조직을 채취하기 위한 규범적 절차를 자세히 설명하고 기도 염증을 평가하기 위한 몇 가지 측정을 소개합니다. 기도 염증을 감지하기 위해 폐 및 기관 절편을 헤마톡실린(hematoxylin)과 에오신(eosin)으로 염색하여 일반 조직 병리학을 평가한다24. BALF의 상층액에서 총 단백질 및 요산의 농도 증가는 기도(33)에서의 염증 및 세포 손상과 연관되어 있다. BALF의 상층액에서의 LDH 활성은 세포 손상과 괴사를 반영한다34. BALF와 혈액 속의 백혈구는 이 질병의 염증 정도를 반영할 수 있다35. BALF의 감별세포수는 만성 기도 질환에서 기도 염증을 평가하는 데 널리 사용되며, 만성 호흡기 질환의 발병 기전 연구, 진단 및 관리 전략에 중요한 정보를 제공한다36.
이 실험의 한계는 많은 수의 조직 샘플을 수집하면 마우스를 장시간 작동하게 되어 조직 샘플의 활성에 영향을 미칠 수 있다는 것입니다. 따라서 마우스 조직 샘플은 채취 후 즉시 얼음 위에 놓아야 합니다. 또한, 본 연구에서 사용된 기관지폐포 세척관은 마우스에는 적합하지만 더 큰 동물에는 적합하지 않습니다.
요약하면, 우리는 쥐에서 기침 및 기도 염증의 감지 방법에 대한 자세한 설명을 제공합니다. 이러한 방법은 연구자들에게 기침의 복잡한 병태생리학을 연구할 수 있는 도구를 제공합니다.
공개
저자는 밝힐 것이 없습니다.
감사의 말
이 연구는 광저우 과학기술계획사업(202002030151), 광저우국가연구소(GZNL2024A02001) 주요사업, 호흡기질환국가중점연구소(SKLRD-Z-202202)의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde | Biosharp | BL539A | |
| Buxco Small Animal Whole Body Plethysmography System | DSI | — | |
| Calcium-free and magnesium-free Hank’s Balanced Salt Solution | Beyotime | C0219 | |
| Citric acid | Sigma-Aldrich | C2404 | |
| Hematoxylin-Eosin | BASO Biotechnology | BA-4098 | |
| Heparin sodium | Alfa Aesar | A16198 | |
| Influenza A/California/7/2009 (H1N1) virus | ATCC | VR-1894 | |
| Isoflurane | RWD | R510-22 | |
| Lactate dehydrogenase assay kit | Nanjing Jiancheng Bioengineering Institute | A020-2-2 | |
| Normal saline | Guangzhou Zhongbo Biotechnology | 1234-1 | |
| Pasteur pipet | NEST | 318415 | |
| Pentobarbital sodium | Merck | P3761 | |
| Phosphate buffered saline | Meilunbio | MA0015 | |
| Total protein assay kit | Nanjing Jiancheng Bioengineering Institute | A045-3 | |
| Uric acid assay kit | Thermo Fisher Scientific | A22181 |
참고문헌
- Brooks, S. M. Perspective on the human cough reflex. Cough. 7, 10(2011).
- Lai, K., Long, L. Current status and future directions of chronic cough in china. Lung. 198 (1), 23-29 (2020).
- Zeiger, R. S., et al. Patient-reported burden of chronic cough in a managed care organization. J Allergy Clin Immunol Pract. 9 (4), 1624-1637.e10 (2021).
- Marchant, J. M., et al. What is the burden of chronic cough for families. Chest. 134 (2), 303-309 (2008).
- Chamberlain, S. A., et al. The impact of chronic cough: A cross-sectional european survey. Lung. 193 (3), 401-408 (2015).
- Morice, A. H., et al. Expert opinion on the cough hypersensitivity syndrome in respiratory medicine. Eur Respir J. 44 (5), 1132-1148 (2014).
- Chung, K. F., et al. Cough hypersensitivity and chronic cough. Nat Rev Dis Primers. 8 (1), 45(2022).
- Deng, Z., et al. Pulmonary IFN-γ causes lymphocytic inflammation and cough hypersensitivity by increasing the number of IFN-γ-secreting t lymphocytes. Allergy Asthma Immunol Res. 14 (6), 653-673 (2022).
- Hiramatsu, Y., et al. The mechanism of pertussis cough revealed by the mouse-coughing model. mBio. 13 (2), e0319721(2022).
- Lin, L., et al. The duration of cough in patients with H1N1 influenza. Clin Respir J. 11 (6), 733-738 (2017).
- Deng, Z., et al. IFN-γ enhances the cough reflex sensitivity via calcium influx in vagal sensory neurons. Am J Respir Crit Care Med. 198 (7), 868-879 (2018).
- Chen, Z., et al. Dorsal vagal complex modulates neurogenic airway inflammation in a guinea pig model with esophageal perfusion of HCl. Front Physiol. 5, 536(2018).
- Zhi, H., et al. Gabapentin alleviated the cough hypersensitivity and neurogenic inflammation in a guinea pig model with repeated intra-esophageal acid perfusion. Eur J Pharmacol. 959, 176078(2023).
- Fang, Z., et al. Traffic-related air pollution induces non-allergic eosinophilic airway inflammation and cough hypersensitivity in guinea-pigs. Clin Exp Allergy. 49 (3), 366-377 (2019).
- Xiang, J., et al. Fructus mume protects against cigarette smoke induced chronic cough guinea pig. J Med Food. 23 (2), 191-197 (2020).
- Chen, Z., et al. A descending pathway emanating from the periaqueductal gray mediates the development of cough-like hypersensitivity. iScience. 25 (1), 103641(2022).
- Chen, Z., et al. Glial activation and inflammation in the nts in a rat model after exposure to diesel exhaust particles. Environ Toxicol Pharmacol. 83, 103584(2021).
- Mai, Y., et al. Methods for assessing cough sensitivity. J Thorac Dis. 12 (9), 5224-5237 (2020).
- Lee, K. K., et al. A longitudinal assessment of acute cough. Am J Respir Crit Care Med. 187 (9), 991-997 (2013).
- Birring, S. S., et al. Development of a symptom specific health status measure for patients with chronic cough: Leicester cough questionnaire (LCQ). Thorax. 58 (4), 339-343 (2003).
- Mazzone, S. B., Farrell, M. J. Heterogeneity of cough neurobiology: Clinical implications. Pulm Pharmacol Ther. 55, 62-66 (2019).
- Morice, A. H., Kastelik, J. A., Thompson, R. Cough challenge in the assessment of cough reflex. Br J Clin Pharmacol. 52 (4), 365-375 (2001).
- Nurmi, H. M., Lätti, A. M., Brannan, J. D., Koskela, H. O. Comparison of mannitol and citric acid cough provocation tests. Respir Med. 158, 14-20 (2019).
- Ding, W., et al. Amg487 alleviates influenza a (H1N1) virus-induced pulmonary inflammation through decreasing IFN-γ-producing lymphocytes and IFN-γ concentrations. Br J Pharmacol. 181 (13), 2053-2069 (2024).
- Connett, G. J. Bronchoalveolar lavage. Paediatr Respir Rev. 1 (1), 52-56 (2000).
- Wu, X., et al. Correlation of adhesion molecules and non-typeable haemophilus influenzae growth in a mice coinfected model of acute inflammation. Microbes Infect. 23 (8), 104839(2021).
- Capristo, C., Rossi, G. A. Post-infectious persistent cough: Pathogenesis and therapeutic options. Minerva Pediatr. 69 (5), 444-452 (2017).
- Kollarik, M., Brozmanova, M. Cough and gastroesophageal reflux: Insights from animal models. Pulm Pharmacol Ther. 22 (2), 130-134 (2009).
- Driessen, A. K., et al. A role for neurokinin 1 receptor expressing neurons in the paratrigeminal nucleus in bradykinin-evoked cough in guinea-pigs. J Physiol. 598 (11), 2257-2275 (2020).
- Ruhl, C. R., et al. Mycobacterium tuberculosis sulfolipid-1 activates nociceptive neurons and induces cough. Cell. 181 (2), 293-305.e211 (2020).
- Chen, L., Lai, K., Lomask, J. M., Jiang, B., Zhong, N. Detection of mouse cough based on sound monitoring and respiratory airflow waveforms. PLoS One. 8 (3), e59263(2013).
- Wallace, E., Guiu Hernandez, E., Ang, A., Hiew, S., Macrae, P. A systematic review of methods of citric acid cough reflex testing. Pulm Pharmacol Ther. 58, 101827(2019).
- Ding, W., et al. Intrapulmonary ifn-γ instillation causes chronic lymphocytic inflammation in the spleen and lung through the CXCR3 pathway. Int Immunopharmacol. 122, 110675(2023).
- Liu, B., et al. Anti-IFN-γ therapy alleviates acute lung injury induced by severe influenza a (H1N1) pdm09 infection in mice. J Microbiol Immunol Infect. 54 (3), 396-403 (2021).
- Domagała-Kulawik, J. Bal in the diagnosis of smoking-related interstitial lung diseases: Review of literature and analysis of our experience. Diagn Cytopathol. 36 (12), 909-915 (2008).
- Miyata, Y., et al. The effect of bronchoconstriction by methacholine inhalation in a murine model of asthma. Int Arch Allergy Immunol. 181 (12), 897-907 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유