Method Article
マウスにおける咳嗽および気道炎症の検出方法
要約
ここでは、非侵襲的でリアルタイムの全身プレチスモグラフィー(WBP)システムを使用した咳の測定と、マウスの組織サンプルを採取するための標準的な手順について説明し、気道の炎症を評価するためのいくつかの方法を紹介します。
要約
慢性的な咳嗽は8週間以上続き、医師の診察を必要とする最も一般的な症状の1つであり、患者は大きな社会経済的負担と生活の質の著しい低下に苦しんでいます。動物モデルは、咳の複雑な病態生理学を模倣することができ、咳研究のための重要なツールです。咳過敏症と気道炎症の検出は、咳の複雑な病理学的メカニズムを研究するために非常に重要です。この記事では、非侵襲的でリアルタイムの全身プレチスモグラフィー(WBP)システムを使用した咳の測定と、マウスの組織サンプル(血液、肺、脾臓、気管を含む)を採取するための標準的な手順について説明します。ヘマトキシリンとエオシン(HE)で染色された肺と気管切片の病理学的変化、総タンパク質濃度、尿酸濃度、気管支肺胞洗浄液(BALF)の上清中の乳酸デヒドロゲナーゼ(LDH)活性、BALFの白血球と細胞数の差など、気道の炎症を評価するためのいくつかの方法を紹介します。これらの方法は再現性があり、咳の複雑な病態生理を研究するための貴重なツールとして機能します。
概要
咳は、気道の開存性を維持し、潜在的に有害な物質から肺を保護するための重要な防御行動です。しかし、調節不全になると、咳は病的状態になります1。慢性咳嗽は、通常8週間以上続くと定義され、医師の診察を必要とする最も頻繁な症状の1つです2。慢性的な咳嗽はしばしば何年も続くため、患者は大きな社会経済的負担と生活の質の著しい低下に苦しんでいます3,4,5。慢性咳嗽は、咳過敏症症候群と広く考えられており、低レベルの熱的、機械的、または化学的曝露によって引き起こされることが多い厄介な咳を特徴としています6。咳過敏症の発生は、気道の炎症と密接に関連しています7。しかし、咳感受性の調節の根底にある病態生理学的メカニズムをさらに解明する必要があります。
動物モデルは、咳の複雑な病態生理学を模倣することができ、咳研究のための重要なツールである8,9。以前の研究では、ウイルス感染、肺内インターフェロンγ(IFN-γ)点滴、塩酸の食道灌流、汚染物質への曝露、タバコの煙、およびクエン酸が動物に咳を誘発する可能性があることがわかっています10,11,12,13,14,15,16,17 .咳と気道の炎症をより適切に評価するために、この研究では、H1N1ウイルスの非致死量を使用して咳のマウスモデルが確立されました。咳の検出のために、主観的および客観的な方法18を含む、咳を測定するためにいくつかの咳測定ツールが臨床的に確立されている。咳の重症度を評価するための主観的な評価ツールには、主に視覚的なアナログスケール、咳スコア、生活の質に関するアンケートなどが含まれます19,20。ただし、動物の咳の評価に使用される可能性は低いです。さらに、咳は、咳チャレンジテストと咳の頻度モニタリングを通じて客観的に評価できます。全身プレチスモグラフィー(WBP)システムを用いた咳チャレンジテストは、咳の感受性を測定し、咳の根本的なメカニズムを明らかにするために動物実験で広く使用されている客観的な方法です13,16。咳反射の神経解剖学的特性に基づいて、クエン酸、カプサイシン、アデノシン5'-三リン酸(ATP)、アリルイソチオシアネート(AITC)、および炎症性メディエーターブラジキニンが咳を誘発する咳薬として一般的に使用されています21,22。クエン酸は、咳反射を引き起こす最も早く、最も広く使用されている咳薬の1つであり、咳の感受性を測定するために検証されています。さらに、クエン酸チャレンジは、安全性、実現可能性、忍容性が良好であり、咳嗽療法23に反応した咳反射感受性を評価することが提案されています。したがって、この記事では、非侵襲的でリアルタイムのWBPシステムを使用して、マウスのクエン酸に対する応答性咳感受性を測定する方法について説明します。
咳の病態生理学の研究には、主要な因子24のレベルの変化を確認するために、血液、気管支肺胞洗浄液(BALF)、肺および気管組織からのサンプルを含むテストサンプルが必要です。現在、マウスの組織サンプルを採取するための規範的な手順が不足しており、関連する研究では、気道炎症の評価を複雑にするさまざまなアプローチが採用されています。気管支肺胞洗浄は、呼吸器疾患の気道炎症を評価するための重要な方法です25。気管支肺胞洗浄の方法が異なると、関連する研究間の比較可能性が失われます。さらに、さまざまな気管支肺胞洗浄法が、BALFの炎症細胞と炎症性サイトカインに影響を与えます。したがって、この記事では、H1N1ウイルスの非致死量による咳嗽のマウスモデルの確立、WBPシステムを使用した咳の測定、およびマウスの信頼性が高く、安全で、非常に成功した気管支肺胞洗浄法について説明します。
プロトコル
すべての手順は、広州医科大学(20240248)の動物管理および使用委員会によって承認され、承認されたガイドラインに厳密に従って実行されました。この研究では、体重20〜25 gの雄特異的な病原体を含まないC57BL / 6マウスを使用しました。すべてのマウスは、温度(22±2°C)、湿度(50%±20%)、および照明(午前6時30分から午後6時30分)を制御した固体の底ケージに収容され、餌と水が自由に利用可能でした。プロトコルのタイムラインを 図 1 に示します。
1. 咳嗽マウスモデルの確立
- インフルエンザA/カリフォルニア/2009年7月(H1N1)ウイルスを使用してください。マウスにおけるH1N1ウイルスの致死量を決定します。
- 簡単に言えば、マウス(n = 10 /グループ)をペントバルビタールナトリウム(80 mg・kg-1)で麻酔し、次いで10倍に段階希釈したウイルスを鼻腔内に感染させる。
- 15日間にわたって死亡を監視します。致死量の中央値(LD50)をReed-Muench法26で計算する。
- マウスにH1N1ウイルスを感染させます。
- H1N1ウイルスのLD50 x 0.8を50 μLのリン酸緩衝生理食塩水(PBS)に溶解します。
- ペントバルビタールナトリウム(80 mg・kg-1)でマウスを麻酔します。
- マウスに深く麻酔をかけたら、鼻孔を上に向けてマウスを仰臥位に置きます。
- ピペットを使用して、5〜10μLのH1N1ウイルス溶液またはPBS溶液(対照として)をマウスの1つの鼻孔に鼻腔内に注入します(図2A)。
- 次に、マウスの口を親指で閉じて鼻を強く吸い込み、鼻腔内のH1N1ウイルス溶液が肺に完全に吸い込まれるようにします(図2B)。
- マウスの他の鼻腔で手順1.2.4と1.2.5を繰り返します。
- ステップ1.2.1で調製したすべてのH1N1ウイルスをマウスの肺に鼻腔内注入したら、仰臥位にして安静にします(図2C)。
- モデル樹立後のマウスの咳感受性を、Buxco小動物全身プレチスモグラフィーシステムを用いて測定します。21日目に、ペントバルビタールナトリウム(150 mg・kg-1)でマウスに腹腔内麻酔をかけます。血液、脾臓、BALF、肺、気管組織を採取して処理します(図1)。
2. 咳過敏測定
- クエン酸(0.4 M)を調製する:0.1537 mgのクエン酸を5 mLの遠心チューブに入れ、生理食塩水を2 mLの容量に加えます。
- 機器検査
- チャネルを確認してください:製造元の指示に従って全身プレチスモグラフチャンバーを接続し、キャリブレーションボタンをクリックします-キャリブレーションボタンがオレンジから緑に変わり、キャリブレーションが成功したことを示します(図3A)。
- ネブライザーを校正します。
- ネブライザーを接続した後、500μLの生理食塩水をネブライザーに加え、ネブライザーボタンをクリックします。
- ネブライザー内の液体が完全にエアロゾル化されたら、ネブライザーボタンをもう一度クリックして、ネブライザーの出力(通常は約0.3 mL / min)を確認します。ネブライザーボタンをもう一度クリックして、現在のネブライザーパワーを受け入れます。
- チャネルを確認した後、エラー値が0.5%未満であることを確認してください。
- パラメータの設定
- 「新規スタディを作成」をクリックし、「咳」オプションを選択し、「マウス・イン・シーズ」を選択して「次へ」をクリックします。
- CCntパラメータを選択します:順化期間の期間を1分、応答時間を10分、エアロゾル量を1mL、送達時間を10分に設定します。
- 意識のある拘束されていないマウスを、個々のプラスチック製の透明な全身プレチスモグラフチャンバーに入れます。マウスの Weight と Subject ID を入力し、 Next をクリックします。
- ネブライザーに1 mLのクエン酸(0.4 M)溶液を加え、CCntのリアルタイムな変化を観察します(図3B)。
- クエン酸を完全に使用した後、「 ファイル 」および 「セッションの終了 」をクリックして実験を完了します。
3. マウスの血液、脾臓、BALF、肺、気管組織の採取(図4)
- 血液を採取します。
- 咳の検出後、腹腔内注射によりペントバルビタールナトリウム(150mg・kg-1)でマウスを麻酔します。深く麻酔をかけたマウスの眼窩から血液を採取します。1 mLの血液を0.1 mLの抗凝固バッファー(9.9 mg / mLヘパリンナトリウムをPBSに溶解)に4°Cで混合します(図4A)。
- 採血チューブを振って血液と抗凝固剤を完全に混合し、血液凝固を防ぎます。
- 採取した血液を800 x g で4°Cで5分間遠心分離します。 上清を採取し、-80°C(サイトカイン測定に使用)で保存し、ペレットをD-ハンク溶液1mLに再懸濁します。血球懸濁液10 μLをスライドガラス上に広げて、細胞プロファイルを決定します。
- 脾臓を収穫します。
- マウスの胸部を開き、血液を採取し、動脈から放血します(図4B)。
- 左耳介を取り出し、5 mLの生理食塩水で肺循環と体循環に灌流します(図4C、D)。外科用鉗子を使用してマウスから脾臓全体を切除します(図4E)。
- 脾臓の重量を測定した後、脾臓を2つに切ります。前半を4%パラホルムアルデヒドで室温(RT)で固定し、病理組織学的解析を行います。後半はサイトカイン測定のために-80°Cで保存します。
- 気管支肺胞洗浄
- パスツールピペットを使用して気管支肺胞洗浄チューブを作成します。アルコールランプを使用してパスツールピペットを加熱します。柔らかくなったら、伸ばして細い筒状にします。気管支肺胞洗浄チューブの長さは5cmです。上側の直径は5mm、下の直径は1mmです(図5)。
- BALFコレクションの場合は、右主気管支で結紮することにより、右肺を分離します。氷上で予冷した0.5mLのPBSで3回洗浄することにより、左肺からBALFを収集します。BALFの回収率は80%以上です(図4F)。
- 回収したBALFを800 x g で4°Cで5分間遠心分離します。 上清を採取し、総タンパク質濃度、尿酸濃度、LDH活性、サイトカイン濃度を測定します。
注:全タンパク質濃度、尿酸濃度、およびBALF上清中のLDH活性を含む炎症マーカーは、メーカーのガイドライン24に従ってアッセイキットを使用して検出される。 - ペレットを200 μLのPBSに再懸濁し、計数スライドを使用してBALFで白血球をカウントします。
- 微分カウントで細胞プロファイルを決定するには、細胞懸濁液の50 μLをスライドガラスに塗抹し、乾燥させます。
- スライドを4%パラホルムアルデヒドで一晩固定し、次にヘマトキシリン-エオシン(HE)で染色します。スライドごとに少なくとも 400 個の細胞を好中球、マクロファージ、リンパ球、または好酸球に分類します。
- 組織病理学的分析のための肺および気管組織の採取
- BALF収集後、組織病理学的分析のために、右肺の半分(図4G)と気管(図4H)をRTで4%パラホルムアルデヒドで取り外して固定します。残りの半分は、ウェスタンブロッティング、リアルタイム定量的ポリメラーゼ連鎖反応(qPCR)、および酵素結合免疫吸着アッセイ(ELISA)のために-80°Cで保存します。
結果
図6 は、HE染色された肺(図6A、B)、気管(図6C、D)、および脾臓(図6E、F)の病理学的変化の代表的な画像を示しています。H1N1ウイルスの感染は、浮腫や多くのリンパ球、好中球の浸潤など、マウスの肺に炎症性変化をもたらしました。H1N1ウイルス感染は、繊毛の排出や炎症性細胞浸潤(多数のリンパ球と少数の好中球)など、マウスの気管に炎症性変化も引き起こしました。さらに、感染により、マウスの全脾臓領域に対する白色歯髄領域の比率も有意に増加しました。リンパ球は脾臓の白い歯髄に蓄積します。組織サンプルを採取するためのこの標準化された手順は、気道の炎症をより適切に評価することができます。
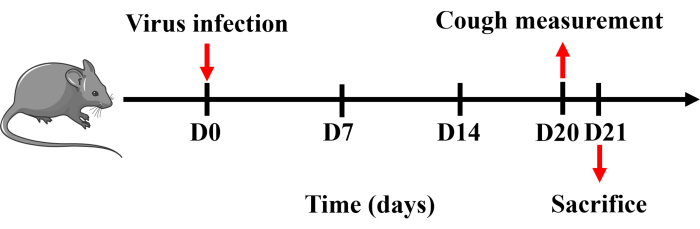
図1:咳のマウスモデルを確立するためのプロトコル。 マウスにペントバルビタールナトリウムを投与し、0日目に1回、PBSの50μLに溶解したH1N1ウイルスの0.8×LD50 を鼻腔内に点滴した。20日目に咳測定を行い、翌日にマウスを孕殺した。 この図の拡大版を表示するには、ここをクリックしてください。

図2:H1N1ウイルスの鼻腔内注入 (A)50μLのPBS中にH1N1ウイルスの0.8×LD50の鼻腔内注入。(B)親指でマウスの口を閉じたまま。(C)マウスを仰臥位に置く。 この図の拡大版を表示するには、ここをクリックしてください。

図3:咳感度測定(A)マウス咳検出装置、(B)咳反射曲線。噴霧されたクエン酸溶液(0.4 M)に応答する咳イベントの数は、モデリング後に全身プレチスモグラフィー(WBP)システムを使用して検出されました。この図の拡大版を表示するには、ここをクリックしてください。

図4:マウスの血液、脾臓、BALF、肺、気管を採取した代表的な画像(A)採血、(B)胸部を開く、(C)左耳介を切断する、(D)肺循環灌流、(E)脾臓を採取する、(F)気管支肺胞洗浄を行う、(G)肺葉と(H)組織病理学的解析のための気管を採取する様子。この図の拡大版を表示するには、ここをクリックしてください。

図5:気管支肺胞洗浄管の仕様。 気管支肺胞洗浄チューブの長さは5cmです。上の直径は5 mm、下の直径は1 mmです。 この図の拡大版を表示するには、ここをクリックしてください。

図6:マウスの肺、気管、脾臓の病理学的変化に対するH1N1ウイルスの影響 (A,B) (A)対照群と(B)H1N1群のHE染色肺切片の病理学的変化の代表的な図。「↑」の記号は、リンパ球(赤)と好中球(青)の浸潤を示しています。スケールバー:50 μm. (C,D) (C)コントロール群と(D)H1N1群のHE染色気管切片の病理学的変化の代表的な数値。「↑」の記号は、リンパ球(赤)と好中球(青)の浸潤を示しています。スケールバー:20 μm. (E,F) (E)コントロール群および(F)H1N1群のHE染色脾臓切片の病理学的変化の代表的な数値。「↑」の記号は白い果肉(緑)を示しています。スケールバー:500μmこの図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
一部の慢性難治性咳嗽および感染後咳嗽は、呼吸器ウイルス感染に関連する一般的な状態である27。咳の感受性と気道の炎症をより適切に評価するために、この研究ではH1N1ウイルスを使用して咳のマウスモデルを確立しました。研究の目的に応じて、他の研究に適したマウス咳モデルを選択する必要があります。以前のほとんどの研究では、咳28,29,30のメカニズム研究または新薬試験でモルモットを動物モデルとして使用していました。最近の研究では、マウスは生殖周期が短く、試薬が多く、咳の行動がまだ議論されているにもかかわらず遺伝子操作の準備ができているため、咳の病態生理学を評価するために使用できる可能性があることが示唆されています16,31。この研究では、クエン酸は咳を誘発するための咳薬として使用されました。クエン酸によって誘発される咳反射のメカニズムは、頸静脈C線維およびNodose Aδ線維の活性化に関連している可能性がある32。さらに、WBPシステムは、マウスの咳反射の変化を非侵襲的に測定し、心理的ストレスの影響を最小限に抑えます。咳過敏症が検出された場合、マウスに対する外部環境の影響は最小限に抑える必要があります。マウスを試験室に置いてから、外部環境による刺激を減らすためにビニール袋で覆う必要があります。
この研究では、マウスの血液、脾臓、BALF、肺、および気管組織を採取するための標準的な手順を詳しく説明し、気道の炎症を評価するためのいくつかの測定値を紹介します。気道の炎症を検出するために、肺と気管切片をヘマトキシリンとエオシンで染色して、一般的な組織病理学を評価します24。BALFの上清中の総タンパク質および尿酸濃度の増加は、気道33の炎症および細胞損傷と関連している。BALFの上清中のLDH活性は、細胞の損傷と壊死を反映している34。BALFおよび血液中の白血球は、疾患の炎症の程度を反映することができる35。BALFの微分細胞数は、慢性気道疾患における気道炎症の評価に広く使用されており、慢性呼吸器疾患の病因の研究、診断、および管理戦略において重要な情報を提供する36。
この実験の限界は、多数の組織サンプルを採取するとマウスを長時間操作することになり、組織サンプルの活性に影響を与える可能性があることです。そのため、マウス組織サンプルは採取後すぐに氷の上に置く必要があります。さらに、この研究で使用された気管支肺胞洗浄チューブはマウスには適していますが、より大きな動物には適していません。
要約すると、マウスの咳と気道炎症の検出方法について詳しく説明します。これらの方法は、研究者に咳の複雑な病態生理学を研究するためのツールを提供します。
開示事項
著者は何も開示していません。
謝辞
この研究は、広州科学技術計画プロジェクト(202002030151)、広州国立研究所の主要プロジェクト(GZNL2024A02001)、および呼吸器疾患国家重点研究所(SKLRD-Z-202202)の助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde | Biosharp | BL539A | |
| Buxco Small Animal Whole Body Plethysmography System | DSI | — | |
| Calcium-free and magnesium-free Hank’s Balanced Salt Solution | Beyotime | C0219 | |
| Citric acid | Sigma-Aldrich | C2404 | |
| Hematoxylin-Eosin | BASO Biotechnology | BA-4098 | |
| Heparin sodium | Alfa Aesar | A16198 | |
| Influenza A/California/7/2009 (H1N1) virus | ATCC | VR-1894 | |
| Isoflurane | RWD | R510-22 | |
| Lactate dehydrogenase assay kit | Nanjing Jiancheng Bioengineering Institute | A020-2-2 | |
| Normal saline | Guangzhou Zhongbo Biotechnology | 1234-1 | |
| Pasteur pipet | NEST | 318415 | |
| Pentobarbital sodium | Merck | P3761 | |
| Phosphate buffered saline | Meilunbio | MA0015 | |
| Total protein assay kit | Nanjing Jiancheng Bioengineering Institute | A045-3 | |
| Uric acid assay kit | Thermo Fisher Scientific | A22181 |
参考文献
- Brooks, S. M. Perspective on the human cough reflex. Cough. 7, 10 (2011).
- Lai, K., Long, L. Current status and future directions of chronic cough in china. Lung. 198 (1), 23-29 (2020).
- Zeiger, R. S., et al. Patient-reported burden of chronic cough in a managed care organization. J Allergy Clin Immunol Pract. 9 (4), 1624-1637.e10 (2021).
- Marchant, J. M., et al. What is the burden of chronic cough for families. Chest. 134 (2), 303-309 (2008).
- Chamberlain, S. A., et al. The impact of chronic cough: A cross-sectional european survey. Lung. 193 (3), 401-408 (2015).
- Morice, A. H., et al. Expert opinion on the cough hypersensitivity syndrome in respiratory medicine. Eur Respir J. 44 (5), 1132-1148 (2014).
- Chung, K. F., et al. Cough hypersensitivity and chronic cough. Nat Rev Dis Primers. 8 (1), 45 (2022).
- Deng, Z., et al. Pulmonary IFN-γ causes lymphocytic inflammation and cough hypersensitivity by increasing the number of IFN-γ-secreting t lymphocytes. Allergy Asthma Immunol Res. 14 (6), 653-673 (2022).
- Hiramatsu, Y., et al. The mechanism of pertussis cough revealed by the mouse-coughing model. mBio. 13 (2), e0319721 (2022).
- Lin, L., et al. The duration of cough in patients with H1N1 influenza. Clin Respir J. 11 (6), 733-738 (2017).
- Deng, Z., et al. IFN-γ enhances the cough reflex sensitivity via calcium influx in vagal sensory neurons. Am J Respir Crit Care Med. 198 (7), 868-879 (2018).
- Chen, Z., et al. Dorsal vagal complex modulates neurogenic airway inflammation in a guinea pig model with esophageal perfusion of HCl. Front Physiol. 5, 536 (2018).
- Zhi, H., et al. Gabapentin alleviated the cough hypersensitivity and neurogenic inflammation in a guinea pig model with repeated intra-esophageal acid perfusion. Eur J Pharmacol. 959, 176078 (2023).
- Fang, Z., et al. Traffic-related air pollution induces non-allergic eosinophilic airway inflammation and cough hypersensitivity in guinea-pigs. Clin Exp Allergy. 49 (3), 366-377 (2019).
- Xiang, J., et al. Fructus mume protects against cigarette smoke induced chronic cough guinea pig. J Med Food. 23 (2), 191-197 (2020).
- Chen, Z., et al. A descending pathway emanating from the periaqueductal gray mediates the development of cough-like hypersensitivity. iScience. 25 (1), 103641 (2022).
- Chen, Z., et al. Glial activation and inflammation in the nts in a rat model after exposure to diesel exhaust particles. Environ Toxicol Pharmacol. 83, 103584 (2021).
- Mai, Y., et al. Methods for assessing cough sensitivity. J Thorac Dis. 12 (9), 5224-5237 (2020).
- Lee, K. K., et al. A longitudinal assessment of acute cough. Am J Respir Crit Care Med. 187 (9), 991-997 (2013).
- Birring, S. S., et al. Development of a symptom specific health status measure for patients with chronic cough: Leicester cough questionnaire (LCQ). Thorax. 58 (4), 339-343 (2003).
- Mazzone, S. B., Farrell, M. J. Heterogeneity of cough neurobiology: Clinical implications. Pulm Pharmacol Ther. 55, 62-66 (2019).
- Morice, A. H., Kastelik, J. A., Thompson, R. Cough challenge in the assessment of cough reflex. Br J Clin Pharmacol. 52 (4), 365-375 (2001).
- Nurmi, H. M., Lätti, A. M., Brannan, J. D., Koskela, H. O. Comparison of mannitol and citric acid cough provocation tests. Respir Med. 158, 14-20 (2019).
- Ding, W., et al. Amg487 alleviates influenza a (H1N1) virus-induced pulmonary inflammation through decreasing IFN-γ-producing lymphocytes and IFN-γ concentrations. Br J Pharmacol. 181 (13), 2053-2069 (2024).
- Connett, G. J. Bronchoalveolar lavage. Paediatr Respir Rev. 1 (1), 52-56 (2000).
- Wu, X., et al. Correlation of adhesion molecules and non-typeable haemophilus influenzae growth in a mice coinfected model of acute inflammation. Microbes Infect. 23 (8), 104839 (2021).
- Capristo, C., Rossi, G. A. Post-infectious persistent cough: Pathogenesis and therapeutic options. Minerva Pediatr. 69 (5), 444-452 (2017).
- Kollarik, M., Brozmanova, M. Cough and gastroesophageal reflux: Insights from animal models. Pulm Pharmacol Ther. 22 (2), 130-134 (2009).
- Driessen, A. K., et al. A role for neurokinin 1 receptor expressing neurons in the paratrigeminal nucleus in bradykinin-evoked cough in guinea-pigs. J Physiol. 598 (11), 2257-2275 (2020).
- Ruhl, C. R., et al. Mycobacterium tuberculosis sulfolipid-1 activates nociceptive neurons and induces cough. Cell. 181 (2), 293-305.e211 (2020).
- Chen, L., Lai, K., Lomask, J. M., Jiang, B., Zhong, N. Detection of mouse cough based on sound monitoring and respiratory airflow waveforms. PLoS One. 8 (3), e59263 (2013).
- Wallace, E., Guiu Hernandez, E., Ang, A., Hiew, S., Macrae, P. A systematic review of methods of citric acid cough reflex testing. Pulm Pharmacol Ther. 58, 101827 (2019).
- Ding, W., et al. Intrapulmonary ifn-γ instillation causes chronic lymphocytic inflammation in the spleen and lung through the CXCR3 pathway. Int Immunopharmacol. 122, 110675 (2023).
- Liu, B., et al. Anti-IFN-γ therapy alleviates acute lung injury induced by severe influenza a (H1N1) pdm09 infection in mice. J Microbiol Immunol Infect. 54 (3), 396-403 (2021).
- Domagała-Kulawik, J. Bal in the diagnosis of smoking-related interstitial lung diseases: Review of literature and analysis of our experience. Diagn Cytopathol. 36 (12), 909-915 (2008).
- Miyata, Y., et al. The effect of bronchoconstriction by methacholine inhalation in a murine model of asthma. Int Arch Allergy Immunol. 181 (12), 897-907 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved