Method Article
Методы выявления кашля и воспаления дыхательных путей у мышей
В этой статье
Резюме
В этой статье мы описываем измерение кашля с помощью неинвазивной системы плетизмографии всего тела (WBP) в режиме реального времени, а также нормативные процедуры сбора образцов тканей мышей, а также представляем некоторые методы оценки воспаления дыхательных путей.
Аннотация
Хронический кашель, который длится более 8 недель, является одной из наиболее распространенных жалоб, требующих медицинской помощи, и пациенты страдают от огромного социально-экономического бремени и заметного снижения качества жизни. Животные модели могут имитировать сложную патофизиологию кашля и являются важными инструментами для исследований кашля. Выявление чувствительности к кашлю и воспаления дыхательных путей имеет большое значение для изучения сложного патологического механизма кашля. В этой статье описывается измерение кашля с помощью неинвазивной системы плетизмографии всего тела (WBP) в режиме реального времени, а также нормативные процедуры сбора образцов тканей (включая кровь, легкие, селезенку и трахею) мышей. В нем представлены некоторые методы оценки воспаления дыхательных путей, включая патологические изменения в окрашенных гематоксилином и эозином (HE) срезах легких и трахеи, концентрацию общего белка, концентрацию мочевой кислоты и активность лактатдегидрогеназы (ЛДГ) в надосадочной жидкости бронхоальвеолярного лаважа (BALF), а также лейкоциты и дифференциальное количество клеток BALF. Эти методы воспроизводимы и служат ценным инструментом для изучения сложной патофизиологии кашля.
Введение
Кашель является важным защитным поведением для поддержания проходимости дыхательных путей и защиты легких от потенциально вредных веществ. Однако, когда кашель нарушается, он становится патологическим состоянием1. Хронический кашель, обычно определяемый как длящийся восемь или более недель, является одним из наиболее частых симптомов, требующих медицинской помощи. Поскольку хронический кашель часто сохраняется в течение многих лет, пациенты страдают от огромного социально-экономического бремени и заметного снижениякачества жизни. Хронический кашель широко рассматривается как синдром гиперчувствительности к кашлю и характеризуется неприятным кашлем, часто вызванным низким уровнем термического, механического или химического воздействия6. Возникновение гиперчувствительности к кашлю тесно связано с воспалением дыхательных путей7. Тем не менее, патофизиологические механизмы, лежащие в основе модуляции чувствительности к кашлю, нуждаются в дальнейшем выяснении.
Животные модели могут имитировать сложную патофизиологию кашля и являются важными инструментами для исследований кашля 8,9. Предыдущие исследования показали, что вирусная инфекция, внутрилегочная инстилляция интерферона-γ (ИФН-γ), перфузия соляной кислоты в пищеводе, воздействие загрязняющих веществ, сигаретный дым и лимонная кислота могут вызвать кашель у животных 10,11,12,13,14,15,16,17. Для того, чтобы лучше оценить кашель и воспаление дыхательных путей, в этом исследовании была создана мышиная модель кашля с использованием нелетальной дозы вируса H1N1. Для выявления кашля были созданы некоторые клинические инструменты измерения кашля, включая субъективные и объективные методы18. К субъективным оценочным инструментам для оценки тяжести кашля в первую очередь относятся визуальная аналоговая шкала, оценка кашля, опросники качества жизни и т.д.19,20. Однако их вряд ли можно использовать для оценки кашля у животных. Кроме того, кашель можно объективно оценить с помощью теста на кашель и мониторинга частоты кашля. Провокационный тест на кашель с использованием системы плетизмографии всего тела (WBP) является объективным методом, широко используемым в исследованиях на животных для измерения чувствительности к кашлю и выявления основных механизмов кашля13,16. Основываясь на нейроанатомических характеристиках кашлевого рефлекса, лимонная кислота, капсаицин, аденозин-5'-трифосфат (АТФ), аллилизотиоцианат (АИТК) и медиатор воспаления брадикинин обычно используются в качестве кашлевых агентов для индуцирования кашля21,22. Лимонная кислота является одним из самых ранних и широко используемых противокашлевых агентов, вызывающих кашлевые рефлексы, который был валидирован для измерения чувствительности к кашлю. Кроме того, воздействие лимонной кислотой обладает хорошей безопасностью, осуществимостью и переносимостью, и рекомендуется для оценки чувствительности кашлевого рефлекса в ответ на терапию кашля23. Поэтому в данной статье будет описан метод измерения чувствительности к кашлю в ответ на лимонную кислоту у мышей с использованием неинвазивной системы WBP в режиме реального времени.
Для изучения патофизиологии кашля требуются тестовые образцы, в том числе образцы крови, жидкости бронхоальвеолярного лаважа (BALF), а также тканей легких и трахеи для подтверждения изменений уровней ключевых факторов24. В настоящее время отсутствуют нормативные процедуры для сбора образцов тканей мышей, и в соответствующих исследованиях используются различные подходы, которые усложняют оценку воспаления дыхательных путей. Бронхоальвеолярный лаваж является важным методом оценки воспаления дыхательных путей при респираторных заболеваниях25. Различные методы бронхоальвеолярного лаважа приведут к отсутствию сопоставимости между родственными исследованиями. Кроме того, различные методы бронхоальвеолярного лаважа оказывают воздействие на воспалительные клетки и воспалительные цитокины в БАЛЬФ. Поэтому в данной статье будет описано создание мышиной модели кашля с нелетальной дозой вируса H1N1, измерение кашля с помощью системы WBP, а также надежный, безопасный и очень успешный метод бронхоальвеолярного лаважа у мышей.
протокол
Все процедуры были одобрены Комитетом по уходу за животными и их использованию Гуанчжоуского медицинского университета (20240248) и выполнялись в строгом соответствии с утвержденными рекомендациями. В данном исследовании использовались мыши-самцы C57BL/6 без патогенов массой 20-25 г. Все мыши содержались при контролируемой температуре (22 ± 2 °C), влажности (50% ± 20%) и освещении (с 6:30 утра до 6:30 вечера) в клетках с твердым дном, где еда и вода были доступны в неограниченном количестве. Временная шкала протокола показана на рисунке 1.
1. Создание мышиной модели кашля
- Используйте вирус гриппа A/California/7/2009 (H1N1). Определение смертельной дозы вируса H1N1 у мышей.
- Вкратце, обезболить мышей (n = 10 в группе) пентобарбиталом натрия (80 мг·кг-1), а затем интраназально инфицировать серийно разведенным в 10 раз вирусом.
- Наблюдайте за смертью в течение 15 дней. Рассчитайте медианную смертельную дозу (ЛД50) по методу Рида-Мюнха26.
- Заразите мышь вирусом H1N1.
- Растворите 0,8 x LD50 вируса H1N1 в 50 мкл фосфатно-солевого буфера (PBS).
- Обезболивайте мышей пентобарбиталом натрия (80 мг·кг-1).
- Когда мыши будут глубоко обезболены, поместите мышь в положение лежа на спине ноздрями вверх.
- Закапывайте 5-10 мкл раствора вируса H1N1 или раствора PBS (в качестве контроля) интраназально в одну ноздрю мышей с помощью пипетки (рис. 2A).
- Затем зажмите рот мыши закрытым большим пальцем, чтобы ее нос сильно вдохнул, чтобы раствор вируса H1N1 в носовой полости полностью вдохнул его в легкие (Рисунок 2B).
- Повторите шаги 1.2.4 и 1.2.5 в другой носовой полости мышей.
- Когда весь вирус H1N1, приготовленный на этапе 1.2.1, будет интраназально введен в легкие мыши, поместите его в положение лежа на спине для отдыха (рисунок 2C).
- Измерьте чувствительность мыши к кашлю после создания модели с помощью системы плетизмографии всего тела мелких животных Buxco. На 21-е сутки внутрибрюшинную анестезию мыши пентобарбиталом натрия (150 мг·кг-1). Сбор и обработка тканей крови, селезенки, BALF, легких и трахеи (рисунок 1).
2. Измерение чувствительности к кашлю
- Приготовьте лимонную кислоту (0,4 М): Поместите 0,1537 мг лимонной кислоты в центрифужную пробирку объемом 5 мл и добавьте обычный физиологический раствор до объема 2 мл.
- Контрольно-измерительный контроль
- Проверьте каналы: Подключите камеры плетизмографа всего тела в соответствии с инструкциями производителя и нажмите кнопку калибровки - кнопка калибровки изменится с оранжевого на зеленый, указывая на успешное выполнение калибровки (рисунок 3A).
- Калибруем небулайзер:
- После подключения небулайзера добавьте в небулайзер 500 μL обычного физиологического раствора и нажмите кнопку распыления.
- Когда жидкость в небулайзере полностью распылится, нажмите кнопку распыления еще раз, чтобы увидеть мощность небулайзера, которая обычно составляет около 0,3 мл/мин. Нажмите кнопку распыления еще раз, чтобы принять текущее распыленное питание.
- После проверки каналов убедитесь, что значение ошибки составляет менее 0,5%.
- Настройка параметров
- Нажмите «Создать новое исследование», выберите опцию «Кашель», выберите «Мышь» в разделе «Виды» и нажмите «Далее».
- Выберите параметры CCnt : установите продолжительность периода акклиматизации равной 1 минуте, время отклика — 10 минут, объем аэрозоля — 1 мл, а продолжительность доставки — 10 минут.
- Поместите находящуюся в сознании обездвиженную мышь в отдельные пластиковые прозрачные камеры для плетизмографа всего тела. Введите Weight и Subject ID мыши и нажмите Next.
- Добавьте 1 мл раствора лимонной кислоты (0,4 М) в небулайзер и наблюдайте за изменениями CCnt в режиме реального времени (рис. 3B).
- После того как лимонная кислота будет полностью использована, нажмите «Файл » и «Завершить сеанс », чтобы завершить эксперимент.
3. Забор крови, селезенки, BALF, легких и тканей трахеи мыши (Рисунок 4)
- Соберите кровь.
- После обнаружения кашля обезболить мышь пентобарбиталом натрия (150 мг·кг-1) путем внутрибрюшинного введения. Соберите кровь с орбит мыши, находящейся под глубоким наркозом. Смешайте 1 мл крови с 0,1 мл антикоагулянтного буфера (9,9 мг/мл гепарина натрия, растворенного в PBS) при 4 °C (рис. 4A).
- Встряхните пробирку для сбора крови, чтобы полностью смешать кровь и антикоагулянт для предотвращения свертывания крови.
- Собранную кровь центрифугируют при концентрации 800 x g в течение 5 мин при 4 °C. Соберите надосадочную жидкость, храните ее при температуре -80 °C (используется для измерения цитокинов) и повторно суспендируйте гранулу в 1 мл раствора D-Hank. Распределите 10 мкл суспензии клеток крови на предметном стекле, чтобы определить профили клеток.
- Соберите урожай из селезенки.
- Откройте грудную клетку мыши, соберите кровь и обескровливайте через артерию (Рисунок 4B).
- Удалите левое ушное предсердие, а затем перфузируйте легочный и системный кровоток 5 мл нормального физиологического раствора (рис. 4C, D). Удалите всю селезенку из мыши с помощью хирургических щипцов (рисунок 4E).
- Измерив вес селезенки, разрежьте ее на две половинки. Зафиксируйте первую половину с 4% параформальдегидом при комнатной температуре (RT) для гистопатологического анализа. Вторую половину хранить при температуре -80 °C для измерения цитокинов.
- Бронхоальвеолярный лаваж
- Сделайте трубку для бронхоальвеолярного лаважа с помощью пипетки Пастера. Нагрейте пипетку Пастера с помощью спиртовой лампы. Когда он станет мягким, удлините его, чтобы получилась тонкая трубка. Длина трубки бронхоальвеолярного лаважа составляет 5 см. Верхний диаметр составляет 5 мм, а нижний диаметр – 1 мм (Рисунок 5).
- Для сбора BALF отделите правое легкое путем лигирования в правом главном бронхе. Соберите BALF из левого легкого путем трехкратного промывания 0,5 мл PBS, предварительно охлажденного на льду. Коэффициент извлечения BALF составляет более 80% (рисунок 4F).
- Собранный BALF центрифугирует при 800 x g в течение 5 мин при 4 °C. Соберите надосадочную жидкость и измерьте общую концентрацию белка, концентрацию мочевой кислоты, активность ЛДГ и концентрацию цитокинов.
ПРИМЕЧАНИЕ: Маркеры воспаления, включая концентрацию общего белка, концентрацию мочевой кислоты и активность ЛДГ в надосадочной жидкости BALF, обнаруживают с помощью набора для анализа в соответствии с рекомендациями производителя24. - Повторно суспендируйте гранулу в 200 мкл PBS и подсчитайте лейкоциты в BALF с помощью счетного стекла.
- Чтобы определить профили клеток по дифференциальному подсчету, нанесите 50 мкл клеточной суспензии на предметное стекло и дайте ей высохнуть.
- Зафиксируйте предметное стекло 4% параформальдегидом на ночь, а затем закрасьте гематоксилин-эозином (HE). Классифицируйте не менее 400 клеток на нейтрофилы, макрофаги, лимфоциты или эозинофилы на предметное стекло.
- Забор тканей легких и трахеи для гистопатологического анализа
- После сбора BALF удалите и зафиксируйте половину правого легкого (Рисунок 4G) и трахеи (Рисунок 4H) с 4% параформальдегидом в ЛТ для гистопатологического анализа. Храните вторую половину при температуре -80 °C для вестерн-блоттинга, количественной полимеразной цепной реакции в реальном времени (qPCR) и иммуноферментного анализа (ИФА).
Результаты
На рисунке 6 представлены репрезентативные изображения патологических изменений в легких, окрашенных ПЭ (рисунок 6A, B), трахее (рисунок 6C, D) и селезенке (рисунок 6E, F). Инфекция, вызванная вирусом H1N1, привела к воспалительным изменениям в легких мышей, включая отек и инфильтрацию многих лимфоцитов и нейтрофилов. Инфекция, вызванная вирусом H1N1, также вызвала воспалительные изменения в трахеях мышей, включая выделение ресничек и воспалительные инфильтрации клеток (большое количество лимфоцитов и небольшое количество нейтрофилов). Кроме того, инфекция также значительно увеличила отношение площади белой пульпы ко всей площади селезенки мышей. Лимфоциты накапливаются в белой пульпе селезенки. Эта стандартизированная процедура сбора образцов тканей позволяет лучше оценить воспаление дыхательных путей.
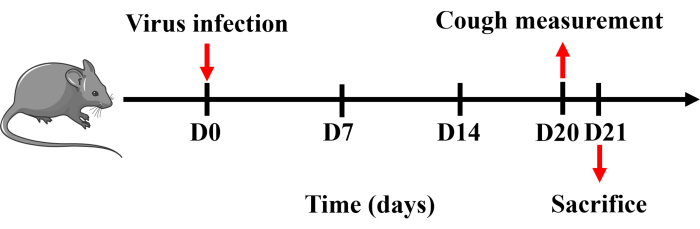
Рисунок 1: Протокол создания мышиной модели кашля. Мышей анестезировали пентобарбиталом натрия и интраназально закапывали 0,8 x LD50 вируса H1N1, растворенного в 50 мкл PBS один раз в 0-й день. Измерение кашля проводилось на 20-й день, а мышей приносили в жертву на следующий день. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Интраназальная инстилляция вируса H1N1. (A) Интраназальная инстилляция 0,8 x LD50 вируса H1N1 в 50 μл PBS. (В) Зажав рот мыши закрытым большим пальцем. (В) Размещение мышей в положении лежа на спине. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Измерение чувствительности к кашлю. (A) Оборудование для обнаружения кашля у мышей и (B) Кривая кашлевого рефлекса. Количество случаев кашля в ответ на распыленный раствор лимонной кислоты (0,4 М) определяли с помощью системы плетизмографии всего тела (WBP) после моделирования. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Репрезентативные изображения забора крови мыши, селезенки, BALF, легких и трахеи. (A) забор крови, (B) вскрытие грудной клетки, (C) отрезание левого предсердия, (D) перфузия в легочном кровообращении, (E) забор селезенки, (F) бронхоальвеолярный лаваж и (G) забор доли легкого и (H) трахея для гистопатологического анализа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Спецификация трубки для бронхоальвеолярного лаважа. Длина трубки бронхоальвеолярного лаважа составляет 5 см. Верхний диаметр составляет 5 мм, а нижний диаметр - 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Влияние вируса H1N1 на патологические изменения в легких, трахее и селезенке мыши. (A,B) Репрезентативные цифры патологических изменений в окрашенных HE срезах легких из контрольной группы (A) и (B) H1N1. Символ «↑» обозначает инфильтрацию лимфоцитов (красный) и нейтрофилов (синий). Масштабные линейки: 50 мкм. (C,D) Репрезентативные цифры патологических изменений в окрашенных HE срезах трахеи из групп (C) контроля и (D) H1N1. Символ «↑» обозначает инфильтрацию лимфоцитов (красный) и нейтрофилов (синий). Масштабные линейки: 20 мкм. (E,F) Репрезентативные цифры патологических изменений в окрашенных HE срезах селезенки из контрольной группы (E) и группы (F) H1N1. Символом «↑» обозначена белая мякоть (зеленая). Масштабные линейки: 500 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Некоторые хронические рефрактерные и постинфекционные кашель являются распространенными состояниями, связанными с респираторной вирусной инфекцией27. Для того, чтобы лучше оценить чувствительность к кашлю и воспаление дыхательных путей, в этом исследовании была создана мышиная модель кашля с использованием вируса H1N1. Подходящие модели кашля у мышей должны быть выбраны для других исследований в соответствии с целью исследования. В большинстве предыдущих исследований морская свинка использовалась в качестве животной модели в механистических исследованиях или новых испытаниях лекарств от кашля 28,29,30. Недавние исследования показали, что мышей можно использовать для оценки патофизиологии кашля благодаря их более короткому репродуктивному циклу, большему количеству реагентов и готовности к генетическим манипуляциям, несмотря на то, что их поведение при кашле все еще обсуждается. В этом исследовании лимонная кислота использовалась в качестве противоборствующего средства для вызывания кашля. Механизмы кашлевого рефлекса, индуцированного лимонной кислотой, могут быть связаны с активацией яремных С-волокон и нодозированных Аδ-волокон32. Кроме того, система WBP измеряет изменения кашлевого рефлекса у мышей неинвазивным способом и сводит к минимуму последствия психологического стресса. Влияние внешней среды на мышей должно быть сведено к минимуму при выявлении чувствительности к кашлю. Мышь следует поместить в помещение для тестирования, а затем накрыть полиэтиленовым пакетом, чтобы уменьшить раздражение, вызванное внешней средой.
В этом исследовании подробно описаны нормативные процедуры забора тканей крови, селезенки, BALF, легких и трахеи мышей, а также представлены некоторые измерения для оценки воспаления дыхательных путей. Для выявления воспаления дыхательных путей срезы легких и трахеи окрашивают гематоксилином и эозином для оценки общей гистопатологии24. Повышенная концентрация общего белка и мочевой кислоты в надосадочной жидкости BALF связана с воспалением и повреждением клеток дыхательных путей33. Активность ЛДГ в надосадочной жидкости BALF отражает повреждение клеток и некроз34. Лейкоциты в БАЛЬФ и крови могут отражать степень воспаления заболевания35. Дифференциальное количество клеток BALF широко используется для оценки воспаления дыхательных путей при хронических заболеваниях дыхательных путей и предоставляет важную информацию для изучения патогенеза, постановки диагнозов и стратегий ведения хроническихреспираторных заболеваний.
Ограничение этого эксперимента заключается в том, что сбор большого количества образцов тканей заставляет мышей работать в течение длительного времени, что может повлиять на активность образцов тканей. Поэтому образцы тканей мышей нужно помещать на лед сразу после сбора. Кроме того, трубка для бронхоальвеолярного лаважа, используемая в этом исследовании, подходит для мышей, но не для более крупных животных.
Подводя итог, мы приводим подробное описание методов обнаружения кашля и воспаления дыхательных путей у мышей. Эти методы предоставляют исследователям инструменты для изучения сложной патофизиологии кашля.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Проектом планирования науки и технологий в Гуанчжоу (202002030151), Крупным проектом Гуанчжоуской национальной лаборатории (GZNL2024A02001) и грантом Государственной ключевой лаборатории респираторных заболеваний (SKLRD-Z-202202).
Материалы
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde | Biosharp | BL539A | |
| Buxco Small Animal Whole Body Plethysmography System | DSI | — | |
| Calcium-free and magnesium-free Hank’s Balanced Salt Solution | Beyotime | C0219 | |
| Citric acid | Sigma-Aldrich | C2404 | |
| Hematoxylin-Eosin | BASO Biotechnology | BA-4098 | |
| Heparin sodium | Alfa Aesar | A16198 | |
| Influenza A/California/7/2009 (H1N1) virus | ATCC | VR-1894 | |
| Isoflurane | RWD | R510-22 | |
| Lactate dehydrogenase assay kit | Nanjing Jiancheng Bioengineering Institute | A020-2-2 | |
| Normal saline | Guangzhou Zhongbo Biotechnology | 1234-1 | |
| Pasteur pipet | NEST | 318415 | |
| Pentobarbital sodium | Merck | P3761 | |
| Phosphate buffered saline | Meilunbio | MA0015 | |
| Total protein assay kit | Nanjing Jiancheng Bioengineering Institute | A045-3 | |
| Uric acid assay kit | Thermo Fisher Scientific | A22181 |
Ссылки
- Brooks, S. M. Perspective on the human cough reflex. Cough. 7, 10 (2011).
- Lai, K., Long, L. Current status and future directions of chronic cough in china. Lung. 198 (1), 23-29 (2020).
- Zeiger, R. S., et al. Patient-reported burden of chronic cough in a managed care organization. J Allergy Clin Immunol Pract. 9 (4), 1624-1637.e10 (2021).
- Marchant, J. M., et al. What is the burden of chronic cough for families. Chest. 134 (2), 303-309 (2008).
- Chamberlain, S. A., et al. The impact of chronic cough: A cross-sectional european survey. Lung. 193 (3), 401-408 (2015).
- Morice, A. H., et al. Expert opinion on the cough hypersensitivity syndrome in respiratory medicine. Eur Respir J. 44 (5), 1132-1148 (2014).
- Chung, K. F., et al. Cough hypersensitivity and chronic cough. Nat Rev Dis Primers. 8 (1), 45 (2022).
- Deng, Z., et al. Pulmonary IFN-γ causes lymphocytic inflammation and cough hypersensitivity by increasing the number of IFN-γ-secreting t lymphocytes. Allergy Asthma Immunol Res. 14 (6), 653-673 (2022).
- Hiramatsu, Y., et al. The mechanism of pertussis cough revealed by the mouse-coughing model. mBio. 13 (2), e0319721 (2022).
- Lin, L., et al. The duration of cough in patients with H1N1 influenza. Clin Respir J. 11 (6), 733-738 (2017).
- Deng, Z., et al. IFN-γ enhances the cough reflex sensitivity via calcium influx in vagal sensory neurons. Am J Respir Crit Care Med. 198 (7), 868-879 (2018).
- Chen, Z., et al. Dorsal vagal complex modulates neurogenic airway inflammation in a guinea pig model with esophageal perfusion of HCl. Front Physiol. 5, 536 (2018).
- Zhi, H., et al. Gabapentin alleviated the cough hypersensitivity and neurogenic inflammation in a guinea pig model with repeated intra-esophageal acid perfusion. Eur J Pharmacol. 959, 176078 (2023).
- Fang, Z., et al. Traffic-related air pollution induces non-allergic eosinophilic airway inflammation and cough hypersensitivity in guinea-pigs. Clin Exp Allergy. 49 (3), 366-377 (2019).
- Xiang, J., et al. Fructus mume protects against cigarette smoke induced chronic cough guinea pig. J Med Food. 23 (2), 191-197 (2020).
- Chen, Z., et al. A descending pathway emanating from the periaqueductal gray mediates the development of cough-like hypersensitivity. iScience. 25 (1), 103641 (2022).
- Chen, Z., et al. Glial activation and inflammation in the nts in a rat model after exposure to diesel exhaust particles. Environ Toxicol Pharmacol. 83, 103584 (2021).
- Mai, Y., et al. Methods for assessing cough sensitivity. J Thorac Dis. 12 (9), 5224-5237 (2020).
- Lee, K. K., et al. A longitudinal assessment of acute cough. Am J Respir Crit Care Med. 187 (9), 991-997 (2013).
- Birring, S. S., et al. Development of a symptom specific health status measure for patients with chronic cough: Leicester cough questionnaire (LCQ). Thorax. 58 (4), 339-343 (2003).
- Mazzone, S. B., Farrell, M. J. Heterogeneity of cough neurobiology: Clinical implications. Pulm Pharmacol Ther. 55, 62-66 (2019).
- Morice, A. H., Kastelik, J. A., Thompson, R. Cough challenge in the assessment of cough reflex. Br J Clin Pharmacol. 52 (4), 365-375 (2001).
- Nurmi, H. M., Lätti, A. M., Brannan, J. D., Koskela, H. O. Comparison of mannitol and citric acid cough provocation tests. Respir Med. 158, 14-20 (2019).
- Ding, W., et al. Amg487 alleviates influenza a (H1N1) virus-induced pulmonary inflammation through decreasing IFN-γ-producing lymphocytes and IFN-γ concentrations. Br J Pharmacol. 181 (13), 2053-2069 (2024).
- Connett, G. J. Bronchoalveolar lavage. Paediatr Respir Rev. 1 (1), 52-56 (2000).
- Wu, X., et al. Correlation of adhesion molecules and non-typeable haemophilus influenzae growth in a mice coinfected model of acute inflammation. Microbes Infect. 23 (8), 104839 (2021).
- Capristo, C., Rossi, G. A. Post-infectious persistent cough: Pathogenesis and therapeutic options. Minerva Pediatr. 69 (5), 444-452 (2017).
- Kollarik, M., Brozmanova, M. Cough and gastroesophageal reflux: Insights from animal models. Pulm Pharmacol Ther. 22 (2), 130-134 (2009).
- Driessen, A. K., et al. A role for neurokinin 1 receptor expressing neurons in the paratrigeminal nucleus in bradykinin-evoked cough in guinea-pigs. J Physiol. 598 (11), 2257-2275 (2020).
- Ruhl, C. R., et al. Mycobacterium tuberculosis sulfolipid-1 activates nociceptive neurons and induces cough. Cell. 181 (2), 293-305.e211 (2020).
- Chen, L., Lai, K., Lomask, J. M., Jiang, B., Zhong, N. Detection of mouse cough based on sound monitoring and respiratory airflow waveforms. PLoS One. 8 (3), e59263 (2013).
- Wallace, E., Guiu Hernandez, E., Ang, A., Hiew, S., Macrae, P. A systematic review of methods of citric acid cough reflex testing. Pulm Pharmacol Ther. 58, 101827 (2019).
- Ding, W., et al. Intrapulmonary ifn-γ instillation causes chronic lymphocytic inflammation in the spleen and lung through the CXCR3 pathway. Int Immunopharmacol. 122, 110675 (2023).
- Liu, B., et al. Anti-IFN-γ therapy alleviates acute lung injury induced by severe influenza a (H1N1) pdm09 infection in mice. J Microbiol Immunol Infect. 54 (3), 396-403 (2021).
- Domagała-Kulawik, J. Bal in the diagnosis of smoking-related interstitial lung diseases: Review of literature and analysis of our experience. Diagn Cytopathol. 36 (12), 909-915 (2008).
- Miyata, Y., et al. The effect of bronchoconstriction by methacholine inhalation in a murine model of asthma. Int Arch Allergy Immunol. 181 (12), 897-907 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены