Method Article
Métodos para detectar la tos y la inflamación de las vías respiratorias en ratones
En este artículo
Resumen
Aquí, describimos la medición de la tos utilizando un sistema de pletismografía de cuerpo entero (WBP) no invasivo y en tiempo real y los procedimientos normativos para la recolección de muestras de tejido de ratones e introducimos algunos métodos para evaluar la inflamación de las vías respiratorias.
Resumen
La tos crónica, que dura más de 8 semanas, es una de las quejas más comunes que requieren atención médica, y los pacientes sufren una enorme carga socioeconómica y una marcada disminución de la calidad de vida. Los modelos animales pueden imitar la compleja fisiopatología de la tos y son herramientas importantes para la investigación de la tos. La detección de la sensibilidad a la tos y la inflamación de las vías respiratorias es de gran importancia para el estudio del complejo mecanismo patológico de la tos. Este artículo describe la medición de la tos utilizando un sistema de pletismografía de cuerpo entero (WBP) no invasivo y en tiempo real y los procedimientos normativos para la recolección de muestras de tejido (incluyendo sangre, pulmón, bazo y tráquea) de ratones. Introduce algunos métodos para evaluar la inflamación de las vías respiratorias, incluidos los cambios patológicos en las secciones de pulmón y tráquea teñidas con hematoxilina y eosina (HE), la concentración total de proteínas, la concentración de ácido úrico y la actividad de la lactato deshidrogenasa (LDH) en el sobrenadante del líquido de lavado broncoalveolar (BALF), y los leucocitos y los recuentos celulares diferenciales de BALF. Estos métodos son reproducibles y sirven como herramientas valiosas para estudiar la compleja fisiopatología de la tos.
Introducción
La tos es un comportamiento de defensa importante para mantener la permeabilidad de las vías respiratorias y proteger los pulmones de sustancias potencialmente dañinas. Sin embargo, cuando está desregulada, la tos se convierte en una condición patológica1. La tos crónica, generalmente definida como de ocho o más semanas, es uno de los síntomas más frecuentes que requieren atención médica2. Debido a que la tos crónica persiste frecuentemente durante años, los pacientes sufren una enorme carga socioeconómica y una marcada disminución de la calidad de vida 3,4,5. La tos crónica se considera ampliamente un síndrome de hipersensibilidad a la tos y se caracteriza por una tos molesta que a menudo se desencadena por bajos niveles de exposición térmica, mecánica o química6. La aparición de hipersensibilidad a la tos está estrechamente relacionada con la inflamación de la vía aérea7. Sin embargo, los mecanismos fisiopatológicos que subyacen a la modulación de la sensibilidad a la tos necesitan ser dilucidados más a fondo.
Los modelos animales pueden imitar la compleja fisiopatología de la tos y son herramientas importantes para la investigación de la tos 8,9. Estudios previos han encontrado que la infección viral, la instilación intrapulmonar de interferón-γ (IFN-γ), la perfusión esofágica de ácido clorhídrico, la exposición a contaminantes, el humo del cigarrillo y el ácido cítrico pueden inducir tos en animales 10,11,12,13,14,15,16,17. Con el fin de evaluar mejor la tos y la inflamación de las vías respiratorias, se estableció un modelo de ratón de tos utilizando una dosis no letal del virus H1N1 en este estudio. Para la detección de la tos, se han establecido clínicamente algunas herramientas de medición de la tos para medir la tos, incluyendo métodos subjetivos y objetivos18. Los instrumentos de evaluación subjetiva para evaluar la gravedad de la tos incluyen principalmente una escala visual analógica, la puntuación de la tos, cuestionarios de calidad de vida, etc.19,20. Sin embargo, es poco probable que se utilicen para evaluar la tos en animales. Además, la tos se puede evaluar objetivamente a través de una prueba de provocación tosina y el monitoreo de la frecuencia de la tos. La prueba de provocación para la tos que utiliza un sistema de pletismografía de cuerpo entero (WBP) es un método objetivo ampliamente utilizado en estudios con animales para medir la sensibilidad a la tos y revelar los mecanismos subyacentes de la tos13,16. Con base en las características neuroanatómicas del reflejo de la tos, el ácido cítrico, la capsaicina, la adenosina 5'-trifosfato (ATP), el isotiocianato de alilo (AITC) y el mediador inflamatorio bradicinina se utilizan comúnmente como agentes tusivos para inducir la tos21,22. El ácido cítrico es uno de los agentes tusivos más tempranos y más utilizados que desencadenan los reflejos de la tos, que ha sido validado para medir la sensibilidad a la tos. Además, la provocación con ácido cítrico tiene buena seguridad, factibilidad y tolerabilidad y se sugiere para evaluar la sensibilidad del reflejo de la tos en respuesta a las terapias para la tos23. Por lo tanto, este artículo describirá el método para medir la sensibilidad a la tos en respuesta al ácido cítrico en ratones utilizando un sistema WBP no invasivo y en tiempo real.
Los estudios de la fisiopatología de la tos requieren muestras de prueba, incluidas muestras de sangre, líquido de lavado broncoalveolar (BALF) y tejidos pulmonares y de tráquea para verificar los cambios en los niveles de factores clave24. En la actualidad, existe una falta de procedimientos normativos para la recolección de muestras de tejido de ratones, y los estudios relacionados emplean diferentes enfoques que complican la evaluación de la inflamación de las vías respiratorias. El lavado broncoalveolar es un método importante para evaluar la inflamación de la vía aérea en las enfermedades respiratorias25. Los diferentes métodos de lavado broncoalveolar conducirán a una falta de comparabilidad entre los estudios relacionados. Además, diferentes métodos de lavado broncoalveolar tienen un impacto sobre las células inflamatorias y las citocinas inflamatorias en BALF. Por lo tanto, este artículo describirá el establecimiento de un modelo de ratón de tos con una dosis no letal del virus H1N1, la medición de la tos utilizando un sistema WBP y un método de lavado broncoalveolar confiable, seguro y altamente exitoso en ratones.
Protocolo
Todos los procedimientos fueron aprobados por el Comité de Cuidado y Uso de Animales de la Universidad Médica de Guangzhou (20240248) y se realizaron en estricta conformidad con las pautas aprobadas. En este estudio se utilizaron ratones machos C57BL/6 libres de patógenos específicos con un peso de 20-25 g. Todos los ratones fueron alojados bajo temperatura controlada (22 ± 2 °C), humedad (50% ± 20%) e iluminación (6:30 AM a 6:30 PM) en jaulas de fondo sólido con comida y agua disponibles ad libitum. La línea de tiempo del protocolo se muestra en la Figura 1.
1. Establecimiento de un modelo de tos en ratones
- Use el virus de la influenza A/California/7/2009 (H1N1). Determinar la dosis letal del virus H1N1 en ratones.
- Brevemente, anestesiar ratones (n = 10 por grupo) con pentobarbital sódico (80 mg·kg-1) y luego infectarlos por vía intranasal con un virus diluido en serie 10 veces.
- Monitorear la muerte durante un período de 15 días. Calcular la dosis letal mediana (DL50) por el método de Reed-Muench26.
- Infectar al ratón con el virus H1N1.
- Disuelva 0,8 x LD50 del virus H1N1 en 50 μL de solución salina tamponada con fosfato (PBS).
- Anestesiar a los ratones con pentobarbital sódico (80 mg·kg-1).
- Cuando los ratones estuvieran profundamente anestesiados, coloque al ratón en posición supina con las fosas nasales hacia arriba.
- Instilar 5-10 μL de solución del virus H1N1 o solución de PBS (como control) por vía intranasal en una fosa nasal de ratones utilizando una pipeta (Figura 2A).
- Luego, mantenga la boca del ratón cerrada con el pulgar para hacer que su nariz inhale con fuerza para que la solución del virus H1N1 en la cavidad nasal se inhale completamente hacia los pulmones (Figura 2B).
- Repita los pasos 1.2.4 y 1.2.5 en la otra cavidad nasal de los ratones.
- Cuando todo el virus H1N1 preparado en el paso 1.2.1 se instila por vía intranasal en los pulmones del ratón, colóquelo en posición supina para descansar (Figura 2C).
- Mida la sensibilidad a la tos del ratón después del establecimiento del modelo utilizando el sistema de pletismografía de cuerpo entero para animales pequeños Buxco. El día 21, anestesiar intraperitonealmente al ratón con pentobarbital sódico (150 mg·kg-1). Recolectar y procesar tejidos de sangre, bazo, BALF, pulmón y tráquea (Figura 1).
2. La medición de la sensibilidad a la tos
- Preparación de ácido cítrico (0,4 M): Coloque 0,1537 mg de ácido cítrico en un tubo de centrífuga de 5 mL y agregue solución salina normal hasta un volumen de 2 mL.
- Inspección de instrumentos
- Verifique los canales: Conecte las cámaras del pletismógrafo de cuerpo entero de acuerdo con las instrucciones del fabricante y haga clic en el botón de calibración: el botón de calibración cambia de naranja a verde, lo que indica que la calibración se ha realizado correctamente (Figura 3A).
- Calibrar el nebulizador:
- Después de conectar el nebulizador, agregue 500 μL de solución salina normal en el nebulizador y haga clic en el botón de nebulización.
- Cuando el líquido del nebulizador esté completamente aerosolizado, vuelva a hacer clic en el botón de nebulización para ver la potencia del nebulizador, que suele ser de aproximadamente 0,3 ml/min. Haga clic en el botón de nebulización nuevamente para aceptar la potencia nebulizada actual.
- Después de comprobar los canales, asegúrese de que el valor de error sea inferior al 0,5%.
- Parámetros de configuración
- Haga clic en Crear nuevo estudio, seleccione la opción Tos , seleccione Ratón en especie y haga clic en Siguiente.
- Seleccione los parámetros CCnt : Establezca la duración del período de aclimatación en 1 min, el tiempo de respuesta en 10 min, el volumen de aerosol en 1 mL y la duración del parto en 10 min.
- Coloque al ratón consciente y sin restricciones en cámaras pletismógrafos individuales de plástico transparente para todo el cuerpo. Introduzca el peso y el ID de sujeto del ratón y haga clic en Siguiente.
- Agregue 1 mL de solución de ácido cítrico (0.4 M) al nebulizador y observe los cambios en tiempo real en CCnt (Figura 3B).
- Una vez que el ácido cítrico se haya utilizado por completo, haga clic en Archivo y finalizar sesión para completar el experimento.
3. Recolección de sangre, bazo, BALF, pulmón y tejidos de tráquea de ratón (Figura 4)
- Recolecta sangre.
- Después de la detección de tos, anestesiar al ratón con pentobarbital sódico (150 mg·kg-1) por inyección intraperitoneal. Recolecta sangre de las órbitas del ratón profundamente anestesiado. Mezclar 1 mL de sangre en 0,1 mL de tampón anticoagulante (9,9 mg/mL de heparina sódica disuelta en PBS) a 4 °C (Figura 4A).
- Agite el tubo de extracción de sangre para mezclar completamente la sangre y el anticoagulante para evitar la coagulación de la sangre.
- Centrifugar la sangre recogida a 800 x g durante 5 min a 4 °C. Recoja el sobrenadante, guárdelo a -80 °C (utilizado para la medición de citocinas) y vuelva a suspender el pellet en 1 ml de solución de D-Hank. Extienda 10 μL de la suspensión de células sanguíneas en el portaobjetos de vidrio para determinar los perfiles celulares.
- Cosecha el bazo.
- Abra el pecho del ratón, recoja la sangre y exanguine a través de la arteria (Figura 4B).
- Extirpar el pabellón auricular izquierdo y, a continuación, perfundir la circulación pulmonar y sistémica con 5 mL de solución salina normal (Figura 4C, D). Extirpar todo el bazo del ratón con pinzas quirúrgicas (Figura 4E).
- Después de medir el peso del bazo, córtelo en dos mitades. Fijar la primera mitad con paraformaldehído al 4% a temperatura ambiente (RT) para análisis histopatológico. Almacene la segunda mitad a -80 °C para la medición de citocinas.
- Lavado broncoalveolar
- Hacer el tubo de lavado broncoalveolar con una pipeta Pasteur. Calentar la pipeta Pasteur con una lámpara de alcohol. Cuando se ablande, alargarlo para formar un tubo delgado. La longitud del tubo de lavado broncoalveolar es de 5 cm. El diámetro superior es de 5 mm y el diámetro inferior es de 1 mm (Figura 5).
- Para la recolección de BALS, separe el pulmón derecho mediante una ligadura en el bronquio principal derecho. Recoja el BALF de los pulmones izquierdos lavándolo tres veces con 0,5 ml de PBS preenfriado en hielo. La tasa de recuperación de BALF es superior al 80% (Figura 4F).
- Centrifugar el BALF recogido a 800 x g durante 5 min a 4 °C. Recoja el sobrenadante y mida la concentración total de proteínas, la concentración de ácido úrico, la actividad de LDH y las concentraciones de citocinas.
NOTA: Los marcadores inflamatorios, incluida la concentración total de proteínas, la concentración de ácido úrico y la actividad de LDH en el sobrenadante BALP, se detectan utilizando el kit de ensayo de acuerdo con las directrices del fabricante24. - Vuelva a suspender el pellet en 200 μL de PBS y cuente los leucocitos en BALF con la ayuda de un portaobjetos de conteo.
- Para determinar los perfiles celulares por recuentos diferenciales, unte 50 μL de la suspensión celular sobre los portaobjetos de vidrio y deje que se seque.
- Fije el portaobjetos con paraformaldehído al 4% durante la noche y luego tiña con la hematoxilina-eosina (HE). Clasifique al menos 400 células en neutrófilos, macrófagos, linfocitos o eosinófilos por portaobjetos.
- Extracción de tejidos pulmonares y de tráquea para su análisis histopatológico
- Después de la recolección de BALS, extraer y fijar la mitad del pulmón derecho (Figura 4G) y la tráquea (Figura 4H) con paraformaldehído al 4% en RT para el análisis histopatológico. Almacene la otra mitad a -80 °C para Western blot, reacción en cadena de la polimerasa cuantitativa en tiempo real (qPCR) y ensayo de inmunoabsorción enzimática (ELISA).
Resultados
La Figura 6 muestra imágenes representativas de los cambios patológicos en el pulmón teñido con HE (Figura 6A,B), la tráquea (Figura 6C,D) y el bazo (Figura 6E,F). La infección por el virus H1N1 produjo cambios inflamatorios en los pulmones de los ratones, incluyendo edema e infiltración de muchos linfocitos y neutrófilos. La infección por el virus H1N1 también indujo cambios inflamatorios en las tráqueas de los ratones, incluyendo el desprendimiento de cilios y las infiltraciones de células inflamatorias (muchos linfocitos y un pequeño número de neutrófilos). Además, la infección también aumentó significativamente la proporción de la zona de la pulpa blanca con respecto a toda la zona del bazo de los ratones. Los linfocitos se acumulan en la pulpa blanca del bazo. Este procedimiento estandarizado para recolectar muestras de tejido puede evaluar mejor la inflamación de las vías respiratorias.
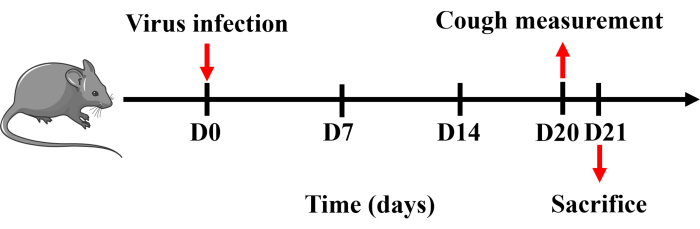
Figura 1: Protocolo para establecer un modelo de tos en ratón. Los ratones fueron anestesiados con pentobarbital sódico e instilados por vía intranasal con 0,8 x LD50 del virus H1N1 disuelto en 50 μL de PBS una vez el día 0. La medición de la tos se realizó el día 20 y los ratones se sacrificaron al día siguiente. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Instilación intranasal del virus H1N1. (A) Instilación intranasal de 0,8 x DL50 del virus H1N1 en 50 μL de PBS. (B) Mantener la boca del ratón cerrada con el pulgar. (C) Colocar a los ratones en posición supina. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Medición de la sensibilidad a la tos. (A) Equipo de detección de tos en ratones y (B) curva del reflejo de la tos. El número de eventos de tos en respuesta a la solución de ácido cítrico nebulizada (0,4 M) se detectó utilizando el sistema de pletismografía de cuerpo entero (WBP) después del modelado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Imágenes representativas de la recolección de la sangre, el bazo, el BALF, el pulmón y la tráquea del ratón. (A) Extracción de sangre, (B) apertura del tórax, (C) corte de la aurícula izquierda, (D) perfusión de la circulación pulmonar, (E) extracción del bazo, (F) lavado broncoalveolar y (G) extracción del lóbulo pulmonar y (H) la tráquea para el análisis histopatológico. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Especificación del tubo de lavado broncoalveolar. La longitud del tubo de lavado broncoalveolar es de 5 cm. El diámetro superior es de 5 mm y el diámetro inferior es de 1 mm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Efectos del virus H1N1 sobre los cambios patológicos en el pulmón, la tráquea y el bazo del ratón. (A,B) Figuras representativas de los cambios patológicos en secciones pulmonares teñidas con HE de los grupos (A) control y (B) H1N1. El símbolo de "↑" marca la infiltración de linfocitos (rojo) y neutrófilos (azul). Barras de escala: 50 μm. (C,D) Figuras representativas de los cambios patológicos en secciones de tráquea teñidas con HE de los grupos (C) control y (D) H1N1. El símbolo de "↑" marca la infiltración de linfocitos (rojo) y neutrófilos (azul). Barras de escala: 20 μm. (E,F) Figuras representativas de los cambios patológicos en secciones de bazo teñidas con HE de los grupos (E) control y (F) H1N1. El símbolo de "↑" marca la pulpa blanca (verde). Barras de escala: 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Algunas toses crónicas refractarias y postinfecciosas son condiciones comunes asociadas con la infección por virus respiratorios27. Con el fin de evaluar mejor la sensibilidad a la tos y la inflamación de las vías respiratorias, se estableció un modelo de ratón de tos utilizando el virus H1N1 en este estudio. Se deben seleccionar modelos apropiados de tos en ratones para otros estudios de acuerdo con el propósito del estudio. La mayoría de los estudios previos utilizaron el conejillo de indias como modelo animal en estudios mecanicistas o ensayos de nuevos medicamentos para la tos 28,29,30. Estudios recientes han sugerido que los ratones podrían ser utilizados para evaluar la fisiopatología de la tos debido a su ciclo reproductivo más corto, más reactivos y preparación para manipulaciones genéticas a pesar de que su comportamiento en la tos aún se debate16,31. El ácido cítrico se utilizó como agente tusivo para inducir la tos en este estudio. Los mecanismos del reflejo de la tos inducidos por el ácido cítrico pueden estar relacionados con la activación de las fibras C yugulares y las fibras Aδ nodosas32. Además, el sistema WBP mide los cambios en el reflejo de la tos en ratones de forma no invasiva y minimiza los efectos del estrés psicológico. El efecto del ambiente externo en los ratones debe minimizarse cuando se detecta sensibilidad a la tos. El ratón debe colocarse en la sala de pruebas y luego cubrirse con una bolsa de plástico para reducir la irritación causada por el entorno externo.
Este estudio detalla los procedimientos normativos para la recolección de sangre, bazo, BALF, tejidos pulmonares y de tráquea de ratones e introduce algunas mediciones para evaluar la inflamación de las vías respiratorias. Para detectar la inflamación de la vía aérea, las secciones pulmonares y de tráquea se tiñen con hematoxilina y eosina para evaluar la histopatología general24. El aumento de la concentración de proteína total y ácido úrico en el sobrenadante de BALF se asocia con inflamación y lesión celular en la vía aérea33. La actividad de la LDH en el sobrenadante de BALF refleja daño celular y necrosis34. Los leucocitos en BALF y en sangre pueden reflejar el grado de inflamación de la enfermedad35. Los recuentos celulares diferenciales de BALF se utilizan ampliamente en la evaluación de la inflamación de las vías respiratorias en las enfermedades crónicas de las vías respiratorias y proporcionan información importante para el estudio de la patogenia, la realización de diagnósticos y las estrategias de tratamiento de las enfermedades respiratorias crónicas36.
La limitación de este experimento es que la recolección de un gran número de muestras de tejido hace que los ratones sean operados durante mucho tiempo, lo que puede afectar la actividad de las muestras de tejido. Por lo tanto, las muestras de tejido de ratón deben colocarse en hielo inmediatamente después de la recolección. Además, el tubo de lavado broncoalveolar utilizado en este estudio es adecuado para ratones, pero no para animales más grandes.
En resumen, proporcionamos una descripción detallada de los métodos de detección de la tos y la inflamación de las vías respiratorias en ratones. Estos métodos proporcionan a los investigadores herramientas para estudiar la compleja fisiopatología de la tos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo contó con el apoyo del Proyecto de Planificación de Ciencia y Tecnología de Guangzhou (202002030151), el Proyecto Principal del Laboratorio Nacional de Guangzhou (GZNL2024A02001) y la subvención del Laboratorio Estatal Clave de Enfermedades Respiratorias (SKLRD-Z-202202).
Materiales
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde | Biosharp | BL539A | |
| Buxco Small Animal Whole Body Plethysmography System | DSI | — | |
| Calcium-free and magnesium-free Hank’s Balanced Salt Solution | Beyotime | C0219 | |
| Citric acid | Sigma-Aldrich | C2404 | |
| Hematoxylin-Eosin | BASO Biotechnology | BA-4098 | |
| Heparin sodium | Alfa Aesar | A16198 | |
| Influenza A/California/7/2009 (H1N1) virus | ATCC | VR-1894 | |
| Isoflurane | RWD | R510-22 | |
| Lactate dehydrogenase assay kit | Nanjing Jiancheng Bioengineering Institute | A020-2-2 | |
| Normal saline | Guangzhou Zhongbo Biotechnology | 1234-1 | |
| Pasteur pipet | NEST | 318415 | |
| Pentobarbital sodium | Merck | P3761 | |
| Phosphate buffered saline | Meilunbio | MA0015 | |
| Total protein assay kit | Nanjing Jiancheng Bioengineering Institute | A045-3 | |
| Uric acid assay kit | Thermo Fisher Scientific | A22181 |
Referencias
- Brooks, S. M. Perspective on the human cough reflex. Cough. 7, 10 (2011).
- Lai, K., Long, L. Current status and future directions of chronic cough in china. Lung. 198 (1), 23-29 (2020).
- Zeiger, R. S., et al. Patient-reported burden of chronic cough in a managed care organization. J Allergy Clin Immunol Pract. 9 (4), 1624-1637.e10 (2021).
- Marchant, J. M., et al. What is the burden of chronic cough for families. Chest. 134 (2), 303-309 (2008).
- Chamberlain, S. A., et al. The impact of chronic cough: A cross-sectional european survey. Lung. 193 (3), 401-408 (2015).
- Morice, A. H., et al. Expert opinion on the cough hypersensitivity syndrome in respiratory medicine. Eur Respir J. 44 (5), 1132-1148 (2014).
- Chung, K. F., et al. Cough hypersensitivity and chronic cough. Nat Rev Dis Primers. 8 (1), 45 (2022).
- Deng, Z., et al. Pulmonary IFN-γ causes lymphocytic inflammation and cough hypersensitivity by increasing the number of IFN-γ-secreting t lymphocytes. Allergy Asthma Immunol Res. 14 (6), 653-673 (2022).
- Hiramatsu, Y., et al. The mechanism of pertussis cough revealed by the mouse-coughing model. mBio. 13 (2), e0319721 (2022).
- Lin, L., et al. The duration of cough in patients with H1N1 influenza. Clin Respir J. 11 (6), 733-738 (2017).
- Deng, Z., et al. IFN-γ enhances the cough reflex sensitivity via calcium influx in vagal sensory neurons. Am J Respir Crit Care Med. 198 (7), 868-879 (2018).
- Chen, Z., et al. Dorsal vagal complex modulates neurogenic airway inflammation in a guinea pig model with esophageal perfusion of HCl. Front Physiol. 5, 536 (2018).
- Zhi, H., et al. Gabapentin alleviated the cough hypersensitivity and neurogenic inflammation in a guinea pig model with repeated intra-esophageal acid perfusion. Eur J Pharmacol. 959, 176078 (2023).
- Fang, Z., et al. Traffic-related air pollution induces non-allergic eosinophilic airway inflammation and cough hypersensitivity in guinea-pigs. Clin Exp Allergy. 49 (3), 366-377 (2019).
- Xiang, J., et al. Fructus mume protects against cigarette smoke induced chronic cough guinea pig. J Med Food. 23 (2), 191-197 (2020).
- Chen, Z., et al. A descending pathway emanating from the periaqueductal gray mediates the development of cough-like hypersensitivity. iScience. 25 (1), 103641 (2022).
- Chen, Z., et al. Glial activation and inflammation in the nts in a rat model after exposure to diesel exhaust particles. Environ Toxicol Pharmacol. 83, 103584 (2021).
- Mai, Y., et al. Methods for assessing cough sensitivity. J Thorac Dis. 12 (9), 5224-5237 (2020).
- Lee, K. K., et al. A longitudinal assessment of acute cough. Am J Respir Crit Care Med. 187 (9), 991-997 (2013).
- Birring, S. S., et al. Development of a symptom specific health status measure for patients with chronic cough: Leicester cough questionnaire (LCQ). Thorax. 58 (4), 339-343 (2003).
- Mazzone, S. B., Farrell, M. J. Heterogeneity of cough neurobiology: Clinical implications. Pulm Pharmacol Ther. 55, 62-66 (2019).
- Morice, A. H., Kastelik, J. A., Thompson, R. Cough challenge in the assessment of cough reflex. Br J Clin Pharmacol. 52 (4), 365-375 (2001).
- Nurmi, H. M., Lätti, A. M., Brannan, J. D., Koskela, H. O. Comparison of mannitol and citric acid cough provocation tests. Respir Med. 158, 14-20 (2019).
- Ding, W., et al. Amg487 alleviates influenza a (H1N1) virus-induced pulmonary inflammation through decreasing IFN-γ-producing lymphocytes and IFN-γ concentrations. Br J Pharmacol. 181 (13), 2053-2069 (2024).
- Connett, G. J. Bronchoalveolar lavage. Paediatr Respir Rev. 1 (1), 52-56 (2000).
- Wu, X., et al. Correlation of adhesion molecules and non-typeable haemophilus influenzae growth in a mice coinfected model of acute inflammation. Microbes Infect. 23 (8), 104839 (2021).
- Capristo, C., Rossi, G. A. Post-infectious persistent cough: Pathogenesis and therapeutic options. Minerva Pediatr. 69 (5), 444-452 (2017).
- Kollarik, M., Brozmanova, M. Cough and gastroesophageal reflux: Insights from animal models. Pulm Pharmacol Ther. 22 (2), 130-134 (2009).
- Driessen, A. K., et al. A role for neurokinin 1 receptor expressing neurons in the paratrigeminal nucleus in bradykinin-evoked cough in guinea-pigs. J Physiol. 598 (11), 2257-2275 (2020).
- Ruhl, C. R., et al. Mycobacterium tuberculosis sulfolipid-1 activates nociceptive neurons and induces cough. Cell. 181 (2), 293-305.e211 (2020).
- Chen, L., Lai, K., Lomask, J. M., Jiang, B., Zhong, N. Detection of mouse cough based on sound monitoring and respiratory airflow waveforms. PLoS One. 8 (3), e59263 (2013).
- Wallace, E., Guiu Hernandez, E., Ang, A., Hiew, S., Macrae, P. A systematic review of methods of citric acid cough reflex testing. Pulm Pharmacol Ther. 58, 101827 (2019).
- Ding, W., et al. Intrapulmonary ifn-γ instillation causes chronic lymphocytic inflammation in the spleen and lung through the CXCR3 pathway. Int Immunopharmacol. 122, 110675 (2023).
- Liu, B., et al. Anti-IFN-γ therapy alleviates acute lung injury induced by severe influenza a (H1N1) pdm09 infection in mice. J Microbiol Immunol Infect. 54 (3), 396-403 (2021).
- Domagała-Kulawik, J. Bal in the diagnosis of smoking-related interstitial lung diseases: Review of literature and analysis of our experience. Diagn Cytopathol. 36 (12), 909-915 (2008).
- Miyata, Y., et al. The effect of bronchoconstriction by methacholine inhalation in a murine model of asthma. Int Arch Allergy Immunol. 181 (12), 897-907 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados