Method Article
PROCÉDÉS DE DÉTECTION DE LA TOUX ET DE L’INFLAMMATION DES VOIES RESPIRATOIRES CHEZ LA SOURIS
Dans cet article
Résumé
Ici, nous décrivons la mesure de la toux à l’aide d’un système de pléthysmographie corps entier (WBP) non invasif et en temps réel et les procédures normatives pour le prélèvement d’échantillons de tissus de souris et présentons certaines méthodes pour évaluer l’inflammation des voies respiratoires.
Résumé
La toux chronique, qui dure plus de 8 semaines, est l’une des affections les plus courantes nécessitant des soins médicaux, et les patients souffrent d’un énorme fardeau socio-économique et d’une diminution marquée de la qualité de vie. Les modèles animaux peuvent imiter la physiopathologie complexe de la toux et constituent des outils importants pour la recherche sur la toux. La détection de la sensibilité à la toux et de l’inflammation des voies respiratoires est d’une grande importance pour l’étude du mécanisme pathologique complexe de la toux. Cet article décrit la mesure de la toux à l’aide d’un système de pléthysmographie du corps entier (WBP) non invasif et en temps réel et les procédures normatives pour le prélèvement d’échantillons de tissus (y compris le sang, les poumons, la rate et la trachée) de souris. Il présente certaines méthodes pour évaluer l’inflammation des voies respiratoires, y compris les changements pathologiques dans les coupes des poumons et de la trachée colorées à l’hématoxyline et à l’éosine (HE), la concentration totale de protéines, la concentration d’acide urique et l’activité de la lactate déshydrogénase (LDH) dans le surnageant du liquide de lavage broncho-alvéolaire (BALF), ainsi que les leucocytes et le nombre de cellules différentielles de BALF. Ces méthodes sont reproductibles et constituent des outils précieux pour étudier la physiopathologie complexe de la toux.
Introduction
La toux est un comportement de défense important pour maintenir la perméabilité des voies respiratoires et protéger les poumons contre les substances potentiellement nocives. Cependant, lorsqu’elle est dérégulée, la toux devient un état pathologique1. La toux chronique, généralement définie comme d’une durée de huit semaines ou plus, est l’un des symptômes les plus fréquents nécessitant des soins médicaux2. Parce que la toux chronique persiste souvent pendant des années, les patients souffrent d’un énorme fardeau socio-économique et d’une baisse marquée de la qualité de vie 3,4,5. La toux chronique est largement considérée comme un syndrome d’hypersensibilité à la toux et se caractérise par une toux gênante souvent déclenchée par de faibles niveaux d’exposition thermique, mécanique ou chimique6. L’apparition de l’hypersensibilité à la toux est étroitement liée à l’inflammation des voies respiratoires7. Cependant, les mécanismes physiopathologiques sous-jacents à la modulation de la sensibilité à la toux doivent être élucidés davantage.
Les modèles animaux peuvent imiter la physiopathologie complexe de la toux et constituent des outils importants pour la recherche sur la toux 8,9. Des études antérieures ont montré que l’infection virale, l’instillation intrapulmonaire d’interféron-γ (IFN-γ, la perfusion œsophagienne d’acide chlorhydrique, l’exposition à des polluants, la fumée de cigarette et l’acide citrique peuvent induire la toux chez les animaux 10,11,12,13,14,15,16,17. Afin de mieux évaluer la toux et l’inflammation des voies respiratoires, un modèle murin de toux a été établi à l’aide d’une dose non létale du virus H1N1 dans cette étude. Pour la détection de la toux, certains outils de mesure de la toux ont été établis cliniquement pour mesurer la toux, y compris des méthodes subjectives et objectives18. Les outils d’évaluation subjective pour évaluer la gravité de la toux comprennent principalement une échelle analogique visuelle, le score de toux et des questionnaires sur la qualité de vie, etc.19,20. Cependant, il est peu probable qu’ils soient utilisés pour évaluer la toux chez les animaux. De plus, la toux peut être évaluée objectivement au moyen d’un test de provocation à la toux et d’une surveillance de la fréquence de la toux. Le test de provocation à la toux à l’aide d’un système de pléthysmographie du corps entier (WBP) est une méthode objective largement utilisée dans les études animales pour mesurer la sensibilité à la toux et révéler les mécanismes sous-jacents de la toux13,16. Sur la base des caractéristiques neuroanatomiques du réflexe de toux, l’acide citrique, la capsaïcine, l’adénosine 5'-triphosphate (ATP), l’isothiocyanate d’allyle (AITC) et le médiateur inflammatoire bradykinine sont couramment utilisés comme agents tussifs pour induire la toux21,22. L’acide citrique est l’un des agents tussifs les plus précoces et les plus largement utilisés déclenchant les réflexes de toux, qui a été validé pour mesurer la sensibilité à la toux. En outre, le défi de l’acide citrique a une bonne sécurité, une bonne faisabilité et une bonne tolérabilité et est suggéré pour évaluer la sensibilité du réflexe de toux en réponse aux traitements contre la toux23. Par conséquent, cet article décrira la méthode de mesure de la sensibilité à la toux en réponse à l’acide citrique chez la souris à l’aide d’un système WBP non invasif et en temps réel.
Les études de la physiopathologie de la toux nécessitent des échantillons de test, y compris des échantillons de sang, de liquide de lavage broncho-alvéolaire (BALF) et de tissus pulmonaires et trachéaux pour vérifier les changements dans les niveaux de facteurs clés24. À l’heure actuelle, il n’existe pas de procédures normatives pour le prélèvement d’échantillons de tissus de souris, et des études connexes utilisent différentes approches qui compliquent l’évaluation de l’inflammation des voies respiratoires. Le lavage broncho-alvéolaire est une méthode importante pour évaluer l’inflammation des voies respiratoires dans les maladies respiratoires25. Différentes méthodes de lavage broncho-alvéolaire entraîneront un manque de comparabilité entre les études connexes. De plus, différentes méthodes de lavage broncho-alvéolaire ont un impact sur les cellules inflammatoires et les cytokines inflammatoires dans le BALF. Par conséquent, cet article décrira l’établissement d’un modèle murin de toux avec une dose non létale du virus H1N1, la mesure de la toux à l’aide d’un système WBP et une méthode de lavage broncho-alvéolaire fiable, sûre et très efficace chez la souris.
Protocole
Toutes les procédures ont été approuvées par le Comité de soin et d’utilisation des animaux de l’Université de médecine de Guangzhou (20240248) et ont été effectuées en stricte conformité avec les directives approuvées. Des souris C57BL/6 exemptes d’agents pathogènes mâles pesant de 20 à 25 g ont été utilisées dans cette étude. Toutes les souris ont été logées à une température contrôlée (22 ± 2 °C), à une humidité (50 % ± 20 %) et à un éclairage (de 6 h 30 à 18 h 30) dans des cages à fond solide avec de la nourriture et de l’eau disponibles à volonté. La chronologie du protocole est illustrée à la figure 1.
1. Etablissement d’un modèle murin de toux
- Utiliser le virus de la grippe A/California/7/2009 (H1N1). Déterminer la dose létale du virus H1N1 chez la souris.
- Brièvement, anesthésie des souris (n = 10 par groupe) avec du pentobarbital sodique (80 mg·kg-1), puis infecte par voie intranasale avec un virus 10 fois dilué en série.
- Surveiller le décès sur une période de 15 jours. Calculer la dose létale médiane (DL50) par la méthode de Reed-Muench26.
- Infecter la souris avec le virus H1N1.
- Dissoudre 0,8 x DL50 du virus H1N1 dans 50 μL de solution saline tamponnée au phosphate (PBS).
- Anesthésier les souris avec du pentobarbital sodique (80 mg·kg-1).
- Lorsque les souris ont été profondément anesthésiées, placez la souris en position couchée avec les narines vers le haut.
- Instiller 5 à 10 μL de solution du virus H1N1 ou de solution PBS (comme témoin) par voie intranasale dans une narine de souris à l’aide d’une pipette (figure 2A).
- Ensuite, tenez la bouche de la souris fermée avec le pouce pour que son nez inspire fort afin que la solution du virus H1N1 dans la cavité nasale soit complètement inhalée dans les poumons (Figure 2B).
- Répétez les étapes 1.2.4 et 1.2.5 dans les autres cavités nasales des souris.
- Lorsque tout le virus H1N1 préparé à l’étape 1.2.1 est instillé par voie intranasale dans les poumons de la souris, placez-la en position couchée pour le repos (figure 2C).
- Mesurer la sensibilité à la toux de la souris après l’établissement du modèle à l’aide du système de pléthysmographie du corps entier des petits animaux Buxco. Le 21e jour, anesthésie intrapéritonéale de la souris avec du pentobarbital sodique (150 mg·kg-1). Prélever et traiter le sang, la rate, le BALF, les poumons et la trachée (figure 1).
2. La mesure de la sensibilité à la toux
- Préparez l’acide citrique (0,4 M) : Placez 0,1537 mg d’acide citrique dans un tube à centrifuger de 5 mL et ajoutez une solution saline normale à un volume de 2 mL.
- Inspection des instruments
- Vérifiez les canaux : Connectez les chambres du pléthysmographe du corps entier conformément aux instructions du fabricant et cliquez sur le bouton d’étalonnage - le bouton d’étalonnage passe de l’orange au vert, indiquant que l’étalonnage est réussi (Figure 3A).
- Calibrez le nébuliseur :
- Après avoir connecté le nébuliseur, ajoutez 500 μL de solution saline normale dans le nébuliseur et cliquez sur le bouton de nébulisation.
- Lorsque le liquide dans le nébuliseur est complètement aérosolisé, cliquez à nouveau sur le bouton de nébulisation pour voir la puissance du nébuliseur, qui est généralement d’environ 0,3 ml/min. Cliquez à nouveau sur le bouton de nébulisation pour accepter l’alimentation nébulisée actuelle.
- Après avoir vérifié les chaînes, assurez-vous que la valeur d’erreur est inférieure à 0,5 %.
- Réglage des paramètres
- Cliquez sur Créer une étude, sélectionnez l’option Toux , sélectionnez Souris dans Espèce, puis cliquez sur Suivant.
- Sélectionnez les paramètres CCnt : Réglez la durée de la période d’acclimatation sur 1 min, le temps de réponse sur 10 min, le volume d’aérosol sur 1 ml et la durée d’administration sur 10 min.
- Placez la souris consciente et non retenue dans des chambres individuelles de pléthysmographe en plastique transparent pour tout le corps. Entrez le poids et l’ID de l’objet de la souris et cliquez sur Suivant.
- Ajoutez 1 mL de solution d’acide citrique (0,4 M) dans le nébuliseur et observez les changements en temps réel du CCnt (figure 3B).
- Une fois que l’acide citrique est complètement utilisé, cliquez sur Fichier et terminer la session pour terminer l’expérience.
3. Prélèvement de sang, de rate, de BALF, de tissus pulmonaires et de trachée de souris (Figure 4)
- Prélever du sang.
- Après la détection de la toux, anesthésier la souris avec du pentobarbital sodique (150 mg·kg-1) par injection intrapéritonéale. Prélevez du sang sur les orbites de la souris profondément anesthésiée. Mélanger 1 mL de sang dans 0,1 mL de tampon anticoagulant (9,9 mg/mL d’héparine sodique dissoute dans du PBS) à 4 °C (Figure 4A).
- Agitez le tube de prélèvement sanguin pour bien mélanger le sang et l’anticoagulant afin d’empêcher la coagulation sanguine.
- Centrifuger le sang prélevé à 800 x g pendant 5 min à 4 °C. Prélever le surnageant, le stocker à -80 °C (utilisé pour la mesure des cytokines) et remettre la pastille en suspension dans 1 mL de solution de D-Hank. Étalez 10 μL de suspension de cellules sanguines sur la lame de verre pour déterminer les profils cellulaires.
- Récoltez la rate.
- Ouvrez la poitrine de la souris, recueillez le sang et exsangchez par l’artère (Figure 4B).
- Retirer le pavillon gauche, puis perfuser la circulation pulmonaire et systémique avec 5 mL de solution saline normale (figures 4C, D). Retirez toute la rate de la souris à l’aide d’une pince chirurgicale (figure 4E).
- Après avoir mesuré le poids de la rate, coupez-la en deux moitiés. Fixez la première moitié avec 4 % de paraformaldéhyde à température ambiante (RT) pour l’analyse histopathologique. Conservez la seconde moitié à -80 °C pour la mesure des cytokines.
- Lavage broncho-alvéolaire
- Réaliser le tube de lavage broncho-alvéolaire à l’aide d’une pipette Pasteur. Chauffez la pipette Pasteur à l’aide d’une lampe à alcool. Lorsqu’il devient mou, allongez-le pour former un tube fin. La longueur du tube de lavage broncho-alvéolaire est de 5 cm. Le diamètre supérieur est de 5 mm et le diamètre inférieur est de 1 mm (Figure 5).
- Pour le prélèvement BALF, séparez le poumon droit en le ligaturant au niveau de la bronche principale droite. Prélever le BALF des poumons gauches en lavant trois fois avec 0,5 mL de PBS pré-refroidi sur de la glace. Le taux de récupération du BALF est supérieur à 80 % (Figure 4F).
- Centrifuger le BALF collecté à 800 x g pendant 5 min à 4 °C. Prélevez le surnageant et mesurez la concentration totale de protéines, la concentration d’acide urique, l’activité de la LDH et les concentrations de cytokines.
REMARQUE : Les marqueurs inflammatoires, y compris la concentration totale en protéines, la concentration en acide urique et l’activité de la LDH dans le surnageant BALF, sont détectés à l’aide du kit de dosage conformément aux directives du fabricant24. - Remettez la pastille en suspension dans 200 μL de PBS et comptez les leucocytes dans BALF à l’aide d’une lame de comptage.
- Pour déterminer les profils cellulaires par comptage différentiel, étalez 50 μL de suspension cellulaire sur les lames de verre et laissez-le sécher.
- Fixez la lame avec du paraformaldéhyde à 4 % pendant la nuit, puis colorez avec l’hématoxyline-éosine (HE). Classez au moins 400 cellules en neutrophiles, macrophages, lymphocytes ou éosinophiles par lame.
- Prélèvement des tissus pulmonaires et de la trachée pour l’analyse histopathologique
- Après le prélèvement du BALF, prélever et fixer la moitié du poumon droit (Figure 4G) et de la trachée (Figure 4H) avec du paraformaldéhyde à 4 % à la RT pour une analyse histopathologique. Conservez l’autre moitié à -80 °C pour le western blot, la réaction en chaîne quantitative par polymérase en temps réel (qPCR) et le test immuno-enzymatique (ELISA).
Résultats
La figure 6 montre des images représentatives des changements pathologiques dans le poumon coloré à l’HE (figures 6A, B), la trachée (figure 6C, D) et la rate (figures 6E, F). L’infection par le virus H1N1 a entraîné des changements inflammatoires dans les poumons de souris, y compris un œdème et une infiltration de nombreux lymphocytes et de neutrophiles. L’infection par le virus H1N1 a également induit des changements inflammatoires dans les trachées de souris, y compris l’excrétion de cils et des infiltrations de cellules inflammatoires (nombreux lymphocytes et un petit nombre de neutrophiles). De plus, l’infection a également augmenté de manière significative le rapport entre la surface de la pulpe blanche et toute la surface de la rate chez la souris. Les lymphocytes s’accumulent dans la pulpe blanche de la rate. Cette procédure standardisée de prélèvement d’échantillons de tissus permet de mieux évaluer l’inflammation des voies respiratoires.
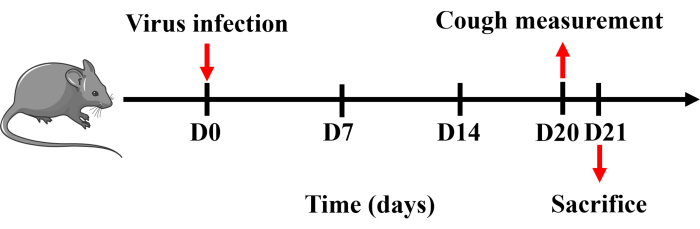
Figure 1 : Protocole d’établissement d’un modèle murin de toux. Des souris ont été anesthésiées avec du pentobarbital sodique et instillées par voie intranasale avec 0,8 x DL50 du virus H1N1 dissous dans 50 μL de PBS une fois le jour 0. La toux a été mesurée le 20e jour et les souris ont été sacrifiées le lendemain. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Instillation intranasale du virus H1N1. (A) Instillation intranasale de 0,8 x DL50 du virus H1N1 dans 50 μL de PBS. (B) Tenir la bouche de la souris fermée avec le pouce. (C) Placer les souris en position couchée. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Mesure de la sensibilité à la toux. (A) Équipement de détection de la toux chez la souris et (B) courbe du réflexe de toux. Le nombre d’épisodes de toux en réponse à la solution d’acide citrique nébulisée (0,4 M) a été détecté à l’aide du système de pléthysmographie du corps entier (WBP) après modélisation. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Images représentatives du prélèvement du sang, de la rate, du BALF, du poumon et de la trachée de la souris. (A) Prélèvement sanguin, (B) ouverture du thorax, (C) coupe de l’oreillette gauche, (D) perfusion de la circulation pulmonaire, (E) prélèvement de la rate, (F) lavage broncho-alvéolaire, et (G) prélèvement du lobe pulmonaire et (H) de la trachée pour l’analyse histopathologique. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Spécification du tube de lavage broncho-alvéolaire. La longueur du tube de lavage broncho-alvéolaire est de 5 cm. Le diamètre supérieur est de 5 mm et le diamètre inférieur est de 1 mm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 6 : Effets du virus H1N1 sur les modifications pathologiques du poumon, de la trachée et de la rate de la souris. (A,B) Figures représentatives des modifications pathologiques dans les sections pulmonaires colorées à l’HE des groupes (A) témoin et (B) H1N1. Le symbole « ↑ » marque l’infiltration des lymphocytes (rouge) et des neutrophiles (bleu). Barres d’échelle : 50 μm. (C,D) Figures représentatives des modifications pathologiques dans les coupes de trachée colorées à l’HE des groupes (C) témoin et (D) H1N1. Le symbole « ↑ » marque l’infiltration des lymphocytes (rouge) et des neutrophiles (bleu). Barres d’échelle : 20 μm. (E,F) Figures représentatives des changements pathologiques dans les coupes de rate colorées à l’HE des groupes témoins (E) et (F) H1N1. Le symbole « ↑ » marque la pulpe blanche (verte). Barres d’échelle : 500 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Certaines toux chroniques réfractaires et post-infectieuses sont des affections courantes associées à l’infection par un virus respiratoire27. Afin de mieux évaluer la sensibilité à la toux et l’inflammation des voies respiratoires, un modèle murin de toux a été établi à l’aide du virus H1N1 dans cette étude. Des modèles de souris appropriés pour la toux doivent être sélectionnés pour d’autres études en fonction de l’objectif de l’étude. La plupart des études précédentes ont utilisé le cobaye comme modèle animal dans des études mécanistes ou des essais de nouveaux médicaments contre la toux 28,29,30. Des études récentes ont suggéré que les souris pourraient être utilisées pour évaluer la physiopathologie de la toux en raison de leur cycle de reproduction plus court, de leur plus grand nombre de réactifs et de leur préparation aux manipulations génétiques, bien que leur comportement en matière de toux soit encore débattu. L’acide citrique a été utilisé comme agent tussif pour induire la toux dans cette étude. Les mécanismes du réflexe de toux induits par l’acide citrique peuvent être liés à l’activation des fibres C jugulaires et des fibres Aδnodoses 32. En outre, le système WBP mesure les changements du réflexe de toux chez la souris de manière non invasive et minimise les effets du stress psychologique. L’effet de l’environnement extérieur sur les souris doit être minimisé lorsque la sensibilité à la toux est détectée. La souris doit être placée dans la salle de test, puis recouverte d’un sac en plastique pour réduire l’irritation causée par l’environnement extérieur.
Cette étude détaille les procédures normatives de prélèvement de sang, de rate, de BALF, de poumons et de tissus de la trachée de souris et introduit certaines mesures pour évaluer l’inflammation des voies respiratoires. Pour détecter l’inflammation des voies respiratoires, les coupes des poumons et de la trachée sont colorées à l’hématoxyline et à l’éosine afin d’évaluer l’histopathologie générale24. L’augmentation de la concentration de protéines totales et d’acide urique dans le surnageant de BALF est associée à une inflammation et à des lésions cellulaires dans les voies respiratoires33. L’activité de la LDH dans le surnageant de BALF reflète des lésions cellulaires et une nécrose34. Les leucocytes dans BALF et le sang peuvent refléter le degré d’inflammation de la maladie35. Le nombre différentiel de cellules BALF est largement utilisé dans l’évaluation de l’inflammation des voies respiratoires dans les maladies chroniques des voies respiratoires et fournit des informations importantes dans l’étude de la pathogenèse, l’établissement de diagnostics et les stratégies de gestion des maladies respiratoires chroniques36.
La limite de cette expérience est que la collecte d’un grand nombre d’échantillons de tissus fait fonctionner les souris pendant une longue période, ce qui peut affecter l’activité des échantillons de tissus. Par conséquent, les échantillons de tissus de souris doivent être placés sur de la glace immédiatement après le prélèvement. De plus, le tube de lavage broncho-alvéolaire utilisé dans cette étude convient aux souris mais pas aux animaux plus gros.
En résumé, nous fournissons une description détaillée des méthodes de détection de la toux et de l’inflammation des voies respiratoires chez la souris. Ces méthodes fournissent aux chercheurs des outils pour étudier la physiopathologie complexe de la toux.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par le Projet de planification scientifique et technologique de Guangzhou (202002030151), le Grand projet du Laboratoire national de Guangzhou (GZNL2024A02001) et la subvention du Laboratoire clé d’État des maladies respiratoires (SKLRD-Z-202202).
matériels
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde | Biosharp | BL539A | |
| Buxco Small Animal Whole Body Plethysmography System | DSI | — | |
| Calcium-free and magnesium-free Hank’s Balanced Salt Solution | Beyotime | C0219 | |
| Citric acid | Sigma-Aldrich | C2404 | |
| Hematoxylin-Eosin | BASO Biotechnology | BA-4098 | |
| Heparin sodium | Alfa Aesar | A16198 | |
| Influenza A/California/7/2009 (H1N1) virus | ATCC | VR-1894 | |
| Isoflurane | RWD | R510-22 | |
| Lactate dehydrogenase assay kit | Nanjing Jiancheng Bioengineering Institute | A020-2-2 | |
| Normal saline | Guangzhou Zhongbo Biotechnology | 1234-1 | |
| Pasteur pipet | NEST | 318415 | |
| Pentobarbital sodium | Merck | P3761 | |
| Phosphate buffered saline | Meilunbio | MA0015 | |
| Total protein assay kit | Nanjing Jiancheng Bioengineering Institute | A045-3 | |
| Uric acid assay kit | Thermo Fisher Scientific | A22181 |
Références
- Brooks, S. M. Perspective on the human cough reflex. Cough. 7, 10(2011).
- Lai, K., Long, L. Current status and future directions of chronic cough in china. Lung. 198 (1), 23-29 (2020).
- Zeiger, R. S., et al. Patient-reported burden of chronic cough in a managed care organization. J Allergy Clin Immunol Pract. 9 (4), 1624-1637.e10 (2021).
- Marchant, J. M., et al. What is the burden of chronic cough for families. Chest. 134 (2), 303-309 (2008).
- Chamberlain, S. A., et al. The impact of chronic cough: A cross-sectional european survey. Lung. 193 (3), 401-408 (2015).
- Morice, A. H., et al. Expert opinion on the cough hypersensitivity syndrome in respiratory medicine. Eur Respir J. 44 (5), 1132-1148 (2014).
- Chung, K. F., et al. Cough hypersensitivity and chronic cough. Nat Rev Dis Primers. 8 (1), 45(2022).
- Deng, Z., et al. Pulmonary IFN-γ causes lymphocytic inflammation and cough hypersensitivity by increasing the number of IFN-γ-secreting t lymphocytes. Allergy Asthma Immunol Res. 14 (6), 653-673 (2022).
- Hiramatsu, Y., et al. The mechanism of pertussis cough revealed by the mouse-coughing model. mBio. 13 (2), e0319721(2022).
- Lin, L., et al. The duration of cough in patients with H1N1 influenza. Clin Respir J. 11 (6), 733-738 (2017).
- Deng, Z., et al. IFN-γ enhances the cough reflex sensitivity via calcium influx in vagal sensory neurons. Am J Respir Crit Care Med. 198 (7), 868-879 (2018).
- Chen, Z., et al. Dorsal vagal complex modulates neurogenic airway inflammation in a guinea pig model with esophageal perfusion of HCl. Front Physiol. 5, 536(2018).
- Zhi, H., et al. Gabapentin alleviated the cough hypersensitivity and neurogenic inflammation in a guinea pig model with repeated intra-esophageal acid perfusion. Eur J Pharmacol. 959, 176078(2023).
- Fang, Z., et al. Traffic-related air pollution induces non-allergic eosinophilic airway inflammation and cough hypersensitivity in guinea-pigs. Clin Exp Allergy. 49 (3), 366-377 (2019).
- Xiang, J., et al. Fructus mume protects against cigarette smoke induced chronic cough guinea pig. J Med Food. 23 (2), 191-197 (2020).
- Chen, Z., et al. A descending pathway emanating from the periaqueductal gray mediates the development of cough-like hypersensitivity. iScience. 25 (1), 103641(2022).
- Chen, Z., et al. Glial activation and inflammation in the nts in a rat model after exposure to diesel exhaust particles. Environ Toxicol Pharmacol. 83, 103584(2021).
- Mai, Y., et al. Methods for assessing cough sensitivity. J Thorac Dis. 12 (9), 5224-5237 (2020).
- Lee, K. K., et al. A longitudinal assessment of acute cough. Am J Respir Crit Care Med. 187 (9), 991-997 (2013).
- Birring, S. S., et al. Development of a symptom specific health status measure for patients with chronic cough: Leicester cough questionnaire (LCQ). Thorax. 58 (4), 339-343 (2003).
- Mazzone, S. B., Farrell, M. J. Heterogeneity of cough neurobiology: Clinical implications. Pulm Pharmacol Ther. 55, 62-66 (2019).
- Morice, A. H., Kastelik, J. A., Thompson, R. Cough challenge in the assessment of cough reflex. Br J Clin Pharmacol. 52 (4), 365-375 (2001).
- Nurmi, H. M., Lätti, A. M., Brannan, J. D., Koskela, H. O. Comparison of mannitol and citric acid cough provocation tests. Respir Med. 158, 14-20 (2019).
- Ding, W., et al. Amg487 alleviates influenza a (H1N1) virus-induced pulmonary inflammation through decreasing IFN-γ-producing lymphocytes and IFN-γ concentrations. Br J Pharmacol. 181 (13), 2053-2069 (2024).
- Connett, G. J. Bronchoalveolar lavage. Paediatr Respir Rev. 1 (1), 52-56 (2000).
- Wu, X., et al. Correlation of adhesion molecules and non-typeable haemophilus influenzae growth in a mice coinfected model of acute inflammation. Microbes Infect. 23 (8), 104839(2021).
- Capristo, C., Rossi, G. A. Post-infectious persistent cough: Pathogenesis and therapeutic options. Minerva Pediatr. 69 (5), 444-452 (2017).
- Kollarik, M., Brozmanova, M. Cough and gastroesophageal reflux: Insights from animal models. Pulm Pharmacol Ther. 22 (2), 130-134 (2009).
- Driessen, A. K., et al. A role for neurokinin 1 receptor expressing neurons in the paratrigeminal nucleus in bradykinin-evoked cough in guinea-pigs. J Physiol. 598 (11), 2257-2275 (2020).
- Ruhl, C. R., et al. Mycobacterium tuberculosis sulfolipid-1 activates nociceptive neurons and induces cough. Cell. 181 (2), 293-305.e211 (2020).
- Chen, L., Lai, K., Lomask, J. M., Jiang, B., Zhong, N. Detection of mouse cough based on sound monitoring and respiratory airflow waveforms. PLoS One. 8 (3), e59263(2013).
- Wallace, E., Guiu Hernandez, E., Ang, A., Hiew, S., Macrae, P. A systematic review of methods of citric acid cough reflex testing. Pulm Pharmacol Ther. 58, 101827(2019).
- Ding, W., et al. Intrapulmonary ifn-γ instillation causes chronic lymphocytic inflammation in the spleen and lung through the CXCR3 pathway. Int Immunopharmacol. 122, 110675(2023).
- Liu, B., et al. Anti-IFN-γ therapy alleviates acute lung injury induced by severe influenza a (H1N1) pdm09 infection in mice. J Microbiol Immunol Infect. 54 (3), 396-403 (2021).
- Domagała-Kulawik, J. Bal in the diagnosis of smoking-related interstitial lung diseases: Review of literature and analysis of our experience. Diagn Cytopathol. 36 (12), 909-915 (2008).
- Miyata, Y., et al. The effect of bronchoconstriction by methacholine inhalation in a murine model of asthma. Int Arch Allergy Immunol. 181 (12), 897-907 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon