Method Article
通过选择性核糖体分析对共翻译相互作用网络进行全局鉴定
摘要
共转化相互作用在新生链修饰,靶向,折叠和组装途径中起着至关重要的作用。在这里,我们描述了选择性核糖体分析,这是一种 体内直接分析真核生物酿酒 酵母模型中这些相互作用的方法。
摘要
近年来,很明显,核糖体不仅可以解码我们的mRNA,还可以引导多肽链进入拥挤的细胞环境。核糖体为膜靶向因子、修饰酶和折叠伴侣的空间和动力学控制结合提供了平台。最近,甚至将组装成高阶低聚物复合物以及蛋白质 - 蛋白质网络形成步骤也被发现与合成相协调。
在这里,我们描述了选择性核糖体分析,这是一种为捕获 体内共翻译相互作用而开发的方法。我们将详细介绍捕获核糖体 - 新生链复合物以及共翻译相互作用物所需的各种亲和纯化步骤,以及以近密码子分辨率破译共翻译相互作用所需的mRNA提取,大小排阻,逆转录,深度测序和大数据分析步骤。
引言
Selective Ribosome Profiling(SeRP)是迄今为止唯一一种在体内以直接方式捕获和表征体内共翻译相互作用的方法1,2,3,4,5,6。SeRP能够以近密码子分辨率2,7对任何因子与翻译核糖体的相互作用进行全局分析。
该方法依赖于生长细胞的快速冷冻和保留活性翻译。然后用RNase I处理细胞裂解物以消化细胞中的所有mRNA,除了被称为"核糖体足迹"的核糖体保护的mRNA片段。然后将样品分成两部分;一部分直接用于分离所有细胞核糖体足迹,代表细胞中所有正在进行的翻译。第二部分用于与感兴趣因子相关的核糖体特定子集的亲和纯化,例如:修饰酶,易位因子,折叠伴侣和复合物组装相互作用。亲和纯化的核糖体足迹统称为相互作用组。然后,提取受核糖体保护的mRNA并用于cDNA文库的生成,然后进行深度测序。
对总翻译组和相互作用组样本的比较分析可以识别与目标因子相关的所有 orfs ,以及表征每个 orf 相互作用曲线。该图谱报告了精确的参与开始和终止序列,从中可以推断出解码的密码子和新兴多肽链的各自残基,以及相互作用过程中的核糖体速度变化7,8。 图1 将协议描述为原理图。
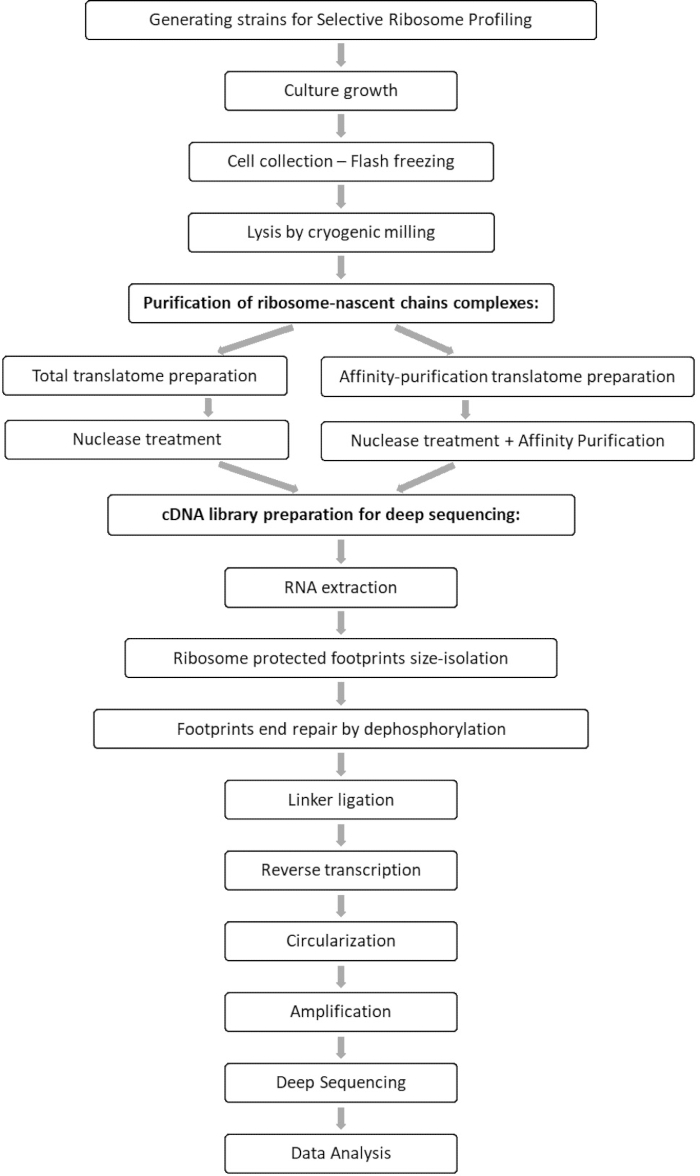
图 1:SeRP 协议概述。 该协议可以在7-10天内完整执行。 请点击此处查看此图的大图。
研究方案
1. 生成用于选择性核糖体分析的菌株
注意: Selective Ribosome Profiling(SeRP)是一种依赖于感兴趣因子的亲和力纯化来评估它们与核糖体 - 新生链复合物的相互作用模式的方法。利用同源重组9以及基于CRISPR / Cas910 的方法将各种感兴趣的因素与标签融合在一起以进行亲和力纯化。这些标签是GFP,用于GFP-trap亲和力纯化,TAP标签用于IgG-Sepharose珠子纯化以及由亲和素或链霉亲和素纯化的AVI标签,以列出近年来的一些成功例子。
- 执行生长或功能测定,以验证标记是否不影响蛋白质功能。应评估 N' 与 C' 终端标记。
注意:核糖体(rRNA)以及各种因素中的许多核糖体结合结构域具有高电荷,使得高电荷标签(如多组氨酸)无法使用,因为它可能导致错误发现或改变结合模式。
2. 文化成长
- 在富含液体酵母提取物蛋白胨胨葡萄糖(YPD)的培养基中,或在合成葡萄糖(SD)最小培养基(1.7 g / L酵母氮碱与硫酸铵或1.7 g / L酵母氮碱,不含硫酸铵,1 g / L谷氨酸单钠,2%葡萄糖并补充完整或适当的氨基酸混合物)中培养含有所需标记蛋白质的构建酵母培养物(基于菌株BY4741)。
- 在适当的培养基中将250-500mL细胞培养物在30 °C下生长至0.5 OD 600(中对数)。
3. 细胞采集和裂解
- 通过真空过滤在带有玻璃过滤系统的0.45μm硝酸纤维素吸墨膜上真空过滤快速收集细胞(玻璃过滤器支架,带1 L玻璃漏斗,真空底座和盖子,不锈钢筛网,垫圈和弹簧夹,90 mm;研磨接头烧瓶1 L)。
- 通过用刮刀刮除颗粒状细胞并立即将它们浸入充满液氮的50mL管中,快速冷冻收集的细胞。
停止点:细胞可以在-80°C下储存长达3-4周。 - 通过在混合研磨机中低温研磨进行细胞裂解:在30 Hz下两次2分钟,用1mL裂解缓冲液(见 表1)。在研磨之间在液氮中冷却。
| 试剂 | 每个样品的量(μL) | 最终浓度 |
| 10毫克/毫升CHX(环己酰亚胺) | 220 | 0.5毫克/毫升 |
| 1M 三盐酸 pH 8.0 | 88 | 20 毫米 |
| 3M氯化钾 | 205.7 | 140 毫米 |
| 100万氯化镁2 | 26.4 | 6 毫米 |
| 100万永久残基 | 4.4 | 1 毫米 |
| NP-40 | 4.4 | 0.10% |
| 蛋白酶抑制剂 | 2 片 | |
| 脱氧核糖核酸酶 I | 8.8 | 0.02 U/毫升 |
| 最终卷 | 4,400 |
表1:裂解缓冲液预混液的配方。
注意:如果感兴趣的蛋白质非常不稳定,裂解缓冲液可以改变以含有更多的蛋白酶抑制剂(如贝他汀,路易替丁,抑肽酶等),但重要的是要避免EDTA,以保持核糖体在以下步骤中组装的小亚基和大亚基。出于类似的原因,始终在缓冲溶液中保持至少6mM MgCl2 。
注意:HCl具有高腐蚀性,PMSF是有毒的。戴上手套,小心处理。
- 在30,000× g,4°C下离心2分钟以清除裂解物并收集上清液。
4. 核糖体新生链复合物对SeRP的纯化
- 对于每个实验,将上清液分成两部分;每个在不同的微量离心管中:总RNA样品(〜200μL)和免疫纯化(IP)样品(〜700μL)翻译组样品。
-
处理总RNA样品
- 在4°C下使用10U RNase I消化总RNA样品25分钟;使用旋转混合架以 30 RPM 旋转。
注意:消化条件可以使用多体分析进行校准,以确保单体峰不会过度或消化不足。 - 制备蔗糖缓冲预混液,如 表2所述。
- 在4°C下使用10U RNase I消化总RNA样品25分钟;使用旋转混合架以 30 RPM 旋转。
| 试剂 | 每个样品的量(μL) | 最终浓度 |
| 50%蔗糖 | 200 | 25% |
| 1M 三盐酸 pH 8.0 | 8 | 20 毫米 |
| 3M氯化钾 | 18.7 | 140 毫米 |
| 100万氯化镁2 | 4 | 10 毫米 |
| 100毫克/毫升血流血酸 | 0.4 | 0.1毫克/毫升 |
| 蛋白酶抑制剂 | 1 片 | |
| 最终卷 | 400 |
表2:蔗糖垫预混料的配方。
- 将样品上样到400μL蔗糖垫上,并在TLA120转子中在245,000× g 和4°C下离心90分钟。
- 用真空泵快速除去上清液,并用150μL裂解缓冲液覆盖沉淀。通过在4°C和300RPM下振荡1小时重悬沉淀。
- 通过移液重悬残留的沉淀并转移到新的1.5 mL管中。
注意:100-200μg总RNA通常足以对总翻译组进行核糖体分析。可以添加rRNA耗竭步骤以减少rRNA污染,这是核糖体 - 新生链复合物亲和力纯化11 中最常见的污染物(参见讨论以获取更多详细信息)。
-
处理免疫纯化样品
- 用3×1mL裂解缓冲液(不含DNA酶I和蛋白酶抑制剂)洗涤每份样品100-400μL亲和结合基质(70%EtOH中的1:1抗体偶联珠);将亲和基质重悬于裂解缓冲液中,然后在4°C下用旋转的混合架以30 RPM旋转5分钟。通过在3,000× g,4°C下离心30s沉淀。 丢弃上面的液体。重复三次。
- 使用每A260nm单位的RNase I10 U以及亲和结合基质(例如,每个样品100-400μLGFP-TRAP)消化免疫纯化样品。
- 在4°C下,用旋转的混合架以30 RPM旋转25分钟,以将蛋白质与亲和基质结合。
- 如 表3中所述制备洗涤缓冲液预混液。
| 试剂 | 每个样品的量(μL) | 最终浓度 |
| 10毫克/毫升血红素 | 50 | 0.1毫克/毫升 |
| 1M 三盐酸 pH 8.0 | 100 | 20 毫米 |
| 3M氯化钾 | 233 | 140 毫米 |
| 100万氯化镁2 | 50 | 10 毫米 |
| 100万永久残基 | 5 | 1 毫米 |
| NP-40 | 0.5 | 0.01% |
| 蛋白酶抑制剂 | 2 片 | |
| 50%甘油 | 1,000 | 10% |
| 最终卷 | 5,000 |
表3:洗涤缓冲液预混液的配方。
- 用1mL洗涤缓冲液洗涤亲和结合基质三次,每次约1分钟,在4°C下以30RPM在混合架中旋转。
- 通过在4°C下以3,000× g 离心30s沉淀。 丢弃上面的液体。
- 在1mL洗涤缓冲液中再洗涤两次,每次5分钟,在4°C下以30RPM在混合架中旋转。
- 通过在3,000× g 和4°C下离心30秒沉淀。
- 使用50μL微球进行蛋白质洗脱,用相同量的2x样品缓冲液。使用其余的磁珠进行RNA提取。
- 在3,000× g,4°C下离心30秒以沉淀珠子并丢弃上部液体。
- 在液氮中冷冻并储存在-80°C。 使用这些样品进行后续的RNA提取。
停止点:样品可以在-80°C下储存过夜或更长时间。这可能是一个停止点。 - 通过蛋白质印迹或考马斯用等分试样(约10%体积,混合后)染色来评估亲和力纯化步骤的成功与否。始终在未标记的 WT 菌株上使用模拟 IP 作为与亲和矩阵的非特异性绑定的对照。
注意:高非特异性背景可以通过增加盐/洗涤剂浓度的额外洗涤步骤来克服。瞬态相互作用可以通过各种交联剂处理来稳定,例如,活细胞的多聚甲醛(PFA)处理 - 向生长培养基中加入0.4%-1%PFA2-5分钟,然后甘氨酸(0.3M)淬火3分钟,强烈建议。
注意:多聚甲醛是一种可疑的致癌物质。由于多聚甲醛蒸发迅速并具有腐蚀性,因此在化学安全罩中工作并戴上两层手套。
5. 用于深度测序的cDNA文库制备
- 核糖核酸提取
注意:使用不含 RNase 的不粘 1.5 mL 试管,以防止可能的 RNA 或 DNA 耗竭。- 将步骤4.2.5和4.3.12中的样品在冰上解冻,并将样品重悬于10mM Tris-HCl pH 7.0至最终体积700μL。
注意:酸性苯酚和氯仿是挥发性和有害的。在化学品安全罩中工作。 - 向 0.7 mL 总 RNA 或 IP 洗脱液中加入 40 μL 20% SDS。关闭并反转几次。蛋白质沉淀应使样品变白。
- 向样品中加入0.75 mL预热酸 - 苯酚:氯仿。密封管子,并在热混合器中以1,400 RPM和65°C摇动5分钟。 将样品在冰上冷却5分钟。
- 离心管从步骤5.1.3。在20,000 x g 下持续 2 分钟。将顶部水层转移到新鲜管中,并向其中加入0.7 mL酸 - 苯酚:氯仿。
- 在室温下孵育5分钟,偶尔涡旋。以20,000× g离心2分钟。将顶部水层转移到新鲜管中,并向其添加0.6mL氯仿和涡旋。
- 以20,000× g离心1分钟。将顶部水层转移到新管中。
- 通过加入78μL3M NaOAc,pH 5.5,2μL糖蓝和0.75mL异丙醇沉淀核酸。彻底涡旋5分钟。在-80°C下孵育至少1小时或在-20°C下孵育16小时。
- 在20,000× g 和4°C下离心30分钟,弃去上清液。用冰冷的0.75mL 80%乙醇洗涤沉淀。倒置管子进行彻底清洗。在4°C下以20,000× g 离心5分钟,然后弃去上清液。
- 在450× g,4°C下旋转20秒,除去剩余的乙醇并丢弃液体。在65°C下用打开的盖子干燥沉淀5分钟。 按如下方式重悬样品:对于IP重悬样品,在10μL的10mM Tris-HCl中,pH 7.0。对于总翻译组分析,将样品重悬于20μL的10mM Tris-HCl中,pH 7.0。
停止点:RNA可以在-80°C下储存数月。
- 将步骤4.2.5和4.3.12中的样品在冰上解冻,并将样品重悬于10mM Tris-HCl pH 7.0至最终体积700μL。
- 通过荧光法定量总RNA浓度
注意:在准备用于下一代测序的cDNA文库时,以下所有材料和表面都应不含RNase。处理RNA样品时,戴上手套。- 将1μL酸性苯酚提取的总RNA稀释在9μL的10mM三盐酸盐中,pH 7.0。按照制造商网站上的说明,使用荧光计进行定量。
- 用10μL的10mM Tris-HCl稀释含有50μgRNA的样品,pH 7.0。
注意:不要测量IP样本,请在下一步中使用所有内容。
- 凝胶纯化核糖体保护足迹碎片
- 设置15%TBE-尿素聚丙烯酰胺凝胶,并浸没在1x TBE电泳缓冲液中。在样品上样前以200 V运行30分钟。向每个样品中加入20μL2x TBE-尿素样品缓冲液。
注意:预期波段大小约为 25-35 nt。 - 将10 bp DNA分子量标准品在80°C下解冻并使样品变性(不是分子量标准品)2分钟,然后在冰上冷却。将每个样品加载到其他通道上。在200 V下运行凝胶50-70分钟。
- 将6μLSYBR金(10,000 x 浓缩物)稀释在60mL 1x TBE缓冲液中并染色,同时在避光盒中摇动15-20分钟。染色凝胶时,在标记的1.5 mL管中准备无菌手术刀和0.5 mL破凝胶管。
- 用无菌手术刀切除所需的条带(使用新鲜的手术刀或在样品之间使用清洁孔),并将每个凝胶片放入凝胶破碎管中。
- 拍摄凝胶的图像,以确保凝胶中没有样品残留物。
- 在4°C下以20,000× g 离心含有切割切片的管5分钟,并将剩余的凝胶片从破凝胶管转移到1.5mL管中。
- 加入0.5毫升10毫升三倍,pH 7.0。在热混合器中以1,400 RPM在70°C下摇动10分钟。
- 转移到具有宽孔移液器尖端的醋酸纤维素柱中,并在4°C下以20,000× g 离心3分钟。
- 将流经物转移到新的 1.5 mL 离心管中,并在冰上冷却。
- 为了沉淀核酸,加入:550μLIPA,55μL3M NaOAc和2μL糖蓝和涡旋彻底混合。将样品置于-80°C下至少1小时。
- 在20,000× g 和4°C下离心至少1小时,并弃去上清液。用0.75mL冰冷的80%乙醇洗涤沉淀。倒置管子进行彻底洗涤,直到颗粒与底部分离。在4°C下以20,000× g 再次离心5分钟,并弃去上清液。
- 在450× g,4°C下旋转20秒,并除去剩余的乙醇。在65°C下用打开的盖子干燥沉淀5分钟。
- 加入15μL10mM Tris,pH 7.0并彻底重悬沉淀。在450× g,4°C下旋转20秒,并将样品转移到新的1.5 mL管中。
停止点:纯化的RNA可以在-80°C下储存几个月。
- 设置15%TBE-尿素聚丙烯酰胺凝胶,并浸没在1x TBE电泳缓冲液中。在样品上样前以200 V运行30分钟。向每个样品中加入20μL2x TBE-尿素样品缓冲液。
- 去磷酸化
- 对于每个样品使用以下混合物的3μL:将1μL RNase抑制剂加入2μL10x T4多核苷酸激酶反应缓冲液中,不含ATP。向每个样品中加入2μLT4多核苷酸激酶。轻轻移液至充分混合,并在37°C下孵育2小时,不摇动。
- 为了灭活酶,将样品在75°C下孵育10分钟,并在450× g,4°C下旋转20秒。加入0.5mL 10mM Tris,pH 7.0。
- 为了沉淀核酸,加入2μL糖蓝,550μLIPA和55μL3M NaOAc。
- 涡旋彻底混合并将样品在-80°C下冷却至少1小时。
停止点:样品可以在-80°C下储存过夜或更长时间。 - 重复步骤 5.3.11-5.3.13。
停止点:去磷酸化的RNA可以在-80°C下储存数月。
- 使用生物分析仪进行定量
- 通过混合1μL样品和4μLDEPC处理过的水,使每个RNA样品的稀释度为1:4。
注意:DEPC是一种致癌物质。戴上手套,小心工作。 - 运行生物分析仪小型RNA芯片/磁带站。遵循制造商的协议。
注意:预期受核糖体保护的RNA片段大小约为28-30 nt。
- 通过混合1μL样品和4μLDEPC处理过的水,使每个RNA样品的稀释度为1:4。
- 连接线 3' 末端,带链接器-1
- 用10mM Tris,pH 7.0将5 pmol小RNA片段稀释至10μL。样品在80°C下变性2分钟,并在冰上冷却。
- 如 表4 中所述制备预混液,每个样品使用29μL。
| 试剂 | 每个样品的量(μL) | 最终浓度 |
| 50% 无菌过滤 PEG 8000 | 16 | 20% |
| 断续器 | 4 | 10% |
| 10×T4 RNA连接酶2缓冲液 | 4 | 1 倍 |
| 超抗酶-在核酸酶抑制剂 | 2 | 2 U |
| 10 mM 腺苷酸化接头 3-L1 | 0.1 | 25 微米 |
| DEPC处理过的水 | 2.9 | |
| 最终卷 | 29 |
表4:3'末端连接预混液的配方。
- 加入1μLT4 RNA连接酶2并轻轻移液以充分混合。在23°C孵育2小时。
- 为了沉淀核酸,加入:550μLIPA,500μL10mM Tris,pH 7.0,55μL3M NaOAc和2μL糖蓝。涡旋彻底混合,并将样品置于-80°C下至少1小时。
停止点:将样品储存在-80°C过夜或更长时间。 - 重复步骤 5.3.2-5.3.12。
- 将沉淀重悬于6μL的10mM Tris中,pH 7.0。在450× g,4°C下旋转20秒,并将样品转移到新的1.5 mL管中。
停止点:样品可以在-80°C下储存数月。
-
3' 链接基底面的凝胶纯化
- 设置10%TBE-尿素聚丙烯酰胺凝胶,并浸没在1x TBE电泳缓冲液中。在样品上样前以200 V运行30分钟。向每个样品中加入6μL2x TBE-尿素样品缓冲液。
注意:预期波段大小约为 71-73 nt。 - 重复步骤 5.3.2-5.3.13。
停止点:样品可以在-80°C下储存数月。
- 设置10%TBE-尿素聚丙烯酰胺凝胶,并浸没在1x TBE电泳缓冲液中。在样品上样前以200 V运行30分钟。向每个样品中加入6μL2x TBE-尿素样品缓冲液。
-
反向转录 3ʹ 链接的足迹片段以生成 ssDNA
- 如 表5 中所述制备预混液,每个样品使用3μL。
| 试剂 | 每个样品的量(μL) | 最终浓度 |
| 1000 万吨/肾上腺素酐 | 1 | 0.5 毫米 |
| 25 μM 链接器 L(rt) | 0.5 | 625 海里 |
| DEPC处理过的水 | 1.5 | |
| 最终卷 | 3 |
表5:核酸变性前逆转录缓冲液预混液的配方。
- 涡旋并旋转样品。
- 将样品在65°C下孵育5分钟。
- 在冰上冷却样品。
- 如 表6 中所述准备预混液,每个样品使用6μL。涡旋并旋转样品。向每个样品和移液管中加入1μL上标III,轻轻混合均匀,并在50°C下孵育30分钟。
| 试剂 | 每个样品的量(μL) | 最终浓度 |
| 5× FS 缓冲液 | 4 | 1 倍 |
| 超抗酶-在核酸酶抑制剂 | 1 | 2 U |
| 直径 0.1 米 | 1 | 5 毫米 |
| 最终卷 | 6 |
表6:核酸变性后逆转录缓冲液预混液的配方。
- 加入2.3μL 1 N NaOH,其水解RNA并淬灭逆转录。
注意:NaOH具有高度腐蚀性。戴上手套和护目镜。 - 在95°C下孵育15分钟,直到样品变成粉红色。
- 设置10%TBE-尿素聚丙烯酰胺凝胶,并浸没在1x TBE电泳缓冲液中。在样品上样前以200 V运行30分钟。向每个样品中加入23μL2x TBE-尿素样品缓冲液。
注意:预期的DNA条带大小为115-117 nt。 - 重复步骤 5.3.2-5.3.12。
- 将沉淀重悬于15μL的10mM Tris中,pH 8.0。在450× g,4°C下旋转20秒,并将样品转移到新的1.5 mL管中。
停止点:样品可以在-80°C下储存数月。
-
ssDNA 环化
- 准备以下预混液,并按 表7所述,每个样品上样4μL。
| 试剂 | 每个样品的量(μL) | 最终浓度 |
| 10×环连接酶II缓冲液 | 2 | 1 倍 |
| 5 M 甜菜碱 (可选) | 1 | 0.25 米 |
| 50 mM 锰2 | 1 | 2.5 毫米 |
| 最终卷 | 4 |
表7:ssDNA环化预混液的配方。
- 向每个样品中加入1μLCircLigase II ssDNA连接酶,并在60°C下孵育1小时。
注意:通过在孵育1小时后向每个样品中加入1μLCircLigase II ssDNA连接酶,可以提高该步骤的效率。 - 通过在80°C下孵育10分钟来灭活酶。
- 在冰上冷却并继续PCR扩增或储存在-80°C。
停止点:样品可以在-80°C下储存多年。
-
PCR 扩增
- 准备以下PCR预混液,并加载每个样品82μL,详见 表8。
| 试剂 | 每个样品的量(μL) | 最终浓度 |
| DEPC处理过的水 | 61.6 | |
| 5×磷氢HF反应缓冲液 | 17.6 | 1 倍 |
| 1000 万吨/肾上腺素酐 | 1.8 | 200 微米 |
| 100 μM PCR 正向引物 | 0.2 | 225 海里 |
| HF 磷离子聚合酶 | 0.8 | 1.6 U |
| 最终卷 | 82 |
表8:PCR扩增预混液配方。
- 向每个含有预混液的试管中,加入5μL环状DNA。
注意:将其余的环状DNA样品储存在-80°C。 - 向每个样品中加入不同的1μL20μM PCR反向条形码引物(见 表9)并涡旋彻底混合。
- 将每个管等分到四个单独的PCR管中,每个管将用于不同数量的PCR循环。
- 根据以下程序运行PCR反应,详见 表10。
| 周期 | 变性 (98 °C) | 退火 (60 °C) | 延伸 (72 °C) |
| 1 | 30 秒 | ||
| 2-16 | 10 秒 | 10 秒 | 5 秒 |
表10:用于PCR反应的PCR程序。
- 在第 8、9、10 和 11 周期后,取出 PCR 管(对于 IP 样品,周期范围为 9 至 15),作为第一次尝试。每个周期后,暂停程序,取出一等分试样并将其放在冰上,然后迅速恢复程序。
注意:循环次数应根据每次反应中环状DNA的数量进行调整。有关示例和进一步说明,请参阅 图 4 。 - 对于每个17μL反应,加入3.5μL6x DNA上样染料。
- 解冻10 bp DNA分子量标准。
- 对于通过凝胶电泳进行尺寸分离,将8%TBE聚丙烯酰胺浸没在1x TBE电泳缓冲液中,并将每个不同循环数的样品加载到相邻孔中,并在180 V下运行凝胶50分钟。
- 将6μLSYBR金(10,000 x 浓缩物)稀释在60mL 1x TBE缓冲液中并染色,同时在避光盒中摇动15-20分钟。
- 染色凝胶时,在标记的1.5 mL管中准备无菌手术刀和0.5 mL破凝胶管。
- 拍摄染色核酸的图像。
- 用无菌手术刀切割预期条带尺寸为174-176 bp的所需条带,并将凝胶切片放入制备的0.5 mL破凝胶管中(在样品之间彻底清洁并使用RNase灭活剂,或切换到新的刀片)。
- 在20,000× g 和4°C下离心管5分钟,然后将剩余的凝胶块从0.5mL破凝胶管转移到1.5mL管中。
- 加入500μL10mM Tris,pH 8.0,并在热混合器中以1,400 RPM振荡10分钟和70°C。
- 将溶解的凝胶转移到具有宽孔移液器尖端的醋酸纤维素柱上。
- 将色谱柱在20,000× g 和4°C下离心3分钟,并将流通转移到新的1.5mL管中并在冰上冷却。
- 为了沉淀核酸,加入:550μLIPA,32μL5M NaCl,1μL 0.5M EDTA和2μL糖蓝和涡旋彻底混合。
- 将样品在-80°C或-20°C下保存至少1小时过夜。
停止点:样品可以在-80°C下储存过夜或更长时间。 - 重复步骤 5.3.11-5.3.12。
- 重悬于11μL的10mM三聚氰胺中,pH 8.0。在450× g,4°C下旋转20秒,并将样品转移到新的1.5 mL管中。
停止点:样品可以在-80°C下储存多年。
-
通过生物分析仪量化尺寸分布
- 通过将1μL样品与4μLDEPC处理过的水混合,使每个样品的稀释度为1:4。
- 运行生物分析仪小型RNA芯片。遵循制造商的协议。
注意:预期长度为 175 ± 5 bp。
-
通过荧光计定量 DNA 浓度
- 根据制造商的建议,使用荧光计进行dsDNA高灵敏度浓度检查。
- 根据 Illumina 建议对样本进行多路复用和序列化(索引适配器池指南12)。
6. 数据分析
- 执行补充文件中详述的分析。
结果
如该方案的流程图所示(图1),细胞生长至对数相,然后通过过滤迅速收集并通过低温研磨裂解。然后将裂解物分为两部分:一个用于总核糖体保护的mRNA足迹,另一个用于选定的受核糖体保护的mRNA足迹,我们在其上进行亲和纯化以拉低标记的蛋白质 - 核糖体 - 新生链复合物。我们确保了标记蛋白表达和蛋白质印迹分析下拉的成功,如图 2所示。根据系统手册,我们验证了通过小RNA电泳(2100 BioAnalyzer系统)分离出受核糖体保护的足迹,其长度通常为20-45 nt,允许尺寸检测5-10 nt变化(图3)。然后,我们生成了一个用于深度测序和大数据分析的cDNA文库。在生成cDNA文库时,请注意,循环不足会导致低产量(如图 3中的泳道2所示),但为了恢复生成的文库,可以重新扩增。当PCR引物耗尽但反应继续时,可能发生过度循环。当dNTPs仍然存在时,反应继续进行,由于PCR产物启动自身13 ,产生具有嵌合序列的更长的PCR伪影(如图 3中的泳道3-4所示,由可见的涂片指示)。如果dNTPs的浓度也变得有限,则会出现表明仅由部分同源文库片段组成的异源双链体存在的产物。 图4 作为参考,通道2表示最佳放大,通道3表示可接受的放大。不应使用来自泳道4和5(周期10和11)的样品,因为可能会引入PCR重复物和伪影。通过高灵敏度DNA电泳(使用相同的生物分析仪系统)进一步验证生成的文库,以实现精确的尺寸分布和定量(图5)。在3'末端连接子连接,逆转录和PCR扩增后,预计cDNA长度分布如此,在175 nt左右具有尖锐的峰值。
我们从序列库中修剪并删除了适配器和条形码,并且仅选择了20至45 nt之间的读数以进行进一步分析。 图 6 显示了生成的长度分布。读取被分为不同的组:编码序列,内含子和基因间序列(图7),并进一步分类如图 8所示。
基于核糖体保护的mRNA片段的富集,进行了共翻译相互作用检测和表征的最终分析,产生了 图9中的图形。我们将总翻译组的归一化核糖体占用率(沿每个 orf的每个核苷酸)与其相应的选定翻译组(新生相互作用组)进行了比较。每个核苷酸比较消除了翻译速率伪影。通过Pearson相关性评估生物重复之间的可重复性(阈值>0.6)。我们提出了选择性核糖体谱,分析了Vma2p与三种蛋白质的共翻译相互作用:核糖体相关的伴侣Ssb1p,Pfk2p(磷酸果糖激酶)和Fas1p(脂肪酸合酶),每种蛋白质C'由GFP最终标记。我们在生物复制中执行了该方案。 图 9 A、D和G示出了各亲和纯化的实验方案。接下来,我们显示了与沿着Vma2p orf的Ssb1相互作用组相比,总翻译组的核糖体占用率,编码液泡H + - ATP酶的亚基(图9 B,E和H)。最后,我们在 orf 的[密码子/aa]的每个核糖体位置进行了基于比率的核糖体富集分析(IP/Total)(图9 C,F和I)。比较这三种蛋白质与核糖体合成的Vma2p的共翻译相互作用,发现Ssb1伴侣在 orf 的四个不同区域参与新生的Vma2p,因为我们通过SeRP确定了四个重要的富集峰。不同地,Pfk2p仅显示一个显着的富集峰,如SeRP鉴定的那样,与共翻译伴侣Ssb1相比处于不同的位置。Fas1与新生Vma2p共翻译相互作用的分析未检测到任何显着的富集。因此,对这些基于比率的富集核糖体谱的比较证明了该方案在检测和表征近密码子分辨率下各种共翻译相互作用方面的能力。
图2:使用HA标记的Naa10对BY4741菌株进行亲和纯化后具有代表性的蛋白质印迹结果。 HA标记的Naa10菌株的亲和力纯化后,具有代表性的蛋白质印迹结果,显示条带约为27.8 kDa,而野生型作为阴性对照,显示无条带。 请点击此处查看此图的大图。

图3:足迹分离和用酸 -苯酚:氯仿提取RNA后的代表性生物分析仪结果,平均尺寸为25 nt。
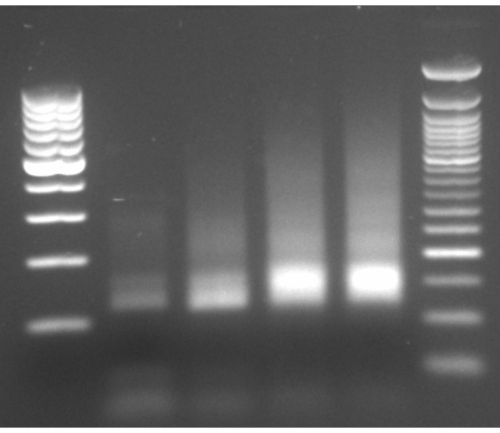
图 4:PCR 扩增的代表性凝胶电泳。 PCR扩增的代表性凝胶电泳,通道2-5加载了周期8-11的PCR产物,两侧都有分子量标准品。 请点击此处查看此图的大图。
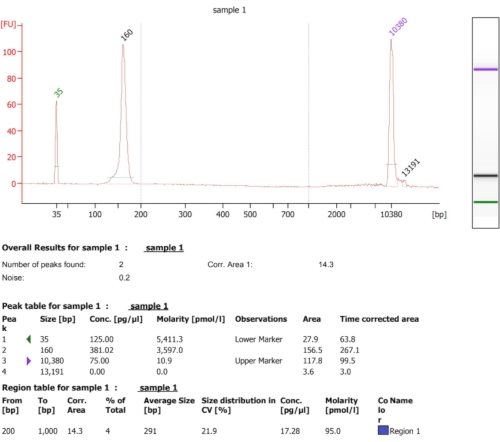
图 5:创建 cDNA 文库后获得的代表性生物分析仪结果。请单击此处查看此图的放大版本。

图 6:使用 Cutadapt 移除适配器后读取的预期长度分布 (删除短于 20 或长于 45 的读取)。 请点击此处查看此图的大图。

图7:使用Bowtie2去除非编码RNA读数并使用TopHat将其余读数与不同生物体对齐后的预期比对成功百分比。 该样品取自 酿酒酵母 (BY4741的突变变体)。 请点击此处查看此图的大图。
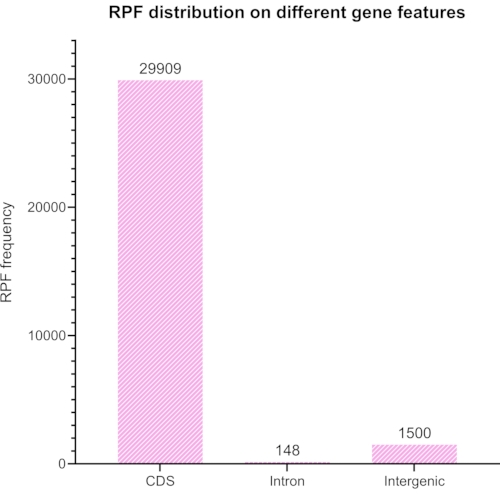
图 8:使用 RiboToolkit 生成的图形,表示使用 Bowtie2 删除读取中的 rRNA 元素后,对齐读取的预期编码与非编码比率。 请点击此处查看此图的大图。
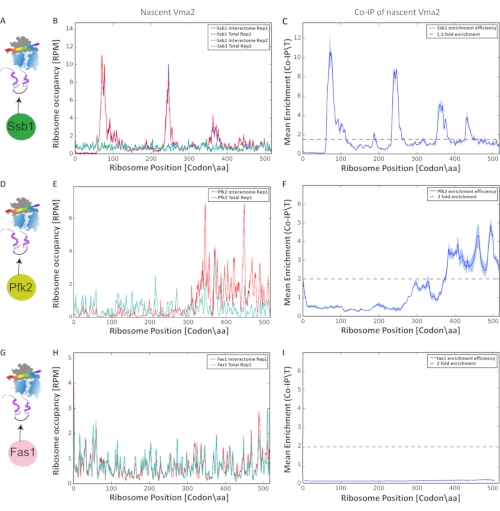
图9:三种不同蛋白质的共翻译相互作用:Ssb1p,Pfk2p和Fas1p与Vma2p,Vma2p由核糖体合成,通过SeRP分析。 所有 y 轴均以每百万次读取 (RPM) 读取数显示。(A, D, G)分别由GFP终端标记的Ssb1p,Pfk2p和Fas1p C'的SeRP实验方案。(乙、英、赫)与Ssb1,Pfk2p和Fas1p相互作用组相比,沿着总翻译组的 orf 的核糖体占用率分别(在生物重复中)。(C, F, I)Ssb1p、Pfk2p和Fas1p(IP/总比值)在[密码子/aa]中每个核糖体位置沿 orf的平均富集。生物重复之间的变化由阴影区域表示。 请点击此处查看此图的大图。
表 9:3' 链接器和引物序列。 3' 连接子 L1:具有 5ʹ 腺苷酸化和 3ʹ 二脱氧-胞苷唯一分子标识符 ('NN...') 的连接子 3-L1(无RNA酶高效液相色谱纯化;逆转录连接子:逆转录(L(rt))与5ʹ磷酸化,唯一分子标识符(无RNase HPLC纯化);PCR正向引物:PCRf;高效液相色谱纯化。 请按此下载此表格。
补充文件。请点击此处下载此文件。
讨论
在这里,方案详细介绍了选择性核糖体分析方法,用于捕获近密码子分辨率中的共翻译相互作用。随着核糖体上升为协调新生链出现在拥挤的细胞质中的中心,这是鉴定和表征确保功能性蛋白质组所需的各种共翻译相互作用以及研究各种疾病的关键方法。迄今为止,SeRP是唯一能够以直接方式在体内捕获和表征这些相互作用的方法14,15,16。
第一步也是最关键的一步是细胞收集和裂解。必须在几秒钟内通过快速冷冻捕获正在进行的转化,然后在冷冻状态下进行裂解。细胞收集必须迅速完成,以避免核糖体径流以及诱导可能迅速发生的应激翻译反应。第二个关键步骤是亲和力纯化步骤。必须通过严格的洗涤来减少背景结合,同时确保维持共翻译相互作用,这可以通过 体内 交联来促进。由于该协议基于高灵敏度的NGS(下一代测序),因此第一步中的高背景可以在以下cDNA文库制备步骤中放大,从而导致低信噪比。
核酸酶处理,消化所有未受保护的mRNA,应通过多体分析17 以及仔细评估分离的核糖体足迹大小分布(如上所述)来评估,以避免过度或低于RNA消化。核酸酶浓度和消化时间的校准可以促进准确的足迹恢复,因为过度消化会导致核糖体rRNA消化,导致核糖体保护足迹的损失。重要的是要注意,消化不足也会导致核糖体保护足迹的发现率降低,因为cDNA文库制备步骤以及此处描述的数据分析步骤会丢弃长时间的非典型读取。
虽然rRNA耗竭并不总是一个关键步骤,也不是强制性的,但它具有一些优点,例如更清洁的样品,因此具有更高的基因组图谱读取率。另一方面,存在偏倚的可能性,因为许多rRNA耗尽方案也可能导致所需的核糖体保护片段的耗尽。还应该考虑rRNA耗竭试剂盒的成本。rRNA耗竭可以在核糖体- 足迹分离步骤或cDNA环化步骤之后进行。
与RNA-seq表达研究相比,此处所述的cDNA文库制备步骤已针对低mRNA输入进行了优化,因为亲和力和核糖体纯化步骤高度降低了mRNA输入量。增加细胞培养物的初始量可以极大地促进cDNA文库的生成。或者,任何选择的cDNA文库方案都可以符合此处描述的亲和纯化和足迹分离步骤。重要的是要注意,产生核糖体足迹的核酸酶处理需要得到的mRNA末端修复(cDNA文库制备,去磷酸化步骤),以允许在您选择的方案中描述的cDNA方案中遵循连接子连接步骤。
在测序过程中,区分SeRP和RNA-Seq非常重要,因为生成的文库的异质性变化很大,这取决于亲和性标记的因子。分子伴侣和靶向因子在结合方面通常更混杂,在翻译过程中与数百或数千个底物相互作用,导致高度多样化的cDNA文库。然而,高度特异性的相互作用子,如共转化复合组装相互作用子,通常会导致产生不那么多样化的cDNA文库。在同一条泳道上对不同和非多样性文库的峰值可以大大改善测序和跟踪数据分析结果。
SeRP的另一个独特特征是它能够捕获沿 orf 的核糖体占用的局部变化,从而允许发现与每组相互作用相关的翻译速率的核糖体变化。因此,必须比较沿 orf 的每个密码子中的核糖体占用率,以正确识别富集。利用 orfs 平均值可能会导致瞬态交互的丢失或错误发现。
正确使用SeRP方法为直接分析开辟了许多共翻译途径,发现了新的机制特征以及新的核糖体相关因子,彻底改变了蛋白质生物合成领域。
披露声明
作者声明没有利益冲突。
致谢
我们要感谢所有实验室成员的富有成效的讨论,并感谢穆罕默德·马赫祖米(Muhammad Makhzumy)对手稿的批判性阅读。这项工作由ISF(以色列科学基金会)2106/20赠款资助。
材料
| Name | Company | Catalog Number | Comments |
| 3'-Phosphorylated 28 nt RNA control oligonucleotide | IDT | custom order | RNase free HPLC purification; 5'-AUGUAGUCGGAGUCGAGGCGC GACGCGA/3Phos/-3' |
| Absolute ethanol | VWR | 20821 | |
| Acid phenol–chloroform | Ambion | AM9722 | |
| Antibody: mouse monclonal anti-HA | Merck | 11583816001 | 12CA5 |
| Aprotinin | Roth | A162.3 | |
| ATP* | NEB | P0756S | 10 mM |
| Bacto agar | BD | 214030 | |
| Bacto peptone | BD | 211820 | |
| Bacto tryptone | BD | 211699 | |
| Bacto yeast extract | BD | 212720 | |
| Bestatin hydrochloride | Roth | 2937.2 | |
| Chloroform | Merck | 102445 | |
| CircLigase II ssDNA Ligase* | Epicentre | CL9025K | 100 U/μL |
| Colloidal Coomassie staining solution | Roth | 4829 | |
| cOmplete, EDTA-free protease inhibitor cocktail tablets | Roche Diagnostics | 29384100 | |
| Cycloheximide | Biological Industries | A0879 | |
| DEPC treated and sterile filtered water* | Sigma | 95284 | |
| D-Glucose anhydrous | Merck | G5767-500G | |
| Diethylpyrocarbonate | Roth | K028 | |
| Dimethylsulfoxide* | Sigma-Aldrich | 276855 | |
| DNA ladder, 10 bp O'RangeRuler* | Thermo Fisher Scientific | SM1313 | |
| DNA loading dye* | Thermo Fisher Scientific | R0631 | 6× |
| DNase I, recombinant | Roche | 4716728001 | RNAse free |
| dNTP solution set* | NEB | N0446S | |
| EDTA* | Roth | 8043 | |
| Glycerol | VWR | 24388.260. | |
| Glycine solution | Sigma-Aldrich | 67419-1ML-F | 1 M |
| GlycoBlue | Ambion | AM9516 | 15 mg/mL |
| HEPES | Roth | HN78.3 | |
| HF Phusion polymerase* | NEB | M0530L | |
| HK from S. cerevisiae | Sigma-Aldrich | H6380-1.5KU | |
| Hydrochloric acid | AppliChem | A1305 | |
| Isopropanol | Sigma-Aldrich | 33539 | |
| Isopropyl β-D-1-thiogalactopyranoside | Roth | CN08 | |
| Kanamycin | Roth | T832.4 | |
| KCl | Roth | 6781.1 | |
| KH2PO4 | Roth | 3904.1 | |
| Leupeptin | Roth | CN33.4 | |
| Linker L(rt) | IDT | custom order | |
| Liquid nitrogen | |||
| MgCl2 | Roth | KK36.3 | |
| Na2HPO4 | Roth | P030.2 | |
| Na2HPO4·2H2O | Roth | T879.3 | |
| NaCl* | Invitrogen | AM97606 | 5 M |
| NaH2PO4·H2O | Roth | K300.2 | |
| NHS-activated Sepharose 4 fast-flow beads | GE Life Sciences | 17090601 | |
| Nonidet P 40 substitute | Sigma | 74385 | |
| Pepstatin A | Roth | 2936.2 | |
| Phenylmethyl sulfonyl fluoride | Roth | 6367 | |
| Precast gels | Bio-Rad | 5671034 | 10% and 12% |
| RNase I | Ambion | AM2294 | |
| SDS, 20% | Ambion | AM9820 | RNase free |
| Sodium acetate* | Ambion | AM9740 | 3 M, pH 5.5 |
| Sodium azide | Merck | S8032-100G | |
| Sodium chloride | Roth | 9265 | |
| Sodium hydroxide* | Sigma | S2770 | 1 N |
| Sucrose | Sigma-Aldrich | 16104 | |
| SUPERase-In RNase Inhibitor | Ambion | AM2694 | |
| Superscript III Reverse Transciptase* | Invitrogen | 18080-044 | |
| SYBR Gold* | Invitrogen | S11494 | |
| T4 polynucleotide kinase* | NEB | M0201L | |
| T4 RNA ligase 2* | NEB | M0242L | |
| TBE polyacrylamide gel* | Novex | EC6215BOX | 8% |
| TBE–urea polyacrylamide gel* | Novex | EC68752BOX | 10% |
| TBE–urea polyacrylamide gel* | Novex | EC6885BOX | 15% |
| TBE–urea sample buffer* | Novex | LC6876 | 2× |
| Tris | Roth | 4855 | |
| Tris* | Ambion | AM9851 | 1 M, pH 7.0 |
| Tris* | Ambion | AM9856 | 1 M, pH 8.0 |
| UltraPure 10× TBE buffer* | Invitrogen | 15581-044 | |
| * - for library preparation | |||
| gasket and spring clamp , 90 mm, | Millipore | XX1009020 | |
| ground joint flask 1 L , | Millipore | XX1504705 |
参考文献
- Oh, E., et al. Selective ribosome profiling reveals the cotranslational chaperone action of trigger factor in vivo. Cell. 147 (6), 1295-1308 (2011).
- Shiber, A., et al. Cotranslational assembly of protein complexes in eukaryotes revealed by ribosome profiling. Nature. 561 (7722), 268-272 (2018).
- Becker, A. H., Oh, E., Weissman, J. S., Kramer, G., Bukau, B. Selective ribosome profiling as a tool for studying the interaction of chaperones and targeting factors with nascent polypeptide chains and ribosomes. Nature Protocols. 8 (11), 2212-2239 (2013).
- Galmozzi, C. V., Merker, D., Friedrich, U. A., Döring, K., Kramer, G. Selective ribosome profiling to study interactions of translating ribosomes in yeast. Nature Protocols. , (2019).
- Knorr, A. G., et al. Ribosome-NatA architecture reveals that rRNA expansion segments coordinate N-terminal acetylation. Nature Structural and Molecular Biology. 26 (1), 35-39 (2019).
- Matsuo, Y., Inada, T. The ribosome collision sensor Hel2 functions as preventive quality control in the secretory pathway. Cell Reports. 34 (12), (2021).
- Döring, K., et al. Profiling Ssb-Nascent chain interactions reveals principles of Hsp70-assisted folding. Cell. , (2017).
- Chartron, J. W., Hunt, K. C. L., Frydman, J. Cotranslational signal-independent SRP preloading during membrane targeting. Nature. 536 (7615), 224-228 (2016).
- Janke, C., et al. A versatile toolbox for PCR-based tagging of yeast genes: New fluorescent proteins, more markers and promoter substitution cassettes. Yeast. 21 (11), 947-962 (2004).
- Levi, O., Arava, Y. Expanding the CRISPR/Cas9 Toolbox for Gene Engineering in S. cerevisiae. Current Microbiology. 77 (3), 468-478 (2020).
- Giannoukos, G., et al. Efficient and robust RNA-seq process for cultured bacteria and complex community transcriptomes. Genome Biology. 13 (3), 23 (2012).
- . Illumina Index Adapters - Pooling Guide Available from: https://support.illumina.com/content/dam/illumina-support/documents/documentation/chemistry_documentation/experiment-design/index-adapters-pooling-guide-1000000041074-05.pdf (2019)
- Kanagawa, T. Bias and artifacts in multitemplate polymerase chain reactions (PCR). Journal of Bioscience and Bioengineering. 96 (4), 317-323 (2003).
- Bertolini, M., et al. Interactions between nascent proteins translated by adjacent ribosomes drive homomer assembly. Science. 371 (6524), (2021).
- Kramer, G., Shiber, A., Bukau, B. Mechanisms of cotranslational maturation of newly synthesized proteins. Annual Review of Biochemistry. 88, 337-364 (2019).
- Joazeiro, C. A. P. Mechanisms and functions of ribosome-associated protein quality control. Nature Reviews Molecular Cell Biology. 20 (6), 368-383 (2019).
- Beaupere, C., Chen, R. B., Pelosi, W., Labunskyy, V. M. Genome-wide quantification of translation in budding yeast by ribosome profiling. Journal of Visualized Experiments: JoVE. (130), e56820 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。