Method Article
Penium margaritaceum için Deneysel Tarama Protokolleri, İmmünositokimya ve Mikroskopi Tabanlı Görüntüleme Teknikleri
Bu Makalede
Özet
Bu rapor, tek hücreli streptofit algi Penium margaritaceum'u kültürlemek ve deneysel olarak manipüle etmek için kullanılan temel yöntemleri açıklamaktadır. Ayrıca, monoklonal antikorlar ve diğer floresan problar ve taramalı elektron mikroskobu ile canlı hücre etiketleme dahil olmak üzere mikroskopi tabanlı görüntülemenin temel protokollerini sağlar.
Özet
Hücre duvarı, gelişim sırasında ve çevresel abiyotik ve biyotik stres faktörlerine yanıt verirken bir bitki hücresi için sinyal alımı/iletiminin ilk bileşenidir. Hücre, hücre duvarının bütünlüğünü sürekli olarak izler ve strese yanıt olarak onu modüle eder. Hücre duvarında meydana gelen spesifik yapısal ve biyokimyasal modülasyonları aydınlatmak, özellikle çok hücreli bitkiler ve organları/dokuları kullanıldığında zor bir iştir. Bu, karmaşık bir çok hücreli ağın parçası olan tek bir hücrede neyin çözülebileceğine ilişkin sınırlamalardan kaynaklanmaktadır. Tek hücreli streptofit alg, Penium margaritaceum, son zamanlarda pektin dinamiği, hücre duvarı bazlı fenotipik plastisite ve alg hücre biyolojisinin birçok yönünün araştırılmasında kullanılmıştır. Basit fenotipi, özellikle kara bitki hücre duvarlarına benzer birçok bileşene sahip farklı hücre duvarı ve immünositokimyasal ve deneysel çalışmalardaki kolaylığı, onu bitki hücre duvarı biyolojisinde güçlü bir model organizma haline getirmektedir. Bu çalışmanın amacı, uygulanan stresörlerin kültürlenmesi, deneysel manipülasyonu ve taranması için temel teknikleri sağlamaktır. İmmünositokimya için tarama protokolleri, konfokal lazer tarama mikroskobu görüntüleme ve hücre duvarı yapısının taramalı elektron mikroskobu görüntülemesi. Benzer şekilde, tarif edilen tekniklerin çoğu, çok çeşitli diğer hücre ve moleküler çalışmalar için değiştirilebilir.
Giriş
Bir bitkinin hücre duvarı, bir bitki hücresinin1 yaşamında birden fazla rolü olan karmaşık bir polimerik ağdır. Hücre duvarının bütünlüğü, gelişim sırasında ve çevresel strese yanıt olarak hücre tarafından sürekli olarak izlenir ve buna göre kimya ve yapıda modüle olur. Penium margaritaceum , son zamanlarda Streptofit algleri (Streptophyta, kara bitkileri2 ile en yakından ilişkili ve atası olan yeşil alg grubu) çalışmalarında kullanılan tek hücreli yeşil bir algdir.
Son yirmi yılda, P. margaritaceum hücre duvarı ve hücre dışı matris dinamikleri, endomembran sistem aktiviteleri, hücre şekli tezahürü ve bitki evrimiaraştırmalarında önemli bir organizma olmuştur 3,4,5,6,7,8,9,10,11 . Bu çalışmanın amacı, bitki hücre duvarı araştırmacılarına P. margaritaceum'u kültürlemek, mikroplaka tabanlı teknikler kullanarak deneysel olarak manipüle etmek ve canlı hücre immünositokimyasal etiketleme ve ışık ve elektron mikroskobu teknikleriyle görüntüleme kullanarak hücre duvarının yapısını izlemek için temel yöntemler sağlamaktır. P. margaritaceum, hücre duvarı biyokimyasında kara bitkilerinin birincil hücre duvarlarıyla birçok benzerliğe sahiptir. Bu algin benzersiz tek hücreli fenotipinden yararlanan ve çok hücreli bitkilerde izlenmesi genellikle zor olan hücre duvarı dinamiklerini incelemek için hızlı bir yol sağlayan çoklu protokoller geliştirdik. Bu teknikler, özellikle pektin ile uğraşanlar olmak üzere, ayrıntılı hücre duvarı dinamiklerini aydınlatmak isteyen bitki hücre duvarı biyologlarına yardımcı olacak ve bitki ve streptofit alg hücre biyolojisi ile ilgili çalışmalar için bir başlangıç noktası olarak hizmet edecektir.
Protokol
NOT: Penium margaritaceum , Sammlung von Algenkulturen der Universität Göttingen - Göttingen Üniversitesi, SAG'daki Alg Kültür Koleksiyonu'nda elde edilir; Zorlanma #2640.
1. Kültürleri korumak
- Algleri, toprak suyu özütü ile de desteklenebilen sıvı Woods Hole ortamında (WH12) tutun (yani, ortamın L başına 40 mL). 16 h:8 h ışıkla kültürleri 20-25 °C'de koruyun: 3,5 klux (74 μmol foton/m2/s) soğuk beyaz floresan ışıkla karanlık döngü.
- Alt kültürleri haftalık olarak hazırlayın ve 10-14 günlük olduklarında hücre kültürlerini kullanın. Penium kültürleri 6 ay boyunca yaşayabilir ve bu süre zarfında alt kültürleri başlatmak için kullanılabilir. Alg ayrıca %1-2 agar katılaşmış WHM'de de büyüyecektir.
- Rutin hücre döngüsü senkronizasyonu için, 10-14 günlük kültürlerden alınan hücreleri 20-25 ° C'de 2-6 hafta boyunca karanlıkta yerleştirin. Bu süreden sonra, hücreleri taze WHM (aşağıya bakınız) ve yukarıda tarif edildiği gibi kültürle yıkayın.
2. Hücre duvarının monoklonal antikorlarla etiketlenmesi
NOT: P. margaritaceum , kara bitkisi birincil hücre duvarlarında bulunan aynı bileşenlerin çoğuna sahip bir birincil hücre duvarı ile kaplıdır11. Kara bitki hücre duvarı epitoplarına karşı yükselen monoklonal antikorların (mAb'ler) çoğu, P. margaritaceum hücre duvarının bileşenlerini tanır. Bu antikorların kaynakları arasında Georgia Üniversitesi (ccrc@uga.edu) veya Kerafast (kerafast.com) Kompleks Karbonhidrat Araştırma Merkezi bulunur. Hücre duvarı epitopları ve florofor konjuge ikincil antikorlar (örneğin, FITC, TRITC) için spesifik birincil mAbs ile canlı hücrelerin hücre duvarı etiketlemesini takiben, hücreler, hücrenin sağlığını veya hücre duvarı birikimini etkilemeden kültüre geri yerleştirilebilir. Hücre duvarının floresan etiketlemesi süresiz olarak kalır ve yeni salgılanan hücre duvarı, hücre genişleme oranlarını belirlemek için ölçülebilen ve / veya mAbs veya diğer problarla tekrar etiketlenebilen koyu (yani etiketlenmemiş) bölgeler olarak sunulur.
- 5 mL aktif olarak büyüyen sıvı hücre kültürünü (10-14 günlük) çıkarın ve 15 mL'lik bir plastik santrifüj tüpüne yerleştirin. 1,000 x g'da 1 dakika boyunca bir masa üstü santrifüjde santrifüjleyin.
- Süpernatanı dökün ve atın. Peleti 5 mL taze WHM içinde tekrar süspanse edin. Kapağı sıkıca ve kuvvetlice yerleştirin, peleti yeniden süspanse etmek ve hücre duvarı yüzeyinden herhangi bir hücre dışı polimerik maddeyi veya EPS'yi çıkarmak için tüpü 10 saniye boyunca sallayın.
- 1.000 x g'da 1 dakika santrifüjleyin. Adım 2.2'yi tekrarlayın ve santrifüjleyin. Peleti 1 mL taze WHM içinde yeniden süspanse edin ve hücre süspansiyonunun 200 μL'lik alikotunu 1.5 mL mikrosantrifüj tüplerine aktarın.
- Tüpleri kapatın ve 1.000 x g'da bir mikrosantrifüjde santrifüjleyin. Süpernatanı çıkarın ve peleti 400 μL taze WHM'de yeniden süspanse edin.
- Süspansiyona 20 μL mAb ekleyin (örneğin, JIM5, düşük metil esterlenmiş homogalakturonana özgüllüğü olan bir sıçan mAb; son seyreltme WHM ile 1/20'dir). Tüpü girdaplayın, alüminyum folyoya sarın ve 90 dakika boyunca bir laboratuvar döndürücüsüne yerleştirin. En iyi sonuçlar için, 90 dakikalık inkübasyon adımı sırasında tüpü 2 kez vorteksleyin.
- Hücre süspansiyonunu 1,000 x g'da 1 dakika santrifüjleyin. Süpernatanı çıkarın ve peleti 500 μL taze WHM içinde yeniden süspanse edin. Tüpü kapatın ve hücre süspansiyonunu 10 saniye boyunca girdaplayın.
- Adım 2.6 2x'i tekrarlayın. Santrifüjlemeden sonra, peleti 400 μL WHM ve 8 μL keçi sıçan önleyici TRITC veya FITC'de (WHM ile 1/75 oranında seyreltilmiş) yeniden süspanse edin. Vorteks, tüpü alüminyum folyoya sarın ve 90 dakika boyunca bir laboratuvar döndürücüsüne yerleştirin.
- 2.6 ve 2.7 adımlarını tekrarlayın. Peleti 100 μL büyüme ortamında yeniden süspanse edin, tüpü kapatın ve görüntüye hazır olana kadar alüminyum folyoya sarın.
NOT: mAbs'de inkübasyondan önce Yağsız Karanfil Hazır süt (% 1) veya sığır serum albümini (% 1) gibi bir bloke edici ajan içeren WHM'deki hücrelerin inkübe edilmesi de kullanılabilir, ancak deneyimlerimize göre kaliteyi veya yoğunluğu etiketlemek için hiçbir şey yapmaz. Penium , hücre duvarını genişletmez veya karanlıkta büyük miktarlarda EPS üretmez. Etiketli antikor en az 3-4 gün boyunca bozulmadan kalır. Bu nedenle, görüntülemenin hemen yapılması gerekmez. Burada başka mAb'ler de uygulanabilir, ancak konsantrasyonların test edilmesi gerekecektir. Kimyasal ve fiziksel tarama çalışmaları için, birkaç gün karanlıkta tutulan ve mikroplaka çalışmalarında kullanılan birkaç mL hücre süspansiyonu etiketlenebilir. Hücreler ayrıca tedaviden önce sadece birincil antikor ile etiketlenebilir, ardından ikincil antikor daha sonra takip edilebilir.
3. Zaman içinde hücre duvarı ve hücre genişleme oranlarının ölçülmesi
- JIM5-TRITC ile etiketlenmiş 1 mL hücre alın ve 1.5 mL mikrosantrifüj tüpüne 1 mL WHM yerleştirin. 1.000 x g'da 1 dakika santrifüjleyin ve süpernatanı atın. Peletleri 250 μL WHM içinde yeniden süspanse edin ve hücreleri karıştırmak için girdap yapın.
- 12 kuyulu bir Petri kabının her bir oyuğuna 1 mL WHM ekleyin. Bu zamanda, her bir oyuğa spesifik inhibitörler ve büyüme düzenleyicileri eklenebilir. Bu yazıda, inkübasyon sırasında artan kalsiyum seviyelerinin etkilerini gösteriyoruz.
- 30 μL etiketli hücre süspansiyonu alın (adım 1) ve mikroplakanın her bir oyuğuna ekleyin. Karıştırmak için plakayı hafifçe döndürün. Şeffaf film ile kapatın.
- Yukarıdaki gibi kültür (adım 1.1) 24 saat, 48 saat veya 72 saat için. Belirtilen zamanlarda, her bir oyuktan 250 mL hücre süspansiyonunu çıkarın ve 1.5 μL'lik bir mikrosantrifüj tüpüne yerleştirin.
- 1.000 x g'da 1 dakika santrifüjleyin. Süpernatanı çıkarın. Peletleri 50 μL büyüme ortamında ve girdapta yeniden süspanse edin.
- 15 μL'lik bir hücre süspansiyonunu bir cam slayt üzerine yerleştirin ve 22 x 22 lamel (kalınlık 1.5) ile örtün. 10x -20x'te bir TRITC filtresi kullanarak hücreleri bir floresan mikroskobu ile gözlemleyin.
- En az 50-100 hücrenin görüntülerini yakalayın. Her hücre için, toplam hücre uzunluğunu ve karanlık bölgenin uzunluğunu ölçün ve kaydedin (yani, etiketlemeden sonra inkübasyon sırasında üretilen yeni duvar).
- Kültürdeki yeni hücre duvarlarının ortalama yüzdesini belirleyin. Zaman içinde hücre duvarı genişlemesi hakkında bilgi edinmek için 48 saat ve 72 saat sonra toplanan hücreler için tekrarlayın.
NOT: Adım 3.5-3.8, tek bir görüş alanında birçok hücrenin görüntülenmesine izin veren yoğun bir hücre süspansiyonu verir. Bu, manuel ölçümü çok daha kolay hale getirir. Birçok kamera yazılım programı, bu alg ile kullanılabilecek hücre boyutlarının uygun ve/veya otomatik olarak ölçülmesini sağlar. Ayrıca hücreler toplanabilir ve bunları JIM5 ile yukarıdaki gibi etiketleyebilir, ancak ikincil antikor olarak anti-sıçan FITC'yi ikame edebilirsiniz. Konfokal lazer tarama mikroskobu (CLSM) kullanılarak, hücreler hem FITC hem de TRITC filtreleriyle görüntülenebilir. Floresan sinyaller daha sonra farklı sahte renklere atanabilir. Bu aynı zamanda, çeşitli tedaviler sırasında üretilen yeni hücre duvarının yapısını (JIM5-FITC ile etiketlenmiş) ön etiketleme hücre duvarlarına (JIM5-TRITC ile etiketlenmiş) kıyasla ayırt etmenin bir ortalamasına izin verir.
4. Hücre duvarı genişlemesinin timelapse görüntülemesi
- Hücre duvarını yukarıda açıklandığı gibi JIM5-TRITC ile etiketleyin (adım 2.1-2.8). Hücreleri WHM'de 10 kez seyreltin ve bir lamel veya cam tabanlı Petri kabına 50 μL'lik bir damla hücre ekleyin.
- Hücrelerin karanlıkta 2 dakika boyunca cama yapışmasına izin verin. Cama yapışmamış hücreleri 1 mL WHM ile nazikçe durulayın. Bir mikropipet kullanın ve WHM'yi cama damla damla dikkatlice ekleyin.
- Cama bağlı hücrelerin üzerine 30 μL WHM ekleyin. WHM/hücre damlacığının üzerine 30 μL ılık %4 agaroz/WHM ekleyin. Agarozun oda sıcaklığına soğumasına ve katılaşmasına izin verin.
- Bir Petri kabındaki numuneler için, agaroza gömülü hücreleri tamamen kaplayacak kadar WHM ekleyin. Bir lamel üzerindeki hücreler için, lamel ters çevirin ve yavaşça WHM ile doldurulmuş bir çöküntü slaytının üzerine yerleştirin.
- Hücreleri bir floresan mikroskobu üzerine monte edin. Harici aydınlatma (lamba) ayarlanabilir veya mikroskobun kendisinden gelen ışık, hücre büyümesi ve hareketi için enerji sağlamak üzere kullanılabilir. Olympus Ix83 veya Ix63 mikroskobunda, trans lambası için 5-6 V'luk bir güç iyi çalışır. Bu, sisteminiz için deneme yanılma gerektirebilir.
- Hücre duvarı genişlemesinin izlenmesi için TRITC filtre setini kullanarak her 10-30 dakikada bir görüntü oluşturun. Varsa, adım 3.8'de kullanılan WHM'ye kimyasallar/enzimler ekleyin.
5. Hücre dışı polimerik madde (EPS) üretiminin gözlemlenmesi
- Hücrelerin hazırlanması: 10-14 günlük kültürlerden 5 mL hücre elde edin ve yukarıdaki 1-4. adımlarda olduğu gibi yıkayın.
- Floresan boncukların hazırlanması: 1.5 mL'lik bir mikrosantrifüj tüpüne 1 damla (yaklaşık 100 μL) 0.75 μm floresan boncuk (Polisfer) ekleyin. Tüpe 1 mL WHM ekleyin ve boncukları yeniden süspanse etmek için kuvvetlice çalkalayın. 3 dakika boyunca 10.000 x g'da santrifüjleyin. Süpernatanı çıkarın. Peletin içine 1 mL WHM ekleyin ve çalkalayın. 3 dakika boyunca 10.000 x g'da santrifüjleyin. Peleti 500 μL WHM'de yeniden süspanse edin.
- Kuyuların hazırlanması: 12 oyuklu bir plakanın kuyucuklarına 1 mL WHM ortamı ekleyin. İstenilen konsantrasyona inhibitörler veya büyüme düzenleyiciler ekleyin ve hafifçe döndürün. 10 μL boncuk çözeltisi ekleyin ve boncukları karıştırmak için plakayı hafifçe döndürün. Her bir oyuğa 10 μL yıkanmış hücre ekleyin ve plakayı hafifçe döndürün.
- Hücre plakasını yukarıdaki gibi kültürleyin (1.1). 24 saat sonra, plakayı (karıştırmamaya dikkat edin) bir FITC filtresi ile donatılmış ters çevrilmiş bir floresan mikroskobu üzerine yavaşça yerleştirin. Boncuklar EPS'ye yapışır ve EPS salınım modellerini ortaya çıkarır. Hücreleri 4x, 10x veya 20x çözünürlükte fotoğraflayın.
6. EPS iz oluşumunun timelapse görüntülemesi
- Yukarıda hazırlandığı gibi 12 oyuklu bir plakada (adım 3.2) veya ayrı bir Petri kabında hızlandırılmış görüntüleme gerçekleştirin. 1-4 arasındaki adımları izleyin. Hücreleri floresan aydınlatma altında kültürlemek yerine, hücreler ters çevrilmiş bir floresan mikroskoba monte edilirken büyütülebilir.
- Hücre hareketini en iyi şekilde yakalamak için hücreleri her 5-10 dakikada bir görüntüleyin. Floresan boncuklar bir FITC filtre seti kullanılarak görülebilir, ancak konsantre boncuklar için parlak alan kanalını kullanın. Harici aydınlatma (lamba) ayarlanabilir veya mikroskobun kendisinden gelen ışık, hücre büyümesi ve hareketi için enerji sağlamak üzere kullanılabilir. Olympus Ix83 mikroskobunda, trans lambası için 5-6 V'luk bir güç iyi çalışır. Bu, sisteminiz için deneme yanılma gerektirebilir.
7. Taramalı elektron mikroskobu (SEM) ile hücre duvarının korelasyon yapısal analizi
NOT: Hücreye özgü antikorlarla etiketlenmiş canlı hücrelerde gözlenen hücre duvarının değişmiş özellikleri, SEM kullanılarak ayrıntılı özellikler için görüntülenebilir. Bu bağıntılı yaklaşım, floresan verileriyle karşılaştırılabilen ultrastrüktürel verilerin elde edilmesini sağlar.
- 1.5 mL'lik bir mikrosantrifüj tüpünde 1 mL hücre süspansiyonu (kontrol veya deneysel olarak tedavi edilmiş) elde edin. 1 dakika boyunca 4.000 x g'da santrifüjleyin.
- Süpernatanı atın. Pelet içeren tüpü sıvı nitrojene daldırın veya mevcut değilse, -80 °C'lik bir dondurucuya koyun. Donmuş hücreler -80 °C'de birkaç ay saklanabilir.
- Hücre duvarı işleme sırasında, tüpü dondurucudan çıkarın ve 15 dakika çözülmesine izin verin. Peleti 20 μL WHM'de yeniden süspanse edin ve 45 mm x 50 mm'lik bir lamel üzerine bir damla yoğun hücre süspansiyonu yerleştirin.
- Bir sandviç oluşturmak için damlanın üzerine ikinci bir lamel yerleştirin. Bir laboratuvar masasına yerleştirin ve hücreleri parçalamak için sandviçin üzerine sürekli olarak bastırın (örn. 30 sn).
- Cam lamelleri dikkatlice ayırın ve yırtılmış hücreleri 15 mL'lik bir santrifüj tüpüne yıkayın. 1 dakika boyunca 500 x g'da santrifüjleyin.
- Süpernatanı dökün. Pelet beyaz veya hafif yeşil olmalıdır. Sonraki görüntüleme yeterli sayıda hücrenin yırtılmadığını gösteriyorsa, buradaki pelet ile 3. adımı tekrarlayın.
- DH2O'da hücre duvarları içeren peleti yeniden süspanse edin ve 7.4 ve 7.5 adımlarını tekrarlayın. Peleti 100 μL DH2O'dayeniden süspanse edin ve 1.5 mL'lik bir santrifüj tüpüne yerleştirin.
- Bir Cambridge saplaması (6 mm veya 8 mm yarıçap) alın ve yüzeyine karbon bant (EMS) yapıştırın. Daha sonra, 5 μL'lik yeniden askıya alınmış hücre duvarı süspansiyonunu (adım 7) karbon bandın üzerine yerleştirin. Bir diseksiyon mikroskobu kullanarak hücre duvarlarının sayısını gözlemleyin. Süspansiyon çok yoğunsa, D-H2O ile seyreltin.
- Saplamayı kapalı bir kaba koyun ve kurumasını bekleyin (2 saat ila gece boyunca). Bir paladyum hedefi kullanarak saplamayı 50 saniye boyunca püskürtün (başka hedefler de kullanılabilir). Hücreleri ikincil elektron dedektöründen 10 cm uzakta, nokta boyutu olan 5 kV'da gözlemleyin.
NOT: Damlaları karbon bant üzerine bırakmadan önce hücre duvarı süspansiyonunun seyreltilmesi, hücre duvarlarının birbiri üzerinde birikmesini sınırlayacaktır.
Sonuçlar
Hücre duvarının P. margaritaceum anti-pektin mAbs (örneğin, JIM5) ile etiketlenmesi, düzenli bir desen veya kafes oluşturan kalsiyum kompleksli lifler ve çıkıntılardan oluşan bir ağı ortaya çıkarır (Şekil 1). Pektin, hücre merkezinde veya isthmus'ta biriktirilir ve burada eski pektini kutuplara doğru yer değiştirir (Şekil 2). Farklı bir pektin antikoru benzeri JIM7 ile etiketleme, isthmus'ta dar bir bantta yüksek metil-esterlenmiş pektinin ilk salgılanmasını vurgular (Şekil 3A, B). mAb, JIM13 ile etiketlenmiş arabinogalaktan proteini de dahil olmak üzere hücre duvarında bulunan diğer polimerler (Şekil 4). Büyük miktarlarda EPS, hücre duvarına dışarıdan salgılanır (Şekil 5), bu da kaymaya ve hücre agregatlarının oluşumuna izin verir. Bu etiketleme tekniklerinin birçoğu, hücre duvarının kantitatif incelemesi ve hücre genişlemesi dahil olmak üzere gelişimsel çalışmalara entegre edilebilir (Şekil 6). Benzer şekilde, SEM görüntüleme kullanılarak pektinin korelasyonel yapısal çalışmaları, canlı hücre etiketleme floresan bazlı mikroskopi ile karşılaştırılabilecek ayrıntılı ultrastrüktürel bilgiler (Şekil 7) sağlar.
Sağlanan yöntemler, çeşitli analiz türleri için P. margaritaceum gibi tek hücreli bir algin kullanılması için temel bir kılavuz sağlar. Hücre duvarının canlı hücre immünoişaretlemesini gerçekleştirme ve sonraki gelişimsel olayları takip etme yeteneği, çok hücreli sistemlerde genellikle izin verilmeyen özel bir avantajdır. P. margaritaceum ayrıca pektinin dış hücre duvarı yüzeyinde olduğu bir hücre duvarı sunar (yani mikroskopi için doğrudan erişilebilir). Mikrokuyu plakalarının kuyularındaki hücrelerin görüntülenmesi ve denenmesi, hızlı bir şekilde veri toplamak için uygun bir yol sağlar. Son olarak, CLSM verilerini SEM verileriyle ilişkilendirme araçları, canlı hücre olaylarını ultrastrüktürel bilgilerle karşılaştırmak için değerli bir kanal sağlar.

Şekil 1: Pektin kafesinin monoklonal antikor ile etiketlenmesi. JIM5 antikor özgüllüğü düşük esterlenmiş homogalakturonandır. Hücre duvarı yüzeyindeki belirgin çıkıntılara (beyaz oklar) dikkat edin. Genişleme bölgesi (siyah ok), yeni hücre duvarı malzemelerinin eklendiği yerdir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Gelişim sırasında hücrelerin JIM5 etiketlemesi. Hücre başlangıçta JIM5-TRITC (turuncu ve *) ile etiketlendi ve tekrar kültüre yerleştirildi. 24 saat sonra hücreler toplandı ve JIM5-FITC (yeşil ve ok) ile etiketlendi. Bu bölge yeni büyümeyi temsil ediyor. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Yüksek esterlenmiş pektinin JIM7 etiketlemesi. (A) Genleşme bölgesinde yüksek esterlenmiş pektinin monoklonal antikor, JIM7 (özgüllük: yüksek esterlenmiş homogalakturonan) ile etiketlenmesi. Hücre duvarı yüzeyindeki dar katmana (beyaz ok) dikkat edin. (B) Hücre genişlemesi sırasında hücre duvarının yüksek ve düşük esterlenmiş pektininin birlikte etiketlenmesi. Hücre başlangıçta JIM5-TRITC (turuncu ve *) ile etiketlendi ve tekrar kültüre yerleştirildi. 24 saat sonra hücreler toplandı ve JIM7-FITC (yeşil ve ok) ile etiketlendi. Etiketli bölgeler arasındaki koyu bölgeler yeni eklenen pektini (siyah oklar) temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Hücre duvarının Arabinoglaktan proteinleri. Hücre duvarı yüzeyi arabinogalaktan proteinlerinin (AGP'ler) monoklonal antikor, JIM13 ile etiketlenmesi. AGP'lerin hücre duvarı (oklar) ile gevşek ilişkisine dikkat edin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
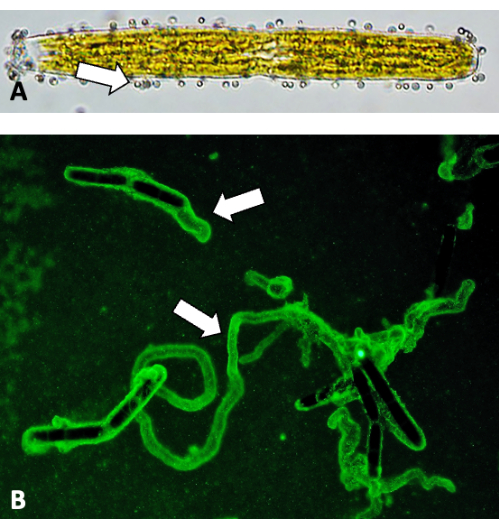
Şekil 5: Floresan boncuklarla kayma izlerinin görüntülenmesi. (A) Hücre duvarı yüzeyine tutturulmuş 0.75 μm floresan boncuklar (oklar). (B) EPS izlerinin floresan boncuk bağlanması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
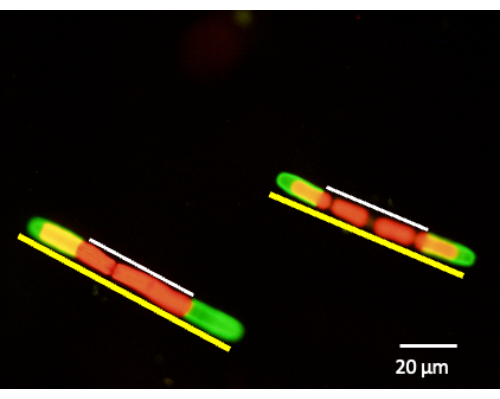
Şekil 6: Hücre duvarı genişlemesinin ölçümü, JIM5-TRITC etiketlemesinden sonra gerçekleştirilebilir. Hücreler kültüre geri yerleştirilir ve 24 saat, 48 saat ve 72 saat büyümesine izin verilir. Hücrelerin alikotları belirli bir zaman periyodunda çıkarılabilir ve floresan konfokal lazer tarama mikroskobu ile görüntülenebilir. Yeni büyüme yüzdesi, etiketlenmemiş hücre duvarının (beyaz çizgi) tüm hücre uzunluğuna (sarı çizgi) karşı ölçülmesiyle belirlenir. Kırmızı floresan, klorofil otofloresansıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7: Bağıl çalışmalar. (A) Tipik kafes, genellikle farklı çıkıntılarda (ok) dıştan sonlanan bir lif ağından yapılır. (B) Büyük miktarlarda kalsiyum ile muamele edildiğinde, kafes düzensiz tortulara (oklar) dönüşür. JIM5 etiketli hücre. (C) Hücre duvarları (B)'deki gibi tedavi edildiğinde ve SEM ile incelendiğinde, düzensiz pektin (ok) ayrıntılı olarak gözlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
P. margaritaceum, bitkilerde ve streptofit alglerinde hücre duvarı gelişimi ve ECM salgılanmasının dinamiklerini aydınlatmak için etkili bir organizmadır. Ana özellikler arasında tek hücreli bir alışkanlık ve kültür bakımı ve deneysel manipülasyonda kolaylık, farklı bir dış pektin kafesi ve diğer polimerlere sahip bir birincil hücre duvarı, sonraki gelişimsel ve/veya deneysel çalışmalar için zamanında takip edilebilecek hücre duvarına yönelik mAb'ler ile canlı hücre etiketlemesinde kolaylık ve floresan boncuklar kullanılarak gerçek zamanlı olarak izlenebilen büyük miktarlarda EPS üretimiyer alır 1, 2,3,6. Ek olarak, etiketleme tekniklerinin çoğu, kantitatif ölçümler için basit araçlar sağlar.
P. maragaritaceum , burada açıklanan protokollerde bazı mütevazı değişiklikleri barındırabilen sağlam bir organizmadır. Bununla birlikte, a) immünositokimya ve deneysel manipülasyon için, 21 günden daha eski kültürlerden elde edilen hücreleri kullanın; b) 28 ° C'den yüksek olmayan sıcaklıklarda kültür; c) Antikor dilüsyonlarını reçete edildiği gibi koruyun. Floresan JIM5-TRITC etiketlemesi, hücreler karanlıkta tutulursa birkaç gün sürecektir. JIM7 etiketli hücreler 24 saat içinde görüntülenmelidir. Floresan boncuk etiketleme için, hücrelerin görüntülenmesi en iyi 24 saat içinde gerçekleşir. Spesifik deneyler için, özellikle mikroplaka tahlilleri kullananlar için, en aktif olanı bulmak için önce çeşitli ajan konsantrasyonları test edilmelidir. Bir ajanın hücre kültürünün canlılığını basitçe değiştirmediğinden emin olmak için geri kazanım deneylerinin yapılması da çok önemlidir.
Açıklanan protokollerde basit değişiklikler, araştırmacının hedeflerine uyacak şekilde kolayca yapılabilir. P. margaritaceum ile henüz denenmemiş olan hücre duvarını incelemek için birçok başka antikor mevcuttur. Spesifik deneyler için, özellikle mikroplaka tahlili kullananlar için, en aktif olanı bulmak için önce çeşitli ajan konsantrasyonları test edilmelidir. Floresan antikorlarla etiketlenmiş hücrelerin mikroplaka görüntülemesi daha sonra tek tek kuyucukların mikroskopi tabanlı taraması kullanılarak hızlı bir şekilde değerlendirilebilir. Bir ajanın hücre kültürünün canlılığını değiştirmediğinden emin olmak için geri kazanım deneylerinin yapılması da çok önemlidir.
Açıklamalar
Herhangi bir çıkar çatışması bildirilmemiştir.
Teşekkürler
Bu çalışma Ulusal Bilim Vakfı (NSF) tarafından desteklenmiştir (MCB hibe numarası 2129443 DD'ye).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcent. Tubes | Fisher Scientific | 01-549-740 | |
| 12 welled microplate | Fisher Scientific | 50-233-6077 | |
| 22 x 22 mm coverslips | Fisher Scientific | 12-541-016 | |
| 45x 50 cm coverslips | Brain Research | 4550-1.5D | |
| Agar | Sigma Aldrich | A9414 | |
| anti-rat FITC | Sigma Aldrich | F6258 | |
| anti-rat TRITC | Sigma Aldrich | T4280 | |
| calcium chloride | Sigma Aldrich | C4981 | |
| Cambbridge stubs | EMS | 75183-65 | |
| Fluoview CLSM | Evident | Fluoview 1200 | |
| JIM5 | Kerafast | ELD004 | |
| JIM7 | Kerafast | ELD005 | |
| Microcentrifuge | Fisher Scientific | 13-100-675 | |
| Micropipetors | BioRad | 1660499EDU | |
| Penium margaritaceum | Sammlung von Algenkulturen der Universität Göttingen - Culture Collection of Algae at Göttingen University | 2640 | |
| Polysphere kit | Polysciences | 18336 | |
| SEM | ThermoFisher | Quattro SEM | |
| sputter coater | EMS | Q150V | |
| Vortex mixer | Fisher Scientific | 02-215-414 |
Referanslar
- Delmer, D., Dixon, R. A., Keegstra, K., Mohnen, D. The plant cell wall-dynamic, strong, and adaptable-is a natural shapeshifter. Plant Cell. 36 (5), 1257-1311 (2024).
- Bierenbroodspot, M. J., et al. Phylogeny and evolution of streptophyte algae. Ann Bot. 134 (3), 385-400 (2024).
- Domozych, D. S., et al. Endomembrane architecture and dynamics during secretion of the extracellular matrix of the unicellular charophyte, Penium margaritaceum. J Exp Bot. 71 (11), 3323-3339 (2020).
- Feng, X., et al. Genomes of multicellular algal sisters to land plants illuminate signaling network evolution. Nat Genet. 56 (5), 1018-1031 (2024).
- Jiao, C., et al. The Penium margaritaceum genome: Hallmarks of the origins of land plants. Cell. 181, 1097-1111 (2020).
- LoRicco, J. G., et al. The multifunctional roles of the extracellular matrix in the sessile life of the zygnematophyte Penium margaritaceum: stick, glide and cluster. Physiologie Plantarum. 176 (5), e14520(2024).
- LoRicco, J. G., et al. Aberrant growth and expansion in Penium margaritaceum triggered by disruption of microtubules and the cell wall. J Exp Bot. erae387, (2024).
- LoRicco, J. G., et al. Chemically induced phenotype plasticity in the unicellular zygnematophyte, Penium margaritaceum. Protoplasma. 261 (6), 1233-1249 (2024).
- Davis, D. J., et al. Callose deposition is essential for the completion of cytokinesis in the unicellular alga, Penium margaritaceum. J Cell Sci. 133 (19), jcs.249599(2020).
- Rydahl, M. G., et al. Penium margaritaceum as a model organism for cell wall analysis of expanding plant cells. Methods Mol Biol. 1242, 1-22 (2015).
- Carrillo-Carrasco, V. P., Hernández-García, J., Weijers, D. Electroporation-based delivery of proteins in Penium margaritaceum and other zygnematophycean algae. Physiol Plant. 175 (6), e14121(2023).
- Nichols, H. W. Growth media-freshwater. Handbook Phycol Methods. , 16-17 (1973).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır
Sitemizdeki deneyiminizi iyileştirmek için çerezleri kullanıyoruz
Sitemizi kullanmaya devam ederek ya da "Devam et" butonuna tıklayarak, çerezleri kabul edebilirsiniz.
