Method Article
Experimentelle Screening-Protokolle, Immunzytochemie und mikroskopiebasierte Bildgebungsverfahren für Penium margaritaceum
In diesem Artikel
Zusammenfassung
Dieser Bericht beschreibt die grundlegenden Methoden, die zur Kultivierung und experimentellen Manipulation der einzelligen Streptophyten-Alge, Penium margaritaceum, verwendet werden. Es bietet auch grundlegende Protokolle für die mikroskopiebasierte Bildgebung, einschließlich der Lebendzellmarkierung mit monoklonalen Antikörpern und anderen Fluoreszenzsonden sowie der Rasterelektronenmikroskopie.
Zusammenfassung
Die Zellwand ist die erste Komponente des Signalempfangs/der Signaltransduktion für eine Pflanzenzelle während der Entwicklung und bei der Reaktion auf abiotische und biotische Stressoren aus der Umwelt. Die Zelle überwacht ständig die Integrität ihrer Zellwand und moduliert sie als Reaktion auf Stress. Die Aufklärung der spezifischen strukturellen und biochemischen Modulationen, die in der Zellwand ablaufen, ist eine schwierige Aufgabe, insbesondere wenn mehrzellige Pflanzen und ihre Organe/Gewebe eingesetzt werden. Dies ist auf die Grenzen dessen zurückzuführen, was in einer einzelnen Zelle, die Teil eines komplexen mehrzelligen Netzwerks ist, aufgelöst werden kann. Die einzellige Streptophyten-Alge, Penium margaritaceum, wurde in jüngster Zeit bei Untersuchungen der Pektindynamik, der auf Zellwänden basierenden phänotypischen Plastizität und mehrerer Aspekte der Algenzellbiologie eingesetzt. Sein einfacher Phänotyp, seine ausgeprägte Zellwand, die viele Komponenten aufweist, die den Zellwänden von Landpflanzen besonders ähnlich sind, und seine Leichtigkeit in immunzytochemischen und experimentellen Studien machen es zu einem leistungsstarken Modellorganismus in der Biologie der pflanzlichen Zellwand. Das Ziel dieser Studie ist es, die grundlegenden Techniken für die Kultivierung, experimentelle Manipulation und das Screening von angewandten Stressoren bereitzustellen. Screening-Protokolle für Immunzytochemie, konfokale Laser-Scanscanning-Mikroskopie-Bildgebung und Rasterelektronenmikroskopie-Bildgebung der Zellwandstruktur. Ebenso können viele der beschriebenen Techniken für eine Vielzahl anderer zellulärer und molekularer Studien modifiziert werden.
Einleitung
Die Zellwand einer Pflanze ist ein komplexes polymeres Netzwerk, das im Leben einer Pflanzenzelle mehrere Funktionen spielt1. Die Integrität der Zellwand wird von der Zelle während der Entwicklung und als Reaktion auf Umweltstress ständig überwacht und in Chemie und Struktur entsprechend moduliert. Penium margaritaceum ist eine einzellige Grünalge, die kürzlich in Studien an Streptophyten-Algen (Streptophyta, die Gruppe der Grünalgen, die am engstenmit den Landpflanzen verwandt und von ihnen angestammt) verwendet wurde.
In den letzten zwei Jahrzehnten war P. margaritaceum ein wichtiger Organismus bei der Erforschung der Zellwand- und extrazellulären Matrixdynamik, der Aktivitäten des Endomembransystems, der Manifestation der Zellform und der Pflanzenevolution 3,4,5,6,7,8,9,10,11 . Das Ziel dieser Arbeit ist es, den Forschern der pflanzlichen Zellwand die grundlegenden Methoden zur Kultivierung von P. margaritaceum, zur experimentellen Manipulation mit Mikroplatten-basierten Techniken und zur Überwachung der Struktur seiner Zellwand durch immunzytochemische Markierung lebender Zellen und Bildgebung mit Licht- und Elektronenmikroskopietechniken an die Hand zu geben. P. margaritaceum weist viele Ähnlichkeiten in der Zellwandbiochemie mit den primären Zellwänden von Landpflanzen auf. Wir haben mehrere Protokolle entwickelt, die sich den einzigartigen einzelligen Phänotyp dieser Alge zunutze machen und eine schnelle Möglichkeit zur Untersuchung der Zellwanddynamik bieten, die bei mehrzelligen Pflanzen oft schwer zu überwachen ist. Diese Techniken sind eine Hilfe für Pflanzen-Zellwandbiologen, die die detaillierte Zellwanddynamik aufklären wollen, insbesondere diejenigen, die sich mit Pektin befassen, und dienen als Ausgangspunkt für Studien, die sich mit der Zellbiologie von Pflanzen und Streptophyten befassen.
Protokoll
HINWEIS: Penium margaritaceum wird in der Sammlung von Algenkulturen der Universität Göttingen - Culture Collection of Algae an der Universität Göttingen, SAG, bezogen; Stamm #2640.
1. Pflege von Kulturen
- Bewahren Sie die Alge in flüssigem Woods Hole-Medium (WH12) auf, das auch mit Bodenwasserextrakt (d. h. 40 mL pro l Medium) ergänzt werden kann. Halten Sie die Kulturen bei 20-25 °C mit einem Licht-Dunkel-Zyklus von 16 h:8 h mit 3,5 klux (74 μmol Photonen/m2/s) kaltweißem Fluoreszenzlicht.
- Bereiten Sie wöchentlich Subkulturen vor und verwenden Sie Zellkulturen, wenn sie 10-14 Tage alt sind. Peniumkulturen sind 6 Monate lang lebensfähig und können während dieser Zeit zum Starten von Subkulturen verwendet werden. Die Alge wächst auch auf 1%-2% Agar-verfestigtem WHM.
- Für die routinemäßige Synchronisierung des Zellzyklus legen Sie Zellen aus 10-14 Tage alten Kulturen 2-6 Wochen lang bei 20-25 °C in die Dunkelheit. Waschen Sie die Zellen nach dieser Zeit mit frischem WHM (siehe unten) und kultivieren Sie sie wie oben beschrieben.
2. Markierung der Zellwand mit monoklonalen Antikörpern
HINWEIS: P. margaritaceum ist mit einer primären Zellwand bedeckt, die viele der gleichen Bestandteile enthält, die auch in den primären Zellwänden von Landpflanzen vorkommen11. Viele der monoklonalen Antikörper (mAbs), die gegen Epitope der Landpflanzenzellwand gezüchtet werden, erkennen Bestandteile der P . margaritaceum-Zellwand . Quellen für diese Antikörper sind das Complex Carbohydrate Research Center der University of Georgia (ccrc@uga.edu) oder Kerafast (kerafast.com). Nach der Zellwandmarkierung lebender Zellen mit primären mAbs, die spezifisch für Zellwandepitope und Fluorophor-konjugierte Sekundärantikörper (z. B. FITC, TITC) sind, können die Zellen wieder in Kultur gebracht werden, ohne die Gesundheit der Zelle oder die Zellwandablagerung zu beeinträchtigen. Die Fluoreszenzmarkierung der Zellwand bleibt auf unbestimmte Zeit bestehen, und die neu sekretierte Zellwand präsentiert sich als dunkle (d.h. unmarkierte) Zonen, die zur Bestimmung der Zellexpansionsraten gemessen und/oder erneut mit mAbs oder anderen Sonden markiert werden können.
- Entnehmen Sie 5 ml aktiv wachsender flüssiger Zellkulturen (10-14 Tage alt) und geben Sie sie in ein 15-ml-Zentrifugenröhrchen aus Kunststoff. Zentrifugieren Sie auf einer Tischzentrifuge bei 1.000 x g für 1 min.
- Gießen Sie den Überstand ab und entsorgen Sie ihn. Resuspendieren Sie das Pellet in 5 mL frischem WHM. Setzen Sie die Kappe fest auf und schütteln Sie das Röhrchen 10 s lang kräftig, um das Pellet wieder zu suspendieren und extrazelluläre polymere Substanzen oder EPS von der Zellwandoberfläche zu entfernen.
- Zentrifugieren Sie bei 1.000 x g für 1 min. Schritt 2.2 wiederholen und zentrifugieren. Resuspendieren Sie das Pellet in 1 mL frischem WHM und übertragen Sie 200 μL Aliquots der Zellsuspension in 1,5 mL Mikrozentrifugenröhrchen.
- Verschließen Sie die Röhrchen und zentrifugieren Sie sie in einer Mikrozentrifuge auf 1.000 x g. Entfernen Sie den Überstand und resuspendieren Sie das Pellet in 400 μl frischem WHM.
- Zu der Suspension werden 20 μl mAb hinzugefügt (z. B. JIM5, ein Ratten-mAb mit Spezifität für niedrig methylverestertes Homogalacturonan; die endgültige Verdünnung beträgt 1/20 mit WHM). Wirbeln Sie das Röhrchen ein, wickeln Sie es in Alufolie ein und legen Sie es für 90 Minuten auf einen Laborrotator. Um beste Ergebnisse zu erzielen, wirbeln Sie das Röhrchen während des 90-minütigen Inkubationsschritts 2x vortexen.
- Zentrifugieren Sie die Zellsuspension bei 1.000 x g für 1 min. Entfernen Sie den Überstand und resuspendieren Sie das Pellet in 500 μl frischem WHM. Verschließen Sie das Röhrchen und wirbeln Sie die Zellsuspension 10 s lang ein.
- Wiederholen Sie Schritt 2.6 2x. Nach der Zentrifugation wird das Pellet in 400 μl WHM und 8 μl Ziegen-Anti-Ratten-TRITC oder FITC (1/75 mit WHM verdünnt) resuspendiert. Vortex, wickeln Sie das Röhrchen in Alufolie ein und legen Sie es für 90 Minuten auf einen Laborrotator.
- Wiederholen Sie die Schritte 2.6 und 2.7. Suspendieren Sie das Pellet in 100 μl Wachstumsmedium, verschließen Sie das Röhrchen und wickeln Sie es in Aluminiumfolie ein, bis es zum Abbild bereit ist.
HINWEIS: Die Inkubation der Zellen in WHM, die ein Blockierungsmittel wie No Fat Carnation Instantmilch (1%) oder Rinderserumalbumin (1%) enthält, vor der Inkubation in den mAbs kann ebenfalls verwendet werden, hat aber nach unserer Erfahrung keinen Einfluss auf die Qualität oder Intensität. Penium dehnt seine Zellwand nicht aus und produziert im Dunkeln keine großen Mengen an EPS. Der markierte Antikörper bleibt mindestens 3-4 Tage intakt. Die Bildgebung muss also nicht sofort durchgeführt werden. Hier können andere mAbs angewendet werden, aber die Konzentrationen müssen getestet werden. Für chemische und physikalische Screening-Studien kann man mehrere ml Zellsuspension markieren, die mehrere Tage im Dunkeln aufbewahrt und in Mikroplatten-Studien verwendet wird. Zellen können auch nur vor der Behandlung mit dem primären Antikörper markiert werden, gefolgt von dem sekundären Antikörper später.
3. Messung der Zellwand- und Zellexpansionsraten im Zeitverlauf
- Entnehmen Sie 1 ml Zellen, die mit JIM5-TRITC markiert sind, und geben Sie 1 ml WHM in ein 1,5-ml-Mikrozentrifugenröhrchen. Bei 1.000 x g 1 min zentrifugieren und den Überstand verwerfen. Resuspendieren Sie das Pellet in 250 μl WHM und wirbeln Sie es ein, um die Zellen zu mischen.
- In jede Vertiefung einer 12-Well-Petrischale wird 1 ml WHM gegeben. Zu diesem Zeitpunkt können jeder Vertiefung spezifische Inhibitoren und Wachstumsregulatoren zugesetzt werden. In dieser Arbeit zeigen wir die Auswirkungen einer Erhöhung des Kalziumspiegels während der Inkubation.
- Nehmen Sie 30 μl markierte Zellsuspension (Schritt 1) und geben Sie sie in jede Vertiefung der Mikrotiterplatte. Schwenken Sie die Platte vorsichtig, um sie zu mischen. Mit Klarsichtfolie versiegeln.
- Kultur wie oben (Schritt 1.1) für 24 h, 48 h oder 72 h. Entnehmen Sie zu bestimmten Zeiten 250 mL Zellsuspension aus jeder Vertiefung und geben Sie sie in ein 1,5-μl-Mikrozentrifugenröhrchen.
- Zentrifugieren Sie bei 1.000 x g für 1 min. Entfernen Sie den Überstand. Resuspendieren Sie das Pellet in 50 μl Wachstumsmedium und Vortex.
- Geben Sie einen 15-μl-Tropfen der Zellsuspension auf einen Objektträger und decken Sie ihn mit einem Deckglas 22 x 22 (Dicke 1,5) ab. Beobachten Sie Zellen mit einem Fluoreszenzmikroskop unter Verwendung eines TRITC-Filters bei 10x -20x.
- Nehmen Sie Bilder von mindestens 50-100 Zellen auf. Messen und notieren Sie für jede Zelle die Gesamtzelllänge und die Länge der dunklen Zone (d. h. die neue Wand, die während der Inkubation nach der Markierung gebildet wird).
- Bestimmen Sie den durchschnittlichen Prozentsatz neuer Zellwände in der Kultur. Wiederholen Sie diesen Vorgang für Zellen, die nach 48 h und 72 h entnommen wurden, um Informationen über die Zellwandausdehnung im Laufe der Zeit zu erhalten.
HINWEIS: Die Schritte 3.5-3.8 ergeben eine dichte Zellsuspension, die die Abbildung vieler Zellen in einem Sichtfeld ermöglicht. Das macht das manuelle Messen deutlich komfortabler. Viele Kamerasoftwareprogramme bieten eine komfortable und/oder automatische Messung der Zellabmessungen, die mit dieser Alge verwendet werden können. Man kann die Zellen auch sammeln und wie oben beschrieben mit JIM5 markieren, aber Anti-Ratten-FITC als sekundären Antikörper ersetzen. Mit einem konfokalen Laser-Scanning-Mikroskop (CLSM) können Zellen sowohl mit dem FITC- als auch mit dem TRITC-Filter abgebildet werden. Die Fluoreszenzsignale können dann verschiedenen Pseudofarben zugeordnet werden. Dies ermöglicht auch eine Unterscheidung der Struktur der neuen Zellwand, die während verschiedener Behandlungen (markiert mit JIM5-FITC) gebildet wurde, im Vergleich zu vormarkierten Zellwänden (markiert mit JIM5-TRITC).
4. Zeitraffer-Bildgebung der Zellwandexpansion
- Beschriften Sie die Zellwand mit JIM5-TRITC wie oben beschrieben (Schritte 2.1-2.8). Verdünnen Sie die Zellen 10x in WHM und geben Sie einen 50-μl-Tropfen Zellen entweder auf ein Deckglas oder eine Petrischale mit Glasboden.
- Lassen Sie die Zellen 2 Minuten lang im Dunkeln am Glas haften. Spülen Sie Zellen, die nicht am Glas haften, vorsichtig mit 1 mL WHM ab. Verwenden Sie eine Mikropipette und geben Sie WHM vorsichtig tropfenweise in das Glas.
- Geben Sie 30 μl WHM auf die am Glas befestigten Zellen. Geben Sie 30 μl warme 4 % Agarose/WHM auf das Tröpfchen WHM/Zellen. Die Agarose auf Zimmertemperatur abkühlen lassen und fest werden lassen.
- Für Proben in einer Petrischale fügen Sie so viel WHM hinzu, dass die in Agarose eingebetteten Zellen vollständig bedeckt sind. Bei Zellen auf einem Deckglas drehen Sie das Deckglas um und legen Sie es vorsichtig über einen mit WHM gefüllten Vertiefungsobjektträger.
- Montieren Sie Zellen an einem Fluoreszenzmikroskop. Es kann eine externe Beleuchtung (Lampe) aufgestellt werden, oder das Licht des Mikroskops selbst kann verwendet werden, um Energie für das Zellwachstum und die Zellbewegung bereitzustellen. An einem Olympus Ix83 oder Ix63 Mikroskop funktioniert eine Leistung von 5-6 V für die trans Lampe gut. Dies kann für Ihr System Versuch und Irrtum erfordern.
- Bild alle 10-30 Minuten mit dem TRITC-Filterset zur Verfolgung der Zellwandexpansion. Gegebenenfalls Chemikalien/Enzyme zu WHM hinzufügen, die in Schritt 3.8 verwendet wurden.
5. Beobachtung der Produktion von extrazellulären Polymersubstanzen (EPS)
- Vorbereitung der Zellen: Entnehmen Sie 5 ml-Zellen aus 10-14 Tage alten Kulturen und waschen Sie sie wie in den Schritten 1-4 oben.
- Vorbereitung der fluoreszierenden Kügelchen: In ein 1,5-ml-Mikrozentrifugenröhrchen geben Sie 1 Tropfen (ca. 100 μl) 0,75 μm fluoreszierende Kügelchen (Polysphäre). Geben Sie 1 ml WHM in das Röhrchen und schütteln Sie es kräftig, um die Kügelchen wieder zu suspendieren. Bei 10.000 x g für 3 min zentrifugieren. Entfernen Sie den Überstand. Geben Sie 1 mL WHM zum Pellet und schütteln Sie es. Bei 10.000 x g für 3 min zentrifugieren. Resuspendieren Sie das Pellet in 500 μl WHM.
- Vorbereitung der Vertiefungen: Geben Sie 1 ml WHM-Medium in die Vertiefungen einer 12-Well-Platte. Inhibitoren oder Wachstumsregulatoren in der gewünschten Konzentration hinzufügen und vorsichtig schwenken. Fügen Sie 10 μl der Bead-Lösung hinzu und schwenken Sie die Platte vorsichtig, um die Beads zu vermischen. Geben Sie 10 μl gewaschene Zellen in jede Vertiefung und schwenken Sie die Platte vorsichtig.
- Die Zellplatte wird wie oben (1.1) kultiviert. Nach 24 Stunden legen Sie die Platte vorsichtig (achten Sie darauf, dass sie nicht vermischt) auf ein inverses Fluoreszenzmikroskop, das mit einem FITC-Filter ausgestattet ist. Die Perlen haften am EPS und zeigen die Muster der EPS-Freisetzung. Fotografieren Sie die Zellen mit 4x, 10x oder 20x.
6. Zeitrafferaufnahme der EPS-Spurbildung
- Führen Sie die Zeitrafferbildgebung in einer 12-Well-Platte (Schritt 3.2) durch, wie oben vorbereitet, oder in einer einzelnen Petrischale. Befolgen Sie die Schritte 1-4. Anstatt die Zellen unter Leuchtstofflampenlicht zu kultivieren, können die Zellen gezüchtet werden, während sie an einem inversen Fluoreszenzmikroskop montiert sind.
- Bilden Sie Zellen alle 5-10 Minuten ab, um die Zellbewegung bestmöglich zu erfassen. Fluoreszierende Kügelchen sind mit einem FITC-Filterset sichtbar, für konzentrierte Kügelchen wird jedoch der Hellfeldkanal verwendet. Es kann eine externe Beleuchtung (Lampe) aufgestellt werden, oder das Licht des Mikroskops selbst kann verwendet werden, um Energie für das Zellwachstum und die Zellbewegung bereitzustellen. An einem Olympus Ix83 Mikroskop funktioniert eine Leistung von 5-6 V für die Trans-Lampe gut. Dies kann für Ihr System Versuch und Irrtum erfordern.
7. Korrelative Strukturanalyse der Zellwand mit Rasterelektronenmikroskopie (REM)
HINWEIS: Veränderte Merkmale der Zellwand, die in lebenden Zellen beobachtet werden, die mit zellspezifischen Antikörpern markiert wurden, können mit REM für detaillierte Merkmale abgebildet werden. Dieser korrelative Ansatz ermöglicht es, ultrastrukturelle Daten zu erhalten, die mit den Fluoreszenzdaten verglichen werden können.
- Gewinnen Sie 1 ml einer Zellsuspension (kontrolliert oder experimentell behandelt) in einem 1,5-ml-Mikrozentrifugenröhrchen. Zentrifugieren Sie bei 4.000 x g für 1 min.
- Entsorgen Sie den Überstand. Tauchen Sie das Rohr mit dem Pellet in flüssigen Stickstoff oder stellen Sie es in einen -80 °C-Gefrierschrank, falls nicht verfügbar. Gefrorene Zellen können mehrere Monate bei -80 °C gelagert werden.
- Nehmen Sie das Röhrchen zum Zeitpunkt der Zellwandverarbeitung aus dem Gefrierschrank und lassen Sie es 15 Minuten lang auftauen. Das Pellet wird in 20 μl WHM resuspendiert und ein Tropfen der dichten Zellsuspension auf ein Deckglas von 45 mm x 50 mm gegeben.
- Legen Sie ein zweites Deckglas auf den Tropfen, um ein Sandwich zu erstellen. Auf einen Labortisch legen und kontinuierlich auf das Sandwich drücken, um die Zellen zu zerbrechen (z.B. 30 s).
- Trennen Sie vorsichtig die Glasdeckgläser und waschen Sie die geplatzten Zellen in ein 15-ml-Zentrifugenröhrchen. Zentrifugieren Sie bei 500 x g für 1 min.
- Den Überstand abgießen. Das Pellet sollte weiß oder leicht grün sein. Wenn die anschließende Bildgebung zeigt, dass nicht genügend Zellen aufgebrochen wurden, wiederholen Sie Schritt 3 mit dem Pellet hier.
- Das Pellet, das Zellwände in D-H2O enthält, resuspendieren und die Schritte 7.4 und 7.5 wiederholen. Das Pellet wird in 100 μl D-H2O resuspendiert und in ein 1,5 mL Zentrifugenröhrchen gegeben.
- Besorgen Sie sich einen Cambridge-Stummel (6 mm oder 8 mm Radius) und kleben Sie Carbonband (EMS) auf die Oberfläche. Geben Sie anschließend 5 μl Tropfen der resuspendierten Zellwandsuspension (Schritt 7) auf das Carbonband. Beobachten Sie die Anzahl der Zellwände mit einem Präpariermikroskop. Wenn die Suspension zu dicht ist, verdünnen Sie sie mit D-H2O.
- Legen Sie den Stummel in ein abgedecktes Gefäß und lassen Sie ihn trocknen (2 h bis über Nacht). Sputtern Sie den Stummel 50 s lang mit einem Palladiumtarget (andere Targets können ebenfalls verwendet werden). Beobachten Sie die Zellen bei 5 kV, Spotgröße, in 10 cm Entfernung vom Sekundärelektronendetektor.
HINWEIS: Durch Verdünnen der Zellwandsuspension vor dem Abscheiden von Tropfen auf das Kohleband wird die Ablagerung der Zellwände aufeinander begrenzt.
Ergebnisse
Die Markierung der Zellwand von P. margaritaceum mit Anti-Pektin-mAbs (z. B. JIM5) zeigt ein Netzwerk von Calciumkomplexfasern und Projektionen, die ein regelmäßiges Muster oder Gitter bilden (Abbildung 1). Das Pektin lagert sich im Zellzentrum oder Isthmus ab, wo es älteres Pektin in Richtung der Pole verdrängt (Abbildung 2). Die Markierung mit einem anderen Pektin-Antikörper-ähnlichen JIM7 zeigt die anfängliche Sekretion von hochmethylverestertem Pektin in einer schmalen Bande am Isthmus (Abbildung 3A,B). Andere Polymere, die sich in der Zellwand befinden, einschließlich des Arabinogalactan-Proteins, das mit dem mAb, JIM13, markiert ist (Abbildung 4). Große Mengen an EPS werden außerhalb der Zellwand sezerniert (Abbildung 5), was das Gleiten und die Bildung von Zellaggregaten ermöglicht. Einige dieser Markierungstechniken können in Entwicklungsstudien integriert werden, einschließlich der quantitativen Untersuchung der Zellwand und der Zellexpansion (Abbildung 6). Ebenso liefern korrelative Strukturuntersuchungen des Pektins mittels REM-Bildgebung detaillierte ultrastrukturelle Informationen (Abbildung 7), die mit der fluoreszenzbasierten Mikroskopie zur Lebendzellmarkierung verglichen werden können.
Die zur Verfügung gestellten Methoden bieten einen grundlegenden Leitfaden für den Einsatz einer einzelligen Alge wie P. margaritaceum für verschiedene Arten von Analysen. Die Möglichkeit, die Immunmarkierung der Zellwand durch lebende Zellen durchzuführen und nachfolgende Entwicklungsereignisse zu verfolgen, ist ein besonderer Vorteil, der bei mehrzelligen Systemen oft nicht möglich ist. P. margaritaceum bietet auch eine Zellwand, bei der sich das Pektin auf der äußeren Zellwandoberfläche befindet (d.h. direkt für die Mikroskopie zugänglich). Die Bildgebung und das Experimentieren mit Zellen in Vertiefungen von Mikrotiterplatten bietet ein bequemes Mittel zur schnellen Datenerfassung. Schließlich bietet die Möglichkeit, CLSM-Daten mit REM-Daten zu korrelieren, einen wertvollen Kanal für den Vergleich von Lebendzellereignissen mit ultrastrukturellen Informationen.

Abbildung 1: Markierung des Pektingitters mit dem monoklonalen Antikörper. Die JIM5-Antikörperspezifität ist niedrig verestertes Homogalacturonan. Beachten Sie die deutlichen Projektionen (weiße Pfeile) auf der Oberfläche der Zellwand. In der Expansionszone (schwarzer Pfeil) werden neue Zellwandmaterialien hinzugefügt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: JIM5-Markierung von Zellen während der Entwicklung. Die Zelle wurde zunächst mit JIM5-TRITC (orange und *) markiert und wieder in Kultur gebracht. Nach 24 Stunden wurden die Zellen entnommen und mit JIM5-FITC markiert (grün und Pfeil). Diese Zone steht für neues Wachstum. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: JIM7-Markierung von hochverestertem Pektin. (A) Markierung von hochverestertem Pektin mit dem monoklonalen Antikörper JIM7 (Spezifität: hochverestertes Homogalacturonan) in der Expansionszone. Beachten Sie die schmale Schicht (weißer Pfeil) auf der Oberfläche der Zellwand. (B) Co-Markierung von hoch- und niedrig verestertem Pektin der Zellwand während der Zellexpansion. Die Zelle wurde zunächst mit JIM5-TRITC (orange und *) markiert und wieder in Kultur gebracht. 24 h später wurden die Zellen entnommen und mit JIM7-FITC (grün und Pfeil) markiert. Die dunklen Zonen zwischen den beschrifteten Zonen stellen neu hinzugefügtes Pektin dar (schwarze Pfeile). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Arabinoglactan-Proteine der Zellwand. Markierung der Arabinogalactan-Proteine (AGPs) der Zellwandoberfläche mit dem monoklonalen Antikörper JIM13. Man beachte die lose Assoziation der AGPs mit der Zellwand (Pfeile). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
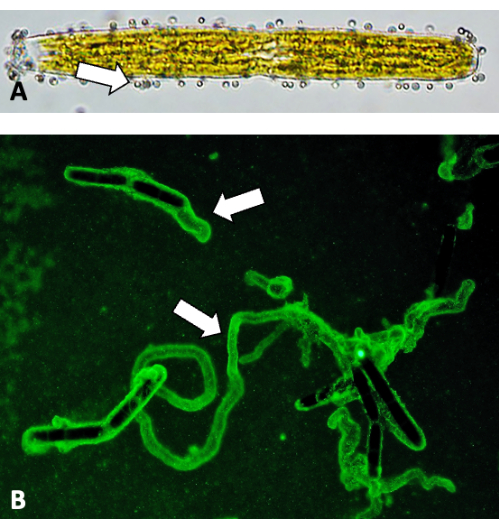
Abbildung 5: Abbildung von Gleitspuren mit fluoreszierenden Kügelchen. (A) Eine 0,75 μm große fluoreszierende Kügelchen, die an der Zellwandoberfläche befestigt sind (Pfeile). (B) Fluoreszierende Perlenbindung von EPS-Spuren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
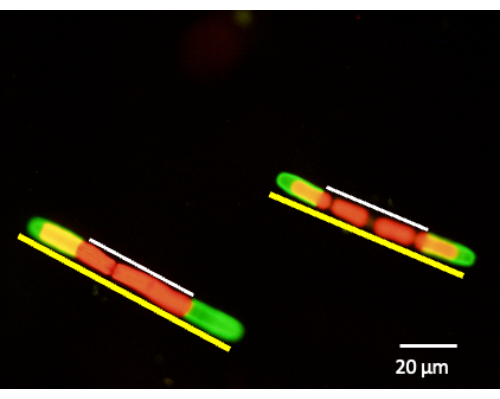
Abbildung 6: Die Messung der Zellwandexpansion kann nach der JIM5-TRITC-Markierung durchgeführt werden. Die Zellen werden wieder in Kultur gegeben und dürfen 24 h, 48 h und 72 h wachsen. Aliquote von Zellen können zu einem bestimmten Zeitpunkt entnommen und mit einem konfokalen Fluoreszenz-Laser-Scanning-Mikroskop betrachtet werden. Der prozentuale Anteil des neuen Wachstums wird durch Messung der unmarkierten Zellwand (weiße Linie) im Vergleich zur gesamten Zelllänge (gelbe Linie) bestimmt. Die rote Fluoreszenz ist die Chlorophyll-Autofluoreszenz. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Korelative Studien. (A) Das typische Gitter besteht aus einem Netz von Fasern, die oft nach außen in deutlichen Vorsprüngen enden (Pfeil). (B) Wenn das Gitter mit großen Mengen Kalzium behandelt wird, verwandelt es sich in unregelmäßige Ablagerungen (Pfeile). JIM5-beschriftete Zelle. (C) Wenn die Zellwände wie in (B) behandelt und mit REM untersucht werden, wird das unorganisierte Pektin (Pfeil) im Detail beobachtet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
P. margaritaceum ist ein wirksamer Organismus zur Aufklärung der Dynamik der Zellwandentwicklung und der EZM-Sekretion in Pflanzen und Streptophytenalgen. Zu den Hauptattributen gehören eine einzellige Gewohnheit und eine einfache Wartung und experimentelle Manipulation der Kultur, eine primäre Zellwand mit einem ausgeprägten äußeren Pektingitter und anderen Polymeren, eine Leichtigkeit bei der Markierung von lebenden Zellen mit zellwandgerichteten mAbs, die rechtzeitig für nachfolgende Entwicklungs- und/oder experimentelle Studien verfolgt werden können, und die Produktion großer Mengen an EPS, die in Echtzeit mit fluoreszierenden Kügelchen überwacht werden können1, 2,3,6. Darüber hinaus bieten die meisten Markierungstechniken einfache Mittel für quantitative Messungen.
P. maragaritaceum ist ein robuster Organismus, der einige bescheidene Änderungen an den hier beschriebenen Protokollen aufnehmen kann. Es ist jedoch wichtig zu beachten, dass a) für die Immunzytochemie und experimentelle Manipulation Zellen aus Kulturen verwendet werden, die weniger als 21 Tage alt sind; b) Kultur bei Temperaturen von nicht mehr als 28 °C; c) Halten Sie die Antikörperverdünnungen wie vorgeschrieben aufrecht. Die fluoreszierende JIM5-TRITC-Markierung hält mehrere Tage an, wenn die Zellen im Dunkeln aufbewahrt werden. JIM7-markierte Zellen sollten innerhalb von 24 Stunden abgebildet werden. Für die Markierung von Fluoreszenzkügelchen erfolgt die Bildgebung der Zellen am besten innerhalb von 24 Stunden. Für spezifische Experimente, insbesondere solche mit Mikrotiterplatten-Assays, sollten zunächst verschiedene Konzentrationen von Wirkstoffen getestet werden, um den aktivsten zu finden. Es ist auch wichtig, dass Rückgewinnungsexperimente durchgeführt werden, um sicherzustellen, dass ein Wirkstoff nicht einfach die Lebensfähigkeit der Zellkultur verändert.
Einfache Änderungen an den beschriebenen Protokollen können leicht vorgenommen werden, um sie an die Ziele des Forschers anzupassen. Viele andere Antikörper stehen zur Verfügung, um die Zellwand zu untersuchen, die mit P. margaritaceum noch ausprobiert werden muss. Für spezifische Experimente, insbesondere solche, bei denen der Mikrotiterplatten-Assay verwendet wird, sollten zunächst verschiedene Konzentrationen von Wirkstoffen getestet werden, um den aktivsten zu finden. Die Mikroplatten-Bildgebung von Zellen, die mit den fluoreszierenden Antikörpern markiert wurden, kann dann durch das mikroskopiebasierte Screening einzelner Wells schnell beurteilt werden. Es ist auch wichtig, dass Rückgewinnungsexperimente durchgeführt werden, um sicherzustellen, dass ein Wirkstoff die Lebensfähigkeit der Zellkultur nicht verändert.
Offenlegungen
Es wird kein Interessenkonflikt gemeldet.
Danksagungen
Diese Arbeit wurde von der National Science Foundation (NSF) unterstützt (MCB-Fördernummer 2129443 DD).
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcent. Tubes | Fisher Scientific | 01-549-740 | |
| 12 welled microplate | Fisher Scientific | 50-233-6077 | |
| 22 x 22 mm coverslips | Fisher Scientific | 12-541-016 | |
| 45x 50 cm coverslips | Brain Research | 4550-1.5D | |
| Agar | Sigma Aldrich | A9414 | |
| anti-rat FITC | Sigma Aldrich | F6258 | |
| anti-rat TRITC | Sigma Aldrich | T4280 | |
| calcium chloride | Sigma Aldrich | C4981 | |
| Cambbridge stubs | EMS | 75183-65 | |
| Fluoview CLSM | Evident | Fluoview 1200 | |
| JIM5 | Kerafast | ELD004 | |
| JIM7 | Kerafast | ELD005 | |
| Microcentrifuge | Fisher Scientific | 13-100-675 | |
| Micropipetors | BioRad | 1660499EDU | |
| Penium margaritaceum | Sammlung von Algenkulturen der Universität Göttingen - Culture Collection of Algae at Göttingen University | 2640 | |
| Polysphere kit | Polysciences | 18336 | |
| SEM | ThermoFisher | Quattro SEM | |
| sputter coater | EMS | Q150V | |
| Vortex mixer | Fisher Scientific | 02-215-414 |
Referenzen
- Delmer, D., Dixon, R. A., Keegstra, K., Mohnen, D. The plant cell wall-dynamic, strong, and adaptable-is a natural shapeshifter. Plant Cell. 36 (5), 1257-1311 (2024).
- Bierenbroodspot, M. J., et al. Phylogeny and evolution of streptophyte algae. Ann Bot. 134 (3), 385-400 (2024).
- Domozych, D. S., et al. Endomembrane architecture and dynamics during secretion of the extracellular matrix of the unicellular charophyte, Penium margaritaceum. J Exp Bot. 71 (11), 3323-3339 (2020).
- Feng, X., et al. Genomes of multicellular algal sisters to land plants illuminate signaling network evolution. Nat Genet. 56 (5), 1018-1031 (2024).
- Jiao, C., et al. The Penium margaritaceum genome: Hallmarks of the origins of land plants. Cell. 181, 1097-1111 (2020).
- LoRicco, J. G., et al. The multifunctional roles of the extracellular matrix in the sessile life of the zygnematophyte Penium margaritaceum: stick, glide and cluster. Physiologie Plantarum. 176 (5), e14520 (2024).
- LoRicco, J. G., et al. Aberrant growth and expansion in Penium margaritaceum triggered by disruption of microtubules and the cell wall. J Exp Bot. erae387, (2024).
- LoRicco, J. G., et al. Chemically induced phenotype plasticity in the unicellular zygnematophyte, Penium margaritaceum. Protoplasma. 261 (6), 1233-1249 (2024).
- Davis, D. J., et al. Callose deposition is essential for the completion of cytokinesis in the unicellular alga, Penium margaritaceum. J Cell Sci. 133 (19), jcs.249599 (2020).
- Rydahl, M. G., et al. Penium margaritaceum as a model organism for cell wall analysis of expanding plant cells. Methods Mol Biol. 1242, 1-22 (2015).
- Carrillo-Carrasco, V. P., Hernández-García, J., Weijers, D. Electroporation-based delivery of proteins in Penium margaritaceum and other zygnematophycean algae. Physiol Plant. 175 (6), e14121 (2023).
- Nichols, H. W. Growth media-freshwater. Handbook Phycol Methods. , 16-17 (1973).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
Wir verwenden Cookies, um Ihre Erfahrung auf unserer Website zu verbessern.
Indem Sie unsere Website weiterhin nutzen oder auf „Weiter“ klicken, stimmen Sie zu, unsere Cookies zu akzeptieren.