Method Article
Протоколы экспериментального скрининга, иммуноцитохимия и методы визуализации на основе микроскопии для Penium margaritaceum
В этой статье
Резюме
В этом отчете описываются основные методы, используемые для культивирования и экспериментального манипулирования одноклеточными стрептофитами водорослями Penium margaritaceum. Он также предоставляет фундаментальные протоколы визуализации на основе микроскопии, включая мечение живых клеток моноклональными антителами и другими флуоресцентными зондами, а также сканирующую электронную микроскопию.
Аннотация
Клеточная стенка является первым компонентом приема/трансдукции сигнала для растительной клетки во время развития и при реагировании на абиотические и биотические стрессоры окружающей среды. Клетка постоянно следит за целостностью своей клеточной стенки и модулирует ее в ответ на стресс. Выяснение специфических структурных и биохимических модуляций, происходящих в клеточной стенке, является сложной задачей, особенно при использовании многоклеточных растений и их органов/тканей. Это связано с ограничениями в отношении того, что может быть разрешено в отдельной клетке, которая является частью сложной многоклеточной сети. Одноклеточная водоросль стрептофитов, Penium margaritaceum, недавно была использована в исследованиях динамики пектина, фенотипической пластичности клеточной стенки и многочисленных аспектов клеточной биологии водорослей. Его простой фенотип, четкая клеточная стенка, которая имеет много компонентов, заметно похожих на клеточные стенки наземных растений, и легкость в иммуноцитохимических и экспериментальных исследованиях делают его мощным модельным организмом в биологии клеточных стенок растений. Целью данного исследования является предоставление основных методов культивирования, экспериментальной манипуляции и скрининга прикладных стрессоров. Протоколы скрининга иммуноцитохимии, конфокальной лазерной сканирующей микроскопии и сканирующей электронной микроскопии структуры клеточной стенки. Кроме того, многие из описанных методов могут быть модифицированы для широкого спектра других клеточных и молекулярных исследований.
Введение
Клеточная стенка растения представляет собой сложную полимерную сеть, которая играет несколько ролей в жизни растительной клетки1. Целостность клеточной стенки постоянно контролируется клеткой во время развития и в ответ на стресс окружающей среды и соответственно модулируется в химии и структуре. Penium margaritaceum — это одноклеточная зеленая водоросль, которая недавно была использована в исследованиях водорослей стрептофитов (Streptophyta, группа зеленых водорослей, наиболее тесно связанных и предков наземных растений2).
В течение последних двух десятилетий P. margaritaceum играл важную роль в исследованиях динамики клеточной стенки и внеклеточного матрикса, активности эндомембранных систем, проявления клеточной формы и эволюции растений 3,4,5,6,7,8,9,10,11 . Цель данной работы состоит в том, чтобы предоставить исследователям клеточной стенки растений фундаментальные методы культивирования P. margaritaceum, экспериментального манипулирования им с помощью методов на основе микропланшетов и мониторинга структуры его клеточной стенки с помощью иммуноцитохимического мечения живых клеток и визуализации с помощью методов световой и электронной микроскопии. P. margaritaceum имеет много общего в биохимии клеточной стенки с первичными клеточными стенками наземных растений. Мы разработали несколько протоколов, которые используют преимущества уникального одноклеточного фенотипа этой водоросли и обеспечивают быстрые средства изучения динамики клеточной стенки, которые часто трудно контролировать у многоклеточных растений. Эти методы будут полезны биологам клеточной стенки растений, которые хотят пролить свет на детальную динамику клеточной стенки, особенно тем, кто имеет дело с пектином, и послужат отправной точкой для исследований, посвященных биологии клеток водорослей растений и стрептофитов.
протокол
ПРИМЕЧАНИЕ: Penium margaritaceum получен в Sammlung von Algenkulturen der Universität Göttingen - Культурная коллекция водорослей в Гёттингенском университете, SAG; Штамм #2640.
1. Поддержание культур
- Водоросли следует содержать в жидкой среде Woods Hole (WH12), которая также может быть дополнена экстрактом почвенной воды (т.е. 40 мл на литр среды). Поддерживайте культуру при температуре 20-25 °C с помощью цикла «свет: темнота» продолжительностью 16 ч:8 ч с яркостью 3,5 клк (74 моль/м2/с) холодного белого флуоресцентного света.
- Подготавливайте субкультуры еженедельно и используйте клеточные культуры, когда им исполнится 10-14 дней. Культуры пениума будут жизнеспособны в течение 6 месяцев и в течение этого времени могут быть использованы для запуска субкультур. Водоросли также будут расти на 1%-2% затвердевшей агаровой WHM.
- Для рутинной синхронизации клеточного цикла поместите клетки 10-14-дневных культур в темноту на 2-6 недель при температуре 20-25 °C. По истечении этого времени промойте клетки свежим WHM (см. ниже) и заквашивайте, как описано выше.
2. Мечение клеточной стенки моноклональными антителами
Примечание: P. margaritaceum покрыт первичной клеточной стенкой, которая содержит многие из тех же компонентов, что и первичные клеточные стенки наземных растений11. Многие моноклональные антитела (mAb), выращенные против эпитопов клеточной стенки наземных растений, распознают компоненты клеточной стенки P. margaritaceum . Источниками этих антител являются Центр исследования сложных углеводов Университета Джорджии (ccrc@uga.edu) или Керафаст (kerafast.com). После мечения клеточной стенки живых клеток первичными mAb, специфичными для эпитопов клеточной стенки, и флуорконъюгированными вторичными антителами (например, FITC, TRITC), клетки могут быть помещены обратно в культуру без влияния на здоровье клетки или отложение клеточной стенки. Флуоресцентное мечение клеточной стенки остается неограниченным, и вновь секретируемая клеточная стенка представляет собой темные (т.е. немеченные) зоны, которые могут быть измерены для определения скорости клеточного расширения и/или снова помечены с помощью mAb или других зондов.
- Извлеките 5 мл активно растущей жидкой клеточной культуры (возрастом 10-14 дней) и поместите ее в пластиковую центрифужную пробирку объемом 15 мл. Центрифугируйте на настольной центрифуге при давлении 1 000 x g в течение 1 мин.
- Слейте и выбросьте надосадочную жидкость. Повторно суспендируйте гранулу в 5 мл свежего WHM. Плотно установите колпачок и энергично встряхивайте пробирку в течение 10 с, чтобы повторно суспендировать гранулу и удалить любое внеклеточное полимерное вещество или EPS с поверхности клеточной стенки.
- Центрифуга при 1 000 x g в течение 1 мин. Повторите шаг 2.2 и центрифугируйте. Повторно суспендируйте гранулу в 1 мл свежего WHM и перенесите 200 μл аликвоты клеточной суспензии в микроцентрифужные пробирки объемом 1,5 мл.
- Закройте пробирки и центрифугу в микроцентрифуге при давлении 1 000 x g. Удалите надосадочную жидкость и повторно суспендируйте гранулу в 400 μл свежего WHM.
- В суспензию добавляют 20 мкл mAb (например, JIM5, крысиный mAb со специфичностью к низкометилэтерифицированному гомогалактуронану; окончательное разведение составляет 1/20 с WHM). Сделайте трубку вихревой, оберните ее алюминиевой фольгой и поместите на лабораторный вращатель на 90 минут. Для достижения наилучших результатов переведите пробирку 2 раза в течение 90-минутной стадии инкубации.
- Центрифугируйте клеточную суспензию при давлении 1000 x g в течение 1 мин. Удалите надосадочную жидкость и повторно суспендируйте гранулу в 500 μл свежей жидкости. Закупорьте трубку и закупорьте ячейку суспензией на 10 с.
- Повторите шаг 2.6 2 раза. После центрифугирования повторно суспендируйте гранулу в 400 мкл WHM и 8 мкл козьего антикрысиного TRITC или FITC (разбавленного в 1/75 с WHM). Вортекс, оберните пробирку алюминиевой фольгой и поместите ее на лабораторный вращатель на 90 минут.
- Повторите шаги 2.6 и 2.7. Повторно суспендируйте гранулу в 100 μл питательной среды, закройте пробирку крышкой и оберните ее алюминиевой фольгой до готовности к изображению.
ПРИМЕЧАНИЕ: Инкубация клеток в ВМП, содержащая блокатор, такой как No Fat Carnation Instant milk (1%) или бычий сывороточный альбумин (1%) перед инкубацией в МП, также может быть использована, но, по нашему опыту, это никак не влияет на качество или интенсивность. Пениум не расширяет свою клеточную стенку и не производит большое количество ЭПС в темноте. Меченое антитело остается неповрежденным в течение как минимум 3-4 дней. Таким образом, визуализацию не обязательно проводить немедленно. Здесь можно применять и другие мАТ, но необходимо будет проверить концентрацию. Для химических и физических скрининговых исследований можно пометить несколько мл клеточной суспензии, выдержать в темноте несколько дней и использовать в исследованиях на микропланшетах. Клетки также могут быть помечены первичным антителом только до начала лечения, а затем вторичным антителом.
3. Измерение клеточной стенки и скорости клеточного расширения с течением времени
- Возьмите 1 мл клеток, помеченных JIM5-TRITC, и поместите 1 мл WHM в микроцентрифужную пробирку объемом 1,5 мл. Центрифугируйте при давлении 1 000 x g в течение 1 минуты и выбросьте надосадочную жидкость. Ресуспендируйте гранулу в 250 мкл WHM и вортексируйте для смешивания ячеек.
- В каждую лунку 12-луночной чашки Петри добавьте 1 мл ВТЧ. В это время в каждую лунку можно добавлять специфические ингибиторы и регуляторы роста. В этой статье мы демонстрируем эффекты повышения уровня кальция во время инкубации.
- Возьмите 30 мкл меченой клеточной суспензии (шаг 1) и добавьте в каждую лунку микропланшета. Аккуратно перемешайте тарелку, чтобы перемешать. Запечатать прозрачной пленкой.
- Культивирование, как указано выше (шаг 1.1), в течение 24 ч, 48 ч или 72 ч. В указанное время удалите 250 мл клеточной суспензии из каждой лунки и поместите ее в микроцентрифужную пробирку объемом 1,5 мкл.
- Центрифуга при 1 000 x g в течение 1 мин. Удалите надосадочную жидкость. Ресуспендируйте гранулу в 50 μл питательной среды и вихря.
- Поместите каплю суспензии на 15 мкл клеточной суспензии на предметное стекло и накройте покровным стеклом размером 22 x 22 (толщина 1,5). Наблюдайте за клетками с помощью флуоресцентного микроскопа с использованием фильтра TRITC при 10-20кратном увеличении.
- Захватите изображения не менее 50-100 ячеек. Для каждой ячейки измерьте и запишите общую длину ячейки и длину темной зоны (т. е. новой стенки, образующейся во время инкубации после маркировки).
- Определите средний процент новых клеточных стенок в культуре. Повторите для клеток, собранных через 48 ч и 72 ч, чтобы получить информацию о расширении клеточной стенки с течением времени.
ПРИМЕЧАНИЕ: Шаги 3.5-3.8 позволяют получить плотную клеточную суспензию, которая позволяет визуализировать множество клеток в одном поле зрения. Это делает ручное измерение намного удобнее. Многие программы для камер обеспечивают удобное и/или автоматическое измерение размеров ячеек, которые можно использовать с этой водорослью. Можно также собрать клетки и пометить их, как указано выше, с помощью JIM5, но заменить его антикрысиным FITC в качестве вторичного антитела. С помощью конфокального лазерного сканирующего микроскопа (CLSM) можно визуализировать клетки с помощью фильтров FITC и TRITC. Затем флуоресцентные сигналы могут быть назначены различным псевдоцветам. Это также позволяет дифференцировать структуру новой клеточной стенки, полученной во время различных процедур (меченных JIM5-FITC), по сравнению с клеточными стенками до мечения (меченных JIM5-TRITC).
4. Покадровая визуализация расширения клеточной стенки
- Пометьте клеточную стенку JIM5-TRITC, как описано выше (шаги 2.1-2.8). Разбавьте элементы в 10 раз в WHM и добавьте каплю 50 μL на покровную крышку или чашку Петри со стеклянным дном.
- Дайте ячейкам прилипнуть к стеклу в течение 2 минут в темноте. Аккуратно промойте не прилипшие к стеклу ячейки 1 мл ВТЧ. Используйте микропипетку и осторожно добавьте WHM по каплям на стакан.
- Добавьте 30 μL WHM поверх ячеек, прикрепленных к стеклу. Добавьте 30 μл теплой 4% агарозы/WHM поверх капли WHM/клеток. Дайте агарозе остыть до комнатной температуры и застыть.
- Для образцов в чашке Петри добавьте достаточное количество WHM, чтобы полностью покрыть клетки, погруженные в агарозу. Для ячеек на покровном стекле переверните покровное стекло и аккуратно поместите его на углубительное стекло, заполненное WHM.
- Установите клетки на флуоресцентный микроскоп. Может быть установлено внешнее освещение (лампа) или свет от самого микроскопа может быть использован для обеспечения энергией для роста и движения клеток. На микроскопе Olympus Ix83 или Ix63 хорошо работает мощность 5-6 В для транс-лампы. Для этого может потребоваться метод проб и ошибок для вашей системы.
- Делайте снимки каждые 10-30 минут с использованием набора фильтров TRITC для отслеживания расширения клеточной стенки. Добавьте химические вещества/ферменты в WHM, используемую на шаге 3.8, если таковые имеются.
5. Наблюдение за продукцией внеклеточного полимерного вещества (ЭПС)
- Подготовка клеток: Получите 5 мл клеток из культур 10-14-дневной давности и промойте их, как описано в шагах 1-4 выше.
- Приготовление флуоресцентных шариков: В микроцентрифужную пробирку объемом 1,5 мл добавьте 1 каплю (примерно 100 μл) 0,75 μм флуоресцентных шариков (Polysphere). Добавьте в пробирку 1 мл WHM и энергично встряхните, чтобы снова суспензировать шарики. Центрифуга при 10 000 x g в течение 3 мин. Удалите надосадочную жидкость. Добавьте в гранулу 1 мл WHM и встряхните. Центрифуга при 10 000 x g в течение 3 мин. Повторно суспендируйте гранулу в 500 μл WHM.
- Подготовка лунок: Добавьте 1 мл среды WHM в лунки 12-луночной пластины. Добавьте ингибиторы или регуляторы роста до нужной концентрации и аккуратно взболтайте. Добавьте 10 μL раствора для шариков и аккуратно перемешайте пластину, чтобы перемешать шарики. Добавьте 10 μL промытых ячеек в каждую лунку и осторожно взболтайте пластину.
- Культивируйте пластину клеток, как указано выше (1.1). Через 24 часа аккуратно поместите планшет (будьте осторожны, чтобы не перемешать) на инвертированный флуоресцентный микроскоп, оснащенный фильтром FITC. Бусины прилипают к EPS и выявляют закономерности выделения EPS. Сфотографируйте клетки с кратным, 10-кратным или 20-кратным увеличением.
6. Покадровая съемка формирования следа EPS
- Проведите покадровую съемку в 12-луночном планшете (шаг 3.2), как описано выше, или в отдельной чашке Петри. Выполните шаги 1-4. Вместо того, чтобы культивировать клетки под флуоресцентным освещением, клетки можно выращивать, устанавливая их на инвертированный флуоресцентный микроскоп.
- Визуализируйте клетки каждые 5–10 минут, чтобы наилучшим образом зафиксировать движение клеток. Флуоресцентные шарики видны с помощью набора фильтров FITC, но для концентрированных шариков используйте канал светлого поля. Может быть установлено внешнее освещение (лампа) или свет от самого микроскопа может быть использован для обеспечения энергией для роста и движения клеток. На микроскопе Olympus Ix83 хорошо работает мощность 5-6 В для транс-лампы. Для этого может потребоваться метод проб и ошибок для вашей системы.
7. Корреляционно-структурный анализ клеточной стенки с помощью сканирующей электронной микроскопии (СЭМ)
Измененные особенности клеточной стенки, наблюдаемые в живых клетках, меченных клеточно-специфическими антителами, могут быть визуализированы для получения подробных характеристик с помощью SEM. Этот корреляционный подход позволяет получить ультраструктурные данные, которые можно сравнить с данными флуоресценции.
- Получить 1 мл клеточной суспензии (контрольной или экспериментально обработанной) в микроцентрифужной пробирке объемом 1,5 мл. Центрифуга при 4 000 x g в течение 1 мин.
- Выбросьте надосадочную жидкость. Погрузите трубку с гранулой в жидкий азот или, если ее нет, поместите ее в морозильную камеру при температуре -80 °C. Замороженные клетки могут храниться при температуре -80 °C в течение нескольких месяцев.
- На время обработки клеточной стенки достаньте пробирку из морозильной камеры и дайте ей оттаять в течение 15 минут. Повторно суспендируйте гранулу в 20 мкл WHM и поместите каплю плотной клеточной суспензии на покровное стекло размером 45 мм x 50 мм.
- Положите второй покровный лист поверх капли, чтобы получился бутерброд. Поместите на лабораторный стол и непрерывно надавливайте на бутерброд, чтобы разорвать клетки (например, 30 с).
- Осторожно отделите стеклянные покровные стекла и промойте разорванные клетки в центрифужную пробирку объемом 15 мл. Центрифугируйте при 500 х г в течение 1 мин.
- Слейте надосадочную жидкость. Гранула должна быть белой или слегка зеленой. Если последующая визуализация показывает, что достаточное количество клеток не было разорвано, повторите шаг 3 с гранулой.
- Повторно суспендируйте гранулу, содержащую клеточные стенки, в D-H2O и повторите шаги 7.4 и 7.5. Повторно суспендируйте гранулу в 100 мкл D-H2O и поместите ее в центрифужную пробирку объемом 1,5 мл.
- Приобретите кембриджский огрызок (радиус 6 мм или 8 мм) и приклейте к его поверхности углеродную ленту (EMS). Затем нанесите 5 μл ресуспензионной суспензии клеточной стенки (шаг 7) на углеродную ленту. Наблюдайте за количеством клеточных стенок с помощью препарирующего микроскопа. Если суспензия слишком плотная, разведите ее с помощью D-H2O.
- Поместите огрызок в закрытый контейнер и дайте ему высохнуть (от 2 часов до ночи). Напыляйте на заглушку в течение 50 с с помощью палладиевой мишени (можно использовать и другие мишени). Наблюдайте за ячейками с напряжением 5 кВ, размером пятна, на расстоянии 10 см от детектора вторичных электронов.
ПРИМЕЧАНИЕ: Разбавление суспензии клеточной стенки перед нанесением капель на углеродную ленту ограничит осаждение клеточных стенок друг на друга.
Результаты
Мечение клеточной стенки P. margaritaceum антипектиновыми mAb (например, JIM5) выявляет сеть кальциевых комплексных волокон и выступов, которые образуют регулярный узор или решетку (рис. 1). Пектин откладывается в клеточном центре или перешейке, где он вытесняет более старый пектин к полюсам (рис. 2). Мечение другим пектиновым антителом JIM7 подчеркивает начальную секрецию пектина с высоким содержанием метилэтерифицированного пектина в узкой полосе на перешейке (рис. 3A, B). Другие полимеры, расположенные в клеточной стенке, в том числе белок арабиногалактан, помеченный mAb, JIM13 (рис. 4). Большое количество ЭПС секретируется извне клеточной стенкой (рис. 5), что способствует скольжению и образованию клеточных агрегатов. Некоторые из этих методов мечения могут быть интегрированы в исследования развития, включая количественное изучение клеточной стенки и клеточной экспансии (Рисунок 6). Аналогичным образом, коррелятивные структурные исследования пектина с использованием СЭМ-визуализации предоставляют подробную ультраструктурную информацию (рис. 7), которую можно сравнить с флуоресцентной микроскопией, основанной на мечении живых клеток.
Представленные методы представляют собой фундаментальное руководство по использованию одноклеточных водорослей, таких как P. margaritaceum, для различных типов анализов. Возможность выполнять иммуномечение клеточной стенки живыми клетками и следить за последующими событиями развития является особым преимуществом, которое часто не учитывается при использовании многоклеточных систем. P. margaritaceum также имеет клеточную стенку, в которой пектин находится на внешней поверхности клеточной стенки (т.е. непосредственно доступен для микроскопии). Визуализация и экспериментирование с клетками в лунках микролуночных планшетов предоставляет удобный способ быстрого сбора данных. Наконец, средства корреляции данных CLSM с данными SEM обеспечивают ценный канал для сравнения событий в живых клетках с ультраструктурной информацией.

Рисунок 1: Мечение пектиновой решетки моноклональным антителом. Специфичность антител JIM5 — низкий уровень этерифицированного гомогалактуронана. Обратите внимание на отчетливые выступы (белые стрелки) на поверхности клеточной стенки. Зона расширения (черная стрелка) — это место, где добавляются новые материалы клеточных стенок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Мечение клеток JIM5 во время развития. Первоначально клетка была помечена JIM5-TRITC (оранжевый и *) и помещена обратно в культуру. Через 24 ч клетки собирали и маркировали JIM5-FITC (зеленым и стрелочным). Эта зона представляет собой новый рост. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Мечение JIM7 высокоэтерифицированным пектином. (A) Мечение высокоэтерифицированного пектина моноклональным антителом JIM7 (специфичность: высокоэтерифицированный гомогалактуронан) в зоне экспансии. Обратите внимание на узкий слой (белая стрелка) на поверхности клеточной стенки. (B) Совместное мечение высокои низкоэтерифицированного пектина клеточной стенки во время клеточной экспансии. Первоначально клетка была помечена JIM5-TRITC (оранжевый и *) и помещена обратно в культуру. Через 24 ч клетки были собраны и помечены JIM7-FITC (зеленым цветом и стрелкой). Темные зоны между помеченными зонами представляют собой недавно добавленный пектин (черные стрелки). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Белки арабиноглактана клеточной стенки. Мечение арабиногалактановых белков (АГП) поверхности клеточной стенки моноклональным антителом JIM13. Обратите внимание на слабую связь AGP с клеточной стенкой (стрелки). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
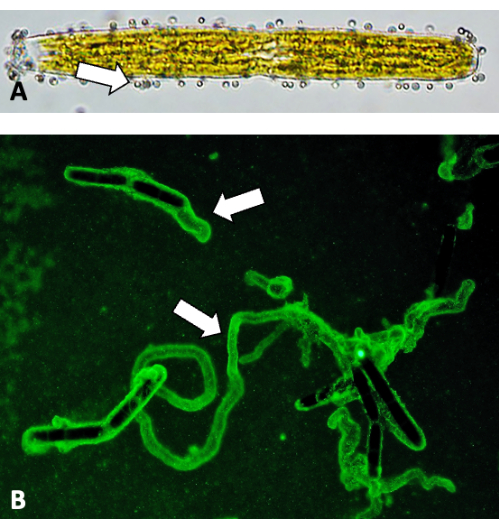
Рисунок 5: Визуализация скользящих следов с флуоресцентными шариками. (A) Флуоресцентные шарики размером 0,75 мкм, прикрепленные к поверхности клеточной стенки (стрелки). (B) Обвязка флуоресцентными шариками следов EPS. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
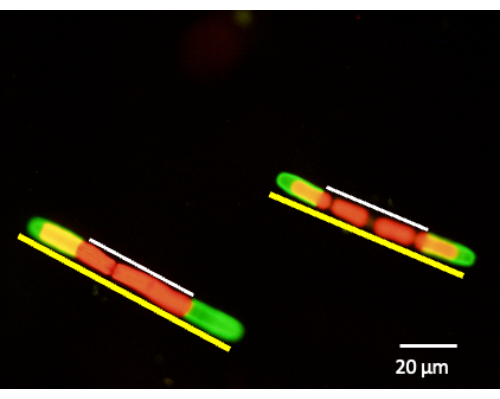
Рисунок 6: Измерение расширения клеточной стенки может быть выполнено после мечения JIM5-TRITC. Клетки помещают обратно в культуру и дают им расти в течение 24 ч, 48 ч и 72 ч. Аликвоты клеток могут быть удалены в определенный период времени и рассмотрены с помощью флуоресцентного конфокального лазерного сканирующего микроскопа. Процент нового роста определяется путем измерения немеченой клеточной стенки (белая линия) по отношению всей длины клетки (желтая линия). Красная флуоресценция — это автофлуоресценция хлорофилла. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 7: Корреляционные исследования. (А) Типичная решетка состоит из сетки волокон, которые часто заканчиваются снаружи в отдельных проекциях (стрелка). (Б) При обработке большим количеством кальция решетка превращается в неправильные отложения (стрелки). Меченая ячейка JIM5. (В) Когда клеточные стенки обрабатываются, как показано в пункте (В), и исследуются с помощью СЭМ, дезорганизованный пектин (стрелка) наблюдается в деталях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
P. margaritaceum является эффективным организмом для выяснения динамики развития клеточной стенки и секреции ВКМ у растений и стрептофитов. К основным характеристикам относятся одноклеточный габитус и простота в поддержании культуры и экспериментальных манипуляциях, первичная клеточная стенка с отчетливой внешней пектиновой решеткой и другими полимерами, легкость мечения живых клеток с помощью mAb, направленных на клеточную стенку, которые можно отслеживать со временем для последующих разработок и/или экспериментальных исследований, а также производство больших количеств EPS, которые можно контролировать в режиме реального времени с использованием флуоресцентных шариков. 2,3,6. Кроме того, большинство методов маркировки предоставляют простые средства для количественных измерений.
P. maragaritaceum является устойчивым организмом, который может приспособиться к некоторым скромным изменениям в описанных здесь протоколах. Однако важно отметить, что: а) для иммуноцитохимии и экспериментальных манипуляций используйте клетки культур, возраст которых не превышает 21 дня; б) культивирование при температуре не выше 28 °С; в) поддерживать разведение антител в соответствии с предписаниями. Флуоресцентное мечение JIM5-TRITC будет длиться несколько дней, если клетки будут храниться в темноте. Изображения, меченные ячейками JIM7, должны быть визуализированы в течение 24 часов. Для мечения флуоресцентными шариками визуализация клеток лучше всего в течение 24 часов. Для конкретных экспериментов, особенно с использованием микропланшетных анализов, сначала следует протестировать различные концентрации агентов, чтобы найти наиболее активный. Также крайне важно проводить эксперименты по восстановлению, чтобы убедиться в том, что агент просто не изменил жизнеспособность клеточной культуры.
Простые модификации описанных протоколов могут быть легко внесены в соответствии с целями исследователя. Существует множество других антител для изучения клеточной стенки, которые еще предстоит опробовать с P. margaritaceum. Для конкретных экспериментов, особенно тех, в которых используется анализ на микропланшетах, сначала следует протестировать различные концентрации веществ, чтобы найти наиболее активный. Визуализация на микропланшетах клеток, меченных флуоресцентными антителами, может быть быстро оценена с помощью скрининга отдельных лунок на основе микроскопии. Также крайне важно проводить эксперименты по восстановлению, чтобы убедиться в том, что агент не изменил жизнеспособность клеточной культуры.
Раскрытие информации
О конфликте интересов не сообщается.
Благодарности
Эта работа была поддержана Национальным научным фондом (NSF) (грант MCB No 2129443 DD).
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcent. Tubes | Fisher Scientific | 01-549-740 | |
| 12 welled microplate | Fisher Scientific | 50-233-6077 | |
| 22 x 22 mm coverslips | Fisher Scientific | 12-541-016 | |
| 45x 50 cm coverslips | Brain Research | 4550-1.5D | |
| Agar | Sigma Aldrich | A9414 | |
| anti-rat FITC | Sigma Aldrich | F6258 | |
| anti-rat TRITC | Sigma Aldrich | T4280 | |
| calcium chloride | Sigma Aldrich | C4981 | |
| Cambbridge stubs | EMS | 75183-65 | |
| Fluoview CLSM | Evident | Fluoview 1200 | |
| JIM5 | Kerafast | ELD004 | |
| JIM7 | Kerafast | ELD005 | |
| Microcentrifuge | Fisher Scientific | 13-100-675 | |
| Micropipetors | BioRad | 1660499EDU | |
| Penium margaritaceum | Sammlung von Algenkulturen der Universität Göttingen - Culture Collection of Algae at Göttingen University | 2640 | |
| Polysphere kit | Polysciences | 18336 | |
| SEM | ThermoFisher | Quattro SEM | |
| sputter coater | EMS | Q150V | |
| Vortex mixer | Fisher Scientific | 02-215-414 |
Ссылки
- Delmer, D., Dixon, R. A., Keegstra, K., Mohnen, D. The plant cell wall-dynamic, strong, and adaptable-is a natural shapeshifter. Plant Cell. 36 (5), 1257-1311 (2024).
- Bierenbroodspot, M. J., et al. Phylogeny and evolution of streptophyte algae. Ann Bot. 134 (3), 385-400 (2024).
- Domozych, D. S., et al. Endomembrane architecture and dynamics during secretion of the extracellular matrix of the unicellular charophyte, Penium margaritaceum. J Exp Bot. 71 (11), 3323-3339 (2020).
- Feng, X., et al. Genomes of multicellular algal sisters to land plants illuminate signaling network evolution. Nat Genet. 56 (5), 1018-1031 (2024).
- Jiao, C., et al. The Penium margaritaceum genome: Hallmarks of the origins of land plants. Cell. 181, 1097-1111 (2020).
- LoRicco, J. G., et al. The multifunctional roles of the extracellular matrix in the sessile life of the zygnematophyte Penium margaritaceum: stick, glide and cluster. Physiologie Plantarum. 176 (5), e14520 (2024).
- LoRicco, J. G., et al. Aberrant growth and expansion in Penium margaritaceum triggered by disruption of microtubules and the cell wall. J Exp Bot. erae387, (2024).
- LoRicco, J. G., et al. Chemically induced phenotype plasticity in the unicellular zygnematophyte, Penium margaritaceum. Protoplasma. 261 (6), 1233-1249 (2024).
- Davis, D. J., et al. Callose deposition is essential for the completion of cytokinesis in the unicellular alga, Penium margaritaceum. J Cell Sci. 133 (19), jcs.249599 (2020).
- Rydahl, M. G., et al. Penium margaritaceum as a model organism for cell wall analysis of expanding plant cells. Methods Mol Biol. 1242, 1-22 (2015).
- Carrillo-Carrasco, V. P., Hernández-García, J., Weijers, D. Electroporation-based delivery of proteins in Penium margaritaceum and other zygnematophycean algae. Physiol Plant. 175 (6), e14121 (2023).
- Nichols, H. W. Growth media-freshwater. Handbook Phycol Methods. , 16-17 (1973).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены