Method Article
Penium margaritaceum 的实验筛选方案、免疫细胞化学和基于显微镜的成像技术
摘要
本报告描述了用于培养和实验纵单细胞链藻 Penium margaritaceum 的基本方法。它还提供了基于显微镜的成像的基本方案,包括使用单克隆抗体和其他荧光探针进行活细胞标记以及扫描电子显微镜检查。
摘要
细胞壁是植物细胞在发育过程中以及响应环境非生物和生物胁迫源时信号接收/转导的第一个组成部分。细胞不断监测其细胞壁的完整性并对其进行调节以响应压力。阐明细胞壁中发生的特定结构和生化调节是一项艰巨的任务,尤其是在使用多细胞植物及其器官/组织时。这是由于在作为复杂多细胞网络一部分的单个细胞中可以解析的内容受到限制。单细胞链藻 Penium margaritaceum 最近被用于研究果胶动力学、基于细胞壁的表型可塑性和藻类细胞生物学的多个方面。其简单的表型、独特的细胞壁(具有许多与陆地植物细胞壁明显相似的成分)以及易于免疫细胞化学和实验研究,使其成为植物细胞壁生物学中强大的模式生物。本研究的目的是为应用应激源的培养、实验作和筛选提供基本技术。免疫细胞化学、共聚焦激光扫描显微镜成像和细胞壁结构扫描电子显微镜成像的筛选方案。同样,许多描述的技术可以修改用于广泛的其他细胞和分子研究。
引言
植物的细胞壁是一个复杂的聚合物网络,在植物细胞的生命周期中具有多种作用1。细胞壁的完整性在发育过程中和响应环境压力时受到细胞的持续监测,并相应地调节化学和结构。 Penium margaritaceum 是一种单细胞绿藻,最近用于研究链藻类(链藻门,与陆地植物关系最密切和祖先的一组绿藻2)。
在过去的二十年里,P. margaritaceum 一直是研究细胞壁和细胞外基质动力学、内膜系统活性、细胞形状表现和植物进化的重要生物 3,4,5,6,7,8,9,10,11 .这项工作的目标是为植物细胞壁研究人员提供培养 P. margaritaceum 的基本方法,使用基于微孔板的技术对其进行实验作,并使用活细胞免疫细胞化学标记和光学和电子显微镜技术成像来监测其细胞壁的结构。P. margaritaceum 在细胞壁生物化学上与陆地植物的初级细胞壁有许多相似之处。我们设计了多种方案,利用这种藻类独特的单细胞表型,提供了一种快速研究细胞壁动力学的方法,而这些细胞壁动力学在多细胞植物中通常难以监测。这些技术将有助于想要阐明详细细胞壁动力学的植物细胞壁生物学家,尤其是那些处理果胶的生物学家,并作为处理植物和链藻细胞生物学研究的起点。
研究方案
注: Penium margaritaceum 是在哥廷根大学 (SAG) 的 Sammlung von Algenkulturen der Universität Göttingen - 藻类培养收藏馆获得的;菌株 #2640。
1. 维护培养物
- 将藻类保持在液体 Woods Hole 培养基 (WH12) 中,该培养基也可以补充土壤水提取物(即每升培养基 40 mL)。用 3.5 klux(74 μmol 光子/m2/s)的冷白荧光灯,用 16 小时:8 小时的光照:暗循环将培养物保持在 20-25 °C。
- 每周准备传代培养物,并在细胞培养物 10-14 天大时使用细胞培养物。 Penium 培养物可存活 6 个月,在此期间可用于开始传代培养。藻类也会在 1%-2% 琼脂固化的 WHM 上生长。
- 对于常规细胞周期同步,将来自 10-14 天龄培养物的细胞在 20-25 °C 下在黑暗中放置 2-6 周。 在此之后,用新鲜的 WHM(见下文)洗涤细胞并如上所述进行培养。
2. 用单克隆抗体标记细胞壁
注意: P. margaritaceum 覆盖着初级细胞壁,该细胞壁具有许多与陆地植物初级细胞壁相同的成分11.许多针对陆地植物细胞壁表位产生的单克隆抗体 (mAb) 可识别 P. margaritaceum 细胞壁的成分。这些抗体的来源包括佐治亚大学复合碳水化合物研究中心 (ccrc@uga.edu) 或 Kerafast (kerafast.com)。使用细胞壁表位特异性的一代 mAb 和荧光团偶联的二抗(例如 FITC、TRITC)对活细胞进行细胞壁标记后,可以将细胞放回培养物中,而不会影响细胞的健康或细胞壁沉积。细胞壁的荧光标记无限期地保持,新分泌的细胞壁表现为暗区(即未标记)区,可以测量以确定细胞扩增速率和/或再次用 mAb 或其他探针标记。
- 取出 5 mL 活跃生长的液体细胞培养物(10-14 天龄),并将其放入 15 mL 塑料离心管中。在台式离心机上以 1,000 x g 离心 1 分钟。
- 倒出并丢弃上清液。将沉淀重悬于 5 mL 的新鲜 WHM 中。盖紧盖子并剧烈摇动试管 10 秒以重悬沉淀并从细胞壁表面去除任何细胞外聚合物物质或 EPS。
- 以 1,000 x g 离心 1 分钟。重复步骤 2.2 并离心。将沉淀重悬于 1 mL 新鲜 WHM 中,并将 200 μL 等分试样的细胞悬液转移到 1.5 mL 微量离心管中。
- 盖上试管并在微量离心机中以 1,000 x g 离心。去除上清液并将沉淀重悬于 400 μL 新鲜 WHM 中。
- 向悬浮液中加入 20 μL mAb(例如 JIM5,一种对低甲酯化高半乳糖醛酸具有特异性的大鼠 mAb;WHM 的最终稀释度为 1/20)。涡旋试管,用铝箔包裹,然后将其放在实验室旋转器上 90 分钟。为获得最佳结果,请在 90 分钟的孵育步骤中将试管涡旋 2 次。
- 将细胞悬液以 1,000 x g 离心 1 分钟。去除上清液并将沉淀重悬于 500 μL 新鲜 WHM 中。盖上试管并涡旋细胞悬液 10 秒。
- 重复步骤 2.6 2 次。离心后,将沉淀重悬于 400 μL WHM 和 8 μL 山羊抗大鼠 TRITC 或 FITC(用 WHM 稀释 1/75)中。涡旋,用铝箔包裹试管,然后将其放在实验室旋转器上 90 分钟。
- 重复步骤 2.6 和 2.7。将沉淀重悬于 100 μL 生长培养基中,盖上试管,然后用铝箔包裹,直到准备好成像。
注意:在 mAb 中孵育之前,也可以使用含有 No Fat Carnation 速溶牛奶 (1%) 或牛血清白蛋白 (1%) 等封闭剂的 WHM 中孵育细胞,但根据我们的经验,对标记质量或强度没有任何作用。 Penium 不会扩大其细胞壁或在黑暗中产生大量 EPS。标记的抗体保持完整至少 3-4 天。因此,不必立即进行成像。其他 mAb 也可在此处应用,但需要测试浓度。对于化学和物理筛选研究,可以标记数 mL 的细胞悬液,在黑暗中保存数天并用于微孔板研究。也可以在处理前仅使用一抗标记细胞,然后再使用二抗标记。
3. 测量细胞壁和细胞扩增速率随时间的变化
- 取 1 mL 用 JIM5-TRITC 标记的细胞,将 1 mL WHM 放入 1.5 mL 微量离心管中。以 1,000 x g 离心 1 分钟,弃去上清液。将沉淀重悬于 250 μL WHM 中并涡旋以混合细胞。
- 向 12 孔培养皿的每个孔中加入 1 mL WHM。此时,可以向每个孔中添加特异性抑制剂和生长调节剂。在本文中,我们展示了在孵育过程中增加钙水平的影响。
- 取 30 μL 标记的细胞悬液(步骤 1)并添加到微孔板的每个孔中。轻轻旋转板以混合。用透明薄膜密封。
- 如上所述培养(步骤 1.1)24 小时、48 小时或 72 小时。在指定时间,从每个孔中取出 250 mL 细胞悬液,并将其放入 1.5 μL 微量离心管中。
- 以 1,000 x g 离心 1 分钟。去除上清液。将沉淀重悬于 50 μL 生长培养基中并涡旋。
- 将 15 μL 细胞悬液滴到载玻片上,并用 22 x 22 的盖玻片(厚度 1.5)覆盖。使用 TRITC 滤光片以 10 倍 -20 倍用荧光显微镜观察细胞。
- 捕获至少 50-100 个细胞的图像。对于每个细胞,测量并记录细胞总长度和暗区的长度(即,标记后孵育过程中产生的新壁)。
- 确定培养物中新细胞壁的平均百分比。对 48 小时和 72 小时后收集的细胞重复此作,以获得细胞壁随时间扩展的信息。
注:步骤 3.5-3.8 产生致密的细胞悬液,允许在一个视野中对许多细胞进行成像。这使得手动测量更加方便。许多相机软件程序提供了可用于这种藻类的细胞尺寸的便捷和/或自动测量。也可以收集细胞并如上所述用 JIM5 标记它们,但用抗大鼠 FITC 代替二抗。使用共聚焦激光扫描显微镜 (CLSM),可以使用 FITC 和 TRITC 滤光片对细胞进行成像。然后可以将荧光信号分配给不同的伪彩。这也允许区分各种处理(用 JIM5-FITC 标记)与预标记细胞壁(用 JIM5-TRITC 标记)产生的新细胞壁的结构的方法。
4. 细胞壁扩增的延时成像
- 如上所述,用 JIM5-TRITC 标记细胞壁(步骤 2.1-2.8)。在 WHM 中将细胞稀释 10 倍,并将 50 μL 细胞滴添加到盖玻片或玻璃底培养皿上。
- 让细胞在黑暗中粘附在玻璃上 2 分钟。用 1 mL WHM 轻轻冲洗掉未粘在玻璃上的细胞。使用微量移液器,小心地将 WHM 逐滴添加到玻璃杯中。
- 在附着在玻璃上的细胞顶部添加 30 μL WHM。在 WHM/细胞液滴的顶部添加 30 μL 温热的 4% 琼脂糖/WHM。让琼脂糖冷却至室温并凝固。
- 对于培养皿中的样品,添加足够的 WHM 以完全覆盖琼脂糖包埋的细胞。对于盖玻片上的细胞,倒置盖玻片并将其轻轻放在充满 WHM 的凹陷载玻片上。
- 将细胞安装在荧光显微镜上。可以设置外部照明(灯),或者可以使用显微镜本身的光为细胞生长和运动提供能量。在奥林巴斯 Ix83 或 Ix63 显微镜上,透射灯的 5-6 V 电源效果很好。这可能需要对您的系统进行反复试验。
- 使用 TRITC 滤光片组每 10-30 分钟成像一次,用于跟踪细胞壁扩张。将化学品/酶添加到步骤 3.8 中使用的 WHM 中(如果有)。
5. 观察细胞外聚合物物质 (EPS) 的产生
- 细胞制备:从 10-14 天龄的培养物中获得 5 mL 细胞,并按照上述步骤 1-4 洗涤它们。
- 荧光珠的制备:向 1.5 mL 微量离心管中加入 1 滴(约 100 μL)0.75 μm 荧光珠(多球)。向试管中加入 1 mL WHM 并剧烈摇晃以重悬珠子。以 10,000 x g 离心 3 分钟。去除上清液。向沉淀中加入 1 mL WHM 并摇匀。以 10,000 x g 离心 3 分钟。将沉淀重悬于 500 μL WHM 中。
- 孔的制备:向 12 孔板的孔中加入 1 mL WHM 培养基。将抑制剂或生长调节剂添加至所需浓度,然后轻轻旋转。加入 10 μL 微珠溶液,轻轻旋转板以混合微珠。向每个孔中加入 10 μL 洗涤过的细胞,然后轻轻旋转板。
- 如上所述培养细胞板 (1.1)。24 小时后,轻轻地将板(注意不要混合)放在配备 FITC 滤光片的倒置荧光显微镜上。珠子粘附在 EPS 上,并揭示了 EPS 释放的模式。以 4 倍、10 倍或 20 倍拍摄细胞。
6. EPS 轨迹形成的延时成像
- 如上所述,在 12 孔板(步骤 3.2)或单个培养皿中进行延时成像。按照步骤 1-4 进行作。细胞不是在荧光灯下培养,而是可以安装在倒置荧光显微镜上生长。
- 每 5-10 分钟对细胞进行一次成像,以最好地捕捉细胞运动。使用 FITC 滤光片组可以看到荧光珠,但对于浓缩珠,请使用明场通道。可以设置外部照明(灯),或者可以使用显微镜本身的光为细胞生长和运动提供能量。在奥林巴斯 Ix83 显微镜上,反式灯的 5-6 V 电源效果很好。这可能需要对您的系统进行反复试验。
7. 使用扫描电子显微镜 (SEM) 对细胞壁进行相关结构分析
注:可以使用 SEM 对在用细胞特异性抗体标记的活细胞中观察到的细胞壁改变特征进行成像以获得详细特征。这种相关方法可以获得可与荧光数据进行比较的超微结构数据。
- 在 1.5 mL 微量离心管中获得 1 mL 细胞悬液(对照或实验处理)。以 4,000 x g 离心 1 分钟。
- 丢弃上清液。将含有沉淀的试管浸入液氮中,如果不可用,请将其放入 -80 °C 冰箱中。冷冻细胞可以在 -80 °C 下储存数月。
- 在细胞壁处理时,从冰箱中取出试管并解冻 15 分钟。将沉淀重悬于 20 μL WHM 中,并将一滴致密细胞悬液滴在 45 mm x 50 mm 的盖玻片上。
- 将第二个盖玻片放在液滴的顶部以制作三明治。放在实验室桌子上,不断按压三明治以使细胞破裂(例如 30 秒)。
- 小心地分离玻璃盖玻片,并将破裂的细胞洗涤到 15 mL 离心管中。以 500 x g 离心 1 分钟。
- 倒出上清液。颗粒应为白色或略带绿色。如果随后的成像显示足够数量的细胞尚未破裂,请在此处对沉淀重复步骤 3。
- 在 DH2O 中重悬包含细胞壁的沉淀,并重复步骤 7.4 和 7.5。将沉淀重悬于 100 μL D-H2O 中,并将其放入 1.5 mL 离心管中。
- 获得 Cambridge 短根(半径 6 mm 或 8 mm)并将碳带 (EMS) 粘附到其表面。接下来,将 5 μL 重悬的细胞壁悬液(步骤 7)滴到碳带上。使用解剖显微镜观察细胞壁的数量。如果悬浮液太稠,请用 D-H2O 稀释。
- 将存根放入有盖的容器中并晾干(2 小时至过夜)。使用钯靶材在存根上溅射涂布 50 秒(也可以使用其他靶材)。在距离二次电子检测器 10 cm 处观察 5 kV、光斑大小的电池。
注:在将液滴沉积到碳带上之前稀释细胞壁悬液将限制细胞壁相互沉积。
结果
用抗果胶 mAb(例如 JIM5)标记 P. margaritaceum 的细胞壁揭示了形成规则图案或晶格的钙复合纤维和突起网络(图 1)。果胶沉积在细胞中心或峡部,在那里它将旧的果胶向两极移动(图 2)。用不同的果胶抗体样 JIM7 标记突出显示了峡部窄带中高甲酯化果胶的初始分泌(图 3A、B)。位于细胞壁中的其他聚合物,包括用 mAb JIM13 标记的阿拉伯半乳聚糖蛋白(图 4)。大量的 EPS 从细胞壁外部分泌(图 5),允许滑动和形成细胞聚集体。其中一些标记技术可以整合到发育研究中,包括细胞壁和细胞扩增的定量检查(图 6)。同样,使用 SEM 成像对果胶进行相关结构研究可提供详细的超微结构信息(图 7),这些信息可以与基于活细胞标记荧光的显微镜进行比较。
提供的方法为使用像 P. margaritaceum 这样的单细胞藻类进行各种类型的分析提供了基本指南。对细胞壁进行 活细胞 免疫标记和跟踪后续发育事件的能力是多细胞系统通常不允许的特殊优势。 P. margaritaceum 还提供一个细胞壁,其中果胶位于细胞外壁表面(即可直接用于显微镜检查)。对微孔板孔中的细胞进行成像和实验提供了一种快速收集数据的便捷方法。最后,将 CLSM 数据与 SEM 数据相关联的方法为将活细胞事件与超微结构信息进行比较提供了有价值的渠道。

图 1:用单克隆抗体标记果胶晶格。 JIM5 抗体的特异性是低酯化同型半乳糖醛酸。请注意细胞壁表面上的不同投影(白色箭头)。扩展区(黑色箭头)是添加新细胞壁材料的地方。 请单击此处查看此图的较大版本。

图 2:发育过程中细胞的 JIM5 标记。 细胞最初用 JIM5-TRITC (橙色和 *) 标记,并放回培养物中。24 小时后,收集细胞并用 JIM5-FITC (绿色和箭头) 标记。这个区域代表新的增长。 请单击此处查看此图的较大版本。

图 3:高酯化果胶的 JIM7 标记。 (A) 在扩增区用单克隆抗体 JIM7 (特异性:高酯化同乳糖醛酸酯) 标记高酯化果胶。请注意细胞壁表面上的窄层(白色箭头)。(B) 细胞扩增过程中细胞壁的高低酯化果胶共标记。细胞最初用 JIM5-TRITC (橙色和 *) 标记,并放回培养物中。24 小时后,收集细胞并用 JIM7-FITC (绿色和箭头) 标记。标记区域之间的暗区代表新添加的果胶(黑色箭头)。 请单击此处查看此图的较大版本。

图 4:细胞壁的阿拉伯半乳聚糖蛋白。 用单克隆抗体 JIM13 标记细胞壁表面阿拉伯半乳聚糖蛋白 (AGP)。注意 AGP 与细胞壁的松散关联(箭头)。 请单击此处查看此图的较大版本。
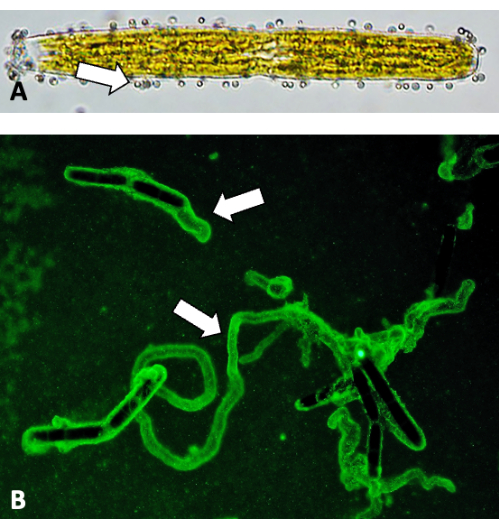
图 5:使用荧光珠对滑动轨迹进行成像。 (A) A 0.75 μm 荧光珠附着在细胞壁表面(箭头)。(B) EPS 轨迹的荧光珠结合。 请单击此处查看此图的较大版本。
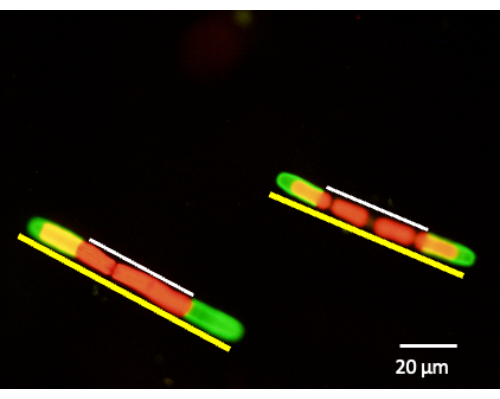
图 6:JIM5-TRITC 标记后可以进行细胞壁扩增的测量。 将细胞放回培养物中并使其生长 24 小时、48 小时和 72 小时。可以在特定时间段内去除等分试样的细胞,并使用荧光共聚焦激光扫描显微镜观察。通过测量未标记的细胞壁(白线)与整个细胞长度(黄线)来确定新生长的百分比。红色荧光是叶绿素自发荧光。 请单击此处查看此图的较大版本。

图 7:协相研究。 (A) 典型的晶格由纤维网组成,这些纤维网通常以不同的突起(箭头)向外部终止。(B) 当用大量钙处理时,晶格会变成不规则的沉积物(箭头)。JIM5 标记的细胞。(C) 当按照 (B) 中处理细胞壁并用 SEM 检查时,可以详细观察杂乱无章的果胶(箭头)。 请单击此处查看此图的较大版本。
讨论
P. margaritaceum 是一种有效的生物,用于阐明植物和链藻中细胞壁发育和 ECM 分泌的动力学。主要属性包括单细胞习性和易于培养维持和实验作、具有独特果胶晶格和其他聚合物的原代细胞壁、易于使用细胞壁定向 mAb 进行活细胞标记,可及时跟踪以进行后续开发和/或实验研究,以及产生大量 EPS,可使用荧光珠实时监测1,2,3,6.此外,大多数标记技术都提供了简单的定量测量方法。
P. maragaritaceum 是一种强大的生物体,可以适应对此处描述的方案进行一些适度的更改。但是,需要注意的是,a) 对于免疫细胞化学和实验作,使用来自不到 21 天的培养物的细胞;b) 在不高于 28 °C 的温度下培养;c) 按规定维持抗体稀释度。如果将细胞置于黑暗中,荧光 JIM5-TRITC 标记将持续数天。JIM7 标记的细胞应在 24 小时内成像。对于荧光珠标记,细胞成像最好在 24 小时内进行。对于特定实验,尤其是那些使用微孔板分析的实验,应首先测试各种浓度的试剂以找到最活跃的试剂。进行回收实验以确保试剂不会简单地改变细胞培养物的活力,这一点也很重要。
可以很容易地对所描述的方案进行简单的修改以适应研究人员的目标。许多其他抗体可用于研究尚未与 P. margaritaceum 一起尝试的细胞壁。对于特定实验,尤其是那些使用微孔板测定的实验,应首先测试各种浓度的试剂以找到最活跃的试剂。然后,可以使用基于显微镜的单个孔筛选来快速评估用荧光抗体标记的细胞的微孔板成像。进行回收实验以确保试剂不会改变细胞培养物的活力也很重要。
披露声明
未报告利益冲突。
致谢
这项工作得到了美国国家科学基金会 (NSF) (DD 的 MCB 资助号 2129443 的支持)。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcent. Tubes | Fisher Scientific | 01-549-740 | |
| 12 welled microplate | Fisher Scientific | 50-233-6077 | |
| 22 x 22 mm coverslips | Fisher Scientific | 12-541-016 | |
| 45x 50 cm coverslips | Brain Research | 4550-1.5D | |
| Agar | Sigma Aldrich | A9414 | |
| anti-rat FITC | Sigma Aldrich | F6258 | |
| anti-rat TRITC | Sigma Aldrich | T4280 | |
| calcium chloride | Sigma Aldrich | C4981 | |
| Cambbridge stubs | EMS | 75183-65 | |
| Fluoview CLSM | Evident | Fluoview 1200 | |
| JIM5 | Kerafast | ELD004 | |
| JIM7 | Kerafast | ELD005 | |
| Microcentrifuge | Fisher Scientific | 13-100-675 | |
| Micropipetors | BioRad | 1660499EDU | |
| Penium margaritaceum | Sammlung von Algenkulturen der Universität Göttingen - Culture Collection of Algae at Göttingen University | 2640 | |
| Polysphere kit | Polysciences | 18336 | |
| SEM | ThermoFisher | Quattro SEM | |
| sputter coater | EMS | Q150V | |
| Vortex mixer | Fisher Scientific | 02-215-414 |
参考文献
- Delmer, D., Dixon, R. A., Keegstra, K., Mohnen, D. The plant cell wall-dynamic, strong, and adaptable-is a natural shapeshifter. Plant Cell. 36 (5), 1257-1311 (2024).
- Bierenbroodspot, M. J., et al. Phylogeny and evolution of streptophyte algae. Ann Bot. 134 (3), 385-400 (2024).
- Domozych, D. S., et al. Endomembrane architecture and dynamics during secretion of the extracellular matrix of the unicellular charophyte, Penium margaritaceum. J Exp Bot. 71 (11), 3323-3339 (2020).
- Feng, X., et al. Genomes of multicellular algal sisters to land plants illuminate signaling network evolution. Nat Genet. 56 (5), 1018-1031 (2024).
- Jiao, C., et al. The Penium margaritaceum genome: Hallmarks of the origins of land plants. Cell. 181, 1097-1111 (2020).
- LoRicco, J. G., et al. The multifunctional roles of the extracellular matrix in the sessile life of the zygnematophyte Penium margaritaceum: stick, glide and cluster. Physiologie Plantarum. 176 (5), e14520 (2024).
- LoRicco, J. G., et al. Aberrant growth and expansion in Penium margaritaceum triggered by disruption of microtubules and the cell wall. J Exp Bot. erae387, (2024).
- LoRicco, J. G., et al. Chemically induced phenotype plasticity in the unicellular zygnematophyte, Penium margaritaceum. Protoplasma. 261 (6), 1233-1249 (2024).
- Davis, D. J., et al. Callose deposition is essential for the completion of cytokinesis in the unicellular alga, Penium margaritaceum. J Cell Sci. 133 (19), jcs.249599 (2020).
- Rydahl, M. G., et al. Penium margaritaceum as a model organism for cell wall analysis of expanding plant cells. Methods Mol Biol. 1242, 1-22 (2015).
- Carrillo-Carrasco, V. P., Hernández-García, J., Weijers, D. Electroporation-based delivery of proteins in Penium margaritaceum and other zygnematophycean algae. Physiol Plant. 175 (6), e14121 (2023).
- Nichols, H. W. Growth media-freshwater. Handbook Phycol Methods. , 16-17 (1973).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。