Method Article
Gelişmiş glikasyon son ürünleri, insan duyu benzeri nöron hücrelerini kapsaisin kaynaklı kalsiyum akışına duyarlı hale getirir
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Artan kollajen türevli ileri glikasyon son ürünleri (AGE'ler) sürekli olarak ağrılı hastalıklarla bağlantılıdır. Burada, glikasyonun duyusal nöronları kapsaisin uyarımına duyarlı hale getirip getirmediğini araştırdık.
Özet
Artan kollajen kaynaklı ileri glikasyon son ürünleri (AGE'ler) sürekli olarak osteoartrit, diyabetik nöropati ve nörodejeneratif bozukluklar dahil olmak üzere ağrılı hastalıklarla bağlantılıdır. SH-SY5Y hücre hattından farklılaşan insan duyu benzeri nöronlar, P maddesini serbest bırakarak ve geçici reseptör potansiyeli vanilloid 1 (TRPV1) ekspresyonunu yukarı regüle ederek AGE'lere maruz kaldıklarında pro-nosiseptif işlevler kazanırlar. Burada, bu reseptörün fonksiyonel olarak aktif olup olmadığını ve glikasyon işleminin duyusal nöronları kapsaisin uyarımına duyarlı hale getirip getirmediğini araştırdık. Duyusal benzeri nöron hücreleri, SH-SY5Y hücrelerinin all-trans-retinoik asit ve beyin kaynaklı nörotrofik faktör ile farklılaşmasından elde edildi. Glikasyonlu kollajen hücre dışı matriks (ECM-GC) ile inkübasyon, pro-nosiseptif bir uyaranı simüle etti. Kontrol hücreleri, glikasyona uğramamış hücre dışı kollajen matriksi (ECM-NC) ile inkübe edildi. Kapsaisin tarafından uyarılan kalsiyum akışını değerlendirmek için Fluo-8 Kalsiyum Akısı Test Kiti kullanıldı. Sonuçlar, glikasyonun normal kollajen ile tedavi edilen hücrelere kıyasla kalsiyum akışını artırdığını göstermektedir, bu da duyusal benzeri nöronların fonksiyonel TRPV1 kanallarını eksprese ettiğini ve glikasyonun kapsaisin uyarımını arttırdığını düşündürmektedir. Bu veriler, AGE'nin aşırı duyarlı duyu benzeri nöron hücrelerini gösterir ve pro-nosiseptif sinyalizasyonu tetikler. Birlikte, sonuçlarımız, ağrılı durumları yönetmek için adayları taramak için yararlı olabilecek kapsaisine yanıt veren fonksiyonel bir model oluşturduğumuzu göstermektedir.
Giriş
Glikasyon, kollajen gibi proteinlerin indirgeyici şeker moleküllerine bağlanarak ileri glikasyon son ürünleri (AGE'ler) ile sonuçlandığı enzimatik olmayan, geri dönüşü olmayan ve spontan bir süreçtir. AGE'ler, hücre dışı sinyal regüle protein kinaz (ERK) 1/2, p38 mitojenle aktive olan protein kinaz (MAPK) ve c-jun n-terminal kinazlar (JNK'ler), rho-GTPazlar, fosfoinositol-3-kinaz (PI3K), Janus kinaz / sinyal dönüştürücü ve transkripsiyon aktivatörü (JAK / STAT) ve protein kinaz C (PKC) gibi hücre içi yolların aktivasyonunu tetikleyerek hücresel zar reseptörlerini aktive edebilir, proinflamatuar moleküllerin salınımını ve oksidatif stresi artırabilir1. Glikasyonlu kollajen ayrıca hücre dışı matrisin yapısını ve özelliklerini bozar ve artan kollajen türevli AGE'ler sürekli olarak osteoartrit, diyabetik nöropati ve nörodejeneratif bozukluklar dahil olmak üzere ağrılı hastalıklarla bağlantılıdır 2,3.
Grubumuz daha önce SH-SY5Y hücre hattının, duyusal benzeri nöron hücrelerine farklılaşabileceğini göstermiştir, çünkü bu hücreler, sodyum kanalları (Nav 1.7, Nav 1.8 ve Nav 1.9) ve geçici reseptör potansiyeli vanilloid tip 1 (TRPV1) gibi nosisepsiyonda yer alan kanalları eksprese eder, tipik olarak periferik duyusal nöronlardabulunan belirteçler 4. TRPV1, kalsiyum iyonlarına geçirgen ve kapsaisin uyaranına duyarlı, seçici olmayan bir katyon kanalıdır. Daha da önemlisi, duyusal benzeri nöron hücreleri glikasyonlu kollajen matrisine (ECM-GC) maruz kaldıklarında, nöronal aktivasyonda yer alan bir transkripsiyon faktörü olan c-Fos ekspresyonunu ve nöroinflamasyon ve ağrıda yaygın olarak yer alan bir nöropeptit olan P maddesi salınımını artırarak pro-nosiseptif işlevler kazanırlar. Bu hücreler, morfin, prototip opiat gibi analjeziklere yanıt vererek ECM-GC'nin neden olduğu madde P salınımını azaltır. Birlikte, bu veriler bu modelin pro ve anti-nosiseptif bir moleküle(4,5) duyarlı olduğunu göstermektedir.
Hücre içi Ca2+ konsantrasyon değişikliklerinin izlenmesi, çok sayıda hücresel süreci incelemek için gereklidir. Nöronlarda, nöronal hasarı ve ilaçların nöroprotektif özelliklerini tahmin etmek için yararlı bir araç olabilir. Acı biberlerin keskin aktif bileşeni olan kapsaisin, TRPV1 reseptörü5'in en çok çalışılan agonistidir ve ağrı mekanizmalarını incelemek ve potansiyel yeni analjezikleri taramak için değerli bir araçtır. Önceki çalışmalar, yüksek glikoz ile inkübe edilen kemirgenlerin dorsal kök gangliyonlarından elde edilen birincil duyusal nöronların, kapsaisin kaynaklı kalsiyum akışında önemli bir artış gösterdiğini göstermiştir6. Bununla birlikte, TRPV1 kanalının hücre modelimizde işlevsel olarak aktif olup olmadığı ve glikasyonlu kollajenin duyusal benzeri nöron hücrelerini, nosiseptif sinyal yollarını aktive edebilen kapsaisin uyarımına duyarlı hale getirip getirmediği bilinmemektedir. Bu nedenle, güvenilir analiz sağlarken duyusal benzeri hücrelerde gerçek zamanlı kalsiyum izleme için basit araçlar kullanan uygun maliyetli bir protokol geliştirmeyi amaçladık. Burada, araştırmacıların duyusal benzeri nöron hücrelerindeki SH-SY5Y hücrelerini ayırt etme adımlarından geçmelerine ve bunları pro-nosiseptif uyaranlara nasıl duyarlı hale getireceklerine yardımcı olmak için kapsamlı bir protokol sunuyoruz. Bu yöntem, yeni analjezik veya nöroprotektif bileşiklerin keşfine katkıda bulunabilir.
Protokol
1. SH-SY5Y kültürü ve duyu benzeri nöron hücrelerine farklılaşma
NOT 1: Bu bölümde yer alan tüm adımların laminer akış başlığı altında yapılması ve tüm solüsyonların ve sarf malzemelerinin steril olması gerekir.
- İlk olarak, 5 mL kültür ortamı ekleyerek bir kültür şişesi (25cm2) hazırlayın.
NOT: Bu hücre tipinin çözülmesi, genişletilmesi ve bakımı için bir kültür ortamı karışımı kullanın: Dulbecco Modifiye Eagle's and Ham's Medium F12 (DMEM / F12), %10 ısıyla inaktive edilmiş fetal sığır serumu ve %1 penisilin-streptomisin ile desteklenmiştir. - Ardından, SH-SY5Y hücrelerini içeren kriyotüpü sıvı nitrojenden çıkarın ve buz üzerinde tutun. Hücreleri 37 °C'de 2 dakika su banyosunda çözdürün.
- Kriyoviyal için 1 mL tam kültür ortamı ekleyin, hücreleri 15 mL'lik bir tüpe aktarın, 3 mL tam kültür ortamı ekleyin (% 10 ısıyla inaktive edilmiş fetal sığır serumu ile desteklenmiş DMEM / F12) ve tekrar tekrar çekerek karıştırın ve bir pipet kullanarak tüpe geri dağıtın.
- Hücreleri 15 mL'lik tüpe pipetleyin ve 290 g'da santrifüjleyin. Hücrelerin dondurulması sırasında buz kristali oluşumunu önlemek için kullanılan kriyoprotektif bir ajan olan dimetil sülfoksiti (DMSO) çıkarmak için süpernatanı atın.
- Hücre peletine 1 mL kültür ortamı ekleyin, bir pipet kullanarak iyice karıştırın ve hücreleri genişletmek için 25cm2'lik bir kültür şişesine yerleştirin. Hücreleri 37 ° C'de% 5 CO2 içeren nemlendirilmiş bir atmosferde bir inkübatöre yerleştirin.
NOT: Hücreler yaklaşık% 80 birleşmeye ulaştıklarında kullanılabilir. Nöronal farklılaşma için, hücre geçişi yirmisine kadar SH-SY5Y hücrelerinin kullanılması önerilir. - Sıçan kuyruğu tip I kollajeni steril PBS'de seyrelterek hücre dışı kollajen matrisini (100 μg/mL) hazırlayın ve bu solüsyonun 1 mL'sini bir kaplama için bir Petri kabına (35/10 mm) dökün.
- Bunu bir inkübatörde% 5CO2 içeren nemlendirilmiş bir atmosferde yaklaşık 1 saat inkübe edin.
- Bu süreden sonra, plakayı steril PBS ile iki kez yıkayın, ardından Neubauer odasını kullanarak hücreleri sayın.
- Hücreleri saymak için, önce hücreyi içeren 25cm2'lik kültür şişesini 5 mL steril PBS ile yıkayın ve tüm kültür ortamını çıkarın. Daha sonra steril PBS'yi çıkarın, hücrelere 3 mL% 0.05 tripsin ekleyin ve hücre ayrılmasını tamamlamak için yaklaşık 3-5 dakika boyunca 37 ° C ve% 5 CO2'de bir inkübatöre yerleştirin.
- Bundan sonra, hücreleri inkübatörden çıkarın, kültür şişesine 6 mL kültür ortamı ekleyin ve bu çözeltiyi 15 mL'lik bir tüpe aktarın. 290 g'da 5 dakika santrifüjleyin.
- Süpernatanı çıkarın ve hücreleri 1 mL tam kültür ortamında iyice yeniden süspanse edin.
- Son olarak, bir Neubauer sayma odası kullanarak hücreleri sayın. 20 μL hücre ve 20 μL tripan mavisi karıştırın ve bu karışımın 10 μL'sini bir Neubauer odasına ekleyin. Mavi renkte lekelenmeyen canlı hücreleri sayın.
- Plaka 5 × 10 Daha önce tarif edilen aynı kültür ortamı üzerinde bir Petri kabında (35/10 mm)4 hücre/mL hücre. Plaka başına toplam 1 mL hacim kullanın.
- Ardından, nöronal farklılaşma protokolünü başlatmak için 24 saat bekleyin. Bunun için kültür ortamını çıkarın ve %2 ısıyla inaktive edilmiş fetal sığır serumu, %1 penisilin-streptomisin ve 10 μM all-trans retinoik asit (RA 10 μM) ile takviye edilmiş 1 mL DMEM/F12 ile değiştirin.
- 48 saat bekleyin ve kültür ortamını 3 gün boyunca her gün değiştirin. Hücreleri 37 ° C'de% 5 CO2 içeren nemlendirilmiş bir atmosferde bir inkübatöre yerleştirin.
- Beşinci günde, ortamı hücrelerden çıkarın ve her plakaya insan beyninden türetilmiş nörotrofik faktör (BDNF 50 ng / mL) ile takviye edilmiş 1 mL serumsuz kültür ortamı ekleyin.
NOT: Farklı şirketlerden BDNF (malzeme tablosuna bakınız) test edilmiştir. Hepsi aynı şekilde çalıştı. - Farklılaşmanın yedinci gününde, hücreleri bir kez steril PBS ile yıkayın ve deneyler için duyusal benzeri nöron hücreleri kullanın. Bu hücreleri deneyler için hemen kullanmak mümkün değilse, kullanıma kadar canlı tutmak için serum içermeyen bir kültür ortamı ekleyin.
NOT: Nöronal farklılaşmanın sonunda, hücre toksisitesini önleyerek kalan BDNF'yi çıkarmak için hücreleri steril PBS ile yıkamak gerekir.
2. Glikasyonlu kollajen ve glikasyon süreci
NOT: Bu bölümdeki tüm adımlar laminer akış başlığı altında yapılmalı ve tüm solüsyonlar ve sarf malzemeleri steril olmalıdır.
- Sıçan kuyruğu fibriller durumundan (3.89 mg / mL) 200 mM D-riboz, 160 mM D-glikoz ve 200 mM D-treoz ile 7 gün boyunca 4 gün boyunca inkübe ederek kollajen glikasyonunu hazırlayın.
NOT: Glikasyonlu kollajen hazırlamak için, şekerleri moleküler ağırlıklarına göre tartın ve sıçan kuyruğu fibriller durumundan (3.89 mg / mL) kollajen tip I ile karıştırın. - Serum ve antibiyotik takviyesi olmadan DMEM/F12 kültür ortamında hazırlanan glikasyonlu kollajen hücre dışı matris (ECM-GC, 100 μg/mL) veya normal kollajen hücre dışı matris (ECM-NC, 100 μg/mL) ile duyusal benzeri nöron hücre kültürünü 24 saat inkübe edin.
3. Kalsiyum akışı testi
- Kalsiyum akışı için, kalsiyum akışı test kitini kullanın ve çözeltileri aşağıda belirtildiği gibi üreticinin talimatlarına göre hazırlayın.
- İlk olarak, 998 μL 1x tahlil tamponuna (HBSS tamponu ve 10x Pluronic F127 Plus karışımı) 2 μL Fluo-8 stok çözeltisi ekleyerek 1 mL Fluo-8 boya yüklemesi hazırlayın.
NOT: Bu çalışma çözümü, oda sıcaklığında (RT) en az 2 saat stabildir. - Daha sonra, bu çözeltinin 250 μL'sini, daha önce farklılaştırılmış ve ECM-NC veya ECM-GC ile muamele edilmiş duyusal benzeri nöron hücrelerinin her bir plakalı kabında, 37 ° C'de% 5 CO2 nemlendirilmiş bir atmosferde 30 dakika boyunca inkübe edin. Ardından, çanağı kuluçka makinesinden çıkarın ve 30 dakika boyunca RT'de (karanlıkta) tutun.
NOT: 2 saatlik inkübasyon tahmin edilirse bu çözelti sitotoksik hale gelir. Kuluçka süresi boyunca kapsaisin çözeltisini hazırlayın.
4. Kapsaisin indüksiyonu
NOT: Bir TRPV1 agonisti olan kapsaisin, hücrelerde kalsiyum akışını indüklemek için kullanıldı.
- Kapsaisini% 1 etanol ve ultra saf su içinde tartın ve seyreltin. Daha sonra, aynı zamanda ultra saf suda seyreltilmiş olan 2 μM'lik bir konsantrasyonda bir çözelti hazırlayın.
NOT: Kapsaisin çözeltisi kullanım gününde yapılmalıdır. Kapsaisini önce etanolde ve sonra suda seyreltin; aksi takdirde çökelir. - Her 35/10 mm'lik Petri kabına 250 μL 2 μM kapsaisin çözeltisi ekleyin, böylece nihai konsantrasyon 1 μM olur.
NOT: Daha iyi dağılım sağlamak ve izole edilmiş floresan tepe noktalarından kaçınmak için kapsaisin stok çözelti konsantrasyonu 2 μM idi.
5. Kalsiyum akışı görüntüleme ve konfokal mikroskopi analizi
NOT: Görüntüleme, 20x/0.75NA objektif ve 488 nm uyarma lazeri (%0.5 yoğunluk) ile donatılmış konfokal mikroskopta gerçekleştirildi. Emisyon 520 nm'de tespit edildi. Hücreler, xy eksenlerinde (512 x 512 piksel) zaman içinde (t) 600 Hz hızında, 433 ms'lik bir edinme aralığı ve toplam 5 dakikalık bir edinme süresi ile tarandı. Mikroskopi yazılımı kullanılarak hücrelerin fizyolojik durumunu korumak için görüntüleme 37 °C'de yapıldı.
- 250 μL 2 μM kapsaisin çözeltisi içeren bir şırınga hazırlayın (plakadaki son konsantrasyon 1 μM olacaktır) ve bunu bir kafa derisi damar setine bağlayın - Kelebek tipi 23 GA steril. Şırıngayı bir laboratuvar standı ve kelepçe kullanarak sabitleyin.
- Petri kabını mikroskop aşamasına koyun ve çok dikkatli bir şekilde kafa derisi iğnesini Petri kabına yerleştirin, alt kısımla temastan kaçının, iğnenin ucu sıvıya batırılmamalıdır.
NOT: Kafa derisi pozisyonunu sabitlemek için yapışkan bir bant kullanılabilir. - Yeterli sayıda hücreye (20'den fazla) sahip bir alan bulun ve parlak alan ışığını kullanarak odağı ayarlayın.
- 488 nm lazerle Canlı modu başlatın ve odak ve aydınlatma parametrelerini ayarlayın.
- Edinme kaydını başlatın ve başlangıç süresinden sonra (t = 0 ila t = 60 saniye), 250 μL 2 μM kapsaisin uygulayın ve hücrelere kalsiyum akışını uyarmak için şırınga pistonunu hafifçe itin.
NOT: Son kayıt alma süresi plaka başına yaklaşık 300 s idi.
6. İşlem sonrası/veri analizi
- Kantifikasyon modunda mikroskopi yazılımını kullanarak hücre analizini gerçekleştirin. İlk olarak, kapsaisin uyaranından önce ve sonra floresan spike hücrelerini analiz edin.
- Her duyarlı hücrede bir ilgi alanı (ROI) oluşturun, yani kapsaisinden sonra bir floresan artışı gösteren hücreler. Yukarıda gösterildiği gibi tüm hücre alanında ROI çizdiğinizden emin olun (Şekil 1).
- Sonraki çözümleme için verileri virgülle ayrılmış değerler (CSV) dosyasında dışa aktarın.
- Alternatif olarak, ücretsiz olarak sunulan FIJI7 (https://fiji.sc) yazılımını kullanarak analizi gerçekleştirin.
- Görüntü dosyalarını açmak için, Dosya > İçe Aktar > Biyo-Formatlar'a gidip dosyayı seçerek Bio-Formats eklentisini kullanın.
- Ardından, yakınlaştırmak için Büyüteç aracını ve duyarlı hücrelerin etrafına bir İlgi Alanı (ROI) çizmek için Serbest El Seçimi aracını kullanın.
- Her bir ROI'yi çizdikten sonra, ROI Yöneticisi'ne eklemek için T tuşuna basın. İlgilendiğiniz tüm hücreler için bu işlemi tekrarlayın (Şekil 2).
- Tüm ROI'ler eklendikten sonra, ROI Yöneticisi penceresine gidin, tüm ROI'leri seçin ve ardından ana menüde Analiz Et > Ölçümleri Ayarla'ya gidin.
- Ardından, ROI Yöneticisi'ne dönün ve tüm karelerdeki yoğunluğu ölçmek için Daha Fazla > Çoklu Ölçüm'ü seçin. Sonuçlar yeni bir pencerede görünecektir; Dosya > Farklı Kaydet'e giderek CSV dosyası olarak dışa aktarın.
NOT: CSV dosyası Excel, Google E-Tablolar ve GraphPad yazılımında analiz edilebilir. Fluo-8 Kalsiyum Akısı Test Kiti ile elde edilen floresan yoğunluğu değerlerini kalsiyum akışı değişiminin göreceli bir ölçüsüne dönüştürmek için ΔF/F0 = (F(t) - F0)/F0 denklemini kullanın. Burada, F0 , kapsaisin ile stimülasyondan önce t = 0 s ile t = 60 s arasında yakalanan görüntülerden elde edilen ortalama yoğunluk olarak hesaplanan temel floresansı temsil eder. F(t), uyarandan sonra gözlemlenen maksimum floresan yoğunluğunun değeridir ve bu, en yüksek kalsiyum akışının değerlendirilmesine izin verir. Bu yaklaşım, ΔF/F0'daki bir artışın hücre içi kalsiyum seviyesinin yükseldiğini gösterdiği taban çizgisine göre floresanstaki artışı vurgular.
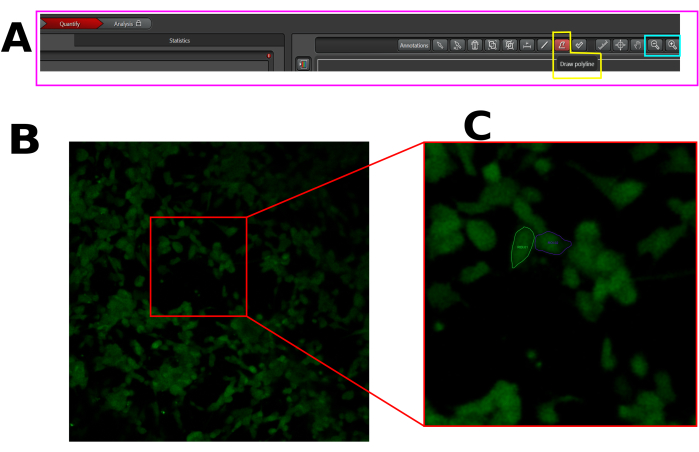
Şekil 1: LAS X yazılımında kalsiyum akışı analizi için seçilen hücrelerdeki ROI örneği. (A) Niceleme modunda LAS X arayüzü. Pembe dikdörtgen, niceleme sekmesini gösterir. Sarı dikdörtgen çoklu çizgi çizme aracını, camgöbeği dikdörtgen ise uzaklaştırma ve yakınlaştırma araçlarını gösterir. (B) Görüş alanı (FOV) yakalandı. (C) Tüm hücrede ROI çizimini kolaylaştırmak için FOV'u yakınlaştırın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
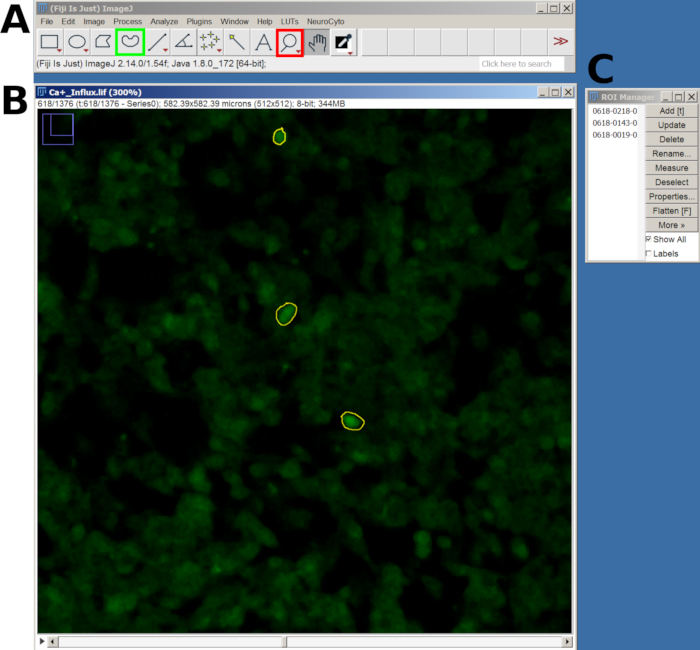
Şekil 2: FIJI yazılımında kalsiyum akışı analizi için seçilen hücrelerdeki ROI örneği. (A) Ana menüyü ve aracı gösteren FIJI arayüzü. Kırmızı kare büyüteç aracını, yeşil kare ise Serbest El seçimini gösterir. (B) Yakınlaştırma ve çizilmiş bir ROI ile yakalanan görüş alanı (FOV). (C) ROI yöneticisi penceresi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
7. Sorun Giderme
- Görüntü odak dışındaysa, aşağıdakileri deneyin:
- Bandın yapışmasını kontrol edin; Gevşemişse, bu iğnenin kaymasına ve odağı etkilemesine neden olabilir.
- Daha fazla stabilite için iğneyi ek bantla yeniden takın.
- Standart iğnelerin değiştirilmesi. Plaka üzerindeki hizalamayı iyileştirmek için önceden bükülmüş diş iğne uçları kullanın.
- Hücreler doymuş bir sinyal sergiliyorsa, aşağıdaki adımları deneyin:
- Lazer yoğunluğunu azaltın ve ayarları kazanın.
- Reaktif inkübasyon süresini doğrulayın. Üreticinin tavsiyesini aşarsa, sinyal doygunluğuna yol açarak kalsiyum akışı tespitini zorlaştırabilir.
- Sorun giderme için şu ek önerileri izleyin:
- Düzenli Kalibrasyon: Odak ve sinyal algılama kalitesini korumak için görüntüleme ekipmanının düzenli olarak kalibre edildiğinden emin olun.
- Belge değişiklikleri: İleride başvurmak ve sorun gidermeyi kolaylaştırmak için protokolde yapılan tüm ayarlamaların kaydını tutun.
- Reaktif ayarlamalar: Sorunlar devam ederse, farklı reaktif konsantrasyonları veya alternatif sinyal algılama yöntemleriyle test etmeyi düşünün.
Sonuçlar
SH-SY5Y hücrelerinin duyu benzeri nörona farklılaşması
Yüksek içerikli tarama görüntüleri, nöronal farklılaşma protokolünün SH-SY5Y hücre morfolojisini değiştirdiğini göstermektedir. Duyusal benzeri nöron hücreleri (farklılaşmış hücreler), geniş bir nörofilament ağını yansıtan yuvarlak bir hücre gövdesi sergiler. Olgun nöron özellikleriyle tutarlı olan çevredeki nöronları birbirine bağlayan daha uzun nörit çıkıntılarının dallarını oluştururlar (Şekil 3)4. Daha da önemlisi, bu hücreler, farklılaşmamış SH-SY5Y hücrelerine kıyasla daha yüksek TRPV1 seviyeleri gösterir (Şekil 4).
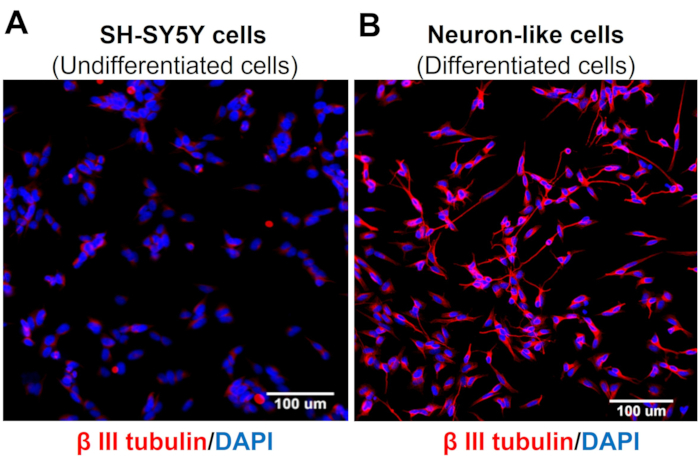
Şekil 3: Farklılaşmamış ve farklılaşmış hücrelerde β-III tübülin ekspresyonu. (A) farklılaşmamış hücrelerde (SH-SY5Y hücreleri) ve (B) farklılaşmış hücrelerde (duyusal nöron benzeri hücreler) spesifik nöronal belirteçlerin (β-III tübülin) Yüksek İçerikli Tarama (Moleküler Cihazlar, San Jose, CA, EUA) immünofloresan görüntüleri. Beş alanın temsili görüntüleri. Büyütme: 20x. Ölçek çubuğu: 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
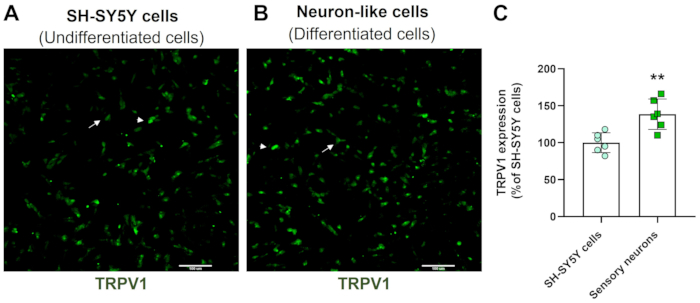
Şekil 4: Farklılaşmamış ve farklılaşmış hücrelerde TRPV1 ekspresyonu. (A) farklılaşmamış hücrelerde (SH-SY5Y hücreleri) ve (B) farklılaşmış hücrelerde (duyusal nöron benzeri hücreler) TRPV1 ekspresyonunun HCS immünofloresan görüntüleri. Dört alanın temsili görüntüleri. Ok, düşük ifadeli TRPV1 hücrelerini etiketler ve ok ucu, yüksek ifadeli TRPV1 hücrelerini etiketler. Büyütme: 10x. Ölçek çubuğu: 100 μm. (C) SH-SY5Y hücrelerinde ve duyusal nöronlarda TRPV1 ekspresyonunun nicelleştirilmesi. Eşlenmemiş Öğrenci t-testi, **p<0.005 EMC-NC ile karşılaştırıldığında, n= 6. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Duyusal benzeri hücrelerle etkileşime giren kollajen glikasyonu, ağrılı bir mikro çevreyi taklit eder4. Burada, glikasyonlu kollajenin, normal kollajen ile tedavi edilen hücrelerle karşılaştırıldığında, kapsaisin kaynaklı kalsiyum akışını arttırdığını gösterdik (Şekil 5). Bu sonuçlar, AGE'lerin kapsaisin ile uyarılmış akımları artırmak için yeterli olduğunu göstermektedir.
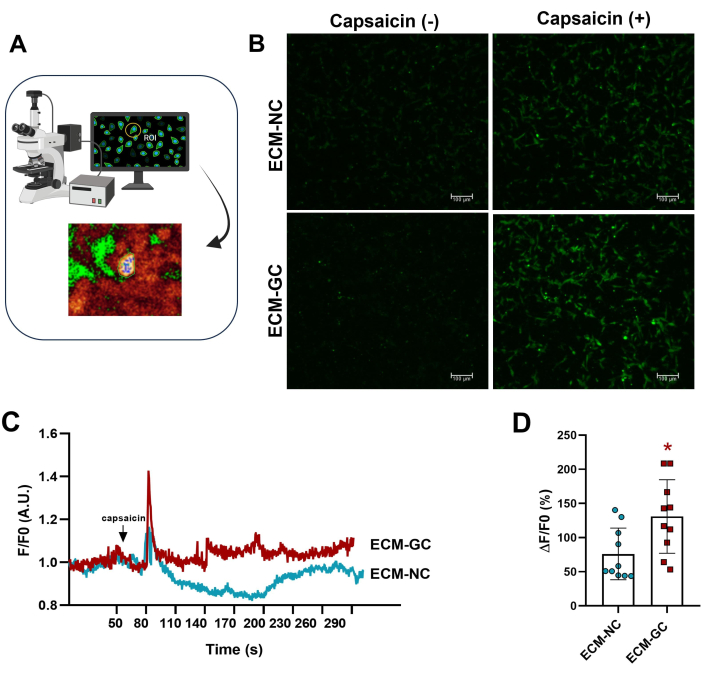
Şekil 5: Hücre içi kalsiyum ölçümleri. (A) İlgilenilen floresan bölgesinin (ROI) belirlenmesi. (B-D) Kalsiyum akışı, kapsaisin uygulamasından önce ve sonra artan floresan ile gösterilir (1 μM, son konsantrasyon). Ok, kapsaisin uygulamasını gösterir. Hücre içi kalsiyumdaki artışlar ΔF/F0 (F0 bazal floresandır) olarak belirlendi. Eşleştirilmiş Öğrenci t-testi (Wilcoxon eşleştirilmiş çiftler), *p < ECM-NC ile karşılaştırıldığında 0.05, n= 10 hücre. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Nosiseptörler, ağrıya aracılık eden duyusal nöronların özel alt kümeleridir. Bu hücreler, aktivasyonu kalsiyum akışına ve nosiseptif iletimi düzenleyen nöropeptitlerin ve nörotransmiterlerin salınmasına yol açan TRPV1 gibi voltaj kapılı ve ligand iyon kanallarını eksprese eder. Burada, kapsaisin kaynaklı kalsiyum akışınıdeğerlendirmek için SH-SY5Y'yi duyu benzeri nöron hücrelerine ayırmak için bir protokol açıklıyoruz 8,9. Daha da önemlisi, glikasyonlu kollajen ile pro-nosiseptif bir ortamı taklit ederek, kapsaisin kaynaklı kalsiyum akışında bir yukarı regülasyon olduğunu gösterdik, bu da TRPV1 kanallarının işlevsel olduğunu ve AGE'lerin zararlı bir uyarana duyarlılıklarını artırarak bu kanalları hassaslaştırabileceğini gösterdik.
Duyusal nöronlardaki kalsiyum akışını değerlendirmek, analjezik adayları taramak için değerli bir araç olmuştur10. Fluo-8 gibi kararlı kalsiyum boyalarının geliştirilmesi ile moleküler kalsiyum indikatörlerinin tasarımında ilerleme kaydedilmiştir. Fluo-8 (yıkama yöntemi yok), artan parlaklık, oda sıcaklığında çalışma ve daha düşük kalsiyum konsantrasyonlarına karşı daha yüksek hassasiyet gösterme gibi diğer floresan boyalara göre avantajlara sahiptir. Bu protokolde kapsaisin saçlı deri damar setinden uygulandı. Önceden, normal bir pipet kullanıyorduk, ancak bu pipet genellikle hücre plakasının yerini alıyor ve görüntü alımını kesintiye uğratıyordu. Başka bir olasılık, kapsaisini yavaşça vermek için bir perfüzyon pompası kullanmak olabilir. İlginç bir şekilde, bu protokoldeki yaklaşım, herhangi bir laboratuvarda uygulanabilen, kolayca bulunabilen ve uygun maliyetli bileşenleri kullanır ve kalsiyum akışını izlemek için geleneksel perfüzyon odalarına göre önemli bir avantaj sağlar. Ayrıca, burada açıklanan aparat, araştırma ortamlarında yaygın olarak kullanılan çoğu floresan mikroskobu ile evrensel olarak uyumludur ve özel ekipman veya modifikasyon ihtiyacını ortadan kaldırır. Bu uyarlanabilirlik, çeşitli görüntüleme konfigürasyonları arasında sorunsuz entegrasyonu kolaylaştırarak, gelişmiş kalsiyum görüntüleme tekniklerinin, özellikle sınırlı bütçeli laboratuvarlarda daha geniş bir laboratuvar yelpazesine erişilebilirliğini artırır. Bununla birlikte, otomatik floresan ölçümlerinin tezgah üstü çok modlu mikroplaka okuyucusundan farklı olarak, burada açıklanan yöntemin bir sınırlaması, daha fazla zaman alan yüksek çözünürlüklü görüntüleme ekipmanı ve manuel pipetleme gerektirmesidir. Bununla birlikte, konfokal mikroskopi, düşük floresan emisyonunu tespit etme avantajına sahiptir.
Duyusal nöronları incelemek için yöntemler çoğunlukla birincil hücre kültürü veya pluripotent kök hücreler (iPS) kullanır. Birincil insan duyusal nöronlarına nadiren erişilebilir ve iPS üretmek emek yoğundur ve pahalı reaktifler ve uzman teknisyenler gerektirir. Bu nedenle, SH-SY5Y'yi, sağlam bir insan nöronunun fizyolojik özelliklerini tamamen korumayan nöronal hücrelere farklılaştırmakla ilgili sınırlamaya rağmen, morfolojik olarak birincil nöronlara 9,10 benzerler ve sodyum kanallarının ekspresyonu, P maddesi salınımı ve kapsaisin ve morfine yanıt verme gibi önemli özellikleri korurlar 4,11,12,13.
Ağrı karmaşık bir durumdur ve kültürlenmiş nöron uyarımını bozan ilaçlar bulmak ağrı hissini engellemek için yeterli olmayabilir. Bununla birlikte, morfinin glikasyonlu kollajen kaynaklı madde P salınımını azalttığını gösteren önceki veriler, modelimizin yeni analjezik moleküller bulmak için yararlı olduğunu düşündürmektedir. Ayrıca, burada, glikolize edilmiş kollajenin, nöronları kapsaisin kaynaklı kalsiyum akışına karşı aşırı duyarlılaştırmak için yeterli olduğunu gösteriyoruz, bu da AGE'lerin varlığında kalsiyum görüntülemenin ağrılı enflamatuar ve dejeneratif hastalıklar için yeni terapötik bileşiklerin araştırılmasında yararlı olabileceğini gösteriyor. Dikkat çekici bir şekilde, nöronlarda Ca2+ görüntüleme için standart bir konsantrasyonolan Ca 2+ akışını indüklemek için 1 μM kapsaisin kullandık 8,14,15. Bununla birlikte, deney koşullarını optimize etmek için gelecekteki çalışmalarda bir doz-yanıt eğrisi yapılmalıdır.
Kalsiyum akışını değerlendirmek için burada açıklanan yöntem, nöron benzeri hücrelerin ötesinde daha geniş uygulamalara sahip olabilir. Birincil duyusal hücre kültürleri için de uygundur ve kardiyomiyositler ve makrofajlar gibi diğer hücre tipleri için uyarlanabilir. Ayrıca, glikasyon kollajeninin yaşlanma ile birlikte ve diyabetik komplikasyonlar gibi patolojik durumlarda ortaya çıktığı göz önüne alındığında, bu yaklaşım böbrek hastalığı ve oküler bozuklukların araştırılması için değerli bir araç olarak hizmet edebilir.
Protokolümüzdeki birincil değişiklik, standart iğnenin önceden bükülmüş diş iğne uçlarıyla değiştirilmesidir. Bu kavisli iğneler, plaka üzerinde daha iyi ayarlama yapılmasına olanak tanır, kullanımı en aza indirir, gereken yapışkan bant miktarını azaltır ve ucun plakanın altına temas etme riskini azaltır.
İşlem sırasında oluşabilecek bazı problemler ve çözümleri protokolün 7. bölümünde detaylandırılmıştır. Plaka üzerindeki iğneyi ayarladıktan sonra görüntü odak dışındaysa, yapışkan bantların gevşeyip gevşemediğini ve iğnenin plakayı kaydırmasına neden olup olmadığını kontrol edin. Daha iyi stabilite için iğnenin ek bantla yeniden takılması önerilir. Hücreler doymuş sinyaller sergiliyorsa, lazer yoğunluğunu azaltmaya ve parametreler kazanmaya çalışılmalıdır. Reaktif inkübasyon süresini doğrulayın. Deneyimlerimiz, inkübasyon süresi üreticinin tavsiyesini aşarsa, sinyalin aşırı derecede yoğunlaştığını ve bunun da kalsiyum akışı tespitini engelleyebileceğini göstermektedir. Sıvı enjeksiyonundan sonra beklenmedik floresan zirveleri ve hücre ayrılması için, ani floresan artışlarını önlemek ve hücre yapışmasını bozmamak için sıvının yavaşça enjekte edilmesi gerekir. Hızlı enjeksiyonlar türbülans oluşturarak geçici sinyal artefaktlarına ve hücrelerin kuyu dibinden ayrılmasına neden olabilir.
Açıklamalar
MCB, AMCT ve VOZ, osteoartrit ağrısında (BR102018008561-1) yer alan moleküler varlıkların tanımlanması sürecinde bir patente sahiptir.
Teşekkürler
Bu çalışma, 2015/50040-4 ve 2020/13139-0 numaralı Fundação Amparo à Pesquisa do Estado de São Paulo FAPESP Hibe numarası, São Paulo Araştırma Vakfı ve GlaxoSmithKline, FAPESP 2022/08417-7 ve 2024/04023-0 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| All-trans retinoic acid | Tocris | 695 | |
| BDNF | Tocris | TOCR-2837 | |
| BDNF | Sigma-Aldrich | B3795 | |
| Butterfly type 23GA sterile | Beckton Dickinson Asepto | 38833814 | Scalp vein set |
| Capsaicin | Sigma-Aldrich | M2028 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| DMEM/F12 | Gibco | 12500062 | Basal medium |
| D-ribose | Sigma-Aldrich | R7500 | |
| D-threose | Sigma-Aldrich | T7392 | |
| Fluo-8 Calcium Flux Assay Kit | Abcam | ab112129 | No wash |
| Heat-inactivated fetal bovine serum | Gibco | A5670801 | |
| High Content Screening | Molecular Devices | ||
| LASX software | Leica Microsystems | Microscopy software | |
| Leica TCS SP8 | Leica Microsystems | Leica TCS SP8 | Confocal microscope |
| Penicillin-streptomycin | Gibco | 15140130 | |
| Petri dish (35/10 mm) | Greiner bio-one | 627965 | |
| Rat tail type I collagen | Corning | 354236 | |
| SH-SY5Y | Merck | 94030304-1VL | Neuroblastoma cell line |
Referanslar
- Bierhaus, A., et al. Understanding RAGE, the receptor for advanced glycation end products. J Mol Med. 83 (11), 876-886 (2005).
- Hudson, B. I., et al. Blockade of receptor for advanced glycation endproducts: A new target for therapeutic intervention in diabetic complications and inflammatory disorders. Arch Biochem Biophys. 419 (1), 80-88 (2003).
- Dandia, H., Makkad, K., Tayalia, P. Glycated collagen - a 3D matrix system to study pathological cell behavior. Biomater Sci. 7 (8), 3480-3488 (2019).
- Bufalo, M. C., et al. Human sensory neuron-like cells and glycated collagen matrix as a model for the screening of analgesic compounds. Cells. 11 (2), 247 (2022).
- Frias, B., Merighi, A. Capsaicin, nociception and pain. Molecules. 21 (6), 797 (2016).
- Lam, D., et al. RAGE-dependent potentiation of TRPV1 currents in sensory neurons exposed to high glucose. PLoS One. 13 (2), e0193312 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Li, F., et al. TRPV1 activity and substance P release are required for corneal cold nociception. Nat Commun. 10 (1), 5678 (2019).
- Mickle, A. D., Shepherd, A. J., Mohapatra, D. P. Sensory TRP channels:the key transducers of nociception and pain. Prog Mol Biol Transl Sci. 131, 73-118 (2015).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiol Pain. 11, 100083 (2022).
- Vetter, I., et al. Characterisation of Nav types endogenously expressed in human SH-SY5Y neuroblastoma cells. Biochem Pharmacol. 83 (11), 1562-1571 (2012).
- Dekker, L. V., et al. Analysis of human Nav1.8 expressed in SH-SY5Y neuroblastoma cells. Eur J Pharmacol. 528 (1-3), 52-58 (2005).
- Lam, P. M. W., Hainsworth, A. H., Smith, G. D., Owen, D. E., Davies, J., Lambert, D. G. Activation of recombinant human TRPV1 receptors expressed in SH-SY5Y human neuroblastoma cells increases [Ca2+]i initiates neurotransmitter release and promotes delayed cell death. J Neurochem. 102 (3), 801-811 (2007).
- Koplas, P. A., Rosenberg, R. L., Oxford, G. S. The role of calcium in the desensitization of capsaicin responses in rat dorsal root ganglion neurons. J Neurosci. 17 (10), 3525-3537 (1997).
- Tominaga, M., et al. The cloned capsaicin receptor integrates multiple pain-producing stimuli. Neuron. 21 (3), 531-543 (1998).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır