Method Article
תוצרי קצה מתקדמים של גליקציה מרגישים תאי עצב דמויי חישה אנושיים לזרם סידן המושרה על ידי קפסאיצין
* These authors contributed equally
In This Article
Summary
תוצרי גליקציה מתקדמים מוגברים שמקורם בקולגן (AGEs) קשורים באופן עקבי למחלות כואבות. כאן, חקרנו אם גליקציה מרגישה נוירונים חושיים לעירור קפסאיצין.
Abstract
תוצרי גליקציה מתקדמים מוגברים שמקורם בקולגן נקשרים באופן עקבי למחלות כואבות, כולל דלקת מפרקים ניוונית, נוירופתיה סוכרתית והפרעות ניווניות. נוירונים דמויי חושים אנושיים המובחנים מקו התאים SH-SY5Y משיגים פונקציות פרו-נוסיספטיביות כאשר הם נחשפים ל-AGEs על ידי שחרור חומר P וויסות ביטוי פוטנציאלי לקולטן חולף ונילואיד 1 (TRPV1). כאן, חקרנו אם קולטן זה היה פעיל מבחינה תפקודית והאם תהליך הגליקציה רגיש לנוירונים חושיים לעירור קפסאיצין. תאי עצב דמויי תחושה התקבלו מהתמיינות של תאי SH-SY5Y עם חומצה טרנס-רטינואית וגורם נוירוטרופי שמקורו במוח. דגירה עם מטריצה חוץ-תאית של קולגן מסוכרר (ECM-GC) דימתה גירוי פרו-נוציספטיבי. תאי הביקורת הודגרו עם מטריצת קולגן חוץ-תאית לא מסוכררת (ECM-NC). ערכת בדיקת שטף הסידן Fluo-8 שימשה להערכת זרם הסידן, שעורר על ידי קפסאיצין. התוצאות מראות כי גליקציה מגבירה את זרם הסידן בהשוואה לתאים שטופלו בקולגן רגיל, מה שמצביע על כך שתאי עצב דמויי חוש מבטאים תעלות TRPV1 פונקציונליות וכי גליקציה מגבירה את עירור הקפסאיצין. נתונים אלה מצביעים על תאי עצב דמויי חוש רגישים יתר על המידה של AGE, המפעילים איתות פרו-נוסיספטיבי. יחד, התוצאות שלנו מצביעות על כך שיצרנו מודל פונקציונלי המגיב לקפסאיצין שיכול להיות שימושי לסינון מועמדים לניהול מצבים כואבים.
Introduction
גליקציה היא תהליך לא אנזימטי, בלתי הפיך וספונטני שבו חלבונים, כגון קולגן, נקשרים למולקולות סוכר מפחיתות, וכתוצאה מכך תוצרי קצה מתקדמים של גליקציה (AGEs). AGEs עשויים להפעיל קולטני ממברנה תאית, ולהפעיל מסלולים תוך-תאיים, כגון חלבון קינאז מווסת אותות חוץ-תאיים (ERK) 1/2, p38 חלבון קינאז המופעל על ידי מיטוגן (MAPK), וקינאזות c-jun n-terminal (JNKs), rho-GTPases, פוספואינוזיטול-3-קינאז (PI3K), ג'אנוס קינאז/מתמר אותות ומפעיל שעתוק (JAK/STAT), וחלבון קינאז C (PKC), מגביר את שחרור המולקולות הפרו-דלקתיות ומתח חמצוני1. קולגן מסוכרר פוגע גם במבנה ובתכונות של המטריצה החוץ-תאית, ועלייה ב-AGEs שמקורם בקולגן נקשרת באופן עקבי למחלות כואבות, כולל דלקת מפרקים ניוונית, נוירופתיה סוכרתית והפרעות ניווניות 2,3.
קבוצתנו הדגימה בעבר כי ניתן להתמיין בקו התאים SH-SY5Y לתאי עצב דמויי חוש מכיוון שתאים אלה מבטאים תעלות המעורבות בנוסיספציה, כגון תעלות נתרן (Nav 1.7, Nav 1.8 ו-Nav 1.9) וקולטן חולף פוטנציאלי ונילואיד מסוג 1 (TRPV1), סמנים הנמצאים בדרך כלל בתאי עצב חושיים היקפיים4. TRPV1 הוא תעלת קטיון לא סלקטיבית, חדירה ליוני סידן ורגישה לגירוי קפסאיצין. חשוב לציין, כאשר תאי העצב דמויי התחושה נחשפים למטריצת קולגן מסוכררת (ECM-GC), הם משיגים פונקציות פרו-נוציספטיביות על ידי הגברת ביטוי c-Fos, גורם שעתוק המעורב בהפעלה עצבית, ושחרור חומר P, נוירופפטיד המעורב באופן נרחב בדלקת עצבית וכאב. תאים אלה מגיבים למשככי כאבים, כגון מורפיום, אב הטיפוס של אופיאטים, ומפחיתים את שחרור החומר P המושרה על ידי ECM-GC. יחד, נתונים אלה מצביעים על כך שמודל זה מגיב למולקולה פרו-ואנטי-נוציספטיבית 4,5.
ניטור שינויים בריכוז Ca2+ תוך תאיים חיוני לחקר תהליכים תאיים רבים. בתאי עצב, זה יכול להיות כלי שימושי לחיזוי נזק עצבי ותכונות נוירו-פרוטקטיביות של תרופות. קפסאיצין, המרכיב הפעיל החריף של פלפל צ'ילי חריף, הוא האגוניסט הנחקר ביותר של קולטן TRPV15 וכלי רב ערך לחקר מנגנוני הכאב ולסינון משככי כאבים פוטנציאליים חדשים. מחקרים קודמים הראו כי נוירונים חושיים ראשוניים מגרעיני השורש הגבי של מכרסמים שהודגרו עם גלוקוז גבוה מציגים עלייה משמעותית בזרם הסידן המושרה על ידי קפסאיצין6. עם זאת, לא ידוע אם ערוץ TRPV1 היה פעיל מבחינה תפקודית במודל התאים שלנו והאם הקולגן המסוכרר רגיש לתאי עצב דמויי תחושה לעירור קפסאיצין, שעשוי להפעיל מסלולי איתות נוסיספטיביים. לכן, שאפנו לפתח פרוטוקול חסכוני המשתמש בכלים פשוטים לניטור סידן בזמן אמת בתאים דמויי חישה תוך הקפדה על ניתוח אמין. כאן, אנו מספקים פרוטוקול מקיף המסייע לחוקרים לעבור את השלבים להתמיינות תאי SH-SY5Y בתאי עצב דמויי תחושה, וכיצד לעורר בהם רגישות לגירויים פרו-נוציספטיביים. שיטה זו יכולה לתרום לגילוי תרכובות משככות כאבים או נוירו-פרוטקטיביות חדשות.
Protocol
תרבית 1. SH-SY5Y והתמיינות לתאי עצב דמויי חישה
הערה 1: כל השלבים הקיימים בסעיף זה צריכים להיעשות מתחת למכסה זרימה למינר, וכל הפתרונות והאספקה צריכים להיות סטריליים.
- ראשית, הכינו בקבוק תרבות (25 ס"מ2) על ידי הוספת 5 מ"ל מדיום תרבות.
הערה: להפשרה, הרחבה ותחזוקה של סוג תאים זה, השתמש בתערובת של מדיום תרבית: Dulbecco Modified Eagle's and Ham's Medium F12 (DMEM/F12) בתוספת 10% סרום בקר עוברי מומת בחום ו-1% פניצילין-סטרפטומיצין. - לאחר מכן, הסר את צינור ה-cryotube המכיל את תאי SH-SY5Y מהחנקן הנוזלי ושמור אותו על קרח. הפשירו את התאים באמבט מים בטמפרטורה של 37 מעלות צלזיוס למשך 2 דקות.
- הוסף 1 מ"ל של מדיום תרבית שלם לקריוביאל, העביר את התאים לצינור של 15 מ"ל, הוסף 3 מ"ל של מדיום תרבית שלם (DMEM/F12 בתוספת 10% סרום בקר עוברי מומת בחום), וערבב על ידי משיכתו שוב ושוב והוצאתו בחזרה לתוך הצינור באמצעות פיפטה.
- פיפטו את התאים לתוך צינור 15 מ"ל וצנטריפוגה ב -290 גרם. השליכו את הסופרנטנט כדי להסיר דימתיל סולפוקסיד (DMSO), חומר מגן קריו המשמש למניעת היווצרות גבישי קרח במהלך תאי ההקפאה.
- הוסף 1 מ"ל של מדיום תרבית לכדור התא, ערבב אותם היטב בעזרת פיפטה, והניח אותם בבקבוק תרביתבגודל 25 ס"מ 2 כדי להרחיב את התאים. הנח את התאים בחממה באווירה לחה של 5% CO2 ב -37 מעלות צלזיוס.
הערה: ניתן להשתמש בתאים כאשר הם מגיעים לכ-80% מפגש. לצורך התמיינות עצבית, מומלץ להשתמש בתאי SH-SY5Y עד למעבר התא עשרים. - הכינו את מטריצת הקולגן החוץ-תאית (100 מיקרוגרם/מ"ל) על ידי דילול קולגן מסוג I של זנב חולדה ב-PBS סטרילי, ושפכו 1 מ"ל מהתמיסה הזו לצלחת פטרי (35/10 מ"מ) לציפוי.
- דגרו זאת בחממה באווירה לחה של 5% CO2 למשך כשעה אחת.
- לאחר תקופה זו, שטפו את הצלחת פעמיים עם PBS סטרילי, ואז ספרו תאים באמצעות תא נויבאואר.
- כדי לספור תאים, יש לשטוף תחילה אתבקבוק התרבות בגודל 25 ס"מ המכיל את התא עם 5 מ"ל PBS סטרילי כדי להסיר את כל מדיום התרבות. לאחר מכן הסר את ה-PBS הסטרילי, הוסף 3 מ"ל של 0.05% טריפסין לתאים, והנח אותם באינקובטור בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 למשך כ-3-5 דקות להשלמת ניתוק התאים.
- לאחר מכן, הסר את התאים מהחממה, הוסף 6 מ"ל מדיום תרבית לבקבוק התרבית והעביר תמיסה זו לצינור של 15 מ"ל. צנטריפוגה ב -290 גרם למשך 5 דקות.
- הסר את הסופרנטנט והשהה מחדש את התאים היטב ב -1 מ"ל של מדיום תרבית שלם.
- לבסוף, ספרו את התאים באמצעות תא ספירה של נויבאואר. מערבבים 20 מיקרוליטר תאים ו -20 מיקרוליטר טריפן כחול, ומוסיפים 10 מיקרוליטר מהתערובת הזו לתא נויבאואר. ספור את התאים החיים שאינם מוכתמים בכחול.
- לוח 5 × 104 תאים/מ"ל תאים בצלחת פטרי (35/10 מ"מ) על אותו מדיום תרבית שתואר קודם. השתמש בנפח הכולל של 1 מ"ל לצלחת.
- לאחר מכן, המתינו 24 שעות כדי להתחיל את פרוטוקול ההתמיינות העצבית. לשם כך, הסר את מדיום התרבית והחלף אותו ב-1 מ"ל של DMEM/F12 בתוספת 2% סרום בקר עוברי מומת בחום, 1% פניצילין-סטרפטומיצין ו-10 מיקרומטר חומצה רטינואית טראנס (RA 10 מיקרומטר).
- המתן 48 שעות והחלף את מדיום התרבות כל יום למשך 3 ימים. הנח את התאים בחממה באווירה לחה של 5% CO2 ב -37 מעלות צלזיוס.
- ביום החמישי, הוציאו את המדיום מהתאים והוסיפו 1 מ"ל של תרבית ללא סרום בתוספת גורם נוירוטרופי שמקורו במוח אנושי (BDNF 50 ננוגרם/מ"ל) בכל צלחת.
הערה: נבדק BDNF מחברות שונות (ראה טבלת חומרים). כולם עבדו באותו אופן. - ביום השביעי להתמיינות, שטפו את התאים עם PBS סטרילי פעם אחת והשתמשו בתאי עצב דמויי חוש לניסויים. אם אי אפשר להשתמש בתאים אלה באופן מיידי לניסויים, הוסף מדיום תרבית ללא סרום כדי לשמור אותם בחיים עד השימוש.
הערה: בתום ההתמיינות העצבית, יש צורך לשטוף תאים עם PBS סטרילי כדי להסיר את ה-BDNF שנותר, תוך הימנעות מרעילות תאים.
2. קולגן מסוכרר ותהליך גליקציה
הערה: כל השלבים בסעיף זה חייבים להיעשות מתחת למכסה זרימה למינר, וכל הפתרונות והאספקה חייבים להיות סטריליים.
- הכן את גליקציה של קולגן על ידי דגירה של קולגן מסוג I ממצב סיבי זנב חולדה (3.89 מ"ג/מ"ל) עם 200 מ"מ D-ריבוז, 160 מ"מ D-גלוקוז ו-200 מ"מ D-תראוז ב-4 מעלות צלזיוס למשך 7 ימים.
הערה: להכנת קולגן מסוכרר, שקלו את הסוכרים לפי המשקל המולקולרי שלהם וערבבו אותם עם קולגן מסוג I ממצב סיבי זנב חולדה (3.89 מ"ג/מ"ל). - דגרו על תרבית תאי עצב דמויי תחושה למשך 24 שעות עם מטריצה חוץ-תאית של קולגן מסוכרר (ECM-GC, 100 מק"ג/מ"ל) או מטריצה חוץ-תאית רגילה של קולגן (ECM-NC, 100 מק"ג/מ"ל) שהוכנה במדיום תרבית DMEM/F12 ללא סרום ותוספי אנטיביוטיקה.
3. בדיקת זרם סידן
- לזרם סידן, השתמש בערכת בדיקת שטף הסידן והכן את התמיסות על פי הוראות היצרן, כמפורט להלן.
- בתחילה, הכינו 1 מ"ל של טעינת צבע Fluo-8 על ידי הוספת 2 מיקרוליטר של תמיסת מלאי Fluo-8 ב-998 מיקרוליטר של מאגר בדיקה 1x (תערובת של מאגר HBSS ו-10x Pluronic F127 Plus.
הערה: פתרון עבודה זה יציב לפחות שעתיים בטמפרטורת החדר (RT). - מאוחר יותר, דגרו 250 מיקרוליטר של תמיסה זו בכל צלחת מצופה של תאי עצב דמויי חוש שהתמיינו בעבר וטופלו ב-ECM-NC או ECM-GC למשך 30 דקות באווירה לחה של 5% CO2 ב-37 מעלות צלזיוס. לאחר מכן, הוציאו את המנה מהחממה ושמרו אותה ב-RT (בחושך) למשך 30 דקות.
הערה: תמיסה זו הופכת לציטוטוקסית אם הדגירה של שעתיים היא אקסטרפולציה. הכן את תמיסת הקפסאיצין בתקופת הדגירה.
4. אינדוקציה של קפסאיצין
הערה: קפסאיצין, אגוניסט TRPV1, שימש להשראת זרימת סידן בתאים.
- שקלו ודללו קפסאיצין ב-1% אתנול ומים טהורים במיוחד. לאחר מכן, הכינו תמיסה בריכוז של 2 מיקרומטר, שגם היא דוללה במים טהורים במיוחד.
הערה: יש להכין תמיסת קפסאיצין ביום השימוש. לדלל קפסאיצין תחילה באתנול ולאחר מכן במים; אחרת, זה יזרז. - הוסף 250 מיקרוליטר של תמיסת קפסאיצין של 2 מיקרומטר לכל צלחת פטרי בגודל 35/10 מ"מ כך שהריכוז הסופי יהיה 1 מיקרומטר.
הערה: ריכוז תמיסת המלאי של קפסאיצין היה 2 מיקרומטר כדי להבטיח פיזור טוב יותר ולהימנע משיאי פלואורסצנטיות מבודדים.
5. הדמיית זרם סידן וניתוח מיקרוסקופיה קונפוקלית
הערה: ההדמיה בוצעה במיקרוסקופ קונפוקלי המצויד באובייקט 20x/0.75NA ובלייזר עירור 488 ננומטר (עוצמה של 0.5%). הפליטה זוהתה ב-520 ננומטר. התאים נסרקו בצירי xy (512 x 512 פיקסלים) לאורך זמן (t) במהירות של 600 הרץ עם מרווח רכישה של 433 אלפיות השנייה וזמן רכישה כולל של 5 דקות. ההדמיה בוצעה ב-37 מעלות צלזיוס כדי לשמור על מצבם הפיזיולוגי של התאים באמצעות תוכנת המיקרוסקופיה.
- הכינו מזרק עם 250 מיקרוליטר של תמיסת קפסאיצין של 2 מיקרומטר (הריכוז הסופי בצלחת יהיה 1 מיקרומטר) וחברו אותו לסט ורידים בקרקפת - פרפר מסוג 23 GA סטרילי. אבטח את המזרק באמצעות מעמד מעבדה ומהדק.
- הניחו את צלחת הפטרי על במת המיקרוסקופ ובזהירות יתרה הניחו את מחט הקרקפת בצלחת הפטרי, הימנעו ממגע עם התחתית, אין לטבול את קצה המחט בנוזל.
הערה: ניתן להשתמש בנייר דבק כדי לתקן את מיקום הקרקפת. - מצא שדה עם מספר מתאים של תאים (יותר מ-20) והתאם את המיקוד באמצעות אור שדה בהיר.
- התחל מצב Live עם לייזר 488 ננומטר והתאם את פרמטרי המיקוד והתאורה.
- התחל את הקלטת הרכישה, ולאחר תקופת הבסיס (t = 0 עד t = 60 שניות), יש למרוח 250 מיקרוליטר של 2 מיקרומטר קפסאיצין ולדחוף בעדינות את בוכנת המזרק כדי לעורר את זרימת הסידן לתאים.
הערה: זמן רכישת ההקלטה הסופי היה כ-300 שניות לצלחת.
6. עיבוד לאחר / ניתוח נתונים
- בצע את ניתוח התאים באמצעות תוכנת המיקרוסקופיה במצב כמות . ראשית, נתח תאי ספייק פלואורסצנטיים לפני ואחרי גירוי הקפסאיצין.
- צור אזור עניין (ROI) בכל תא מגיב, כלומר תאים המציגים עלייה פלואורסצנטית לאחר קפסאיצין. הקפידו לצייר החזר ROI בכל אזור התא, כפי שמודגם לעיל (איור 1).
- ייצא את הנתונים בקובץ ערכים מופרדים באמצעות פסיקים (CSV) לצורך ניתוח עוקב.
- לחלופין, בצע את הניתוח באמצעות התוכנה הזמינה בחינם FIJI7 (https://fiji.sc).
- כדי לפתוח את קובצי התמונה, השתמש בתוסף Bio-Formats על ידי ניווט אל File > Import > Bio-Formats ובחירת הקובץ.
- לאחר מכן, השתמשו בכלי זכוכית מגדלת כדי להגדיל את התצוגה ובכלי בחירה ביד חופשית כדי לצייר אזור עניין (ROI) סביב התאים המגיבים.
- לאחר ציור כל החזר ROI, לחץ על מקש T כדי להוסיף אותו למנהל ה-ROI. חזרו על התהליך הזה עבור כל התאים המעניינים (איור 2).
- לאחר הוספת כל ההחזר על ההשקעה, עבור לחלון מנהל החזר ההשקעה , בחר את כל ההחזר על ההשקעה ולאחר מכן נווט אל ניתוח > הגדרת מדידות בתפריט הראשי.
- לאחר מכן, חזרו למנהל ההחזר על ההשקעה ובחרו עוד > Multi Measure כדי למדוד את העוצמה בכל המסגרות. התוצאות יופיעו בחלון חדש; ייצא כקובץ CSV על-ידי מעבר אל קובץ > שמירה בשם.
הערה: ניתן לנתח את קובץ ה-CSV בתוכנות Excel, Google Sheets ו-GraphPad. השתמש במשוואה ΔF/F0 = (F(t) - F0)/F0 כדי להמיר ערכי עוצמת הקרינה המתקבלים עם ערכת בדיקת שטף הסידן Fluo-8 למדד יחסי של שינוי שטף הסידן. כאן, F0 מייצג את הקרינה הבסיסית, המחושבת כעוצמה הממוצעת מתמונות שצולמו מ-t = 0 s עד t = 60 שניות לפני גירוי עם קפסאיצין. F(t) הוא הערך של עוצמת הקרינה המקסימלית שנצפתה לאחר הגירוי, המאפשרת להעריך את שיא זרם הסידן. גישה זו מדגישה את העלייה בקרינה ביחס לקו הבסיס, כאשר עלייה ב-ΔF/F0 מצביעה על רמת סידן תוך תאית מוגברת.
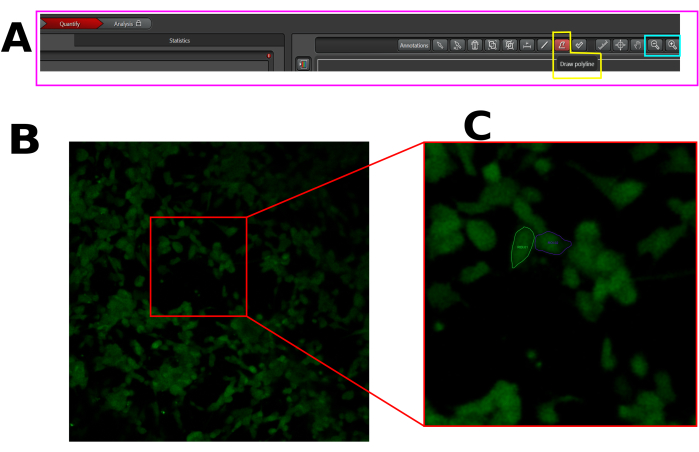
איור 1: דוגמה להחזר ROI בתאים שנבחרו עבור ניתוח זרם סידן בתוכנת LAS X. (A) ממשק LAS X במצב כמות. המלבן הוורוד מציג את לשונית הכימות. המלבן הצהוב מציג את הכלי ציור פולי-קווים, ומלבן הציאן מציג את כלי התצוגה וההתקרבות. (B) שדה ראייה (FOV) שנלכד. (C) התקרב ל-FOV כדי להקל על ציור החזר ה-ROI בתא כולו. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
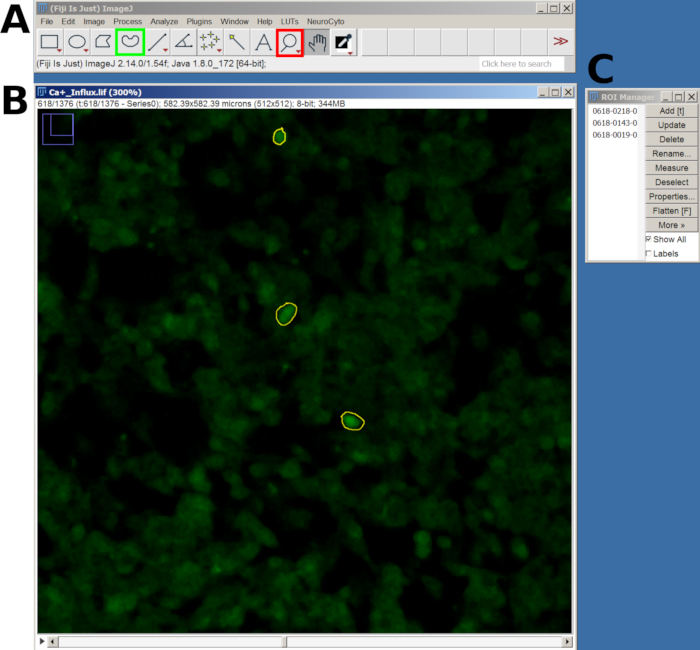
איור 2: דוגמה להחזר ROI בתאים שנבחרו עבור ניתוח זרם סידן בתוכנת FIJI. (A) ממשק FIJI המציג את התפריט הראשי והכלי. הריבוע האדום מציג את הכלי זכוכית מגדלת, והריבוע הירוק מציג את הבחירה ביד חופשית. (B) שדה ראייה (FOV) שצולם עם זום אין והחזר ROI מצויר. (ג) חלון מנהל ההחזר על ההשקעה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
7. פתרון בעיות
- אם התמונה אינה ממוקדת, נסה את הפעולות הבאות:
- בדוק את הידבקות הקלטת; אם הוא השתחרר, הדבר עלול לגרום למחט לזוז ולהשפיע על המיקוד.
- חבר מחדש את המחט עם סרט נוסף ליציבות מוגברת.
- החלפת מחטים סטנדרטיות. השתמש בקצות מחט שיניים כפופות מראש כדי לשפר את היישור על הצלחת.
- אם התאים מציגים אות רווי, נסה את הצעדים הבאים:
- הפחת את עוצמת הלייזר ואת הגדרות ההגברה.
- ודא את זמן הדגירה של המגיב . אם זה חורג מהמלצת היצרן, זה עלול להוביל לרוויית אותות, ולסבך את זיהוי זרם הסידן.
- עקוב אחר ההצעות הנוספות הבאות לפתרון בעיות:
- כיול רגיל: ודא שציוד ההדמיה מכויל באופן קבוע כדי לשמור על איכות המיקוד וזיהוי האותות.
- שינויים במסמך: נהל יומן של כל ההתאמות שבוצעו בפרוטוקול לעיון עתידי וכדי להקל על פתרון בעיות.
- התאמות תגובתיות: אם הבעיות נמשכות, שקול לבדוק עם ריכוזי ריאגנטים שונים או שיטות חלופיות לזיהוי אותות.
תוצאות
התמיינות תאי SH-SY5Y לנוירון דמוי חושי
תמונות הקרנה בעלות תוכן גבוה מדגימות כי פרוטוקול ההתמיינות העצבית משנה את המורפולוגיה של תאי SH-SY5Y. תאי העצב דמויי החישה (תאים מובחנים) מציגים גוף תאים מעוגל שמקרין רשת נרחבת של נוירופילמנטים. הם יוצרים ענפים של הקרנות נויריט מוארכות יותר שמחברות את תאי העצב שמסביב, מה שעולה בקנה אחד עם תכונות של תאי עצב בוגרים (איור 3)4. חשוב לציין, תאים אלה מציגים רמות מוגברות של TRPV1 בהשוואה לתאי SH-SY5Y לא ממוינים (איור 4).
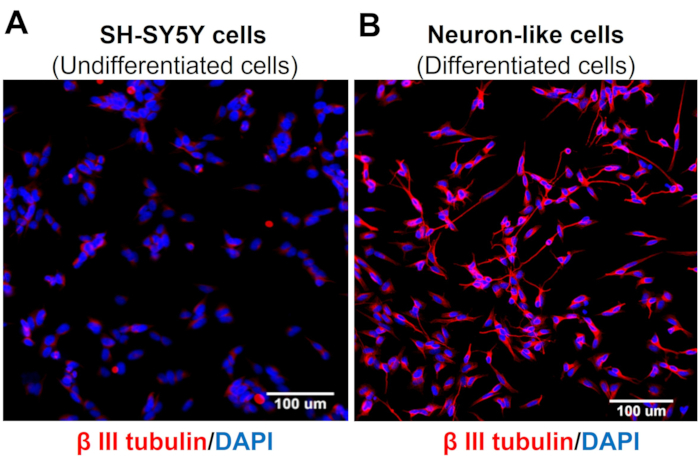
איור 3: ביטוי טובולין β-III בתאים לא ממוינים וממויינים. תמונות אימונופלואורסצנטיות בתוכן גבוה (מכשירים מולקולריים, סן חוזה, קליפורניה, EUA) של סמנים עצביים ספציפיים (β-III tubulin) ב-(A) תאים לא ממוינים (תאי SH-SY5Y) ו-(B) תאים מובחנים (תאים דמויי נוירונים חושיים). תמונות מייצגות של חמישה אזורים. הגדלה: פי 20. סרגל קנה מידה: 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
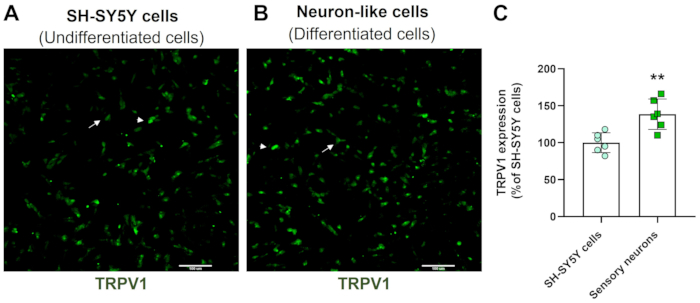
איור 4: ביטוי TRPV1 בתאים לא ממוינים ומובחנים. תמונות אימונופלואורסצנטיות של HCS של ביטוי TRPV1 ב- (A) תאים לא ממוינים (תאי SH-SY5Y) ו- (B) תאים מובחנים (תאים דמויי נוירונים חושיים). תמונות מייצגות של ארבעה אזורים. החץ מסמן תאי TRPV1 בעלי ביטוי נמוך, וראש החץ מסמן תאי TRPV1 בעלי ביטוי גבוה. הגדלה: פי 10. סרגל קנה מידה: 100 מיקרומטר. (C) כימות ביטוי TRPV1 בתאי SH-SY5Y ונוירונים חושיים. מבחן t של סטודנט לא מזווג, **p<0.005 בהשוואה ל-EMC-NC, n= 6. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
גליקציה של קולגן המקיימת אינטראקציה עם תאים דמויי חושים מחקה מיקרו-סביבה כואבת4. כאן, הראינו שקולגן מסוכרר משפר את זרם הסידן המושרה על ידי קפסאיצין בהשוואה לתאים שטופלו בקולגן רגיל (איור 5). תוצאות אלה מצביעות על כך ש-AGEs מספיקים כדי להגביר את הזרמים המעוררים קפסאיצין.
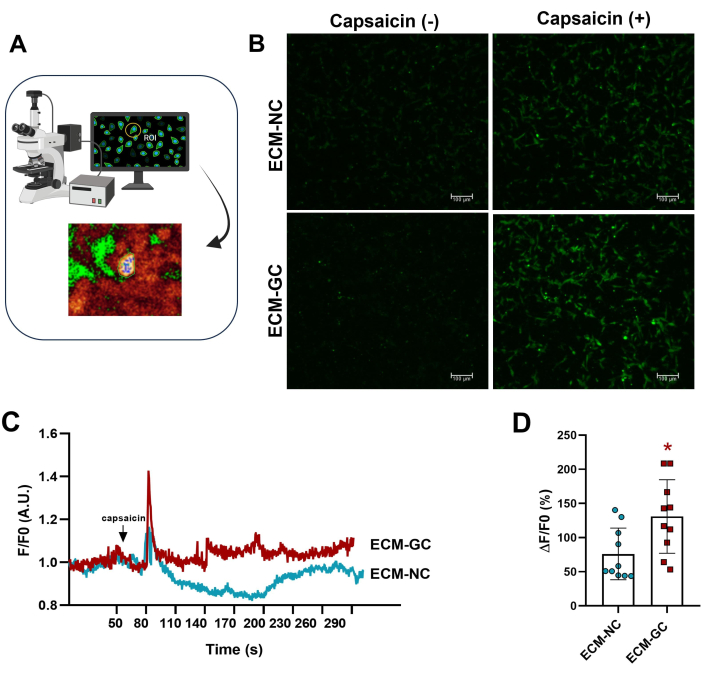
איור 5: מדידות סידן תוך-תאיות. (A) זיהוי אזור עניין פלואורסצנטי (ROI). (ב-ד) זרם הסידן מסומן על ידי פלואורסצנטיות מוגברת לפני ואחרי יישום קפסאיצין (1 מיקרומטר, ריכוז סופי). החץ מציין שימוש בקפסאיצין. עלייה בסידן תוך תאי נקבעה כ-ΔF/F0 (F0 הוא פלואורסצנטי בסיסי). מבחן t מזווג של סטודנט (זוגות מותאמים של Wilcoxon), *p < 0.05 בהשוואה ל-ECM-NC, n= 10 תאים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
קולטני כאב הם תת-קבוצות מיוחדות של נוירונים חושיים המתווכים כאב. תאים אלה מבטאים תעלות יונים מגודרות מתח וליגנד, כגון TRPV1, שהפעלתן מובילה לזרם סידן ולשחרור נוירופפטידים ונוירוטרנסמיטורים המווסתים את ההעברה הנוסיספטיבית. כאן, אנו מתארים פרוטוקול להבדיל SH-SY5Y לתאי עצב דמויי חושים כדי להעריך את זרם הסידן המושרה על ידי קפסאיצין 8,9. חשוב לציין, הראינו כי בחיקוי סביבה פרו-נוציספטיבית עם קולגן מסוכרר, יש ויסות מוגבר של זרם הסידן המושרה על ידי קפסאיצין, המאשר שתעלות TRPV1 מתפקדות, ו-AGEs עשויים לעורר רגישות לערוצים אלה על ידי הגברת התגובה שלהם לגירוי מזיק.
הערכת זרם הסידן בנוירונים חושיים הייתה כלי רב ערך לסינון מועמדים למשככי כאבים10. חלה התקדמות בתכנון מדדי סידן מולקולריים, עם פיתוח צבעי סידן יציבים כמו Fluo-8. ל-Fluo-8 (ללא שיטת כביסה) יתרונות על פני צבעים פלואורסצנטיים אחרים, כולל בהירות מוגברת, עבודה בטמפרטורת החדר והצגת רגישות גבוהה יותר לריכוזי סידן נמוכים יותר. בפרוטוקול זה, קפסאיצין נמרח דרך סט ורידים בקרקפת. בעבר השתמשנו בפיפטה רגילה, אך לעתים קרובות היא עקרה את לוחית התא והפריעה לקליטת התמונה. אפשרות נוספת היא שימוש במשאבת זלוף כדי לספק קפסאיצין לאט. מעניין לציין כי הגישה בפרוטוקול זה משתמשת ברכיבים זמינים וחסכוניים הניתנים ליישום בכל מעבדה, ומספקים יתרון משמעותי על פני תאי זלוף מסורתיים לניטור זרימת סידן. יתר על כן, המנגנון המתואר כאן תואם באופן אוניברסלי לרוב המיקרוסקופים הפלואורסצנטיים הנפוצים במסגרות מחקר, ומבטל את הצורך בציוד מיוחד או שינויים. יכולת הסתגלות זו מאפשרת אינטגרציה חלקה בין תצורות הדמיה מגוונות, ומשפרת את הנגישות של טכניקות הדמיית סידן מתקדמות למגוון רחב יותר של מעבדות, במיוחד במעבדות עם תקציבים מוגבלים. עם זאת, בשונה מקורא מיקרו-פלטות רב-מצבי של מדידות פלואורסצנטיות אוטומטיות, מגבלה אחת של השיטה המתוארת כאן היא שהיא דורשת ציוד הדמיה ברזולוציה גבוהה ופיפטינג ידני, שגוזל זמן רב יותר. עם זאת, מיקרוסקופיה קונפוקלית מחזיקה ביתרון של זיהוי פליטת פלואורסצנטיות נמוכה יותר.
שיטות לחקר נוירונים חושיים משתמשות בעיקר בתרבית תאים ראשונית או בתאי גזע פלוריפוטנטיים (iPS). נוירונים חושיים אנושיים ראשוניים נגישים רק לעתים רחוקות ויצירת iPS היא אינטנסיבית ודורשת ריאגנטים יקרים וטכנאים מומחים. לכן, למרות המגבלה הכרוכה בהתמיינות SH-SY5Y לתאי עצב, שאינם שומרים לחלוטין על המאפיינים הפיזיולוגיים של נוירון אנושי שלם, הם דומים מבחינה מורפולוגית לנוירונים ראשוניים 9,10, ושומרים על תכונות חשובות, כגון ביטוי תעלות נתרן, שחרור חומר P והיענות לקפסאיצין ומורפיום 4,11,12,13.
כאב הוא מצב מורכב, ומציאת תרופות הפוגעות בעירור תאי עצב מתורבתים עשויה שלא להספיק כדי לחסום את תחושת הכאב. עם זאת, הנתונים הקודמים המראים כי מורפיום מפחית את שחרור החומר המושרה על ידי קולגן מסוכרר P מרמזים על כך שהמודל שלנו שימושי למציאת מולקולות משככות כאבים חדשות. יתר על כן, כאן אנו מדגימים כי קולגן מסוכרר מספיק כדי לעורר רגישות יתר של נוירונים לזרם סידן המושרה על ידי קפסאיצין, מה שמצביע על כך שהדמיית סידן בנוכחות AGEs עשויה להיות שימושית בחיפוש אחר תרכובות טיפוליות חדשות למחלות דלקתיות וניווניות כואבות. יש לציין שהשתמשנו בקפסאיצין של 1 מיקרומטר כדי לגרום לזרם Ca2+, ריכוז סטנדרטי להדמיית Ca2+ בתאי עצב 8,14,15. עם זאת, יש לבצע עקומת מינון-תגובה במחקרים עתידיים כדי לייעל את תנאי הניסוי.
לשיטה המתוארת כאן להערכת זרם הסידן עשויים להיות יישומים רחבים יותר מעבר לתאים דמויי נוירונים. הוא מתאים גם לתרביות תאי חישה ראשוניות וניתן להתאים אותו לסוגי תאים אחרים, כגון קרדיומיוציטים ומקרופאגים. יתר על כן, בהתחשב בכך שקולגן גליקציה מתרחש עם ההזדקנות ובמצבים פתולוגיים כמו סיבוכי סוכרת, גישה זו עשויה לשמש כלי רב ערך לחקירת מחלות כליות והפרעות עיניים.
שינוי עיקרי בפרוטוקול שלנו הוא החלפת המחט הסטנדרטית בקצות מחט שיניים כפופות מראש. מחטים מעוקלות אלו מאפשרות התאמה טובה יותר על הצלחת, מזעור הטיפול, הפחתת כמות סרט ההדבקה הדרוש והפחתת הסיכון שהקצה יגע בתחתית הצלחת.
חלק מהבעיות שעלולות להתרחש במהלך ההליך ופתרונותיהן מפורטים בסעיף 7 לפרוטוקול. אם התמונה אינה ממוקדת לאחר התאמת המחט בצלחת, בדוק אם סרטי ההדבקה השתחררו, מה שגורם למחט להזיז את הצלחת. מומלץ לחבר מחדש את המחט עם סרט נוסף ליציבות טובה יותר. אם תאים מציגים אותות רוויים, יש לנסות להפחית את עוצמת הלייזר ואת פרמטרי הרווח. ודא את זמן הדגירה של המגיב. הניסיון שלנו מצביע על כך שאם זמן הדגירה עולה על המלצת היצרן, האות הופך להיות אינטנסיבי מדי, מה שעלול להפריע לזיהוי זרם הסידן. עבור שיאי פלואורסצנציה בלתי צפויים וניתוק תאים לאחר הזרקת נוזל, יש להזריק את הנוזל לאט כדי למנוע קפיצות פלואורסצנטיות פתאומיות ולמנוע שיבוש הידבקות התאים. הזרקות מהירות עלולות ליצור מערבולת, מה שמוביל לחפצי אותות חולפים ולניתוק תאים מקרקעית הבאר.
Disclosures
MCB, AMCT ו-VOZ מחזיקים בפטנט על תהליך זיהוי ישויות מולקולריות המעורבות בכאבי דלקת מפרקים ניוונית (BR102018008561-1).
Acknowledgements
עבודה זו נתמכה על ידי Fundação Amparo à Pesquisa do Estado de São Paulo FAPESP Grant Number 2015/50040-4 ו-2020/13139-0, קרן המחקר של סאו פאולו ו-GlaxoSmithKline, FAPESP 2022/08417-7 ו-2024/04023-0.
Materials
| Name | Company | Catalog Number | Comments |
| All-trans retinoic acid | Tocris | 695 | |
| BDNF | Tocris | TOCR-2837 | |
| BDNF | Sigma-Aldrich | B3795 | |
| Butterfly type 23GA sterile | Beckton Dickinson Asepto | 38833814 | Scalp vein set |
| Capsaicin | Sigma-Aldrich | M2028 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| DMEM/F12 | Gibco | 12500062 | Basal medium |
| D-ribose | Sigma-Aldrich | R7500 | |
| D-threose | Sigma-Aldrich | T7392 | |
| Fluo-8 Calcium Flux Assay Kit | Abcam | ab112129 | No wash |
| Heat-inactivated fetal bovine serum | Gibco | A5670801 | |
| High Content Screening | Molecular Devices | ||
| LASX software | Leica Microsystems | Microscopy software | |
| Leica TCS SP8 | Leica Microsystems | Leica TCS SP8 | Confocal microscope |
| Penicillin-streptomycin | Gibco | 15140130 | |
| Petri dish (35/10 mm) | Greiner bio-one | 627965 | |
| Rat tail type I collagen | Corning | 354236 | |
| SH-SY5Y | Merck | 94030304-1VL | Neuroblastoma cell line |
References
- Bierhaus, A., et al. Understanding RAGE, the receptor for advanced glycation end products. J Mol Med. 83 (11), 876-886 (2005).
- Hudson, B. I., et al. Blockade of receptor for advanced glycation endproducts: A new target for therapeutic intervention in diabetic complications and inflammatory disorders. Arch Biochem Biophys. 419 (1), 80-88 (2003).
- Dandia, H., Makkad, K., Tayalia, P. Glycated collagen - a 3D matrix system to study pathological cell behavior. Biomater Sci. 7 (8), 3480-3488 (2019).
- Bufalo, M. C., et al. Human sensory neuron-like cells and glycated collagen matrix as a model for the screening of analgesic compounds. Cells. 11 (2), 247 (2022).
- Frias, B., Merighi, A. Capsaicin, nociception and pain. Molecules. 21 (6), 797 (2016).
- Lam, D., et al. RAGE-dependent potentiation of TRPV1 currents in sensory neurons exposed to high glucose. PLoS One. 13 (2), e0193312 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Li, F., et al. TRPV1 activity and substance P release are required for corneal cold nociception. Nat Commun. 10 (1), 5678 (2019).
- Mickle, A. D., Shepherd, A. J., Mohapatra, D. P. Sensory TRP channels:the key transducers of nociception and pain. Prog Mol Biol Transl Sci. 131, 73-118 (2015).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiol Pain. 11, 100083 (2022).
- Vetter, I., et al. Characterisation of Nav types endogenously expressed in human SH-SY5Y neuroblastoma cells. Biochem Pharmacol. 83 (11), 1562-1571 (2012).
- Dekker, L. V., et al. Analysis of human Nav1.8 expressed in SH-SY5Y neuroblastoma cells. Eur J Pharmacol. 528 (1-3), 52-58 (2005).
- Lam, P. M. W., Hainsworth, A. H., Smith, G. D., Owen, D. E., Davies, J., Lambert, D. G. Activation of recombinant human TRPV1 receptors expressed in SH-SY5Y human neuroblastoma cells increases [Ca2+]i initiates neurotransmitter release and promotes delayed cell death. J Neurochem. 102 (3), 801-811 (2007).
- Koplas, P. A., Rosenberg, R. L., Oxford, G. S. The role of calcium in the desensitization of capsaicin responses in rat dorsal root ganglion neurons. J Neurosci. 17 (10), 3525-3537 (1997).
- Tominaga, M., et al. The cloned capsaicin receptor integrates multiple pain-producing stimuli. Neuron. 21 (3), 531-543 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved