Method Article
I prodotti finali della glicazione avanzata sensibilizzano le cellule neuronali sensoriali umane all'afflusso di calcio indotto dalla capsaicina
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
L'aumento dei prodotti finali della glicazione avanzata (AGE) derivati dal collagene è costantemente collegato a malattie dolorose. Qui, abbiamo studiato se la glicazione sensibilizza i neuroni sensoriali all'eccitazione della capsaicina.
Abstract
L'aumento dei prodotti finali della glicazione avanzata (AGE) derivati dal collagene è costantemente collegato a malattie dolorose, tra cui l'osteoartrite, la neuropatia diabetica e i disturbi neurodegenerativi. I neuroni umani simil-sensoriali differenziati dalla linea cellulare SH-SY5Y acquisiscono funzioni pro-nocicettive quando esposti agli AGE, rilasciando la sostanza P e sovraregolando l'espressione del potenziale recettoriale transitorio vanilloide 1 (TRPV1). Qui, abbiamo studiato se questo recettore fosse funzionalmente attivo e se il processo di glicazione sensibilizza i neuroni sensoriali all'eccitazione della capsaicina. Le cellule neuronali sensoriali sono state ottenute dalla differenziazione di cellule SH-SY5Y con acido all-trans-retinoico e fattore neurotrofico derivato dal cervello. L'incubazione con matrice extracellulare di collagene glicato (ECM-GC) ha simulato uno stimolo pro-nocicettivo. Le cellule di controllo sono state incubate con una matrice di collagene extracellulare non glicata (ECM-NC). Il kit per il dosaggio del flusso di calcio Fluo-8 è stato utilizzato per valutare l'afflusso di calcio, che è stato stimolato dalla capsaicina. I risultati mostrano che la glicazione aumenta l'afflusso di calcio rispetto alle cellule trattate con collagene normale, suggerendo che i neuroni sensoriali esprimono canali TRPV1 funzionali e che la glicazione aumenta l'eccitazione della capsaicina. Questi dati indicano che le cellule neuronali sensoriali di AGE sono ipersensibili, innescando la segnalazione pro-nocicettiva. Insieme, i nostri risultati suggeriscono che abbiamo stabilito un modello funzionale sensibile alla capsaicina che può essere utile per lo screening dei candidati per la gestione delle condizioni dolorose.
Introduzione
La glicazione è un processo non enzimatico, irreversibile e spontaneo in cui le proteine, come il collagene, si legano alle molecole di zucchero riducenti, dando luogo a prodotti finali di glicazione avanzata (AGE). Gli AGE possono attivare i recettori di membrana cellulare, innescando l'attivazione di vie intracellulari, come la proteina chinasi regolata dal segnale extracellulare (ERK) 1/2, la proteina chinasi attivata dal mitogeno p38 (MAPK) e le chinasi n-terminali c-jun (JNK), le rho-GTPasi, la fosfoinositolo-3-chinasi (PI3K), la Janus chinasi/trasduttore di segnale e attivatore della trascrizione (JAK/STAT) e la proteina chinasi C (PKC), aumentando il rilascio di molecole proinfiammatorie e lo stress ossidativo1. Il collagene glicato compromette anche la struttura e le proprietà della matrice extracellulare e l'aumento degli AGE derivati dal collagene è costantemente collegato a malattie dolorose, tra cui l'osteoartrite, la neuropatia diabetica e i disturbi neurodegenerativi 2,3.
Il nostro gruppo ha precedentemente dimostrato che la linea cellulare SH-SY5Y può essere differenziata in cellule neuronali sensoriali poiché queste cellule esprimono canali coinvolti nella nocicezione, come i canali del sodio (Nav 1.7, Nav 1.8 e Nav 1.9) e il potenziale recettoriale transitorio vanilloide di tipo 1 (TRPV1), marcatori tipicamente presenti nei neuroni sensoriali periferici4. TRPV1 è un canale cationico non selettivo permeabile agli ioni calcio e sensibile allo stimolo della capsaicina. È importante sottolineare che, quando le cellule neuronali sensoriali sono esposte alla matrice di collagene glicato (ECM-GC), acquisiscono funzioni pro-nocicettive aumentando l'espressione di c-Fos, un fattore di trascrizione coinvolto nell'attivazione neuronale, e il rilascio della sostanza P, un neuropeptide ampiamente coinvolto nella neuroinfiammazione e nel dolore. Queste cellule rispondono agli analgesici, come la morfina, il prototipo dell'oppiaceo, diminuendo il rilascio di P indotto dalla ECM-GC. Insieme, questi dati indicano che questo modello risponde a una molecola pro e anti-nocicettiva 4,5.
Il monitoraggio delle variazioni intracellulari della concentrazione di Ca2+ è essenziale per lo studio di numerosi processi cellulari. Nei neuroni, può essere uno strumento utile per prevedere il danno neuronale e le proprietà neuroprotettive dei farmaci. La capsaicina, il principio attivo pungente dei peperoncini piccanti, è l'agonista più studiato del recettoreTRPV1 5 e un valido strumento per studiare i meccanismi del dolore e lo screening di potenziali nuovi analgesici. Studi precedenti hanno dimostrato che i neuroni sensoriali primari dei gangli della radice dorsale dei roditori incubati con glucosio elevato mostrano un aumento significativo dell'afflusso di calcio indotto dalla capsaicina6. Tuttavia, non è noto se il canale TRPV1 fosse funzionalmente attivo nel nostro modello cellulare e se il collagene glicato sensibilizzi le cellule neuronali sensoriali all'eccitazione della capsaicina, che può attivare vie di segnalazione nocicettive. Pertanto, abbiamo mirato a sviluppare un protocollo economico che utilizzasse strumenti semplici per il monitoraggio del calcio in tempo reale in cellule sensoriali, garantendo al contempo un'analisi affidabile. Qui, forniamo un protocollo completo per aiutare i ricercatori a passare attraverso i passaggi per differenziare le cellule SH-SY5Y in cellule neuronali sensoriali e come sensibilizzarle agli stimoli pro-nocicettivi. Questo metodo può contribuire alla scoperta di nuovi composti analgesici o neuroprotettivi.
Protocollo
Coltura 1. SH-SY5Y e differenziazione in cellule neuronali sensoriali
NOTA 1: Tutti i passaggi presenti in questa sezione devono essere eseguiti sotto una cappa a flusso laminare e tutte le soluzioni e le forniture devono essere sterili.
- Per prima cosa, preparare un pallone di coltura (25 cm2) aggiungendo 5 ml di terreno di coltura.
NOTA: Per lo scongelamento, l'espansione e il mantenimento di questo tipo di cellule, utilizzare una miscela di terreno di coltura: Dulbecco Modified Eagle's and Ham's Medium F12 (DMEM/F12) integrato con il 10% di siero fetale bovino inattivato termicamente e l'1% di penicillina-streptomicina. - Quindi, rimuovere il criotubo contenente le cellule SH-SY5Y dall'azoto liquido e tenerlo sul ghiaccio. Scongelare le cellule a bagnomaria a 37 °C per 2 minuti.
- Aggiungere 1 mL di terreno di coltura completo alla crioviale, trasferire le cellule in una provetta da 15 mL, aggiungere 3 mL di terreno di coltura completo (DMEM/F12 integrato con il 10% di siero fetale bovino inattivato termicamente) e mescolare aspirandolo ripetutamente e dispensandolo nuovamente nella provetta utilizzando una pipetta.
- Pipettare le cellule nella provetta da 15 mL e centrifugare a 290 g. Scartare il surnatante per rimuovere il dimetilsolfossido (DMSO), un agente crioprotettivo utilizzato per prevenire la formazione di cristalli di ghiaccio durante il congelamento delle cellule.
- Aggiungere 1 mL di terreno di coltura al pellet cellulare, mescolarli bene con una pipetta e metterli in un pallone di coltura da 25 cm2 per espandere le cellule. Porre le cellule in un incubatore in atmosfera umidificata al 5% di CO2 a 37 °C.
NOTA: Le celle possono essere utilizzate quando raggiungono circa l'80% di confluenza. Per la differenziazione neuronale, si consiglia di utilizzare cellule SH-SY5Y fino al passaggio cellulare venti. - Preparare la matrice extracellulare di collagene (100 μg/mL) diluendo il collagene di coda di ratto di tipo I in PBS sterile e versare 1 mL di questa soluzione in una capsula di Petri (35/10 mm) per un rivestimento.
- Incubarlo in un incubatore in un'atmosfera umidificata al 5% di CO2 per circa 1 ora.
- Trascorso questo periodo, lavare la piastra due volte con PBS sterile, quindi contare le cellule utilizzando la camera Neubauer.
- Per contare le cellule, lavare prima il pallone di coltura da 25 cm2 contenente la cellula con 5 mL di PBS sterile per rimuovere tutto il terreno di coltura. Quindi rimuovere il PBS sterile, aggiungere 3 mL di tripsina allo 0,05% alle cellule e metterle in un incubatore a 37 °C e CO2 al 5% per circa 3-5 minuti per completare il distacco delle cellule.
- Successivamente, rimuovere le cellule dall'incubatore, aggiungere 6 ml di terreno di coltura al pallone di coltura e trasferire questa soluzione in una provetta da 15 ml. Centrifugare a 290 g per 5 min.
- Rimuovere il surnatante e risospendere bene le cellule in 1 mL di terreno di coltura completo.
- Infine, contare le cellule utilizzando una camera di conteggio Neubauer. Miscelare 20 μl di cellule e 20 μl di blu di tripano e aggiungere 10 μl di questa miscela in una camera Neubauer. Conta le cellule vive che non si colorano di blu.
- Piastra 5 × 104 cellule/mL di cellule in una piastra di Petri (35/10 mm) sullo stesso terreno di coltura descritto in precedenza. Utilizzare il volume totale di 1 ml per piastra.
- Quindi, attendere 24 ore per avviare il protocollo di differenziazione neuronale. A tal fine, rimuovere il terreno di coltura e sostituirlo con 1 mL di DMEM/F12 integrato con il 2% di siero fetale bovino inattivato termicamente, l'1% di penicillina-streptomicina e 10 μM di acido all-trans retinoico (RA 10 μM).
- Attendere 48 ore e sostituire il terreno di coltura ogni giorno per 3 giorni. Porre le cellule in un incubatore in atmosfera umidificata al 5% di CO2 a 37 °C.
- Il quinto giorno, rimuovere il terreno dalle cellule e aggiungere 1 mL di terreno di coltura privo di siero integrato con fattore neurotrofico derivato dal cervello umano (BDNF 50 ng/mL) in ciascuna piastra.
NOTA: È stato testato BDNF di diverse aziende (vedi tabella del materiale). Lavoravano tutti allo stesso modo. - Al settimo giorno di differenziazione, lavare le cellule con PBS sterile una volta e utilizzare cellule neuronali sensoriali per gli esperimenti. Se è impossibile utilizzare immediatamente queste cellule per gli esperimenti, aggiungere un terreno di coltura privo di siero per mantenerle in vita fino all'uso.
NOTA: Al termine del differenziamento neuronale, è necessario lavare le cellule con PBS sterile per rimuovere il BDNF rimanente, evitando la tossicità cellulare.
2. Collagene glicato e processo di glicazione
NOTA: Tutti i passaggi di questa sezione devono essere eseguiti sotto una cappa a flusso laminare e tutte le soluzioni e le forniture devono essere sterili.
- Preparare la glicazione del collagene incubando il collagene di tipo I dallo stato fibrillare della coda di ratto (3,89 mg/mL) con 200 mM di D-ribosio, 160 mM di D-glucosio e 200 mM di D-treosio a 4 °C per 7 giorni.
NOTA: Per preparare il collagene glicato, pesare gli zuccheri in base al loro peso molecolare e mescolarli con collagene di tipo I dallo stato fibrillare della coda di ratto (3,89 mg/mL). - Incubare colture cellulari di neuroni sensoriali per 24 ore con matrice extracellulare di collagene glicato (ECM-GC, 100 μg/mL) o matrice extracellulare di collagene normale (ECM-NC, 100 μg/mL) preparata in terreno di coltura DMEM/F12 senza integrazione di siero e antibiotici.
3. Saggio dell'afflusso di calcio
- Per l'afflusso di calcio, utilizzare il kit per il dosaggio del flusso di calcio e preparare le soluzioni secondo le istruzioni del produttore, come indicato di seguito.
- Inizialmente, preparare 1 mL di Fluo-8 dye-loading aggiungendo 2 μL di soluzione madre Fluo-8 in 998 μL di 1x tampone di saggio (una miscela di tampone HBSS e 10x Pluronic F127 Plus).
NOTA: Questa soluzione di lavoro è stabile per almeno 2 ore a temperatura ambiente (RT). - Successivamente, incubare 250 μL di questa soluzione in ciascuna piastra di cellule neuronali sensoriali precedentemente differenziate e trattate con ECM-NC o ECM-GC per 30 minuti in un'atmosfera umidificata del 5% di CO2 a 37 °C. Quindi, togliete il piatto dall'incubatrice e tenetelo a RT (al buio) per 30 minuti.
NOTA: Questa soluzione diventa citotossica se si estrapola l'incubazione di 2 ore. Preparare la soluzione di capsaicina durante il periodo di incubazione.
4. Induzione della capsaicina
NOTA: La capsaicina, un agonista del TRPV1, è stata utilizzata per indurre l'afflusso di calcio nelle cellule.
- Pesare e diluire la capsaicina in etanolo all'1% e acqua ultrapura. Quindi, preparare una soluzione a una concentrazione di 2 μM, che è stata anche diluita in acqua ultrapura.
NOTA: La soluzione di capsaicina deve essere preparata il giorno dell'uso. Diluire la capsaicina prima in etanolo e poi in acqua; in caso contrario, precipiterà. - Aggiungere 250 μL di soluzione di capsaicina da 2 μM a ciascuna piastra di Petri da 35/10 mm in modo che la concentrazione finale sia di 1 μM.
NOTA: La concentrazione della soluzione madre di capsaicina era di 2 μM per garantire una migliore dispersione ed evitare picchi di fluorescenza isolati.
5. Imaging dell'afflusso di calcio e analisi al microscopio confocale
NOTA: L'imaging è stato eseguito in un microscopio confocale dotato di un obiettivo 20x/0,75NA e di un laser di eccitazione da 488 nm (intensità 0,5%). L'emissione è stata rilevata a 520 nm. Le cellule sono state scansionate in assi xy (512 x 512 pixel) nel tempo (t) a una velocità di 600 Hz con un intervallo di acquisizione di 433 ms e un tempo di acquisizione totale di 5 minuti. L'imaging è stato eseguito a 37 °C per mantenere le condizioni fisiologiche delle cellule utilizzando il software di microscopia.
- Preparare una siringa con 250 μL di soluzione di capsaicina da 2 μM (la concentrazione finale nella piastra sarà di 1 μM) e collegarla a un set di vene del cuoio capelluto - Butterfly type 23 GA sterile. Fissare la siringa utilizzando un supporto da laboratorio e un morsetto.
- Posizionare la piastra di Petri sul tavolino del microscopio e, con estrema cautela, posizionare l'ago del cuoio capelluto nella piastra di Petri, evitando il contatto con il fondo, la punta dell'ago non deve essere immersa nel liquido.
NOTA: È possibile utilizzare un nastro adesivo per fissare la posizione del cuoio capelluto. - Trova un campo con un numero adeguato di celle (più di 20) e regola la messa a fuoco utilizzando la luce del campo luminoso.
- Avvia la modalità Live con un laser a 488 nm e regola i parametri di messa a fuoco e illuminazione.
- Avviare la registrazione dell'acquisizione e, dopo il periodo basale (da t = 0 a t = 60 secondi), applicare 250 μL di capsaicina 2 μM e spingere delicatamente lo stantuffo della siringa per stimolare l'afflusso di calcio nelle cellule.
NOTA: Il tempo di acquisizione della registrazione finale è stato di circa 300 s per lastra.
6. Post-elaborazione/analisi dei dati
- Eseguire l'analisi cellulare utilizzando il software di microscopia in modalità Quantificazione . Innanzitutto, analizza le cellule spike di fluorescenza prima e dopo lo stimolo della capsaicina.
- Creare una regione di interesse (ROI) in ogni cellula responsiva, cioè cellule che mostrano un picco di fluorescenza dopo la capsaicina. Assicurati di disegnare il ROI nell'intera area della cella, come dimostrato sopra (Figura 1).
- Esportare i dati in un file con valori separati da virgole (CSV) per l'analisi successiva.
- In alternativa, eseguire l'analisi utilizzando il software disponibile gratuitamente FIJI7 (https://fiji.sc).
- Per aprire i file immagine, utilizza il plug-in Bio-Formats navigando su File > Importa > Bio-Formats e selezionando il file.
- Quindi, usa lo strumento Lente di ingrandimento per ingrandire e lo strumento Selezione a mano libera per disegnare una regione di interesse (ROI) attorno alle celle reattive.
- Dopo aver disegnato ogni ROI, premere il tasto T per aggiungerla al ROI Manager. Ripetere questo processo per tutte le celle di interesse (Figura 2).
- Una volta aggiunte tutte le ROI, vai alla finestra ROI Manager , seleziona tutte le ROI, quindi vai su Analizza > imposta misurazioni nel menu principale.
- Quindi, torna a ROI Manager e seleziona Altro > Multi Measure per misurare l'intensità in tutti i fotogrammi. I risultati appariranno in una nuova finestra; esporta come file CSV andando su File > Salva con nome.
NOTA: Il file CSV può essere analizzato nei software Excel, Fogli Google e GraphPad. Utilizzare l'equazione ΔF/F0 = (F(t) - F0)/F0 per convertire i valori di intensità della fluorescenza ottenuti con il kit per il saggio del flusso di calcio Fluo-8 in una misura relativa della variazione dell'afflusso di calcio. Qui, F0 rappresenta la fluorescenza di base, calcolata come l'intensità media delle immagini catturate da t = 0 s a t = 60 s prima della stimolazione con capsaicina. F(t) è il valore dell'intensità massima di fluorescenza osservata dopo lo stimolo, che consente di valutare il picco di afflusso di calcio. Questo approccio evidenzia l'aumento della fluorescenza rispetto al basale, dove un aumento di ΔF/F0 indica un elevato livello intracellulare di calcio.
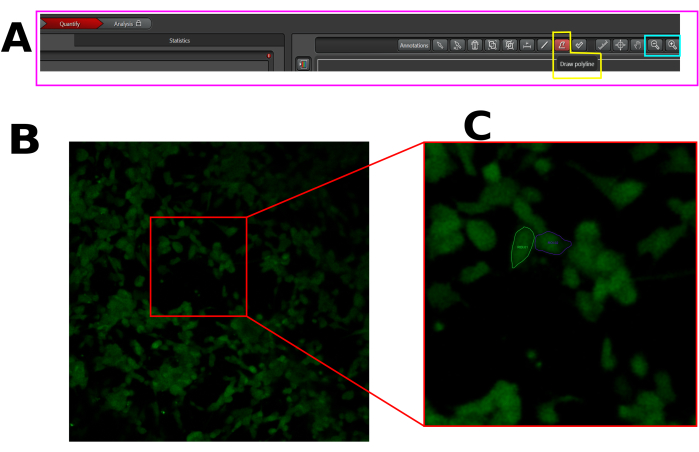
Figura 1: Esempio di ROI nelle cellule selezionate per l'analisi dell'afflusso di calcio nel software LAS X. (A) Interfaccia LAS X in modalità di quantificazione. Il rettangolo rosa mostra la scheda di quantificazione. Il rettangolo giallo mostra lo strumento Disegna polilinea e il rettangolo ciano mostra gli strumenti di zoom indietro e ingrandisci. (B) Campo visivo (FOV) acquisito. (C) Ingrandisci il FOV per facilitare il disegno del ROI nell'intera cella. Clicca qui per visualizzare una versione più grande di questa figura.
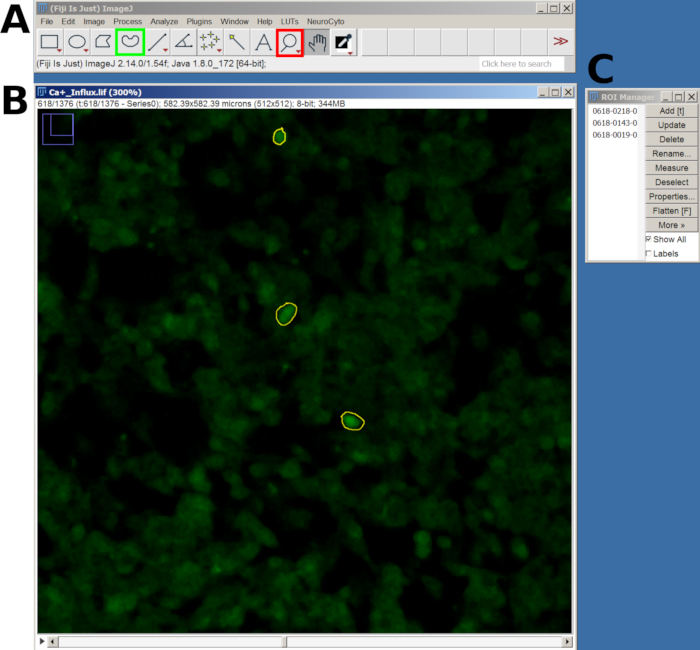
Figura 2: Esempio di ROI nelle celle selezionate per l'analisi dell'afflusso di calcio nel software FIJI. (A) Interfaccia FIJI che mostra il menu principale e lo strumento. Il quadrato rosso mostra lo strumento lente di ingrandimento, mentre il quadrato verde mostra la selezione a mano libera. (B) Campo visivo (FOV) acquisito con zoom avanti e un ROI disegnato. (C) La finestra del ROI manager. Clicca qui per visualizzare una versione più grande di questa figura.
7. Risoluzione dei problemi
- Se l'immagine non è a fuoco, provare quanto segue:
- Controllare l'adesione del nastro; Se si è allentato, ciò potrebbe causare lo spostamento dell'ago e influire sulla messa a fuoco.
- Riattaccare l'ago con del nastro adesivo aggiuntivo per una maggiore stabilità.
- Sostituzione degli aghi standard. Utilizzare punte dell'ago dentale pre-piegate per migliorare l'allineamento sulla piastra.
- Se le celle mostrano un segnale saturo, prova i seguenti passaggi:
- Diminuisci l'intensità del laser e le impostazioni di guadagno.
- Verificare il tempo di incubazione del reagente. Se supera le raccomandazioni del produttore, può portare alla saturazione del segnale, complicando il rilevamento dell'afflusso di calcio.
- Segui questi suggerimenti aggiuntivi per la risoluzione dei problemi:
- Calibrazione regolare: assicurarsi che l'apparecchiatura di imaging sia calibrata regolarmente per mantenere la messa a fuoco e la qualità del rilevamento del segnale.
- Modifiche ai documenti: tenere un registro di tutte le modifiche apportate al protocollo per riferimento futuro e per facilitare la risoluzione dei problemi.
- Regolazioni reattive: se i problemi persistono, prendere in considerazione la possibilità di eseguire test con diverse concentrazioni di reagenti o metodi alternativi di rilevamento del segnale.
Risultati
Differenziazione delle cellule SH-SY5Y in neuroni sensoriali
Le immagini di screening ad alto contenuto dimostrano che il protocollo di differenziazione neuronale modifica la morfologia cellulare SH-SY5Y. Le cellule neuronali sensoriali (cellule differenziate) mostrano un corpo cellulare arrotondato che proietta un'ampia rete di neurofilamenti. Formano rami di proiezioni neuritiche più allungate che collegano i neuroni circostanti, il che è coerente con le caratteristiche dei neuroni maturi (Figura 3)4. È importante sottolineare che queste cellule mostrano livelli aumentati di TRPV1 rispetto alle cellule SH-SY5Y indifferenziate (Figura 4).
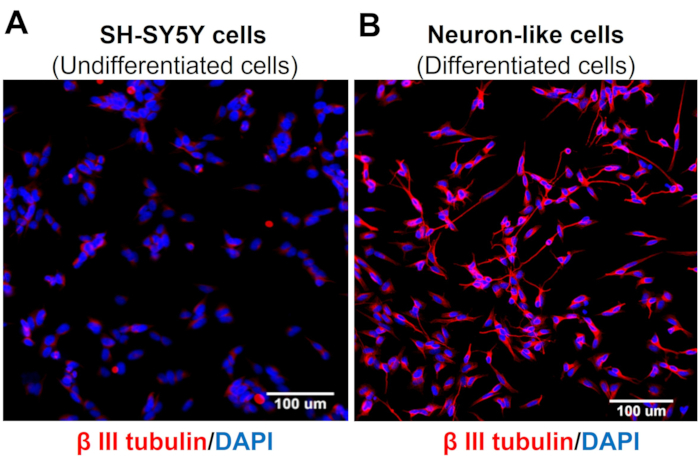
Figura 3: Espressione della tubulina β-III in cellule indifferenziate e differenziate. Immagini di immunofluorescenza ad alto contenuto di screening (Molecular Devices, San Jose, CA, EUA) di specifici marcatori neuronali (tubulina β-III) in (A) cellule indifferenziate (cellule SH-SY5Y) e (B) cellule differenziate (cellule sensoriali simili ai neuroni). Immagini rappresentative di cinque aree. Ingrandimento: 20x. Barra della scala: 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
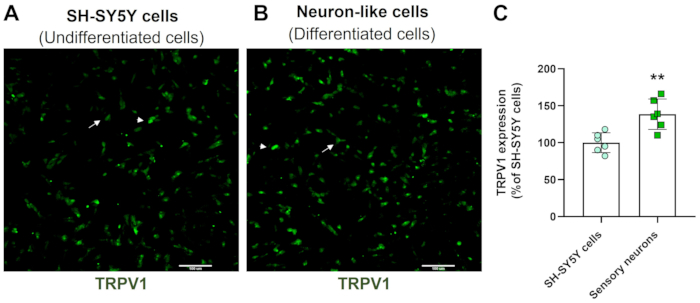
Figura 4: Espressione di TRPV1 in cellule indifferenziate e differenziate. Immagini in immunofluorescenza HCS dell'espressione di TRPV1 in (A) cellule indifferenziate (cellule SH-SY5Y) e (B) cellule differenziate (cellule sensoriali-simili). Immagini rappresentative di quattro aree. La freccia contrassegna le cellule TRPV1 a bassa espressione, mentre la punta della freccia indica le cellule TRPV1 ad alta espressione. Ingrandimento: 10x. Barra della scala: 100 μm. (C) Quantificazione dell'espressione di TRPV1 nelle cellule SH-SY5Y e nei neuroni sensoriali. Test t di Student non accoppiato, **p<0,005 rispetto a EMC-NC, n= 6. Clicca qui per visualizzare una versione più grande di questa figura.
La glicazione del collagene, interagendo con le cellule sensoriali, imita un microambiente doloroso4. Qui, abbiamo dimostrato che il collagene glicato aumenta l'afflusso di calcio indotto dalla capsaicina rispetto alle cellule trattate con collagene normale (Figura 5). Questi risultati suggeriscono che gli AGE sono sufficienti per aumentare le correnti evocate dalla capsaicina.
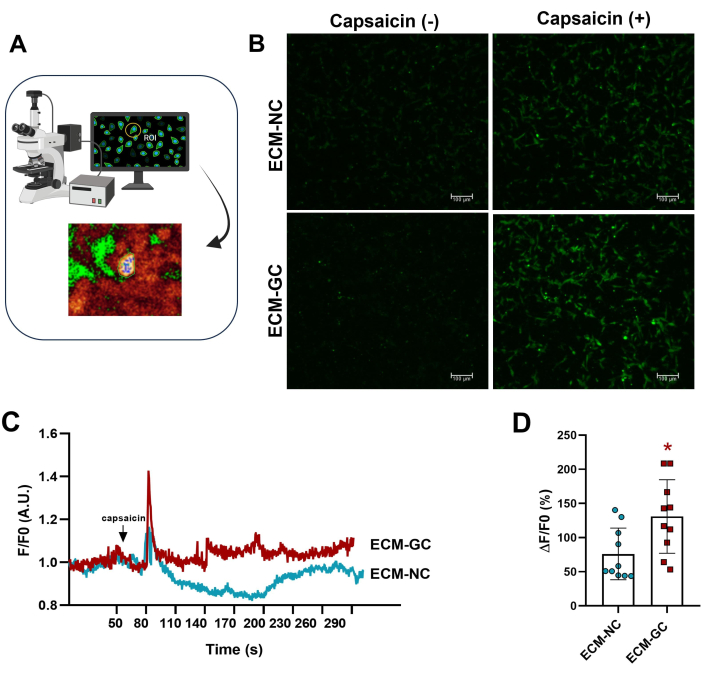
Figura 5: Misure intracellulari del calcio. (A) Identificazione della regione di fluorescenza di interesse (ROI). (B-D) L'afflusso di calcio è indicato da un aumento della fluorescenza prima e dopo l'applicazione della capsaicina (1 μM, concentrazione finale). La freccia indica l'applicazione della capsaicina. Gli aumenti del calcio intracellulare sono stati determinati come ΔF/F0 (F0 è la fluorescenza basale). Test t di Student accoppiato (coppie abbinate di Wilcoxon), *p < 0,05 rispetto a ECM-NC, n= 10 cellule. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
I nocicettori sono sottogruppi specializzati di neuroni sensoriali che mediano il dolore. Queste cellule esprimono canali ionici voltaggio-dipendenti e ligando, come TRPV1, la cui attivazione porta all'afflusso di calcio e al rilascio di neuropeptidi e neurotrasmettitori che regolano la trasmissione nocicettiva. Qui, descriviamo un protocollo per differenziare SH-SY5Y in cellule neuronali sensoriali per valutare l'afflusso di calcio indotto dalla capsaicina 8,9. È importante sottolineare che abbiamo dimostrato che imitando un ambiente pro-nocicettivo con collagene glicato, c'è una sovraregolazione dell'afflusso di calcio indotto dalla capsaicina, confermando che i canali TRPV1 sono funzionali, e gli AGE possono sensibilizzare questi canali aumentando la loro reattività a uno stimolo nocivo.
La valutazione dell'afflusso di calcio nei neuroni sensoriali è stata uno strumento prezioso per lo screening dei candidati analgesici10. Sono stati compiuti progressi nella progettazione di indicatori molecolari di calcio, con lo sviluppo di coloranti di calcio stabili come il Fluo-8. Fluo-8 (senza metodo di lavaggio) presenta vantaggi rispetto ad altri coloranti fluorescenti, tra cui una maggiore luminosità, il funzionamento a temperatura ambiente e la maggiore sensibilità a concentrazioni di calcio più basse. In questo protocollo, la capsaicina è stata applicata attraverso un set di vene del cuoio capelluto. In precedenza, utilizzavamo una pipetta normale, ma spesso spostava la piastra cellulare e interrompeva l'acquisizione dell'immagine. Un'altra possibilità sarebbe quella di utilizzare una pompa di perfusione per erogare lentamente la capsaicina. È interessante notare che l'approccio di questo protocollo utilizza componenti prontamente disponibili ed economici che possono essere implementati in qualsiasi laboratorio, fornendo un vantaggio significativo rispetto alle tradizionali camere di perfusione per il monitoraggio dell'afflusso di calcio. Inoltre, l'apparecchio qui descritto è universalmente compatibile con la maggior parte dei microscopi a fluorescenza comunemente utilizzati in contesti di ricerca, eliminando la necessità di apparecchiature specializzate o modifiche. Questa adattabilità facilita l'integrazione perfetta tra diverse configurazioni di imaging, migliorando l'accessibilità delle tecniche avanzate di imaging del calcio a una gamma più ampia di laboratori, soprattutto nei laboratori con budget limitati. Tuttavia, a differenza di un lettore di micropiastre multimodale da banco per misure automatizzate di fluorescenza, una limitazione del metodo qui descritto è che richiede apparecchiature di imaging ad alta risoluzione e pipettaggio manuale, che richiede più tempo. Tuttavia, la microscopia confocale ha il vantaggio di rilevare una minore emissione di fluorescenza.
I metodi per studiare i neuroni sensoriali utilizzano principalmente colture cellulari primarie o cellule staminali pluripotenti (iPS). I neuroni sensoriali umani primari sono raramente accessibili e la generazione di iPS è laboriosa e richiede reagenti costosi e tecnici esperti. Pertanto, nonostante la limitazione coinvolta nella differenziazione di SH-SY5Y in cellule neuronali, che non conservano completamente le caratteristiche fisiologiche di un neurone umano intatto, sono morfologicamente simili ai neuroni primari 9,10 e mantengono caratteristiche importanti, come l'espressione dei canali del sodio, il rilascio di sostanze P e la risposta alla capsaicina e alla morfina 4,11,12,13.
Il dolore è una condizione complessa e trovare farmaci che compromettono l'eccitazione dei neuroni in coltura potrebbe non essere sufficiente per bloccare la sensazione di dolore. Tuttavia, i dati precedenti che mostrano che la morfina riduce il rilascio di P indotto dal collagene glicato suggeriscono che il nostro modello è utile per trovare nuove molecole analgesiche. Inoltre, qui dimostriamo che il collagene glicato è sufficiente per ipersensibilizzare i neuroni all'afflusso di calcio indotto dalla capsaicina, indicando che l'imaging del calcio in presenza di AGE può essere utile nella ricerca di nuovi composti terapeutici per malattie infiammatorie e degenerative dolorose. Da notare che abbiamo usato 1 μM di capsaicina per indurre l'afflusso di Ca2+, una concentrazione standard per l'imaging di Ca2+ nei neuroni 8,14,15. Tuttavia, negli studi futuri dovrebbe essere condotta una curva dose-risposta per ottimizzare le condizioni sperimentali.
Il metodo qui descritto per valutare l'afflusso di calcio può avere applicazioni più ampie oltre le cellule simili ai neuroni. È adatto anche per colture cellulari sensoriali primarie e può essere adattato per altri tipi di cellule, come cardiomiociti e macrofagi. Inoltre, dato che la glicazione del collagene si verifica con l'invecchiamento e in condizioni patologiche come le complicanze diabetiche, questo approccio può servire come un valido strumento per indagare le malattie renali e i disturbi oculari.
Una delle principali modifiche apportate al nostro protocollo è la sostituzione dell'ago standard con punte dentali pre-piegate. Questi aghi curvi consentono una migliore regolazione della piastra, riducendo al minimo la manipolazione, riducendo la quantità di nastro adesivo necessario e diminuendo il rischio che la punta tocchi il fondo della piastra.
Alcuni problemi che possono verificarsi durante la procedura e le relative soluzioni sono descritti in dettaglio nella sezione 7 del protocollo. Se l'immagine è sfocata dopo aver regolato l'ago sulla lastra, controllare se i nastri adesivi si sono allentati, provocando lo spostamento dell'ago della lastra. Si consiglia di riattaccare l'ago con del nastro adesivo aggiuntivo per una migliore stabilità. Se le cellule mostrano segnali saturi, si dovrebbe cercare di diminuire l'intensità del laser e guadagnare i parametri. Verificare il tempo di incubazione del reagente. La nostra esperienza indica che se il tempo di incubazione supera le raccomandazioni del produttore, il segnale diventa eccessivamente intenso, il che può interferire con il rilevamento dell'afflusso di calcio. In caso di picchi di fluorescenza imprevisti e di distacco cellulare dopo l'iniezione del liquido, il liquido deve essere iniettato lentamente per evitare picchi di fluorescenza improvvisi ed evitare di interrompere l'adesione cellulare. Le iniezioni rapide possono generare turbolenza, portando ad artefatti transitori del segnale e al distacco delle cellule dal fondo del pozzetto.
Divulgazioni
MCB, AMCT e VOZ possiedono un brevetto sul processo di identificazione delle entità molecolari coinvolte nel dolore da osteoartrite (BR102018008561-1).
Riconoscimenti
Questo lavoro è stato sostenuto dalla Fundação Amparo à Pesquisa do Estado de São Paulo FAPESP Grant number 2015/50040-4 e 2020/13139-0, dalla São Paulo Research Foundation e da GlaxoSmithKline, FAPESP 2022/08417-7 e 2024/04023-0.
Materiali
| Name | Company | Catalog Number | Comments |
| All-trans retinoic acid | Tocris | 695 | |
| BDNF | Tocris | TOCR-2837 | |
| BDNF | Sigma-Aldrich | B3795 | |
| Butterfly type 23GA sterile | Beckton Dickinson Asepto | 38833814 | Scalp vein set |
| Capsaicin | Sigma-Aldrich | M2028 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| DMEM/F12 | Gibco | 12500062 | Basal medium |
| D-ribose | Sigma-Aldrich | R7500 | |
| D-threose | Sigma-Aldrich | T7392 | |
| Fluo-8 Calcium Flux Assay Kit | Abcam | ab112129 | No wash |
| Heat-inactivated fetal bovine serum | Gibco | A5670801 | |
| High Content Screening | Molecular Devices | ||
| LASX software | Leica Microsystems | Microscopy software | |
| Leica TCS SP8 | Leica Microsystems | Leica TCS SP8 | Confocal microscope |
| Penicillin-streptomycin | Gibco | 15140130 | |
| Petri dish (35/10 mm) | Greiner bio-one | 627965 | |
| Rat tail type I collagen | Corning | 354236 | |
| SH-SY5Y | Merck | 94030304-1VL | Neuroblastoma cell line |
Riferimenti
- Bierhaus, A., et al. Understanding RAGE, the receptor for advanced glycation end products. J Mol Med. 83 (11), 876-886 (2005).
- Hudson, B. I., et al. Blockade of receptor for advanced glycation endproducts: A new target for therapeutic intervention in diabetic complications and inflammatory disorders. Arch Biochem Biophys. 419 (1), 80-88 (2003).
- Dandia, H., Makkad, K., Tayalia, P. Glycated collagen - a 3D matrix system to study pathological cell behavior. Biomater Sci. 7 (8), 3480-3488 (2019).
- Bufalo, M. C., et al. Human sensory neuron-like cells and glycated collagen matrix as a model for the screening of analgesic compounds. Cells. 11 (2), 247 (2022).
- Frias, B., Merighi, A. Capsaicin, nociception and pain. Molecules. 21 (6), 797 (2016).
- Lam, D., et al. RAGE-dependent potentiation of TRPV1 currents in sensory neurons exposed to high glucose. PLoS One. 13 (2), e0193312 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Li, F., et al. TRPV1 activity and substance P release are required for corneal cold nociception. Nat Commun. 10 (1), 5678 (2019).
- Mickle, A. D., Shepherd, A. J., Mohapatra, D. P. Sensory TRP channels:the key transducers of nociception and pain. Prog Mol Biol Transl Sci. 131, 73-118 (2015).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiol Pain. 11, 100083 (2022).
- Vetter, I., et al. Characterisation of Nav types endogenously expressed in human SH-SY5Y neuroblastoma cells. Biochem Pharmacol. 83 (11), 1562-1571 (2012).
- Dekker, L. V., et al. Analysis of human Nav1.8 expressed in SH-SY5Y neuroblastoma cells. Eur J Pharmacol. 528 (1-3), 52-58 (2005).
- Lam, P. M. W., Hainsworth, A. H., Smith, G. D., Owen, D. E., Davies, J., Lambert, D. G. Activation of recombinant human TRPV1 receptors expressed in SH-SY5Y human neuroblastoma cells increases [Ca2+]i initiates neurotransmitter release and promotes delayed cell death. J Neurochem. 102 (3), 801-811 (2007).
- Koplas, P. A., Rosenberg, R. L., Oxford, G. S. The role of calcium in the desensitization of capsaicin responses in rat dorsal root ganglion neurons. J Neurosci. 17 (10), 3525-3537 (1997).
- Tominaga, M., et al. The cloned capsaicin receptor integrates multiple pain-producing stimuli. Neuron. 21 (3), 531-543 (1998).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon