Method Article
고급 당화 최종 산물은 인간의 감각과 유사한 뉴런 세포를 캡사이신에 의한 칼슘 유입에 민감하게 만듭니다.
* 이 저자들은 동등하게 기여했습니다
요약
콜라겐에서 유래한 최종당화산물(AGEs)의 증가는 고통스러운 질병과 일관되게 연관되어 있습니다. 여기에서는 당화가 감각 뉴런을 캡사이신 흥분에 민감하게 만드는지 여부를 조사했습니다.
초록
콜라겐 유래 최종당화산물(AGEs)의 증가는 골관절염, 당뇨병성 신경병증, 신경퇴행성 질환을 포함한 고통스러운 질병과 일관되게 연관되어 있습니다. SH-SY5Y 세포주와 분화된 인간 감각 유사 뉴런은 AGE에 노출될 때 물질 P를 방출하고 일시적 수용체 전위 바닐로이드 1(TRPV1) 발현을 상향 조절하여 통각(pro-nociceptive) 기능을 얻습니다. 여기에서 우리는 이 수용체가 기능적으로 활성화되는지, 그리고 당화 과정이 캡사이신 흥분에 감각 뉴런을 민감하게 만드는지 여부를 조사했습니다. 감각과 유사한 뉴런 세포는 SH-SY5Y 세포와 all-trans-retinoic acid 및 brain-derived neurotrophic factor의 분화로부터 얻어졌다. 당화 콜라겐 세포외 기질(ECM-GC)을 사용한 배양은 통각 촉진 자극을 시뮬레이션했습니다. 대조 세포는 비당화(non-glycated extracellular collagen matrix, ECM-NC)로 배양하였다. Fluo-8 Calcium Flux Assay Kit는 캡사이신에 의해 자극된 칼슘 유입을 평가하는 데 사용되었습니다. 그 결과, 당화(glycation)는 정상 콜라겐으로 처리된 세포에 비해 칼슘 유입을 증가시키는 것으로 나타났으며, 이는 감각 유사 뉴런이 기능적 TRPV1 채널을 발현하고 당화(glycation)가 캡사이신 흥분(capsaicin excitation)을 증가시킨다는 것을 시사합니다. 이러한 데이터는 AGE가 과민한 감각 유사 뉴런 세포를 나타내며 통각 민감성 신호를 유발합니다. 우리의 결과는 함께 통증이 있는 상태를 관리하기 위한 후보를 선별하는 데 유용할 수 있는 캡사이신에 반응하는 기능 모델을 확립했음을 시사합니다.
서문
당화(glycation)는 비효소적이고, 비가역적이며, 자발적인 과정으로, 콜라겐과 같은 단백질이 환원된 당 분자에 결합하여 최종 당화 산물(AGE)을 생성합니다. AGE는 세포막 수용체를 활성화하여 세포외 신호 조절 단백질 키나아제(ERK) 1/2, p38 미토겐 활성화 단백질 키나아제(MAPK) 및 c-jun n-말단 키나아제(JNK), rho-GTPase, 포스포이노시톨-3-키나아제(PI3K), 야누스 키나아제/신호 변환기 및 전사 활성화제(JAK/STAT) 및 단백질 키나아제 C(PKC)와 같은 세포 내 경로 활성화를 유발하여 전염증 분자 방출 및 산화 스트레스를 증가시킬 수 있습니다1. 당화당화 콜라겐은 또한 세포외 기질의 구조와 특성을 손상시키며, 콜라겐 유래 AGE가 증가하면 골관절염, 당뇨병성 신경병증, 신경퇴행성 질환 등의 고통스러운 질환과 일관되게 연관되어 있습니다 2,3.
우리 연구팀은 이전에 SH-SY5Y 세포주가 말초 감각 뉴런에서 일반적으로 발견되는 마커인 나트륨 채널(Nav 1.7, Nav 1.8 및 Nav 1.9) 및 일시적 수용체 전위 바닐로이드 유형 1(TRPV1)과 같은 통각에 관여하는 채널을 발현하기 때문에 감각 유사 뉴런 세포로 분화될 수 있음을 입증했습니다4. TRPV1은 칼슘 이온을 투과할 수 있고 캡사이신 자극에 민감한 비선택적 양이온 채널입니다. 중요한 것은 감각과 유사한 뉴런 세포가 당화 콜라겐 매트릭스(ECM-GC)에 노출되면 신경 세포 활성화에 관여하는 전사 인자인 c-Fos 발현과 신경 염증 및 통증에 널리 관여하는 뉴로펩타이드인 물질 P 방출을 증가시켜 통각 전 기능을 얻는다는 것입니다. 이 세포는 프로토 타입 아편제 인 모르핀과 같은 진통제에 반응하여 ECM-GC 유도 물질 P 방출을 줄입니다. 이러한 데이터는 이 모델이 프로 및 항통각 분자 4,5에 반응한다는 것을 나타냅니다.
세포 내 Ca2+ 농도 변화를 모니터링하는 것은 수많은 세포 과정을 연구하는 데 필수적입니다. 뉴런에서는 뉴런의 손상 및 약물의 신경 보호 특성을 예측하는 데 유용한 도구가 될 수 있습니다. 매운 고추의 톡 쏘는 활성 성분인 캡사이신(Capsaicin)은 TRPV1 수용체5 중 가장 많이 연구된 작용제이며 통증 메커니즘을 연구하고 잠재적인 새로운 진통제를 스크리닝하는 데 유용한 도구입니다. 이전 연구에서는 고포도당을 배양한 설치류의 등뿌리 신경절에서 추출한 1차 감각 뉴런이 캡사이신에 의한 칼슘 유입이 현저히 증가한다는 사실이 입증되었다6. 그러나 TRPV1 채널이 세포 모델에서 기능적으로 활성화되었는지, 그리고 당화 콜라겐이 통각 신호 전달 경로를 활성화할 수 있는 캡사이신 흥분에 감각과 유사한 뉴런 세포를 민감하게 만드는지 여부는 아직 알려지지 않았습니다. 따라서 우리는 신뢰할 수 있는 분석을 보장하면서 감각 유사 세포에서 실시간 칼슘 모니터링을 위한 간단한 도구를 사용하는 비용 효율적인 프로토콜을 개발하는 것을 목표로 했습니다. 여기에서는 연구자들이 감각 유사 뉴런 세포에서 SH-SY5Y 세포를 분화하는 단계와 통각 수용성 자극에 민감하게 만드는 방법을 안내하는 데 도움이 되는 포괄적인 프로토콜을 제공합니다. 이 방법은 새로운 진통제 또는 신경 보호 화합물의 발견에 기여할 수 있습니다.
프로토콜
1. SH-SY5Y 배양 및 감각 유사 뉴런 세포로의 분화
참고 1: 이 섹션에 있는 모든 단계는 층류 후드 아래에서 수행되어야 하며, 모든 용액과 소모품은 멸균되어야 합니다.
- 먼저 배양 배지 5mL를 첨가하여 배양 플라스크(25cm2)를 준비합니다.
참고: 이 세포 유형의 해동, 확장 및 유지를 위해 배양 배지를 혼합하여 사용하십시오: Dulbecco Modified Eagle's 및 Ham's Medium F12(DMEM/F12)에 10% 열 비활성화 소 태아 혈청과 1% 페니실린-스트렙토마이신이 보충됩니다. - 그런 다음 액체 질소에서 SH-SY5Y 세포가 들어 있는 극저온 튜브를 제거하고 얼음 위에 보관하십시오. 37°C의 수조에서 2분 동안 셀을 해동합니다.
- 1mL의 완전 배양 배지를 cryovial에 추가하고, 세포를 15mL 튜브로 옮기고, 3mL의 완전 배양 배지(10% 열 비활성화 소 태아 혈청이 보충된 DMEM/F12)를 추가하고, 피펫을 사용하여 튜브에 반복적으로 추출하고 다시 분주하여 혼합합니다.
- 세포를 15mL 튜브에 피펫으로 넣고 290g의 속도로 원심분리합니다. 상등액을 버리고 세포가 동결되는 동안 얼음 결정 형성을 방지하는 데 사용되는 동결 보호제인 DMSO(Dimethyl sulfoxide)를 제거합니다.
- 세포 펠렛에 배양 배지 1mL를 첨가하고 피펫을 사용하여 잘 혼합한 후 25cm2 배양 플라스크에 넣어 세포를 확장시킵니다. 세포를 37 ° C에서 5 % CO2 의 가습 된 분위기의 인큐베이터에 놓습니다.
참고: 세포는 약 80% 합류점에 도달할 때 사용할 수 있습니다. 신경 세포 분화를 위해 세포 통로 20까지 SH-SY5Y 세포를 사용하는 것이 좋습니다. - 쥐꼬리 I형 콜라겐을 멸균 PBS에 희석하여 세포외 콜라겐 매트릭스(100μg/mL)를 준비하고 이 용액 1mL를 페트리 접시(35/10mm)에 붓고 코팅합니다.
- 이것을 5% CO2 의 가습 분위기의 인큐베이터에서 약 1시간 동안 배양합니다.
- 이 기간이 지나면 멸균 PBS로 플레이트를 두 번 세척한 다음 Neubauer 챔버를 사용하여 세포를 계수합니다.
- 세포 계수를 위해서는 먼저 세포가 들어있는25cm2 배양 플라스크를 5mL의 멸균 PBS로 세척하여 모든 배양 배지를 제거합니다. 그런 다음 멸균된 PBS를 제거하고 세포에 0.05% 트립신 3mL를 첨가한 후 37°C 및 5%CO2 의 인큐베이터에 약 3-5분 동안 넣어 세포 분리를 완료합니다.
- 그 후, 인큐베이터에서 세포를 제거하고 배양 플라스크에 6mL의 배양 배지를 첨가한 다음 이 용액을 15mL 튜브로 옮깁니다. 290g에서 5분 동안 원 심분리기
- 상등액을 제거하고 1mL의 완전한 배양 배지에 세포를 잘 재현탁시킵니다.
- 마지막으로, Neubauer 계수 챔버를 사용하여 세포를 계수합니다. 20μL의 세포와 20μL의 트리판 블루를 혼합하고 이 혼합물 10μL를 Neubauer 챔버에 추가합니다. 파란색으로 염색되지 않는 살아있는 세포를 세십시오.
- 플레이트 5 × 104 cells/mL 세포를 앞서 설명한 것과 동일한 배양 배지에 페트리 접시(35/10 mm)에 넣습니다. 플레이트당 총 부피 1mL를 사용합니다.
- 그런 다음 24시간 동안 기다렸다가 신경 분화 프로토콜을 시작합니다. 이를 위해 배양 배지를 제거하고 2% 열 비활성화 소 태아 혈청, 1% 페니실린-스트렙토마이신 및 10μM 올-트랜스 레티노산(RA 10μM)이 보충된 1mL의 DMEM/F12로 교체합니다.
- 48시간 동안 기다렸다가 3일 동안 매일 배양 배지를 교체하십시오. 세포를 37 ° C에서 5 % CO2 의 가습 된 분위기의 인큐베이터에 놓습니다.
- 5일째에 세포에서 배지를 제거하고 각 플레이트에 인간 뇌 유래 신경 영양 인자(BDNF 50ng/mL)가 보충된 무혈청 배양 배지 1mL를 추가합니다.
참고: 다른 회사의 BDNF(재료 표 참조)가 테스트되었습니다. 그들은 모두 같은 방식으로 일했습니다. - 분화 7일째에 멸균 PBS로 세포를 한 번 세척하고 감각과 유사한 뉴런 세포를 사용하여 실험합니다. 이러한 세포를 실험에 즉시 사용할 수 없는 경우 무혈청 배양 배지를 추가하여 사용할 때까지 살아 있게 하십시오.
참고: 신경 분화가 끝나면 멸균 PBS로 세포를 세척하여 남아 있는 BDNF를 제거하여 세포 독성을 피해야 합니다.
2. 당화콜라겐과 당화작용 과정
알림: 이 섹션의 모든 단계는 층류 후드 아래에서 수행해야 하며 모든 용액과 소모품은 멸균되어야 합니다.
- 쥐꼬리 섬유소 상태(3.89 mg/mL)의 콜라겐 I형을 4°C에서 7일 동안 4°C에서 200mM D-리보오스, 160mM D-글루코스 및 200mM D-트레오스로 배양하여 콜라겐 당화를 준비합니다.
참고: 당화 콜라겐을 준비하려면 분자량에 따라 당의 무게를 측정하고 쥐꼬리 섬유소 상태의 콜라겐 유형 I(3.89mg/mL)과 혼합합니다. - 혈청 및 항생제 보충 없이 DMEM/F12 배양 배지에서 준비된 당화 콜라겐 세포외 기질(ECM-GC, 100 μg/mL) 또는 정상 콜라겐 세포외 기질(ECM-NC, 100 μg/mL)을 사용하여 24시간 동안 감각 유사 뉴런 세포 배양을 배양합니다.
3. 칼슘 유입 분석
- 칼슘 유입의 경우 칼슘 플럭스 분석 키트를 사용하고 아래 표시된 대로 제조업체의 지침에 따라 용액을 준비하십시오.
- 초기에는 998μL의 1x 분석 완충액(HBSS 완충액과 10x Pluronic F127 Plus의 혼합)에 2μL의 Fluo-8 원액을 첨가하여 1mL의 Fluo-8 염료 로딩을 준비합니다.
알림: 이 작업 솔루션은 실온(RT)에서 최소 2시간 동안 안정적입니다. - 나중에, 37°C에서 5%CO2 의 가습 분위기에서 30분 동안 ECM-NC 또는 ECM-GC로 분화 및 처리한 감각 유사 뉴런 세포의 각 플레이트형 접시에 이 용액 250μL를 배양합니다. 그런 다음 인큐베이터에서 접시를 꺼내 30분 동안 RT(어둠 속)로 유지합니다.
참고 : 이 용액은 2 h 배양이 외삽되면 세포 독성이됩니다. 배양 기간 동안 캡사이신 용액을 준비합니다.
4. 캡사이신 유도
참고: TRPV1 작용제인 캡사이신(Capsaicin)은 세포의 칼슘 유입을 유도하는 데 사용되었습니다.
- 캡사이신을 칭량하여 1% 에탄올과 초순수에 희석합니다. 그런 다음, 역시 초순수에 희석한 2μM 농도의 용액을 준비한다.
참고: 캡사이신 용액은 사용 당일에 만들어야 합니다. 캡사이신을 먼저 에탄올에 희석한 다음 물에 희석하십시오. 그렇지 않으면 침전됩니다. - 최종 농도가 1μM가 되도록 각 35/10mm 페트리 접시에 250μL의 2μM 캡사이신 용액을 추가합니다.
참고: 캡사이신의 원액 농도는 2μM로 더 나은 분산을 보장하고 고립된 형광 피크를 피할 수 있었습니다.
5. 칼슘 유입 이미징 및 컨포칼 현미경 분석
참고: 이미징은 20x/0.75NA 대물렌즈와 488nm 여기 레이저(0.5% 강도)가 장착된 컨포칼 현미경에서 수행되었습니다. 방출은 520nm에서 감지되었습니다. 셀은 600Hz의 속도(t)로 시간(t)에 따라 xy축(512 x 512 픽셀)에서 433ms의 획득 간격과 5분의 총 획득 시간으로 스캔되었습니다. 이미징은 현미경 소프트웨어를 사용하여 세포의 생리적 상태를 유지하기 위해 37°C에서 수행되었습니다.
- 250 μL의 2 μM 캡사이신 용액(플레이트의 최종 농도는 1 μM)이 포함된 주사기를 준비하고 두피 정맥 세트(Butterfly type 23 GA sterile)에 연결합니다. 실험실 스탠드와 cl을 사용하여 주사기를 고정합니다.amp.
- 페트리 접시를 현미경 스테이지에 올려 놓고 각별한 주의로 두피 바늘을 페트리 접시에 넣고 바닥과의 접촉을 피하고 바늘 끝이 액체에 잠기지 않도록 합니다.
알림: 접착 테이프를 사용하여 두피 위치를 고정할 수 있습니다. - 적절한 수의 셀(20개 이상)이 있는 필드를 찾고 명시야 조명을 사용하여 초점을 조정합니다.
- 488nm 레이저로 라이브 모드를 시작하고 초점 및 조명 매개변수를 조정합니다.
- 획득 기록을 시작하고 기준선 기간(t = 0 - t = 60초) 후에 2μL 2μM 캡사이신을 250μL에 바르고 실린지 플런저를 부드럽게 밀어 세포로의 칼슘 유입을 자극합니다.
참고: 최종 기록 획득 시간은 플레이트당 약 300초였습니다.
6. 후처리/데이터 분석
- 정량화 모드에서 현미경 소프트웨어를 사용하여 세포 분석을 수행합니다. 먼저 캡사이신 자극 전후의 형광 스파이크 세포를 분석합니다.
- 각 반응성 세포, 즉 캡사이신 후 형광 스파이크를 표시하는 세포에 관심 영역(ROI)을 생성합니다. 위와 같이 전체 셀 영역에서 ROI를 그려야 합니다(그림 1).
- 후속 분석을 위해 CSV(쉼표로 구분된 값) 파일로 데이터를 내보냅니다.
- 또는 무료로 제공되는 소프트웨어 FIJI7 (https://fiji.sc)을 사용하여 분석을 수행합니다.
- 이미지 파일을 열려면 File > Import > Bio-Formats로 이동하여 파일을 선택하여 Bio-Formats 플러그인을 사용합니다.
- 그런 다음 돋보기 도구를 사용하여 확대하고 자유형 선택 도구를 사용하여 반응형 셀 주위에 ROI(관심 영역)를 그립니다.
- 각 ROI를 그린 후 T 키를 눌러 ROI Manager에 추가합니다. 관심 있는 모든 셀에 대해 이 과정을 반복합니다(그림 2).
- 모든 ROI가 추가되면 ROI Manager 창으로 이동하여 모든 ROI를 선택한 다음 메인 메뉴에서 Analyze > Set Measurements 로 이동합니다.
- 그런 다음 ROI Manager로 돌아가서 More > Multi Measure 를 선택하여 모든 프레임의 강도를 측정합니다. 결과가 새 창에 나타납니다. File (파일) > Save As(다른 이름으로 저장)로 이동하여 CSV 파일로 내보냅니다.
참고: CSV 파일은 Excel, Google 스프레드시트 및 GraphPad 소프트웨어에서 분석할 수 있습니다. 방정식 ΔF/F0 = (F(t) - F0)/F0 을 사용하여 Fluo-8 Calcium Flux Assay Kit로 얻은 형광 강도 값을 칼슘 유입 변화의 상대적 측정값으로 변환합니다. 여기서,F0 는 캡사이신으로 자극하기 전에 t = 0초부터 t = 60초까지 캡처된 이미지의 평균 강도로 계산된 기준선 형광을 나타냅니다. F(t)는 자극 후 관찰된 최대 형광 강도의 값으로, 이를 통해 최대 칼슘 유입량을 평가할 수 있습니다. 이 접근법은 기준선에 비해 형광이 증가한다는 것을 강조하며, ΔF/F0 의 상승은 세포 내 칼슘 수치가 상승했음을 나타냅니다.
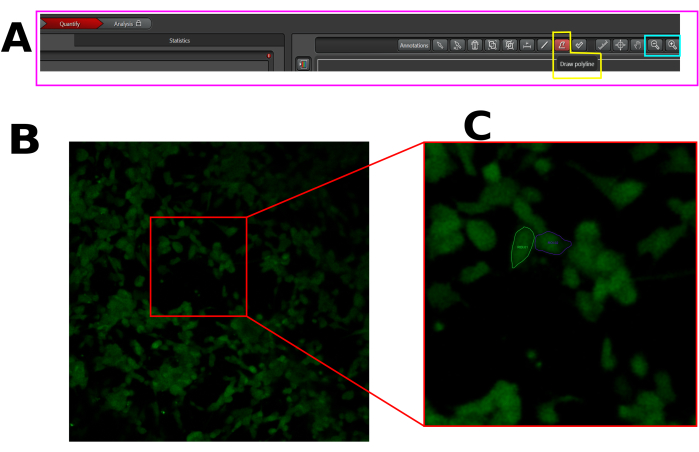
그림 1: LAS X 소프트웨어에서 칼슘 유입 분석을 위해 선택한 세포의 ROI 예. (A) 정량화 모드의 LAS X 인터페이스. 분홍색 사각형은 수량화 탭을 나타냅니다. 노란색 사각형은 폴리라인 그리기 도구를 나타내고 청록색 사각형은 축소 및 확대 도구를 나타냅니다. (B) 캡처된 시야(FOV). (C) FOV를 확대하여 전체 셀에서 ROI를 쉽게 그릴 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
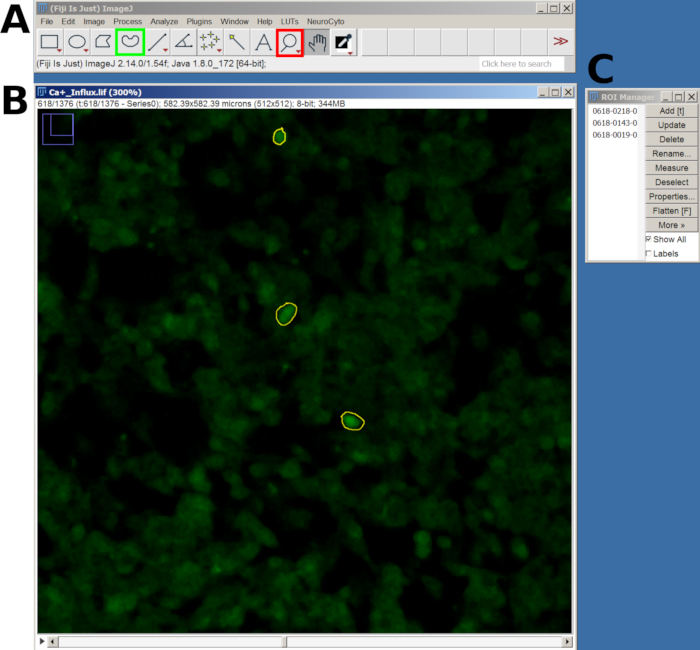
그림 2: FIJI 소프트웨어에서 칼슘 유입 분석을 위해 선택한 세포의 ROI 예. (A) 메인 메뉴와 도구를 보여주는 FIJI 인터페이스. 빨간색 사각형은 돋보기 도구를 나타내고 녹색 사각형은 자유형 선택 영역을 나타냅니다. (B) 확대 및 그려진 ROI로 캡처된 시야(FOV). (C) ROI 관리자 창. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7. 문제 해결
- 이미지의 초점이 맞지 않으면 다음을 시도해 보십시오.
- 테이프의 접착력을 확인하십시오. 느슨해지면 바늘이 이동하여 초점에 영향을 줄 수 있습니다.
- 안정성을 높이기 위해 추가 테이프로 바늘을 다시 부착합니다.
- 표준 바늘 교체. 미리 구부러진 치과 바늘 끝을 사용하여 플레이트의 정렬을 개선합니다.
- 셀에서 포화 신호가 나타나면 다음 단계를 시도해 보십시오.
- 레이저 강도 및 게인 설정을 줄입니다.
- 시약 배양 시간을 확인합니다. 제조업체의 권장 사항을 초과하면 신호 포화로 이어져 칼슘 유입 감지가 복잡해질 수 있습니다.
- 문제 해결을 위한 다음 추가 제안 사항을 따르십시오.
- 정기 보정: 초점 및 신호 감지 품질을 유지하기 위해 이미징 장비를 정기적으로 보정해야 합니다.
- 변경 사항 문서화: 나중에 참조하고 문제 해결을 용이하게 하기 위해 프로토콜에 대한 모든 조정 사항을 로그로 보관합니다.
- 반응적 조정: 문제가 지속되면 다른 시약 농도 또는 대체 신호 검출 방법으로 테스트하는 것이 좋습니다.
결과
SH-SY5Y 세포가 감각 유사 뉴런으로 분화
High-Content 스크리닝 이미지는 신경 분화 프로토콜이 SH-SY5Y 세포 형태를 변화시킨다는 것을 보여줍니다. 감각과 유사한 뉴런 세포(분화된 세포)는 광범위한 신경 필라멘트 네트워크를 투영하는 둥근 세포체를 나타냅니다. 그들은 주변 뉴런을 연결하는 더 길쭉한 신경돌기 돌기의 가지를 형성하며, 이는 성숙한 뉴런 특징과 일치합니다(그림 3)4. 중요한 것은 이러한 세포가 미분화 SH-SY5Y 세포와 비교할 때 TRPV1 수치가 증가했다는 것입니다(그림 4).
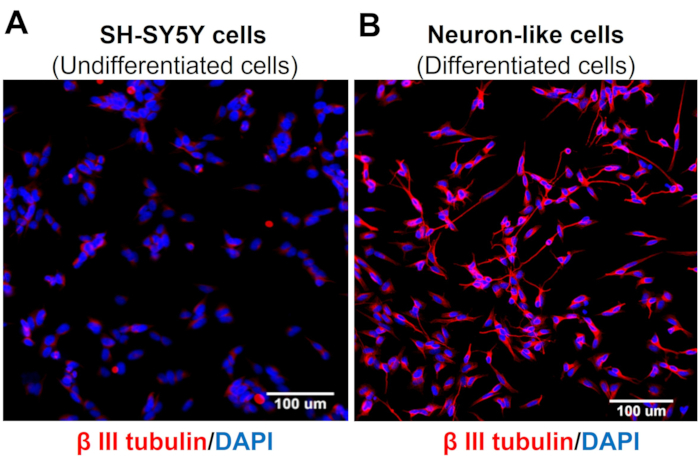
그림 3: 미분화 및 분화된 세포에서 β-III 튜불린 발현. (A) 미분화 세포(SH-SY5Y 세포) 및 (B) 분화된 세포(감각 뉴런 유사 세포)에서 특정 신경 세포 마커(β-III 튜불린)의 고함량 스크리닝(Molecular Devices, San Jose, CA, EUA) 면역 형광 이미지. 5개 지역의 대표 이미지입니다. 배율 : 20 배. 눈금 막대 : 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
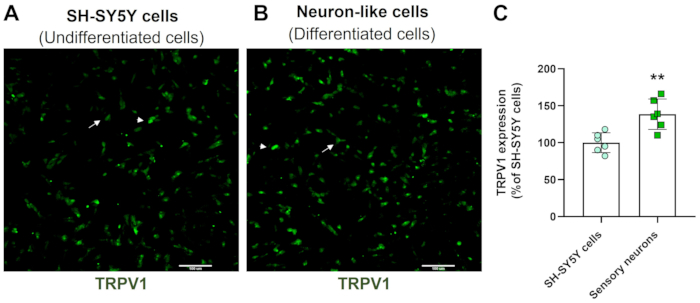
그림 4: 미분화 및 분화된 세포에서의 TRPV1 발현. (A) 미분화 세포(SH-SY5Y 세포) 및 (B) 분화된 세포(감각 뉴런 유사 세포)에서 TRPV1 발현의 HCS 면역형광 이미지. 4 개의 영역을 대표하는 이미지입니다. 화살표는 저발현 TRPV1 세포를 표시하고, 화살촉은 고발현 TRPV1 세포를 표시합니다. 배율 : 10 배. 스케일 바: 100 μm. (C) SH-SY5Y 세포 및 감각 뉴런에서 TRPV1 발현의 정량화. 짝을 이루지 않은 학생의 t-검정, **p<0.005 vs EMC-NC, n= 6. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
감각 유사 세포와 상호 작용하는 콜라겐 당화는 고통스러운 미세환경을 모방합니다4. 여기서, 우리는 당화 콜라겐이 정상 콜라겐으로 처리된 세포와 비교할 때 캡사이신에 의한 칼슘 유입을 향상시킨다는 것을 보여주었습니다(그림 5). 이러한 결과는 AGE가 캡사이신 유발 전류를 증가시키기에 충분하다는 것을 시사합니다.
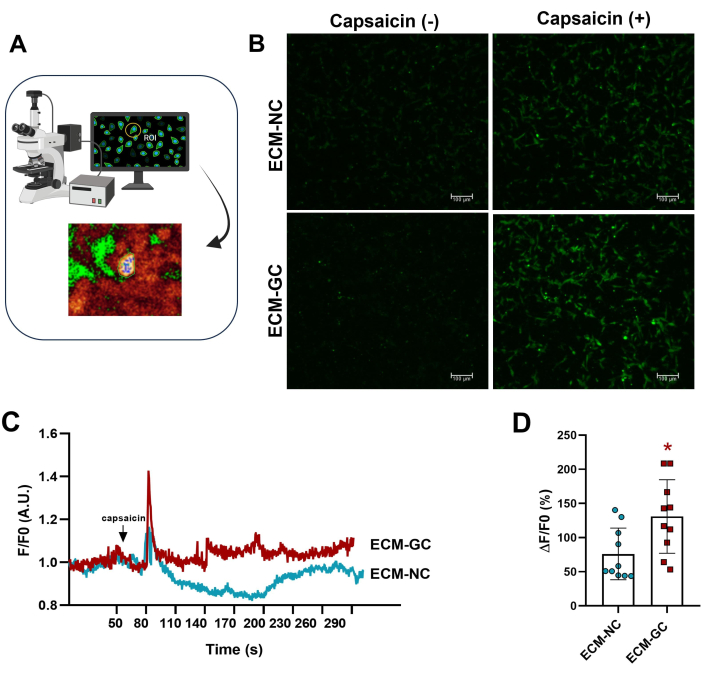
그림 5: 세포 내 칼슘 측정.(A) 형광 관심 영역(ROI) 식별. (B-D) 칼슘 유입은 캡사이신 적용 전후에 증가된 형광으로 표시됩니다(1μM, 최종 농도). 화살표는 캡사이신 적용을 나타냅니다. 세포 내 칼슘의 증가는 ΔF/F0(F0는 기초 형광)로 측정되었습니다. 쌍을 이룬 스튜던트의 t-검정(Wilcoxon matched-pairs), *p < 0.05 ECM-NC와 비교, n= 10 셀. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
통각 수용기는 통증을 중재하는 감각 뉴런의 특수한 부분 집합입니다. 이 세포는 TRPV1과 같은 전위의존성 및 리간드 이온 채널을 발현하며, 이 채널은 활성화로 칼슘 유입과 통각 수용성 전달을 조절하는 뉴로펩티드 및 신경전달물질의 방출로 이어집니다. 여기에서는 캡사이신 유도 칼슘 유입을 평가하기 위해 SH-SY5Y를 감각 유사 뉴런 세포로 분화하는 프로토콜에 대해 설명합니다 8,9. 중요한 것은, 당화 콜라겐으로 통각(pro-nociceptive) 환경을 모방하면 캡사이신에 의한 칼슘 유입이 상향 조절된다는 것을 보여주었으며, 이를 통해 TRPV1 채널이 기능적이며, AGE가 유해한 자극에 대한 반응을 증가시켜 이러한 채널을 민감하게 만들 수 있음을 확인했습니다.
감각 뉴런의 칼슘 유입을 평가하는 것은 진통제 후보를 선별하는 데 유용한 도구이다10. Fluo-8과 같은 안정적인 칼슘 염료의 개발과 함께 분자 칼슘 지표의 설계가 진전을 이루었습니다. Fluo-8(세척 방법 없음)은 다른 형광 염료에 비해 밝기 증가, 실온에서 작업, 낮은 칼슘 농도에 대한 더 높은 민감도 등의 장점이 있습니다. 이 프로토콜에서는 캡사이신이 두피 정맥 세트를 통해 적용되었습니다. 이전에는 일반 피펫을 사용했지만 종종 셀 플레이트를 대체하여 이미지 획득을 방해했습니다. 또 다른 가능성은 관류 펌프를 사용하여 캡사이신을 천천히 전달하는 것입니다. 흥미롭게도, 이 프로토콜의 접근 방식은 모든 실험실에서 구현할 수 있는 쉽게 구할 수 있고 비용 효율적인 구성 요소를 활용하여 칼슘 유입을 모니터링하기 위한 기존 관류 챔버에 비해 상당한 이점을 제공합니다. 또한 여기에 설명된 장치는 연구 환경에서 일반적으로 사용되는 대부분의 형광 현미경과 보편적으로 호환되므로 특수 장비나 수정이 필요하지 않습니다. 이러한 적응성은 다양한 이미징 구성 전반에 걸쳐 원활한 통합을 촉진하여 특히 예산이 제한된 실험실에서 더 광범위한 실험실에 대한 고급 칼슘 이미징 기술의 접근성을 향상시킵니다. 그러나 자동 형광 측정의 벤치탑 멀티모드 마이크로플레이트 리더와 달리 여기에 설명된 방법의 한 가지 한계는 고해상도 이미징 장비와 수동 피펫팅이 필요하여 시간이 더 많이 소요된다는 것입니다. 그러나 컨포칼 현미경 검사는 낮은 형광 방출을 검출할 수 있는 장점이 있습니다.
감각 뉴런을 연구하는 방법은 대부분 일차 세포 배양 또는 만능 줄기 세포(iPS) 세포를 사용합니다. 일차 인간 감각 뉴런은 거의 접근할 수 없으며 iPS를 생성하는 것은 노동 집약적이며 값비싼 시약과 전문 기술자가 필요합니다. 그러므로, SH-SY5Y를 온전한 인간 뉴런의 생리학적 특성을 완전히 유지하지 못하는 뉴런 세포로 분화시키는 데 관련된 한계에도 불구하고, 이들은 1차뉴런과 형태학적으로 유사하며9,10 나트륨 채널의 발현, 물질 P 방출, 캡사이신 및 모르핀에 대한 반응성과 같은 중요한 특징을 유지한다 4,11,12,13.
통증은 복잡한 질환이며, 배양된 뉴런 흥분을 손상시키는 약물을 찾는 것만으로는 통증 감각을 차단하기에 충분하지 않을 수 있습니다. 그러나 모르핀이 당화 콜라겐 유도 물질 P 방출을 감소시킨다는 것을 보여주는 이전 데이터는 우리의 모델이 새로운 진통 분자를 찾는 데 유용하다는 것을 시사합니다. 또한, 여기에서 우리는 당화 콜라겐이 캡사이신 유도 칼슘 유입에 대해 뉴런을 과민하게 만들기에 충분하다는 것을 입증했으며, 이는 AGE가 있는 상태에서 칼슘 이미징이 고통스러운 염증성 및 퇴행성 질환에 대한 새로운 치료 화합물을 찾는 데 유용할 수 있음을 나타냅니다. 참고로, 우리는 1μM 캡사이신을 사용하여 뉴런 8,14,15에서 Ca2+ 이미징을 위한 표준 농도인 Ca2+ 유입을 유도했습니다. 그러나 실험 조건을 최적화하기 위해 향후 연구에서 용량-반응 곡선을 수행해야 합니다.
칼슘 유입을 평가하기 위해 여기에 설명된 방법은 뉴런 유사 세포를 넘어 더 광범위한 응용 분야를 가질 수 있습니다. 또한 1차 감각 세포 배양에 적합하며 심근세포 및 대식세포와 같은 다른 세포 유형에 적용할 수 있습니다. 또한, 당화 콜라겐이 노화와 함께 당뇨병 합병증과 같은 병리학적 상태에서 발생한다는 점을 감안할 때 이 접근 방식은 신장 질환 및 안구 질환을 조사하는 데 유용한 도구가 될 수 있습니다.
프로토콜의 주요 수정 사항은 표준 바늘을 미리 구부러진 치과 바늘 끝으로 교체하는 것입니다. 이 곡선형 바늘을 사용하면 플레이트를 더 잘 조정할 수 있어 취급을 최소화하고 필요한 접착 테이프의 양을 줄이며 팁이 플레이트 바닥에 닿을 위험을 낮출 수 있습니다.
절차 중에 발생할 수 있는 몇 가지 문제와 해결 방법은 프로토콜의 섹션 7에 자세히 설명되어 있습니다. 플레이트의 바늘을 조정한 후 이미지의 초점이 맞지 않으면 접착 테이프가 헐거워져 바늘이 플레이트를 이동시키는지 확인하십시오. 더 나은 안정성을 위해 바늘을 추가 테이프로 다시 부착하는 것이 좋습니다. 세포가 포화 신호를 보이면 레이저 강도와 게인 매개변수를 줄이려고 노력해야 합니다. 시약 배양 시간을 확인합니다. 우리의 경험에 따르면 배양 시간이 제조업체의 권장 사항을 초과하면 신호가 과도하게 강해져 칼슘 유입 감지를 방해할 수 있습니다. 액체 주입 후 예상치 못한 형광 피크 및 세포 박리의 경우, 갑작스러운 형광 스파이크를 방지하고 세포 부착을 방해하지 않도록 액체를 천천히 주입해야 합니다. 빠른 주입은 난류를 생성하여 일시적인 신호 아티팩트를 일으키고 웰 바닥에서 세포를 분리할 수 있습니다.
공개
MCB, AMCT 및 VOZ는 골관절염 통증과 관련된 분자 실체를 식별하는 과정에 대한 특허를 보유하고 있습니다(BR102018008561-1).
감사의 말
이 작업은 Fundação Amparo à Pesquisa do Estado de São Paulo FAPESP 보조금 번호 2015/50040-4 및 2020/13139-0, São Paulo Research Foundation 및 GlaxoSmithKline, FAPESP 2022/08417-7 및 2024/04023-0의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| All-trans retinoic acid | Tocris | 695 | |
| BDNF | Tocris | TOCR-2837 | |
| BDNF | Sigma-Aldrich | B3795 | |
| Butterfly type 23GA sterile | Beckton Dickinson Asepto | 38833814 | Scalp vein set |
| Capsaicin | Sigma-Aldrich | M2028 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| DMEM/F12 | Gibco | 12500062 | Basal medium |
| D-ribose | Sigma-Aldrich | R7500 | |
| D-threose | Sigma-Aldrich | T7392 | |
| Fluo-8 Calcium Flux Assay Kit | Abcam | ab112129 | No wash |
| Heat-inactivated fetal bovine serum | Gibco | A5670801 | |
| High Content Screening | Molecular Devices | ||
| LASX software | Leica Microsystems | Microscopy software | |
| Leica TCS SP8 | Leica Microsystems | Leica TCS SP8 | Confocal microscope |
| Penicillin-streptomycin | Gibco | 15140130 | |
| Petri dish (35/10 mm) | Greiner bio-one | 627965 | |
| Rat tail type I collagen | Corning | 354236 | |
| SH-SY5Y | Merck | 94030304-1VL | Neuroblastoma cell line |
참고문헌
- Bierhaus, A., et al. Understanding RAGE, the receptor for advanced glycation end products. J Mol Med. 83 (11), 876-886 (2005).
- Hudson, B. I., et al. Blockade of receptor for advanced glycation endproducts: A new target for therapeutic intervention in diabetic complications and inflammatory disorders. Arch Biochem Biophys. 419 (1), 80-88 (2003).
- Dandia, H., Makkad, K., Tayalia, P. Glycated collagen - a 3D matrix system to study pathological cell behavior. Biomater Sci. 7 (8), 3480-3488 (2019).
- Bufalo, M. C., et al. Human sensory neuron-like cells and glycated collagen matrix as a model for the screening of analgesic compounds. Cells. 11 (2), 247 (2022).
- Frias, B., Merighi, A. Capsaicin, nociception and pain. Molecules. 21 (6), 797 (2016).
- Lam, D., et al. RAGE-dependent potentiation of TRPV1 currents in sensory neurons exposed to high glucose. PLoS One. 13 (2), e0193312 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Li, F., et al. TRPV1 activity and substance P release are required for corneal cold nociception. Nat Commun. 10 (1), 5678 (2019).
- Mickle, A. D., Shepherd, A. J., Mohapatra, D. P. Sensory TRP channels:the key transducers of nociception and pain. Prog Mol Biol Transl Sci. 131, 73-118 (2015).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiol Pain. 11, 100083 (2022).
- Vetter, I., et al. Characterisation of Nav types endogenously expressed in human SH-SY5Y neuroblastoma cells. Biochem Pharmacol. 83 (11), 1562-1571 (2012).
- Dekker, L. V., et al. Analysis of human Nav1.8 expressed in SH-SY5Y neuroblastoma cells. Eur J Pharmacol. 528 (1-3), 52-58 (2005).
- Lam, P. M. W., Hainsworth, A. H., Smith, G. D., Owen, D. E., Davies, J., Lambert, D. G. Activation of recombinant human TRPV1 receptors expressed in SH-SY5Y human neuroblastoma cells increases [Ca2+]i initiates neurotransmitter release and promotes delayed cell death. J Neurochem. 102 (3), 801-811 (2007).
- Koplas, P. A., Rosenberg, R. L., Oxford, G. S. The role of calcium in the desensitization of capsaicin responses in rat dorsal root ganglion neurons. J Neurosci. 17 (10), 3525-3537 (1997).
- Tominaga, M., et al. The cloned capsaicin receptor integrates multiple pain-producing stimuli. Neuron. 21 (3), 531-543 (1998).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유