Method Article
Усовершенствованные конечные продукты гликирования сенсибилизируют сенсорные нейронные клетки человека к индуцированному капсаицином притоку кальция
* Эти авторы внесли равный вклад
В этой статье
Резюме
Повышенное содержание конечных продуктов гликирования (КПГ), полученных из коллагена, неизменно связано с болезненными заболеваниями. В данной работе мы исследовали, повышает ли гликирование сенсибилизацию сенсорных нейронов к возбуждению капсаицина.
Аннотация
Повышенное содержание конечных продуктов гликирования (КПГ), полученных из коллагена, неизменно связано с болезненными заболеваниями, включая остеоартрит, диабетическую нейропатию и нейродегенеративные расстройства. Сенсорные нейроны человека, дифференцированные от клеточной линии SH-SY5Y, приобретают проноцицептивные функции при воздействии КПГ за счет высвобождения вещества P и повышения экспрессии транзиторного рецепторного потенциала ваниллоида 1 (TRPV1). В данной работе мы исследовали, является ли этот рецептор функционально активным и сенсибилизирует ли процесс гликации сенсорные нейроны к возбуждению капсаицина. Сенсорноподобные нейронные клетки были получены в результате дифференцировки клеток SH-SY5Y с полностью транс-ретиноевой кислотой и нейротрофическим фактором мозга. Инкубация с гликированным коллагеновым внеклеточным матриксом (ECM-GC) имитировала проноцицептивный стимул. Контрольные клетки инкубировали с негликированным внеклеточным коллагеновым матриксом (ECM-NC). Для оценки притока кальция использовался набор Fluo-8 Calcium Flux Assay Kit, который стимулировался капсаицином. Результаты показывают, что гликирование увеличивает приток кальция по сравнению с клетками, обработанными нормальным коллагеном, что позволяет предположить, что сенсорные нейроны экспрессируют функциональные каналы TRPV1 и что гликирование увеличивает возбуждение капсаицина. Эти данные указывают на то, что КПГ являются гиперчувствительными сенсорными нейронными клетками, запускающими проноцицептивную сигнализацию. В совокупности наши результаты свидетельствуют о том, что мы создали функциональную модель, реагирующую на капсаицин, которая может быть полезна для скрининга кандидатов на лечение болезненных состояний.
Введение
Гликирование — это неферментативный, необратимый и спонтанный процесс, при котором белки, такие как коллаген, связываются с молекулами редуцирующего сахара, что приводит к усовершенствованным конечным продуктам гликирования (КПГ). КПГ могут активировать рецепторы клеточных мембран, запуская активацию внутриклеточных путей, таких как внеклеточная сигнал-регулируемая протеинкиназа (ERK) 1/2, p38 митоген-активируемая протеинкиназа (MAPK) и n-концевые киназы c-jun (JNKs), ро-ГТФазы, фосфоинозитол-3-киназа (PI3K), янус-киназа/сигнальный преобразователь и активатор транскрипции (JAK/STAT) и протеинкиназа C (PKC), увеличивая высвобождение провоспалительных молекул и окислительный стресс1. Гликированный коллаген также ухудшает структуру и свойства внеклеточного матрикса, а повышенные КПГ, полученные из коллагена, неизменно связаны с болезненными заболеваниями, включая остеоартрит, диабетическую нейропатию и нейродегенеративные расстройства 2,3.
Наша группа ранее продемонстрировала, что клеточная линия SH-SY5Y может быть дифференцирована в сенсорные нейронные клетки, поскольку эти клетки экспрессируют каналы, участвующие в ноцицепции, такие как натриевые каналы (Nav 1.7, Nav 1.8 и Nav 1.9) и транзиторный рецепторный потенциал ваниллоида 1-го типа (TRPV1), маркеры, обычно обнаруживаемые в периферических сенсорных нейронах4. TRPV1 представляет собой неселективный катионный канал, проницаемый для ионов кальция и чувствительный к раздражителю капсаицина. Важно отметить, что когда сенсорные нейронные клетки подвергаются воздействию гликированного коллагенового матрикса (ECM-GC), они приобретают проноцицептивные функции за счет увеличения экспрессии c-Fos, транскрипционного фактора, участвующего в активации нейронов, и высвобождения вещества P, нейропептида, широко участвующего в нейровоспалении и боли. Эти клетки реагируют на анальгетики, такие как морфин, прототип опиата, снижая индуцированное ECM-GC высвобождение вещества P. В совокупности эти данные указывают на то, что данная модель реагирует на про и антиноцицептивную молекулу 4,5.
Мониторинг внутриклеточных изменений концентрацииCa2+ имеет важное значение для изучения многочисленных клеточных процессов. В нейронах он может быть полезным инструментом для прогнозирования повреждения нейронов и нейропротекторных свойств лекарств. Капсаицин, острый активный ингредиент острого перца чили, является наиболее изученным агонистомрецептора TRPV1 5 и ценным инструментом для изучения механизмов боли и скрининга потенциальных новых анальгетиков. Предыдущие исследования показали, что первичные сенсорные нейроны из ганглиев дорсального корешка грызунов, инкубированных с высоким содержанием глюкозы, демонстрируют значительное увеличение индуцированного капсаицином притока кальция6. Тем не менее, остается неизвестным, был ли канал TRPV1 функционально активен в нашей клеточной модели и сенсибилизирует ли гликированный коллаген сенсорные нейронные клетки к возбуждению капсаицина, что может активировать ноцицептивные сигнальные пути. Поэтому мы стремились разработать экономически эффективный протокол, использующий простые инструменты для мониторинга кальция в сенсорных клетках в режиме реального времени, обеспечивая при этом надежный анализ. В этой статье мы предоставляем комплексный протокол, который поможет исследователям пройти этапы дифференцировки клеток SH-SY5Y в клетках сенсорных нейронов и того, как повысить их сенсибилизацию к проноцицептивным стимулам. Этот метод может способствовать открытию новых обезболивающих или нейропротекторных соединений.
протокол
Культура 1. SH-SY5Y и дифференцировка в сенсорноподобные нейронные клетки
ПРИМЕЧАНИЕ 1: Все шаги, описанные в этом разделе, должны выполняться под ламинарным вытяжным колпаком, а все растворы и расходные материалы должны быть стерильными.
- Сначала приготовьте колбу для культур (25 см2 ), добавив 5 мл питательной среды.
ПРИМЕЧАНИЕ: Для размораживания, расширения и поддержания этого типа клеток используйте смесь питательных сред: Dulbecco Modified Eagle's and Ham's Medium F12 (DMEM/F12) с добавлением 10% термоинактивированной фетальной бычьей сыворотки и 1% пенициллин-стрептомицина. - Затем извлеките криопробирку, содержащую клетки SH-SY5Y, из жидкого азота и держите ее на льду. Разморозьте клетки на водяной бане при температуре 37 °C в течение 2 минут.
- Добавьте 1 мл полной питательной среды в криовиальную среду, перенесите клетки в пробирку объемом 15 мл, добавьте 3 мл полной питательной среды (DMEM/F12 с добавлением 10% термоинактивированной фетальной сыворотки крупного рогатого скота) и перемешайте, многократно набирая ее и дозируя обратно в пробирку с помощью пипетки.
- Пипетируйте клетки в пробирку объемом 15 мл и центрифугируйте при давлении 290 г. Утилизируйте надосадочную жидкость, чтобы удалить диметилсульфоксид (ДМСО), криопротекторное средство, используемое для предотвращения образования кристаллов льда во время замораживания клеток.
- Добавьте 1 мл питательной среды к клеточной грануле, хорошо перемешайте их с помощью пипетки и поместите в колбу с культурой 25 см2 для расширения клеток. Поместите клетки в инкубатор во влажной атмосфере с содержаниемCO2 5% при температуре 37 °C.
ПРИМЕЧАНИЕ: Клетки можно использовать, когда они достигают примерно 80% конфлюенции. Для дифференцировки нейронов рекомендуется использовать клетки SH-SY5Y до двадцати клеточного пассажа. - Приготовьте внеклеточный коллагеновый матрикс (100 мкг/мл), разбавив коллаген типа I типа крысиного хвоста в стерильном PBS, и налейте 1 мл этого раствора в чашку Петри (35/10 мм) для покрытия.
- Инкубируйте его в инкубаторе во влажной атмосфере с содержаниемCO2 5% в течение примерно 1 часа.
- По истечении этого срока дважды промойте пластину стерильным PBS, затем подсчитайте клетки с помощью камеры Нейбауэра.
- Чтобы подсчитать клетки, сначала промойте культуральную колбу 25см2 , содержащую клетку, 5 мл стерильного PBS, чтобы удалить всю питательную среду. Затем удалите стерильные PBS, добавьте в клетки 3 мл 0,05% трипсина и поместите их в инкубатор при температуре 37 °C и 5%CO2 примерно на 3-5 минут до полного отделения клеток.
- После этого извлеките клетки из инкубатора, добавьте в колбу для культур 6 мл питательной среды, и переложите этот раствор в пробирку объемом 15 мл. Центрифугировать при 290 г в течение 5 мин.
- Удалите надосадочную жидкость и хорошо суспендируйте клетки в 1 мл готовой питательной среды.
- Наконец, подсчитайте ячейки с помощью счетной камеры Нейбауэра. Смешайте 20 мкл ячеек и 20 мкл трипанового синего и добавьте 10 мкл этой смеси в камеру Нойбауэра. Посчитайте живые клетки, которые не окрашиваются в синий цвет.
- Планшет 5 × 104 клеток/мл клеток в чашке Петри (35/10 мм) на той же питательной среде, описанной ранее. Используйте общий объем 1 мл на одну тарелку.
- Затем подождите 24 часа, чтобы начать протокол дифференцировки нейронов. Для этого удалите питательную среду и замените ее 1 мл DMEM/F12 с добавлением 2% инактивированной тепловой сывороткой плода крупного рогатого скота, 1% пенициллин-стрептомицином и 10 мкМ полностью транс-ретиноевой кислоты (RA 10 мкМ).
- Подождите 48 ч и заменяйте питательную среду каждый день в течение 3 дней. Поместите клетки в инкубатор во влажной атмосфере с содержаниемCO2 5% при температуре 37 °C.
- На пятый день удалите среду из клеток и добавьте 1 мл бессывороточной питательной среды с добавлением нейротрофического фактора мозга человека (BDNF 50 нг/мл) в каждую пластину.
ПРИМЕЧАНИЕ: Тестировались BDNF от разных фирм (см. таблицу материалов). Все они работали одинаково. - На седьмой день дифференцировки промойте клетки стерильным PBS один раз и используйте сенсорные нейронные клетки для экспериментов. Если невозможно сразу использовать эти клетки для экспериментов, добавьте бессывороточную питательную среду, чтобы сохранить их живыми до использования.
Примечание: В конце дифференцировки нейронов необходимо промыть клетки стерильным PBS для удаления остатков BDNF, избегая клеточной токсичности.
2. Гликированный коллаген и процесс гликации
ПРИМЕЧАНИЕ: Все шаги в этом разделе должны выполняться под ламинарным колпаком, а все растворы и расходные материалы должны быть стерильными.
- Гликирование коллагена путем инкубации коллагена типа I из фибриллярного состояния крысиного хвоста (3,89 мг/мл) с 200 мМ D-рибозой, 160 мМ D-глюкозой и 200 мМ D-треозом при 4 °C в течение 7 дней.
ПРИМЕЧАНИЕ: Чтобы приготовить гликированный коллаген, взвесьте сахара на основе их молекулярной массы и смешайте их с коллагеном типа I из фибриллярного состояния крысиного хвоста (3,89 мг/мл). - Инкубировать культуру сенсорных нейронов в течение 24 ч с гликированным коллагеновым внеклеточным матриксом (ECM-GC, 100 мкг/мл) или нормальным коллагеновым внеклеточным матриксом (ECM-NC, 100 мкг/мл), приготовленным в культуральной среде DMEM/F12 без сыворотки и антибиотиков.
3. Анализ притока кальция
- Для притока кальция используйте набор для анализа кальция и приготовьте растворы в соответствии с инструкциями производителя, как указано ниже.
- Первоначально приготовьте 1 мл красителя Fluo-8, добавив 2 мкл стокового раствора Fluo-8 в 998 мкл 1x буфера для анализа (смесь буфера HBSS и 10x Pluronic F127 Plus).
ПРИМЕЧАНИЕ: Этот рабочий раствор стабилен не менее 2 часов при комнатной температуре (RT). - Затем инкубируют 250 мкл этого раствора в каждой пластинчатой чашке сенсорных нейронных клеток, предварительно дифференцированных и обработанных ECM-NC или ECM-GC, в течение 30 мин во влажной атмосфере с концентрацией 5%CO2 при 37 °C. Затем выньте чашку из инкубатора и подержите ее при температуре RT (в темноте) в течение 30 минут.
ПРИМЕЧАНИЕ: Этот раствор становится цитотоксичным при экстраполяции 2-часовой инкубации. Готовят раствор капсаицина в период инкубации.
4. Индукция капсаицином
Капсаицин, агонист TRPV1, использовался для индуцирования притока кальция в клетки.
- Взвесьте и разведите капсаицин в 1% этаноле и сверхчистой воде. Затем приготовьте раствор в концентрации 2 μМ, который также разбавили в сверхчистой воде.
ПРИМЕЧАНИЕ: Раствор капсаицина необходимо вносить в день использования. Разведите капсаицин сначала в этаноле, а затем в воде; В противном случае он выпадет в осадок. - Добавьте 250 мкл 2 мкМ раствора капсаицина в каждую чашку Петри диаметром 35/10 мм так, чтобы конечная концентрация составила 1 мкМ.
ПРИМЕЧАНИЕ: Концентрация капсаицина в исходном растворе составляла 2 мкМ для обеспечения лучшего диспергирования и предотвращения изолированных пиков флуоресценции.
5. Визуализация притока кальция и анализ конфокальной микроскопии
ПРИМЕЧАНИЕ: Визуализация проводилась в конфокальном микроскопе, оснащенном объективом 20x/0,75NA и лазером с возбуждением 488 нм (интенсивность 0,5%). Излучение было обнаружено на длине волны 520 нм. Ячейки сканировали по осям xy (512 x 512 пикселей) в течение времени (t) с частотой 600 Гц с интервалом сбора данных 433 мс и общим временем сбора данных 5 минут. Визуализация проводилась при температуре 37 °C для поддержания физиологического состояния клеток с помощью программного обеспечения для микроскопии.
- Приготовьте шприц с 250 μЛ 2 μМ раствора капсаицина (конечная концентрация в пластине будет 1 μМ) и подключите его к набору для кожи головы - Butterfly type 23 GA sterile. Закрепите шприц с помощью лабораторной подставки и зажима.
- Поставьте чашку Петри на предметный столик микроскопа и с особой осторожностью поместите иглу для кожи головы в чашку Петри, не допуская соприкосновения со дном, кончик иглы не должен быть погружен в жидкость.
ПРИМЕЧАНИЕ: Для фиксации положения кожи головы можно использовать клейкую ленту. - Найдите поле с достаточным количеством ячеек (более 20) и отрегулируйте фокус с помощью яркого света поля.
- Запустите режим Live с помощью лазера 488 нм и отрегулируйте параметры фокусировки и подсветки.
- Начните запись регистрации и по истечении исходного периода (t = 0 до t = 60 секунд) введите 250 мкл 2 мкМ капсаицина и осторожно нажмите на поршень шприца, чтобы стимулировать приток кальция в клетки.
ПРИМЕЧАНИЕ: Окончательное время захвата записи составило примерно 300 с на пластину.
6. Постобработка/анализ данных
- Выполните анализ клеток с помощью программного обеспечения для микроскопии в режиме количественной оценки . Во-первых, проанализируйте флуоресцентные спайковые клетки до и после стимуляции капсаицином.
- Создайте область интереса (ROI) в каждой чувствительной клетке, т.е. в клетках, которые демонстрируют всплеск флуоресценции после капсаицина. Убедитесь, что вы нарисовали ROI по всей площади ячейки, как показано выше (Рисунок 1).
- Экспортируйте данные в файл значений, разделенных запятыми (CSV) для последующего анализа.
- В качестве альтернативы можно провести анализ с помощью бесплатного программного обеспечения FIJI7 (https://fiji.sc).
- Чтобы открыть файлы изображений, используйте плагин Bio-Formats , перейдя в раздел Файл > Импорт > Биоформаты и выбрав файл.
- Затем используйте инструмент «Лупа» для увеличения масштаба и инструмент «Выделение от руки », чтобы нарисовать область интереса (ROI) вокруг чувствительных ячеек.
- После отрисовки каждого ROI нажмите клавишу T , чтобы добавить его в Менеджер ROI. Повторите этот процесс для всех интересующих вас клеток (рисунок 2).
- После того как все ROI будут добавлены, перейдите в окно «Менеджер ROI », выберите все ROI, а затем перейдите в раздел «Анализ > набор измерений » в главном меню.
- Затем вернитесь в диспетчер ROI и выберите «Больше» > «Мультимер», чтобы измерить интенсивность на всех кадрах. Результаты появятся в новом окне; экспортируйте как файл CSV, перейдя в раздел «Файл» > «Сохранить как».
ПРИМЕЧАНИЕ: CSV-файл может быть проанализирован в программах Excel, Google Sheets и GraphPad. Используйте уравнение ΔF/F0 = (F(t) - F0)/F0 для преобразования значений интенсивности флуоресценции, полученных с помощью набора для анализа потока кальция Fluo-8, в относительную меру изменения притока кальция. Здесь F0 представляет собой базовую флуоресценцию, рассчитанную как средняя интенсивность изображений, полученных от t = 0 с до t = 60 с до стимуляции капсаицином. F(t) – значение максимальной интенсивности флуоресценции, наблюдаемой после стимула, что позволяет оценить пиковый приток кальция. Этот подход подчеркивает увеличение флуоресценции относительно исходного уровня, где повышение ΔF/F0 указывает на повышенный внутриклеточный уровень кальция.
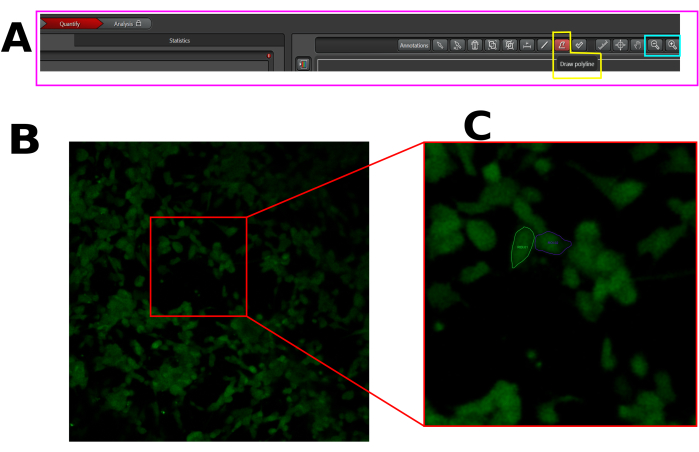
Рисунок 1: Пример ROI в выбранных ячейках для анализа притока кальция в программном обеспечении LAS X. (A) Интерфейс LAS X в режиме количественной оценки. Розовым прямоугольником показана вкладка количественной оценки. Желтый прямоугольник показывает инструмент рисования полилиний, а голубой прямоугольник показывает инструменты уменьшения и увеличения. (B) Захват поля зрения (FOV). (C) Увеличьте угол обзора, чтобы облегчить отрисовку ROI во всей ячейке. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
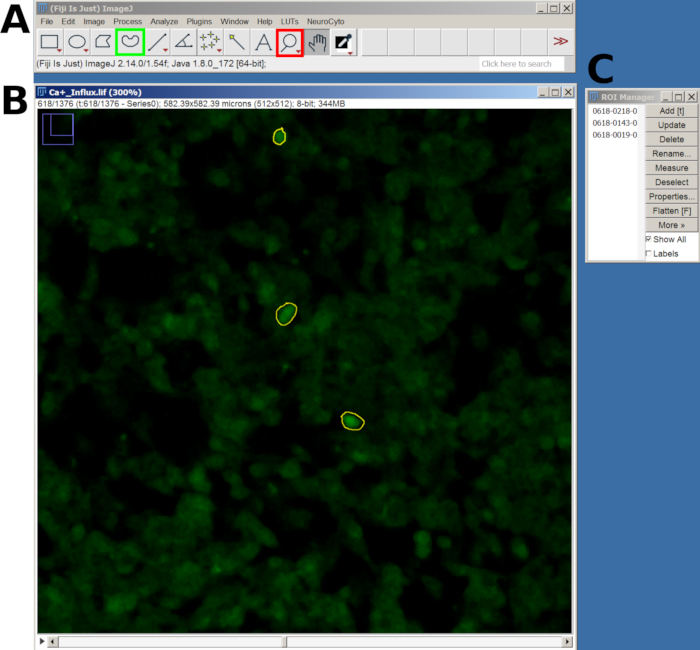
Рисунок 2: Пример ROI в выбранных ячейках для анализа притока кальция в программном обеспечении FIJI. (A) Интерфейс FIJI с главным меню и инструментом. Красным квадратом обозначен инструмент «Лупа», а зеленым квадратом — выбор «От руки». (B) Поле зрения (FOV) снято с увеличением и отрисовкой ROI. (C) Окно менеджера ROI. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
7. Устранение неполадок
- Если изображение не в фокусе, попробуйте выполнить следующие действия.
- Проверьте адгезию ленты; Если она ослабла, это может привести к смещению иглы и повлиять на фокус.
- Снова прикрепите иглу с помощью дополнительной ленты для повышения устойчивости.
- Замена штатных игл. Используйте предварительно изогнутые наконечники стоматологических игл для улучшения выравнивания на пластине.
- Если клетки проявляют насыщенный сигнал, попробуйте выполнить следующие действия:
- Уменьшите интенсивность лазера и настройки усиления.
- Проверьте время инкубации реагента. Если он превышает рекомендацию производителя, это может привести к насыщению сигнала, что затруднит обнаружение притока кальция.
- Следуйте этим дополнительным рекомендациям по устранению неполадок:
- Регулярная калибровка: Убедитесь, что оборудование для обработки изображений регулярно калибруется для поддержания фокусировки и качества обнаружения сигнала.
- Изменения в документах: Ведите журнал любых корректировок, внесенных в протокол, для дальнейшего использования и облегчения устранения неполадок.
- Реактивная корректировка: Если проблемы не устранены, рассмотрите возможность тестирования с использованием реагентов с другой концентрацией или альтернативными методами обнаружения сигнала.
Результаты
Дифференцировка клеток SH-SY5Y в сенсорные нейроны
Скрининговые изображения с высоким содержанием демонстрируют, что протокол дифференцировки нейронов изменяет морфологию клеток SH-SY5Y. Сенсорные нейронные клетки (дифференцированные клетки) имеют округлое клеточное тело, которое проецирует обширную сеть нейрофиламентов. Они образуют ветви более удлиненных нейритовых проекций, соединяющих окружающие нейроны, что согласуется с особенностями зрелых нейронов (рис. 3)4. Важно отметить, что эти клетки демонстрируют повышенные уровни TRPV1 по сравнению с недифференцированными клетками SH-SY5Y (Рисунок 4).
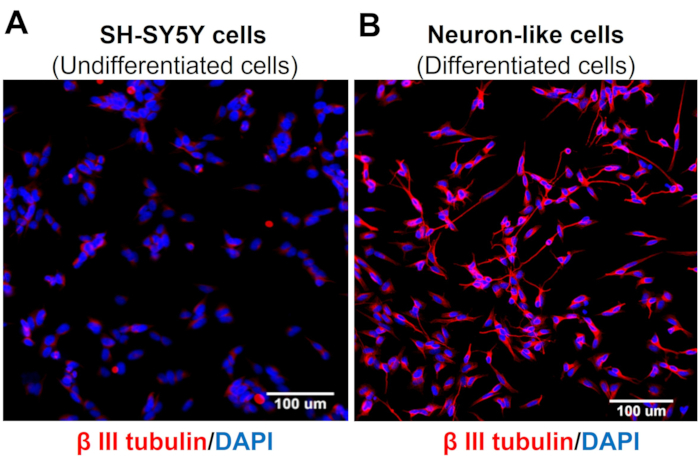
Рисунок 3: Экспрессия тубулина β-III в недифференцированных и дифференцированных клетках. High Content Screening (Molecular Devices, San Jose, CA, EUA) иммунофлуоресцентные изображения специфических нейрональных маркеров (тубулина β-III) в (А) недифференцированных клетках (клетки SH-SY5Y) и (В) дифференцированных клетках (сенсорные нейроноподобные клетки). Репрезентативные изображения пяти областей. Увеличение: 20x. Масштабная линейка: 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
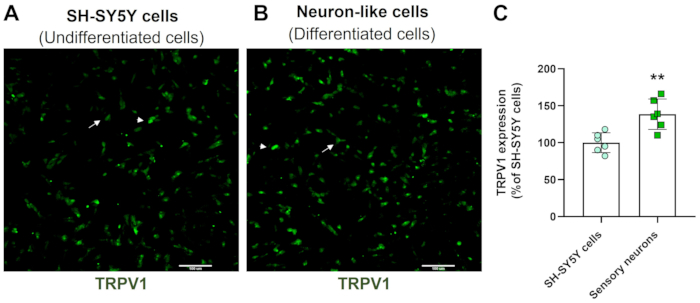
Рисунок 4: Экспрессия TRPV1 в недифференцированных и дифференцированных клетках. Иммунофлуоресцентные изображения экспрессии TRPV1 HCS в (А) недифференцированных клетках (клетках SH-SY5Y) и (В) дифференцированных клетках (сенсорных нейроноподобных клетках). Репрезентативные изображения четырех областей. Стрелка обозначает клетки TRPV1 с низкой экспрессией, а стрелка — клетки TRPV1 с высокой экспрессией. Увеличение: 10x. Масштабная линейка: 100 мкм. (C) Количественная оценка экспрессии TRPV1 в клетках SH-SY5Y и сенсорных нейронах. Непарный t-критерий Стьюдента, **p<0,005 по сравнению с EMC-NC, n= 6. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Гликирование коллагена, взаимодействуя с сенсорными клетками, имитирует болезненную микросреду4. Здесь мы показали, что гликированный коллаген усиливает индуцированный капсаицином приток кальция по сравнению с клетками, обработанными нормальным коллагеном (Рисунок 5). Эти результаты свидетельствуют о том, что КПГ достаточны для увеличения токов, вызванных капсаицином.
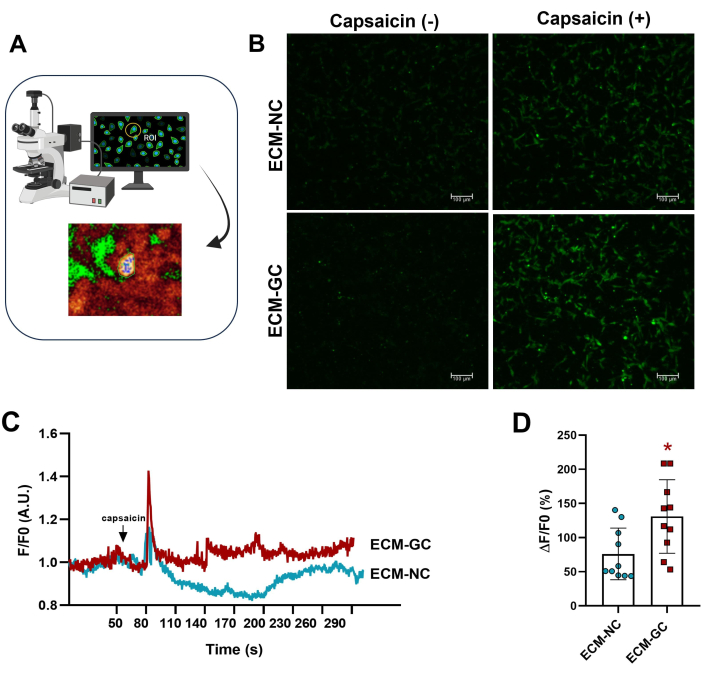
Рисунок 5: Внутриклеточные измерения кальция. (A) Определение флуоресцентной области интереса (ROI). (Б-Г) О притоке кальция свидетельствует повышенная флуоресценция до и после применения капсаицина (1 мкМ, конечная концентрация). Стрелка указывает на применение капсаицина. Увеличение внутриклеточного кальция определялось как ΔF/F0 (F0 — базальная флуоресценция). Парный t-критерий Стьюдента (пары Вилкоксона), *p < 0,05 по сравнению с ECM-NC, n= 10 клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Ноцицепторы — это специализированные подмножества сенсорных нейронов, которые опосредуют боль. Эти клетки экспрессируют потенциал-зависимые и лиганд-ионные каналы, такие как TRPV1, активация которых приводит к притоку кальция и высвобождению нейропептидов и нейротрансмиттеров, регулирующих ноцицептивную передачу. В данной работе мы описываем протокол дифференцировки SH-SY5Y в сенсорноподобные нейронные клетки для оценки индуцированного капсаицином притока кальция 8,9. Важно отметить, что мы показали, что при имитации проноцицептивной среды с гликированным коллагеном происходит повышенная регуляция индуцированного капсаицином притока кальция, подтверждая, что каналы TRPV1 функциональны, и КПГ могут сенсибилизировать эти каналы, повышая их реакцию на вредный стимул.
Оценка притока кальция в сенсорные нейроны является ценным инструментом для скрининга кандидатов на обезболивание10. Был достигнут прогресс в разработке молекулярных индикаторов кальция с разработкой стабильных кальциевых красителей, таких как Fluo-8. Fluo-8 (без метода промывки) имеет преимущества перед другими флуоресцентными красителями, в том числе повышенную яркость, работу при комнатной температуре и более высокую чувствительность к более низким концентрациям кальция. В этом протоколе капсаицин вводился через набор вен на коже головы. Раньше мы использовали обычную пипетку, но она часто смещала клеточную пластину и прерывала получение изображения. Другой возможностью может быть использование перфузионного насоса для медленной доставки капсаицина. Интересно, что подход в этом протоколе использует легкодоступные и экономически эффективные компоненты, которые могут быть реализованы в любой лаборатории, что дает значительное преимущество по сравнению с традиционными перфузионными камерами для мониторинга притока кальция. Кроме того, описанный здесь аппарат универсально совместим с большинством флуоресцентных микроскопов, обычно используемых в исследовательских условиях, что устраняет необходимость в специализированном оборудовании или модификациях. Такая адаптируемость обеспечивает бесшовную интеграцию в различные конфигурации визуализации, повышая доступность передовых методов визуализации кальция для более широкого круга лабораторий, особенно в лабораториях с ограниченным бюджетом. Однако, в отличие от настольного многорежимного считывателя микропланшетов для автоматизированных измерений флуоресценции, одним из ограничений описанного здесь метода является то, что он требует оборудования для визуализации с высоким разрешением и ручного пипетирования, что занимает больше времени. Тем не менее, преимущество конфокальной микроскопии заключается в том, что она обнаруживает более низкое флуоресцентное излучение.
Методы изучения сенсорных нейронов в основном используют первичную клеточную культуру или плюрипотентные стволовые (iPS) клетки. Первичные сенсорные нейроны человека доступны лишь в редких случаях, а создание iPS является трудоемким процессом и требует дорогостоящих реагентов и квалифицированных технических специалистов. Таким образом, несмотря на ограничение, связанное с дифференцировкой SH-SY5Y в нейрональные клетки, которые не полностью сохраняют физиологические характеристики интактного человеческого нейрона, они морфологически сходны с первичными нейронами 9,10 и сохраняют важные особенности, такие как экспрессия натриевых каналов, высвобождение вещества P и реакция на капсаицин и морфин 4,11,12,13.
Боль является сложным состоянием, и поиск лекарств, которые ухудшают возбуждение культивируемых нейронов, может быть недостаточным для блокировки болевых ощущений. Тем не менее, предыдущие данные, показывающие, что морфин снижает высвобождение гликированного коллагенового вещества P, позволяют предположить, что наша модель полезна для поиска новых молекул обезболивающих. Более того, здесь мы демонстрируем, что гликированный коллаген достаточен для гиперсенсибилизации нейронов к индуцированному капсаицином притоку кальция, что указывает на то, что визуализация кальция в присутствии КПГ может быть полезна в поиске новых терапевтических соединений для лечения болезненных воспалительных и дегенеративных заболеваний. Следует отметить, что мы использовали 1 мкМ капсаицин для индуцирования притока Ca2+, что является стандартной концентрацией для визуализации Ca2+ в нейронах8, 14, 15. Тем не менее, в будущих исследованиях следует проводить кривую «доза-реакция» для оптимизации условий эксперимента.
Описанный здесь метод оценки притока кальция может иметь более широкое применение, выходящее за рамки нейроноподобных клеток. Он также подходит для первичных сенсорных клеточных культур и может быть адаптирован для других типов клеток, таких как кардиомиоциты и макрофаги. Кроме того, учитывая, что гликирование коллагена происходит с возрастом и при патологических состояниях, таких как диабетические осложнения, этот подход может служить ценным инструментом для исследования заболеваний почек и глазных расстройств.
Основным изменением в нашем протоколе является замена стандартной иглы на предварительно изогнутые наконечники стоматологических игл. Эти изогнутые иглы обеспечивают лучшую регулировку пластины, сводя к минимуму манипуляции, уменьшая количество необходимой клейкой ленты и снижая риск касания кончика нижней части пластины.
Некоторые проблемы, которые могут возникнуть во время процедуры, и пути их решения подробно описаны в разделе 7 протокола. Если изображение оказалось не в фокусе после регулировки иглы на пластине, проверьте, не ослабли ли клейкие ленты, в результате чего игла сместила пластину. Рекомендуется повторно прикрепить иглу с помощью дополнительной ленты для лучшей устойчивости. Если клетки проявляют насыщенные сигналы, следует попытаться уменьшить интенсивность лазера и параметры усиления. Проверьте время инкубации реагента. Наш опыт показывает, что если время инкубации превышает рекомендацию производителя, сигнал становится чрезмерно интенсивным, что может помешать обнаружению притока кальция. При неожиданных пиках флуоресценции и отслоении клеток после инъекции жидкости жидкость следует вводить медленно, чтобы предотвратить внезапные всплески флуоресценции и не нарушить клеточную адгезию. Быстрые закачки могут создавать турбулентность, что приводит к переходным артефактам сигнала и отрыву ячеек от дна скважины.
Раскрытие информации
MCB, AMCT и VOZ владеют патентом на процесс идентификации молекулярных соединений, участвующих в боли при остеоартрите (BR102018008561-1).
Благодарности
Эта работа была поддержана Fundação Amparo à Pesquisa do Estado de São Paulo FAPESP Grant No 2015/50040-4 и 2020/13139-0, Исследовательским фондом Сан-Паулу и GlaxoSmithKline, FAPESP 2022/08417-7 и 2024/04023-0.
Материалы
| Name | Company | Catalog Number | Comments |
| All-trans retinoic acid | Tocris | 695 | |
| BDNF | Tocris | TOCR-2837 | |
| BDNF | Sigma-Aldrich | B3795 | |
| Butterfly type 23GA sterile | Beckton Dickinson Asepto | 38833814 | Scalp vein set |
| Capsaicin | Sigma-Aldrich | M2028 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| DMEM/F12 | Gibco | 12500062 | Basal medium |
| D-ribose | Sigma-Aldrich | R7500 | |
| D-threose | Sigma-Aldrich | T7392 | |
| Fluo-8 Calcium Flux Assay Kit | Abcam | ab112129 | No wash |
| Heat-inactivated fetal bovine serum | Gibco | A5670801 | |
| High Content Screening | Molecular Devices | ||
| LASX software | Leica Microsystems | Microscopy software | |
| Leica TCS SP8 | Leica Microsystems | Leica TCS SP8 | Confocal microscope |
| Penicillin-streptomycin | Gibco | 15140130 | |
| Petri dish (35/10 mm) | Greiner bio-one | 627965 | |
| Rat tail type I collagen | Corning | 354236 | |
| SH-SY5Y | Merck | 94030304-1VL | Neuroblastoma cell line |
Ссылки
- Bierhaus, A., et al. Understanding RAGE, the receptor for advanced glycation end products. J Mol Med. 83 (11), 876-886 (2005).
- Hudson, B. I., et al. Blockade of receptor for advanced glycation endproducts: A new target for therapeutic intervention in diabetic complications and inflammatory disorders. Arch Biochem Biophys. 419 (1), 80-88 (2003).
- Dandia, H., Makkad, K., Tayalia, P. Glycated collagen - a 3D matrix system to study pathological cell behavior. Biomater Sci. 7 (8), 3480-3488 (2019).
- Bufalo, M. C., et al. Human sensory neuron-like cells and glycated collagen matrix as a model for the screening of analgesic compounds. Cells. 11 (2), 247 (2022).
- Frias, B., Merighi, A. Capsaicin, nociception and pain. Molecules. 21 (6), 797 (2016).
- Lam, D., et al. RAGE-dependent potentiation of TRPV1 currents in sensory neurons exposed to high glucose. PLoS One. 13 (2), e0193312 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Li, F., et al. TRPV1 activity and substance P release are required for corneal cold nociception. Nat Commun. 10 (1), 5678 (2019).
- Mickle, A. D., Shepherd, A. J., Mohapatra, D. P. Sensory TRP channels:the key transducers of nociception and pain. Prog Mol Biol Transl Sci. 131, 73-118 (2015).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiol Pain. 11, 100083 (2022).
- Vetter, I., et al. Characterisation of Nav types endogenously expressed in human SH-SY5Y neuroblastoma cells. Biochem Pharmacol. 83 (11), 1562-1571 (2012).
- Dekker, L. V., et al. Analysis of human Nav1.8 expressed in SH-SY5Y neuroblastoma cells. Eur J Pharmacol. 528 (1-3), 52-58 (2005).
- Lam, P. M. W., Hainsworth, A. H., Smith, G. D., Owen, D. E., Davies, J., Lambert, D. G. Activation of recombinant human TRPV1 receptors expressed in SH-SY5Y human neuroblastoma cells increases [Ca2+]i initiates neurotransmitter release and promotes delayed cell death. J Neurochem. 102 (3), 801-811 (2007).
- Koplas, P. A., Rosenberg, R. L., Oxford, G. S. The role of calcium in the desensitization of capsaicin responses in rat dorsal root ganglion neurons. J Neurosci. 17 (10), 3525-3537 (1997).
- Tominaga, M., et al. The cloned capsaicin receptor integrates multiple pain-producing stimuli. Neuron. 21 (3), 531-543 (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены