Method Article
Fortschrittliche Glykationsendprodukte sensibilisieren menschliche sensorische Neuronenzellen für den Capsaicin-induzierten Kalziumeinstrom
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Vermehrt aus Kollagen gewonnene fortgeschrittene Glykationsendprodukte (AGEs) werden durchweg mit schmerzhaften Krankheiten in Verbindung gebracht. In dieser Arbeit untersuchten wir, ob die Glykierung sensorische Neuronen für die Erregung von Capsaicin sensibilisiert.
Zusammenfassung
Vermehrt aus Kollagen gewonnene fortgeschrittene Glykationsendprodukte (AGEs) werden durchweg mit schmerzhaften Krankheiten wie Osteoarthritis, diabetischer Neuropathie und neurodegenerativen Erkrankungen in Verbindung gebracht. Humane sensorische Neuronen, die von der SH-SY5Y-Zelllinie differenziert werden, erhalten pro-nozizeptive Funktionen, wenn sie AGEs ausgesetzt sind, indem sie Substanz P freisetzen und die Expression des transienten Rezeptorpotentials Vanilloid 1 (TRPV1) hochregulieren. In dieser Arbeit untersuchten wir, ob dieser Rezeptor funktionell aktiv ist und ob der Glykationsprozess sensorische Neuronen für die Erregung von Capsaicin sensibilisiert. Sensorisch ähnliche Neuronenzellen wurden aus der Differenzierung von SH-SY5Y-Zellen mit all-trans-Retinsäure und brain-derived neurotrophic factor gewonnen. Die Inkubation mit glykierter extrazellulärer Kollagenmatrix (ECM-GC) simulierte einen pro-nozizeptiven Stimulus. Die Kontrollzellen wurden mit einer nicht-glykierten extrazellulären Kollagenmatrix (ECM-NC) inkubiert. Das Fluo-8 Calcium Flux Assay Kit wurde verwendet, um den Kalziumeinstrom zu beurteilen, der durch Capsaicin stimuliert wurde. Die Ergebnisse zeigen, dass die Glykation den Kalziumeinstrom im Vergleich zu Zellen, die mit normalem Kollagen behandelt wurden, erhöht, was darauf hindeutet, dass sensorische Neuronen funktionelle TRPV1-Kanäle exprimieren und dass die Glykation die Capsaicin-Erregung erhöht. Diese Daten deuten darauf hin, dass AGEs überempfindliche sensorische Neuronenzellen auslösen, die pro-nozizeptive Signale auslösen. Zusammengenommen deuten unsere Ergebnisse darauf hin, dass wir ein funktionelles Modell etabliert haben, das auf Capsaicin anspricht und für das Screening von Kandidaten zur Behandlung schmerzhafter Erkrankungen nützlich sein kann.
Einleitung
Die Glykation ist ein nicht-enzymatischer, irreversibler und spontaner Prozess, bei dem Proteine wie Kollagen an reduzierende Zuckermoleküle binden, was zu fortgeschrittenen Glykationsendprodukten (AGEs) führt. AGEs können zelluläre Membranrezeptoren aktivieren und die Aktivierung intrazellulärer Signalwege auslösen, wie z. B. die extrazelluläre signalregulierte Proteinkinase (ERK) 1/2, die p38-Mitogen-aktivierte Proteinkinase (MAPK) und c-jun n-terminale Kinasen (JNKs), rho-GTPasen, Phosphoinositol-3-Kinase (PI3K), Janus-Kinase/Signaltransducer und Aktivator der Transkription (JAK/STAT) und Proteinkinase C (PKC), wodurch die Freisetzung proinflammatorischer Moleküle und oxidativer Stress erhöhtwerden 1. Glykiertes Kollagen beeinträchtigt auch die Struktur und die Eigenschaften der extrazellulären Matrix, und erhöhte aus Kollagen gewonnene AGEs werden durchweg mit schmerzhaften Krankheiten wie Osteoarthritis, diabetischer Neuropathie und neurodegenerativen Erkrankungen in Verbindung gebracht 2,3.
Unsere Gruppe hat zuvor gezeigt, dass die SH-SY5Y-Zelllinie in sensorische Neuronenzellen differenziert werden kann, da diese Zellen Kanäle exprimieren, die an der Nozizeption beteiligt sind, wie z. B. Natriumkanäle (Nav 1.7, Nav 1.8 und Nav 1.9) und transiente Rezeptorpotential-Vanilloide Typ 1 (TRPV1), Marker, die typischerweise in peripheren sensorischen Neuronen vorkommen4. TRPV1 ist ein nichtselektiver Kationenkanal, der für Calciumionen durchlässig und empfindlich gegenüber Capsaicin-Reizen ist. Wichtig ist, dass die sensorischen Neuronenzellen, wenn sie glykierter Kollagenmatrix (ECM-GC) ausgesetzt sind, pro-nozizeptive Funktionen erhalten, indem sie die c-Fos-Expression, einen Transkriptionsfaktor, der an der neuronalen Aktivierung beteiligt ist, und die Freisetzung von Substanz P, einem Neuropeptid, das häufig an Neuroinflammation und Schmerzen beteiligt ist, erhöhen. Diese Zellen reagieren auf Analgetika wie Morphin, das Prototyp-Opiat, und verringern die Freisetzung von ECM-GC-induzierter Substanz P. Zusammengenommen deuten diese Daten darauf hin, dass dieses Modell auf ein pro- und ein anti-nozizeptives Molekül anspricht 4,5.
Die Überwachung intrazellulärer Ca2+ -Konzentrationsänderungen ist für die Untersuchung zahlreicher zellulärer Prozesse unerlässlich. In Neuronen kann es ein nützliches Werkzeug sein, um neuronale Schäden und neuroprotektive Eigenschaften von Medikamenten vorherzusagen. Capsaicin, der scharfe Wirkstoff der scharfen Chilischote, ist der am besten untersuchte Agonist des TRPV1-Rezeptors5 und ein wertvolles Werkzeug zur Untersuchung der Schmerzmechanismen und zum Screening potenzieller neuer Analgetika. Frühere Studien zeigten, dass primäre sensorische Neuronen aus den Spinalganglien von Nagetieren, die mit hohem Glukosespiegel inkubiert wurden, einen signifikanten Anstieg des Capsaicin-induzierten Kalziumeinstroms aufweisen6. Ob der TRPV1-Kanal in unserem Zellmodell funktionell aktiv war und ob das glykierte Kollagen sensorische Neuronenzellen für die Erregung von Capsaicin sensibilisiert, was nozizeptive Signalwege aktivieren könnte, bleibt jedoch unbekannt. Daher haben wir uns zum Ziel gesetzt, ein kostengünstiges Protokoll zu entwickeln, das einfache Werkzeuge für die Echtzeit-Kalziumüberwachung in sensorischen Zellen verwendet und gleichzeitig eine zuverlässige Analyse gewährleistet. Hier stellen wir ein umfassendes Protokoll zur Verfügung, das Forschern hilft, die Schritte zur Unterscheidung von SH-SY5Y-Zellen in sensorischen Neuronenzellen zu durchlaufen und sie für pro-nozizeptive Reize zu sensibilisieren. Diese Methode kann zur Entdeckung neuer schmerzstillender oder neuroprotektiver Verbindungen beitragen.
Protokoll
1. SH-SY5Y-Kultur und Differenzierung in sensorische Neuronenzellen
HINWEIS 1: Alle in diesem Abschnitt beschriebenen Schritte müssen unter einer Laminar-Flow-Haube durchgeführt werden, und alle Lösungen und Verbrauchsmaterialien müssen steril sein.
- Zuerst wird ein Kulturkolben (25 cm2) vorbereitet, indem 5 ml Nährmedium hinzugefügt werden.
HINWEIS: Verwenden Sie zum Auftauen, zur Expansion und zur Erhaltung dieses Zelltyps eine Mischung aus Kulturmedium: Dulbecco Modified Eagle's and Ham's Medium F12 (DMEM/F12), ergänzt mit 10 % hitzeinaktiviertem fötalem Rinderserum und 1 % Penicillin-Streptomycin. - Entfernen Sie dann das Kryoröhrchen mit den SH-SY5Y-Zellen aus dem flüssigen Stickstoff und bewahren Sie es auf Eis auf. Tauen Sie die Zellen in einem Wasserbad bei 37 °C für 2 min auf.
- Geben Sie 1 ml vollständiges Kulturmedium in das Kryofläschchen, geben Sie die Zellen in ein 15-ml-Röhrchen, fügen Sie 3 ml vollständiges Kulturmedium hinzu (DMEM/F12 ergänzt mit 10 % hitzeinaktiviertem fötalem Rinderserum) und mischen Sie, indem Sie es wiederholt aufziehen und mit einer Pipette wieder in das Röhrchen abgeben.
- Pipettieren Sie die Zellen in das 15-ml-Röhrchen und zentrifugieren Sie sie bei 290 g. Entsorgen Sie den Überstand, um Dimethylsulfoxid (DMSO) zu entfernen, ein kryoprotektives Mittel, das zur Verhinderung der Bildung von Eiskristallen während der Gefrierzellen verwendet wird.
- Geben Sie 1 ml Nährmedium zum Zellpellet, mischen Sie sie mit einer Pipette gut und geben Sie sie in einen 25 cm2 Kulturkolben, um die Zellen zu expandieren. Stellen Sie die Zellen in einen Inkubator in einer befeuchteten Atmosphäre von 5 % CO2 bei 37 °C.
HINWEIS: Zellen können verwendet werden, wenn sie eine Konfluenz von ca. 80 % erreichen. Für die neuronale Differenzierung wird empfohlen, SH-SY5Y-Zellen bis zur Zellpassage zwanzig zu verwenden. - Bereiten Sie die extrazelluläre Kollagenmatrix (100 μg/ml) vor, indem Sie Rattenschwanzkollagen Typ I in sterilem PBS verdünnen und 1 ml dieser Lösung in eine Petrischale (35/10 mm) gießen, um eine Beschichtung zu erhalten.
- Inkubieren Sie dies in einem Inkubator bei einer befeuchteten Atmosphäre von 5 % CO2 für ca. 1 h.
- Waschen Sie die Platte nach dieser Zeit zweimal mit sterilem PBS und zählen Sie die Zellen mit der Neubauer-Kammer.
- Um die Zellen zu zählen, waschen Sie zuerst den 25 cmgroßen 2-Kulturkolben, der die Zelle enthält, mit 5 ml sterilem PBS, um das gesamte Kulturmedium zu entfernen. Entfernen Sie dann das sterile PBS, geben Sie 3 ml 0,05 % Trypsin zu den Zellen und legen Sie sie für ca. 3-5 Minuten bei 37 °C und 5 % CO2 in einen Inkubator, um die Zellablösung abzuschließen.
- Nehmen Sie danach die Zellen aus dem Inkubator, geben Sie 6 ml Kulturmedium in den Kulturkolben und überführen Sie diese Lösung in ein 15-ml-Röhrchen. Bei 290 g 5 min zentrifugieren.
- Entfernen Sie den Überstand und resuspendieren Sie die Zellen gut in 1 ml vollständigem Kulturmedium.
- Zum Schluss zählen Sie die Zellen mit einer Neubauer-Zählkammer. Mischen Sie 20 μl Zellen und 20 μl Trypanblau und geben Sie 10 μl dieser Mischung in eine Neubauer-Kammer. Zählen Sie die lebenden Zellen, die sich nicht blau färben.
- Platte 5 × 104 Zellen/ml Zellen in einer Petrischale (35/10 mm) auf dem gleichen Kulturmedium wie zuvor beschrieben. Verwenden Sie das Gesamtvolumen von 1 ml pro Platte.
- Warten Sie dann 24 Stunden, um das neuronale Differenzierungsprotokoll zu starten. Entfernen Sie dazu das Nährmedium und ersetzen Sie es durch 1 ml DMEM/F12, ergänzt mit 2 % hitzeinaktiviertem fötalem Rinderserum, 1 % Penicillin-Streptomycin und 10 μM all-trans-Retinsäure (RA 10 μM).
- Warten Sie 48 Stunden und tauschen Sie den Nährboden 3 Tage lang täglich aus. Stellen Sie die Zellen in einen Inkubator in einer befeuchteten Atmosphäre von 5 % CO2 bei 37 °C.
- Am fünften Tag entfernen Sie das Medium aus den Zellen und fügen Sie 1 ml serumfreies Kulturmedium hinzu, das mit dem aus dem menschlichen Gehirn stammenden neurotrophen Faktor (BDNF 50 ng/ml) in jeder Platte ergänzt ist.
HINWEIS: Getestet wurden BDNF von verschiedenen Firmen (siehe Materialtabelle). Sie funktionierten alle auf die gleiche Weise. - Am siebten Tag der Differenzierung waschen Sie die Zellen einmal mit sterilem PBS und verwenden Sie sensorisch ähnliche Neuronenzellen für Experimente. Wenn es nicht möglich ist, diese Zellen sofort für Experimente zu verwenden, fügen Sie ein serumfreies Kulturmedium hinzu, um sie bis zur Verwendung am Leben zu erhalten.
HINWEIS: Am Ende der neuronalen Differenzierung ist es notwendig, die Zellen mit sterilem PBS zu waschen, um das verbleibende BDNF zu entfernen und so eine Zelltoxizität zu vermeiden.
2. Glykiertes Kollagen und Glykationsprozess
HINWEIS: Alle Schritte in diesem Abschnitt müssen unter einer Laminar-Flow-Haube durchgeführt werden, und alle Lösungen und Verbrauchsmaterialien müssen steril sein.
- Bereiten Sie die Kollagenglykation vor, indem Sie Kollagen Typ I aus dem fibrillären Zustand des Rattenschwanzes (3,89 mg/ml) mit 200 mM D-Ribose, 160 mM D-Glukose und 200 mM D-Threose bei 4 °C für 7 Tage inkubieren.
HINWEIS: Um glykiertes Kollagen herzustellen, wiegen Sie die Zucker basierend auf ihrem Molekulargewicht und mischen Sie sie mit Kollagen Typ I aus dem fibrillären Zustand des Rattenschwanzes (3,89 mg/ml). - Inkubieren Sie eine sensorisch ähnliche Neuronenzellkultur für 24 Stunden mit glykierter extrazellulärer Kollagenmatrix (ECM-GC, 100 μg/ml) oder normaler extrazellulärer Kollagenmatrix (ECM-NC, 100 μg/ml), die in DMEM/F12-Kulturmedium ohne Serum- und Antibiotikaergänzung hergestellt wurde.
3. Calcium-Influx-Assay
- Verwenden Sie für den Kalziumeinstrom das Kalziumfluss-Assay-Kit und bereiten Sie die Lösungen gemäß den Anweisungen des Herstellers vor, wie unten angegeben.
- Bereiten Sie zunächst 1 ml Fluo-8-Farbstoffbeladung vor, indem Sie 2 μl Fluo-8-Stammlösung in 998 μl 1x Assay-Puffer (eine Mischung aus HBSS-Puffer und 10x Pluronic F127 Plus) hinzufügen.
HINWEIS: Diese Arbeitslösung ist bei Raumtemperatur (RT) mindestens 2 h lang stabil. - Später inkubieren Sie 250 μl dieser Lösung in jeder plattierten Schale mit sensorisch ähnlichen Neuronenzellen, die zuvor differenziert und mit ECM-NC oder ECM-GC behandelt wurden, für 30 Minuten in einer befeuchteten Atmosphäre von 5 % CO2 bei 37 °C. Nehmen Sie dann die Schale aus dem Inkubator und halten Sie sie 30 Minuten lang auf RT (im Dunkeln).
HINWEIS: Diese Lösung wird zytotoxisch, wenn die 2-stündige Inkubation extrapoliert wird. Bereiten Sie die Capsaicin-Lösung während der Inkubationszeit vor.
4. Capsaicin-Induktion
HINWEIS: Capsaicin, ein TRPV1-Agonist, wurde verwendet, um den Kalziumeinstrom in die Zellen zu induzieren.
- Capsaicin in 1% Ethanol und Reinstwasser wiegen und verdünnen. Bereiten Sie dann eine Lösung in einer Konzentration von 2 μM vor, die ebenfalls in Reinstwasser verdünnt wurde.
HINWEIS: Die Capsaicin-Lösung muss am Tag der Anwendung hergestellt werden. Capsaicin zuerst in Ethanol und dann in Wasser verdünnen; Andernfalls wird es regnen. - 250 μl 2 μM Capsaicin-Lösung in jede 35/10 mm Petrischale geben, so dass die Endkonzentration 1 μM beträgt.
HINWEIS: Die Stammlösungskonzentration von Capsaicin betrug 2 μM, um eine bessere Dispersion zu gewährleisten und isolierte Fluoreszenzpeaks zu vermeiden.
5. Bildgebung des Kalziumeinstroms und konfokale Mikroskopieanalyse
HINWEIS: Die Bildgebung wurde in einem konfokalen Mikroskop durchgeführt, das mit einem 20x/0,75NA-Objektiv und einem 488-nm-Anregungslaser (0,5 % Intensität) ausgestattet war. Die Emission wurde bei 520 nm detektiert. Die Zellen wurden in xy-Achsen (512 x 512 Pixel) über die Zeit (t) bei einer Geschwindigkeit von 600 Hz mit einem Erfassungsintervall von 433 ms und einer Gesamterfassungszeit von 5 min abgetastet. Die Bildgebung wurde bei 37 °C durchgeführt, um den physiologischen Zustand der Zellen mit Hilfe der Mikroskopiesoftware zu erhalten.
- Bereiten Sie eine Spritze mit 250 μl 2 μM Capsaicin-Lösung vor (die Endkonzentration in der Platte beträgt 1 μM) und schließen Sie sie an ein Kopfhautvenen-Set an - Schmetterling Typ 23 GA steril. Sichern Sie die Spritze mit einem Laborstativ und einer Klemme.
- Stellen Sie die Petrischale auf den Mikroskoptisch und platzieren Sie die Kopfhautnadel mit äußerster Vorsicht in der Petrischale, vermeiden Sie den Kontakt mit dem Boden, die Spitze der Nadel sollte nicht in die Flüssigkeit getaucht werden.
HINWEIS: Ein Klebeband kann verwendet werden, um die Position der Kopfhaut zu fixieren. - Suchen Sie ein Feld mit einer ausreichenden Anzahl von Zellen (mehr als 20) und stellen Sie den Fokus mit Hellfeldlicht ein.
- Starten Sie den Live-Modus mit einem 488-nm-Laser und passen Sie die Fokus- und Beleuchtungsparameter an.
- Starten Sie die Aufnahmeaufzeichnung und tragen Sie nach dem Ausgangszeitraum (t = 0 bis t = 60 Sekunden) 250 μl 2 μM Capsaicin auf und drücken Sie vorsichtig auf den Spritzenkolben, um den Kalziumeinstrom in die Zellen zu stimulieren.
HINWEIS: Die endgültige Aufnahmezeit betrug ca. 300 s pro Platte.
6. Nachbearbeitung/Datenanalyse
- Führen Sie die Zellanalyse mit der Mikroskopie-Software im Quantifizierungsmodus durch. Analysieren Sie zunächst Fluoreszenz-Spike-Zellen vor und nach dem Capsaicin-Stimulus.
- Erstellen Sie einen Region of Interest (ROI) in jeder responsiven Zelle, d. h. in den Zellen, die nach Capsaicin einen Fluoreszenzanstieg aufweisen. Stellen Sie sicher, dass der ROI im gesamten Zellbereich erzielt wird, wie oben gezeigt (Abbildung 1).
- Exportieren Sie die Daten in eine CSV-Datei (Comma-Separated Values) für die nachfolgende Analyse.
- Alternativ können Sie die Analyse mit der frei verfügbaren Software FIJI7 (https://fiji.sc) durchführen.
- Um die Bilddateien zu öffnen, verwenden Sie das Plugin Bio-Formate , indem Sie zu Datei navigieren > > Bio-Formate importieren und die Datei auswählen.
- Verwenden Sie als Nächstes das Lupenwerkzeug zum Vergrößern und das Freihandauswahlwerkzeug , um einen Interessenbereich (ROI) um die responsiven Zellen zu zeichnen.
- Nachdem Sie die einzelnen ROI gezeichnet haben, drücken Sie die Taste T , um sie dem ROI-Manager hinzuzufügen. Wiederholen Sie diesen Vorgang für alle interessierenden Zellen (Abbildung 2).
- Sobald alle ROIs hinzugefügt wurden, gehen Sie zum ROI-Manager-Fenster , wählen Sie alle ROIs aus und navigieren Sie dann im Hauptmenü zu Messungen analysieren > festlegen .
- Kehren Sie dann zum ROI-Manager zurück und wählen Sie Mehr > Multi-Measure , um die Intensität über alle Frames hinweg zu messen. Die Ergebnisse werden in einem neuen Fenster angezeigt. Exportieren Sie als CSV-Datei, indem Sie zu Datei gehen > Speichern unter.
HINWEIS: Die CSV-Datei kann in Excel, Google Sheets und GraphPad analysiert werden. Verwenden Sie die Gleichung ΔF/F0 = (F(t) - F0)/F0 , um die mit dem Fluo-8 Calciumflux Assay Kit erhaltenen Fluoreszenzintensitätswerte in ein relatives Maß für die Änderung des Kalziumeinstroms umzuwandeln. Hier stellt F0 die Ausgangsfluoreszenz dar, berechnet als die durchschnittliche Intensität von Bildern, die von t = 0 s bis t = 60 s vor der Stimulation mit Capsaicin aufgenommen wurden. F(t) ist der Wert der maximalen Fluoreszenzintensität, die nach dem Stimulus beobachtet wird, was es ermöglicht, den maximalen Kalziumeinstrom zu beurteilen. Dieser Ansatz unterstreicht die Zunahme der Fluoreszenz im Vergleich zur Basislinie, wobei ein Anstieg von ΔF/F0 auf einen erhöhten intrazellulären Kalziumspiegel hinweist.
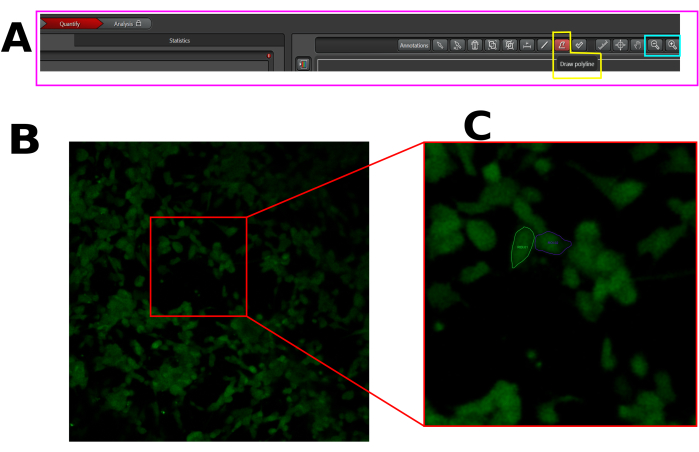
Abbildung 1: Beispiel für den ROI in den ausgewählten Zellen für die Analyse des Kalziumeinstroms in der LAS X-Software. (A) LAS X-Schnittstelle im Quantifizierungsmodus. Das rosa Rechteck zeigt die Registerkarte Quantifizierung. Das gelbe Rechteck zeigt das Polylinien-Zeichenwerkzeug und das cyanfarbene Rechteck die Werkzeuge zum Verkleinern und Vergrößern. (B) Sichtfeld (FOV) erfasst. (C) Vergrößern Sie das FOV, um die Darstellung des ROI in der gesamten Zelle zu erleichtern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
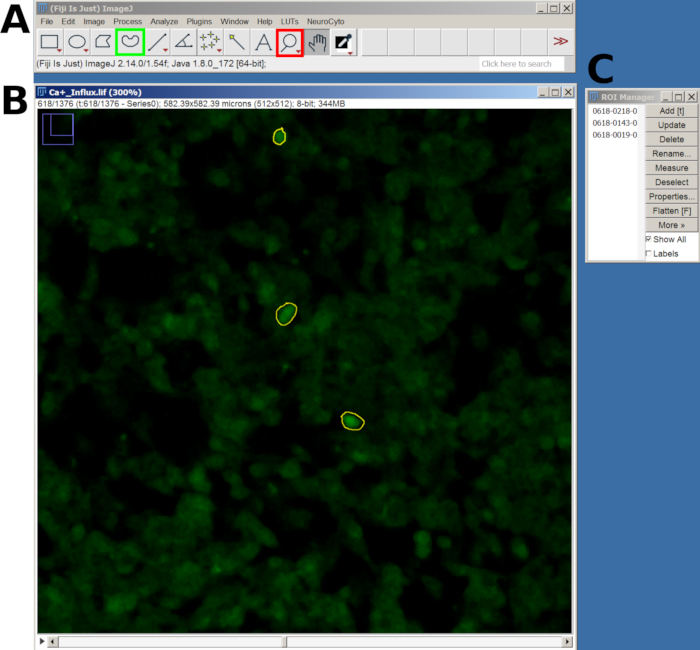
Abbildung 2: Beispiel für den ROI in den ausgewählten Zellen für die Analyse des Kalziumeinstroms in der FIJI-Software. (A) FIJI-Oberfläche mit dem Hauptmenü und dem Tool. Das rote Quadrat zeigt das Lupenwerkzeug und das grüne Quadrat die Freihandauswahl. (B) Sichtfeld (FOV), aufgenommen mit Zoom-In und gezeichnetem ROI. (C) Das ROI-Manager-Fenster. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
7. Fehlerbehebung
- Wenn das Bild unscharf ist, versuchen Sie Folgendes:
- Überprüfen Sie die Haftung des Klebebandes; Wenn sie sich gelöst hat, kann dies dazu führen, dass sich die Nadel verschiebt und den Fokus beeinträchtigt.
- Befestigen Sie die Nadel wieder mit zusätzlichem Klebeband, um die Stabilität zu erhöhen.
- Ersatz von Standardnadeln. Verwenden Sie vorgebogene Zahnnadelspitzen, um die Ausrichtung auf der Platte zu verbessern.
- Wenn die Zellen ein gesättigtes Signal aufweisen, versuchen Sie die folgenden Schritte:
- Verringern Sie die Laserintensität und die Verstärkungseinstellungen.
- Überprüfen Sie die Inkubationszeit des Reagenzes. Wenn es die Empfehlung des Herstellers überschreitet, kann es zu einer Signalsättigung kommen, die die Erkennung des Kalziumeinflusses erschwert.
- Befolgen Sie diese zusätzlichen Vorschläge zur Fehlerbehebung:
- Regelmäßige Kalibrierung: Stellen Sie sicher, dass das bildgebende Gerät regelmäßig kalibriert wird, um die Qualität der Fokus- und Signalerkennung zu erhalten.
- Änderungen dokumentieren: Führen Sie ein Protokoll über alle am Protokoll vorgenommenen Anpassungen, um später darauf zurückgreifen zu können und die Fehlerbehebung zu erleichtern.
- Reaktive Anpassungen: Wenn Probleme weiterhin bestehen, sollten Sie Tests mit anderen Reagenzienkonzentrationen oder alternativen Methoden zur Signalerkennung in Betracht ziehen.
Ergebnisse
Differenzierung von SH-SY5Y-Zellen in sensorische Neuronen
High-Content-Screening-Bilder zeigen, dass das Protokoll der neuronalen Differenzierung die Morphologie der SH-SY5Y-Zellen verändert. Die sensorisch ähnlichen Neuronenzellen (differenzierte Zellen) weisen einen abgerundeten Zellkörper auf, der ein ausgedehntes Netzwerk von Neurofilamenten projiziert. Sie bilden Äste aus länglicheren Neuritenprojektionen, die umgebende Neuronen verbinden, was mit reifen Neuronenmerkmalen übereinstimmt (Abbildung 3)4. Wichtig ist, dass diese Zellen im Vergleich zu undifferenzierten SH-SY5Y-Zellen erhöhte TRPV1-Spiegel aufweisen (Abbildung 4).
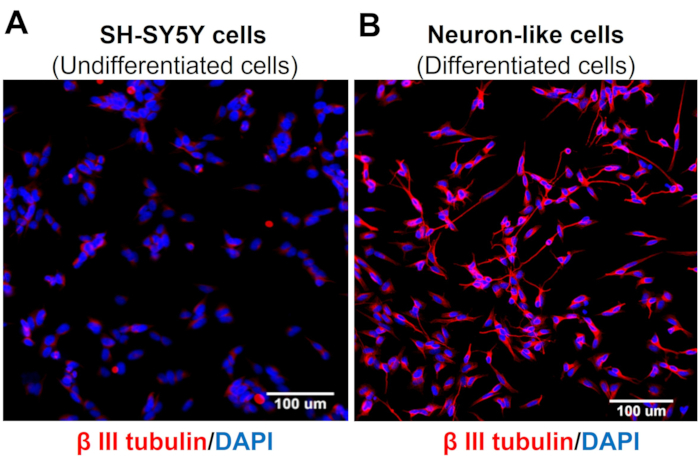
Abbildung 3: β-III-Tubulinexpression in undifferenzierten und differenzierten Zellen. High Content Screening (Molecular Devices, San Jose, CA, EUA) Immunfluoreszenzbilder von spezifischen neuronalen Markern (β-III-Tubulin) in (A) undifferenzierten Zellen (SH-SY5Y-Zellen) und (B) differenzierten Zellen (sensorische neuronenähnliche Zellen). Repräsentative Bilder von fünf Bereichen. Vergrößerung: 20x. Maßstab: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
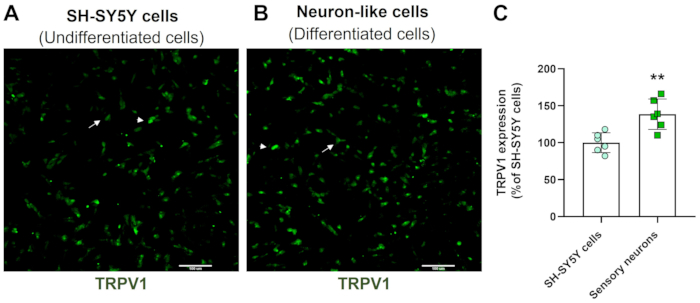
Abbildung 4: TRPV1-Expression in undifferenzierten und differenzierten Zellen. HCS-Immunfluoreszenzbilder der TRPV1-Expression in (A) undifferenzierten Zellen (SH-SY5Y-Zellen) und (B) differenzierten Zellen (sensorische neuronenähnliche Zellen). Repräsentative Bilder von vier Bereichen. Der Pfeil beschriftet TRPV1-Zellen mit niedriger Expression, und die Pfeilspitze beschriftet TRPV1-Zellen mit hoher Expression. Vergrößerung: 10x. Maßstabsbalken: 100 μm. (C) Quantifizierung der TRPV1-Expression in SH-SY5Y-Zellen und sensorischen Neuronen. Der t-Test des ungepaarten Schülers, **p<0,005 im Vergleich zu EMC-NC, n= 6. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Kollagenglykation, die mit sensorischen Zellen interagiert, ahmt eine schmerzhafte Mikroumgebungnach 4. Hier zeigten wir, dass glykiertes Kollagen den Capsaicin-induzierten Kalziumeinstrom im Vergleich zu Zellen, die mit normalem Kollagen behandelt wurden, erhöht (Abbildung 5). Diese Ergebnisse deuten darauf hin, dass AGEs ausreichen, um die Capsaicin-evozierten Ströme zu erhöhen.
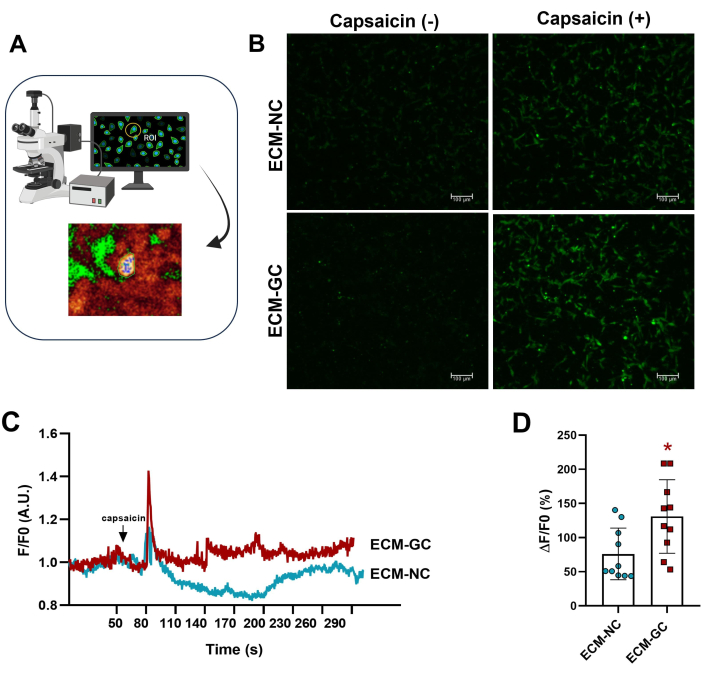
Abbildung 5: Intrazelluläre Kalziummessungen. (A) Identifizierung der Fluoreszenzregion von Interesse (ROI). (B-D) Der Calciumeinstrom wird durch eine erhöhte Fluoreszenz vor und nach der Capsaicin-Applikation (1 μM, Endkonzentration) angezeigt. Der Pfeil zeigt die Anwendung von Capsaicin an. Erhöhungen des intrazellulären Kalziums wurden als ΔF/F0 bestimmt (F0 ist die basale Fluoreszenz). Gepaarter Student's t-Test (Wilcoxon-Matched-Pairs), *p < 0,05 im Vergleich zu ECM-NC, n= 10 Zellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Nozizeptoren sind spezialisierte Untergruppen sensorischer Neuronen, die Schmerzen vermitteln. Diese Zellen exprimieren spannungsgesteuerte und ligandische Ionenkanäle wie TRPV1, deren Aktivierung zum Kalziumeinstrom und zur Freisetzung von Neuropeptiden und Neurotransmittern führt, die die nozizeptive Übertragung regulieren. In dieser Arbeit beschreiben wir ein Protokoll zur Differenzierung von SH-SY5Y in sensorische Neuronenzellen, um den Capsaicin-induzierten Kalziumeinstrom zu bewerten 8,9. Wichtig ist, dass wir gezeigt haben, dass es bei der Nachahmung einer pro-nozizeptiven Umgebung mit glykiertem Kollagen zu einer Hochregulierung des Capsaicin-induzierten Kalziumeinstroms kommt, was bestätigt, dass TRPV1-Kanäle funktionsfähig sind und AGEs diese Kanäle sensibilisieren können, indem sie ihre Reaktionsfähigkeit auf einen schädlichen Reiz erhöhen.
Die Bewertung des Kalziumeinstroms in sensorischen Neuronen war ein wertvolles Instrument für das Screening von Analgetika-Kandidaten10. Mit der Entwicklung stabiler Calciumfarbstoffe wie Fluo-8 wurden Fortschritte bei der Entwicklung molekularer Calciumindikatoren erzielt. Fluo-8 (keine Waschmethode) hat Vorteile gegenüber anderen Fluoreszenzfarbstoffen, einschließlich erhöhter Helligkeit, Arbeit bei Raumtemperatur und höherer Empfindlichkeit gegenüber niedrigeren Kalziumkonzentrationen. In diesem Protokoll wurde Capsaicin über einen Kopfhautvenensatz appliziert. Früher haben wir eine normale Pipette verwendet, aber sie hat oft die Zellplatte verschoben und die Bildaufnahme unterbrochen. Eine andere Möglichkeit wäre die Verwendung einer Perfusionspumpe, um Capsaicin langsam zu verabreichen. Interessanterweise verwendet der Ansatz in diesem Protokoll leicht verfügbare und kostengünstige Komponenten, die in jedem Labor implementiert werden können, was einen erheblichen Vorteil gegenüber herkömmlichen Perfusionskammern zur Überwachung des Kalziumeinstroms bietet. Darüber hinaus ist die hier beschriebene Vorrichtung universell kompatibel mit den meisten Fluoreszenzmikroskopen, die üblicherweise in Forschungsumgebungen verwendet werden, wodurch spezielle Geräte oder Modifikationen überflüssig werden. Diese Anpassungsfähigkeit ermöglicht eine nahtlose Integration über verschiedene Bildgebungskonfigurationen hinweg und verbessert den Zugang zu fortschrittlichen Kalzium-Bildgebungstechniken für ein breiteres Spektrum von Laboren, insbesondere in Laboren mit begrenzten Budgets. Im Gegensatz zu einem Tisch-Multimode-Mikroplatten-Reader für automatisierte Fluoreszenzmessungen besteht eine Einschränkung des hier beschriebenen Verfahrens jedoch darin, dass es hochauflösende Bildgebungsgeräte und manuelles Pipettieren erfordert, was zeitaufwändiger ist. Die konfokale Mikroskopie hat jedoch den Vorteil, dass sie eine geringere Fluoreszenzemission detektieren kann.
Methoden zur Untersuchung sensorischer Neuronen verwenden meist primäre Zellkultur- oder pluripotente Stammzellen (iPS). Primäre menschliche sensorische Neuronen sind nur selten zugänglich, und die Erzeugung von iPS ist arbeitsintensiv und erfordert teure Reagenzien und erfahrene Techniker. Daher sind sie trotz der Einschränkung, die mit der Differenzierung von SH-SY5Y in neuronale Zellen verbunden ist, die die physiologischen Eigenschaften eines intakten menschlichen Neurons nicht vollständig beibehalten, morphologisch ähnlich zu primären Neuronen 9,10 und behalten wichtige Merkmale bei, wie z. B. die Expression von Natriumkanälen, die Freisetzung von Substanz P und die Reaktionsfähigkeit auf Capsaicin und Morphin 4,11,12,13.
Schmerzen sind eine komplexe Erkrankung, und die Suche nach Medikamenten, die die erregte Kulturneuronen beeinträchtigen, reicht möglicherweise nicht aus, um das Schmerzempfinden zu blockieren. Die bisherigen Daten, die zeigen, dass Morphin die durch glykiertes Kollagen induzierte Substanz-P-Freisetzung verringert, deuten jedoch darauf hin, dass unser Modell nützlich ist, um neue analgetische Moleküle zu finden. Darüber hinaus zeigen wir, dass glykiertes Kollagen ausreicht, um Neuronen gegenüber Capsaicin-induziertem Kalziumeinstrom zu hypersensibilisieren, was darauf hindeutet, dass Kalziumbildgebung in Gegenwart von AGEs bei der Suche nach neuen therapeutischen Wirkstoffen für schmerzhafte entzündliche und degenerative Erkrankungen nützlich sein könnte. Bemerkenswert ist, dass wir 1 μM Capsaicin verwendeten, um denCa2+-Einstrom zu induzieren, eine Standardkonzentration für dieCa2+-Bildgebung in Neuronen 8,14,15. In zukünftigen Studien sollte jedoch eine Dosis-Wirkungs-Kurve durchgeführt werden, um die experimentellen Bedingungen zu optimieren.
Die hier beschriebene Methode zur Bewertung des Kalziumeinstroms könnte breitere Anwendungen über neuronenähnliche Zellen hinaus haben. Es eignet sich auch für primäre sensorische Zellkulturen und kann für andere Zelltypen, wie Kardiomyozyten und Makrophagen, angepasst werden. Angesichts der Tatsache, dass Glykationskollagen mit zunehmendem Alter und bei pathologischen Zuständen wie diabetischen Komplikationen auftritt, kann dieser Ansatz als wertvolles Instrument zur Untersuchung von Nierenerkrankungen und Augenerkrankungen dienen.
Eine wesentliche Änderung in unserem Protokoll ist der Ersatz der Standardnadel durch vorgebogene Zahnnadelspitzen. Diese gebogenen Nadeln ermöglichen eine bessere Anpassung an der Platte, minimieren die Handhabung, reduzieren die Menge an benötigtem Klebeband und verringern das Risiko, dass die Spitze den Boden der Platte berührt.
Einige Probleme, die während des Eingriffs auftreten können, und deren Lösungen sind in Abschnitt 7 des Protokolls aufgeführt. Wenn das Bild nach dem Einstellen der Nadel auf der Platte unscharf ist, überprüfen Sie, ob sich die Klebebänder gelöst haben, wodurch die Nadel die Platte verschoben hat. Es wird empfohlen, die Nadel für eine bessere Stabilität mit zusätzlichem Klebeband wieder zu befestigen. Wenn Zellen gesättigte Signale aufweisen, sollte man versuchen, die Laserintensität und die Verstärkungsparameter zu verringern. Überprüfen Sie die Inkubationszeit des Reagenzes. Unsere Erfahrung zeigt, dass, wenn die Inkubationszeit die vom Hersteller empfohlene Inkubationszeit überschreitet, das Signal übermäßig intensiv wird, was die Erkennung des Kalziumeinstroms beeinträchtigen kann. Bei unerwarteten Fluoreszenzspitzen und Zellablösung nach der Flüssigkeitsinjektion muss die Flüssigkeit langsam injiziert werden, um plötzliche Fluoreszenzspitzen zu vermeiden und eine Störung der Zelladhäsion zu vermeiden. Schnelle Injektionen können Turbulenzen erzeugen, die zu vorübergehenden Signalartefakten und einer Ablösung von Zellen vom Bohrlochboden führen.
Offenlegungen
MCB, AMCT und VOZ besitzen ein Patent auf das Verfahren zur Identifizierung molekularer Entitäten, die an Arthroseschmerzen beteiligt sind (BR102018008561-1).
Danksagungen
Diese Arbeit wurde unterstützt von der Fundação Amparo à Pesquisa do Estado de São Paulo FAPESP Fördernummer 2015/50040-4 und 2020/13139-0, der São Paulo Research Foundation und GlaxoSmithKline, FAPESP 2022/08417-7 und 2024/04023-0.
Materialien
| Name | Company | Catalog Number | Comments |
| All-trans retinoic acid | Tocris | 695 | |
| BDNF | Tocris | TOCR-2837 | |
| BDNF | Sigma-Aldrich | B3795 | |
| Butterfly type 23GA sterile | Beckton Dickinson Asepto | 38833814 | Scalp vein set |
| Capsaicin | Sigma-Aldrich | M2028 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| DMEM/F12 | Gibco | 12500062 | Basal medium |
| D-ribose | Sigma-Aldrich | R7500 | |
| D-threose | Sigma-Aldrich | T7392 | |
| Fluo-8 Calcium Flux Assay Kit | Abcam | ab112129 | No wash |
| Heat-inactivated fetal bovine serum | Gibco | A5670801 | |
| High Content Screening | Molecular Devices | ||
| LASX software | Leica Microsystems | Microscopy software | |
| Leica TCS SP8 | Leica Microsystems | Leica TCS SP8 | Confocal microscope |
| Penicillin-streptomycin | Gibco | 15140130 | |
| Petri dish (35/10 mm) | Greiner bio-one | 627965 | |
| Rat tail type I collagen | Corning | 354236 | |
| SH-SY5Y | Merck | 94030304-1VL | Neuroblastoma cell line |
Referenzen
- Bierhaus, A., et al. Understanding RAGE, the receptor for advanced glycation end products. J Mol Med. 83 (11), 876-886 (2005).
- Hudson, B. I., et al. Blockade of receptor for advanced glycation endproducts: A new target for therapeutic intervention in diabetic complications and inflammatory disorders. Arch Biochem Biophys. 419 (1), 80-88 (2003).
- Dandia, H., Makkad, K., Tayalia, P. Glycated collagen - a 3D matrix system to study pathological cell behavior. Biomater Sci. 7 (8), 3480-3488 (2019).
- Bufalo, M. C., et al. Human sensory neuron-like cells and glycated collagen matrix as a model for the screening of analgesic compounds. Cells. 11 (2), 247 (2022).
- Frias, B., Merighi, A. Capsaicin, nociception and pain. Molecules. 21 (6), 797 (2016).
- Lam, D., et al. RAGE-dependent potentiation of TRPV1 currents in sensory neurons exposed to high glucose. PLoS One. 13 (2), e0193312 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Li, F., et al. TRPV1 activity and substance P release are required for corneal cold nociception. Nat Commun. 10 (1), 5678 (2019).
- Mickle, A. D., Shepherd, A. J., Mohapatra, D. P. Sensory TRP channels:the key transducers of nociception and pain. Prog Mol Biol Transl Sci. 131, 73-118 (2015).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiol Pain. 11, 100083 (2022).
- Vetter, I., et al. Characterisation of Nav types endogenously expressed in human SH-SY5Y neuroblastoma cells. Biochem Pharmacol. 83 (11), 1562-1571 (2012).
- Dekker, L. V., et al. Analysis of human Nav1.8 expressed in SH-SY5Y neuroblastoma cells. Eur J Pharmacol. 528 (1-3), 52-58 (2005).
- Lam, P. M. W., Hainsworth, A. H., Smith, G. D., Owen, D. E., Davies, J., Lambert, D. G. Activation of recombinant human TRPV1 receptors expressed in SH-SY5Y human neuroblastoma cells increases [Ca2+]i initiates neurotransmitter release and promotes delayed cell death. J Neurochem. 102 (3), 801-811 (2007).
- Koplas, P. A., Rosenberg, R. L., Oxford, G. S. The role of calcium in the desensitization of capsaicin responses in rat dorsal root ganglion neurons. J Neurosci. 17 (10), 3525-3537 (1997).
- Tominaga, M., et al. The cloned capsaicin receptor integrates multiple pain-producing stimuli. Neuron. 21 (3), 531-543 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten