Method Article
Los productos finales de glicación avanzada sensibilizan las células neuronales humanas sensoriales a la afluencia de calcio inducida por la capsaicina
* Estos autores han contribuido por igual
En este artículo
Resumen
El aumento de los productos finales de glicación avanzada (AGE) derivados del colágeno se relaciona constantemente con enfermedades dolorosas. Aquí, investigamos si la glicación sensibiliza las neuronas sensoriales a la excitación de la capsaicina.
Resumen
El aumento de los productos finales de glicación avanzada (AGE) derivados del colágeno se relaciona constantemente con enfermedades dolorosas, como la osteoartritis, la neuropatía diabética y los trastornos neurodegenerativos. Las neuronas humanas de tipo sensorial diferenciadas de la línea celular SH-SY5Y obtienen funciones pronociceptivas cuando se exponen a AGEs mediante la liberación de la sustancia P y la regulación positiva de la expresión del receptor de potencial transitorio vaniloide 1 (TRPV1). Aquí, investigamos si este receptor era funcionalmente activo y si el proceso de glicación sensibiliza las neuronas sensoriales a la excitación de la capsaicina. Las células neuronales sensoriales se obtuvieron a partir de la diferenciación de las células SH-SY5Y con ácido trans-retinoico y factor neurotrófico derivado del cerebro. La incubación con matriz extracelular de colágeno glicosilado (ECM-GC) simuló un estímulo pronociceptivo. Las células control se incubaron con una matriz de colágeno extracelular no glicosilado (ECM-NC). Se utilizó el kit de ensayo de flujo de calcio Fluo-8 para evaluar la afluencia de calcio, que fue estimulada por la capsaicina. Los resultados muestran que la glicación aumenta la entrada de calcio en comparación con las células tratadas con colágeno normal, lo que sugiere que las neuronas sensoriales expresan canales TRPV1 funcionales y que la glicación aumenta la excitación de la capsaicina. Estos datos indican que las células neuronales sensoriales hipersensibles de AGE, desencadenan la señalización pronociceptiva. En conjunto, nuestros resultados sugieren que establecimos un modelo funcional que responde a la capsaicina que puede ser útil para la detección de candidatos para el manejo de afecciones dolorosas.
Introducción
La glicación es un proceso no enzimático, irreversible y espontáneo en el que las proteínas, como el colágeno, se unen a las moléculas de azúcar reductoras, lo que da lugar a productos finales de glicación avanzada (AGE). Los AGEs pueden activar los receptores de la membrana celular, desencadenando la activación de vías intracelulares, como la proteína quinasa 1/2 regulada por señales extracelulares (ERK), la proteína quinasa activada por mitógenos p38 (MAPK) y las quinasas n-terminal c-jun (JNKs), rho-GTPasas, fosfoinositol-3-quinasa (PI3K), Janus quinasa/transductor de señales y activador de la transcripción (JAK/STAT) y proteína quinasa C (PKC), aumentando la liberación de moléculas proinflamatorias y el estrés oxidativo1. El colágeno glicosilado también perjudica la estructura y las propiedades de la matriz extracelular, y el aumento de los AGE derivados del colágeno se relaciona constantemente con enfermedades dolorosas, como la osteoartritis, la neuropatía diabética y los trastornos neurodegenerativos 2,3.
Nuestro grupo demostró previamente que la línea celular SH-SY5Y se puede diferenciar en células neuronales sensoriales, ya que estas células expresan canales involucrados en la nocicepción, como los canales de sodio (Nav 1.7, Nav 1.8 y Nav 1.9) y el receptor de potencial transitorio vaniloide tipo 1 (TRPV1), marcadores que se encuentran típicamente en las neuronas sensoriales periféricas4. TRPV1 es un canal catiónico no selectivo permeable a los iones de calcio y sensible al estímulo de la capsaicina. Es importante destacar que cuando las células neuronales sensoriales se exponen a la matriz de colágeno glicosilado (ECM-GC), obtienen funciones pronociceptivas al aumentar la expresión de c-Fos, un factor de transcripción involucrado en la activación neuronal, y la liberación de la sustancia P, un neuropéptido ampliamente involucrado en la neuroinflamación y el dolor. Estas células responden a los analgésicos, como la morfina, el opiáceo prototipo, disminuyendo la liberación de la sustancia P inducida por ECM-GC. En conjunto, estos datos indican que este modelo responde a una molécula pro-nociceptiva y anti-nociceptiva 4,5.
El seguimiento de los cambios en la concentración intracelular deCa2+ es esencial para estudiar numerosos procesos celulares. En las neuronas, puede ser una herramienta útil para predecir el daño neuronal y las propiedades neuroprotectoras de los fármacos. La capsaicina, el ingrediente activo picante de los chiles picantes, es el agonista más estudiado del receptor TRPV1 5 y una herramienta valiosa para estudiar los mecanismos del dolor y detectar posibles nuevos analgésicos. Estudios previos demostraron que las neuronas sensoriales primarias de los ganglios de la raíz dorsal de roedores incubados con glucosa alta exhiben un aumento significativo en la afluencia de calcio inducida por la capsaicina6. Sin embargo, aún se desconoce si el canal TRPV1 fue funcionalmente activo en nuestro modelo celular y si el colágeno glicosilado sensibiliza a las células neuronales sensoriales a la excitación de la capsaicina, lo que puede activar las vías de señalización nociceptivas. Por lo tanto, nuestro objetivo era desarrollar un protocolo rentable que utilizara herramientas sencillas para la monitorización del calcio en tiempo real en células sensoriales y, al mismo tiempo, garantizara un análisis fiable. Aquí, proporcionamos un protocolo integral para ayudar a los investigadores a seguir los pasos para diferenciar las células SH-SY5Y en células neuronales sensoriales y cómo sensibilizarlas a los estímulos pronociceptivos. Este método puede contribuir al descubrimiento de nuevos compuestos analgésicos o neuroprotectores.
Protocolo
Cultivo y diferenciación de 1. SH-SY5Y en células neuronales sensoriales
NOTA 1: Todos los pasos presentes en esta sección deben realizarse bajo una campana de flujo laminar, y todas las soluciones y suministros deben ser estériles.
- En primer lugar, prepare un matraz de cultivo (25cm2) añadiendo 5 mL de medio de cultivo.
NOTA: Para la descongelación, expansión y mantenimiento de este tipo de célula, utilice una mezcla de medio de cultivo: Medio de Águila y Ham F12 modificado con Dulbecco F12 (DMEM/F12) suplementado con un 10% de suero fetal bovino inactivado por calor y un 1% de penicilina-estreptomicina. - A continuación, retire el tubo criogénico que contiene las células SH-SY5Y del nitrógeno líquido y manténgalo en hielo. Descongele las células en un baño de agua a 37 °C durante 2 min.
- Añadir 1 mL de medio de cultivo completo al criovial, transferir las células a un tubo de 15 mL, añadir 3 mL de medio de cultivo completo (DMEM/F12 suplementado con un 10% de suero fetal bovino inactivado por calor) y mezclar extrayéndolo repetidamente y dispensándolo de nuevo en el tubo con una pipeta.
- Pipetear las células en el tubo de 15 ml y centrifugar a 290 g. Deseche el sobrenadante para eliminar el dimetilsulfóxido (DMSO), un agente crioprotector utilizado para prevenir la formación de cristales de hielo durante la congelación de las celdas.
- Añadir 1 mL de medio de cultivo al pellet de células, mezclarlos bien con una pipeta y colocarlos en un matraz decultivo de 25 cm2 para expandir las células. Coloque las células en una incubadora en una atmósfera humidificada de 5% de CO2 a 37 °C.
NOTA: Las celdas se pueden usar cuando alcanzan aproximadamente el 80% de confluencia. Para la diferenciación neuronal, se recomienda utilizar células SH-SY5Y hasta el paso celular veinte. - Prepare la matriz de colágeno extracelular (100 μg/mL) diluyendo colágeno de cola de rata tipo I en PBS estéril y vierta 1 mL de esta solución en una placa de Petri (35/10 mm) para un recubrimiento.
- Incubar en una incubadora en una atmósfera humidificada de 5% deCO2 durante aproximadamente 1 h.
- Después de este período, lave la placa dos veces con PBS estéril y luego cuente las células con la cámara de Neubauer.
- Para contar las células, primero lave el matraz de cultivo de 25cm2 que contiene la célula con 5 mL de PBS estéril para eliminar todo el medio de cultivo. A continuación, retire el PBS estéril, añada 3 ml de tripsina al 0,05% a las células y colóquelas en una incubadora a 37 °C y 5% de CO2 durante aproximadamente 3-5 minutos para completar el desprendimiento de la célula.
- Después de eso, retire las células de la incubadora, agregue 6 mL de medio de cultivo al matraz de cultivo y transfiera esta solución a un tubo de 15 mL. Centrifugar a 290 g durante 5 min.
- Retirar el sobrenadante y resuspender bien las células en 1 mL de medio de cultivo completo.
- Por último, cuente las células con una cámara de recuento de Neubauer. Mezcle 20 μL de células y 20 μL de azul de tripano, y agregue 10 μL de esta mezcla a una cámara de Neubauer. Cuente las células vivas que no se manchan en azul.
- Placa 5 × 104 células/mL células en una placa de Petri (35/10 mm) en el mismo medio de cultivo descrito anteriormente. Utilice el volumen total de 1 ml por placa.
- A continuación, espera 24 h para iniciar el protocolo de diferenciación neuronal. Para ello, retire el medio de cultivo y reemplácelo con 1 mL de DMEM/F12 suplementado con suero fetal bovino inactivado por calor al 2%, penicilina-estreptomicina al 1% y 10 μM de ácido retinoico trans (RA 10 μM).
- Espere 48 h y reemplace el medio de cultivo todos los días durante 3 días. Coloque las células en una incubadora en una atmósfera humidificada de 5% de CO2 a 37 °C.
- Al quinto día, retire el medio de las células y agregue 1 mL de medio de cultivo sin suero suplementado con factor neurotrófico derivado del cerebro humano (BDNF 50 ng/mL) en cada placa.
NOTA: Se probó BDNF de diferentes empresas (ver tabla de materiales). Todos funcionaban de la misma manera. - En el séptimo día de diferenciación, lave las células con PBS estéril una vez y use células de neuronas similares a los sentidos para experimentos. Si es imposible usar estas células inmediatamente para experimentos, agregue un medio de cultivo sin suero para mantenerlas vivas hasta el uso.
NOTA: Al final de la diferenciación neuronal, es necesario lavar las células con PBS estéril para eliminar el BDNF restante, evitando la toxicidad celular.
2. Colágeno glicosilado y proceso de glicación
NOTA: Todos los pasos de esta sección deben realizarse bajo una campana de flujo laminar, y todas las soluciones y suministros deben ser estériles.
- Prepare la glicación del colágeno incubando colágeno tipo I a partir del estado fibrilar de la cola de rata (3,89 mg/mL) con 200 mM de D-ribosa, 160 mM de D-glucosa y 200 mM de D-treosa a 4 °C durante 7 días.
NOTA: Para preparar colágeno glicosilado, pesa los azúcares en función de su peso molecular y mézclalos con colágeno tipo I procedente del estado fibrilar de cola de rata (3,89 mg/mL). - Incubar un cultivo de células neuronales sensoriales durante 24 h con matriz extracelular de colágeno glicosilado (ECM-GC, 100 μg/mL) o matriz extracelular de colágeno normal (ECM-NC, 100 μg/mL) preparada en medio de cultivo DMEM/F12 sin suplementación con suero y antibióticos.
3. Ensayo de afluencia de calcio
- Para la afluencia de calcio, utilice el kit de ensayo de flujo de calcio y prepare las soluciones de acuerdo con las instrucciones del fabricante, como se indica a continuación.
- Inicialmente, prepare 1 mL de carga de colorante Fluo-8 agregando 2 μL de solución madre Fluo-8 en 998 μL de tampón de ensayo 1x (una mezcla de tampón HBSS y 10x Pluronic F127 Plus.
NOTA: Esta solución de trabajo es estable durante al menos 2 h a temperatura ambiente (RT). - Posteriormente, incubar 250 μL de esta solución en cada placa de células de neuronas sensoriales previamente diferenciadas y tratadas con ECM-NC o ECM-GC durante 30 min en una atmósfera humidificada de 5% CO2 a 37 °C. Luego, retire la placa de la incubadora y manténgala a RT (en la oscuridad) durante 30 minutos.
NOTA: Esta solución se vuelve citotóxica si se extrapola la incubación de 2 h. Prepare la solución de capsaicina durante el período de incubación.
4. Inducción de capsaicina
NOTA: La capsaicina, un agonista de TRPV1, se utilizó para inducir la afluencia de calcio en las células.
- Pesar y diluir la capsaicina en etanol al 1% y agua ultrapura. A continuación, se preparó una solución a una concentración de 2 μM, que también se diluyó en agua ultrapura.
NOTA: La solución de capsaicina debe prepararse el día de su uso. Diluir la capsaicina primero en etanol y luego en agua; de lo contrario, se precipitará. - Añadir 250 μL de solución de capsaicina de 2 μM a cada placa de Petri de 35/10 mm para que la concentración final sea de 1 μM.
NOTA: La concentración de la solución madre de capsaicina fue de 2 μM para garantizar una mejor dispersión y evitar picos de fluorescencia aislados.
5. Imágenes de afluencia de calcio y análisis de microscopía confocal
NOTA: Las imágenes se realizaron en un microscopio confocal equipado con un objetivo de 20x/0,75NA y un láser de excitación de 488 nm (intensidad del 0,5%). La emisión se detectó a 520 nm. Las celdas se escanearon en ejes xy (512 x 512 píxeles) a lo largo del tiempo (t) a una velocidad de 600 Hz con un intervalo de adquisición de 433 ms y un tiempo total de adquisición de 5 min. Las imágenes se realizaron a 37 °C para mantener la condición fisiológica de las células utilizando el software de microscopía.
- Prepare una jeringa con 250 μL de solución de capsaicina de 2 μM (la concentración final en la placa será de 1 μM) y conéctela a un juego de venas del cuero cabelludo - Butterfly tipo 23 GA estéril. Asegure la jeringa con un soporte de laboratorio y una pinza.
- Coloque la placa de Petri en la etapa del microscopio y, con extrema precaución, coloque la aguja del cuero cabelludo en la placa de Petri, evitando el contacto con el fondo, la punta de la aguja no debe sumergirse en el líquido.
NOTA: Se puede utilizar una cinta adhesiva para fijar la posición del cuero cabelludo. - Encuentre un campo con un número adecuado de celdas (más de 20) y ajuste el enfoque usando luz de campo brillante.
- Inicie el modo Live con un láser de 488 nm y ajuste los parámetros de enfoque e iluminación.
- Inicie el registro de adquisición y, después del período de referencia (t = 0 a t = 60 segundos), aplique 250 μL de 2 μM de capsaicina y empuje suavemente el émbolo de la jeringa para estimular la entrada de calcio en las células.
NOTA: El tiempo final de adquisición de la grabación fue de aproximadamente 300 s por placa.
6. Post-procesamiento/análisis de datos
- Realice el análisis de células utilizando el software de microscopía en el modo de cuantificación . En primer lugar, analice las células de la espícula de fluorescencia antes y después del estímulo de capsaicina.
- Cree una región de interés (ROI) en cada célula que responda, es decir, células que muestren un pico de fluorescencia después de la capsaicina. Asegúrese de dibujar el ROI en toda el área de la celda, como se muestra arriba (Figura 1).
- Exporte los datos en un archivo de valores separados por comas (CSV) para su posterior análisis.
- Alternativamente, realice el análisis utilizando el software gratuito FIJI7 (https://fiji.sc).
- Para abrir los archivos de imagen, utilice el plugin Bio-Formats navegando hasta Archivo > Importar > Bio-Formatos y seleccionando el archivo.
- A continuación, utilice la herramienta Lupa para acercar y la herramienta Selección a mano alzada para dibujar una región de interés (ROI) alrededor de las celdas responsivas.
- Después de dibujar cada ROI, presione la tecla T para agregarlo al Administrador de ROI. Repita este proceso para todas las celdas de interés (Figura 2).
- Una vez que se agreguen todos los ROI, vaya a la ventana Administrador de ROI , seleccione todos los ROI y luego navegue hasta Analizar > establecer mediciones en el menú principal.
- A continuación, vuelve al Administrador de ROI y selecciona Más > Multi Measure para medir la intensidad en todos los fotogramas. Los resultados aparecerán en una nueva ventana; exporte como un archivo CSV yendo a Archivo > Guardar como.
NOTA: El archivo CSV se puede analizar en el software Excel, Google Sheets y GraphPad. Utilice la ecuación ΔF/F0 = (F(t) - F0)/F0 para convertir los valores de intensidad de fluorescencia obtenidos con el kit de ensayo de flujo de calcio Fluo-8 en una medida relativa del cambio de afluencia de calcio. Aquí, F0 representa la fluorescencia basal, calculada como la intensidad media de las imágenes capturadas desde t = 0 s hasta t = 60 s antes de la estimulación con capsaicina. F(t) es el valor de la intensidad máxima de fluorescencia observada después del estímulo, lo que permite evaluar el flujo máximo de calcio. Este enfoque destaca el aumento de la fluorescencia en relación con la línea de base, donde un aumento en ΔF/F0 indica un nivel elevado de calcio intracelular.
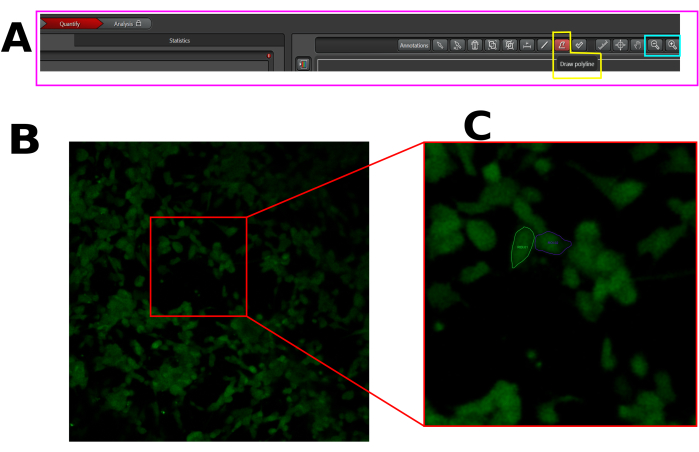
Figura 1: Ejemplo de ROI en las celdas seleccionadas para el análisis de afluencia de calcio en el software LAS X. (A) Interfaz LAS X en modo de cuantificación. El rectángulo rosa muestra la pestaña de cuantificación. El rectángulo amarillo muestra la herramienta de dibujo de polilínea, y el rectángulo cian muestra las herramientas de alejamiento y acercamiento. (B) Campo de visión (FOV) capturado. (C) Acérquese al campo de visión para facilitar el dibujo del ROI en toda la celda. Haga clic aquí para ver una versión más grande de esta figura.
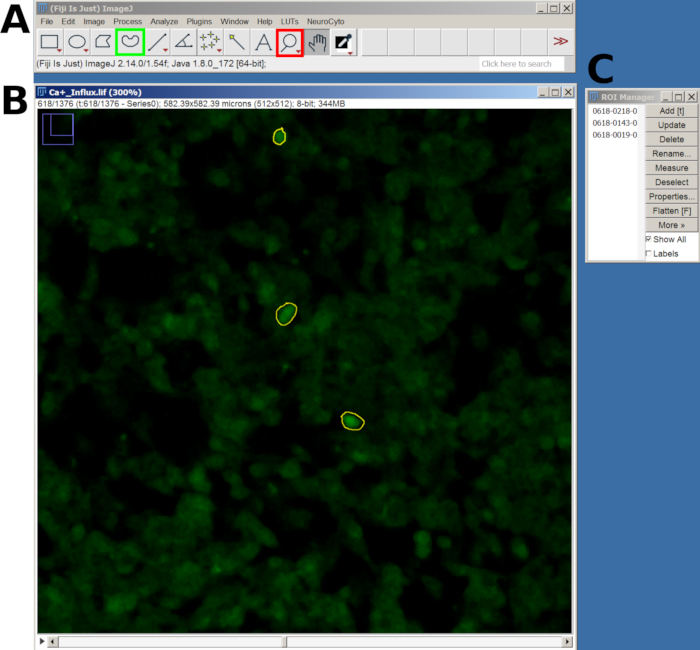
Figura 2: Ejemplo de ROI en las celdas seleccionadas para el análisis de afluencia de calcio en el software FIJI. (A) Interfaz FIJI que muestra el menú principal y la herramienta. El cuadrado rojo muestra la herramienta de lupa y el cuadrado verde muestra la selección a mano alzada. (B) Campo de visión (FOV) capturado con zoom y un ROI dibujado. (C) La ventana del administrador de ROI. Haga clic aquí para ver una versión más grande de esta figura.
7. Solución de problemas
- Si la imagen está desenfocada, pruebe lo siguiente:
- Compruebe la adherencia de la cinta; Si se ha aflojado, esto puede hacer que la aguja se desplace y afecte el enfoque.
- Vuelva a colocar la aguja con cinta adhesiva adicional para aumentar la estabilidad.
- Sustitución de agujas estándar. Utilice las puntas de las agujas dentales predobladas para mejorar la alineación en la placa.
- Si las células muestran una señal saturada, pruebe los siguientes pasos:
- Disminuya la intensidad del láser y los ajustes de ganancia.
- Verifique el tiempo de incubación de los reactivos. Si excede las recomendaciones del fabricante, puede provocar saturación de la señal, lo que complica la detección de la afluencia de calcio.
- Siga estas sugerencias adicionales para solucionar problemas:
- Calibración regular: Asegúrese de que el equipo de imágenes se calibra regularmente para mantener la calidad del enfoque y la detección de señales.
- Documente los cambios: Mantenga un registro de los ajustes realizados en el protocolo para futuras referencias y para facilitar la resolución de problemas.
- Ajustes reactivos: Si los problemas persisten, considere la posibilidad de realizar pruebas con diferentes concentraciones de reactivos o métodos alternativos de detección de señales.
Resultados
Diferenciación de las células SH-SY5Y en neurona sensorial
Las imágenes de cribado de alto contenido demuestran que el protocolo de diferenciación neuronal cambia la morfología de las células SH-SY5Y. Las células neuronales sensoriales (células diferenciadas) muestran un cuerpo celular redondeado que proyecta una extensa red de neurofilamentos. Forman ramas de proyecciones de neuritas más alargadas que conectan las neuronas circundantes, lo que es consistente con las características de las neuronas maduras (Figura 3)4. Es importante destacar que estas células muestran niveles aumentados de TRPV1 en comparación con las células SH-SY5Y indiferenciadas (Figura 4).
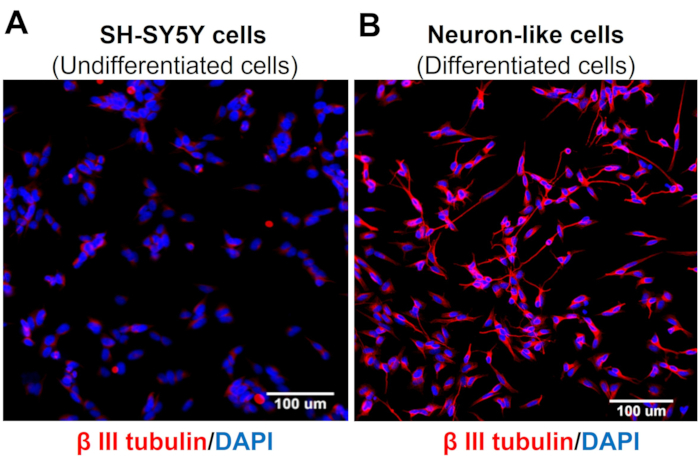
Figura 3: Expresión de tubulina β-III en células indiferenciadas y diferenciadas. Cribado de alto contenido (Molecular Devices, San Jose, CA, EUA) imágenes de inmunofluorescencia de marcadores neuronales específicos (tubulina β-III) en (A) células indiferenciadas (células SH-SY5Y) y (B) células diferenciadas (células sensoriales similares a las neuronas). Imágenes representativas de cinco zonas. Ampliación: 20x. Barra de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
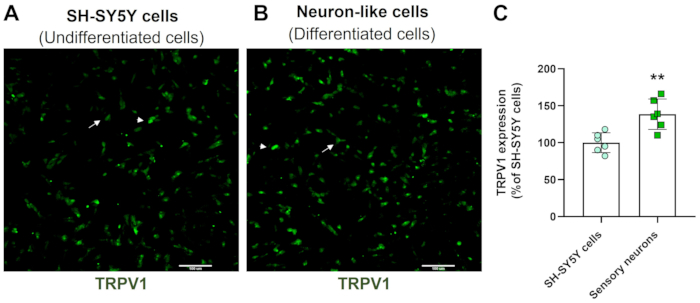
Figura 4: Expresión de TRPV1 en células indiferenciadas y diferenciadas. Imágenes de inmunofluorescencia HCS de la expresión de TRPV1 en (A) células indiferenciadas (células SH-SY5Y) y (B) células diferenciadas (células sensoriales similares a neuronas). Imágenes representativas de cuatro zonas. La flecha etiqueta las células TRPV1 de baja expresión y la punta de flecha etiqueta las células TRPV1 de alta expresión. Aumento: 10x. Barra de escala: 100 μm. (C) Cuantificación de la expresión de TRPV1 en células SH-SY5Y y neuronas sensoriales. Prueba t de Student no pareada, **p<0,005 en comparación con EMC-NC, n= 6. Haga clic aquí para ver una versión más grande de esta figura.
La glicación del colágeno que interactúa con las células sensoriales imita un microambiente doloroso4. Aquí, demostramos que el colágeno glicosilado aumenta la afluencia de calcio inducida por la capsaicina en comparación con las células tratadas con colágeno normal (Figura 5). Estos resultados sugieren que los AGEs son suficientes para aumentar las corrientes evocadas por la capsaicina.
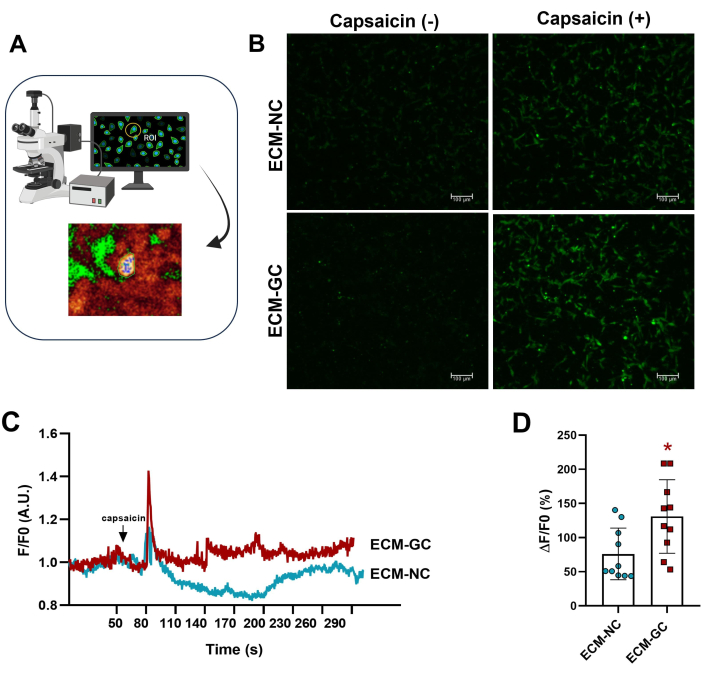
Figura 5: Mediciones de calcio intracelular. (A) Identificación de la región de fluorescencia de interés (ROI). (B-D) La afluencia de calcio está indicada por el aumento de la fluorescencia antes y después de la aplicación de capsaicina (1 μM, concentración final). La flecha indica la aplicación de capsaicina. Los aumentos en el calcio intracelular se determinaron como ΔF/F0 (F0 es fluorescencia basal). Prueba t de Student pareada (pares emparejados de Wilcoxon), *p < 0,05 en comparación con ECM-NC, n= 10 celdas. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los nociceptores son subconjuntos especializados de neuronas sensoriales que median el dolor. Estas células expresan canales iónicos dependientes de voltaje y ligandos, como TRPV1, cuya activación conduce a la afluencia de calcio y la liberación de neuropéptidos y neurotransmisores que regulan la transmisión nociceptiva. Aquí, describimos un protocolo para diferenciar SH-SY5Y en células neuronales sensoriales para evaluar la afluencia de calcio inducida por capsaicina 8,9. Es importante destacar que demostramos que, imitando un entorno pronociceptivo con colágeno glicosilado, hay una regulación positiva de la afluencia de calcio inducida por la capsaicina, lo que confirma que los canales TRPV1 son funcionales, y los AGE pueden sensibilizar estos canales al aumentar su capacidad de respuesta a un estímulo nocivo.
La evaluación del influjo de calcio en las neuronas sensoriales ha sido una herramienta valiosa para el cribado de candidatos a analgésicos10. Se ha avanzado en el diseño de indicadores moleculares de calcio, con el desarrollo de colorantes de calcio estables como el Fluo-8. Fluo-8 (sin método de lavado) tiene ventajas sobre otros tintes fluorescentes, incluido el aumento del brillo, el trabajo a temperatura ambiente y la mayor sensibilidad a concentraciones de calcio más bajas. En este protocolo, la capsaicina se aplicó a través de un conjunto de venas del cuero cabelludo. Anteriormente, usábamos una pipeta normal, pero a menudo desplazaba la placa celular e interrumpía la adquisición de imágenes. Otra posibilidad sería usar una bomba de perfusión para administrar capsaicina lentamente. Curiosamente, el enfoque de este protocolo utiliza componentes fácilmente disponibles y rentables que se pueden implementar en cualquier laboratorio, lo que proporciona una ventaja significativa sobre las cámaras de perfusión tradicionales para monitorear el flujo de calcio. Además, el aparato descrito aquí es universalmente compatible con la mayoría de los microscopios de fluorescencia comúnmente utilizados en entornos de investigación, lo que elimina la necesidad de equipos especializados o modificaciones. Esta adaptabilidad facilita la integración perfecta entre diversas configuraciones de imágenes, lo que mejora la accesibilidad de las técnicas avanzadas de imágenes de calcio a una gama más amplia de laboratorios, especialmente en laboratorios con presupuestos limitados. Sin embargo, a diferencia de un lector de microplacas multimodo de sobremesa para mediciones de fluorescencia automatizadas, una limitación del método descrito aquí es que requiere un equipo de imágenes de alta resolución y pipeteo manual, lo que requiere más tiempo. Sin embargo, la microscopía confocal tiene la ventaja de detectar una emisión de fluorescencia más baja.
Los métodos para estudiar las neuronas sensoriales utilizan principalmente cultivos celulares primarios o células madre pluripotentes (iPS). Las neuronas sensoriales humanas primarias son raramente accesibles, y la generación de iPS requiere mucha mano de obra y reactivos costosos y técnicos expertos. Por lo tanto, a pesar de la limitación que implica la diferenciación de SH-SY5Y en células neuronales, que no conservan completamente las características fisiológicas de una neurona humana intacta, son morfológicamente similares a las neuronas primarias 9,10 y mantienen características importantes, como la expresión de canales de sodio, la liberación de la sustancia P y la capacidad de respuesta a la capsaicina y la morfina 4,11,12,13.
El dolor es una afección compleja, y encontrar fármacos que perjudiquen la excitación de las neuronas cultivadas puede no ser suficiente para bloquear la sensación de dolor. Sin embargo, los datos previos que muestran que la morfina disminuye la liberación de la sustancia P inducida por el colágeno glicosilado sugieren que nuestro modelo es útil para encontrar nuevas moléculas analgésicas. Además, aquí demostramos que el colágeno glicosilado es suficiente para hipersensibilizar las neuronas a la afluencia de calcio inducida por la capsaicina, lo que indica que las imágenes de calcio en presencia de AGEs pueden ser útiles en la búsqueda de nuevos compuestos terapéuticos para enfermedades inflamatorias y degenerativas dolorosas. Cabe destacar que utilizamos 1 μM de capsaicina para inducir la afluencia de Ca2+, una concentración estándar para las imágenes de Ca2+ en las neuronas 8,14,15. Sin embargo, en estudios futuros se debe realizar una curva dosis-respuesta para optimizar las condiciones experimentales.
El método descrito aquí para evaluar la afluencia de calcio puede tener aplicaciones más amplias más allá de las células neuronales. También es adecuado para cultivos de células sensoriales primarias y se puede adaptar a otros tipos de células, como cardiomiocitos y macrófagos. Además, dado que el colágeno de glicación se produce con el envejecimiento y en condiciones patológicas como las complicaciones diabéticas, este enfoque puede servir como una herramienta valiosa para investigar la enfermedad renal y los trastornos oculares.
Una modificación principal en nuestro protocolo es el reemplazo de la aguja estándar con puntas de aguja dental predobladas. Estas agujas curvas permiten un mejor ajuste en la placa, lo que minimiza la manipulación, reduce la cantidad de cinta adhesiva necesaria y disminuye el riesgo de que la punta toque la parte inferior de la placa.
Algunos problemas que pueden ocurrir durante el procedimiento y sus soluciones se detallan en la sección 7 del protocolo. Si la imagen está desenfocada después de ajustar la aguja en la placa, compruebe si las cintas adhesivas se han aflojado, lo que hace que la aguja se desplace de la placa. Se recomienda volver a colocar la aguja con cinta adhesiva adicional para una mejor estabilidad. Si las células exhiben señales saturadas, se debe intentar disminuir la intensidad del láser y los parámetros de ganancia. Verifique el tiempo de incubación del reactivo. Nuestra experiencia indica que si el tiempo de incubación supera la recomendación del fabricante, la señal se vuelve excesivamente intensa, lo que puede interferir en la detección de la afluencia de calcio. Para picos de fluorescencia inesperados y desprendimiento de células después de la inyección de líquido, el líquido debe inyectarse lentamente para evitar picos repentinos de fluorescencia y evitar interrumpir la adhesión celular. Las inyecciones rápidas pueden generar turbulencias, lo que provoca artefactos de señal transitorios y el desprendimiento de células del fondo del pozo.
Divulgaciones
MCB, AMCT y VOZ poseen una patente sobre el proceso de identificación de entidades moleculares involucradas en el dolor de la osteoartritis (BR102018008561-1).
Agradecimientos
Este trabajo contó con el apoyo de la Fundação Amparo à Pesquisa do Estado de São Paulo FAPESP Grant nº 2015/50040-4 y 2020/13139-0, la Fundación de Investigación de São Paulo y GlaxoSmithKline, FAPESP 2022/08417-7 y 2024/04023-0.
Materiales
| Name | Company | Catalog Number | Comments |
| All-trans retinoic acid | Tocris | 695 | |
| BDNF | Tocris | TOCR-2837 | |
| BDNF | Sigma-Aldrich | B3795 | |
| Butterfly type 23GA sterile | Beckton Dickinson Asepto | 38833814 | Scalp vein set |
| Capsaicin | Sigma-Aldrich | M2028 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| DMEM/F12 | Gibco | 12500062 | Basal medium |
| D-ribose | Sigma-Aldrich | R7500 | |
| D-threose | Sigma-Aldrich | T7392 | |
| Fluo-8 Calcium Flux Assay Kit | Abcam | ab112129 | No wash |
| Heat-inactivated fetal bovine serum | Gibco | A5670801 | |
| High Content Screening | Molecular Devices | ||
| LASX software | Leica Microsystems | Microscopy software | |
| Leica TCS SP8 | Leica Microsystems | Leica TCS SP8 | Confocal microscope |
| Penicillin-streptomycin | Gibco | 15140130 | |
| Petri dish (35/10 mm) | Greiner bio-one | 627965 | |
| Rat tail type I collagen | Corning | 354236 | |
| SH-SY5Y | Merck | 94030304-1VL | Neuroblastoma cell line |
Referencias
- Bierhaus, A., et al. Understanding RAGE, the receptor for advanced glycation end products. J Mol Med. 83 (11), 876-886 (2005).
- Hudson, B. I., et al. Blockade of receptor for advanced glycation endproducts: A new target for therapeutic intervention in diabetic complications and inflammatory disorders. Arch Biochem Biophys. 419 (1), 80-88 (2003).
- Dandia, H., Makkad, K., Tayalia, P. Glycated collagen - a 3D matrix system to study pathological cell behavior. Biomater Sci. 7 (8), 3480-3488 (2019).
- Bufalo, M. C., et al. Human sensory neuron-like cells and glycated collagen matrix as a model for the screening of analgesic compounds. Cells. 11 (2), 247 (2022).
- Frias, B., Merighi, A. Capsaicin, nociception and pain. Molecules. 21 (6), 797 (2016).
- Lam, D., et al. RAGE-dependent potentiation of TRPV1 currents in sensory neurons exposed to high glucose. PLoS One. 13 (2), e0193312 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Li, F., et al. TRPV1 activity and substance P release are required for corneal cold nociception. Nat Commun. 10 (1), 5678 (2019).
- Mickle, A. D., Shepherd, A. J., Mohapatra, D. P. Sensory TRP channels:the key transducers of nociception and pain. Prog Mol Biol Transl Sci. 131, 73-118 (2015).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiol Pain. 11, 100083 (2022).
- Vetter, I., et al. Characterisation of Nav types endogenously expressed in human SH-SY5Y neuroblastoma cells. Biochem Pharmacol. 83 (11), 1562-1571 (2012).
- Dekker, L. V., et al. Analysis of human Nav1.8 expressed in SH-SY5Y neuroblastoma cells. Eur J Pharmacol. 528 (1-3), 52-58 (2005).
- Lam, P. M. W., Hainsworth, A. H., Smith, G. D., Owen, D. E., Davies, J., Lambert, D. G. Activation of recombinant human TRPV1 receptors expressed in SH-SY5Y human neuroblastoma cells increases [Ca2+]i initiates neurotransmitter release and promotes delayed cell death. J Neurochem. 102 (3), 801-811 (2007).
- Koplas, P. A., Rosenberg, R. L., Oxford, G. S. The role of calcium in the desensitization of capsaicin responses in rat dorsal root ganglion neurons. J Neurosci. 17 (10), 3525-3537 (1997).
- Tominaga, M., et al. The cloned capsaicin receptor integrates multiple pain-producing stimuli. Neuron. 21 (3), 531-543 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados