Method Article
Sarı Humma Sivrisineği Aedes aegypti'de CRISPR-Cas9 Kullanılarak Genom Düzenleme
Bu Makalede
Özet
Burada, CRISPR-Cas9 teknolojisini kullanarak sivrisinek A. aegypti'de embriyonik mikroenjeksiyon yoluyla genom düzenleme için ayrıntılı bir protokol açıklıyoruz.
Özet
Kümelenmiş, düzenli olarak serpiştirilmiş, kısa palindromik tekrarlar (CRISPR)-Cas9 teknolojisinin ortaya çıkışı, genetik mühendisliği alanında devrim yarattı ve model olmayan organizmalar da dahil olmak üzere birçok türde hassas genom düzenlemesi için kapıları açtı. Sivrisinek Aedes aegypti'de, fonksiyon kaybı mutasyonları ve DNA eklemeleri bu teknoloji ile gerçekleştirilmiştir. Burada, CRISPR-Cas9 teknolojisini kullanarak sivrisinek A. aegypti'de embriyonik mikroenjeksiyon yoluyla genom düzenleme için ayrıntılı bir protokol açıklıyoruz ve hem gen nakavt hem de knockin hatlarının oluşturulmasına odaklanıyoruz. Bu protokolde kuvars iğneleri, gen knockin isteniyorsa, kılavuz RNA, rekombinant Cas9 ve bir floresan markör için bir geni kodlayan bir DNA kaseti içeren bir plazmit karışımı ile doldurulur. Preblastoderm aşamasındaki embriyolar, daha sonra bir cam slayt üzerine monte edilen bir lamel üzerine yerleştirilmiş çift taraflı yapışkan bir bant şeridi üzerine dizilir. Bir mikroenjektör yardımıyla, iğneler embriyoların arka ucuna nazikçe yerleştirilir ve küçük bir hacimde CRISPR karışımı dağıtılır. Embriyolar yumurtadan çıktığında, larvalar floresan kapsamı altında kontrol edilir ve pupalar cinsiyete göre sıralanır ve farklı kafeslerde ayrılır. Yetişkinler ortaya çıktıktan sonra, bunlar karşılıklı olarak vahşi tip bireylerle çaprazlanır, kanla beslenir ve yumurtlama için yerleştirilir. Bu yumurtalar yumurtadan çıktıktan sonra, toplanan floresan larvalar, DNA kasetinin genomlarına kararlı bir şekilde yerleştirildiği bireyleri temsil eder. Bu larvalar daha sonra yetişkin aşamasına kadar büyütülür, vahşi tip bireylere çaprazlanır ve daha sonra DNA kasetinin tam dizisinin sivrisinek genomunun istenen bölgesinde mevcut olduğunu doğrulamak için moleküler tekniklerle daha fazla değerlendirilir. Homozigot çizgiler, sağlanan geçiş şeması boru hattı ve mutasyonların moleküler taraması izlenerek de elde edilebilir.
Giriş
Hassas genom düzenleme, moleküler makasın CRISPR-Cas teknolojilerinin kurulmasıyla tartışmalı bir şekilde daha kolay hale geldi, ancak mümkün hale geldi1. Bu teknolojiler, prokaryotik bağışıklık sisteminin faj enfeksiyonlarına karşı savaşmak için kullandığı bir mekanizmadan yararlanır2. Bu sistemler arasında, kümelenmiş, düzenli olarak serpiştirilmiş, kısa palindromik tekrarlar (CRISPR) Cas9 nükleaz ile birlikte genellikle 20 baz çifti RNA'ya, kılavuz RNA'lara (gRNA'lar) dayanır ve hedeflenen DNA'ya homolog diziler izler ve bunu bir NGG protospacer bitişik motif (PAM) dizisi3 izler. Cas9'a yüklenen gRNA'lar, bu nükleazları tam olarak genomdaki belirli hedef bölgelere yönlendirir ve çift sarmallı DNA kırılmalarını tetikler3.
DNA çift iplikçik kırılmaları, çift sarmal4'ü yamalamak için onarım mekanizmalarını indükler. Herhangi bir DNA onarımının kesin olması beklenirken, dizi izlerini ve dolayısıyla işlev kaybı mutasyonlarını geride bırakabilecek daha az doğru DNA onarım mekanizmaları vardır4. Hataya eğilimli DNA onarım mekanizmaları arasında, Homolog Olmayan Uç Birleştirme (NHEJ), fonksiyon kaybı mutasyonuna neden olabilecek küçük delesyonlar, eklemeler ve nükleotid değişiklikleri (SNP'ler) dahil olmak üzere çerçeve kayması mutasyonlarına neden olabilir. Öte yandan, Homoloji Yönlendirilmiş Onarım (HDR) mekanizması, hasarsız alelin tam dizisini kopyalamak ve hedeflenen DNA dizisinin4 mükemmel bir onarımını yapmak için bir şablon olarak homolog kromozoma dayanır.
Bu bilgiye dayanarak, CRISPR-Cas9 teknolojisi, muhtemelen bir PAM bölgesi3 içeren herhangi bir dizide genomları hassas bir şekilde düzenlemek için geliştirilmiştir. Sivrisineklerde, CRISPR-Cas9 teknolojisi, NHEJ onarım mekanizmasından 5,6 yararlanarak, Cas9 ve gRNA'ların bir karışımının embriyonik mikroenjeksiyonu yoluyla çeşitli genleri devre dışı bırakmak için kullanılmıştır. Benzer germline mutajenez, gRNA + Cas9 karışımının yetişkin dişi sivrisineklerinhemolenfine enjekte edilmesiyle elde edilir 7. Bu teknoloji ReMOT kontrolü olarak adlandırıldı ve yumurta gelişimi (vitellogenez) sürecinde endositoz yoluyla yumurtalıklar tarafından alınan bir peptit ile etiketlenmiş bir Cas9'un değiştirilmiş bir versiyonuna dayanıyor7. Spesifik gen kasetlerinin bir genoma çalınması, yalnızca istenen bir DNA kasetini8 kodlayan bir plazmit ile birlikte bir gRNA ve Cas9 karışımının (veya bu molekülleri ifade eden bir plazmitin) embriyonik mikroenjeksiyonu ile mümkündür. HDR mekanizmasından yararlanılarak, homolog dizilerle (500-1.000bp)9,10 hedef bölgenin yukarı ve aşağı akışında çevrili ilgilenilen DNA kasetini içeren plazmit, çift iplikli kopmayı yeniden yazmak için bir şablon olarak kullanılır ve ayrıca DNA kasetini hedef diziyekopyalar 9.
CRISPR-Cas9 teknolojisi, sivrisinek Aedes aegypti11'deki duyusal sistemlerle ilgili çoklu genleri devre dışı bırakmak için kullanılmıştır, aynı zamanda popülasyon kontrolü12 için erkek doğurganlığı ve dişi canlılığı (PgSIT) ile ilişkili genleri de devre dışı bırakmak için kullanılmıştır. Hedef genlerin devre dışı bırakılması, floresan belirteçleri kodlayan genlerin belirli genlerin kodlama dizilerine çarpılmasıyla da gerçekleştirilmiştir13,14. Bu strateji, yalnızca çerçeve kaydırma mutasyonlarını indüklemekle kalmayıp, aynı zamanda yeni nakavt hattının13,14 bireylerini sıralamak için floresan ışığın kullanılmasına da izin verme avantajına sahiptir. A. aegypti genomu, Q-sistemi (QF-QUAS)11 gibi ikili ekspresyon sistemlerinin dizileri ile de düzenlenmiştir. QF transaktivatörünü kodlayan genin aşağı akışta belirli bir genin bir promotörüne vurulması, transaktivatörün15,16 tanımlanmış uzay-zamansal ekspresyonunu sağlar. QF eksprese eden bir sivrisinek hattı, QF için bağlanma bölgelerini (QUAS) içeren başka bir sivrisinek hattına geçtiğinde, ikincisi ona bağlanır ve QUAS dizisi 15,16'ya akış aşağı akıştaki genlerin ekspresyonunu tetikler. Bu sistem, genel olarak, hücre lokalizasyonu veya nöronal aktivitenin tespiti için kullanılan floresan belirteçler ve hatta belirli dokulardaki genleri bozmak için Cas9 nükleazları (yani, somatik nakavt) olabilen bu tür efektör genlerin dokuya ve zamana özgü ekspresyonuna izin verir11.
A. aegypti genetik dönüşümü için mevcut tüm bilgiler göz önüne alındığında, burada embriyonik mikroenjeksiyon yoluyla CRISPR-Cas9 sistemi ile genom düzenlemesi yapmak için adım adım talimatlar içeren ayrıntılı bir protokol sunuyoruz. NHEJ'nin aracılık ettiği çerçeve kaydırmalı mutasyonlar ve delesyonlar yoluyla hem nakavt hem de HDR aracılı gen kaseti eklemeleri ile knockin hatları oluşturma stratejileri tartışılmaktadır.
Protokol
Bu protokolde kullanılan ekipman ve reaktiflerle ilgili ayrıntılar Malzeme Tablosunda listelenmiştir. Tüm hayvanlar, Ulusal Sağlık Enstitüleri tarafından önerildiği şekilde Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na göre ele alındı. Prosedürler, UCSD Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC, Hayvan Kullanım Protokolü #S17187) ve UCSD Biyolojik Kullanım İzni (BUA #R2401) tarafından onaylandı.
1. gRNA'lar ve donör plazmit tasarımı
- Nakavt mutantları yapmak için, ~20-100 bp aralıklı iki gRNA tasarlayın (Şekil 1A).
- CHOPCHOP (https://chopchop.cbu.uib.no/)17veya Benchling (benchling.com) veya CRISPOR (http://crispor.gi.ucsc.edu/)18 gibi çevrimiçi bir araç (Şekil 1A) kullanarak PAM dizisi (NGG) hariç olmak üzere CRISPR-Cas9 için 20 bp gRNA tasarlayın. Çevrimiçi araç tarafından önerildiği gibi, deneyler için en spesifik ve hedef dışı gRNA'ları seçin.
- gRNA kesim bölgeleri arasındaki diziye verimli bir kısıtlama enzimi kesme bölgesinin dahil edildiğinden emin olun (Şekil 1A). Başarılı düzenlemelerin hızlı bir şekilde görsel olarak onaylanmasını sağlamak için gRNA kesim bölgeleri arasına bir kısıtlama enzimi bölgesi ekleyin.
NOT: Silme gerçekleştiğinde, kısıtlama bölgesi kaldırılır, böylece enzim diziyi kesmez ve silmeyi doğrulamak için bir jel üzerinde tek, kesilmemiş bir bant üretir.
- HDR aracılı gen kaseti yerleştirmeleri için, nakavt mutantları yapmak için bahsedilen araçları kullanarak birden fazla gRNA tasarlayın ve daha sonraki değerlendirmeden sonra en etkili olanı seçin.
- Hedef bölge homoloji kolları, kargo DNA dizisi, bir floresan işaretleyici, replikasyonun kökeni ve bir antibiyotik direnç geni içeren Homolojiye Yönelik Onarım (HDR) için donör plazmitleri tasarlayın (Şekil 1B).
- Hedef sahanın yukarı ve aşağı bölgelerinden, her biri 500-1.000 bp10'u kapsayan homoloji kollarını seçin (Şekil 1B).
- Bir floresan işaretleyici, ilgilenilen bir gen veya düzenleyici bir unsur (örneğin, QF2) içerebilecek kargo sırasını seçin.
- Bir floresan kalemi seçin. A. aegypti için kullanılan yaygın floresan işaretleyiciler, bir promotör, bir floresan işaretleyici kodlama geni ve bir 3' UTR dizisi içeren bir DNA kasetine dahil edilir. Daha fazla ayrıntı için tartışmaya bakın.
2. Enjeksiyon karışımı hazırlama
- Cas9 proteinini Cas9 seyreltme tamponu ile 1 μg/μL'ye seyreltin.
NOT: Cas9'u 2 kattan fazla çözdürmeyin ve dondurmayın. Cas9 proteininin alikotlarının yapılması tavsiye edilir. - gRNA'ları satın alın veya şirket içinde üretin.
NOT: Şirket içi üretim için standart RNA dekontaminasyon uygulamaları ve RNAse içermeyen malzemeler kullanın.- 4-6 gRNA tasarlayın ve enjeksiyon için en iyi iki gRNA'yı seçin (aşağıdaki in vitro bölünme testine bakın).
- gRNA dizisinin yukarı akışında T7 promotör dizisini içeren bir ileri astar tasarlayın. Aşağıda açıklandığı gibi şablon olmayan PCR reaksiyonları için evrensel gRNA ters astarını kullanın. Üst üste binen dizi bazı, evrensel ters astardaki (kalın ve altı çizili) karşılık gelen diziyle eşleşir ve DNA polimerazın dizilerini yükseltmesi için bir şablon oluşturur.
NOT: Bu PCR reaksiyonları için, ileri primer T7 promotörü (kalın), ardından iki guanin (T7 RNA polimeraz yoluyla transkripsiyon başlangıcı için önemlidir), gRNA'nın 20 nükleotid dizisi (N20; PAM dizisi olmadan) ve primer örtüşme dizisi (altı çizili) içermelidir.
Astar ileri: 5'- GAAATTAATACGACTCACTATAGGN20 GTTTTAGAGCTAGAAATAGC- 3'
Astar ters: 5''-AAAAGCACCGACTCGGTGCCACTTTTT CAAGTTGATAACGGACTAGC
CTTATT TTAACTT GCTATTTCTAGCTCTAAAAC - 3' - DNA şablonunu şablon olmayan PCR ile sentezleyin. Birden fazla reaksiyon ayarlayın (her biri 12.5 μL 2x ana karışım, 1.25 μL 10 μM ileri astar çözeltisi, 1.25 μL 10 μM ters astar çözeltisi ve 10 μL ultra saf su içerir) böylece in vitro transkripsiyon reaksiyonu için yeterli PCR ürünü (300 ng) mevcuttur. Aşağıdaki PCR koşullarını kullanın: 98 °C'de 30 saniye boyunca ilk denatürasyon; 98 °C'de 10 sn, 62 °C'de 10 sn ve 72 °C'de 10 sn boyunca 35 döngü amplifikasyon; 72 °C'de 2 dakika son uzatma; ve 4 °C'de depolama.
- Tek bir DNA fragmanının (122 baz çifti) bir agaroz jeli (% 2) üzerinde amplifikasyonunu onaylayın.
- Üreticinin tavsiyelerine uyarak bir PCR Saflaştırma kiti kullanarak PCR şablonunu temizleyin.
- Bir T7 Transkripsiyon Kiti ile in vitro transkripsiyon reaksiyonu gerçekleştirin. 2 μL 10x reaksiyon tamponu, 2 μL nükleotid (ATP, CTP, UTP ve GTP), 2 μL T7 RNA polimeraz, 3 μL şablon DNA (100 ng/μL) ve 5 μL ultra saf suyu karıştırın. Karışımı 37 ° C'de en az 2 saat (en fazla 16 saat) ila gece (12 saat) arasında inkübe edin.
NOT: Bu reaksiyonda, T7 RNA polimeraz, primer ileri diziye dahil edilen T7 promotörüne bağlanır ve bu da gRNA'nın transkripsiyonuna yol açar. - 1 μL DNaz ekleyerek (iyice karıştırın) ve 37 ° C'de 15 dakika inkübe ederek transkripsiyon reaksiyonunu DNaz ile tedavi edin.
- Üreticinin tavsiyelerine uyarak sentezlenen sgRNA'ları bir transkripsiyon temizleme kiti ile saflaştırın.
- Seçilen gRNA'ların kesme verimliliğini değerlendirmek için bir in vitro bölünme testi yapın (Şekil 1C).
- gRNA kesme bölgesini çevreleyen bir DNA fragmanını (500-1.000 bp) amplifiye etmek için primerler tasarlayın.
- PCR reaksiyonlarını aşağıdaki gibi ayarlayın: 12.5 μL 2x ana karışım, 1.25 μL 10 μM ileri primer çözeltisi, 1.25 μL 10 μM ters astar çözeltisi, 9 μL ultra saf su ve 1 μL 5 ng/μL şablon DNA.
- Aşağıdaki PCR koşullarını kullanın: koşullar: 98 ° C'de 30 saniye boyunca ilk denatürasyon; 98 °C'de 10 sn, X °C'de 15-30 sn (astarlar için ideal tavlama sıcaklığı) ve 72 °C'de 35 sn için 35 döngü amplifikasyon; 72 °C'de 2 dakika son uzatma; ve son olarak 4 °C'de uzun süreli depolama.
- En iyi amplifikasyon sıcaklıkları ve zaman aralığı için üreticinin yönergelerine bakın. PCR temizlemesi (tek bant) veya agaroz jel PCR bandı saflaştırmasından sonra yeterli PCR ürünü (1.5-2 μg) elde etmek için en az beş reaksiyonu bir araya getirin veya reaktiflerin hacimlerini büyütün.
- Aşağıdaki karışımı 37 °C'de 1 saat inkübe ederek rekombinant Cas9 ile Cas9 bölünme reaksiyonlarını ayarlayın: 1 μL 10x Cas9 reaksiyon tamponu, 0.35 μL rekombinant Cas9 (1 μg/μL), 1 μL gRNA (100 ng/μL), 6.65 μL ultra saf su ve 1 μL 300 ng/μL şablon DNA.
- Herhangi bir gRNA olmadan negatif bir kontrol reaksiyonu ayarlayın.
- Bir agaroz jel (% 1.5-2.0) üzerinde reaksiyonlar çalıştırarak bölünme verimliliğini kontrol edin; Şekil 1C).
3. Donör plazmidinin montajı
- PCR-amplifiye A . aegypti'nin genomik DNA'sından homoloji kolları.
- Astar tasarımı için klonlama kiti üreticisinin yönergelerine bakın. Farklı klonlama stratejileri (örneğin, Gibson, Golden Gate ve restriksiyon enzimi tabanlı klonlama) kullanarak plazmit tasarımı ve montajı için destek sağlayan çevrimiçi bir araç (örneğin, Benchling) kullanın.
- A. aegypti genomik DNA'sından kargo dizisini çoğaltın veya ticari olarak sentezlenmiş bir gen parçası sipariş edin.
- Plazmitlerden floresan belirteçleri şirket içinde çoğaltın.
- 3.1.1'den 3.1.3'e kadar olan DNA parçalarını Gibson montajı ile mevcut bir plazmitin omurgasına bağlayın. 10 μL 2x ana karışım, tüm DNA fragmanlarının X μL'si, 10-X μL ultra saf su karışımını 50 °C'de 1 saat inkübe edin.
NOT: Eklerin plazmit omurgasına ideal oranını hesaplamak için üreticinin yönergelerine bakın.- Her bir klonlama parçasının konsantrasyonlarını piko mol cinsinden hesaplayın: pmols = (ng cinsinden ağırlık) × 1.000/(baz çiftleri × 650 dalton).
- 50-100 ng plazmit omurgası ve her bir kesici uçtan 2-3 kat fazla molar kullanın.
- 2-3 parçayı bir araya getiriyorsanız, Gibson reaksiyonuna her parçadan 0.02-0.5 pmol ekleyin. 4-6 parçayı bir araya getiriyorsanız, her birinden 0.2-1.0 pmol ekleyin.
- E. coli yetkin hücreleri JM109'u dönüştürmek için 3-5 μL Gibson montaj reaksiyonu kullanın.
NOT: JM109, istenmeyen rekombinasyon olaylarını azaltan ve hücre hasadı sırasında nükleaz taşınmasını önleyen, birleştirilen DNA parçalarının bütünlüğünü sağlayan recA-genotipi nedeniyle Gibson montajı için seçilmiştir.
10 kb'den büyük plazmitler için, üreticinin tavsiyelerine uyarak genişletilmiş protokolü kullanarak DH5α yetkin hücrelerinin dönüştürülmesini öneririz. - Dönüştürülen bakterileri genişletin ve bir mini hazırlık kiti kullanarak plazmidi saflaştırın.
- Doğru plazmit düzeneğinin doğrulanması için, saflaştırılmış plazmit DNA ile bir tanısal kısıtlama enzimi sindirimi çalıştırın ve agaroz jel elektroforezi ile görselleştirin (Şekil 1D, E).
NOT: Plazmidi tek bir bölgede kesebilecek birkaç kısıtlama enziminin seçimi için çevrimiçi bir araç kullanmanızı öneririz. Benchling gibi bir yazılım, seçilen kısıtlama enzimleri ile plazmit dizilerinin sanal sindirimini gerçekleştiren ve beklenen DNA bandı modelini sanal bir elektroforez jeli üzerinde görüntüleyen yerleşik bir araca sahiptir (Şekil 1D).- Plazmit kısıtlama enzimi sindirimini gerçekleştirin. 1 μL 10x restriksiyon sindirim tamponu, 0.5 μL restriksiyon enzimi 1, 0.5 μL restriksiyon enzimi 2, 1 μL plazmit DNA (300 ng/mL) ve 7 μL ultra saf su karışımını 37 ° C'de 2 saat inkübe edin.
- Kısıtlama sindirim reaksiyonlarını bir agaroz jel (% 1.5) üzerinde çalıştırın.
NOT: DNA bant modeli (Şekil 1E), sanal özet bant modeline (Şekil 1D) benzemelidir. Hizmet mevcutsa, plazmitler tüm plazmit dizilimi için de gönderilebilir.
- Plazmit klonunu 150 mL LB ortamına kültürleyin.
- Üreticinin yönergelerini izleyerek plazmid maxiprep'i gerçekleştirin.
- Plazmidi ultra saf suda askıya alın.
4. Enjeksiyon yapısının karıştırılması
NOT: Her yapı için önerilen nihai konsantrasyon aralıkları Tablo 1'de verilmiştir. 2:1:2 oranıyla başlayın (ng Cas9: ng sgRNA: ng donör plazmidi) ve HDR verimliliğini optimize etmek için gerektiği gibi ayarlayın. Sonuçların izlenmesi, en etkili kombinasyonun belirlenmesine yardımcı olacaktır.
- Nakavt mutantları yapmak için,
- Cas9 seyreltme tamponunu kullanarak Cas9 proteininin alikotunu istenen konsantrasyona seyreltin ve gRNA'nın alikotunu ultra saf su ile seyreltin.
- Bir Ribonükleoprotein (RNP) kompleksi oluşturmak için Cas9 proteinini her gRNA ile önceden karıştırın. Önceden karıştırılmış çözeltileri birleştirin.
- HDR aracılı gen kaseti yerleştirmeleri için,
- Cas9 proteinini ve gRNA'ları nakavt mutantları yapmak için önerildiği gibi seyreltin ve karıştırın.
- Donör plazmidini ultra saf suyla seyreltin.
- Tüm yapıları birleştirin.
5. Mikroenjeksiyon iğnelerinin çekilmesi ve yüklenmesi
- Enjeksiyon iğnelerini çekmek için kuvars filament kullanın (Şekil 2). Filamentin 10 cm uzunluğunda, dış çapı 1 mm ve iç çapı 0,7 mm olduğundan emin olun.
- Aşağıdaki iki programdan biriyle bir lazer mikropipet çektirmesi kullanarak iğneleri çekin:
Program 1: Isı 805, Filament 4, Hız 50, Gecikme 145, Çekme 145
Program 2: Isı 650, Filament 4, Hız 40, Gecikme 150, Çekme 156
NOT: Program 1, daha ince ancak daha uzun bir iğne ucu ile sonuçlanır, bu da onu daha ince bir ucun hassasiyet için faydalı olduğu daha düşük konsantrasyonlu yapılara sahip enjeksiyonlar için uygun hale getirir. Program 2, yapı daha kalın olduğundan ve daha sağlam bir iğne gerektirdiğinden, daha yüksek konsantrasyonlu enjeksiyonlar için ideal olan daha kısa ama daha kalın bir iğne ucu verir.
6. Embriyo toplama
- Sivrisinekleri toplamak için elektrikli veya manuel bir aspiratör hazırlayın ve toplama ve embriyo toplama için plastik şişeler kullanın.
- Beyaz daire filtre kağıtlarını nemlendirin ve iç duvara veya kollektördeki nemli pamuğun üzerine yerleştirin.
- 5-10 gün önce kanla beslenmiş 5-10 dişi sivrisineği kolektöre yerleştirin. Kollektörü 45 dakika karanlıkta bırakın.
- Embriyo toplama için filtre kağıtlarını çıkarın.
7. Embriyo sıralaması
- Embriyo enjeksiyonu için A. aegypti'nin vahşi tip bir suşu (Liverpool) kullanın.
- Hasat kağıdından preblastoderm evresi embriyolarını, özellikle açık gri renkli olanları seçin (Şekil 3).
- Islak bir fırça ile birkaç embriyoyu bir lamel üzerine yerleştirilen çift taraflı yapışkan banda aktarın. Embriyoları, çevreleri hala ıslakken, tüm arka uçları öne bakacak şekilde yan yana olduklarından emin olarak paralel olarak hizalayın.
- Doğru yerleştirildikten sonra, embriyoları yerinde sabitlemek için ortamın hafifçe kurumasını bekleyin.
- Kurumayı önlemek için hizalama sırasında embriyoların üzerine Halokarbon yağı 700 ekleyin.
NOT: Yağı eklerken embriyoların suyla çevrili olmadığından emin olun, çünkü bu embriyoların yağda yüzmesine neden olur.
8. Embriyo mikroenjeksiyonu
NOT: Enjeksiyon oda sıcaklığında veya 18 °C'de yapılır. 18 ° C sıcaklık, embriyo gelişimini geciktirdiği için pratik nedenlerle önerilir.
- Aşağıdaki parametrelere sahip bir mikro enjektör kurun: dengeleme basıncı (Pc) 300 hPa, enjeksiyon basıncı (Pi) 500 hPa. Gerektiğinde bu koşulları ayarlayın.
- Karışık yapıdan 3 μL'yi bir mikro yükleyici kullanarak bir iğneye yükleyin.
- Hizalanmış embriyoların bulunduğu kapak camını bir mikroskop lamının üzerine yerleştirin (Şekil 3). Kapak camını yerleştirin ve enjeksiyon için mikroskobun altına kaydırın. Embriyonun arka ucunun iğneye doğru konumlandırıldığından emin olun.
- Bir iğneyi bir mikromanipülatör ile birlikte bir iğne tutucusuna yerleştirin ve iğneyi hizalanmış embriyoların arka ucuna doğru 10°'lik bir açıyla sabit tutarak konumlandırın (Şekil 4A). İğneyi mikroskop altında nazikçe açın ve bir lamel kenarıyla hafifçe dokunun.
NOT: Diğer bir seçenek ise iğneye embriyo ile vurarak iğnede küçük bir açıklık oluşturmaktır. Bununla birlikte, Cas9 proteininin yapışkanlığı iğneyi tıkayabileceğinden, biraz daha geniş bir iğne açıklığı önerilir. - Sürgülü camı enjeksiyon için iğneye doğru hareket ettirin (Şekil 5).
9. Enjekte edilen embriyo sonrası bakım
- Embriyoları çevreleyen yağı çıkarmak için tüy bırakmayan, tek kullanımlık mendiller kullanın.
- Embriyoları durulamak için deiyonize su ekleyin ve embriyoları ıslak bir filtre kağıdına taşıyın. Islak filtre kağıdını Karat 9 oz bardakların içindeki ıslak bir mendil üzerine yerleştirin (Şekil 4B ve Şekil 6A,B).
- Nemi korumak için bardağın dibine ıslak pamuk yerleştirin (Şekil 6B).
- Enjekte edilen embriyoları ıslak filtre kağıdı üzerinde muhafaza edin.
10. Embriyo kuluçka ve G0 larva taraması
- Enjeksiyondan en az 4 gün sonra, embriyolu filtre kağıdını kuluçka için Sterilite 6 litrelik tavalarda yaklaşık 3 L deiyonize suya aktarın.
NOT: Yumurtalar tipik olarak enjeksiyondan sonraki 2 hafta içinde daha verimli bir şekilde çatlar. Bu süre zarfında yumurtaların nemli kaldığından emin olun. Filtre kağıdı çok ıslak olmamalıdır, çünkü aşırı nem embriyoların erken yumurtadan çıkmasına neden olabilir. Daha uzun süre koruma, kuluçka oranlarını iyileştirebilirken, en iyi sonuçlar için bir ayı aşmayın. Oksijensiz su kullanmak da yumurtadan çıkmaya yardımcı olabilir. - G0 larvaları yumurtadan çıktıktan sonra, su ile karıştırılmış balık yemini tavaya yiyecek olarak ekleyin.
- G0 larvalarını 3. ila 4. instar larva aşamasında floresan işaretleyici için tarayın (Şekil 7).
- Larvaları floresan durumlarına göre ayrı ayrı muhafaza edin, floresan pozitif ve floresan negatif larvalar ayrı tavalarda tutulur.
11. Cinsiyet sıralama pupa ve vahşi türe geçiş
- Enjekte edilen sivrisinekleri, tanımlama için genital lobdaki boyut ve cinsiyete özgü yapıları kullanarak, pupa olduklarında cinsiyete göre ayırın:
- Erkekler: Daha küçük boyut, daha belirgin ve sivri bir genital lob ve daha geniş kürekler (pupaların kuyruk ucundaki yapılar; Şekil 8A 1,A2).
- Dişiler: Daha büyük boyut, daha küçük ve daha az belirgin bir genital lob ve daha dar kürekler (Şekil 8B 1,B2).
- Her cinsiyetten floresan pozitif veya floresan negatif sivrisinekleri havuzlayın.
- Havuzlanmış sivrisinekleri, Liverpool suşundan karşı cinsten sivrisineklerle geçin. Yabani türün G0 sivrisineğe 3: 1 ila 5: 1 oranını kullanın.
- Sivrisinekleri 4 gün boyunca geçin.
- Geçtikten sonra dişilere kan unu verin.
12. G1 taraması
- Kan beslemesinden üç gün sonra, Karat 9 oz bardakların duvarına bir kağıt havlu koyarak ve yaklaşık 3 oz deiyonize su ekleyerek yumurta kapları sağlayın.
- 3-4 gün sonra G1 embriyolarını toplayın ve yumurtadan çıkarın. G1 larvalarını 3. ila 4. instar aşamalarında floresan işaretleyici için tarayın (Şekil 7).
- Floresan larvaları toplayın, bu da bir HDR yerleştirilmesini önerir. Floresan G1 bireyleri pupa aşamasına ulaştığında, onları cinsiyetlerine göre ayırın ve her cinsiyeti ayrı kafeslere koyun.
- Floresan G1 sivrisineklerini Liverpool suşunun karşı cinsinden bireylere geçin.
13. G1 yerleştirme yeri onaylıyor
- Kan unu sağladıktan sonra, tek tek Drosophila şişelerine küçük bir parça kağıt havlu koyarak ve 3 mL deiyonize su ekleyerek G1 dişilerini tek dişi yumurta yumurtlaması için ayarlayın.
- Nakavt mutantlar için:
- Yumurtlamadan sonra su buharlaşır ve kağıt havlu kurur, yumurtaları açıkça nakavt mutasyonları sergileyen dişilerden çıkarın ve G2 neslini elde edin.
- G1 annelerinin vücudunu toplayın, G2 yavrularını başarıyla yumurtadan çıkarın ve DNA'yı çıkarın.
- Hedef bölgeyi kapsayan diziyi amplifiye etmek için DNA'yı PCR için bir şablon olarak kullanın. Primerlerin ~ 200 bp'lik bir DNA parçasını çoğalttığından emin olun. Reaksiyonları ayarlayın (her biri 12.5 μL 2x ana karışım, 1.25 μL 10 μM ileri primer çözeltisi, 1.25 μL 10 μM ters astar çözeltisi, 9 μL ultra saf su ve 1 μL şablon DNA [5 ng/μL]). Aşağıdaki PCR koşullarını kullanın: 98 °C'de 30 saniye boyunca ilk denatürasyon; 98 °C'de 10 sn, X °C'de (primerlerin ideal tavlama sıcaklığı) 15-30 sn ve 72 °C'de 10 sn için 35 döngü amplifikasyon; 72 °C'de 2 dakika son uzatma; ve son olarak 4 °C'de uzun süreli depolama.
- 1 μL 10x restriksiyon sindirim tamponu, 0.5 μL restriksiyon enzimi 1, 0.5 μL restriksiyon enzimi 2, 1 μL PCR fragmanı (200 ng/mL) ve 7 μL ultra saf su karışımını 37 °C'de 30 dakika inkübe ederek PCR fragmanlarını saflaştırın ve restriksiyon enzimi sindirimini gerçekleştirin.
NOT: Bazı kısıtlama enzimleri, önceden saflaştırılmadan PCR karışımında kullanılabilir. - Bölünmenin meydana gelip gelmediğini doğrulamak için jel elektroforezi ile PCR fragmanı sindirimini görselleştirin.
- Nakavt mutasyonlarını tanımlamak için sindirilmemiş PCR fragmanını sıralayın.
- HDR aracılı yerleştirmeler için, yumurtlamadan sonra:
- G1 annelerinin vücudunu toplayın ve DNA'yı çıkarın.
- Hedef bölgeyi kapsayan diziyi çoğaltmak için DNA'yı PCR için bir şablon olarak kullanın.
- Yerleştirilen DNA kasetinin bütünlüğünü doğrulamak için amplifiye edilmiş DNA parçasının dizilimini gerçekleştirin.
- Yumurtayı çatlatın ve G2 neslini elde edin.
14. Yeni CRISPR hatlarının genişletilmesi
- Nakavt mutant çizgiler için:
- G2 dişilerini, G1 başına 20 dişi olacak şekilde yumurtlama için ayarlayın. Her G1 bir satırı temsil eder.
- Yumurtlamadan sonra, nakavt mutasyonlarını G1 ile aynı şekilde onaylayın.
- Hem G1 hem de G2'de açıkça tanımlanmış mutasyonlar sergileyen beş G1 çizgisi ile devam edin. Her hattın G2'sinden toplanan yumurtaları çatlatın ve G3 nesline yol açın.
- Kesişen beş çizgiden, açıkça tanımlanmış mutasyonlara ve yüksek uygunluğa veya istenen fenotipe sahip iki çizgi seçin.
- Seçilen her çizgiden G3 dişilerini Liverpool suşundan erkeklerle çaprazlayın.
- Her hattan yumurtlamak için 50 bekar dişi ayarlayın. Daha önce G1 için yapıldığı gibi nakavt mutasyonlarını onaylayın.
NOT: Çeşitliliği korumak için kurulumdaki kadın sayısını artırın. - İki çizgi ile iki ek nesil için prosedürleri tekrarlayın (Şekil 4J).
- Yeni HDR aracılı ekleme hatları için:
- G2 neslinde floresan bireylerin varlığını doğrulayın.
- Liverpool suşu ile her G1 bireyinden G2 sivrisineklerini çaprazlayın. Her G1 bireyi bir satırı temsil eder.
- Üç nesil daha geçiş ile devam edin. Floresan işaretleyiciyi sürekli olarak kontrol edin ve her satırın uygunluğunu19 gözlemleyin (Şekil 4x).
- Doğru eklemelere ve yüksek uygunluğa ve istenen fenotipe sahip bir satır seçin.
15. Homozigot çizgiler yapın
- Nakavt mutant çizgiler için:
- G6 Kuşağı:
- G5 tarafından üretilen yumurtaları çatlatın ve G6 neslini elde edin.
- G6 yetişkinlerini kendi çizgileri içinde çaprazlayın (Şekil 4K ve Şekil 9A).
- Hat başına yumurtlama için 50 tek G6 dişi ayarlayın ve yumurtaları daha önce açıklandığı gibi yumurtadan çıkarın (Şekil 9B).
- G7 yavrularını başarıyla yumurtadan çıkaran G6 dişilerini toplayın, DNA'yı çıkarın ve G1 için yapıldığı gibi PCR ve kısıtlama enzimi sindirimi gerçekleştirin (Şekil 9C).
NOT: Bu adımda DNA ekstraksiyonu için basit ve ucuz bir ezme tamponu (SB) kullanılabilir.- El tipi bir öğütücü kullanarak, tek bir sivrisineği 100 μL 1x SB'de (10 mM Tris-HCl pH 8, 1 mM EDTA ve 25 mM NaCl) yumuşatın. Proteinaz K (200 μg/mL) ekleyin ve 37 °C'de 30 dakika, ardından 95 °C'de 2 dakika inkübe edin. 5 dakika boyunca 10.000 × g'da döndürün ve süpernatan20'yi toplayın.
- Sonuçları bir jel üzerinde görselleştirerek mutasyonu onaylayın.
- Dişiler tarafından üretilen yumurtaları mutasyon olmadan atın (Şekil 9D).
- Birkaç G7 soyu oluşturmak için doğrulanmış mutasyonlara sahip dişilerden larvaları koruyun ve mutasyon olmadan yavruları atın (Şekil 9D).
- G7 Kuşağı:
- Her G7 soyu içindeki dişiler ve erkekler arası çaprazlama (Şekil 9E).
- Her hat için yumurtlama için 10 tek G7 dişi ayarlayın ve yumurtaları daha önce açıklandığı gibi yumurtadan çıkarın (Şekil 9F).
- G7 yavrularını başarıyla yumurtadan çıkaran G7 dişilerini toplayın, DNA'yı çıkarın ve PCR ve kısıtlama enzimi sindirimi gerçekleştirin (Şekil 9G).
- Sonuçları bir jel üzerinde görselleştirerek her iki aleldeki veya tek bir aleldeki nakavt mutasyonlarını tespit edin.
- Her iki alelde de nakavt olduğu doğrulanan G7 dişilerinden larvaları koruyun ve G8 neslini üretin (Şekil 9H). Mutasyon olmadan yavruları atın (Şekil 9H).
NOT: Bu adım, dişilerin homozigot olmasını sağlar. G8'de, döllerin homozigotluğunun test edilmesi, babaların da homozigot olup olmadığını doğrular.
- G8 Kuşağı:
- Her G7 kadın soyu için G8 yetişkinlerini çaprazlayın (Şekil 9I).
- Rastgele beş G8 erkeği seçin, DNA'yı çıkarın ve PCR ve kısıtlama enzimi sindirimi gerçekleştirin (Şekil 9J).
- Bir kan unu sağlayın ve her iki alelde de nakavt olduğu doğrulanan G8 erkekleriyle çaprazlanan G8 dişilerinden yumurtaları çıkarın.
- Tespit edilen tüm erkeklerin her iki alelinde de nakavtlara sahip olduğu G7 soylarıyla devam edin, bu da bu soyların homozigot olduğunu gösterir.
- G6 Kuşağı:
- HDR aracılı ekleme hatları için:
- G5 tarafından üretilen yumurtaları çatlatın ve G6 neslini elde edin. Floresan işaretleyiciler için G6 aşamasında ekran larvaları.
- Larvaları floresan işaretleyiciler olmadan atın (Şekil 4xi).
- Floresan belirteçler sergileyen çapraz sivrisinekler.
- Floresan olmayan larva gözlenene kadar sonraki her nesil için bu işleme devam edin. Bu noktada, sivrisinek hattı homozigot olacaktır.
Sonuçlar
HDR homoloji rekombinasyonu için gRNA aracılı gen hedeflemesinin tasarımı ve doğrulanması
İstenen genin doğru bir şekilde hedeflendiğinden emin olmak için, birkaç gRNA seçmenizi ve HDR aracılı homolog rekombinasyon için 5' ve 3' homoloji kollarını kesme bölgesine yakın konumlandırmanızı öneririz (Şekil 1A). Örneğin, ilgilenilen genin başlangıç kodonunun her iki tarafını hedeflemek için iki gRNA tasarladık ve QF2-Hsp70-OpIE2-ECFP-SV40 kasetini bir işaretleyici olarak kullandık ve HDR mekanizması aracılığıyla 1 kb homoloji kolları aracılığıyla hedeflenen gene yerleştirdik (Şekil 1B). Çift iplikli kopmalar, gRNA'ların kesme bölgeleri arasında kısa bir DNA parçasının silinmesine yol açar (Şekil 1A).
gRNA'ların bölünme etkinliği ve hedef geni kesme yetenekleri, in vitro Cas9 bölünme testi ile test edildi. Hedef genden gelen PCR fragmanları, gRNA'larla yüklü Cas9 tarafından iki fragmana bölündü (Şekil 1C). Ek olarak, protokolün aşağı akış adımlarına geçmeden önce donör plazmidinin bütünlüğünü doğrulamak için kısıtlama enzimleri kullanılabilir. Plazmit sindirim sonuçları, jel üzerinde bir veya iki bant göstermelidir ve küçük bir bandın varlığı, kısa bir parçaya başarılı bir şekilde sindirimi gösterir (Şekil 1D, E).
Mikroenjeksiyon iğnelerinin hazırlanması
Enjeksiyon işlemine başlamadan önce taze mikroenjeksiyon iğnelerinin hazırlanması önemlidir. İğneler, hafif bir eğri ile çıkıntılı bir şekle sahip olmalıdır. İğnenin yaklaşık 2/3'ü üst kısımda dar, kalan 1/3'ü ise daha geniş olmalıdır. İğne ucunun ön ucunun uzunluğu dar kısımdan geniş kısma doğru 0,5 cm'yi geçmemelidir (Şekil 2A). İğneyi açmak için lamel kenarını kullandıktan sonra, siyah sivrisinek embriyosunun yüzeyine hafifçe dokunarak iğneyi kırdıktan sonra kullanımı daha kolay olduğundan, mikroenjeksiyon için eğimli uçlu bir iğne tercih edilir (Şekil 2B). Öte yandan, künt uçlu bir iğne, mikroenjeksiyon sırasında açık gri embriyoların delinmesini zorlaştırabilir (Şekil 2C). İğnenin kırılmasını önlemek için iğneler sivrisinek embriyolarına etkili bir şekilde nüfuz etmek için ne çok yumuşak ne de çok sert olmalıdır.
Embriyoların enjeksiyonu
Başarılı bir enjeksiyon sağlamak için, açık gri sivrisinek embriyolarını hasat ederek ve bunları arka kutup aynı yöne bakacak şekilde hizalayarak başlayın (Şekil 3A). Bu yönlü hizalama, plazmitin germ hattı hücrelerine (arka kutup) yakın enjekte edilmesine yardımcı olur, bu da gelecek nesil tarafından miras alınabilecek mutantların üretilmesi için çok önemlidir. 5-10 gün önce kanla beslenen dişilerden taze, homojen, açık gri embriyolar seçin (Şekil 3A1). Eşit olmayan gri veya kahverengi olan embriyoları kullanmaktan kaçının (Şekil 3A2), çünkü bunlar düzgün gelişmeyebilir.
Doğru ve verimli enjeksiyonu kolaylaştırmak için sivrisinek embriyolarını çift taraflı bant üzerinde tek tek hizalayın. Yumurtalar kurumadan ve orta veya koyu gri bir renge koyulaşmadan önce halokarbon yağı uygulayın (Şekil 3B).
Enjekte ederken, her embriyonun arka kutbunun yüzeyine odaklanın. Embriyonun ön tarafı ( Şekil 5'te sağ taraf) ise düz ve sert bir yüzey (mikropil) taşır. Embriyoyu delmek için enjeksiyon karışımını içeren eğimli bir iğne kullanın (Şekil 5). Embriyonun yüzeyi bastırır ve geri teper, bu da iğnenin embriyoya nüfuz ettiğini gösterir. Başarılı bir enjeksiyondan sonra, embriyonun rengi birkaç saniye içinde açılır ( Şekil 5'teki sarı eğri, sağ üst).
Enjeksiyondan sonra, fazla yağı çıkarmak için bir laboratuvar mendili kullanarak embriyoları almak ve başka bir ıslak filtre kağıdına aktarmak için fırçayı dikkatlice kullanın (Şekil 6A). Embriyoları yetiştirme sıcaklığında birkaç gün ıslak bir kağıt havlu üzerinde tutun (Şekil 6B). Fazla yağ, sivrisinek embriyolarının kuluçka oranını azaltabilir. Hidrasyonu korumak için ultra saf su içeren pamuk topları kullanın. Enjeksiyondan 2 saat sonra gri veya kahverengi (sarı ok) kalan embriyoların çatlaması olası değildir (Şekil 6C).
Tarama ve geçiş
Embriyolar olgunlaştıktan sonra, yumurta kabına ultra saf su ekleyin ve kuluçka için 27 ° C'lik bir kuluçka makinesine koyun. Larvaların 3. instar aşamasına gelişmesi tipik olarak 5-7 gün sürer. Başlangıçta, floresan sergileyen G0 larvalarını ön elemeden geçirdik, ancak diğer mutant hatlara kıyasla daha zayıf veya kısmi idi. Bu, markörün doğru bir şekilde ifade edilmesini ve plazmitlerin embriyolara başarılı bir şekilde enjekte edilmesini sağladı.
Bu larvalar daha sonra vahşi tip (WT) sivrisineklerle çaprazlandı. Sonraki taramalar sırasında, yetiştirme, hat stoğunu genişletme ve daha fazla deney yapma için daha güçlü ve tam floresan ifadesi sergileyen G1 larvalarını seçtik ve tuttuk. G1 floresan larvaları, raportör promotör ve floresan proteinin kombinasyonu ile sağlanan floresan protein ekspresyonu modeline dayalı olarak tanımlanabilir: promotör Hr5Ie1-eGFP (Şekil 7A), tüm vücut boyunca yeşil floresan proteinin ekspresyonunu yönlendirir; Hr5Ie1-DsRed (Şekil 7B) vücutta kırmızı floresan ekspresyonuna yol açar; OpIE2-CFP (Şekil 7C), vücudun sadece belirli bir bölümünde camgöbeği (mavi) floresan proteininin ekspresyonunu indükler. 3xP3-TdTomato kombinasyonu kullanıldığında, kırmızı floresan proteini gözlerde spesifik olarak eksprese edilir (Şekil 7D). Bu spesifik transgenik sivrisinek hattı ayrıca tüm vücutta CFP ekspresyonunu yönlendiren OpIE2 promotörü içerir (Şekil 7D).
Nakavt mutantlar için özel homozigot kuruluş süreci
Hat bakımını basitleştirmek ve tüm sivrisineklerin mutant olduğundan emin olmak için, floresan olmayan homozigot mutant sivrisinekler üretmek için bir boru hattı uyguladık. Protokol adımı 15'te açıklandığı gibi, WT sivrisinekleriyle çaprazlama yaptıktan sonra, G6 mutant sivrisineklerini çaprazlama için aynı kafese yerleştirdik (Şekil 9A). Çaprazlamayı takiben, dişiler yumurtlama için ayrı şişelere toplandı (Şekil 9B). Bu adım, dişilerin farklı genotiplere sahip olmasına izin verdi.
G7'yi elde etmek için yumurtalar toplandıktan sonra, G6 dişilerinden genomik DNA ekstrakte edildi, ardından bir kısıtlama enzimi ile muamele edilmiş veya muamele edilmemiş PCR fragmanlarının PCR ve jel elektroforezi yapıldı (Şekil 9C). Sadece sindirilmiş PCR fragmanlarını gösteren, mutasyon olmadığını gösteren çizgiler atıldı. Mutasyonların ve dolayısıyla heterozigot dişilerin varlığını gösteren çift PCR bantlarını gösteren bu çizgiler tutulurken ve yumurtadan çıkılmıştır (Şekil 9D). Daha sonra G7 sivrisineklerinin olgunlaşmasına izin verildi ve homozigot bir çizgi oluşturma olasılığını artırmak için tüm yetişkinler başka bir çapraz geçiş turu için aynı kafese yerleştirildi (Şekil 9E). Kanla beslenen G7 dişileri, üç potansiyel genotipi temsil eden G8 yumurta toplama için tekrar ayrı ayrı toplandı (Şekil 9F). G7 dişilerinden genomik DNA ekstrakte edildi ve hangilerinin homozigot olduğunu belirlemek için PCR ve ardından jel elektroforezi yapıldı (Şekil 9G). Mutant olmayan veya heterozigot dişilerden alınan yumurtalar atıldı ve sadece homozigot sonuçları olanlar tutuldu (Şekil 9H). H basamağından G8 yumurtaları çatlatıldı ve elde edilen yetişkinler ayrı bir kafeste çaprazlandı (Şekil 9I). Her kafesten 10 yetişkin erkek, jel elektroforezi ve dizileme için rastgele seçildi (Şekil 9J). Bu adım, daha sonra stok olarak tutulan homozigot bireyler vermelidir (Şekil 9K).
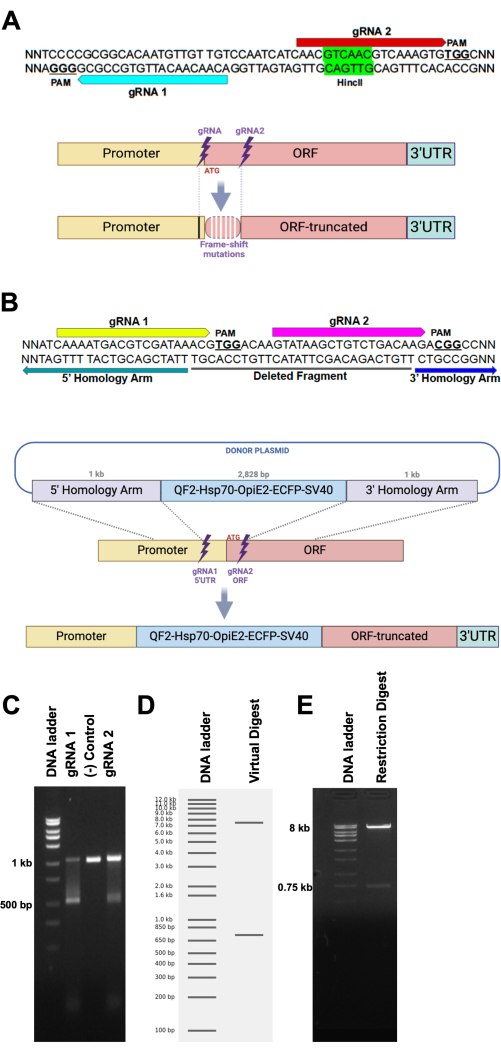
Şekil 1: gRNA şeması ve HDR donör plazmid tasarımı. (A, üst) İki gRNA için varsayımsal DNA dizisi hedef dizisi (mavi ve kırmızı oklar ve bunlarla ilişkili PAM bölgeleri ile birlikte bir kısıtlama enzimi hedef bölgesi (HincII). (A, altta) NHEJ'ye tabi tutulan bir hedef bölgenin şematik gösterimi, küçük bir dizi silinmesi veya eklenmesi nedeniyle çerçeve kaydırma mutasyonlarının (beyaz dikey çubuklar) ortaya çıkmasına yol açar. Mutasyonlar, gRNA'ların (siyah dikey çubuk) bölünme bölgesinin ötesine uzanabilir. (B, üst) gRNA 1 (sarı ok) ve gRNA 2 (macenta ok) için hedef bölgeleri ve ardından PAM bölgelerini (NGG, kalın ve altı çizili) gösteren varsayımsal DNA dizisi. Her iki gRNA arasındaki potansiyel olarak silinmiş DNA dizisinin altı siyah bir çubukla (silinmiş parça) çizilir. Yeşil ve mavi oklar, sırasıyla 5' homoloji kolunun en fazla 3' dizisini ve 3' homoloji kolunun en çok 5' dizisini vurgular. (B, alt) Bir DNA kasetinin bir plazmitten genomdaki homolog bir bölgeye HDR rekombinasyonunun şematik gösterimi. (C) İn vitro bölünme testi. 1 kb'lik bir DNA fragmanının inkübasyonu, gRNA 1 (sol şerit) veya gRNA 2 (sağ şerit) ile yüklü Cas9 tarafından sindirilir ve 500 bp'lik bir fragman elde edilir. Orta şerit, herhangi bir gRNA'dan yoksun olan negatif kontrol reaksiyonunu gösterir. (D) Bir plazmidin (8.75 kb) iki tek kesimli kısıtlama enzimi ile sanal sindirimi, varsayımsal bir jel üzerinde neredeyse iki bant (8 kb ve 750 bp) ile sonuçlanır. (E) Sanal sindirim tarafından sağlanan beklenen sonuçları gösteren, bir plazmidin kısıtlama sindirim reaksiyonu ile yüklenmiş bir agaroz jeli. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Mikroenjeksiyon iğne şekli. (A) Bir iğne ucunun temsili görüntüsü. (B) Sivrisinek yumurtalarının mikroenjeksiyonu için ideal iğne ucu şekli. (C) Kaçınılması gereken iğne ucu şekli. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Embriyoların toplanması. (A) Enjeksiyonlar için açık gri ve (A1) homojen ancak (A2) düzensiz olmayan embriyoların toplanması; Ölçek çubuğu=500 μm. (B) Hizalanmış embriyolar için görüntü; Ölçek çubuğu=500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
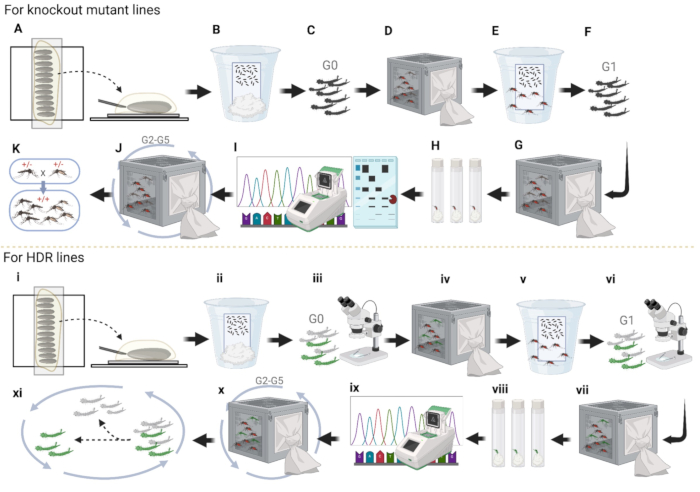
Şekil 4: Sivrisinek embriyo mikroenjeksiyonunun boru hattı. (A-K) Nakavt Hattı enjeksiyonları. (A) Sivrisinek embriyolarını hizalayın ve plazmidi arka uca enjekte edin. (B) Islak kağıt ile fincana enjekte edilen embriyo depolaması; (C) G0 larvalarının yumurtadan çıkması ve her iki cinsiyete ayrılması. (D) Yetişkinlerin her iki cinsiyeti de ayrı kafeslerde WT'ye geçer; (E) dişilerin yumurtalarını yumurta kabında toplamak. (F) G1 larvalarının yumurtadan çıkması ve her iki cinsiyete ayrılması. (G) Yetişkinlerin her iki cinsiyeti de ayrı kafeslerde WT'ye geçer. (H) G1 dişi yumurtaları tek tek plastik şişelerde toplayın ve yumurtaları çatlatın. (I) PCR, jeli enzimle muamele edilmiş parçalarla çalıştırın ve başarılı bir şekilde yumurtadan çıkmış G1 bekar dişiler için dizilim. (J) G2'yi üç nesil daha WT ile çaprazlayın ve sivrisinekleri G1 için yapıldığı gibi sıralayın. (K) Çaprazlama yaparak homozigot oluşturun. (I-XI) HDR çizgi enjeksiyonları. (i) Embriyoların hizalanması. (ii) Islak kağıt ile fincana enjekte edilen embriyo saklanması. (iii) Floresan için G0 larvalarının ön taraması. (iv) Floresan larvaları yetişkinlere dönüştürün ve bir kafeste WT ile çaprazlayın. (v) G1 yumurtalarının yumurta kabında toplanması. (vi) Floresan G1 larvalarının taranması ve seçimi. (vii) G1 floresan yetişkinler WT ile çaprazlandı. (viii) Kanla beslenen floresan G1 yetişkin dişiler, yumurtaları tek tek plastik şişelere bırakır. (ix) Floresan G1 yetişkinlerinin ayrı ayrı toplanması ve sıralanması. (x) Üç ek nesil daha yabani tip ile çaprazlama ve (xi) homozigotlar oluşturmak için larvaları floresan olmadan atın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Embriyoların enjekte edilmesi. Sivrisinek embriyolarına plazmit enjeksiyonu anı. Ek: embriyo içinde bulanık bir sıvı olarak görselleştirilen enjeksiyon karışımı (sarı noktalı çizgi); Ölçek çubuğu=200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 6: Embriyo toplama. (A) Enjeksiyondan sonra embriyoların toplanması ve ıslak bir filtre kağıdına aktarılması. Ölçek çubuğu = 7.5 mm. (B) Enjekte edilen embriyoların bir kapta tutulması. Ölçek çubuğu = 25 mm. (C) Enjeksiyondan sonra koyu renkli embriyolar; Ölçek çubuğu=500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
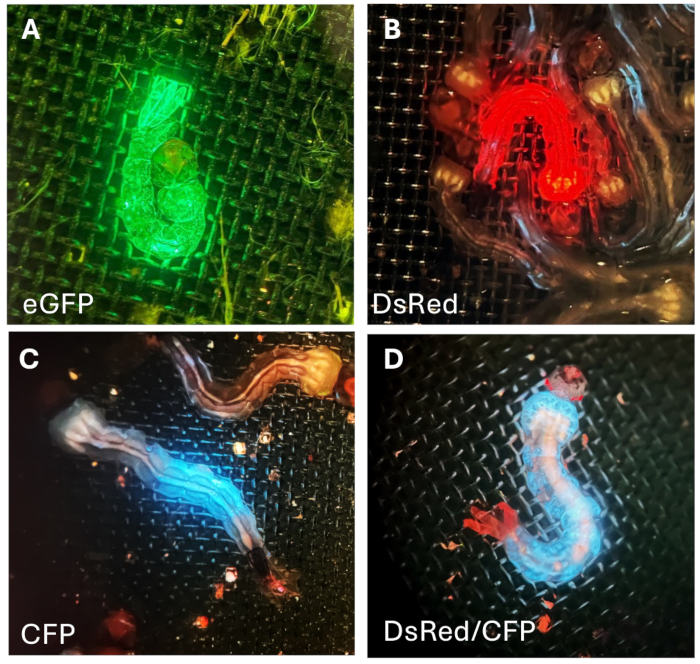
Şekil 7: G1 larvalarında floresan. (A) Sivrisinek larvalarının vücudunda yeşil, (B) kırmızı ve (C) mavifloresan proteinleri. (D) Göze özgü kırmızı floresan ve vücuda özgü mavi floresan sergileyen larva. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 8: Pupa morfolojisinde cinsel dimorfizm. (A1,A2) Erkek pupalar, daha küçük bir vücut boyutu, belirgin ve sivri bir genital lob ve kuyruk ucunda daha geniş kürekler ile karakterize edilir. (B1,B2) Dişi pupalar daha büyük bir vücut boyutu, daha küçük, daha az belirgin bir genital lob ve daha dar kuyruk ucu kürekleri gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
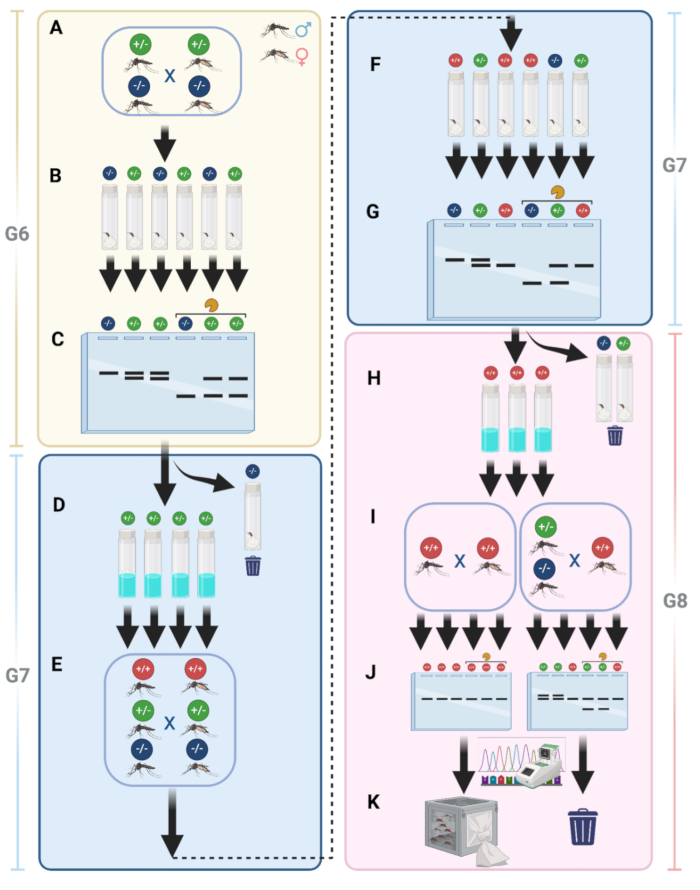
Şekil 9: Nakavt mutant hatlar için homozigot kuruluşun detayları. (A) Mutant sivrisinekler, WT ile çaprazlandıktan sonra aynı kafeste çaprazlanır. (B) Çaprazlamadan sonra, tek tek dişiler yumurtlama için şişelerde toplanır. (C) Genomik DNA, G6 dişilerinden ekstrakte edilir, ardından enzimle muamele edilmiş ve muamele edilmemiş fragmanlarla PCR ve jel elektroforezi yapılır. (D) PCR sonuçları pozitif olan (heterozigot) G7 yumurtaları çatlar. (E) Homozigot bireyler elde etme şansını artırmak için G7 yetişkinleri tekrar çaprazlanır. (F) Kanla beslenen G7 dişileri, üç genotipi temsil eden G8 yumurtasının toplanması için ayrı ayrı toplanır. (G) Homozigot bireyleri tanımlamak için G7 dişilerinde genomik DNA ekstraksiyonu, PCR ve jel elektroforezi gerçekleştirilir. (H) Mutant olmayan veya heterozigot dişilerden elde edilen yumurtalar atılır; homozigot yumurtalar tutulur. (I) G8 yumurtaları yumurtadan çıkar ve ayrı bir kafeste çaprazlanır. (J) Jel elektroforezi ve dizilimi için her kafesten rastgele on yetişkin erkek seçilir. (K) Homozigot sivrisinekler stok olarak tanımlanır ve muhafaza edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Enjeksiyon yapısı | Son konsantrasyon |
| Cas9 proteini | 100-300 ng/μL |
| gRNA (İngilizce) | 50-100 ng/μL |
| donör plazmidi | 100-500 ng/μL |
Tablo 1: Her bir enjeksiyon yapısı için önerilen nihai konsantrasyon aralıkları.
Tartışmalar
CRISPR-Cas teknolojisi, kromozom1'de hedefe özgü değişiklikleri teşvik ederek genom düzenleme manzarasını değiştirdi. Transpoze edilebilir elementler, ilk transgenik sivrisineklerin oluşumu için gerekli olsa da, yerleştirme yerleri biraz rastgeledir ve kargo yapısının ifadesi (promotör + gen), genellikle ektopik ekspresyona yol açan bir genom konumsal etkisi (yani, yerleştirme bölgesi) nedeniyle gerçek genin ekspresyon profiline karşılık gelmeyebilir21. CRISPR-Cas9 moleküler makasının ortaya çıkmasından önce, belirli hedef bölgelerde DNA çift iplikçik kırılmalarını teşvik eden teknolojiler geliştirildi ve TALEN22 ve Çinko Parmak23 gibi FokI kısıtlama enzimine etiketlenmiş spesifik protein alanlarının DNA bağlama özelliklerine dayanıyordu. İkinci teknoloji, sivrisinek genetik mühendisliği24,25 için başarılı bir şekilde kullanılmış olsa da, bu tür alanların mühendisliğinin yüksek maliyeti ve hedef dışı bölünme potansiyeli, bu tür teknolojilerin durdurulmasına yol açmıştır. O zamandan beri, CRISPR-Cas9 teknolojisi11 numaralı moleküler makas tercihi haline geldi.
Sivrisineklerin genetik mühendisliği, çoğunlukla, dönüşüm karışımının embriyolara enjekte edilmesiyle gerçekleştirilmiştir26,27. Sivrisinek embriyonik mikroenjeksiyonunun hazırlanması odaklanma, sabır ve detaylara dikkat gerektirir. Yumurtlamadan sonraki 2 saat boyunca, bu embriyolar gelişimlerini bozmamak için mümkün olduğunca dikkatli bir şekilde sıralanmalı, enjekte edilmeli ve yıkanmalıdır. Odaklanma, diziliş sırasında yumurtaların zarar görme veya embriyoların kuruma olasılığını azaltmak için önemli bir beceridir. Cas9 proteini karışımda olduğunda oldukça sık meydana gelen iğne tıkanması, uç kopması ve enjeksiyon karışımı sızıntısı gibi beklenmedik olaylar karşısında, sabır bu durumları yönetmek için bir diğer önemli beceridir. İğne ucu çok büyük olduğunda veya çok fazla enjeksiyon karışımı sızdığında embriyoları delmek sadece embriyoya zarar verebilir. En iyi çözüm, iğneyi değiştirmek ve enjeksiyonlara devam etmektir. Detaylara gösterilen özen daha az önemli değildir. Genç dişi sivrisinekler (6-10 günlük) yaşlılardan daha fazla yumurta bırakır ve bu sağlıklı embriyoların toplanması için yararlıdır. Mikroenjeksiyondan sonra embriyoları saklamak için deiyonize veya ultra saf su ve kahverengi (ağartılmamış) kağıt havluları seçin, çünkü kontamine su veya ağartılmış yüzeylerle herhangi bir temas embriyo ölümünü önemli ölçüde artırabilir. Açık gri (<1 saatlik) embriyolar daha yumuşaktır, bu da enjeksiyon prosedürünü kolaylaştırır ve mutant çizgiyi elde etme şansını artırır. Ek olarak, enjekte edilen embriyolar, tam iyileşme ve iyileşmeyi sağlamak için yumurtadan çıkmadan önce en az 5 gün nemlendirilmiş filtre kağıdında dinlenmelidir.
Enjeksiyon karışımının kalitesi ve saflığı embriyonun hayatta kalması için esastır. Plazmit ekstraksiyon kitlerinden veya gRNA sentez kitlerinden elde edilen tamponlar, tuzlar veya alkoller enjeksiyon karışımlarına taşınmamalıdır. Maliyetli olsa da, gRNA'ları sipariş etme seçeneği, uygun RNA katlanması olasılığını artırabilir. Ayrıca, Cas9'u kodlayan bir plazmit üzerine rekombinant Cas9 proteininin enjekte edilmesini öneririz, çünkü rekombinant versiyonun zaten yüklenmiş ve çift sarmallı kırılmalar gerçekleştirmeye hazır olduğuna inanıyoruz, çünkü DNA üzerinde hareket etmeye başlamak için kopyalanması ve çevrilmesi gereken ve daha sonra gRNA'larla yüklenmesi gereken bir plazmit kaynağına kıyasla.
Sivrisinek A. aegypti'de genom düzenleme için CRISPR-Cas9 teknolojisinin kullanımı konusunda elimizde en iyi çalışan protokolü tanımlamış olsak da, literatürde gerektiğinde ikame olarak da kullanılabilecek alternatif reaktifler tanımlanmıştır. Örneğin, tüm reaktifleri askıya alıyoruz ve enjeksiyon karışımlarını ultra saf su ile seyreltiyoruz. Alternatif olarak, enjeksiyon karışımları 5 mM KCl ve 0.1 M NaPO4'ten (pH = 6.8) yapılmış bir enjeksiyon tamponunda seyreltilebilir26,28. Embriyoları sıraya dizdikten sonra kurumaya karşı korumak için halokarbon yağı 700 kullanmanın yanı sıra, halokarbon yağı 2729 ve 27 ve 70030 karışımı da benzer koruma sağlar. Yukarıda tarif edilen enjeksiyon tamponunun 10x konsantre versiyonu alternatif olarak embriyo kurumasını önlemek için kullanılmıştır26. Yukarıda bahsedildiği gibi, Cas9'u kodlayan plazmitler ticari olarak temin edilebilir (addgene) ve sivrisineklerde CRISPR-Cas9 aracılı genom düzenlemesi için kullanılmıştır31.
Bir sivrisinek transgenik hattı elde etme stratejileri arasında, NHEJ aracılı nakavt ve HDR aracılı nakavt yaklaşımları mevcuttur. İlkinin başarı oranı ikincisinden çok daha yüksek32,33 iken, geçiş şeması ve tarama süreci, Şekil 4'te açıklandığı gibi, bir nakavt elde etmek için bir nakavt hattından çok daha fazla zaman alıcıdır. Karmaşık geçiş şemalarından geçmeden bir nakavt hattı elde etmek için alternatif bir yaklaşım olarak, bir floresan işaretleyiciyi kodlayan bir gen kasetinin HDR aracılı vuruntusu, bir genin kodlama dizisini bozma ve floresan işaretleyici14,34 kullanarak sivrisineğin transgenik hattını seçme imkanı sunar.
Bu protokol sadece sivrisineklerin genetik dönüşümü için temel adımlara odaklansa da, HDR için donör plazmitleri tasarlamak, dikkate alınması gereken önemli bir adımdır. 3xP3, OpIE2, Hr5-IE1 ve Pub 6,35,36,37,38 gibi destekleyicileri kullanmak önemlidir. 3xP3, sinir sisteminde ve böceklerin gözlerinde ifadeyi yönlendirmek için yaygın olarak kullanılan sentetik bir promotördür. OpIE2 ve Hr5-IE1, böcek hücrelerinde güçlü ekspresyonu sağlamak için kullanılan bakulovirüsten türetilen promotörlerdir. Pub organizatörü, tüm vücutta ifadeyi yönlendirir. U6 promotörü, gRNA'ların ekspresyonu için kullanılır. HDR için donör plazmitleri için dsRed (ve TdTomato), eGFP, CFP ve YFP gibi floresan belirteçler de kullanılır. Bunlar sırasıyla kırmızı, yeşil, camgöbeği ve sarı floresan yayan floresan proteinlerdir. 3' UTR'ler için, p1039 ve SV4040, transgenlerde mRNA stabilitesini ve translasyon verimliliğini artırmak için sıklıkla kullanılır.
Mikroenjeksiyon prosedürünün bir özeti olarak, nakavt mutant çizgiler için, önce sivrisinek embriyolarını enjeksiyon için çift taraflı bant üzerinde yan yana hizalayın (Şekil 4A). İkinci olarak, embriyoların hayatta kalma oranını kolaylaştırmak için halokarbon yağının çoğunu çıkarın ve embriyoları çift taraflı banttan temiz bir ıslak filtre kağıdına aktarın. Birkaç gün boyunca yüksek nemi korumak için onları ultra saf su içeren bir kapta tutun ve embriyoların tamamen gelişmesini bekleyin (Şekil 4B). Üçüncüsü, enjekte edilen embriyoları yumurtadan çıkarın, pupaları her iki cinsiyete ayırın ve farklı kafeslere koyun (Şekil 4C). Dördüncüsü, tüm floresan erkekleri 5 ila 7 günlük WT dişileri ile çaprazlamak için bir kafese yerleştirin ve bunun tersi de geçerlidir (Şekil 4D). Beşincisi, başlangıçta sivrisinek sayısını artırmak için çaprazlanmış WT dişilerinden G1 yumurtalarını toplayın (Şekil 4E). Altıncısı, G1 yumurtalarının kuluçkalanması ve pupaların her iki cinsiyete ayrılması (Şekil 4F). Yedinci, G1 yetişkinleri tekrar WT ile çaprazlanır (Şekil 4G). Sekizincisi, bireysel G2 yumurta toplama için G1 yetişkin dişileri şişelere toplayın ve birkaç gün boyunca pamuk topları veya bir kağıt havlu kullanarak şişelerin dibinde ultra saf su bulundurun (Şekil 4H). Dokuzuncusu, yumurtladıktan sonra G1 dişilerini toplayın ve PCR ve dizileme için G1 dişilerinden genomik DNA'yı çıkarın (Şekil 4I). Onuncusu, çizgi tutma için doğru G2 yumurtalarının kuluçkalanması ve bağlantısız arka plan mutasyonlarının çoğunu ortadan kaldırmak için üç nesil daha WT ile çaprazlamalar (Şekil 4J). On birincisi, PCR, kısıtlama enzimi testi, jel elektroforezi ve mutasyonları taramak için dizileme kullanarak homozigot bir sivrisinek hattı oluşturmak (Şekil 4K).
HDR çizgilerinin oluşturulması için, embriyo mikroenjeksiyonu için sivrisinek embriyolarını çift taraflı bant üzerinde yan yana hizalayın (Şekil 4i). İkinci olarak, enjeksiyonlardan sonra, halokarbon yağının çoğunu çıkarın ve embriyoları birkaç gün boyunca nemi korumak için ultra saf su içeren bir kapta saklayın ve embriyoların olgunlaşmasını bekleyin (Şekil 4ii). Üçüncüsü, enjekte edilen embriyoları yumurtadan çıkarın ve floresan olan veya olmayanları sıralamak için G0 larvalarını tarayın (Şekil 4iii); Floresan ile larvalar, plazmidin sivrisinek embriyolarına başarılı bir şekilde enjekte edildiği anlamına gelir. Dördüncüsü, floresan larvaların yetişkinlere olgunlaşmasına izin verin ve tüm floresan erkekleri WT dişileri ile çaprazlamak için bir kafese koyun ve bunun tersi de sivrisinek sayısını artırmak için geçerlidir (Şekil 4iv). Beşincisi, çaprazlanmış WT dişilerinden yumurta toplayın (Şekil 4v). Altıncısı, G1 floresan larvalarını yumurtadan çıkarın, tarayın ve sıralayın ve larvaları floresan olmadan atın (Şekil 4vi). Yedinci, WT ile çapraz G1 floresan yetişkinler (Şekil 4vii). Sekizincisi, sivrisineklerde plazmitin farklı yerleştirme yerlerini ayırmak için G2 yumurtalarını plastik şişelerde ayrı ayrı toplayın (Şekil 4viii). Dokuzuncusu, yumurtaları çatlatın, sivrisinek uygunluğunu kontrol edin ve sıralama yapın (Şekil 4ix). Onuncusu, daha güçlü fenotipe sahip iki çizgi seçin ve üç nesil daha WT ile çaprazlayın (Şekil 4x). On birincisi, daha sonraki deneyler için homozigot bir çizgi oluşturmak üzere iki nesil daha çaprazlamak üzere floresan ile larvaların seçilmesi (Şekil 4xi).
Burada, çoklu transgenik hatlar oluşturmak için kullandığımız CRISPR-Cas9 ile A. aegypti genom düzenlemesi için en kapsamlı protokolü sağladık. Bu protokolün, mikroenjeksiyon denemelerinden elde edilen deneyime dayanarak değişiklik yapması gereken diğer araştırmacılar için bir başlangıç noktası olarak kullanılmasını öneriyoruz. Farklı reaktifler ve koşullar her zaman test edilmelidir. Sivrisineklerde gen düzenlemenin başarı oranı henüz tam olarak optimize edilmemiştir ve çok az sayıda laboratuvar CRISPR-Cas9 aracılığıyla transgenik sivrisinekler üretebilmiştir.
Açıklamalar
O.S.A., Agragene, Inc. ve Synvect, Inc.'in öz sermaye payıyla kurucusudur. Bu düzenlemenin şartları, çıkar çatışması politikalarına uygun olarak California Üniversitesi, San Diego tarafından gözden geçirilmiş ve onaylanmıştır. Kalan yazarlar hiçbir rakip çıkar beyan etmezler.
Teşekkürler
Yazarlar, sivrisinek yetiştiriciliğine yardımcı oldukları için Judy Ishikawa ve Ava Stevenson'a teşekkür ediyor. Bu çalışma, OSA'ya verilen NIH ödüllerinden (R01AI151004, RO1AI148300, RO1AI175152) ve K22AI166268 NHR'ye verilen fonlarla desteklenmiştir. Figürler BioRender kullanılarak oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10x Cas9 reaction buffer | PNA Bio | CB01 | |
| Benchling software | Benchling | N/A | www.benchling.com |
| Cas9 dilution buffer | PNA Bio | CB03 | |
| Cas9 protein | PNA Bio | CP01-50 | |
| DH5α E. coli Competent Cells | New England Biolabs | C2987 | |
| Double-sided sticky tape | Scotch Permanent | 3136 | |
| Drosophila vials | Genesee Scientific | 32-109 | |
| Filter papers | GE Healthcare Life Science | 1450-042 | |
| Fish food | Tetra | B00025Z6YI | goldfish flakes |
| Flugs | Genesee Scientific | AS273 | |
| Fluorescent microscope | Leica Microsystems | M165 FC | |
| Gene fragment | Integrated DNA Technologies | N/A | |
| gRNA | Synthego | N/A | |
| Halocarbon oil 700 | Sigma-Aldrich | H8898 | |
| Injection microscope | Leica Microsystems | DM2000 | |
| JM109 E. coli Competent Cells | Zymo Research | T3005 | |
| Microinjector | Eppendorf | FemtoJet 4x | |
| Microloader Tips for Filling Femtotips | Eppendorf | E5242956003 | |
| Micromanipulator | Eppendorf | TransferMan 4r | |
| Micropipette Pullers | Sutter Instrument | P-2000 | |
| Microscope Cover Glass | Fisherbrand | 12-542-B | |
| Microscope slide | Eisco | 12-550-A3 | |
| Mouse blood (live mice used for feeding) | University of California | IACUC, Animal Use Protocol #S17187 | Used for mosquito blood feeding; details comply with animal ethics protocols |
| NEB Q5 High-Fidelity DNA polymerase | New England Biolabs | M0491S | |
| PCR Purification Kit | Qiagen | 28004 | |
| Plasmid Miniprep Kit | Zymo Research | D4036 | |
| Quartz filament | Sutter Instruments | QF100-70-10 | |
| Transcription Clean-Up Kit | Fisher Scientific | AM1908 | |
| Ultra-pure water | Life Technologies | 10977-023 |
Referanslar
- Anzalone, A. V., Koblan, L. W., Liu, D. R. Genome editing with CRISPR-Cas nucleases, base editors, transposases and prime editors. Nat Biotechnol. 38 (7), 824-844 (2020).
- Garneau, J. E., et al. The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature. 468 (7320), 67-71 (2010).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Shen, H., Li, Z. DNA double-strand break repairs and their application in plant DNA integration. Genes (Basel). 13 (2), 322 (2022).
- Vinauger, C., et al. Modulation of host learning in Aedes aegypti mosquitoes. Curr Biol. 28 (3), 333-344.e8 (2018).
- Li, M., Bui, M., Yang, T., Bowman, C. S., White, B. J., Akbari, O. S. Germline Cas9 expression yields highly efficient genome engineering in a major worldwide disease vector. Proc Natl Acad Sci U S A. 114 (49), E10540-E10549 (2017).
- Chaverra-Rodriguez, D., et al. Targeted delivery of CRISPR-Cas9 ribonucleoprotein into arthropod ovaries for heritable germline gene editing. Nat Commun. 9 (1), 3008 (2018).
- Rouyar, A., et al. Transgenic line for characterizing GABA-receptor expression to study the neural basis of olfaction in the yellow-fever mosquito. Front Physiol. 15, 1381164 (2024).
- Ang, J. X. D., et al. Considerations for homology-based DNA repair in mosquitoes: Impact of sequence heterology and donor template source. PLoS Genet. 18 (2), e1010060 (2022).
- Zhang, J. -. P., et al. Efficient precise knockin with a double cut HDR donor after CRISPR/Cas9-mediated double-stranded DNA cleavage. Genome Biol. 18 (1), 35 (2017).
- Coutinho-Abreu, I. V., Akbari, O. S. Technological advances in mosquito olfaction neurogenetics. Trends Genet. 39 (2), 154-166 (2023).
- Li, M., et al. Targeting sex determination to suppress mosquito populations. eLife. 12, RP90199 (2024).
- Zhan, Y., Alonso San Alberto, D., Rusch, C., Riffell, J. A., Montell, C. Elimination of vision-guided target attraction in Aedes aegypti using CRISPR. Current Biol. 31 (18), 4180-4187.e6 (2021).
- Greppi, C., et al. Mosquito heat seeking is driven by an ancestral cooling receptor. Science. 367 (6478), 681-684 (2020).
- Potter, C. J., Tasic, B., Russler, E. V., Liang, L., Luo, L. The Q system: a repressible binary system for transgene expression, lineage tracing, and mosaic analysis. Cell. 141 (3), 536-548 (2010).
- Riabinina, O., et al. Improved and expanded Q-system reagents for genetic manipulations. Nat Methods. 12 (3), 219-222 (2015).
- Labun, K., et al. CHOPCHOP v3: expanding the CRISPR web toolbox beyond genome editing. Nucleic Acids Res. 47 (W1), W171-W174 (2019).
- Concordet, J. -. P., Haeussler, M. CRISPOR: intuitive guide selection for CRISPR/Cas9 genome editing experiments and screens. Nucleic Acids Res. 46 (W1), W242-W245 (2018).
- Williams, A. E., et al. Quantifying fitness costs in transgenic Aedes aegypti mosquitoes. J Vis Exp. , e65136 (2023).
- Bassett, A. R., Tibbit, C., Ponting, C. P., Liu, J. -. L. Highly efficient targeted mutagenesis of Drosophila with the CRISPR/Cas9 system. Cell Rep. 4 (1), 220-228 (2013).
- Coutinho-Abreu, I. V., Zhu, K. Y., Ramalho-Ortigao, M. Transgenesis and paratransgenesis to control insect-borne diseases: current status and future challenges. Parasitol Int. 59 (1), 1-8 (2010).
- Christian, M., et al. Targeting DNA double-strand breaks with TAL effector nucleases. Genetics. 186 (2), 757-761 (2010).
- Kim, Y. G., Cha, J., Chandrasegaran, S. Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain. Proc Natl Acad Sci U S A. 93 (3), 1156-1160 (1996).
- DeGennaro, M., et al. orco mutant mosquitoes lose strong preference for humans and are not repelled by volatile DEET. Nature. 498 (7455), 487-491 (2013).
- McMeniman, C. J., Corfas, R. A., Matthews, B. J., Ritchie, S. A., Vosshall, L. B. Multimodal integration of carbon dioxide and other sensory cues drives mosquito attraction to humans. Cell. 156 (5), 1060-1071 (2014).
- Lobo, N. F., Clayton, J. R., Fraser, M. J., Kafatos, F. C., Collins, F. H. High efficiency germ-line transformation of mosquitoes. Nat Protoc. 1 (3), 1312-1317 (2006).
- Kistler, K. E., Vosshall, L. B., Matthews, B. J. Genome engineering with CRISPR-Cas9 in the mosquito Aedes aegypti. Cell Rep. 11 (1), 51-60 (2015).
- Handler, A. M., Harrell, R. A. 2nd Transformation of the Caribbean fruit fly, Anastrephasuspensa, with a piggyBac vector marked with polyubiquitin-regulated GFP. Insect Biochem Mol Biol. 31 (2), 199-205 (2001).
- Harrell, R. A. . 2nd Mosquito embryo microinjection under halocarbon oil or in aqueous solution. 2024 (7), (2024).
- Sun, R., Raban, R., Akbari, O. S. Generating mutant strains with transgenic Cas9. Cold Spring Harb Protoc. 2023 (9), 671-678 (2023).
- Giraldo, D., et al. An expanded neurogenetic toolkit to decode olfaction in the African malaria mosquito Anopheles gambiae. Cell Rep Methods. 4 (2), 100714 (2024).
- Liu, G., Lin, Q., Jin, S., Gao, C. The CRISPR-Cas toolbox and gene editing technologies. Mol Cell. 82 (2), 333-347 (2022).
- Chu, V. T., et al. Increasing the efficiency of homology-directed repair for CRISPR-Cas9-induced precise gene editing in mammalian cells. Nat Biotechnol. 33 (5), 543-548 (2015).
- Laursen, W. J., et al. Humidity sensors that alert mosquitoes to nearby hosts and egg-laying sites. Neuron. 111 (6), 874-887.e8 (2023).
- Weng, S. -. C., Antoshechkin, I., Marois, E., Akbari, O. S. Efficient sex separation by exploiting differential alternative splicing of a dominant marker in Aedes aegypti. PLoS Genet. 19 (11), e1011065 (2023).
- Li, M., et al. Development of a confinable gene drive system in the human disease vector. eLife. 9, e51701 (2020).
- Dalla Benetta, E., et al. Engineered Antiviral Sensor Targets Infected Mosquitoes. The CRISPR journal. 6 (6), 543-556 (2023).
- Li, H. -. H., et al. C-Type lectins link immunological and reproductive processes in Aedes aegypti. iScience. 23 (9), 101486 (2020).
- van Oers, M. M., Vlak, J. M., Voorma, H. O., Thomas, A. A. M. Role of the 3' untranslated region of baculovirus p10 mRNA in high-level expression of foreign genes. J Gen Virol. 80 (Pt 8), 2253-2262 (1999).
- Salem, T. Z., et al. The influence of SV40 polyA on gene expression of baculovirus expression vector systems. PloS One. 10 (12), e0145019 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır