Method Article
Zebra Balığı Embriyolarında Lösemi Hücre Greftleri Kullanılarak Hızlı İn Vivo İlaç Yanıtı Tahmini
Bu Makalede
Özet
Bu protokol, geçici olarak bağışıklığı baskılanmış zebra balığı embriyolarında hücre hatlarından ve taze hasta materyalinden insan akut lenfoblastik lösemi (ALL) ksenogreftlerinin oluşturulması ve sorun giderilmesi için adım adım talimatların yanı sıra akış sitometrisi kullanılarak ilaç yanıtı değerlendirmesi için kılavuzlar sağlar. Deneysel boru hattı katı tümörler için de uyarlanabilir.
Özet
Zebra balığı ksenotransplantasyonu, insan kanseri patogenezini araştırmak ve bireysel ilaç yanıtlarını tahmin etmek için çok önemli bir tekniktir. Bu belge, tedavi yanıtlarının yüksek çözünürlüklü tek hücreli analizi için akış sitometrisini kullanan, geçici olarak bağışıklığı baskılanmış zebra balığı embriyolarında primer B hücresi öncüsü akut lenfoblastik lösemi (BCP-ALL) hasta örneklerini veya ölümsüzleştirilmiş hücre hatlarını genişletmek için kolaylaştırılmış bir protokol (ZefiX) sunar. Katı tümör aşılamaları ile karşılaştırıldığında, lösemi hücreleri, tahlil sırasında makrofaj ve nötrofil farklılaştırıcı faktörlerin morfolino antisens oligonükleotid bazlı baskılanmasından önemli ölçüde fayda sağlar. Ayrışmış greft hücrelerinin akış sitometrisi analizi, hücre başına tedavi sonrası hücre sayısının, proliferasyon hızının ve canlılığın hassas bir şekilde değerlendirilmesini sağlar. Bu yaklaşım, venetoklaks ve dasatinib gibi hedefe yönelik terapötikler kullanılarak, ilgili hasta örneklerinin klinik kayıtları ve geleneksel 2D kültür kontrolleriyle karşılaştırılan tedavi sonuçları ile doğrulanmıştır. Özellikle, protokol klinik karar verme zaman çizelgelerine uygun olarak 7 gün içinde tamamlanır. Metodoloji, katı tümörler de dahil olmak üzere çeşitli kanser türlerinde seçilen ilaçları test etmek için uyarlanabilir ve böylece kişiselleştirilmiş terapötik stratejileri destekler. Bununla birlikte, muhtemelen zebra balığı embriyolarındaki farmakokinetik kısıtlamalar nedeniyle değerlendirilebilecek ilaç sayısındaki sınırlamalar dikkate alınmalıdır.
Giriş
Zebra balığı ksenotransplantasyonu, kanser patogenezini anlamak ve ilaç yanıtlarını tahmin etmek için çok önemli bir in vivo model haline gelmiştir 1,2,3,4,5. Hayvan modelleri, klinik öncesi ilaç testleri için kritik olmaya devam etmektedir ve zebra balığı modeli, yüksek verim ve maliyet verimliliği dahil olmak üzere diğer in vivo sistemlere göre önemli avantajlar sunmaktadır 6,7,8. Bu model aynı zamanda moleküler hedefli tedaviler ve CAR-T hücre tedavisi 9,10,11,12 dahil olmak üzere kişiselleştirilmiş tedavi yanıtı tahminlerine de yardımcı olabilir.
BCP-ALL, kültürde birincil hasta hücrelerinin genişletilmesi zor olmaya devam ettiğinden, zebra balığı ksenogreftlemesinden özellikle yararlanabilir13. ALL'de yeni tedavi yaklaşımlarına olan ihtiyaç yadsınamaz bir ihtiyaçtır. BCP-ALL'li çocuklarda %80-85 gibi yüksek bir remisyon oranına rağmen, nüks veya refrakter hastalığı olan hastalarda uzun dönem sağkalım oranları sadece yaklaşık %30-%60 arasında değişmektedir 14,15,16. Bu gibi durumlarda, önerilen boru hattı kullanılarak yapılan ilaç testi, hastaya özgü optimal tedaviyi belirlemek için klinik ortama entegre edilebilir14,15. Bu kişiselleştirilmiş yaklaşım, çoklu ilaç dirençleriyle uğraşırken çok önemli olabilir ve ciddi yan etkileri olan etkisiz veya optimal olmayan ilaçlardan kaçınarak hastalar için tedavi yükünü önemli ölçüde azaltır.
Çeşitli özellikler zebra balığı embriyo ksenogreftlemesini uygun bir model haline getirir. İnsanlar ve zebra balığı arasındaki genetik benzerlikler -% 70 genetik homoloji ve% 84 paylaşılan hastalığa bağlı genler - gen-ilaç etkileşimi çalışmalarını desteklemektedir17. Transgenik bir konakçı embriyonun kullanılması, ilaç duyarlılığını etkileyen genetik yatkınlıkları ortaya çıkarabilir18. Alternatif olarak, ilaç duyarlılığının veya direncinin in vitro bulgularla uyumlu olup olmadığını değerlendirmek için spesifik genetik modifikasyonlara sahip hücreler nakledilebilir. Zebra balığı embriyo ksenogreftleri ayrıca ilaçların potansiyel sistemik etkileri hakkında bilgi sağlar. 2-3 günlük embriyolarda organ gelişimi tam olarak olgunlaşmamış olmasına rağmen, organlar doğru bir şekilde lokalizedir ve hücresel bileşimi kısmen yetişkin meslektaşlarıyla paylaşır19.
Bu modelin diğer avantajları arasında aşılama için sadece birkaç kanser hücresine ihtiyaç duyulması, yaşamın ilk 5 günü içinde beslenmeye gerek duyulmadığı için konakçı embriyoların bakımının basit olması ve embriyoların şeffaflığı ve boyutu nedeniyle enjeksiyon başarısının hızlı bir şekilde değerlendirilebilmesi sayılabilir. Benzersiz bir özellik, bu gelişim aşamasında yalnızca doğuştan gelen bağışıklığın aktif olması ve verimli aşılamayı kolaylaştırmasıdır20. Burada açıklanan ZefiX protokolünde (Şekil 1'deki özete bakınız), immün yetmezlik, makrofaj ve nötrofil farklılaşmasını bloke eden spi1 ve csf3r'yi hedefleyen stabil Morpholino antisens oligonükleotidler kullanılarak yaşamın ilk 4 günü boyunca doğuştan gelen bağışıklık sistemini baskılayarak daha da arttırılır 21,22,23.
Bu protokol ayrıca, esas olarak katı tümör greftleri için geliştirilen ve tipik olarak tam montajlı görüntülemeye dayalı ilaç yanıtı değerlendirme yöntemlerini kullanan önceki zebra balığı ksenotransplantasyon protokollerinden farklıdır. ZefiX, BCP-ALL hücreleri gibi sıvı kanser hücreleri için optimize edilmiştir ve taze veya taze dondurulmuş hasta materyalini genişletmek için başarıyla kullanılmıştır21. ZefiX, doku ayrışması için uygun enzimleri seçerek yapışık kanser hücreleri için de uyarlanabilir.
Diğer bir önemli avantaj, çeşitli faydalar sunan akış sitometrisi kullanılarak yapılan aşağı akış analizidir: (i) çok sayıda greft hücresi hızlı bir şekilde işlenebilir, bu da tek hücre düzeyinde sağlam istatistiksel analize olanak tanır, (ii) proliferasyon hızı ve canlılık tek tek hücrelerde aynı anda değerlendirilebilir ve (iii) akış sitometreleri klinik araştırma ortamlarında yaygın olarak bulunur, greft hücrelerinin birkaç saat içinde tek hücre düzeyinde ilaç yanıtı değerlendirmesinin sağlanması. Tekrarlanabilirliği sağlamak için bu protokol, hazırlıktan transplantasyona ve akış sitometrisi analizine kadar standartlaştırılmış bir boru hattı sağlar ve bir hafta içinde TÜM hücrelerde ilaç yanıtı tahminine izin verir.
Protokol
Tüm zebra balığı deneyleri, Charité-Universitätsmedizin Berlin Deneysel Tıp Araştırma Enstitüleri yönergelerine ve resmi makamlara uygundur. Tüm çalışmalar, döllenmeden 6 gün Danio rerio), standart protokollere göre Charité-Universitätsmedizin Berlin, Berlin, Almanya'daki hayvan tesisinde yetiştirildi ve bakımı yapıldı. 14 saat aydınlık ve 10 saat karanlık döngü ile 28 ° C'ye yerleştirildiler. Tüm deneyler için AB veya TüLF suşlarının yabani tip balıkları kullanılmıştır.
NOT: ZefiX uygulamasından önce istenen her ilaç için en uygun tedavi koşullarının oluşturulması, birkaç gerekli adımı içerir. İlk olarak, geleneksel bir 2D kültür sistemi içinde uygun bir hücre hattı kullanarak her ilacın yarı maksimal inhibitör konsantrasyonunu (IC50) belirleyin. Önceki deneyimlere dayanarak, ZefiX tedavisi için etkili ilaç konsantrasyonları, tipik hücre kültürü koşulları altında kullanılanlardan 5 kat - 50 kat daha yüksek olabilir 21,24. Aşılanmış embriyoları tedavi etmeden önce, belirlenen konsantrasyon aralığını kullanarak nakledilmemiş konakçı embriyolar içindeki toksisiteyi değerlendirmek önemlidir. Toksisiteyi değerlendirdikten sonra, hücre hattı ile aşılanmış embriyoları, daha önce 2D kültürde belirlenen IC50 değerinin yaklaşık 50 katı olan çeşitli ilaç konsantrasyonlarına maruz bırakın. Aşılanmış hücreler IC50'nin 100 katına kadar olan dozlara yanıt vermezse, ilacın ZefiX için etkisiz olduğu düşünülebilir. Etkinliği potansiyel olarak arttırmak için, bir seçenek, greft hücrelerinin embriyolara nakledilmeden kısa bir süre önce ilaçla önceden koşullandırılmasıdır25. Burada kullanılan tüm çözümler için Tablo 1'e bakın.
1. Gün 1: Deney için hazırlık
- E3 besiyeri hazırlığı: Embriyo bakımı için kullanılmak üzere 2 L otoklavlanmış E3 besiyeri hazırlayın.
- Morfolino antisens oligonükleotidler (MO) hazırlığı: Nükleaz içermeyen su kullanarak 1.5 mL'lik bir mikrosantrifüj tüpünde her iki MO'yu içeren 50 μM'lik bir stok çözeltisi hazırlayın. Stok çözeltisini oda sıcaklığında (RT) saklayın. Çözeltiyi 65 ° C'de 10 dakika boyunca bir ısıtma bloğu üzerinde inkübe ederek MO'ları enjeksiyona hazırlayın.
NOT: MO'lar, referans 22,23,26'da açıklandığı gibi makrofaj ve nötrofil hücre farklılaşmasını inhibe etmek için spi1 ve csf3r'ye yöneliktir. - Enjeksiyon plakalarının hazırlanması
- 4-5 tabak hazırlamak için, 100 mL'lik bir çözelti oluşturmak için% 1 agarozu E3 ortamında çözün. Transplantasyon plakaları için, her 10 cm'lik Petri kabına ~ 20 mL çözelti dökün ve yarı dolu olduklarından emin olun. Sıvıyı eşit şekilde dağıtmak için döndürün.
- Morpholino enjeksiyon plakaları için, enjeksiyon kalıbını iki Petri kabındaki sıvı agarozun üzerine yerleştirin ve kabarcık oluşmadığından emin olun. Kapakları eğerek bulaşıkları örtün ve agaroz katılaşana kadar RT'de bırakın. Katılaştıktan sonra kalıbı çıkarın ve plakaları kapalı bir plastik torba içinde 4 °C'de baş aşağı saklayın.
- Enjeksiyon iğnelerinin hazırlanması
- Morpholino enjeksiyonları için: Bir iğne çektirme kullanarak 10 cm'lik kılcal damarlardan iğneler oluşturun ve tahmini 10 μm'lik bir çap elde etmek için uçları kırın (27'de açıklandığı gibi).
- Hücre nakli için: 20 μm dış çapa sahip, ticari olarak temin edilebilen önceden çekilmiş künt uçlu enjeksiyon iğnelerini kullanın.
- Greft hücre kültürü: %10 FCS ve %1 P/S (RPMI-tam) ile desteklenmiş RPMI ortamı olan bir T175 hücre kültürü şişesinde 4. günde %70-80'lik bir hedef yoğunluğu hedefleyen bölünmüş hücreler (ör., Nalm6). Uygun bir çoğalma oranı sağlamak için hücreleri kullanmadan önce 3-4 kez bölün.
NOT: Nakil için taze veya taze/donmuş hasta materyalinin hazırlanması için talimatlar adım 4.3'te bulunabilir. Hücreler daha sonra nakil gününde hazırlanır. - Zebra balığı yetiştiriciliği: Öğleden sonra üreme tanklarında vahşi tip zebra balığı kurun, erkekleri ve dişileri ayrı tutun.
NOT: Zebra balığı referans28'de anlatıldığı gibi büyütülmüş ve sahnelenmiştir. Zaman referansları (hpf veya dpf) döllenmeden sonraki saatleri veya günleri gösterir.
2. Gün 2: Morpholino enjeksiyonu
- 500 mL otoklavlanmış E3 besiyerini %1 penisilin / streptomisin (E3 / P / S) ile destekleyin ve iki adet 10 cm'lik Petri kabını doldurun. RT'de ön ısıtma yapmak için enjeksiyon plakasını buzdolabından çıkarın.
- Üreme tanklarının kademeli kapı açması, böylece döllenmenin bir seferde tankların yalnızca bir kısmında (enjeksiyon hızına bağlı olarak) gerçekleşebilmesi için, Morpholino çözeltisinin tek hücreli aşamada zebra balığı embriyolarına zamanında mikroenjeksiyonlarını sağlamak için28,29. Enjektörün hızına bağlı olarak bir veya iki kapı açarak başlayın, bir parti yumurta kolayca enjekte edildiğinde başka bir kapı veya iki kapı açın ve bu şekilde devam edin.
- Döllenmiş yumurtaları mümkün olduğunca az sıvı ile 100'lük gruplar halinde önceden yapılmış enjeksiyon plakasına aktarın. Embriyoları plakanın oluklarına hizalayın.
- Tek hücreli aşama29 sırasında her iki Morpholinos'un 50 μM'lik bir karışımından 1 nL'yi hücreye veya hücrenin hemen altındaki yumurta sarısı kesesine enjekte edin. Sonraki prosedürler için yeterli yumurta enjekte edin (örneğin, 96 oyuklu bir plaka için, transplantasyondan önce potansiyel bırakma için yeterli yedeğe sahip olmak için 200'e kadar yumurta enjekte edin).
- Enjekte edilen yumurtaları E3/P/S içeren Petri kaplarına aktarın. Enjekte edilen yumurtaları 28 °C'de inkübe edin. Enjekte edilmemiş yumurtaları 5 dpf'de akış sitometrisi analizi için kontrol balığı olarak tutun. Kalan E3/P/S ortamını 4 °C'de saklayın.
3. Gün 3: De-chorionation
- Zebra balığı embriyolarının de-koryonasyonu: İki hassas forseps29 kullanarak 24 hpf'den daha eski olduklarında embriyoları manuel olarak de-koryonat.
- Kalp atışı veya hareket göstermeyen ve opak görünen ölü embriyoları veya düzensiz şekilli embriyoları bir Pasteur pipeti ile bulaşıklardan çıkarın.
- Koryonu yerinde tutmak için hassas forseps ile sıkıştırın. Hassas forsepsin ucunun hemen yanında sıkıştırın, embriyoyu ikinci forseps ile yerinde tutun ve embriyoyu serbest bırakmak için koryonu dikkatlice ayırın
NOT: 24 hpf'den daha genç embriyoları dekoryonlaştırmak için, plastiğe yapışmalarını önlemek için agaroz kaplı bir tabakta tutulmalıdırlar. Embriyolar için daha nazik olduğu için manuel de-koryonasyon tercih edilir. Alternatif bir enzimatik de-koriyonasyon yöntemi başka bir yerde açıklanmıştır30.
- De-koryonlu embriyoları gece boyunca 28 ° C'de inkübe edin.
4. Gün 4: Ksenotransplantasyon ve ilaç tedavisi
- Konak embriyoların hazırlanması: Hazırlanan agaroz plakalarını ve E3 / P / S'yi buzdolabından çıkarın ve RT'ye ulaşmalarına izin verin. Stereo mikroskop kullanarak 48 hpf'de uygun gelişim aşaması için embriyoları tarayın. Başka bir yerde açıklandığı gibi, iş akışına yalnızca uygun şekilde evrelenmiş ve morfolojik olarak tipik embriyoları dahil edin29. Tüm sağlıklı embriyoları sayın ve daha fazla tedavi planlayın. Oksijen eksikliğinin neden olduğu eşit olmayan gelişim hızlarını önlemek için 28 ° C'de 10 cm Petri kabı başına 100'den fazla embriyo tutmayın.
NOT: Adım 4.2'yi izleyin. hücre hatları için. Taze/dondurulmuş materyal için doğrudan Adım 4.3'e geçin. - Hücre hatlarının hazırlanması
- Akış sitometrisi ve transplantasyon için floresan etiketli BCP-ALL hücrelerini hazırlamak için, hücreleri (adım 1.5'ten itibaren) 1x PBS ile yıkayın: 5 dakika boyunca 350 x g'da santrifüjleyin ve 20 mL PBS'de yeniden süspanse edin.
- Hücreleri sayın ve 3 x 105 boyanmamış hücreyi 0. gün (enjeksiyondan 0 gün sonra, dpi) akış sitometrisi analizi için bir FACS tüpüne aktarın. Buz üzerinde saklayın.
- Plaka 3 x 10 3 mL RPMI içinde5 hücre-6 oyuklu bir plakanın bir oyuğunda tamamlayın ve 3 dpi kontrol için 37 ° C'de tutun.
- CTV etiketlemesi için 1 x 107 hücreyi 15 mL'lik bir santrifüj tüpüne aktarın. RT'de 5 dakika boyunca 350 x g'da santrifüjleyin, süpernatanı dökün (geri kalanı için bir pipet kullanın) ve peleti 1 μL CTV stok çözeltisi ile 2,5 mL PBS (RT) içinde yeniden süspanse edin.
- Karanlıkta 37 ° C'de 5 dakika inkübe edin, 12.5 mL RPMI-tam ile reaksiyonu durdurun, ardından karanlıkta 37 ° C'de 10 dakika inkübe edin.
- RT'de 5 dakika boyunca 350 x g'da santrifüjleyin ve 10 mL RPMI-complete ile bir kez yıkayın. Tekrar santrifüjleyin ve 10 mL RPM-complete'de yeniden süspanse edin.
- 350 x g'da 5 dakika santrifüjleyerek 10 μm'lik bir filtre kullanarak hücreleri filtreleyin. Peleti yeniden süspanse edin, hücreleri sayın ve 3 x 105 CTV etiketli hücreleri bir FACS tüpüne aktarın. 3 oyuklu bir plakanın bir oyuğunda 3 mL RPMI'ye sahip 3x 10^5 hücreyi plakalayın ve 3 dpi proliferasyon kontrolü için 37 ° C'de tutun. Kalan hücreleri transplantasyona kadar buz üzerinde 1 mL PBS'de saklayın.
- Taze/donmuş hasta materyalinin hazırlanması
- Her biri 37 °C'de tamamlanan 10 mL RPMI'ye sahip iki adet 15 mL santrifüj tüpünü önceden ısıtın. 5-10 x 106 hücre içeren bir şişeyi 37 ° C'lik bir su banyosunda çözdürün.
- Sadece az miktarda buz kaldığında, hücreleri önceden ısıtılmış ortamla santrifüj tüpüne aktarın. RT'de 5 dakika boyunca 350 x g'da santrifüjleyin, süpernatanı atın ve peleti önceden ısıtılmış RPMI tamamlamanın ikinci tüpünde yeniden süspanse edin.
- Tripan mavisi kullanarak canlı hücreleri sayın. 1x 10^5 hücreyi 1,5 mL'lik bir santrifüj tüpüne alın ve bu hücre alikotunu RT'de 5 dakika boyunca 350 x g'de bir FACS tüpünde santrifüjleyin, süpernatanı atın ve peleti 300 μL PBS'de yeniden süspanse edin.
- Akış sitometrisi analizi için işlenmemiş bir kontrol olarak yeniden askıya alınmış alikotu buz üzerinde saklayın.
NOT: Yeterli numune boyutu izin veriyorsa, 7. günde akış sitometrisi ölçümü için kültürde tedavi edilmemiş bir kontrol sağlayın. - Her 1 x 106 hücre için 2,5 mL PBS'ye (RT) 1 μL CTV stok çözeltisi ekleyin. Daha az hücre varsa CTV stok çözeltisinin hacmini ayarlayın.
- Hücreleri karanlıkta 37 °C'de 5 dakika CTV ile inkübe edin, 12,5 mL önceden ısıtılmış (37 °C) RPMI-complete ekleyerek reaksiyonu durdurun ve karanlıkta 37 °C'de 10 dakika inkübe edin.
- Hücreleri RT'de 5 dakika boyunca 350 x g'da santrifüjleyin ve hücreleri bir kez 10 mL RPMI-complete ile yıkayın. RT'de 5 dakika boyunca 350 x g'da tekrar santrifüjleyin ve hücreleri 10 mL RPMI-complete'de yeniden süspanse edin.
- Hücre süspansiyonunu 10 μm'lik bir filtre kullanarak 50 mL'lik yeni bir santrifüj tüpüne süzün ve 5 dakika boyunca 350 x g'de santrifüjleyin.
- Süpernatanı atmayın. Peleti yeniden askıya alın ve hücreleri sayın. 3 x 105 CTV etiketli hücreleri bir FACS tüpüne aktarın.
- Kalan hücreleri RT'de 5 dakika boyunca 350 x g'da santrifüjleyin ve süpernatanı atın. Kalan hücreleri 1 mL PBS'de yeniden süspanse edin ve transplantasyonda kullanılana kadar buz üzerinde saklayın.
NOT: Yeterli CTV pozitif hücre kalırsa, proliferasyon hızı karşılaştırması için ksenogreftlere paralel olarak 2D kültürde tutulabilirler.
- Akış sitometrisi ölçümü
NOT: Transplantasyondan önce hücrelerin buz üzerinde kalma süresini en aza indirmek için 0 dpi'de akış sitometrisi ikinci bir kişi tarafından yapılmalıdır. Atanan boyama panelini (CTV, CD19-Alexa488, APC-Annexin V ve 7AAD) kullanarak ilk akış sitometrisi ölçümünden önce, üreticinin talimatlarına göre bir kompanzasyon testi yapın.- Aşağıdaki gibi iki FACS tüpü hazırlayın: Tüp 1: Boyanmamış kontrol hücreleri; Tüp 2: CTV, CD19, 7AAD ve Annexin ile boyanmış hücreler.
NOT: Boyama ve Etiketler: CellTrace Violet (CTV), etiketli greft hücrelerini konakçı balık hücrelerine karşı tanımlar ve 3 gün sonra çoğalma oranını değerlendirir. Bir hücre yüzeyi markörü olan CD19 antikoru, insan BCP-ALL greft hücrelerini tanımlamak için ek bir belirteç görevi görür. Diğer kanser türleri için alternatif belirteç antikorlar gerekebilir. Annexin V, hücre canlılığı değerlendirmesi için erken evre apoptozu işaretler. 7AAD, hücre canlılığı değerlendirmesi için geç evre apoptozu veya nekrozu işaretler. - RT'de 5 dakika boyunca 350 x g'da santrifüj tüplerini (biri CTV ile boyanmış hücreler ve diğeri boyanmamış hücreler içerir) ve süpernatanı Tüp 1'den atın. Peleti 310 μL Annexin Bağlayıcı Tampon (ABB) içinde yeniden süspanse edin.
- Tüp 2: Aşağıda açıklandığı gibi antikor ve canlılık boyaması yapın.
NOT: Bu boyama protokolü, CD19 B hücresi boyaması için optimize edilmiştir. Farklı hücre tiplerini etiketlemek için kullanılan diğer insan antikorları için protokolün adaptasyona ihtiyacı olabilir.- Tüp 2'ye (CTV etiketli hücreler içeren) 98 μL ABB ekleyin. Eklenen 98 μL ABB'ye 2 μL CD19-Alexa488 antikoru (1:50 seyreltme) ekleyin. İyice karıştırın.
- Karışımı 4 °C'de 30 dakika inkübe edin ve reaksiyonu durdurmak için 500 μL ABB ekleyin. Tüpü 350 x g'da 4 °C'de 5 dakika santrifüjleyin. Süpernatanı çıkarın ve yıkama adımını tekrarlayın.
- Hücre peletini 100 μL ABB içinde yeniden süspanse edin ve 7AAD ve APC-Annexin V boyamaya devam edin. Aşağıda açıklandığı gibi 7AAD ve APC Annexin V boyama ve akış sitometrisi ölçümü yapın.
- Yeniden süspanse hücrelere 5 μL 7AAD ve 5 μL APC-Annexin V ekleyin. Karıştırmak için hafifçe girdap yapın. Tüpü RT'de karanlıkta 15 dakika inkübe edin. 310 μL'lik bir nihai hacme ulaşmak için 200 μL ABB ekleyin.
- Çapraz kontaminasyonu önlemek için transplantasyon gününde aşağıdaki sırayla akış sitometrisi analizi yapın: Boyanmamış kontrol hücreleri (Tüp 1), Alexa488-CD19 ile boyanmış CTV işaretli hücreler, APC-Annexin V ve 7AAD (Tüp 2). Yeterli analiz için örnek başına en az 10.000 olay kaydedin.
- Aşağıdaki gibi iki FACS tüpü hazırlayın: Tüp 1: Boyanmamış kontrol hücreleri; Tüp 2: CTV, CD19, 7AAD ve Annexin ile boyanmış hücreler.
5. Transplantasyon
- Transplantasyon plakası: E3/P/S ile doldurulmuş iki adet 10 cm'lik Petri kabı hazırlayın ve ön ısıtma için en az 30 dakika boyunca 28 °C'de inkübatöre yerleştirin.
- Hücre hazırlama: Hücreleri RT'de 5 dakika boyunca 350 x g'da santrifüjleyin, süpernatanı atın ve kalan sıvıyı bir mikro pipet kullanarak çıkarın. 20 μL'lik bir son hacim elde etmek için PBS ekleyin. Konsantre hücre süspansiyonunu buz üzerinde tutun.
NOT: Transplantasyon işlemi sırasında hücreler 2 saatten fazla buz üzerinde kalmamalıdır. - Transplantasyon iğnesi ve konak embriyo hazırlığı
- 25-30 embriyoyu, kontrol görevi görmesi için bir cam Pasteur pipeti kullanarak E3 / P / S içeren önceden ısıtılmış Petri kaplarından birine aktarın. Bir mikro yükleyici ucu kullanarak 4 μL hücre süspansiyonunu transplantasyon iğnesine yükleyin.
NOT: Yükleme 1-2 dakika içinde sorunsuz bir şekilde ilerlemelidir. Aksi takdirde, hücre süspansiyonuna dikkatlice daha fazla PBS ekleyin. - Mikroenjektörü ayarlayarak enjeksiyon basıncını ve darbe uzunluğunu kalibre edin. Bir enjeksiyon yaklaşık 1.000 ALL hücresini veya 2 nL hücre süspansiyonunu dışarı atana kadar ayarlayın (20 μL'de 1x 10,7 hücre için). 1.000 hücreyi tahmin etmek için, süspansiyonun bir hacmini ortamla kaplı bir agaroz yüzeyine boşaltın. Küçük bir alanda 100 hücreyi sayın, dağılımlarını toplam hücre popülasyonuna göre tahmin edin ve toplam sayıyı tahmin edin.
- Trikadlı 50 mL E3 hazırlayın (son konsantrasyon: 80 mg / L). Konakçı embriyoları tricaine solüsyonuna aktarın ve uygun anesteziyi sağlamak için en az 2 dakika inkübe edin. Embriyo, herhangi bir motor yanıt gözlenmediğinde uygun şekilde uyuşturulur
NOT: Embriyoya dikkatlice yaklaşmak ve/veya dokunmak için bir mikro yükleyici ucu veya forseps kullanılabilir. - Embriyoların kaymasını önlemek için mümkün olduğunca az sıvı kullanarak 15-20 dekoryonlu embriyoyu agaroz kaplı bir enjeksiyon kabına aktarın (önceki hazırlama talimatlarına bakın).
- Embriyoları Şekil 2A'da gösterildiği gibi düzenleyin. Perikardiyal boşluğa yaklaşık 1.000 CTV-pozitif BCP-ALL hücresi enjekte edin. Hücreleri enjekte etmek için iğneyi Şekil 45B'de gösterildiği gibi dorso-kaudal yönden 2°'lik bir açıyla sokun.
NOT: Küçük lösemi hücreleri için özel olarak tasarlanmış, 20 μm açıklık çapına sahip, piyasada bulunan önceden çekilmiş, kör uçlu iğneler kullanın (malzeme listesine bakın). İğne tıkanırsa, gerektiği gibi kesin, ancak daha sonra enjeksiyon hacmini ve hücre sayısını yeniden kalibre edin. - 15-20 embriyonun tümü enjekte edildikten sonra, bunları E3 / P / S ile doldurulmuş önceden ısıtılmış Petri kabına aktarın ve 28 ° C'de tutun.
- Üç ilaç konsantrasyonu ve bir kontrol içermesi gereken bir ilaç tedavisi testi için yaklaşık 100 - 150 embriyo nakledilene kadar adımları tekrarlayın.
- İlaç tedavisine başlamadan önce hem nakledilen embriyoları hem de nakledilmeyen kontrolleri 28 °C'de 1-3 saat inkübe edin.
- 25-30 embriyoyu, kontrol görevi görmesi için bir cam Pasteur pipeti kullanarak E3 / P / S içeren önceden ısıtılmış Petri kaplarından birine aktarın. Bir mikro yükleyici ucu kullanarak 4 μL hücre süspansiyonunu transplantasyon iğnesine yükleyin.
- İn vivo ilaç tedavisi (96 oyuklu plaka)
- Floresan stereomikroskopi kullanarak, başarılı aşılamayı doğrulamak için embriyoları tarayın (Şekil 2C). Yumurta sarısı ortamı greft hücreleri için toksik olabileceğinden, yumurta sarısının sağlam olduğundan emin olun21. Yumurta sarısındaki hücrelerle embriyoları atın.
- % 0.5 DMSO ile E3 / P / S'de test edilecek her ilaç koşulu için 2.5 mL 2x konsantre çözelti hazırlayın. Ek olarak, E3/P/S'de %0,5 DMSO içeren 5 mL'lik bir araç kontrol solüsyonu hazırlayın.
- 96 oyuklu bir plakanın her bir oyuğuna 100 μL E3/P/S +% 0,5 DMSO ekleyin. Bu adım, kuyucuklar arasında minimum ilaç miktarlarının istenmeyen transferini önler.
- Her bir oyuğa bir aşılanmış embriyoyu dikkatlice aktarın. Her embriyoyu mümkün olduğunca az E3 ortamında almak için bir cam Pasteur pipeti kullanın.
- Pipeti hafifçe eğerek embriyonun pipet ucunun dibine batmasına izin verin ve kılcal kuvvetler kullanarak kuyuya bırakın. Aktarım sırasında kuyudaki ortama dokunmaktan kaçının.
- Plakaya ilaç çözeltileri ekleyin: 96 oyuklu plakanın 24 kuyusunu (2 sıra) 100 μL araç kontrol solüsyonu veya üç adet 2x konsantre ilaç solüsyonundan biri ile doldurun.
NOT: Etkili ilaç konsantrasyonları, test edilen her ilaca özgü önceki deneylerde belirlenmelidir. - 7. günde akış sitometrisi analizi için kontrol görevi görecek olan nakledilmemiş embriyolar da dahil olmak üzere embriyoları 72 saat boyunca 35 ° C'de tutun.
6. Gün 7
- Embriyo / greft ayrışması
- Sağlıklı zebra balığı embriyolarını tanımlamak ve seçmek için stereomikroskopi kullanarak 96 oyuklu plakayı tarayın. Her koşuldan 10 sağlıklı konakçı embriyoyu 1.5 mL'lik bir mikrosantrifüj tüpüne rastgele bir araya getirin (ideal olarak koşul başına 2 tüp ile sonuçlanır).
- Embriyo içeren her tüpten mümkün olduğunca fazla sıvı çıkarın ve tüpleri buz üzerinde 1 saat inkübe ederek embriyoları hipotermal şokla kurban edin.
- Her tüpe 500 μL kalsiyum ve magnezyum içermeyen Hank'in dengeli tuz çözeltisi (HBSS) ekleyin. Embriyoları ve greft hücrelerini, 200 μL'lik bir mikropipet ucu kullanarak, yaklaşık 15 kat yukarı ve aşağı pipetleyerek öğütme yoluyla mekanik olarak ayırın.
- Doku parçalarını RT'de 5 dakika boyunca 350 x g'da santrifüjleme ile peletleyin. Bu arada, FACS tüplerini, koşul başına 2 mL PBS (toplam 4 tüp) içeren 35 μm ince gözenekli filtre süzgeç kapağı ile hazırlayın.
- Enzimatik ayrışma için her peleti 500 μL enzim karışımında (%0.01 papain, %0.1 dispas II, %0.01 deoksiribonükleaz I ve kalsiyum ve magnezyum içermeyen HBSS'de 12.4 mMMgS04 ) yeniden süspanse edin. RT'de 15 dakika inkübe edin.
- İnkübasyon sırasında, doku kaybını önlemek için her bir tüp için aynı pipet ucunu kullanarak karışımı her 5 dakikada bir tekrar tekrar yukarı ve aşağı pipetleyin.
- Akış sitometrisi ölçümü
- Ayrışan hücreleri FACS tüplerinin 35 μm ince gözenekli filtre süzgeci kapağına aktarın ve 5 dakika boyunca 350 x g'da santrifüjleyin.
- Santrifüjleme sırasında, CD19 B hücresi yüzey boyaması için bir ana karışım hazırlayın. Her koşul için 98 μL ABB'yi 2 μL Alexa Fluor 488 anti-insan CD19 antikoru ile birleştirin.
- Süpernatanı ayrışmış hücre peletinden atın ve peleti 100 μL CD19 boyama ana karışımında yeniden süspanse edin.
- Varsa paralel hücre kültüründen 3 x 105 CTV pozitif hücreler dahil olmak üzere tüm ZefiX örnekleri için CD19, 7AAD ve APC Annexin V boyama protokolünü gerçekleştirin.
- Sırayı takip ederek akış sitometrisi analizi yapın ve Tablo 2'de belirtilen olayların sayısını kaydedin. Toplam greft hücresi sayılarını değerlendirmek için konak ve greft hücrelerini içeren tüm numuneleri mümkün olduğunca eksiksiz çalıştırın.
- Ticari yazılım kullanarak sonuçların analizi.
- Hücre kültürü örneği için geçit stratejisi: Yazılımı açın ve FCS dosyalarını çalışma alanına yükleyin. Sinyalin örtüştüğünden emin olmak ve kanser hücrelerinin varlığını doğrulamak için CD19 ve CTV ile bir nokta grafiği oluşturun. Ardından, sağlam hücreleri (Q2) döküntülerden (Q4; Şekil 3A').
- Tek hücreleri tanımlamak için SSC-H (x ekseni) ve SSC-A (y ekseni) ile yeni bir çizim oluşturmak için Bozulmamış Hücreler popülasyonunu kullanın (Şekil 3A '').
- Tek Hücre popülasyonunu kullanarak Annexin V (x ekseni) ve 7AAD (y ekseni) ile başka bir nokta grafiği oluşturun (Şekil 3A'''). Hücreleri dört popülasyona ayırın: Canlı hücreler: Annexin V negatif, 7AAD negatif (Q4); Erken apoptotik hücreler: Annexin V pozitif, 7AAD negatif (Q3); Geç apoptotik / nekrotik hücreler: Annexin V pozitif, 7AAD pozitif (Q2); Nekrotik hücreler: Annexin V negatif, 7AAD pozitif (Q1).
- 3 dpi örnek için bu adımları tekrarlayın (Şekil 3B).
- Greft ve konak embriyo hücreleri için geçit stratejisi
- CTV (x ekseni) ve CD19 (y ekseni) ile bir nokta grafiği kullanarak insan greft hücrelerini konakçı hücrelerden ayırın. CTV/CD19 çift pozitif greft hücrelerini tanımlayın ve izole edin (Şekil 3C).
- 3 dpi kültür hücreleri (Şekil 3B'' - B''') için açıklanan aynı geçit stratejisini greft hücresi popülasyonuna uygulayın. Tutarlılık için geçit stratejisini kopyalayın.
- Tüm Annexin V ve 7AAD negatif hücre popülasyonlarını, x ekseninde CTV değerleri olan bir histogramda birleştirin (Şekil 3D). Proliferasyon oranlarını belirlemek için beş numunenin tümü için geometrik ortalamayı hesaplayın.
- Tedavi yanıtı değerlendirmesi için hesaplamalar
- 3 gün sonra hücre bölünmelerinin sayısını belirlemek için aşağıdaki formülü kullanın:
n = günlük2 (I0/I)
Nerede, I0 = İlk CTV floresan yoğunluğu (geometrik ortalama, 0 dpi), I = 72 saatteki CTV floresan yoğunluğu, n = Hücre bölünmesi sayısı.
Örnek: Taze donmuş hasta hücreleri ZefiX günlüğünde 2,6x'e bölünür2(88317/14644) = 2,6
ve 2B kültür günlüğünde 2,8x2(88317/12992) = 2,8 - 3 gün sonra balık başına toplam greft hücresi sayısını belirlemek için, toplam kanser hücresi sayısını (apoptotik hücreler dahil, ancak enkaz hariç) numunede toplanan balık sayısına (tipik olarak n = 10) bölün.
- 3 gün sonra CTV pozitif greft hücrelerinin canlılığını belirlemek için aşağıdaki formülü kullanın:
V = (C/100) x A
Nerede: V = Canlılık, C = enkaz içermeyen bozulmamış tek hücrelerin fraksiyonu (yüzde olarak), A = Annexin V- ve 7AAD-negatif hücrelerin fraksiyonu (yüzde olarak).
- 3 gün sonra hücre bölünmelerinin sayısını belirlemek için aşağıdaki formülü kullanın:
Sonuçlar
Taze dondurulmuş, birincil BCP-ALL hücre örneklerinin ksenogreft ve ilaç tedavisi de dahil olmak üzere ZefiX protokolünün ayrıntılı bir bilimsel değerlendirmesi için lütfen daha önce yayınlanmış makale21'e bakın. Klinik öncesi ilaç testi için yapılan araştırmalarda hasta örneklerinin kullanımına ilişkin onay, yerel tıbbi araştırma etik kurulları tarafından ALL-REZ BFM 2002 denemesine (NCT00114348) ve ALL-REZ BFM kayıt ve biyobankasına (EA2/055/12) ve ayrıca ulusal otorite tarafından yapılan IntReALL SR 2010 uluslararası denemesine (NCT01802814) ek çalışmaların bir parçası olarak verilmiştir. Hastalardan ve/veya vasilerinden, kayıtlı oldukları ilgili çalışma veya kayıt defteri aracılığıyla bilgilendirilmiş onam alınmıştır.
Şekil 2, enjeksiyondan önce bir agaroz kabında embriyo hizalamasının bir örneğini göstermektedir, bu da enjeksiyon sürecini kolaylaştırmaya yardımcı olur. Enjeksiyon, gelişmekte olan kalbi çevreleyen boşluğu tam olarak hedeflemek için gösterilen açıda yapılmalıdır. Ek olarak, Şekil 2C , enjeksiyondan önce CTV ile etiketlenmiş insan greft hücrelerini (mavi) içeren başarılı bir şekilde enjekte edilen 2 dpf embriyosunun bir referansını sağlar. Şekil 2C'de gösterilenlerden farklı enjeksiyon sonuçlarına sahip embriyolar, sonraki üç günlük inkübasyon sırasında greft hücresi canlılığını sağlamak için yolk kesesi perforasyonundan kaçınmaya özel olarak odaklanılarak hariç tutuldu.
Üç günlük kuluçka dönemini takiben konak embriyolar akım sitometri analizi için 10'lu havuzlarda işlenir. Enzimatik ayrışmadan sonra, hücre süspansiyonları bir anti-insan-CD19 antikoru ve iki canlılık belirteci ile boyanır: Erken apoptotik hücreler için Annexin V ve geç apoptotik ve nekrotik hücreler için 7AAD.
Şekil 3, BCP-ALL'li bir hastadan ZefiX ile genişletilmiş BCP-ALL hücrelerinin akış sitometrisi verilerini sunmaktadır. A, A', A'' ve A'' panelleri, nakil gününde 0 dpi'de toplanan verileri gösterir. Şekil 3A , 3 dpi'de konak-greft hücre süspansiyonlarına uygulanan geçit stratejisi için bir referans olarak toplam 10.000 hücre için CTV ve CD19 floresan değerlerini gösterir (Şekil 3C). Şekil 3A'da, döküntü, İleri Saçılma Alanı (FSC-A) ve Yana Doğru Saçılma Alanı (SSC-A) kullanılarak hücrelerin düzenli olarak geçitlenmesi yoluyla hariç tutulur. Şekil 3A''da, tek hücreler, SSC-A'ya karşı SSC yüksekliği (SSC-H) grafiği kullanılarak çiftlerden ayrılır. Bu tek hücreli popülasyon, canlı hücrelerin (Q4) erken apoptotik hücrelerden (Q3, daha yüksek Annexin V değerleri) ve geç apoptotik veya nekrotik hücrelerden (Q2, daha yüksek 7AAD seviyeleri) ayırt edildiği Şekil 3A'''da canlılık değerlendirmesi için kullanılır.
Karşılaştırma için, konvansiyonel 2D koşullar altında kültürlenen hasta hücreleri de aynı geçit stratejisini izleyerek üç gün sonra akış sitometrisi ile analiz edilir (Şekil 3B, B'', B'', B''). 2D kültürde 72 saat sonra hasta hücrelerinin canlılığı, Şekil 2B''deki Q2'den ve Şekil 2B'deki Q4'ten hesaplanır: (% 95.0 / 100)*% 61.9 =% 58.8.
Şekil 3C'de başlangıç materyali, greft hücreleri içeren konakçı embriyolardan alınan hücre süspansiyonudur. İn vitro ölçümlerden farklı olarak, tüpteki tüm hücreler akış sitometrisi ile analiz edilir. CD19 ve CTV-pozitif greft hücreleri, onları CD19 ve CTV-negatif balık hücrelerinden ayırmak için kapılıdır. Sağlam greft hücresi popülasyonu, döküntülerin dışlandığı Şekil 3C'de daha fazla analiz edilir. Tek greft hücrelerinin canlılığı daha sonra Şekil 3B'deki ile aynı geçit stratejisi kullanılarak değerlendirilir.
Sonuçlar, embriyolarda genişleyen canlı tek hücrelerin yüzdesinin %95.2 olduğunu ve bunun bir tabakta kültürlenen hücrelerin canlılığından 1.6 kat daha yüksek olduğunu göstermektedir (Şekil 3B'''). Hücre bölünme oranları, her popülasyonda CTV floresan yoğunluğundaki azalmanın 0 dpi'den 3 dpi'ye analiz edilmesiyle in vivo ve in vitro olarak hesaplanmıştır (Şekil 3D). Hücre bölünmelerinin sayısı, Bölüm 6.4.1'deki formül ve her bir CTV eğrisinin geometrik ortalaması kullanılarak belirlendi (Şekil 3D). Hesaplanan bölünme oranları (in vivo olarak 2.59 bölünme ve in vitro olarak 2.77 bölünme), canlı hücrelerin üç gün boyunca her iki koşul altında benzer bir oranda bölündüğünü göstermektedir.
Son olarak, üç gün sonra embriyo başına ortalama sağlam greft hücresi sayısı, sağlam greft hücrelerinin sayısının (enkaz hariç, Şekil 3C') bir tüpte toplanan embriyo sayısınabölünmesiyle belirlendi 21.
Sonuç olarak, zebra balığı embriyolarına aşılanmış taze BCP-ALL örnekleri, bir tabaktaki geleneksel kültüre kıyasla üç gün sonra daha yüksek canlılık sergiler ve canlı hücreler her iki durumda da karşılaştırılabilir bir oranda bölünür.
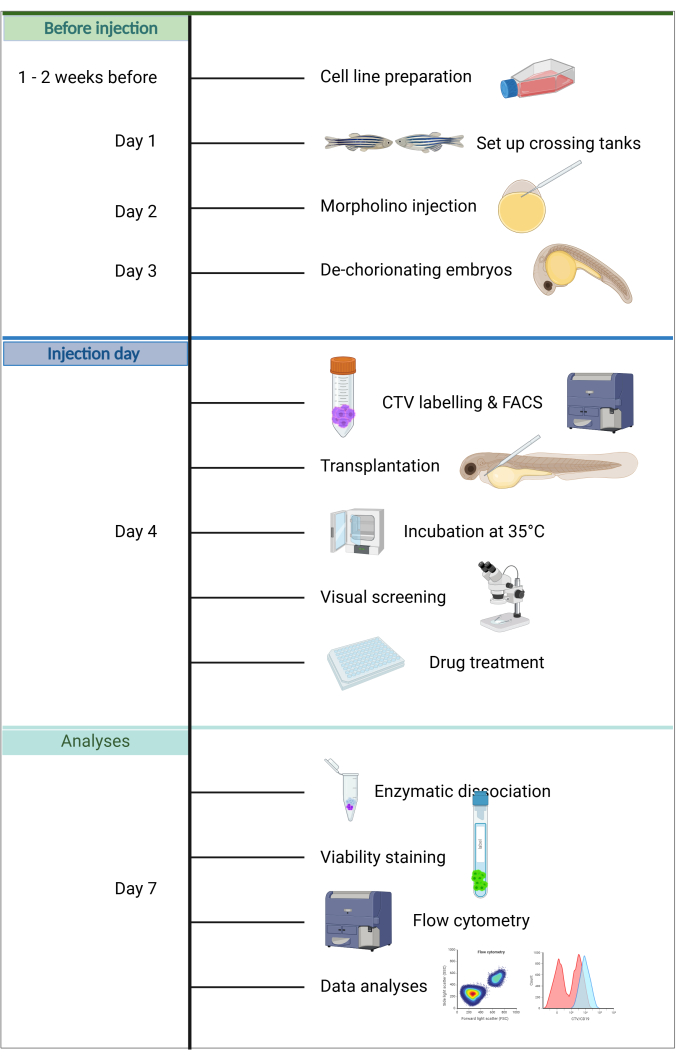
Şekil 1. ALL-ZefiX boru hattının iş akışı. https://BioRender.com yılında oluşturuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
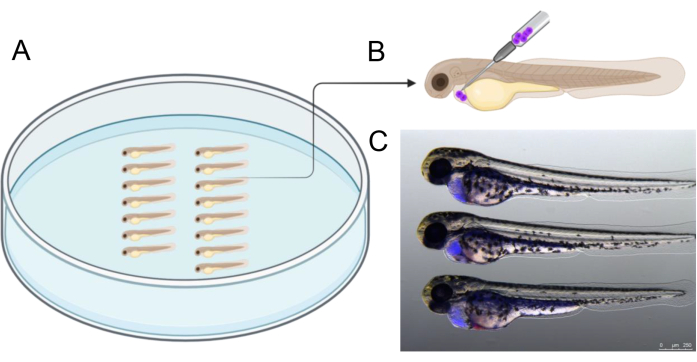
Şekil 2: Enjeksiyon düzenlemesi. (A) Embriyoların gösterildiği gibi düzenlenmesi enjeksiyonu kolaylaştırır. Embriyolar forseps kullanılarak veya 2,5 - 3 cm uzunluğunda bir uca sahip olacak şekilde kesilmiş 20 μL'lik bir mikro yükleyici pipet ucu ile düzenlenebilir. (B) 2 dpf embriyosunun perikardına hücreleri greftlemek için önerilen enjeksiyon açısının şematik gösterimi. (C) Nakledilen kanser hücrelerinin miktarını doğru bir şekilde tahmin etmek için görsel yardımcılar. Bu resim, daha önce CellTrace Violet ile etiketlenmiş insan kanser hücreleri ile enjeksiyondan 3 saat sonra 48 hpf'lik bir embriyoyu göstermektedir). https://BioRender.com yılında oluşturuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Zebra balığı embriyolarında 2D aşılama kültürünü takiben izole BCP-ALL blast hücrelerinin hastadan türetilmiş taze donmuş örneğinin geçit stratejisi ve akış sitometrisi analizi. (A, B) Hasta hücreleri kültür öncesi CellTrace Violet (CTV) ile işaretlendi. Hücreler, akış sitometrisi analizinden önce 0 saat (A) veya 72 saat (B) için 37 ° C'de doku kültürü plastiği üzerinde kültürlendi. (C) CTV ile işaretlenmiş ve konakçı zebra balığı embriyolarında greft olarak 72 saat boyunca 35 ° C'de büyütülmüş hasta hücreleri. Akış sitometrisi analizi için tek hücre ayrışmasından önce 10 embriyodan oluşan bir grup toplandı. (B)'deki geçit stratejisi uygulandı ve canlı greft hücre fraksiyonu belirlendi ve miktar tayini yapıldı. Bunu yapmak için, CTV pozitif greft hücreleri (Q2), analiz için greft hücresi popülasyonunu ayırmak için otomatik floresan zebra balığı hücrelerinden (Q1 / 4) ayrıldı. Bu greft hücre popülasyonunda CTV etiketleme yoğunluğu analiz edildi. (D) Yalnızca canlı hücre seçiminden elde edilen hücre sayıları ve CTV etiketlerinin ortalama yoğunluğu. 3 gün sonra CTV yoğunluğunun değişmesine dikkat edin (3 dpi). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Kullanılan çözeltiler tablosu. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: Akış sitometrisi ile ölçülen numuneler. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Zebra balığı embriyoları, yüksek verim kapasiteleri ve maliyet etkinlikleri nedeniyle ilaç taraması ve kanser araştırmaları için giderek daha popüler bir ksenogreft modeli haline geldi. Bu ksenogreftler, translasyonel tıbbın kritik bir ayağı olarak umut vaat ediyor ve klinik öncesi araştırmalara ve karar vermeye yardımcı oluyor 9,21. Bununla birlikte, insan lösemi hücre genişlemesi ve tedavisi için zebra balığı ksenogreft modelleri, katı tümör greftleri üzerindeki kapsamlı çalışmalara kıyasla yeterince temsil edilmemektedir. Bu protokol, lösemi araştırmalarında zebra balığı ksenogreftlerinden yararlanmak için ayrıntılı rehberlik sunarken, katı tümörlerde kullanım için uyarlanabilir kalır.
Tutarlı kanser hücresi nakli elde etmek zor olabilir, bu da standartlaştırılmış analiz ve daha yüksek istatistiksel güvenilirlik ihtiyacını vurgular. Bu protokol, sorun giderme önerileriyle birlikte hazırlık, transplantasyon ve aşağı akış sitometrisi analizi için kapsamlı bir boru hattı sunarak bu sorunları ele alır.
Geçici bağışıklık baskılanması için morfolino enjeksiyonu
Zebra balığı embriyoları, gelişimin ilk günlerinde doğuştan gelen bağışıklık sistemlerine güvenirler ve bu da bu deneysel boru hattının20 zaman çerçevesini tanımlar. İlkel makrofajlar 12 hpf civarında ortaya çıkar ve bazıları 33 hpf ile nötrofillere farklılaşır 20,31,32. T hücreleri döllenmeden yaklaşık 8 gün sonra dolaşıma girer20,33. Doğuştan gelen bağışıklık tepkisinin bir parçası olarak makrofajlar ve nötrofiller, önceki çalışmalarda transplantasyondan üç gün sonra gözlenen BCP-ALL hücrelerinin sağkalımının azalmasında rol oynamıştır21.
Spi1 ve csf3r'yi hedefleyen morfolino aracılı temporal immün supresyon, makrofaj ve nötrofil farklılaşmasını etkili bir şekilde inhibe ederek, embriyo canlılığını etkilemeden BCP-ALL hücrelerinin daha iyi aşılanmasına yol açar21. Bu yöntem kalıcı tükenme sağlayamasa da, spi1 ve csf3r'nin tamamen devre dışı bırakılması ölümcül olduğundan, bu boru hattı için en iyi yaklaşım olmaya devam etmektedir.
Enjeksiyon hacimlerinin bir gratikül kullanılarak kalibre edilmesi ve tek hücreli aşamada yumurta sarısı kesesine hassas bir şekilde verilmesi, yüksek hayatta kalma oranlarına sahip tutarlı Morpholino enjeksiyonları sağlar. Makrofaj tükenmesi için lipozomal klodronat enjeksiyonları (Klonozom) gibi alternatifler umut vaat etmiştir, ancak bu boru hattı için daha fazla doğrulama gerektirmektedir34,35.
Hücre hazırlığı
Yeterince yoğun ve canlı bir hücre popülasyonu, bu protokolde başarılı BCP-ALL genişlemesi için kritik öneme sahiptir. CellTrace Violet (CTV), 0 dpi'de implantasyon başarısını değerlendirmek ve deney boyunca proliferasyon oranlarını izlemek için floresan etiketleme için kullanılır. Diğer etiketlerin aksine, CTV hücre davranışını değiştirmez ve hassas tek hücre düzeyinde proliferasyon analizine izin verir. Bu, yalnızca proliferasyon sırasında hücreleri yakalayan, ancak hücre döngüsünden zaten çıkmış olan bölünmüş hücreleri yakalamayan Ki-67 antikor boyamasına göre avantajlar sunar.
CTV ayrıca hücre canlılığını yansıtmada CellTracker CM-DiI'den (DiI) daha iyi performans gösterir. DiI ve türevleri, genellikle hücre ölümünün ötesinde devam eden daha kararlı floroforlardır ve bu da deneysel sonuçları karıştırabilir2. Ek olarak, akış sitometrisine CD19'a karşı BCP-ALL'ye özgü bir antikorun dahil edilmesi, greft hücrelerinin kesin olarak tanımlanmasını sağlar. Anti-HLA gibi insana özgü antikorlar, diğer kanser hücresi tipleri için alternatif olarak hizmet edebilir36.
Kanser hücresi nakli
Tutarlı aşılama, hücre süspansiyonunun optimal seyreltilmesini ve konsantrasyonunu gerektirir. Süspansiyon, enjeksiyonu bozan viskoziteden kaçınırken yeterli yoğunluğu korumalıdır. Bu protokol, yolk kesesi üzerinden perikardiyal boşluğa veya perivitellin boşluğa (PVS) enjeksiyona öncelik verir, çünkü bu bölgeler daha iyi vaskülarizasyon ve daha az hipoksik koşullar sunar37. Yolk kesesi nakli, erişilebilir olmasına rağmen, genellikle yüksek mortalite oranları ve zayıf hücre canlılığı ile sonuçlanır21.
Mikropartiküller nedeniyle iğne tıkanması prosedürel bir zorluk olmaya devam etmektedir. Hücre süspansiyonunun filtrelenmesi ve tıkalı iğnelerin kırpılmasından sonra enjeksiyon hacimlerinin yeniden kalibre edilmesi önemli adımlardır. Sonraki ilaç tedavileri için sadece yoğun dolu perikardiya sahip embriyolar kullanılmalıdır21,36.
Önerilen 35 °C'lik kuluçka sıcaklığı, insan kanser hücrelerinin doğal sıcaklığını (37 °C) ve standart zebra balığı barınak sıcaklığını (28 °C) dengeler21. Zebra balığı embriyoları bu sıcaklığa minimal gelişimsel deformasyonlarla adapte olur ve çevre, hastadan elde edilen taze hücrelerin çoğalmasını ve hayatta kalmasını artırır38.
İlaç tedavisi
Zebra balığı ksenogreft modelleri, yüksek verimli ilaç taramasını kolaylaştırmak için geliştirilmiştir. Bununla birlikte, ilaç tedavisi, ZefiX testinin en zorlu yönlerinden biri olmaya devam etmektedir. Birçok standart bakım ilacı ve hedefe yönelik tedavi, in vivo olarak greft hücrelerine etkili bir şekilde ulaşmaz. Ayrıca daha büyük bir ilaç konsantrasyonları panelinin test edilmesini gerektirebilir. Venetoklaks ve dasatinib gibi başarılı örnekler, geleneksel 2D kültür tahlillerinden önemli ölçüde daha yüksek konsantrasyonlar gerektirir21.
Alternatif olarak, transplantasyondan önce hücrelerin in vitro olarak ön muamele edilmesi, belirli sistemik ve lokalize etkilerin incelenmesine de izin verir. Örneğin, bu yaklaşım glioblastoma39'da Adeno ilişkili virüs (AAV) bazlı tedaviler için uygun olabilir.
İlaç tedavisinin etkileri in vitro olarak gözlenirse ancak bu boru hattı kullanılarak in vivo değilse, örneğin 1k hücre aşamasına (3 hpf) veya blastula aşamasına nakil yapmak ve 24 hpf'de ilaç tedavisine başlamak bir alternatif olabilir40,41. Bu, 48 saatlik embriyolarda başarılı olamayan greft hücrelerine ilaçların ulaşmasına veya aynı anda25 hücre ve ilaçların birlikte enjekte edilmesine izin verebilir.
Dissosiyasyon ve akış sitometrisi analizi
Doku ayrışması, toplam greft hücre sayılarını analiz etmek ve deneysel sonuçları güvenilir bir şekilde yorumlamak için kritik öneme sahiptir. Mekanik ve enzimatik ayrışmanın bir kombinasyonu, hücre yüzeyi protein bütünlüğünü korurken yüksek kaliteli tek hücreli süspansiyon sağlar. Farklı kanser türleri için ayrışma koşullarının ayarlanması (örneğin, enzim bileşimi, pipetleme veya Dounce homojenizatör kullanma) gerekli olabilir.
Akış sitometresinin tıkanmasını önlemek için numuneler filtrelenmelidir ve yapışkan proteinler veya lipitler, ayrışmadan önce EDTA veya embriyo sarısı giderme ile hafifletilebilir.
Özet
ZefiX protokolü, klinik öncesi kanser araştırmaları, ilaç direnci çalışmaları ve kişiselleştirilmiş tedavi değerlendirmeleri için hızlı ve uygun maliyetli bir deneysel boru hattı sağlar. Zebra balığı ksenogreft modellerinin sınırlamaları vardır ve tüm ilaç türlerini barındıramazken, bu standardize protokol taze hasta lösemi hücrelerinin ve hücre hatlarının in vivo genişlemesine izin verir. Diğer kanser türleri için uyarlanabilir olup, klinik karar verme zaman çerçevesi içinde hızlı, kişiselleştirilmiş ilaç yanıtı tahmini için umut verici bir araç sunar.
Açıklamalar
Tüm yazarlar herhangi bir çıkar çatışması beyan etmez.
Teşekkürler
Bu çalışma, Deutsche Forschungsgemeinschaft (DFG, Alman Araştırma Vakfı) bünyesindeki Ortak Araştırma Merkezi CRC1588, 493872418 numaralı proje ve Dr. Kleist Stiftung, Berlin'in yanı sıra Deutsche José Carreras Leukämie Stiftung (R03/2016), Berliner Krebsgesellschaft (HEFF201633KK) ve Alman Kanser Konsorsiyumu (DKTK, Ortak Finansman Çağrısı 2016) tarafından desteklenmiştir. Julia Köppke ve Mareike Wolff'a el yazmasını eleştirel okumaları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Petri dish (10 cm) | Greiner | P7237 | |
| 7-AAD viability staining solution | Invitrogen | 00-6993-50 | |
| Agarose (LE, analytic grade) | Biozym | 840004 | |
| Air pressure injector | Narishige | IM400 | with external gas supply |
| Alexa Fluor 488 anti-human CD19 antibody | Biolegend | 302219 | |
| Annexin binding buffer | Biolegend | 422201 | Or see solutions for preparation |
| APC annexin V | Biolegend | 640941 | |
| Capillaries (10 cm, OD 1.0 mm, with filaments) | WPIINC | TW100F-4 | 1.0 OD; 0.75 ID |
| Cell culture flask (T-175) | Sarstedt | 83,39,12,002 | |
| CellTrace Violet | Invitrogen | C34557 | |
| Dimethyl sulphoxide (DMSO) | Roth | A994.1 | |
| Dispase II | Sigma Aldrich | D4693-1g | |
| DNase I | AppliChem GmbH | A3778 | |
| Eppendorf tubes (1.5 ml) | Eppendorf | 30120086 | |
| FACS tube (Polystyrene round botton Tube with Cell strainer Cap, 5 ml) | Falcon | 352235 | |
| Falcon tubes (50 ml) | Falcon | 352070 | |
| Fetal calf serum (FCS) | Sigma Aldrich | C8056 | |
| Fine mesh filter (10 µm) | PluriStrainer | 435001050 | |
| Fine mesh filter (20 µm) | PluriStrainer | 431002040 | |
| Flow cytometer | Becton Dickinson | BD LSRFortessa X-20 | |
| Fluorescent stereomicroscope | Leica | ||
| Fluorescent stereomicroscope with camera | Leica | M165 FC | Camera: DFC7000 T |
| Hank’s Balanced Salt Solution (HBSS, Calcium and Magnesium free ) | Sigma Aldrich | 88284 | |
| Injection mold (Zebrafish MI/Transplant KIT) | World Precision Instruments | Z-MOLDS | |
| Injection needles (without filament) | Biomedical instruments | VZIPbl-20-10-55 | Zebrafish injection pipette, blunt, OD: 20μm ± 1, TL:~10mm, PL: 55mm, Glass: BM100T-10P |
| Macro-centrifuge | Eppendorf | ||
| Micro-centrifuge | |||
| Morpholino (csf3r) | Gene Tools LLC | csf3r (GAAGCACAAGCGA GACGGATGCCA) | |
| Morpholino (spi1) | Gene Tools LLC | spi1(GATATACTGATAC TCCATTGGTGGT) | |
| Papain | Sigma Aldrich | P3125 | |
| Penicillin-Streptomycin (Penstrep; 10.000 U/ml) | Gibco | 15140122 | |
| Plates (4-well) | Greiner Bio one | 657160 | |
| Plates (96-well) | Greiner Bio one | 657180 | |
| Roswell Park Memorial Institute (RPMI) 1640 Medium | Gibco | 21875-034 | |
| Tricaine (MS-222) | Sigma Aldrich | E10521-50G | Ethy-3 aminobenzoate methanesulfenate |
Referanslar
- Fontana, C. M., Van Doan, H. Zebrafish xenograft as a tool for the study of colorectal cancer: a review. Cell Death Dis. 15, 1-12 (2024).
- Sturtzel, C., et al. Refined high-content imaging-based phenotypic drug screening in zebrafish xenografts. NPJ Precis Oncol. 7 (1), 1-16 (2023).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24, 2288 (2023).
- Gamble, J. T., Elson, D. J., Greenwood, J. A., Tanguay, R. L., Kolluri, S. K. The zebrafish xenograft models for investigating cancer and cancer therapeutics. Biology. 10 (4), 252 (2021).
- Costa, B., Estrada, M. F., Mendes, R. V., Fior, R. Zebrafish avatars towards personalized medicine-A comparative review between avatar models. Cells. 9 (2), 293 (2020).
- Wang, W., et al. Progress in building clinically relevant patient-derived tumor xenograft models for cancer research. Animal Model Exp Med. 6 (5), 381-398 (2023).
- Xiao, J., Glasgow, E., Agarwal, S. Zebrafish xenografts for drug discovery and personalized medicine. Trend Cancer. 6 (7), 569-579 (2020).
- Fazio, M., Ablain, J., Chuan, Y., Langenau, D. M., Zon, L. I. Zebrafish patient avatars in cancer biology and precision cancer therapy. Nat Rev Cancer. 20 (5), 263-273 (2020).
- Costa, B., et al. Zebrafish avatar-test forecasts clinical response to chemotherapy in patients with colorectal cancer. Nat Comm. 15 (1), 4771 (2024).
- Grissenberger, S., et al. Chapter 8 - Preclinical testing of CAR T cells in zebrafish xenografts. Method Cell Biol. 167, 133-147 (2022).
- Yan, C., et al. Single-cell imaging of T cell immunotherapy responses in vivo. J Exp Med. 218 (10), 20210314 (2021).
- Pascoal, S., et al. A preclinical embryonic zebrafish xenograft model to investigate CAR T cells in vivo. Cancers. 12 (3), 567 (2020).
- Pal, D., et al. Long-term in vitro maintenance of clonal abundance and leukaemia-initiating potential in acute lymphoblastic leukaemia. Leukemia. 30 (8), 1691-1700 (2016).
- Beneduce, G., et al. Blinatumomab in children and adolescents with relapsed/refractory B cell precursor acute lymphoblastic leukemia: A real-life multicenter retrospective study in seven AIEOP (Associazione Italiana di Ematologia e Oncologia Pediatrica) Centers. Cancers. 14 (2), 426 (2022).
- Xie, J., et al. Short-course blinatumomab for refractory/relapse precursor B acute lymphoblastic leukemia in children. Front Pediatr. 11, 1187607 (2023).
- Mengxuan, S., Fen, Z., Runming, J. Novel treatments for pediatric relapsed or refractory acute B-cell lineage lymphoblastic leukemia: Precision medicine era. Front Pediatr. 10, 923419 (2022).
- Howe, K. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Lee, H. C., Lin, C. Y., Tsai, H. J. Zebrafish, an in vivo platform to screen drugs and proteins for biomedical use. Pharmaceuticals. 14 (6), 500 (2021).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. J Clin Investigation. 122 (7), 2337-2343 (2012).
- Miao, K. Z., Kim, G. Y., Meara, G. K., Qin, X., Feng, H. Tipping the scales with zebrafish to understand adaptive tumor immunity. Front Cell Dev Biol. 9, 660969 (2021).
- Gauert, A., et al. Fast, in vivo model for drug-response prediction in patients with B-cell precursor acute lymphoblastic leukemia. Cancers. 12 (7), 1883 (2020).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. Mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), e49-e56 (2011).
- Pase, L., et al. Neutrophil-delivered myeloperoxidase dampens the hydrogen peroxide burst after tissue wounding in zebrafish. Current Biol. 22 (19), 1818-1824 (2012).
- Wijk, R. C. V., et al. Mechanistic and quantitative understanding of pharmacokinetics in Zebrafish larvae through nanoscale blood sampling and metabolite modeling of paracetamol. J Pharmacol Exp Ther. 371 (1), 15-24 (2019).
- Lázaro-Navarro, J., et al. Inhibiting casein kinase 2 sensitizes acute lymphoblastic leukemia cells to venetoclax via MCL1 degradation. Blood Advances. 5 (24), 5501 (2021).
- Rhodes, J., et al. Interplay of pu.1 and gata1 determines myelo-erythroid progenitor cell fate in zebrafish. Developmental Cell. 8 (1), 97-108 (2005).
- Zakaria, Z. Z., Eisa-Beygi, S., Benslimane, F. M., Ramchandran, R., Yalcin, H. C. Design and microinjection of Morpholino antisense oligonucleotides and mRNA into zebrafish embryos to elucidate specific gene function in heart dvelopment. J Vis Exp. (186), e63324 (2022).
- . ZFIN: Zebrafish Book: Contents Available from: https://zfin.org/zf_info/zfbook/cont.html (2025)
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Hasegawa, E. H., Gist H Farr, I. I. I., Maves, L. Comparison of pronase versus manual dechorionation of zebrafish embryos for small molecule treatments. J Dev Biol. 11 (2), 16 (2023).
- Wattrus, S. J., Zon, L. I. Stem cell safe harbor: the hematopoietic stem cell niche in zebrafish. Blood Adv. 2 (21), 3063-3069 (2018).
- Harvie, E. A., Huttenlocher, A. Neutrophils in host defense: new insights from zebrafish. J Leukocyte Biol. 98 (4), 523-537 (2015).
- Page, D. M., et al. An evolutionarily conserved program of B-cell development and activation in zebrafish. Blood. 122 (8), e1-e11 (2013).
- Nguyen-Chi, M., et al. TNF signaling and macrophages govern fin regeneration in zebrafish larvae. Cell Death Dis. 8 (8), e2979-e2979 (2017).
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Dis Models Mech. 13 (1), dmm041889 (2020).
- Rebelo de Almeida, C., et al. Zebrafish xenografts as a fast screening platform for bevacizumab cancer therapy. Comm Biol. 3 (1), 1-13 (2020).
- Pringle, E. S., et al. The zebrafish xenograft platform-A novel tool for modeling KSHV-associated diseases. Viruses. 12 (1), 12 (2020).
- Pype, C., et al. Incubation at 32.5 °C and above causes malformations in the zebrafish embryo. Reprod Toxicol. 56, 56-63 (2015).
- Xu, X., et al. Adeno-associated virus (AAV)-based gene therapy for glioblastoma. Cancer Cell Int. 21 (1), 76 (2021).
- Siebert, J., et al. Rhabdomyosarcoma xenotransplants in zebrafish embryos. Pediat Blood Cancer. 70 (1), e30053 (2023).
- van Bree, N., et al. Development of an orthotopic medulloblastoma zebrafish model for rapid drug testing. Neuro-Oncol. noae210, (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır