Method Article
在斑马鱼胚胎中使用白血病细胞移植 物进行体内 药物反应的快速预测
摘要
该方案提供了从细胞系和瞬时免疫抑制斑马鱼胚胎中的新鲜患者材料生成和排除人急性淋巴细胞白血病 (ALL) 异种移植物的分步说明,以及使用流式细胞术评估药物反应的指南。实验管道也可以适用于实体瘤。
摘要
斑马鱼异种移植是研究人类癌症发病机制和预测个体药物反应的关键技术。本文件介绍了一种简化的方案 (ZefiX),用于扩增原代 B 细胞前体急性淋巴细胞白血病 (BCP-ALL) 患者样本或瞬时免疫抑制斑马鱼胚胎中的永生化细胞系,利用流式细胞术对治疗反应进行高分辨率单细胞分析。与实体瘤植入相比,白血病细胞在测定过程中从基于吗啉反义寡核苷酸的巨噬细胞和中性粒细胞分化因子抑制中获益。解离的移植细胞的流式细胞术分析能够精确评估每个细胞处理后的细胞计数、增殖率和活力。这种方法已使用维奈托克和达沙替尼等靶向疗法进行了验证,治疗结果与相关患者样本和传统 2D 培养对照的临床记录进行了比较。值得注意的是,该方案在 7 天内完成,与临床决策时间表保持一致。该方法适用于测试各种癌症类型(包括实体瘤)中的选定药物,从而支持个性化的治疗策略。然而,应考虑可以评估的药物数量的限制,这可能是由于斑马鱼胚胎中的药代动力学限制。
引言
斑马鱼异种移植已成为了解癌症发病机制和预测药物反应的重要体内模型 1,2,3,4,5。动物模型对于临床前药物测试仍然至关重要,斑马鱼模型与其他体内系统相比具有显著优势,包括高通量和成本效益 6,7,8。 该模型还可以帮助个性化治疗反应预测,包括分子靶向治疗和 CAR-T 细胞疗法 9,10,11,12。
BCP-ALL 特别受益于斑马鱼异种移植,因为在培养物中扩增原代患者细胞仍然具有挑战性13。不可否认,ALL 需要新的治疗方法。尽管 BCP-ALL 患儿的缓解率高达 80%-85%,但复发或难治性疾病患者的长期生存率仅在约 30%-60 %14,15,16 之间。在这种情况下,使用拟议管道的药物测试可以整合到临床环境中,以确定最佳的患者特异性疗法14,15。在处理多种耐药性时,这种个性化方法至关重要,通过避免使用具有严重副作用的无效或次优药物,显着减轻患者的治疗负担。
几个特点使斑马鱼胚胎异种移植成为合适的模型。人类和斑马鱼之间的遗传相似性——70% 的遗传同源性和 84% 共享的疾病相关基因——支持基因-药物相互作用研究17。因此,使用转基因宿主胚胎可以揭示影响药物敏感性的遗传易感性18。或者,可以移植具有特定基因修饰的细胞,以评估药物敏感性或耐药性是否与 体外 结果一致。斑马鱼胚胎异种移植物还有助于了解药物的潜在全身效应。尽管 2-3 天大胚胎的器官发育尚未完全成熟,但器官已正确定位,并部分与成年胚胎共享细胞组成19。
该模型的其他优点包括植入只需要少量癌细胞,维持宿主胚胎很简单,因为在出生后的前 5 天内不需要喂养,并且由于胚胎的透明度和大小,可以快速评估注射成功。一个独特的特点是,在这个发育阶段只有先天免疫是活跃的,促进了有效的植入20。在此处描述的 ZefiX 方案中(参见图 1 中的摘要),通过使用靶向 spi1 和 csf3r 的稳定吗啉反义寡核苷酸在出生后的前 4 天内抑制先天免疫系统来进一步增强免疫缺陷,从而阻断巨噬细胞和中性粒细胞分化 21,22,23。
该方案也不同于以前的斑马鱼异种移植方案,后者主要是为实体瘤移植物开发的,通常使用基于整体成像的药物反应评估方法。ZefiX 针对液体癌细胞(如 BCP-ALL 细胞)进行了优化,并已成功用于扩增新鲜或新鲜冷冻的患者材料21。ZefiX 还可以通过选择合适的酶进行组织解离来适应贴壁癌细胞。
另一个主要优势是使用流式细胞术进行下游分析,它具有以下几个好处:(i) 可以快速处理大量移植细胞,从而可以在单细胞水平上进行稳健的统计分析,(ii) 可以同时评估单个细胞的增殖速率和活力,以及 (iii) 流式细胞仪在临床研究环境中通常可用, 能够在几个小时内在单个细胞水平上对移植细胞进行药物反应评估。为确保可重复性,该方案提供了从制备到移植再到流式细胞术分析的标准化管道,允许在一周内预测 ALL 细胞的药物反应。
研究方案
所有斑马鱼实验均符合柏林夏里特医学院实验医学研究所的指导方针和官方权威。所有研究都涉及受精后 6 天 (dpf) <斑马鱼胚胎,因此不受《动物保护法》的约束。斑马鱼 (Danio rerio) 根据标准方案在德国柏林柏林夏里特大学医学院的动物设施中饲养和饲养。将它们置于 28 °C 下,光照循环 14 小时,暗循环 10 小时。所有实验均使用 AB 或 TüLF 菌株的野生型鱼。
注:在应用 ZefiX 之前,为每种所需药物建立最佳治疗条件包括几个必要的步骤。首先,在常规 2D 培养系统中使用合适的细胞系确定每种药物的半数最大抑制浓度 (IC50)。根据以往的经验,ZefiX 治疗的有效药物浓度可能比在典型细胞培养条件下使用的药物浓度高 5 - 50 倍21,24。在处理移植胚胎之前,必须使用既定的浓度范围评估未移植宿主胚胎内的毒性。评估毒性后,将细胞系移植的胚胎暴露于各种药物浓度中,约为先前在 2D 培养中测定的 IC50 值的 50 倍。如果移植细胞对高达 100 倍 IC50 的剂量没有反应,则可能认为该药物对 ZefiX 无效。为了潜在地提高疗效,一种选择是在移植细胞移植到胚胎之前不久用药物预处理移植细胞25。有关此处使用的所有解决方案,请参见表 1。
1. 第 1 天:实验准备
- E3 培养基制备:制备 2 L 高压灭菌的 E3 培养基,用于胚胎维持。
- 吗啉代反义寡核苷酸 (MO) 制备:使用不含核酸酶的水,在 1.5 mL 微量离心管中制备含有两种 MO 的 50 μM 储备液。将储备溶液储存在室温 (RT) 下。通过将溶液在加热块上于 65 °C 孵育 10 分钟来准备用于注射的 MO。
注意:MO 针对 spi1 和 csf3r 以抑制巨噬细胞和中性粒细胞分化,如参考文献22、23、26 所述。 - 注射板的制备
- 要制备 4-5 块板,请将 1% 琼脂糖溶解在 E3 培养基中,制成 100 mL 溶液。对于移植板,将 ~20 mL 溶液倒入每个 10 cm 培养皿中,确保它们半满。旋转以均匀分布液体。
- 对于 Morpholino 注射板,将注射模具放在两个培养皿中的液体琼脂糖上,确保没有气泡形成。倾斜盖子盖住培养皿,然后将它们放在 RT 直到琼脂糖凝固。凝固后,取出模具并将板倒置在 4 °C 的密封塑料袋中。
- 注射针的制备
- 对于 Morpholino 注射:使用拔针器从 10 cm 毛细管生成针头并折断尖端,以达到 10 μm 的估计直径(如27 中所述)。
- 对于细胞移植:使用市售的外径为 20 μm 的预拉式平头注射针。
- 移植细胞培养:在第 4 天,在 T175 细胞培养瓶中,用补充有 10% FCS 和 1% P/S(RPMI 完全)的 RPMI 培养基分流细胞(例如 Nalm6),目标密度为 70%-80%。使用前将细胞分开 3-4 次,以确保适当的增殖速率。
注意:对于用于移植的新鲜或新鲜/冷冻患者材料的制备,可在步骤 4.3 中找到说明。然后在移植当天准备细胞。 - 斑马鱼繁殖:下午在繁殖池中设置野生型斑马鱼,将雄性和雌性分开。
注意:斑马鱼按照参考文献28 中的描述进行饲养和分级。时间参考(hpf 或 dpf)表示受精后的小时或天。
2. 第 2 天:吗啉
- 用 1% 青霉素/链霉素 (E3/P/S) 补充 500 mL 高压灭菌的 E3 培养基,并填充两个 10 cm 培养皿。将注射板从冰箱中取出,在 RT 下预热。
- 错开繁殖罐的大门,以便一次只能在一小部分水箱中进行受精(取决于注射速度),以确保在单细胞阶段及时将吗啡溶液显微注射到斑马鱼胚胎中 28,29。首先根据注射器的速度打开一个或两个门,当一批鸡蛋很容易注射时,打开另一个门或两个门,依此类推。
- 将受精卵分批转移至 100 个受精蛋中,并加入尽可能少的液体,并加入先前制作的注射板中。将胚胎对齐板的凹槽中。
- 在单细胞阶段29 期间,将 1 nL 的 50 μM 两种吗啡脂肪酸混合物注入细胞或细胞下方的卵黄囊中。为后续程序注射足够的卵子(例如,对于一个 96 孔板,最多注射 200 个卵子,以便有足够的备份以应对移植前可能丢失的情况)。
- 将注射的鸡蛋转移到含有 E3 / P/S 的培养皿中,将注射的鸡蛋在 28 °C 下孵育。 保留未注射的卵作为对照鱼,以 5 dpf 进行流式细胞术分析。将剩余的 E3/P/S 培养基储存在 4 °C。
3. 第 3 天:去绒毛
- 斑马鱼胚胎的去绒毛处理:当胚胎大于 24 hpf 时,使用两个精密镊子手动去绒毛处理29。
- 用巴斯德移液管从培养皿中取出任何没有心跳或运动且看起来不透明或形状不规则的胚胎的死胚胎。
- 用精密镊子捏住绒毛膜以将其固定到位。捏住精密镊子尖端的正旁,用第二个镊子将胚胎固定到位,然后小心地将绒毛膜拉开以释放胚胎
注意:要对小于 24 hpf 的胚胎进行去绒毛膜化,应将它们保存在琼脂糖涂层的培养皿中,以防止它们粘在塑料上。手动去绒毛是首选,因为它对胚胎更温和。另一种酶促去绒毛裂纹方法在其他地方描述30。
- 将去绒毛膜化的胚胎在 28 °C 下孵育过夜。
4. 第 4 天:异种移植和药物治疗
- 宿主胚胎的制备:从冰箱中取出准备好的琼脂糖板和 E3/P/S,让它们达到 RT。使用立体显微镜以 48 hpf 筛选胚胎进入适当的发育阶段。如其他地方所述,工作流程中仅包括适当分期和形态学典型的胚胎29。清点所有健康的胚胎并计划进一步的治疗。在28°C下,每10厘米培养皿保持不超过100个胚胎,以避免因缺氧而导致发育速度不均。
注意:按照步骤 4.2 进行作。用于细胞系。对于新鲜/冷冻材料,请直接执行步骤 4.3。 - 细胞系的制备
- 为了制备用于流式细胞术和移植的荧光标记的 BCP-ALL 细胞,用 1x PBS 洗涤细胞(从步骤 1.5 开始):以 350 x g 离心 5 分钟,然后重悬于 20 mL PBS 中。
- 计数细胞并将 3 x 105 个未染色的细胞转移到 FACS 管中,用于第 0 天(注射后 0 天,dpi)流式细胞术分析。储存在冰上。
- 将 3 x 105 个细胞接种在 3 mL RPMI 中,完全接种在 6 孔板的一个孔中,并保持在 37 °C 进行 3 dpi 控制。
- 将 1 x 107 个细胞转移到 15 mL 离心管中进行 CTV 标记。在 RT 下以 350 x g 离心 5 分钟,倒出上清液(其余部分使用移液器),然后将沉淀重悬于 2.5 mL PBS (RT) 和 1 μL CTV 储备溶液中。
- 在 37 °C 避光中孵育 5 分钟,用 12.5 mL RPMI 完全终止反应,然后在 37 °C 下避光孵育 10 分钟。
- 在 RT 下以 350 x g 离心 5 分钟,然后用 10 mL RPMI 完全洗涤一次。再次离心并重悬于 10 mL RPMI 完全培养基中。
- 使用 10 μm 过滤器以 350 x g 离心 5 分钟来过滤细胞。重悬沉淀,计数细胞,并将 3 x 105 个 CTV 标记的细胞转移到 FACS 管中。在 6 孔板的一个孔中接种 3x 10^5 个含有 3 mL RPMI 完全的细胞,并保持在 37°C 进行 3 dpi 增殖控制。将剩余细胞储存在冰上的 1 mL PBS 中直至移植。
- 新鲜/冷冻患者材料的制备
- 在 37 °C 下预热两个 15 mL 离心管,每个离心管含 10 mL RPMI-complete。 在 37 °C 水浴中解冻含有 5-10 x 106 个细胞的小瓶。
- 一旦只剩下少量冰,将细胞转移到装有预热培养基的离心管中。在 RT 下以 350 x g 离心 5 分钟,弃去上清液,并将沉淀重悬于预热的 RPMI -complete 的第二管中。
- 使用台盼蓝计数活细胞。将 1x 10^5 个细胞分装到 1,5 mL 离心管中,并在室温下以 350 x g 的速度将等分试样的细胞在 FACS 管中离心 5 分钟,弃去上清液并将沉淀重悬于 300 μL PBS 中。
- 将重悬的等分试样储存在冰上,作为流式细胞术分析的未处理对照。
注:如果样品量允许,请在培养物中保留未处理的对照,以便在第 7 天进行流式细胞术测量。 - 每 1 x 106 个细胞将 1 μL CTV 储备液加入 2.5 mL PBS (RT) 中。如果可用的细胞较少,请调整 CTV 储备液的体积。
- 将细胞与 CTV 在 37 °C 下避光孵育 5 分钟,加入 12.5 mL 预热 (37 °C) RPMI 完全终止反应,并在 37 °C 下避光孵育 10 分钟。
- 在 RT 下以 350 x g 离心细胞 5 分钟,然后用 10 mL RPMI 完全洗涤细胞一次。在 RT 下再次以 350 x g 离心 5 分钟,然后将细胞重悬于 10 mL RPMI 完全培养基中。
- 使用 10 μm 过滤器将细胞悬液过滤到新鲜的 50 mL 离心管中,并以 350 x g 离心 5 分钟。
- 不要丢弃上清液。重悬沉淀并计数细胞。将 3 x 105 个 CTV 标记的细胞转移到一个 FACS 管中。
- 在 RT 下以 350 x g 离心剩余细胞 5 分钟,并弃去上清液。将剩余细胞重悬于 1 mL PBS 中并储存在冰上直至用于移植。
注意:如果仍有足够的 CTV 阳性细胞,则可以将它们维持在平行于异种移植物的 2D 培养物中,以比较增殖率。
- 流式细胞术测量
注意:0 dpi 的流式细胞术应由第二个人进行,以尽量减少细胞在移植前在冰上停留的时间。在使用指定的染色面板(CTV、CD19-Alexa488、APC-Annexin V 和 7AAD)进行第一次流式细胞术测量之前,请按照制造商的说明进行补偿测试。- 按如下方式准备两个 FACS 管:管 1:未染色的对照细胞;试管 2:用 CTV、CD19、7AAD 和 Appendin 染色的细胞。
注:染色和标记:CellTrace Violet (CTV) 可识别标记的移植细胞与宿主鱼细胞,并在 3 天后评估增殖速率。CD19 抗体是一种细胞表面标志物,可作为识别人 BCP-ALL 移植细胞的附加标志物。对于其他癌症类型,可能需要替代标志物抗体。Annexin V 标记用于细胞活力评估的早期细胞凋亡。7AAD 标记晚期细胞凋亡或坏死,用于细胞活力评估。 - 在 RT 下以 350 x g 离心管(一个含有 CTV 染色的细胞,另一个含有未染色的细胞)5 分钟,并丢弃管 1 中的上清液。将沉淀重悬于 310 μL 膜联蛋白结合缓冲液 (ABB) 中。
- 试管 2:如下所述进行抗体和活力染色。
注:该染色方案针对 CD19 B 细胞染色进行了优化。对于用于标记不同细胞类型的其他人类抗体,该方案可能需要调整。- 将 98 μL ABB 添加到 Tube 2 中(含有 CTV 标记的细胞)。将 2 μL CD19-Alexa488 抗体(1:50 稀释)添加到添加的 98 μL ABB 中。搅拌均匀。
- 将混合物在 4 °C 下孵育 30 分钟,并加入 500 μL ABB 以终止反应。将试管在 4 °C 下以 350 x g 离心 5 分钟。 去除上清液并重复洗涤步骤。
- 将细胞沉淀重悬于 100 μL ABB 中,然后进行 7AAD 和 APC-Annexin V 染色。如下所述执行 7AAD 和 APC Annexin V 染色和流式细胞术测量。
- 向重悬的细胞中加入 5 μL 7AAD 和 5 μL APC-Annexin V。轻轻涡旋混合。将试管在 RT 下避光孵育 15 分钟。加入 200 μL ABB 以达到 310 μL 的最终体积。
- 在移植当天按以下顺序进行流式细胞术分析,以避免交叉污染:未染色的对照细胞(试管 1)、用 Alexa488-CD19、APC-Annexin V 和 7AAD 染色的 CTV 标记细胞(试管 2)。每个样本至少记录 10,000 个事件,以便进行充分分析。
- 按如下方式准备两个 FACS 管:管 1:未染色的对照细胞;试管 2:用 CTV、CD19、7AAD 和 Appendin 染色的细胞。
5. 移植
- 移植板:准备两个装满 E3/P/S 的 10 cm 培养皿,并置于 28 °C 的培养箱中至少 30 分钟以预热。
- 细胞制备:在 RT 下以 350 x g 离心细胞 5 分钟,弃去上清液并使用微量移液器去除任何残留液体。添加 PBS 以达到 20 μL 的最终体积。将浓缩的细胞悬液保存在冰上。
注意:在移植过程中,细胞在冰上停留的时间不应超过 2 小时。 - 移植针和宿主胚胎准备
- 使用玻璃巴斯德移液管将 25-30 个胚胎转移到含有 E3/P/S 的预热培养皿之一中作为对照。使用微型装载器尖端将 4 μL 细胞悬液加载到移植针中。
注意:加载应在 1-2 分钟内顺利进行。如果不是这种情况,请小心地向细胞悬液中添加更多 PBS。 - 通过调整显微注射器校准注射压力和脉冲长度。调整直至一次注射排出大约 1,000 个 ALL 细胞或 2 nL 细胞悬液(20 μL 中 1x 107 个细胞)。要估计 1,000 个细胞,将一体积的悬浮液排出到覆盖有培养基的琼脂糖表面上。在小区域中计数 100 个细胞,推断它们的分布到总细胞群,并估计总数。
- 制备 50 mL 含有三卡因的 E3(终浓度:80 mg/L)。将宿主胚胎转移到三卡因溶液中并孵育至少 2 分钟,以确保适当的麻醉。当没有观察到运动反应时,胚胎被适当麻醉
注意:可以使用微型装载器尖端或镊子小心地接近和/或触摸胚胎。 - 将 15-20 个去绒毛膜的胚胎转移到琼脂糖包被的注射皿(参见前面的制备说明)上,使用尽可能少的液体,以防止胚胎滑落。
- 如图 2A 所示排列胚胎。将大约 1,000 个 CTV 阳性 BCP-ALL 细胞注射到心包腔中。如图 2B 所示,从背尾方向以 45° 角引入针头以注射细胞。
注:使用市售的开口直径为 20 μm 的预拉式钝头针,专为小白血病细胞设计(参见材料列表)。如果针头堵塞,请根据需要修剪它,但之后重新校准注射体积和细胞计数。 - 注射所有 15-20 个胚胎后,将它们转移到装有 E3/P/S 的预热培养皿中并保持在 28 °C。
- 重复这些步骤,直到移植大约 100 - 150 个胚胎进行一次药物治疗测定,其中应包括三种药物浓度和一种对照。
- 在开始药物治疗之前,将移植的胚胎和非移植的对照在 28 °C 下孵育 1-3 小时。
- 使用玻璃巴斯德移液管将 25-30 个胚胎转移到含有 E3/P/S 的预热培养皿之一中作为对照。使用微型装载器尖端将 4 μL 细胞悬液加载到移植针中。
- 体内 药物治疗(96 孔板)
- 使用荧光立体显微镜,筛选胚胎以确认成功植入(图 2C)。确保蛋黄完好无损,因为蛋黄环境可能对移植细胞有毒21。丢弃卵黄中带有细胞的胚胎。
- 为每种药物条件准备 2.5 mL 的 2x 浓缩溶液,以便在含有 0.5% DMSO 的 E3/P/S 中进行测试。此外,制备含有 0.5% DMSO 的 E3/P/S 的 5 mL 载体对照溶液。
- 向 96 孔板的每个孔中加入 100 μL 的 E3/P/S + 0.5% DMSO。此步骤可防止在孔之间意外转移最小剂量的药物。
- 小心地将一个植入的胚胎转移到每个孔中。使用玻璃巴斯德移液器在尽可能少的 E3 培养基中拾取每个胚胎。
- 轻轻倾斜移液器,让胚胎沉入移液器吸头底部,然后使用毛细管力将其释放到孔中。转移过程中避免接触孔中的介质。
- 向板中加入药物溶液:用 100 μL 载体对照溶液或三种 2x 浓缩药物溶液中的一种填充 96 孔板的 24 个孔(2 行)。
注:必须在针对每种被测药物的先前实验中确定有效药物浓度。 - 将胚胎在 35 °C 下维持 72 小时,包括未移植的胚胎,这将作为第 7 天流式细胞术分析的对照。
6. 第 7 天
- 胚胎/移植物解离
- 使用立体显微镜筛选 96 孔板,以识别和选择健康的斑马鱼胚胎。将来自每种条件的 10 个健康宿主胚胎随机混合到 1.5 mL 微量离心管中(理想情况下,每种条件 2 个试管)。
- 从每个含有胚胎的试管中去除尽可能多的液体,并通过在冰上孵育试管 1 小时通过低温休克牺牲胚胎。
- 向每个试管中加入 500 μL 不含钙和镁的 Hank 平衡盐溶液 (HBSS)。使用 200 μL 微量移液器吸头研磨,机械解离胚胎和移植细胞,上下移液约 15 次。
- 通过在 RT 下以 350 x g 离心 5 分钟来沉淀组织片段。同时,准备带有 35 μm 细网过滤器过滤器帽的 FACS 管,每个条件含有 2 mL PBS(总共 4 管)。
- 将每个沉淀重悬于 500 μL 酶混合物(0.01% 木瓜蛋白酶、0.1% 分散酶 II、0.01% 脱氧核糖核酸酶 I 和 12.4 mM MgSO4 在不含钙和镁的 HBSS 中)进行酶解离。在 RT 孵育 15 分钟。
- 在孵育过程中,每隔 5 分钟重复用同一移液器吸头吸取混合物,以避免组织损失。
- 流式细胞术测量
- 将解离的细胞转移到 FACS 管的 35 μm 细网过滤器过滤器帽中,并以 350 x g 离心 5 分钟。
- 离心时,制备用于 CD19 B 细胞表面染色的预混液。针对每种情况,将 98 μL ABB 与 2 μL Alexa Fluor 488 抗人 CD19 抗体混合。
- 弃去解离的细胞沉淀物中的上清液,并将沉淀重悬于 100 μL CD19 染色预混液中。
- 对所有 ZefiX 样品执行 CD19、7AAD 和 APC 膜联蛋白 V 染色方案,包括来自平行细胞培养物的 3 x 105 个 CTV 阳性细胞(如果可用)。
- 按照顺序进行流式细胞术分析,并记录 表 2 中概述的事件数。尽可能完整地运行所有包含宿主细胞和移植细胞的样品,以评估移植细胞总数。
- 使用商业软件分析结果。
- 细胞培养样品的设门策略:打开软件并将 FCS 文件加载到工作区中。使用 CD19 和 CTV 创建点图,以确保信号重叠并确认癌细胞的存在。接下来,使用 FSC-A (x 轴) 和 SSC-A (y 轴) 创建点图,以区分完整细胞 (Q2) 和碎片 (Q4; 图 3A')。
- 使用完整细胞群创建带有 SSC-H(x 轴)和 SSC-A(y 轴)的新图,以识别单个细胞(图 3A'')。
- 使用单细胞群创建另一个带有 Annexin V(x 轴)和 7AAD(y 轴)的点图(图 3A''')。将细胞分为四个群体:活细胞:膜联蛋白 V 阴性、7AAD 阴性 (Q4);早期凋亡细胞:膜联蛋白 V 阳性,7AAD 阴性 (Q3);晚期凋亡/坏死细胞:膜联蛋白 V 阳性,7AAD 阳性 (Q2);坏死细胞:膜联蛋白 V 阴性,7AAD 阳性 (Q1)。
- 对 3 dpi 样品重复这些步骤(图 3B)。
- 移植物和宿主胚胎细胞的设门策略
- 使用带有 CTV(x 轴)和 CD19(y 轴)的点图将人移植细胞与宿主细胞分开。鉴定并分离 CTV/CD19 双阳性移植细胞(图 3C)。
- 将适用于 3 dpi 培养细胞的相同门控策略(图 3B' - B''')应用于移植细胞群。复制门控策略以保持一致性。
- 将所有 Annexin V 和 7AAD 阴性细胞群合并到一个直方图中,其中 CTV 值在 x 轴上(图 3D)。计算所有五个样品的几何平均值以确定增殖速率。
- 治疗反应评估的计算
- 要确定 3 天后的细胞分裂次数,请使用以下公式:
n = 对数2 (I0/I)
其中,I0 = 初始 CTV 荧光强度(几何平均值,0 dpi),I = 72 小时时的 CTV 荧光强度,n = 细胞分裂次数。
示例:新鲜冷冻的患者细胞在 ZefiX log 2 中分裂2.6 倍 (88317/14644) = 2.6
和 2.8 倍的 2D 培养 log2 (88317/12992) = 2.8 - 为了确定 3 天后每条鱼的移植细胞总数,将癌细胞的总数(包括凋亡细胞,但不包括碎片)除以样本中汇集的鱼的数量(通常 n = 10)。
- 要确定 3 天后 CTV 阳性移植细胞的活力,请使用以下公式:
V = (C/100) x A
其中:V = 活力,C = 无碎片的完整单细胞的分数(百分比),A = 膜联蛋白 V 和 7AAD 阴性细胞的分数(百分比)。
- 要确定 3 天后的细胞分裂次数,请使用以下公式:
结果
有关 ZefiX 方案的详细科学评估,包括新鲜冷冻原代 BCP-ALL 细胞样品的异种移植和药物治疗,请参阅先前发表的手稿21。作为附加研究的一部分,当地医学研究伦理委员会批准了 ALL-REZ BFM 2002 试验 (NCT00114348) 和 ALL-REZ BFM 登记和生物样本库 (EA2/055/12) 以及国家当局的 IntReALL SR 2010 国际试验 (NCT01802814) 的附加研究。通过患者和/或其监护人参加的相应试验或登记处获得知情同意。
图 2 说明了注射前琼脂糖培养皿中胚胎对齐的示例,这有助于简化注射过程。注射应以所描绘的角度进行,以精确针对发育中的心脏周围的腔。此外, 图 2C 提供了成功注射 2 个含有人类移植细胞(蓝色)的 dpf 胚胎的参考,这些胚胎在注射前用 CTV 标记。注射结果与 图 2C 所示不同的胚胎被排除在外,特别注重避免卵黄囊穿孔,以确保在随后的三天孵育期间移植细胞活力。
在三天的孵育期之后,将宿主胚胎在 10 个的池中处理以进行流式细胞术分析。酶解离后,用抗人 CD19 抗体和两种活力标志物对细胞悬液进行染色:用于早期凋亡细胞的 Annexin V 和用于晚期凋亡和坏死细胞的 7AAD。
图 3 显示了 BCP-ALL 患者的 ZefiX 扩增 BCP-ALL 细胞的流式细胞术数据。图 A、A'、A'' 和 A''' 显示了移植当天在 0 dpi 下收集的数据。 图 3A 显示了总共 10,000 个细胞的 CTV 和 CD19 荧光值,作为在 3 dpi 下应用于宿主移植细胞悬液的门控策略的参考(图 3C)。在 图 3A' 中,通过使用前向散射区 (FSC-A) 和侧向散射区 (SSC-A) 对细胞进行定期门控来排除碎片。在 图 3A'' 中,使用 SSC 高度 (SSC-H) 与 SSC-A 的图表将单个细胞与双合体分离。该单细胞群用于 图 3A''' 中的活力评估,其中活细胞 (Q4) 与早期凋亡细胞(Q3,较高的膜联蛋白 V 值)和晚期凋亡或坏死细胞(Q2,较高的 7AAD 水平)区分开来。
为了进行比较,在常规 2D 条件下培养的患者细胞也在三天后通过流式细胞术进行分析(图 3B,B',B'',B''),遵循相同的门控策略。根据 图 2B' 中的 Q2 和 图 2B 中的 Q4 计算 2D 培养 72 小时后患者细胞的活力:(95.0%/100)*61.9% = 58.8%。
在 图 3C 中,起始材料是来自含有移植细胞的宿主胚胎的细胞悬液。与体外测量不同,试管中的所有细胞都通过流式细胞术进行分析。对 CD19 和 CTV 阳性移植细胞进行门控,以将它们与 CD19 和 CTV 阴性的鱼细胞分开。在 图 3C' 中进一步分析完整的移植细胞群,其中排除了碎片。然后使用与 图 3B 相同的门控策略评估单个移植细胞的活力。
结果表明,在胚胎中扩增的活单细胞的百分比为 95.2%,比培养皿中培养的细胞活力高 1.6 倍(图 3B''')。通过分析每个群体中 CTV 荧光强度从 0 dpi 到 3 dpi 的降低,计算体内和体外细胞分裂率(图 3D)。使用第 6.4.1 节中的公式和每条 CTV 曲线的几何平均值确定细胞分裂的数量(图 3D)。计算的分裂速率(体内 2.59 次分裂和体外 2.77 次分裂)表明,在两种条件下,活细胞在三天内以相似的分裂速率分裂。
最后,通过将完整移植细胞的数量(不包括碎片, 图 3C')除以管中汇集的胚胎数量来确定三天后每个胚胎的完整移植细胞的平均数量21.
总之,与培养皿中的常规培养物相比,植入斑马鱼胚胎中的新鲜 BCP-ALL 样品在三天后表现出更高的活力,并且活细胞在两种条件下以相当的速率分裂。
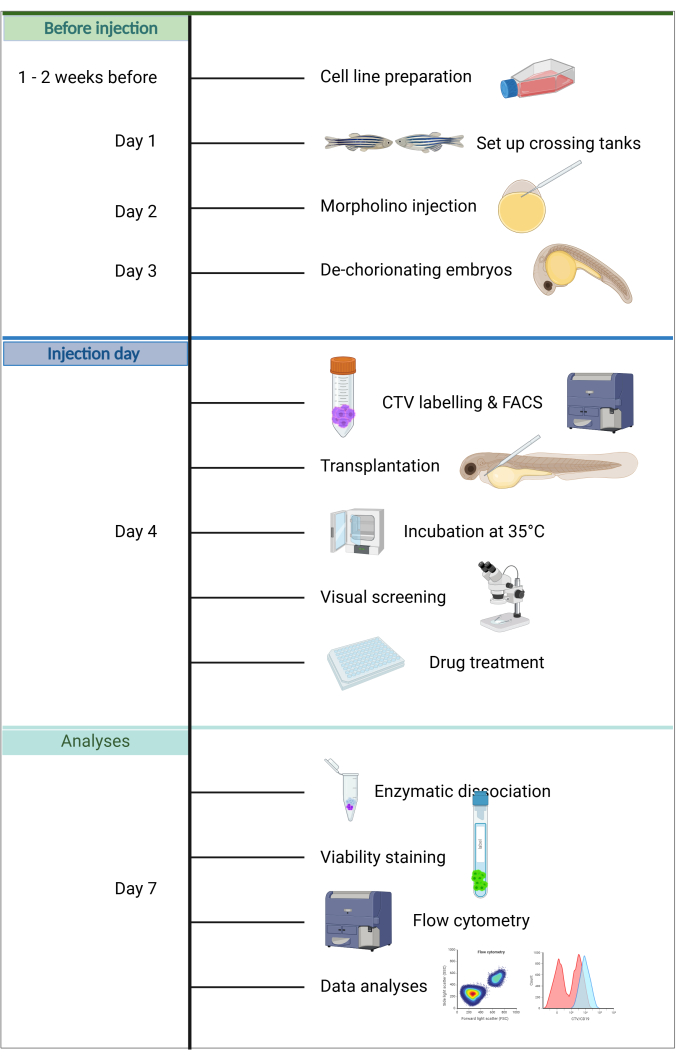
图 1.ALL-ZefiX 管道的工作流程。 创建于 https://BioRender.com。请单击此处查看此图的较大版本。
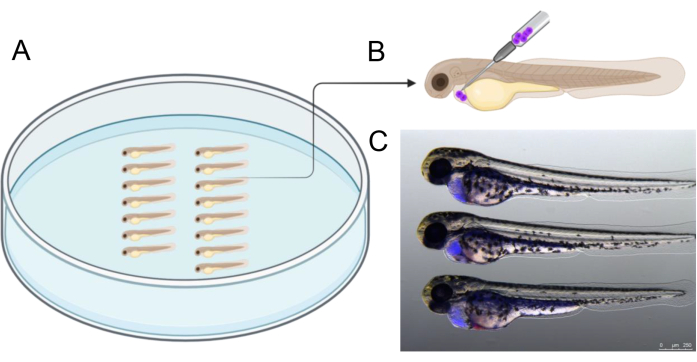
图 2:注射安排。 (A) 如图所示排列胚胎有助于注射。可以使用镊子或 20 μL 微量进样器移液器吸头(将吸头切割成 2.5 - 3 cm 长)来排列胚胎。(B) 将细胞移植到 2 个 dpf 胚胎心包的推荐注射角度的示意图。(C) 正确估计移植癌细胞数量的视觉辅助工具。这张图片显示了注射后 3 小时的 48 hpf 胚胎,之前用 CellTrace Violet 标记的人类癌细胞。创建于 https://BioRender.com。请单击此处查看此图的较大版本。

图 3:斑马鱼胚胎植入 2D 培养后,患者来源的分离 BCP-ALL 原始细胞新鲜冷冻样本的门控策略和流式细胞术分析。 (一、二)培养前用 CellTrace Violet (CTV) 标记患者细胞。在流式细胞术分析之前,将细胞在 37 °C 的组织培养塑料上培养 0 小时 (A) 或 72 小时 (B)。(C) 用 CTV 标记并在 35 °C 下作为移植物在宿主斑马鱼胚胎中生长 72 小时的患者细胞。在单细胞解离之前,将一组 10 个胚胎合并用于流式细胞术分析。应用 (B) 中的设门策略,鉴定和定量活的移植细胞组分。为此,将 CTV 阳性移植细胞 (Q2) 与自发荧光斑马鱼细胞 (Q1/4) 分离,以分选出移植细胞群进行分析。分析该移植细胞群中的 CTV 标记强度。(D) 仅来自活细胞选择的细胞计数和 CTV 标记的平均强度。注意 3 天后 CTV 强度的变化 (3 dpi)。 请单击此处查看此图的较大版本。
表 1:使用的解决方案表。请点击此处下载此表格。
表 2:通过流式细胞术测量的样品。请点击此处下载此表格。
讨论
斑马鱼胚胎由于其高通量和成本效益,已成为药物筛选和癌症研究中越来越受欢迎的异种移植模型。这些异种移植物有望成为转化医学的关键支柱,有助于临床前研究和决策 9,21。然而,与实体瘤移植物的广泛工作相比,用于人类白血病细胞扩增和治疗的斑马鱼异种移植模型仍然代表性不足。该方案为在白血病研究中利用斑马鱼异种移植物提供了详细的指导,同时保持对实体瘤的适应性。
实现一致的癌细胞移植可能具有挑战性,这凸显了标准化分析和更高统计可靠性的需求。该方案通过提供用于制备、移植和下游流式细胞术分析的综合管道以及故障排除建议来解决这些问题。
用于瞬时免疫抑制的吗啉代注射液
斑马鱼胚胎在发育的最初几天依赖于其先天免疫系统,这定义了这个实验管道的时间框架20。原始巨噬细胞出现在 12 hpf 左右,其中一些通过 33 hpf 20,31,32 分化为中性粒细胞。T 细胞在受精后约 8 天进入循环20,33。巨噬细胞和中性粒细胞作为先天免疫反应的一部分,与在先前的研究中观察到的移植后 3 天的 BCP-ALL 细胞存活率降低有关21。
吗啉代介导的颞免疫抑制,靶向 spi1 和 csf3r,有效抑制巨噬细胞和中性粒细胞分化,从而改善 BCP-ALL 细胞的植入,而不影响胚胎活力21。虽然这种方法不能实现永久耗竭,因为 spi1 和 csf3r 的完全敲除是致命的,但它仍然是该管道的最佳方法。
使用刻度校准注射体积,并在单细胞阶段精确输送到卵黄囊中,确保 Morpholino 注射的一致性和高存活率。用于巨噬细胞耗竭的脂质体氯膦酸盐注射 (Clodrosome) 等替代品已显示出前景,但需要进一步验证该管道34,35。
细胞制备
在该方案中,足够密集和有活力的细胞群对于成功扩增 BCP-ALL 至关重要。CellTrace Violet (CTV) 用于荧光标记,以评估 0 dpi 下的植入成功率,并在整个实验过程中跟踪增殖速率。与其他标记不同,CTV 不会改变细胞行为,因此可以进行精确的单细胞水平增殖分析。与 Ki-67 抗体染色相比,这具有优势,Ki-67 抗体染色仅捕获增殖过程中的细胞,而不捕获已经退出细胞周期的分裂细胞。
CTV 在反映细胞活力方面也优于 CellTracker CM-DiI (DiI)。DiI 及其衍生物是更稳定的荧光团,通常在细胞死亡后仍然存在,这可能会混淆实验结果2。此外,在流式细胞术中加入针对 CD19 的 BCP-ALL 特异性抗体能够精确识别移植细胞。人类特异性抗体(如抗 HLA)可以作为其他癌细胞类型的替代品36。
癌细胞移植
一致的植入需要细胞悬液的最佳稀释和浓度。悬浮液应保持足够的密度,同时避免影响注射的粘度。该方案优先注射到心包腔或卵黄周围间隙 (PVS) 而不是卵黄囊中,因为这些部位提供更好的血管形成和更少的缺氧条件37。卵黄囊移植虽然可及,但通常会导致高死亡率和较差的细胞活力21。
由于微粒引起的针头堵塞仍然是一个程序上的挑战。过滤细胞悬液并在修剪堵塞的针头后重新校准注射体积是必不可少的步骤。只有心包致密的胚胎才应用于后续药物治疗21,36。
建议的 35 °C 孵育温度平衡了人类癌细胞的自然温度 (37°C) 和斑马鱼的标准饲养温度 (28 °C)21。斑马鱼胚胎以最小的发育变形适应这种温度,并且环境增强了新鲜患者来源细胞的增殖和存活38。
药物治疗
开发斑马鱼异种移植模型以促进高通量药物筛选。然而,药物治疗仍然是 ZefiX 检测最具挑战性的方面之一。许多标准护理药物和靶向疗法在体内无法有效到达移植细胞。它可能还需要测试更大的药物浓度组。成功的例子,如维奈托克和达沙替尼,需要的浓度明显高于传统的 2D 培养测定21。
或者,在移植前对细胞进行体外预处理也可以研究某些全身和局部效应。例如,这种方法可能适用于胶质母细胞瘤39 中基于腺相关病毒 (AAV) 的治疗。
如果使用此管道在体外观察到药物治疗的效果,但在体内未观察到药物治疗的效果,则另一种方法是,例如,移植到 1k 细胞期 (3 hpf) 或囊胚期,并在 24 hpf40,41 开始药物治疗。这可能允许药物到达在 48 小时老胚胎中不成功的移植细胞或同时共同注射细胞和药物25。
解离和流式细胞术分析
组织解离对于分析移植物细胞总数和可靠地解释实验结果至关重要。机械解离和酶解离相结合,确保高质量的单细胞悬液,同时保持细胞表面蛋白质的完整性。对于不同的癌症类型,可能需要调整解离条件(例如,酶组成、移液或使用 Dounce 匀浆器)。
应过滤样品以防止流式细胞仪堵塞,并且在解离前可以通过 EDTA 或胚胎脱脂来减轻粘性蛋白质或脂质。
总结
ZefiX 方案为临床前癌症研究、耐药研究和个性化治疗评估提供了快速且经济高效的实验管道。虽然斑马鱼异种移植模型存在局限性并且无法适应所有药物类型,但这种标准化方案允许新鲜患者白血病细胞和细胞系的 体内 扩增。它适用于其他癌症类型,为在临床决策时间范围内快速、个性化地预测药物反应提供了一种有前途的工具。
披露声明
所有作者均声明无利益冲突。
致谢
这项工作得到了 CRC1588 合作研究中心内德国研究基金会 (DFG,德国研究基金会) 的支持,项目编号为 493872418 和柏林 Kleist 博士基金会,以及德国 José Carreras Leukämie 基金会 (R03/2016)、柏林 Krebsgesellschaft (HEFF201633KK) 和德国癌症联盟 (DKTK,联合资助电话 2016)。我们感谢 Julia Köppke 和 Mareike Wolff 对手稿的批判性阅读。
材料
| Name | Company | Catalog Number | Comments |
| Petri dish (10 cm) | Greiner | P7237 | |
| 7-AAD viability staining solution | Invitrogen | 00-6993-50 | |
| Agarose (LE, analytic grade) | Biozym | 840004 | |
| Air pressure injector | Narishige | IM400 | with external gas supply |
| Alexa Fluor 488 anti-human CD19 antibody | Biolegend | 302219 | |
| Annexin binding buffer | Biolegend | 422201 | Or see solutions for preparation |
| APC annexin V | Biolegend | 640941 | |
| Capillaries (10 cm, OD 1.0 mm, with filaments) | WPIINC | TW100F-4 | 1.0 OD; 0.75 ID |
| Cell culture flask (T-175) | Sarstedt | 83,39,12,002 | |
| CellTrace Violet | Invitrogen | C34557 | |
| Dimethyl sulphoxide (DMSO) | Roth | A994.1 | |
| Dispase II | Sigma Aldrich | D4693-1g | |
| DNase I | AppliChem GmbH | A3778 | |
| Eppendorf tubes (1.5 ml) | Eppendorf | 30120086 | |
| FACS tube (Polystyrene round botton Tube with Cell strainer Cap, 5 ml) | Falcon | 352235 | |
| Falcon tubes (50 ml) | Falcon | 352070 | |
| Fetal calf serum (FCS) | Sigma Aldrich | C8056 | |
| Fine mesh filter (10 µm) | PluriStrainer | 435001050 | |
| Fine mesh filter (20 µm) | PluriStrainer | 431002040 | |
| Flow cytometer | Becton Dickinson | BD LSRFortessa X-20 | |
| Fluorescent stereomicroscope | Leica | ||
| Fluorescent stereomicroscope with camera | Leica | M165 FC | Camera: DFC7000 T |
| Hank’s Balanced Salt Solution (HBSS, Calcium and Magnesium free ) | Sigma Aldrich | 88284 | |
| Injection mold (Zebrafish MI/Transplant KIT) | World Precision Instruments | Z-MOLDS | |
| Injection needles (without filament) | Biomedical instruments | VZIPbl-20-10-55 | Zebrafish injection pipette, blunt, OD: 20μm ± 1, TL:~10mm, PL: 55mm, Glass: BM100T-10P |
| Macro-centrifuge | Eppendorf | ||
| Micro-centrifuge | |||
| Morpholino (csf3r) | Gene Tools LLC | csf3r (GAAGCACAAGCGA GACGGATGCCA) | |
| Morpholino (spi1) | Gene Tools LLC | spi1(GATATACTGATAC TCCATTGGTGGT) | |
| Papain | Sigma Aldrich | P3125 | |
| Penicillin-Streptomycin (Penstrep; 10.000 U/ml) | Gibco | 15140122 | |
| Plates (4-well) | Greiner Bio one | 657160 | |
| Plates (96-well) | Greiner Bio one | 657180 | |
| Roswell Park Memorial Institute (RPMI) 1640 Medium | Gibco | 21875-034 | |
| Tricaine (MS-222) | Sigma Aldrich | E10521-50G | Ethy-3 aminobenzoate methanesulfenate |
参考文献
- Fontana, C. M., Van Doan, H. Zebrafish xenograft as a tool for the study of colorectal cancer: a review. Cell Death Dis. 15, 1-12 (2024).
- Sturtzel, C., et al. Refined high-content imaging-based phenotypic drug screening in zebrafish xenografts. NPJ Precis Oncol. 7 (1), 1-16 (2023).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24, 2288(2023).
- Gamble, J. T., Elson, D. J., Greenwood, J. A., Tanguay, R. L., Kolluri, S. K. The zebrafish xenograft models for investigating cancer and cancer therapeutics. Biology. 10 (4), 252(2021).
- Costa, B., Estrada, M. F., Mendes, R. V., Fior, R. Zebrafish avatars towards personalized medicine-A comparative review between avatar models. Cells. 9 (2), 293(2020).
- Wang, W., et al. Progress in building clinically relevant patient-derived tumor xenograft models for cancer research. Animal Model Exp Med. 6 (5), 381-398 (2023).
- Xiao, J., Glasgow, E., Agarwal, S. Zebrafish xenografts for drug discovery and personalized medicine. Trend Cancer. 6 (7), 569-579 (2020).
- Fazio, M., Ablain, J., Chuan, Y., Langenau, D. M., Zon, L. I. Zebrafish patient avatars in cancer biology and precision cancer therapy. Nat Rev Cancer. 20 (5), 263-273 (2020).
- Costa, B., et al. Zebrafish avatar-test forecasts clinical response to chemotherapy in patients with colorectal cancer. Nat Comm. 15 (1), 4771(2024).
- Grissenberger, S., et al. Chapter 8 - Preclinical testing of CAR T cells in zebrafish xenografts. Method Cell Biol. 167, 133-147 (2022).
- Yan, C., et al. Single-cell imaging of T cell immunotherapy responses in vivo. J Exp Med. 218 (10), 20210314(2021).
- Pascoal, S., et al. A preclinical embryonic zebrafish xenograft model to investigate CAR T cells in vivo. Cancers. 12 (3), 567(2020).
- Pal, D., et al. Long-term in vitro maintenance of clonal abundance and leukaemia-initiating potential in acute lymphoblastic leukaemia. Leukemia. 30 (8), 1691-1700 (2016).
- Beneduce, G., et al. Blinatumomab in children and adolescents with relapsed/refractory B cell precursor acute lymphoblastic leukemia: A real-life multicenter retrospective study in seven AIEOP (Associazione Italiana di Ematologia e Oncologia Pediatrica) Centers. Cancers. 14 (2), 426(2022).
- Xie, J., et al. Short-course blinatumomab for refractory/relapse precursor B acute lymphoblastic leukemia in children. Front Pediatr. 11, 1187607(2023).
- Mengxuan, S., Fen, Z., Runming, J. Novel treatments for pediatric relapsed or refractory acute B-cell lineage lymphoblastic leukemia: Precision medicine era. Front Pediatr. 10, 923419(2022).
- Howe, K. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Lee, H. C., Lin, C. Y., Tsai, H. J. Zebrafish, an in vivo platform to screen drugs and proteins for biomedical use. Pharmaceuticals. 14 (6), 500(2021).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. J Clin Investigation. 122 (7), 2337-2343 (2012).
- Miao, K. Z., Kim, G. Y., Meara, G. K., Qin, X., Feng, H. Tipping the scales with zebrafish to understand adaptive tumor immunity. Front Cell Dev Biol. 9, 660969(2021).
- Gauert, A., et al. Fast, in vivo model for drug-response prediction in patients with B-cell precursor acute lymphoblastic leukemia. Cancers. 12 (7), 1883(2020).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. Mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), e49-e56 (2011).
- Pase, L., et al. Neutrophil-delivered myeloperoxidase dampens the hydrogen peroxide burst after tissue wounding in zebrafish. Current Biol. 22 (19), 1818-1824 (2012).
- Wijk, R. C. V., et al. Mechanistic and quantitative understanding of pharmacokinetics in Zebrafish larvae through nanoscale blood sampling and metabolite modeling of paracetamol. J Pharmacol Exp Ther. 371 (1), 15-24 (2019).
- Lázaro-Navarro, J., et al. Inhibiting casein kinase 2 sensitizes acute lymphoblastic leukemia cells to venetoclax via MCL1 degradation. Blood Advances. 5 (24), 5501(2021).
- Rhodes, J., et al. Interplay of pu.1 and gata1 determines myelo-erythroid progenitor cell fate in zebrafish. Developmental Cell. 8 (1), 97-108 (2005).
- Zakaria, Z. Z., Eisa-Beygi, S., Benslimane, F. M., Ramchandran, R., Yalcin, H. C. Design and microinjection of Morpholino antisense oligonucleotides and mRNA into zebrafish embryos to elucidate specific gene function in heart dvelopment. J Vis Exp. (186), e63324(2022).
- ZFIN: Zebrafish Book: Contents. , https://zfin.org/zf_info/zfbook/cont.html (2025).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Hasegawa, E. H., Gist H Farr, I. I. I., Maves, L. Comparison of pronase versus manual dechorionation of zebrafish embryos for small molecule treatments. J Dev Biol. 11 (2), 16(2023).
- Wattrus, S. J., Zon, L. I. Stem cell safe harbor: the hematopoietic stem cell niche in zebrafish. Blood Adv. 2 (21), 3063-3069 (2018).
- Harvie, E. A., Huttenlocher, A. Neutrophils in host defense: new insights from zebrafish. J Leukocyte Biol. 98 (4), 523-537 (2015).
- Page, D. M., et al. An evolutionarily conserved program of B-cell development and activation in zebrafish. Blood. 122 (8), e1-e11 (2013).
- Nguyen-Chi, M., et al. TNF signaling and macrophages govern fin regeneration in zebrafish larvae. Cell Death Dis. 8 (8), e2979-e2979 (2017).
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Dis Models Mech. 13 (1), dmm041889(2020).
- Rebelo de Almeida, C., et al. Zebrafish xenografts as a fast screening platform for bevacizumab cancer therapy. Comm Biol. 3 (1), 1-13 (2020).
- Pringle, E. S., et al. The zebrafish xenograft platform-A novel tool for modeling KSHV-associated diseases. Viruses. 12 (1), 12(2020).
- Pype, C., et al. Incubation at 32.5 °C and above causes malformations in the zebrafish embryo. Reprod Toxicol. 56, 56-63 (2015).
- Xu, X., et al. Adeno-associated virus (AAV)-based gene therapy for glioblastoma. Cancer Cell Int. 21 (1), 76(2021).
- Siebert, J., et al. Rhabdomyosarcoma xenotransplants in zebrafish embryos. Pediat Blood Cancer. 70 (1), e30053(2023).
- van Bree, N., et al. Development of an orthotopic medulloblastoma zebrafish model for rapid drug testing. Neuro-Oncol. noae210, (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。