Method Article
Schnelle in vivo Vorhersage des Ansprechens auf Medikamente mit Hilfe von Leukämiezelltransplantaten in Zebrafischembryonen
In diesem Artikel
Zusammenfassung
Dieses Protokoll enthält Schritt-für-Schritt-Anleitungen für die Generierung und Fehlerbehebung von Xenotransplantaten der akuten lymphatischen Leukämie (ALL) beim Menschen aus Zelllinien und frischem Patientenmaterial in transient immunsupprimierten Zebrafischembryonen sowie Richtlinien für die Beurteilung des Ansprechens auf das Arzneimittel mittels Durchflusszytometrie. Die experimentelle Pipeline kann auch für solide Tumore angepasst werden.
Zusammenfassung
Die Zebrafisch-Xenotransplantation ist eine zentrale Technik zur Untersuchung der Pathogenese von Krebs beim Menschen und zur Vorhersage individueller Arzneimittelreaktionen. In diesem Dokument wird ein optimiertes Protokoll (ZefiX) für die Erweiterung von primären B-Zell-Vorläufern von Patienten mit akuter lymphatischer Leukämie (BCP-ALL) oder immortalisierten Zelllinien in transient immunsupprimierten Zebrafischembryonen vorgestellt, wobei die Durchflusszytometrie für die hochauflösende Einzelzellanalyse des Ansprechens auf die Behandlung verwendet wird. Im Vergleich zu soliden Tumortransplantationen profitieren Leukämiezellen signifikant von einer Morpholino-Antisense-Oligonukleotid-basierten Unterdrückung von Makrophagen- und Neutrophilen-Differenzierungsfaktoren während des Assays. Die durchflusszytometrische Analyse von dissoziierten Transplantatzellen ermöglicht eine präzise Bewertung der Zellzahl, der Proliferationsrate und der Vitalität nach der Behandlung auf Zellbasis. Dieser Ansatz wurde mit gezielten Therapeutika wie Venetoclax und Dasatinib validiert, wobei die Behandlungsergebnisse mit klinischen Aufzeichnungen verwandter Patientenproben und traditionellen 2D-Kulturkontrollen verglichen wurden. Bemerkenswert ist, dass das Protokoll innerhalb von 7 Tagen abgeschlossen wird, was mit den klinischen Entscheidungsfristen übereinstimmt. Die Methodik ist anpassungsfähig, um ausgewählte Medikamente bei verschiedenen Krebsarten, einschließlich solider Tumore, zu testen und so personalisierte therapeutische Strategien zu unterstützen. Es sollte jedoch eine Begrenzung der Anzahl der Arzneimittel in Betracht gezogen werden, die wahrscheinlich auf pharmakokinetische Einschränkungen bei Zebrafischembryonen zurückzuführen sind.
Einleitung
Die Zebrafisch-Xenotransplantation ist zu einem wichtigen In-vivo-Modell für das Verständnis der Krebspathogenese und die Vorhersage des Ansprechens auf Medikamentegeworden 1,2,3,4,5. Tiermodelle sind nach wie vor von entscheidender Bedeutung für präklinische Arzneimitteltests, und das Zebrafischmodell bietet erhebliche Vorteile gegenüber anderen In-vivo-Systemen, einschließlich eines hohen Durchsatzes und einer Kosteneffizienz 6,7,8. Dieses Modell könnte auch personalisierte Vorhersagen des Ansprechens auf die Behandlung unterstützen, einschließlich molekularer zielgerichteter Therapien und CAR-T-Zelltherapie 9,10,11,12.
BCP-ALL kann besonders von der Xenotransplantation von Zebrafischen profitieren, da die Expansion von primären Patientenzellen in Kultur nach wie vor eine Herausforderung darstellt13. Es besteht ein unbestreitbarer Bedarf an neuartigen Behandlungsansätzen bei ALL. Trotz einer hohen Remissionsrate von 80%-85% bei Kindern mit BCP-ALL liegen die Langzeitüberlebensraten bei Patienten mit rezidivierter oder refraktärer Erkrankung nur zwischen etwa 30%-60%14,15,16. In solchen Fällen könnten Arzneimitteltests mit der vorgeschlagenen Pipeline in das klinische Umfeld integriert werden, um die optimale patientenspezifische Therapie zu identifizieren14,15. Dieser personalisierte Ansatz kann bei der Behandlung mehrerer Arzneimittelresistenzen von entscheidender Bedeutung sein und die Behandlungsbelastung für Patienten erheblich reduzieren, indem unwirksame oder suboptimale Medikamente mit schweren Nebenwirkungen vermieden werden.
Mehrere Merkmale machen die Zebrafischembryo-Xenotransplantation zu einem geeigneten Modell. Die genetischen Ähnlichkeiten zwischen Mensch und Zebrafisch - 70 % genetische Homologie und 84 % gemeinsame krankheitsbedingte Gene - unterstützen Studien zu Gen-Arzneimittel-Wechselwirkungen17. Die Verwendung eines transgenen Wirtsembryos kann somit genetische Prädispositionen aufdecken, die sich auf die Empfindlichkeit gegenüber Arzneimitteln auswirken18. Alternativ können Zellen mit spezifischen genetischen Modifikationen transplantiert werden, um zu beurteilen, ob die Empfindlichkeit oder Resistenz des Medikaments mit den In-vitro-Befunden übereinstimmt. Xenotransplantate von Zebrafischembryonen geben auch Aufschluss über die möglichen systemischen Wirkungen von Medikamenten. Obwohl die Organentwicklung bei 2-3 Tage alten Embryonen noch nicht vollständig ausgereift ist, sind die Organe korrekt lokalisiert und teilen sich teilweise die zelluläre Zusammensetzung mit ihren erwachsenen Gegenstücken19.
Weitere Vorteile dieses Modells sind, dass nur wenige Krebszellen für die Transplantation benötigt werden, die Erhaltung der Wirtsembryonen einfach ist, da innerhalb der ersten 5 Lebenstage keine Fütterung erforderlich ist, und der Injektionserfolg aufgrund der Transparenz und Größe der Embryonen schnell beurteilt werden kann. Ein einzigartiges Merkmal ist, dass in diesem Entwicklungsstadium nur die angeborene Immunität aktiv ist, was eine effiziente Transplantation ermöglicht20. In dem hier beschriebenen ZefiX-Protokoll (siehe Zusammenfassung in Abbildung 1) wird die Immundefizienz durch Unterdrückung des angeborenen Immunsystems während der ersten 4 Lebenstage mit stabilen Morpholino-Antisense-Oligonukleotiden verstärkt, die auf spi1 und csf3r abzielen und die Differenzierung von Makrophagen und Neutrophilen blockieren 21,22,23.
Dieses Protokoll unterscheidet sich auch von früheren Zebrafisch-Xenotransplantationsprotokollen, die in erster Linie für solide Tumortransplantate entwickelt wurden und in der Regel auf der Grundlage von Whole-Mount-Bildgebung Methoden zur Bewertung des Wirkstoffansprechens verwenden. ZefiX ist für flüssige Krebszellen, wie z. B. BCP-ALL-Zellen, optimiert und wurde erfolgreich zur Erweiterung von frischem oder frisch gefrorenem Patientenmaterial eingesetzt21. ZefiX kann auch für adhärente Krebszellen angepasst werden, indem geeignete Enzyme für die Gewebedissoziation ausgewählt werden.
Ein weiterer großer Vorteil ist die nachgelagerte Analyse mittels Durchflusszytometrie, die mehrere Vorteile bietet: (i) Eine große Anzahl von Transplantatzellen kann schnell verarbeitet werden, was eine robuste statistische Analyse auf Einzelzellebene ermöglicht, (ii) die Proliferationsrate und die Lebensfähigkeit können gleichzeitig in einzelnen Zellen beurteilt werden, und (iii) Durchflusszytometer sind in der klinischen Forschung üblich. Ermöglicht die Bewertung des Wirkstoffansprechens von Transplantatzellen auf Einzelzellebene innerhalb weniger Stunden. Um die Reproduzierbarkeit zu gewährleisten, bietet dieses Protokoll eine standardisierte Pipeline von der Vorbereitung über die Transplantation bis hin zur Durchflusszytometrie-Analyse, die eine Vorhersage des Ansprechens auf das Arzneimittel in ALLEN Zellen innerhalb einer Woche ermöglicht.
Protokoll
Alle Zebrafischversuche entsprechen den Richtlinien der Charité-Universitätsmedizin Berlin, den Leitlinien der Forschungsinstitute für Experimentelle Medizin und den offiziellen Behörden. Alle Studien betrafen Zebrafischembryonen < 6 Tagen nach der Befruchtung (dpf), wodurch sie vom Tierschutzgesetz ausgenommen sind. Zebrafische (Danio rerio) wurden in der Tierklinik der Charité-Universitätsmedizin Berlin, Berlin, Deutschland, nach Standardprotokollen aufgezogen und gehalten. Sie wurden bei 28 °C mit einem 14 h Licht- und 10 h Dunkelzyklus untergebracht. Für alle Experimente wurden Wildtyp-Fische der Stämme AB oder TüLF verwendet.
HINWEIS: Die Festlegung optimaler Behandlungsbedingungen für jedes gewünschte Medikament vor seiner ZefiX-Anwendung umfasst mehrere notwendige Schritte. Bestimmen Sie zunächst die halbmaximale Hemmkonzentration (IC50) jedes Medikaments unter Verwendung einer geeigneten Zelllinie innerhalb eines konventionellen 2D-Kultursystems. Basierend auf früheren Erfahrungen können die wirksamen Wirkstoffkonzentrationen für die ZefiX-Behandlung 5x - 50x höher sein als die unter typischen Zellkulturbedingungen verwendeten21,24. Vor der Behandlung von transplantierten Embryonen ist es wichtig, die Toxizität der nicht transplantierten Wirtsembryonen anhand des festgelegten Konzentrationsbereichs zu bewerten. Nach der Bewertung der Toxizität sind in Zelllinien transplantierte Embryonen einer Vielzahl von Arzneimittelkonzentrationen auszusetzen, die etwa das 50-fache des zuvor in 2D-Kultur bestimmten IC50-Werts betragen. Wenn die transplantierten Zellen auf Dosierungen bis zum 100-fachen des IC50 nicht ansprechen, kann das Medikament für ZefiX als unwirksam angesehen werden. Um die Wirksamkeit möglicherweise zu verbessern, besteht eine Möglichkeit darin, Transplantatzellen kurz vor ihrer Transplantation in Embryonen mit dem Medikament vorzukonditionieren25. In Tabelle 1 finden Sie alle hier verwendeten Lösungen.
1. Tag 1: Vorbereitung auf das Experiment
- Vorbereitung des E3-Mediums: Bereiten Sie 2 l autoklaviertes E3-Medium für die Embryonerhaltung vor.
- Herstellung von Morpholino-Antisense-Oligonukleotiden (MO): Bereiten Sie eine 50-μM-Stammlösung mit beiden MOs in einem 1,5-ml-Mikrozentrifugenröhrchen unter Verwendung von nukleasefreiem Wasser vor. Lagern Sie die Stammlösung bei Raumtemperatur (RT). Die MO werden für die Injektion vorbereitet, indem die Lösung auf einem Heizblock bei 65 °C 10 Minuten lang inkubiert wird.
HINWEIS: Die MOs sind gegen spi1 und csf3r gerichtet, um die Differenzierung von Makrophagen- und Neutrophilenzellen zu hemmen, wie in den Referenzen 22,23,26 beschrieben. - Vorbereitung von Injektionsplatten
- Um 4-5 Platten herzustellen, lösen Sie 1% Agarose in E3-Medium auf, um eine 100-ml-Lösung zu erhalten. Gießen Sie für Transplantationsplatten ~20 ml der Lösung in jede 10 cm große Petrischalen und stellen Sie sicher, dass sie zur Hälfte gefüllt sind. Schwenken, um die Flüssigkeit gleichmäßig zu verteilen.
- Für Morpholino-Injektionsplatten stellen Sie die Spritzgussform in zwei Petrischalen auf die flüssige Agarose, wobei Sie darauf achten, dass sich keine Blasen bilden. Decken Sie die Schalen ab, indem Sie die Deckel kippen, und lassen Sie sie auf RT, bis die Agarose fest geworden ist. Sobald sie erstarrt sind, entfernen Sie die Form und lagern Sie die Platten kopfüber bei 4 °C in einer verschlossenen Plastiktüte.
- Vorbereitung der Injektionsnadeln
- Für die Morpholino-Injektion: Erzeugen Sie mit einem Nadelzieher Nadeln aus 10 cm Kapillaren und brechen Sie die Spitzen ab, um einen geschätzten Durchmesser von 10 μm zu erreichen (wie in27 beschrieben).
- Für die Zelltransplantation: Verwenden Sie handelsübliche vorgezogene stumpfe Injektionsnadeln mit einem Außendurchmesser von 20 μm.
- Transplantatzellkultur: Geteilte Zellen (z. B. Nalm6) mit dem Ziel einer Zieldichte von 70 %-80 % an Tag 4 in einem T175-Zellkulturkolben mit RPMI-Medium, ergänzt mit 10 % FCS und 1 % P/s (RPMI-vollständig). Teilen Sie die Zellen vor der Verwendung 3-4 Mal, um eine angemessene Proliferationsrate zu gewährleisten.
HINWEIS: Für die Vorbereitung von frischem oder frischem/gefrorenem Patientenmaterial für die Transplantation finden Sie Anweisungen in Schritt 4.3. Am Tag der Transplantation werden dann die Zellen präpariert. - Zebrafischzucht: Wildtyp-Zebrafische nachmittags in Aufzuchtbecken aufsetzen und dabei Männchen und Weibchen getrennt halten.
HINWEIS: Zebrafische wurden wie in Referenz28 beschrieben aufgezogen und in Szene gesetzt. Zeitangaben (hpf oder dpf) bezeichnen Stunden oder Tage nach der Befruchtung.
2. Tag 2: Morpholino-Injektion
- 500 ml autoklaviertes E3-Medium mit 1 % Penicillin/Streptomycin (E3/P/S) ergänzen und zwei 10 cm Petrischalen füllen. Die Injektionsplatte aus dem Kühlschrank nehmen, um sie bei RT vorzuwärmen.
- Die Öffnung der Zuchtbecken ist gestaffelt, so dass die Befruchtung jeweils nur in einem Bruchteil der Tanks erfolgen kann (abhängig von der Injektionsgeschwindigkeit), um eine rechtzeitige Mikroinjektion von Morpholino-Lösung in Zebrafischembryonen im Einzelzellstadiumzu gewährleisten 28,29. Beginnen Sie damit, je nach Geschwindigkeit des Injektors ein oder zwei Tore zu öffnen, wenn die eine Charge Eier leicht injiziert ist, öffnen Sie ein weiteres Tor oder zwei Tore und so weiter.
- Übertragen Sie befruchtete Eier in Chargen von 100 Stück mit so wenig Flüssigkeit wie möglich in die zuvor hergestellte Injektionsplatte. Richten Sie die Embryonen in den Rillen der Platte aus.
- Injizieren Sie 1 nL einer 50-μM-Mischung aus beiden Morpholinos in die Zelle oder den Dottersack direkt unter der Zelle während des Ein-Zell-Stadiums29. Injizieren Sie ausreichend Eizellen für nachfolgende Eingriffe (z. B. injizieren Sie für eine 96-Well-Platte bis zu 200 Eizellen, um vor der Transplantation genügend Sicherheit für einen möglichen Aussetzer zu haben).
- Die injizierten Eier werden in Petrischalen mit E3/P/S umgefüllt. Die injizierten Eier werden bei 28 °C inkubiert. Nicht injizierte Eier werden als Kontrollfische für die Durchflusszytometrie-Analyse bei 5 dpf aufbewahrt. Das restliche E3/P/S-Medium bei 4 °C lagern.
3. Tag 3: Dechorionation
- Dechorionation von Zebrafischembryonen: Embryonen, die älter als 24 hpf sind, werden mit zwei Präzisionszangen29 manuell dechorioniert.
- Entfernen Sie tote Embryonen, die keinen Herzschlag oder Bewegung zeigen und undurchsichtig erscheinen, oder Embryonen mit unregelmäßigen Formen mit einer Pasteur-Pipette aus der Schale.
- Kneifen Sie das Chorion mit einer Präzisionszange zusammen, um es an Ort und Stelle zu halten. Kneifen Sie direkt neben der Spitze der Präzisionszange, halten Sie den Embryo mit der zweiten Pinzette an Ort und Stelle, und ziehen Sie das Chorion vorsichtig auseinander, um den Embryo freizugeben
HINWEIS: Um Embryonen unter 24 hpf zu dechorionieren, sollten sie auf einer mit Agarose überzogenen Schale aufbewahrt werden, um zu verhindern, dass sie am Kunststoff kleben. Die manuelle Dechorionation wird bevorzugt, da sie schonender für die Embryonen ist. Ein alternatives enzymatisches Dechorionierungsverfahren wird an anderer Stellebeschrieben 30.
- Inkubieren Sie dechorionierte Embryonen über Nacht bei 28 °C.
4. Tag 4: Xenotransplantation und medikamentöse Behandlung
- Präparation der Wirtsembryonen: Nehmen Sie die vorbereiteten Agaroseplatten und E3/P/S aus dem Kühlschrank und lassen Sie sie RT erreichen. Screenen Sie die Embryonen mit einem Stereomikroskop bei 48 hpf auf das entsprechende Entwicklungsstadium. Es sollten nur ordnungsgemäß inszenierte und morphologisch typische Embryonen in den Arbeitsablauf einbezogen werden, wie an anderer Stellebeschrieben 29. Zählen Sie alle gesunden Embryonen und planen Sie die weitere Behandlung. Halten Sie nicht mehr als 100 Embryonen pro 10 cm Petrischale bei 28 °C, um ungleichmäßige Entwicklungsgeschwindigkeiten durch Sauerstoffmangel zu vermeiden.
HINWEIS: Befolgen Sie Schritt 4.2. für Zelllinien. Für frisches/gefrorenes Material fahren Sie direkt mit Schritt 4.3 fort. - Aufbereitung von Zelllinien
- Um fluoreszenzmarkierte BCP-ALL-Zellen für die Durchflusszytometrie und Transplantation vorzubereiten, waschen Sie die Zellen (aus Schritt 1.5.) mit 1x PBS: zentrifugieren Sie 5 min lang bei 350 x g und resuspendieren Sie sie in 20 mL PBS.
- Zählen Sie die Zellen und übertragen Sie 3 x 105 ungefärbte Zellen in ein FACS-Röhrchen für die Durchflusszytometrie-Analyse an Tag 0 (0 Tage nach der Injektion, dpi). Auf Eis lagern.
- Platte: 3 x 105 Zellen in 3 ml RPMI-vollständig in einer Vertiefung einer 6-Well-Platte und bei 37 °C für 3 dpi-Kontrolle halten.
- 1 x 107 Zellen für die CTV-Markierung in ein 15 mL Zentrifugenröhrchen geben. Zentrifugieren Sie bei 350 x g für 5 min bei RT, gießen Sie den Überstand aus (verwenden Sie eine Pipette für den Rest) und resuspendieren Sie das Pellet in 2,5 mL PBS (RT) mit 1 μl CTV-Stammlösung.
- 5 min im Dunkeln bei 37 °C inkubieren, die Reaktion mit 12,5 mL RPMI-complete stoppen und dann 10 min im Dunkeln bei 37 °C inkubieren.
- Bei 350 x g für 5 min bei RT zentrifugieren und einmal mit 10 mL RPMI-complete waschen. Erneut zentrifugieren und in 10 mL RPMI-complete resuspendieren.
- Filtrieren Sie die Zellen mit einem 10 μm Filter, indem Sie bei 350 x g für 5 min zentrifugieren. Resuspendieren Sie das Pellet, zählen Sie die Zellen und geben Sie 3 x 105 CTV-markierte Zellen in ein FACS-Röhrchen. Platte 3x 10^5 Zellen mit 3 mL RPMI-vollständig in einer Vertiefung einer 6-Well-Platte und bei 37°C für 3 dpi Proliferationskontrolle halten. Lagern Sie die restlichen Zellen bis zur Transplantation in 1 ml PBS auf Eis.
- Aufbereitung von frischem/gefrorenem Patientenmaterial
- Zwei 15-ml-Zentrifugenröhrchen mit je 10 mL RPMI-complete bei 37 °C vorwärmen. Tauen Sie ein Fläschchen mit 5-10 x 106 Zellen in einem 37 °C warmen Wasserbad auf.
- Sobald nur noch eine kleine Menge Eis übrig ist, geben Sie die Zellen in das Zentrifugenröhrchen mit dem vorgewärmten Medium. Bei 350 x g für 5 min bei RT zentrifugieren, den Überstand verwerfen und das Pellet in das zweite Röhrchen mit vorgewärmtem RPMI-complete resuspendieren.
- Zählen Sie lebensfähige Zellen mit Trypanblau. Aliquotieren Sie 1x 10^5 Zellen in ein 1,5 mL Zentrifugenröhrchen und zentrifugieren Sie dieses Aliquot von Zellen in einem FACS-Röhrchen bei 350 x g für 5 min bei RT, verwerfen Sie den Überstand und resuspendieren Sie das Pellet in 300 μl PBS.
- Lagern Sie das resuspendierte Aliquot auf Eis als unbehandelte Kontrolle für die Durchflusszytometrie-Analyse.
HINWEIS: Wenn eine ausreichende Probengröße dies zulässt, ist an Tag 7 eine unbehandelte Kontrolle in Kultur für die Durchflusszytometrie-Messung durchzuführen. - Geben Sie 1 μl der CTV-Stammlösung zu 2,5 mL PBS (RT) pro 1 x 106 Zellen. Passen Sie das Volumen der CTV-Stammlösung an, wenn weniger Zellen verfügbar sind.
- Die Zellen mit CTV werden 5 min lang bei 37 °C im Dunkeln inkubiert, die Reaktion durch Zugabe von 12,5 mL vorgewärmtem (37 °C) RPMI-complete gestoppt und 10 min im Dunkeln bei 37 °C inkubiert.
- Zentrifugieren Sie die Zellen bei 350 x g für 5 min bei RT und waschen Sie die Zellen einmal mit 10 mL RPMI-complete. Zentrifugieren Sie erneut bei 350 x g für 5 min bei RT und resuspendieren Sie die Zellen in 10 mL RPMI-complete.
- Die Zellsuspension wird mit einem 10 μm Filter in ein frisches 50 mL Zentrifugenröhrchen filtriert und 5 min lang bei 350 x g zentrifugiert.
- Entsorgen Sie den Überstand nicht. Resuspendieren Sie das Pellet und zählen Sie die Zellen. Übertragen Sie 3 x 105 CTV-markierte Zellen in ein FACS-Röhrchen.
- Die restlichen Zellen werden bei 350 x g für 5 min bei RT zentrifugiert und der Überstand verworfen. Die restlichen Zellen werden in 1 ml PBS resuspendiert und bis zur Verwendung bei der Transplantation auf Eis gelagert.
HINWEIS: Wenn genügend CTV-positive Zellen übrig bleiben, können diese in 2D-Kultur parallel zu den Xenotransplantaten zum Vergleich der Proliferationsraten aufbewahrt werden.
- Durchflusszytometrische Messung
HINWEIS: Die Durchflusszytometrie bei 0 dpi sollte von einer zweiten Person durchgeführt werden, um die Zeit, die die Zellen vor der Transplantation auf dem Eis verbleiben, zu minimieren. Führen Sie vor der ersten durchflusszytometrischen Messung mit dem dafür vorgesehenen Färbepanel (CTV, CD19-Alexa488, APC-Annexin V und 7AAD) einen Kompensationstest gemäß den Anweisungen des Herstellers durch.- Bereiten Sie zwei FACS-Röhrchen wie folgt vor: Röhrchen 1: Ungefärbte Kontrollzellen; Röhrchen 2: Zellen, die mit CTV, CD19, 7AAD und Annexin gefärbt wurden.
HINWEIS: Färbung und Markierungen: CellTrace Violet (CTV) identifiziert markierte Transplantatzellen im Vergleich zu Wirtsfischzellen und beurteilt die Proliferationsrate nach 3 Tagen. Der CD19-Antikörper, ein Marker für die Zelloberfläche, dient als zusätzlicher Marker zur Identifizierung von humanen BCP-ALL-Transplantatzellen. Für andere Krebsarten können alternative Marker-Antikörper erforderlich sein. Annexin V markiert die Apoptose im Frühstadium für die Beurteilung der Zellviabilität. 7AAD markiert die Apoptose oder Nekrose im Spätstadium für die Beurteilung der Zellviabilität. - Zentrifugenröhrchen (eines mit CTV-gefärbten Zellen und das andere mit ungefärbten Zellen) bei 350 x g für 5 min bei RT zentrifugieren und den Überstand aus Röhrchen 1 verwerfen. Das Pellet wird in 310 μl Annexin Binding Buffer (ABB) resuspendiert.
- Röhrchen 2: Führen Sie die Antikörper- und Viabilitätsfärbung wie unten beschrieben durch.
HINWEIS: Dieses Färbeprotokoll ist für die CD19 B-Zell-Färbung optimiert. Für andere humane Antikörper, die zur Markierung verschiedener Zelltypen verwendet werden, muss das Protokoll möglicherweise angepasst werden.- Geben Sie 98 μl ABB in Röhrchen 2 (mit CTV-markierten Zellen). Fügen Sie 2 μl CD19-Alexa488-Antikörper (1:50 Verdünnung) zu den hinzugefügten 98 μl ABB hinzu. Gut mischen.
- Die Mischung wird 30 Minuten lang bei 4 °C inkubiert und 500 μl ABB hinzugefügt, um die Reaktion zu stoppen. Das Röhrchen bei 350 x g für 5 min bei 4 °C zentrifugieren. Entfernen Sie den Überstand und wiederholen Sie den Waschschritt.
- Resuspendieren Sie das Zellpellet in 100 μl ABB und fahren Sie mit der Färbung mit 7AAD und APC-Annexin V fort. Führen Sie die 7AAD- und APC-Annexin-V-Färbung und Durchflusszytometrie-Messung wie unten beschrieben durch.
- Geben Sie 5 μl 7AAD und 5 μl APC-Annexin V zu den resuspendierten Zellen. Zum Mischen vorsichtig vortexen. Inkubieren Sie das Röhrchen 15 Minuten lang im Dunkeln bei RT. Fügen Sie 200 μl ABB hinzu, um ein Endvolumen von 310 μl zu erreichen.
- Führen Sie die Durchflusszytometrie-Analyse am Tag der Transplantation in der folgenden Reihenfolge durch, um eine Kreuzkontamination zu vermeiden: Ungefärbte Kontrollzellen (Röhrchen 1), CTV-markierte Zellen, die mit Alexa488-CD19, APC-Annexin V und 7AAD gefärbt wurden (Röhrchen 2). Zeichnen Sie mindestens 10.000 Ereignisse pro Probe auf, um eine ausreichende Analyse zu gewährleisten.
- Bereiten Sie zwei FACS-Röhrchen wie folgt vor: Röhrchen 1: Ungefärbte Kontrollzellen; Röhrchen 2: Zellen, die mit CTV, CD19, 7AAD und Annexin gefärbt wurden.
5. Transplantation
- Transplantationsplatte: Bereiten Sie zwei 10 cm große Petrischalen vor, die mit E3/P/S gefüllt sind, und stellen Sie sie für mindestens 30 Minuten bei 28 °C zum Vorwärmen in den Inkubator.
- Zellvorbereitung: Zentrifugieren Sie die Zellen bei 350 x g für 5 min bei RT, entsorgen Sie den Überstand und entfernen Sie die restliche Flüssigkeit mit einer Mikropipette. Fügen Sie PBS hinzu, um ein Endvolumen von 20 μl zu erreichen. Halten Sie die konzentrierte Zellsuspension auf Eis.
HINWEIS: Die Zellen sollten während des Transplantationsverfahrens nicht länger als 2 Stunden auf Eis verbleiben. - Vorbereitung der Transplantationsnadel und des Wirtsembryos
- Übertragen Sie 25-30 Embryonen in eine der vorgewärmten Petrischalen mit E3/P/S und verwenden Sie eine Pasteur-Glaspipette zur Kontrolle. Laden Sie 4 μl der Zellsuspension mit einer Mikroladerspitze in die Transplantationsnadel.
HINWEIS: Die Beladung sollte innerhalb von 1-2 Minuten reibungslos vonstattengehen. Wenn dies nicht der Fall ist, fügen Sie der Zellsuspension vorsichtig mehr PBS hinzu. - Kalibrieren Sie den Einspritzdruck und die Impulslänge, indem Sie den Mikroinjektor einstellen. Anpassen, bis eine Injektion ca. 1.000 ALL-Zellen oder 2 nL Zellsuspension ausstößt (für 1x 107 Zellen in 20 μl). Um 1.000 Zellen zu schätzen, stoßen Sie ein Volumen der Suspension auf eine mit Medium bedeckte Agaroseoberfläche aus. Zählen Sie 100 Zellen in einem kleinen Bereich, extrapolieren Sie ihre Verteilung auf die gesamte Zellpopulation und schätzen Sie die Gesamtanzahl.
- Bereiten Sie 50 ml E3 vor, das Tricain enthält (Endkonzentration: 80 mg/l). Übertragen Sie die Wirtsembryonen in die Tricainlösung und inkubieren Sie sie mindestens 2 Minuten lang, um eine ordnungsgemäße Anästhesie zu gewährleisten. Der Embryo wird ordnungsgemäß betäubt, wenn keine motorische Reaktion zu beobachten ist
HINWEIS: Eine Mikroladerspitze oder eine Pinzette können verwendet werden, um sich dem Embryo vorsichtig zu nähern und/oder ihn zu berühren. - Übertragen Sie 15-20 dechorionierte Embryonen mit so wenig Flüssigkeit wie möglich in eine mit Agarose beschichtete Injektionsschale (siehe frühere Zubereitungsanleitung), um ein Verrutschen der Embryonen zu verhindern.
- Ordnen Sie die Embryonen wie in Abbildung 2A dargestellt an. Injizieren Sie ca. 1.000 CTV-positive BCP-ALL-Zellen in die Perikardhöhle. Führen Sie die Nadel in einem Winkel von 45° aus dorso-kaudaler Richtung ein, wie in Abbildung 2B gezeigt, um die Zellen zu injizieren.
HINWEIS: Verwenden Sie handelsübliche vorgezogene Nadeln mit stumpfen Enden und einem Öffnungsdurchmesser von 20 μm, die speziell für kleine Leukämiezellen entwickelt wurden (siehe Materialliste). Wenn die Nadel verstopft ist, schneiden Sie sie nach Bedarf ab, kalibrieren Sie jedoch das Injektionsvolumen und die Zellzahl danach neu. - Sobald alle 15-20 Embryonen injiziert sind, geben Sie sie in die vorgewärmte Petrischale, die mit E3/P/S gefüllt ist, und halten Sie sie bei 28 °C.
- Wiederholen Sie die Schritte, bis etwa 100 - 150 Embryonen für einen medikamentösen Behandlungstest transplantiert wurden, der drei Arzneimittelkonzentrationen und eine Kontrolle umfassen sollte.
- Inkubieren Sie sowohl die transplantierten Embryonen als auch die nicht transplantierten Kontrollen 1-3 Stunden lang bei 28 °C, bevor Sie mit der medikamentösen Behandlung beginnen.
- Übertragen Sie 25-30 Embryonen in eine der vorgewärmten Petrischalen mit E3/P/S und verwenden Sie eine Pasteur-Glaspipette zur Kontrolle. Laden Sie 4 μl der Zellsuspension mit einer Mikroladerspitze in die Transplantationsnadel.
- In-vivo-Behandlung mit Medikamenten (96-Well-Platte)
- Mit Hilfe der Fluoreszenz-Stereomikroskopie werden die Embryonen gescreent, um eine erfolgreiche Transplantation zu bestätigen (Abbildung 2C). Stellen Sie sicher, dass das Eigelb intakt ist, da das Dottermilieu für Transplantatzellen toxisch sein könnte21. Embryonen mit Zellen im Eigelb entsorgen.
- Bereiten Sie 2,5 ml einer 2x konzentrierten Lösung für jede Arzneimittelbedingung vor, die in E3/P/S mit 0,5 % DMSO getestet werden soll. Bereiten Sie zusätzlich eine 5-ml-Fahrzeugsteuerungslösung mit 0,5 % DMSO in E3/P/S vor.
- Geben Sie 100 μl E3/P/S + 0,5 % DMSO in jede Vertiefung einer 96-Well-Platte. Dieser Schritt verhindert den unbeabsichtigten Transfer minimaler Wirkstoffmengen zwischen den Wells.
- Übertragen Sie vorsichtig einen transplantierten Embryo in jede Vertiefung. Verwenden Sie eine Pasteur-Pipette aus Glas, um jeden Embryo in so wenig E3-Medium wie möglich aufzunehmen.
- Lassen Sie den Embryo durch leichtes Kippen der Pipette auf den Boden der Pipettenspitze sinken und lassen Sie ihn mit Kapillarkräften in die Vertiefung gleiten. Vermeiden Sie es, das Medium während der Übertragung in der Vertiefung zu berühren.
- Geben Sie Arzneimittellösungen in die Platte: Füllen Sie 24 Vertiefungen (2 Reihen) der 96-Well-Platte mit 100 μl entweder der Fahrzeugsteuerungslösung oder einer der drei 2x konzentrierten Arzneimittellösungen.
HINWEIS: Die wirksamen Arzneimittelkonzentrationen müssen in früheren Experimenten bestimmt werden, die für jedes zu testende Arzneimittel spezifisch sind. - Halten Sie die Embryonen 72 Stunden lang bei 35 °C, einschließlich der nicht transplantierten Embryonen, die am Tag 7 als Kontrollen für die Durchflusszytometrie dienen.
6. Tag 7
- Dissoziation von Embryo und Transplantat
- Screening der 96-Well-Platte mittels Stereomikroskopie, um gesunde Zebrafischembryonen zu identifizieren und auszuwählen. Poolen Sie nach dem Zufallsprinzip 10 gesunde Wirtsembryonen aus jeder Erkrankung in ein 1,5-ml-Mikrozentrifugenröhrchen (idealerweise ergeben sich 2 Röhrchen pro Erkrankung).
- Entfernen Sie so viel Flüssigkeit wie möglich aus jedem embryonalen Röhrchen und opfern Sie die Embryonen durch hypothermischen Schock, indem Sie die Röhrchen 1 h lang auf Eis inkubieren.
- Geben Sie 500 μl calcium- und magnesiumfreie Hank's Balanced Salt Solution (HBSS) in jedes Röhrchen. Dissoziieren Sie die Embryonen und Transplantatzellen mechanisch durch Verreibung mit einer 200-μl-Mikropipettenspitze, wobei Sie ca. 15x auf und ab pipettieren müssen.
- Die Gewebefragmente werden durch Zentrifugation bei 350 x g für 5 min bei RT pelletiert. In der Zwischenzeit sind die FACS-Röhrchen mit einer 35 μm feinmaschigen Filtersiebkappe vorzubereiten, die 2 ml PBS pro Bedingung (insgesamt 4 Röhrchen) enthält.
- Jedes Pellet wird in 500 μl Enzymmischung (0,01 % Papain, 0,1 % Dispase II, 0,01 % Desoxyribonuklease I und 12,4 mM MgSO4 in calcium- und magnesiumfreiem HBSS) für die enzymatische Dissoziation resuspendiert. 15 Minuten bei RT inkubieren.
- Pipettieren Sie die Mischung während der Inkubation alle 5 Minuten wiederholt auf und ab, wobei Sie für jedes einzelne Röhrchen dieselbe Pipettenspitze verwenden, um Gewebeverlust zu vermeiden.
- Durchflusszytometrische Messung
- Die dissoziierten Zellen in den 35 μm feinmaschigen Filtersiebdeckel der FACS-Röhrchen überführen und bei 350 x g für 5 min zentrifugieren.
- Bereiten Sie während des Zentrifugierens einen Mastermix für die CD19-B-Zell-Oberflächenfärbung vor. Kombinieren Sie 98 μl ABB mit 2 μl Alexa Fluor 488 Anti-Human-CD19-Antikörper für jede Bedingung.
- Verwerfen Sie den Überstand aus dem dissoziierten Zellpellet und resuspendieren Sie das Pellet in 100 μl des CD19-Färbe-Mastermixes.
- Führen Sie das CD19-, 7AAD- und APC-Annexin-V-Färbeprotokoll für alle ZefiX-Proben durch, einschließlich 3 x 105 CTV-positiven Zellen aus parallelen Zellkulturen, falls verfügbar.
- Führen Sie die Durchflusszytometrie-Analyse gemäß der Reihenfolge durch und zeichnen Sie die in Tabelle 2 beschriebene Anzahl von Ereignissen auf. Führen Sie alle Proben, die Wirts- und Transplantatzellen enthalten, so vollständig wie möglich durch, um die Gesamtzahl der Transplantatzellen zu bewerten.
- Analyse der Ergebnisse mit kommerzieller Software.
- Gating-Strategie für Zellkulturprobe: Öffnen Sie die Software und laden Sie die FCS-Dateien in den Arbeitsbereich. Erstellen Sie ein Punktdiagramm mit CD19 und CTV, um sicherzustellen, dass sich das Signal überlappt, und um das Vorhandensein der Krebszellen zu bestätigen. Erstellen Sie als Nächstes ein Punktdiagramm mit FSC-A (x-Achse) und SSC-A (y-Achse), um intakte Zellen (Q2) von Trümmern (Q4; Abbildung 3A').
- Verwenden Sie die Population Intakte Zellen, um ein neues Diagramm mit SSC-H (x-Achse) und SSC-A (y-Achse) zu erstellen, um einzelne Zellen zu identifizieren (Abbildung 3A'').
- Erstellen Sie ein weiteres Punktdiagramm mit Annexin V (x-Achse) und 7AAD (y-Achse) unter Verwendung der Einzelzellenpopulation (Abbildung 3A'''). Unterscheidung der Zellen in vier Populationen: Lebensfähige Zellen: Annexin V negativ, 7AAD negativ (Q4); Frühe apoptotische Zellen: Annexin V positiv, 7AAD negativ (Q3); Spätapoptotische/nekrotische Zellen: Annexin V positiv, 7AAD positiv (Q2); Nekrotische Zellen: Annexin V negativ, 7AAD positiv (Q1).
- Wiederholen Sie diese Schritte für 3-dpi-Proben (Abbildung 3B).
- Gating-Strategie für Transplantat- und Wirtsembryozellen
- Trennen Sie menschliche Transplantatzellen von Wirtszellen mithilfe eines Punktdiagramms mit CTV (x-Achse) und CD19 (y-Achse). Identifizieren und isolieren Sie doppelt positive CTV/CD19-Transplantatzellen (Abbildung 3C).
- Wenden Sie die gleiche Gating-Strategie, die für 3-dpi-Kulturzellen beschrieben wurde (Abbildung 3B' - B'''), auf die Transplantatzellpopulation an. Kopieren Sie die Gating-Strategie, um die Konsistenz zu gewährleisten.
- Führen Sie alle Annexin V- und 7AAD-negativen Zellpopulationen in einem Histogramm mit CTV-Werten auf der x-Achse zusammen (Abbildung 3D). Berechnen Sie das geometrische Mittel für alle fünf Proben, um die Proliferationsraten zu bestimmen.
- Berechnungen zur Bewertung des Ansprechens auf die Behandlung
- Um die Anzahl der Zellteilungen nach 3 Tagen zu bestimmen, verwenden Sie die Formel:
n = log2 (I0/I)
Dabei ist I0 = Anfängliche CTV-Fluoreszenzintensität (geometrisches Mittel, 0 dpi), I = CTV-Fluoreszenzintensität nach 72 h, n = Anzahl der Zellteilungen.
Beispiel: Frisch gefrorene Patientenzellen in ZefiX log2 (88317/14644) geteilt 2,6x = 2,6
und 2,8x im 2D-Kulturprotokoll2(88317/12992) = 2,8 - Um die Gesamtzahl der Transplantatzellen pro Fisch nach 3 Tagen zu bestimmen, dividieren Sie die Gesamtzahl der Krebszellen (einschließlich apoptotischer Zellen, aber ohne Trümmer) durch die Anzahl der in der Probe gesammelten Fische (typischerweise n = 10).
- Um die Lebensfähigkeit von CTV-positiven Transplantatzellen nach 3 Tagen zu bestimmen, verwenden Sie die Formel:
V = (C/100) x A
Dabei gilt: V = Lebensfähigkeit, C = Anteil intakter Einzelzellen ohne Ablagerungen (in Prozent), A = Anteil von Annexin V- und 7AAD-negativen Zellen (in Prozent).
- Um die Anzahl der Zellteilungen nach 3 Tagen zu bestimmen, verwenden Sie die Formel:
Ergebnisse
Für eine detaillierte wissenschaftliche Bewertung des ZefiX-Protokolls, einschließlich der Xenotransplantat- und medikamentösen Behandlung von frisch gefrorenen, primären BCP-ALL-Zellproben, verweisen wir auf das zuvor veröffentlichte Manuskript21. Die Zulassung für die Verwendung von Patientenproben in der Forschung für die präklinische Arzneimittelprüfung erfolgte im Rahmen von Zusatzstudien zur ALL-REZ BFM 2002 Studie (NCT00114348) und zum ALL-REZ BFM Register und zur Biobank (EA2/055/12) durch die lokalen Ethikkommissionen der medizinischen Forschung sowie zur internationalen Studie IntReALL SR 2010 (NCT01802814) durch die nationale Behörde. Die Einwilligungserklärung der Patienten und/oder ihrer Erziehungsberechtigten wurde über die jeweilige Studie oder das Register, in das sie aufgenommen wurden, eingeholt.
Abbildung 2 zeigt ein Beispiel für die Ausrichtung des Embryos in einer Agaroseschale vor der Injektion, was zur Rationalisierung des Injektionsprozesses beiträgt. Die Injektion sollte in dem dargestellten Winkel durchgeführt werden, um genau auf die Höhle abzuzielen, die das sich entwickelnde Herz umgibt. Darüber hinaus zeigt Abbildung 2C eine Referenz von erfolgreich injizierten 2-dpf-Embryonen mit menschlichen Transplantatzellen (blau), die vor der Injektion mit CTV markiert wurden. Embryonen mit Injektionsergebnissen, die sich von den in Abbildung 2C gezeigten unterscheiden, wurden ausgeschlossen, wobei ein besonderer Schwerpunkt auf der Vermeidung einer Perforation des Dottersacks lag, um die Lebensfähigkeit der Transplantatzellen während der anschließenden dreitägigen Inkubation sicherzustellen.
Nach der dreitägigen Inkubationszeit werden die Wirtsembryonen in 10er-Pools für die durchflusszytometrische Analyse aufbereitet. Nach der enzymatischen Dissoziation werden die Zellsuspensionen mit einem Anti-Human-CD19-Antikörper und zwei Viabilitätsmarkern gefärbt: Annexin V für frühe apoptotische Zellen und 7AAD für späte apoptotische und nekrotische Zellen.
Abbildung 3 zeigt durchflusszytometrische Daten von ZefiX-expandierten BCP-ALL-Zellen von einem Patienten mit BCP-ALL. Die Felder A, A', A'' und A''' zeigen Daten, die am Tag der Transplantation bei 0 dpi aufgenommen wurden. Abbildung 3A zeigt CTV- und CD19-Fluoreszenzwerte für insgesamt 10.000 Zellen als Referenz für die Gating-Strategie, die auf Wirt-Transplantat-Zellsuspensionen bei 3 dpi angewendet wird (Abbildung 3C). In Abbildung 3A' wird Ablagerungen durch regelmäßiges Gating von Zellen unter Verwendung der Forward Scatter Area (FSC-A) und der Sideward Scatter Area (SSC-A) ausgeschlossen. In Abbildung 3A'' werden einzelne Zellen von Dubletten getrennt, indem ein Diagramm der SSC-Höhe (SSC-H) im Vergleich zu SSC-A verwendet wird. Diese Einzelzellpopulation wird für die Viabilitätsbewertung in Abbildung 3A verwendet, wobei lebensfähige Zellen (Q4) von frühen apoptotischen Zellen (Q3, höhere Annexin-V-Werte) und späten apoptotischen oder nekrotischen Zellen (Q2, höhere 7AAD-Spiegel) unterschieden werden.
Zum Vergleich werden Patientenzellen, die unter konventionellen 2D-Bedingungen kultiviert wurden, nach drei Tagen ebenfalls mittels Durchflusszytometrie analysiert (Abbildungen 3B,B',B'',B'''), wobei die gleiche Gating-Strategie verfolgt wird. Die Lebensfähigkeit von Patientenzellen nach 72 Stunden in 2D-Kultur wird aus Q2 in Abbildung 2B' und Q4 in Abbildung 2B''' berechnet: (95,0%/100)*61,9% = 58,8%.
In Abbildung 3C ist das Ausgangsmaterial die Zellsuspension von Wirtsembryonen, die Transplantatzellen enthalten. Im Gegensatz zu In-vitro-Messungen werden alle Zellen im Röhrchen mittels Durchflusszytometrie analysiert. CD19- und CTV-positive Transplantatzellen werden angesteuert, um sie von CD19- und CTV-negativen Fischzellen zu trennen. Die intakte Transplantatzellpopulation wird in Abbildung 3C weiter analysiert, wobei Trümmer ausgeschlossen sind. Die Lebensfähigkeit einzelner Transplantatzellen wird dann mit der gleichen Gating-Strategie wie in Abbildung 3B bewertet.
Die Ergebnisse zeigen, dass der Prozentsatz lebensfähiger Einzelzellen, die in Embryonen vermehrt werden, 95,2 % beträgt, was 1,6-mal höher ist als die Lebensfähigkeit von Zellen, die in einer Schale kultiviert werden (Abbildung 3B'''). Die Zellteilungsraten wurden in vivo und in vitro berechnet, indem die Abnahme der CTV-Fluoreszenzintensität in jeder Population von 0 dpi auf 3 dpi analysiert wurde (Abbildung 3D). Die Anzahl der Zellteilungen wurde anhand der Formel in Abschnitt 6.4.1 und des geometrischen Mittels jeder CTV-Kurve bestimmt (Abbildung 3D). Die berechneten Teilungsraten (2,59 Teilungen in vivo und 2,77 Teilungen in vitro) deuten darauf hin, dass sich lebensfähige Zellen unter beiden Bedingungen über drei Tage hinweg mit einer ähnlichen Geschwindigkeit teilen.
Schließlich wurde die durchschnittliche Anzahl intakter Transplantatzellen pro Embryo nach drei Tagen bestimmt, indem die Anzahl der intakten Transplantatzellen (ohne Trümmer, Abbildung 3C') durch die Anzahl der in einem Röhrchen gepoolten Embryonendividiert wurde 21.
Zusammenfassend lässt sich sagen, dass frische BCP-ALL-Proben, die in Zebrafischembryonen transplantiert wurden, nach drei Tagen eine höhere Lebensfähigkeit aufweisen als bei herkömmlichen Kulturen in einer Schale, und lebensfähige Zellen teilen sich unter beiden Bedingungen mit einer vergleichbaren Geschwindigkeit.
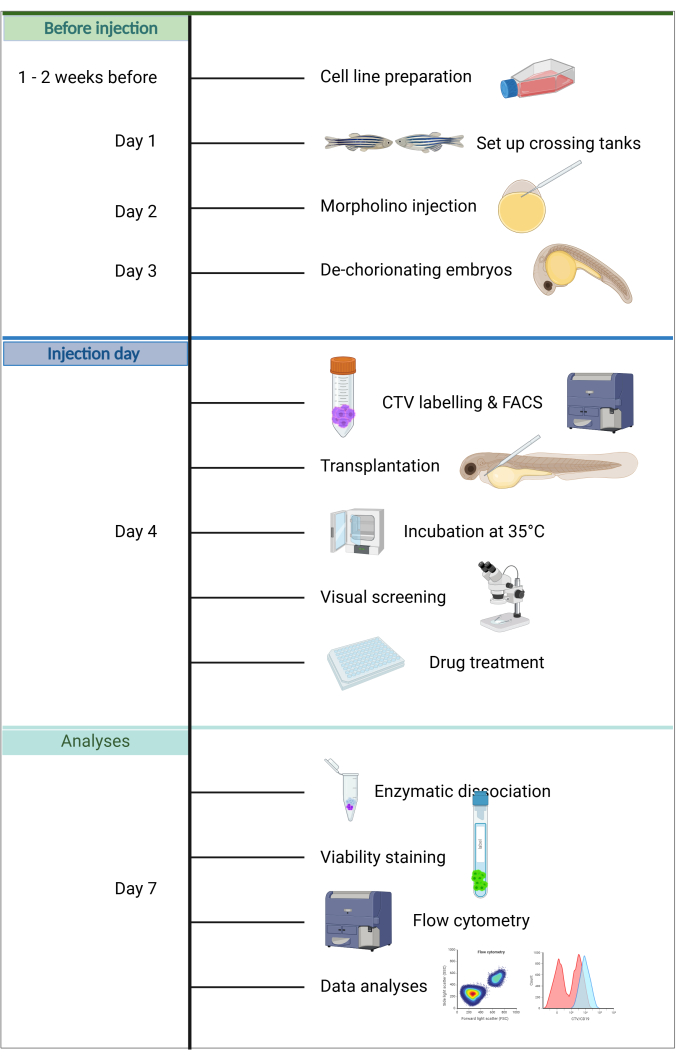
Abbildung 1. Arbeitsablauf der ALL-ZefiX-Pipeline. Erstellt im https://BioRender.com. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
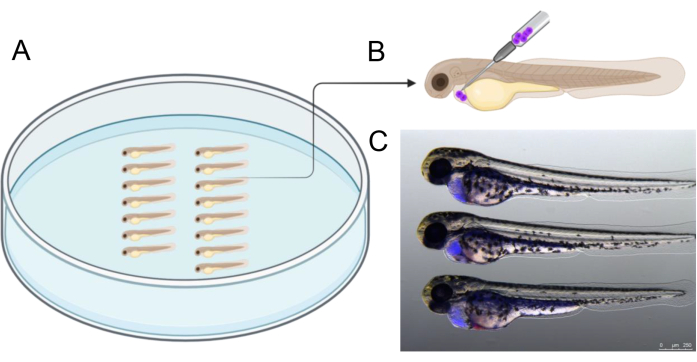
Abbildung 2: Anordnung der Injektion. (A) Die Anordnung der Embryonen wie abgebildet erleichtert die Injektion. Die Embryonen können mit einer Pinzette oder mit einer 20 μl Mikrolader-Pipettenspitze angeordnet werden, die auf eine Spitze von 2,5 - 3 cm Länge zugeschnitten wurde. (B) Schematische Darstellung des empfohlenen Injektionswinkels zur Transplantation von Zellen in das Perikard von 2 dpf Embryonen. (C) Visuelle Hilfsmittel zur korrekten Schätzung der Menge der transplantierten Krebszellen. Dieses Bild zeigt einen 48 hpf großen Embryo 3 h nach der Injektion mit menschlichen Krebszellen, die zuvor mit CellTrace Violet markiert wurden. Erstellt im https://BioRender.com. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Gating-Strategie und Durchflusszytometrie-Analyse einer vom Patienten abgeleiteten, frisch gefrorenen Probe isolierter BCP-ALL-Blastenzellen nach einer 2D-Kultur der Transplantation in Zebrafischembryonen. (A, B) Patientenzellen wurden vor der Kultur mit CellTrace Violet (CTV) markiert. Die Zellen wurden vor der Durchflusszytometrie-Analyse auf Gewebekulturkunststoff bei 37 °C für 0 h (A) oder 72 h (B) kultiviert. (C) Patientenzellen, die mit CTV markiert und bei 35 °C für 72 Stunden als Transplantate in Zebrafischembryonen des Wirts gezüchtet wurden. Eine Gruppe von 10 Embryonen wurde vor der Einzelzelldissoziation für die Durchflusszytometrie-Analyse gepoolt. Die Gating-Strategie in (B) wurde angewendet, und die lebensfähige Transplantatzellfraktion wurde identifiziert und quantifiziert. Zu diesem Zweck wurden CTV-positive Transplantatzellen (Q2) von autofluoreszierenden Zebrafischzellen (Q1/4) getrennt, um die Transplantatzellpopulation für die Analyse auszusortieren. Die Intensität der CTV-Markierung wurde in dieser Transplantatzellpopulation analysiert. (D) Zellzahl und mittlere Intensität von CTV-Markierungen nur aus der Selektion lebensfähiger Zellen. Beachten Sie die Verschiebung der CTV-Intensität nach 3 Tagen (3 dpi). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Tabelle der verwendeten Lösungen. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Proben, die mit Durchflusszytometrie gemessen wurden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Zebrafischembryonen sind aufgrund ihrer hohen Durchsatzkapazität und Kosteneffizienz zu einem immer beliebteren Xenotransplantat-Modell für das Wirkstoffscreening und die Krebsforschung geworden. Diese Xenotransplantate sind eine vielversprechende Säule der translationalen Medizin und unterstützen die präklinische Forschung und Entscheidungsfindung 9,21. Zebrafisch-Xenotransplantatmodelle für die Expansion und Behandlung menschlicher Leukämiezellen sind jedoch im Vergleich zu den umfangreichen Arbeiten an soliden Tumortransplantaten nach wie vor unterrepräsentiert. Dieses Protokoll bietet eine detaillierte Anleitung für die Nutzung von Zebrafisch-Xenotransplantaten in der Leukämieforschung und bleibt gleichzeitig für den Einsatz bei soliden Tumoren anpassungsfähig.
Das Erreichen einer konsistenten Krebszelltransplantation kann eine Herausforderung sein, was die Notwendigkeit einer standardisierten Analyse und einer höheren statistischen Zuverlässigkeit unterstreicht. Dieses Protokoll befasst sich mit diesen Problemen, indem es eine umfassende Pipeline für die Vorbereitung, Transplantation und nachgelagerte Durchflusszytometrie-Analyse sowie Empfehlungen zur Fehlerbehebung enthält.
Morpholino-Injektion zur vorübergehenden Immunsuppression
Zebrafischembryonen verlassen sich in den ersten Tagen der Entwicklung auf ihr angeborenes Immunsystem, was den Zeitrahmen für diese experimentelle Pipeline definiert20. Primitive Makrophagen treten bei etwa 12 hpf auf, wobei sich einige um 33 hpf 20,31,32 in Neutrophile differenzieren. Die T-Zellen gelangen etwa 8 Tage nach der Befruchtung in den Kreislauf20,33. Makrophagen und Neutrophile wurden als Teil der angeborenen Immunantwort mit dem verminderten Überleben von BCP-ALL-Zellen in Verbindung gebracht, das in früheren Studien drei Tage nach der Transplantation beobachtet wurde21.
Die Morpholino-vermittelte temporale Immunsuppression, die auf spi1 und csf3r abzielt, hemmt effektiv die Differenzierung von Makrophagen und Neutrophilen, was zu einer verbesserten Transplantation von BCP-ALL-Zellen führt, ohne die Lebensfähigkeit des Embryos zu beeinträchtigen21. Obwohl diese Methode keine dauerhafte Depletion erreichen kann, da ein vollständiger Knockout von spi1 und csf3r tödlich ist, bleibt sie der beste Ansatz für diese Pipeline.
Die Kalibrierung des Injektionsvolumens anhand eines Gradnetzes und die präzise Abgabe in den Dottersack im Einzelzellstadium gewährleisten konsistente Morpholino-Injektionen mit hohen Überlebensraten. Alternativen wie liposomale Clodronat-Injektionen (Clodrosom) zur Depletion von Makrophagen haben sich als vielversprechend erwiesen, bedürfen aber einer weiteren Validierung für diese Pipeline34,35.
Vorbereitung der Zellen
Eine ausreichend dichte und lebensfähige Zellpopulation ist entscheidend für eine erfolgreiche BCP-ALL-Expansion in diesem Protokoll. CellTrace Violet (CTV) wird für die Fluoreszenzmarkierung verwendet, um den Implantationserfolg bei 0 dpi zu bewerten und die Proliferationsraten während des gesamten Experiments zu verfolgen. Im Gegensatz zu anderen Markierungen verändert CTV das Zellverhalten nicht und ermöglicht eine präzise Proliferationsanalyse auf Einzelzellebene. Dies bietet Vorteile gegenüber der Ki-67-Antikörperfärbung, bei der nur Zellen während der Proliferation eingefangen werden, nicht aber geteilte Zellen, die den Zellzyklus bereits verlassen haben.
CTV übertrifft auch den CellTracker CM-DiI (DiI) bei der Reflexion der Zellviabilität. DiI und seine Derivate sind stabilere Fluorophore, die oft über den Zelltod hinaus bestehen bleiben, was die experimentellen Ergebnisse verwirren kann2. Darüber hinaus ermöglicht die Aufnahme eines BCP-ALL-spezifischen Antikörpers gegen CD19 in die Durchflusszytometrie eine präzise Identifizierung von Transplantatzellen. Humanspezifische Antikörper wie Anti-HLA können als Alternative für andere Krebszelltypen dienen36.
Transplantation von Krebszellen
Eine konsistente Transplantation erfordert eine optimale Verdünnung und Konzentration der Zellsuspension. Die Suspension sollte eine ausreichende Dichte beibehalten und gleichzeitig eine Viskosität vermeiden, die die Injektion beeinträchtigt. Bei diesem Protokoll wird die Injektion in die Perikardhöhle oder den Perivitellinraum (PVS) gegenüber dem Dottersack priorisiert, da diese Stellen eine bessere Vaskularisation und weniger hypoxische Bedingungen bieten37. Die Transplantation des Dottersacks ist zwar zugänglich, führt aber oft zu hohen Sterblichkeitsraten und einer schlechten Lebensfähigkeit der Zellen21.
Das Verstopfen der Nadel durch Mikropartikel bleibt eine verfahrenstechnische Herausforderung. Das Filtern der Zellsuspension und die Neukalibrierung des Injektionsvolumens nach dem Trimmen blockierter Nadeln sind wesentliche Schritte. Nur Embryonen mit dicht gefüllter Perikardie sollten für nachfolgende medikamentöse Behandlungen verwendet werden21,36.
Die empfohlene Inkubationstemperatur von 35 °C gleicht die natürliche Temperatur menschlicher Krebszellen (37 °C) und die Standard-Haltungstemperatur von Zebrafischen (28 °C) aus21. Zebrafischembryonen passen sich mit minimalen Entwicklungsdeformationen an diese Temperatur an, und die Umgebung verbessert die Proliferation und das Überleben frischer Patientenzellen38.
Medikamentöse Behandlung
Zebrafisch-Xenotransplantatmodelle wurden entwickelt, um das Hochdurchsatz-Wirkstoffscreening zu erleichtern. Die medikamentöse Behandlung bleibt jedoch einer der schwierigsten Aspekte des ZefiX-Assays. Viele Standardmedikamente und zielgerichtete Therapien erreichen die Transplantatzellen in vivo nicht effektiv. Es könnte auch die Untersuchung einer größeren Gruppe von Arzneimittelkonzentrationen erfordern. Erfolgreiche Beispiele wie Venetoclax und Dasatinib erfordern deutlich höhere Konzentrationen als in herkömmlichen 2D-Kulturassays21.
Alternativ ermöglicht die Vorbehandlung von Zellen in vitro vor der Transplantation auch die Untersuchung bestimmter systemischer und lokalisierter Effekte. Zum Beispiel könnte dieser Ansatz für Behandlungen auf Basis von Adeno-assoziierten Viren (AAV) beim Glioblastomgeeignet sein 39.
Wenn Wirkungen einer medikamentösen Behandlung in vitro, aber nicht in vivo mit dieser Pipeline beobachtet werden, könnte eine Alternative beispielsweise darin bestehen, in das 1k-Zellstadium (3 hpf) oder das Blastulastadium zu transplantieren und die medikamentöse Behandlung bei 24 hpfzu beginnen 40,41. Dies könnte es ermöglichen, dass Medikamente die Transplantatzellen erreichen, die bei 48 h alten Embryonen nicht erfolgreich sind, oder dass Zellen und Medikamente gleichzeitig injiziert werden25.
Dissoziations- und Durchflusszytometrie-Analyse
Die Dissoziation des Gewebes ist entscheidend für die Analyse der Gesamtzahl der Transplantatzellen und die zuverlässige Interpretation der experimentellen Ergebnisse. Eine Kombination aus mechanischer und enzymatischer Dissoziation gewährleistet eine qualitativ hochwertige Einzelzellsuspension bei gleichzeitiger Beibehaltung der Proteinintegrität der Zelloberfläche. Die Anpassung der Dissoziationsbedingungen (z. B. Enzymzusammensetzung, Pipettieren oder Verwendung eines Dounce-Homogenisators) kann bei verschiedenen Krebsarten erforderlich sein.
Die Proben sollten filtriert werden, um ein Verstopfen des Durchflusszytometers zu vermeiden, und klebrige Proteine oder Lipide können vor der Dissoziation mit EDTA oder Embryo-Deyolking gemildert werden.
Zusammenfassung
Das ZefiX-Protokoll bietet eine schnelle und kostengünstige experimentelle Pipeline für die präklinische Krebsforschung, Arzneimittelresistenzstudien und personalisierte Behandlungsbewertungen. Während Zebrafisch-Xenotransplantatmodelle Einschränkungen aufweisen und nicht alle Wirkstofftypen abdecken können, ermöglicht dieses standardisierte Protokoll die In-vivo-Expansion von frischen Leukämiezellen und Zelllinien von Patienten. Es ist für andere Krebsarten anpassbar und bietet ein vielversprechendes Werkzeug für die schnelle, personalisierte Vorhersage des Ansprechens auf Medikamente innerhalb des Zeitrahmens der klinischen Entscheidungsfindung.
Offenlegungen
Alle Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Diese Arbeit wurde gefördert durch die Deutsche Forschungsgemeinschaft (DFG) im Rahmen des Sonderforschungsbereichs CRC1588, Projektnummer 493872418 und die Dr. Kleist Stiftung, Berlin, sowie durch die Deutsche José Carreras Leukämie Stiftung (R03/2016), die Berliner Krebsgesellschaft (HEFF201633KK) und das Deutsche Konsortium für Translationale Krebsforschung (DKTK, Joint Funding Call 2016). Wir danken Julia Köppke und Mareike Wolff für die kritische Lektüre des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| Petri dish (10 cm) | Greiner | P7237 | |
| 7-AAD viability staining solution | Invitrogen | 00-6993-50 | |
| Agarose (LE, analytic grade) | Biozym | 840004 | |
| Air pressure injector | Narishige | IM400 | with external gas supply |
| Alexa Fluor 488 anti-human CD19 antibody | Biolegend | 302219 | |
| Annexin binding buffer | Biolegend | 422201 | Or see solutions for preparation |
| APC annexin V | Biolegend | 640941 | |
| Capillaries (10 cm, OD 1.0 mm, with filaments) | WPIINC | TW100F-4 | 1.0 OD; 0.75 ID |
| Cell culture flask (T-175) | Sarstedt | 83,39,12,002 | |
| CellTrace Violet | Invitrogen | C34557 | |
| Dimethyl sulphoxide (DMSO) | Roth | A994.1 | |
| Dispase II | Sigma Aldrich | D4693-1g | |
| DNase I | AppliChem GmbH | A3778 | |
| Eppendorf tubes (1.5 ml) | Eppendorf | 30120086 | |
| FACS tube (Polystyrene round botton Tube with Cell strainer Cap, 5 ml) | Falcon | 352235 | |
| Falcon tubes (50 ml) | Falcon | 352070 | |
| Fetal calf serum (FCS) | Sigma Aldrich | C8056 | |
| Fine mesh filter (10 µm) | PluriStrainer | 435001050 | |
| Fine mesh filter (20 µm) | PluriStrainer | 431002040 | |
| Flow cytometer | Becton Dickinson | BD LSRFortessa X-20 | |
| Fluorescent stereomicroscope | Leica | ||
| Fluorescent stereomicroscope with camera | Leica | M165 FC | Camera: DFC7000 T |
| Hank’s Balanced Salt Solution (HBSS, Calcium and Magnesium free ) | Sigma Aldrich | 88284 | |
| Injection mold (Zebrafish MI/Transplant KIT) | World Precision Instruments | Z-MOLDS | |
| Injection needles (without filament) | Biomedical instruments | VZIPbl-20-10-55 | Zebrafish injection pipette, blunt, OD: 20μm ± 1, TL:~10mm, PL: 55mm, Glass: BM100T-10P |
| Macro-centrifuge | Eppendorf | ||
| Micro-centrifuge | |||
| Morpholino (csf3r) | Gene Tools LLC | csf3r (GAAGCACAAGCGA GACGGATGCCA) | |
| Morpholino (spi1) | Gene Tools LLC | spi1(GATATACTGATAC TCCATTGGTGGT) | |
| Papain | Sigma Aldrich | P3125 | |
| Penicillin-Streptomycin (Penstrep; 10.000 U/ml) | Gibco | 15140122 | |
| Plates (4-well) | Greiner Bio one | 657160 | |
| Plates (96-well) | Greiner Bio one | 657180 | |
| Roswell Park Memorial Institute (RPMI) 1640 Medium | Gibco | 21875-034 | |
| Tricaine (MS-222) | Sigma Aldrich | E10521-50G | Ethy-3 aminobenzoate methanesulfenate |
Referenzen
- Fontana, C. M., Van Doan, H. Zebrafish xenograft as a tool for the study of colorectal cancer: a review. Cell Death Dis. 15, 1-12 (2024).
- Sturtzel, C., et al. Refined high-content imaging-based phenotypic drug screening in zebrafish xenografts. NPJ Precis Oncol. 7 (1), 1-16 (2023).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24, 2288(2023).
- Gamble, J. T., Elson, D. J., Greenwood, J. A., Tanguay, R. L., Kolluri, S. K. The zebrafish xenograft models for investigating cancer and cancer therapeutics. Biology. 10 (4), 252(2021).
- Costa, B., Estrada, M. F., Mendes, R. V., Fior, R. Zebrafish avatars towards personalized medicine-A comparative review between avatar models. Cells. 9 (2), 293(2020).
- Wang, W., et al. Progress in building clinically relevant patient-derived tumor xenograft models for cancer research. Animal Model Exp Med. 6 (5), 381-398 (2023).
- Xiao, J., Glasgow, E., Agarwal, S. Zebrafish xenografts for drug discovery and personalized medicine. Trend Cancer. 6 (7), 569-579 (2020).
- Fazio, M., Ablain, J., Chuan, Y., Langenau, D. M., Zon, L. I. Zebrafish patient avatars in cancer biology and precision cancer therapy. Nat Rev Cancer. 20 (5), 263-273 (2020).
- Costa, B., et al. Zebrafish avatar-test forecasts clinical response to chemotherapy in patients with colorectal cancer. Nat Comm. 15 (1), 4771(2024).
- Grissenberger, S., et al. Chapter 8 - Preclinical testing of CAR T cells in zebrafish xenografts. Method Cell Biol. 167, 133-147 (2022).
- Yan, C., et al. Single-cell imaging of T cell immunotherapy responses in vivo. J Exp Med. 218 (10), 20210314(2021).
- Pascoal, S., et al. A preclinical embryonic zebrafish xenograft model to investigate CAR T cells in vivo. Cancers. 12 (3), 567(2020).
- Pal, D., et al. Long-term in vitro maintenance of clonal abundance and leukaemia-initiating potential in acute lymphoblastic leukaemia. Leukemia. 30 (8), 1691-1700 (2016).
- Beneduce, G., et al. Blinatumomab in children and adolescents with relapsed/refractory B cell precursor acute lymphoblastic leukemia: A real-life multicenter retrospective study in seven AIEOP (Associazione Italiana di Ematologia e Oncologia Pediatrica) Centers. Cancers. 14 (2), 426(2022).
- Xie, J., et al. Short-course blinatumomab for refractory/relapse precursor B acute lymphoblastic leukemia in children. Front Pediatr. 11, 1187607(2023).
- Mengxuan, S., Fen, Z., Runming, J. Novel treatments for pediatric relapsed or refractory acute B-cell lineage lymphoblastic leukemia: Precision medicine era. Front Pediatr. 10, 923419(2022).
- Howe, K. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Lee, H. C., Lin, C. Y., Tsai, H. J. Zebrafish, an in vivo platform to screen drugs and proteins for biomedical use. Pharmaceuticals. 14 (6), 500(2021).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. J Clin Investigation. 122 (7), 2337-2343 (2012).
- Miao, K. Z., Kim, G. Y., Meara, G. K., Qin, X., Feng, H. Tipping the scales with zebrafish to understand adaptive tumor immunity. Front Cell Dev Biol. 9, 660969(2021).
- Gauert, A., et al. Fast, in vivo model for drug-response prediction in patients with B-cell precursor acute lymphoblastic leukemia. Cancers. 12 (7), 1883(2020).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. Mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), e49-e56 (2011).
- Pase, L., et al. Neutrophil-delivered myeloperoxidase dampens the hydrogen peroxide burst after tissue wounding in zebrafish. Current Biol. 22 (19), 1818-1824 (2012).
- Wijk, R. C. V., et al. Mechanistic and quantitative understanding of pharmacokinetics in Zebrafish larvae through nanoscale blood sampling and metabolite modeling of paracetamol. J Pharmacol Exp Ther. 371 (1), 15-24 (2019).
- Lázaro-Navarro, J., et al. Inhibiting casein kinase 2 sensitizes acute lymphoblastic leukemia cells to venetoclax via MCL1 degradation. Blood Advances. 5 (24), 5501(2021).
- Rhodes, J., et al. Interplay of pu.1 and gata1 determines myelo-erythroid progenitor cell fate in zebrafish. Developmental Cell. 8 (1), 97-108 (2005).
- Zakaria, Z. Z., Eisa-Beygi, S., Benslimane, F. M., Ramchandran, R., Yalcin, H. C. Design and microinjection of Morpholino antisense oligonucleotides and mRNA into zebrafish embryos to elucidate specific gene function in heart dvelopment. J Vis Exp. (186), e63324(2022).
- ZFIN: Zebrafish Book: Contents. , https://zfin.org/zf_info/zfbook/cont.html (2025).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Hasegawa, E. H., Gist H Farr, I. I. I., Maves, L. Comparison of pronase versus manual dechorionation of zebrafish embryos for small molecule treatments. J Dev Biol. 11 (2), 16(2023).
- Wattrus, S. J., Zon, L. I. Stem cell safe harbor: the hematopoietic stem cell niche in zebrafish. Blood Adv. 2 (21), 3063-3069 (2018).
- Harvie, E. A., Huttenlocher, A. Neutrophils in host defense: new insights from zebrafish. J Leukocyte Biol. 98 (4), 523-537 (2015).
- Page, D. M., et al. An evolutionarily conserved program of B-cell development and activation in zebrafish. Blood. 122 (8), e1-e11 (2013).
- Nguyen-Chi, M., et al. TNF signaling and macrophages govern fin regeneration in zebrafish larvae. Cell Death Dis. 8 (8), e2979-e2979 (2017).
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Dis Models Mech. 13 (1), dmm041889(2020).
- Rebelo de Almeida, C., et al. Zebrafish xenografts as a fast screening platform for bevacizumab cancer therapy. Comm Biol. 3 (1), 1-13 (2020).
- Pringle, E. S., et al. The zebrafish xenograft platform-A novel tool for modeling KSHV-associated diseases. Viruses. 12 (1), 12(2020).
- Pype, C., et al. Incubation at 32.5 °C and above causes malformations in the zebrafish embryo. Reprod Toxicol. 56, 56-63 (2015).
- Xu, X., et al. Adeno-associated virus (AAV)-based gene therapy for glioblastoma. Cancer Cell Int. 21 (1), 76(2021).
- Siebert, J., et al. Rhabdomyosarcoma xenotransplants in zebrafish embryos. Pediat Blood Cancer. 70 (1), e30053(2023).
- van Bree, N., et al. Development of an orthotopic medulloblastoma zebrafish model for rapid drug testing. Neuro-Oncol. noae210, (2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten