Method Article
제브라피시 배아에서 백혈병 세포 이식을 사용한 신속한 생체 내 약물 반응 예측
요약
이 프로토콜은 유세포 분석을 사용한 약물 반응 평가 지침과 함께 일시적 면역 억제 제브라피시 배아의 세포주 및 신선한 환자 물질에서 인간 급성 림프구 백혈병(ALL) 이종이식편을 생성하고 문제를 해결하기 위한 단계별 지침을 제공합니다. 실험 파이프라인은 고형 종양에도 적용할 수 있습니다.
초록
제브라피시 이종이식은 인간의 암 발병 기전을 조사하고 개별 약물 반응을 예측하기 위한 중추적인 기술입니다. 이 문서는 치료 반응의 고해상도 단세포 분석을 위해 유세포 분석을 활용하여 일시적 면역 억제 제브라피시 배아에서 원발성 B세포 전구체 급성 림프구 백혈병(BCP-ALL) 환자 샘플 또는 불멸 세포주를 확장하기 위한 간소화된 프로토콜(ZefiX)을 소개합니다. 고형 종양 생착제와 비교했을 때, 백혈병 세포는 분석 중 대식세포 및 호중구 분화 인자의 모르폴리노 안티센스 올리고뉴클레오티드 기반 억제로부터 상당한 이익을 얻습니다. 해리된 이식 세포의 유세포 분석을 통해 치료 후 세포별로 세포 수, 증식 속도 및 활력을 정밀하게 평가할 수 있습니다. 이 접근법은 베네토클락스(venetoclax) 및 다사티닙(dasatinib)과 같은 표적 치료제를 사용하여 검증되었으며, 관련 환자 샘플의 임상 기록 및 기존 2D 배양 대조군과 비교하여 치료 결과를 확인했습니다. 특히 이 프로토콜은 임상 의사 결정 일정에 맞춰 7일 이내에 완료됩니다. 이 방법론은 고형 종양을 포함한 다양한 암 유형에서 선별된 약물을 테스트하는 데 적용할 수 있으므로 개인화된 치료 전략을 지원합니다. 그러나 제브라피시 배아의 약동학적 제약으로 인해 평가할 수 있는 약물의 수에 대한 제한을 고려해야 합니다.
서문
제브라피시 이종이식은 암 발병기전을 이해하고 약물 반응을 예측하기 위한 중요한 생체 내 모델이 되었습니다 1,2,3,4,5. 동물 모델은 전임상 약물 검사에서 여전히 중요하며, 제브라피시 모델은 높은 처리량과 비용 효율성을 포함하여 다른 in vivo 시스템에 비해 상당한 이점을 제공합니다 6,7,8. 이 모델은 또한 분자 표적 치료 및 CAR-T 세포 요법을 포함한 맞춤형 치료 반응 예측에 도움이 될 수 있습니다 9,10,11,12.
BCP-ALL은 배양에서 일차 환자 세포를 확장하는 것이 여전히 어려운 과제이기 때문에 제브라피시 이종 이식의 이점을 특히 활용할 수 있습니다13. ALL에서 새로운 치료 접근법이 필요하다는 것은 부인할 수 없는 사실입니다. BCP-ALL을 앓고 있는 소아의 관해율이 80%-85%로 높음에도 불구하고, 재발성 또는 불응성 질환 환자의 장기 생존율은 약 30%-60%14,15,16에 불과합니다. 이러한 경우, 제안된 파이프라인을 사용한 약물 검사를 임상 환경에 통합하여 최적의 환자 특이적 치료법을 식별할 수 있습니다14,15. 이러한 맞춤형 접근 방식은 여러 약물 내성을 다룰 때 중요할 수 있으며, 심각한 부작용이 있는 효과가 없거나 최적이 아닌 약물을 피함으로써 환자의 치료 부담을 크게 줄일 수 있습니다.
몇 가지 기능으로 인해 제브라피시 배아 이종 이식이 적합한 모델입니다. 인간과 제브라피시 간의 유전적 유사성(70%의 유전적 상동성과 84%의 질병 관련 유전자 공유)은 유전자-약물 상호작용 연구를 뒷받침한다17. 따라서 형질전환 숙주 배아를 사용하면 약물 감수성에 영향을 미치는 유전적 소인을 밝힐 수 있습니다18. 또는 특정 유전자 변형이 있는 세포를 이식하여 약물 민감성 또는 내성이 체외 결과와 일치하는지 여부를 평가할 수 있습니다. 제브라피시 배아 이종이식편은 또한 약물의 잠재적인 전신 효과에 대한 통찰력을 제공합니다. 생후 2-3일 된 배아의 장기 발달은 완전히 성숙하지 않았지만, 장기는 정확하게 국소화되어 있으며 성체 배아와 부분적으로 세포 구성을 공유합니다19.
이 모델의 또 다른 장점으로는 생착에 필요한 암세포가 몇 개에 불과하고, 생후 5일 이내에 영양을 공급할 필요가 없기 때문에 숙주 배아를 유지하는 것이 간단하며, 배아의 투명성과 크기로 인해 주입 성공을 빠르게 평가할 수 있다는 점이 있습니다. 이 발달 단계에서는 선천면역만이 활성화되어 효율적인 생착을 촉진한다는 것이 독특한 특징이다20. 여기에 설명된 ZefiX 프로토콜(그림 1의 요약 참조)에서 면역결핍은 대식세포와 호중구 분화를 차단하는 spi1 및 csf3r을 표적으로 하는 안정적인 Morpholino 안티센스 올리고뉴클레오티드를 사용하여 생후 첫 4일 동안 선천면역 체계를 억제함으로써 더욱 향상됩니다 21,22,23.
이 프로토콜은 주로 고형 종양 이식을 위해 개발되었으며 일반적으로 전체 마운트 이미징 기반 약물 반응 평가 방법을 사용하는 이전의 제브라피시 이종 이식 프로토콜과도 다릅니다. ZefiX는 BCP-ALL 세포와 같은 액체 암세포에 최적화되어 있으며, 신선 또는 신선 냉동 환자 물질을 확장하는 데 성공적으로 사용되었습니다21. ZefiX는 또한 조직 해리에 적합한 효소를 선택하여 부착 암세포에 맞게 조정할 수 있습니다.
또 다른 주요 장점은 유세포 분석을 사용한 다운스트림 분석으로, (i) 많은 수의 이식 세포를 신속하게 처리할 수 있어 단일 세포 수준에서 강력한 통계 분석이 가능하고, (ii) 개별 세포에서 증식 속도 및 생존율을 동시에 평가할 수 있으며, (iii) 유세포 분석기는 임상 연구 환경에서 일반적으로 사용할 수 있습니다. 몇 시간 내에 단일 세포 수준에서 이식 세포의 약물 반응을 평가할 수 있습니다. 재현성을 보장하기 위해 이 프로토콜은 준비부터 이식, 유세포 분석까지 표준화된 파이프라인을 제공하여 일주일 이내에 모든 세포에서 약물 반응을 예측할 수 있습니다.
프로토콜
모든 제브라피시 실험은 Charité-Universitätsmedizin Berlin Research Institutes for Experimental Medicine 지침 및 공식 기관을 준수합니다. 모든 연구는 수정 후 6일(dpf)< 제브라피시 배아를 대상으로 했으며, 이는 동물보호법(Protection of Animals Act)에서 면제되었습니다. 제브라피시(Danio rerio)는 표준 프로토콜에 따라 독일 베를린에 있는 Charité-Universitätsmedizin의 동물 시설에서 사육 및 유지되었습니다. 그들은 14 시간의 빛과 10 시간의 어두운 주기로 28 ° C에서 보관되었습니다. 모든 실험에는 AB 또는 TüLF 균주의 야생형 물고기가 사용되었습니다.
참고: ZefiX를 적용하기 전에 원하는 각 약물에 대한 최적의 치료 조건을 설정하려면 몇 가지 필요한 단계가 포함됩니다. 먼저, 기존 2D 배양 시스템 내에서 적절한 세포주를 사용하여 각 약물의 절반 최대 억제 농도(IC50)를 측정합니다. 이전 경험에 비추어 볼 때, ZefiX 치료를 위한 효과적인 약물 농도는 일반적인 세포 배양 조건에서 사용되는 것보다 5배 - 50배 더 높을 수 있습니다21,24. 생착된 배아를 치료하기 전에, 확립된 농도 범위를 사용하여 이식되지 않은 숙주 배아 내의 독성을 평가하는 것이 필수적입니다. 독성을 평가한 후, 세포주가 생착된 배아를 2D 배양에서 이전에 측정된 IC50 값의 약 50배에 달하는 다양한 약물 농도에 노출시킵니다. 이식된 세포가 IC50의 최대 100배까지 투여되어도 반응을 보이지 않는 경우, 해당 약물은 ZefiX에 효과가 없는 것으로 간주될 수 있습니다. 잠재적으로 효능을 향상시키기 위한 한 가지 옵션은 배아에 이식하기 직전에 약물로 이식 세포를 사전 조건화하는 것입니다25. 여기에 사용된 모든 솔루션은 표 1을 참조하십시오.
1. 1일차: 실험 준비
- E3 배지 준비: 배아 유지에 사용할 오토클레이브 E3 배지 2L를 준비합니다.
- Morpholino 안티센스 올리고뉴클레오티드(MO) 제제: 뉴클레아제가 없는 물을 사용하여 1.5mL 마이크로 원심분리 튜브에 두 MO를 모두 포함하는 50μM 원액을 준비합니다. 원액을 실온(RT)에서 보관하십시오. 65°C의 가열 블록에서 용액을 10분 동안 배양하여 주입을 위해 MO를 준비합니다.
참고: MO는 참고 문헌 22,23,26에 기술된 바와 같이 대식세포 및 호중구 세포 분화를 억제하기 위해 spi1 및 csf3r에 대한 지시입니다. - 사출 플레이트의 준비
- 4-5개의 플레이트를 준비하려면 E3 배지에 1% 아가로스를 용해시켜 100mL 용액을 만듭니다. 이식 플레이트의 경우 각 20cm 페트리 접시에 ~10mL의 용액을 붓고 반쯤 채워졌는지 확인합니다. 액체를 고르게 분배하기 위해 소용돌이칩니다.
- Morpholino 사출 플레이트의 경우 두 개의 페트리 접시에 있는 액체 아가로스 위에 사출 금형을 놓고 기포가 형성되지 않도록 합니다. 뚜껑을 기울여 접시를 덮고 아가로스가 굳을 때까지 RT에 두십시오. 응고되면 금형을 제거하고 밀봉된 비닐 봉지에 4°C에서 플레이트를 거꾸로 보관하십시오.
- 주사 바늘의 준비
- Morpholino 주사의 경우: 니들 풀러를 사용하여 10cm 모세관에서 바늘을 생성하고 팁을 절단하여 10μm의 예상 직경을 달성합니다(27에 설명된 바와 같이).
- 세포 이식의 경우: 외경이 20μm인 시중에서 판매되는 미리 당겨진 무딘 끝 주삿바늘을 사용합니다.
- 이식편 세포 배양: 10% FCS 및 1% P/S(RPMI-complete)가 보충된 RPMI 배지가 있는 T175 세포 배양 플라스크에서 4일차에 목표 밀도 70%-80%를 목표로 세포(예: Nalm6)를 분할합니다. 적절한 증식 속도를 보장하기 위해 사용하기 전에 세포를 3-4회 분할하십시오.
참고: 이식을 위한 신선 또는 신선/냉동 환자 재료 준비에 대한 지침은 4.3단계에서 찾을 수 있습니다. 그런 다음 이식 당일에 세포를 준비합니다. - 제브라피시 번식: 오후에 번식 탱크에 야생형 제브라피시를 설치하여 수컷과 암컷을 분리하십시오.
참고: 제브라피쉬는 참고 문헌28에 설명된 대로 사육되고 준비되었습니다. 시간 참조(hpf 또는 dpf)는 수정 후 몇 시간 또는 며칠을 나타냅니다.
2. 2일차: 모르폴리노 주사
- 오토클레이브 E3 배지 500mL에 1% 페니실린/스트렙토마이신(E3/P/S)을 보충하고 10cm 페트리 접시 2개를 채웁니다. 냉장고에서 주입판을 꺼내 RT에서 예열합니다.
- 번식 탱크의 게이트 개방을 비틀거리게 하여 수정이 한 번에 일부의 탱크에서만 이루어질 수 있도록(주입 속도에 따라 다름) 단일 세포 단계에서 제브라피시 배아에 Morpholino 용액을 적시에 미량 주입할 수 있도록합니다 28,29. 인젝터의 속도에 따라 하나 또는 두 개의 게이트를 여는 것으로 시작하여 한 배치의 계란이 즉시 주입되면 다른 게이트 또는 두 개의 게이트를 엽니다.
- 수정란을 100개 배치로 가능한 한 적은 액체와 함께 이전에 만들어진 주입 플레이트로 옮깁니다. 플레이트의 홈에 배아를 정렬합니다.
- 두 Morpholinos의 50μM 혼합물 1nL를 세포 또는 단일 세포 단계29 동안 세포 바로 아래의 난황낭에 주입합니다. 후속 절차를 위해 충분한 난자를 주입합니다(예: 96웰 플레이트 1개의 경우 이식 전 잠재적인 탈락에 대한 충분한 백업을 위해 최대 200개의 난자를 주입).
- 주입된 계란을 E3/P/S를 포함하는 페트리 접시로 옮기고 주입된 계란을 28°C에서 배양합니다. 주입되지 않은 난자를 5dpf에서 유세포 분석을 위한 대조군 어류로 유지합니다. 나머지 E3/P/S 매체는 4°C에서 보관하십시오.
3. 3일차: 탈융모
- 제브라피시 배아의 탈융삭(de-chorionation): 배아가 24 hpf 이상일 때 두 개의 정밀 집게를 사용하여 수동으로 융모를 제거합니다29.
- 심장 박동이나 움직임이 보이지 않고 불투명하게 보이거나 불규칙한 모양의 배아를 파스퇴르 피펫으로 접시에서 제거하는 죽은 배아를 제거하십시오.
- 정밀한 집게로 융모막을 꼬집어 제자리에 고정합니다. 정밀 집게 끝 바로 옆을 꼬집고 두 번째 집게로 배아를 제자리에 고정하고 융모막을 조심스럽게 당겨 배아를 분리합니다
참고: 24hpf 미만의 배아를 제거하려면, 플라스틱에 달라붙는 것을 방지하기 위해 아가로스로 코팅된 접시에 보관해야 합니다. 수동 융모막 제거는 배아에 더 부드럽기 때문에 선호됩니다. 대안적인 효소적 탈융삭 방법은 문헌30의 다른 곳에 기재되어 있다.
- 탈융모가 제거된 배아를 28°C에서 하룻밤 동안 배양합니다.
4. 4일차: 이종이식 및 약물치료
- 숙주 배아의 준비: 준비된 아가로스 플레이트와 E3/P/S를 냉장고에서 꺼내 RT에 도달하도록 합니다.실체 현미경을 사용하여 48 hpf에서 적절한 발달 단계에 대한 배아를 스크리닝합니다. 적절하게 병기되고 형태학적으로 전형적인 배아(whole embryos)만을 워크플로우에 포함시키며, 이는 다른 문헌29에 기술되어 있다. 모든 건강한 배아를 세고 추가 치료를 계획하십시오. 산소 부족으로 인한 불균일한 발달 속도를 피하기 위해 28°C에서 10cm 페트리 접시당 100개 이상의 배아를 보관하지 마십시오.
참고: 4.2단계를 따릅니다. 세포주를 위해. 신선/냉동 재료의 경우 4.3단계로 바로 진행하십시오. - 세포주 준비
- 유세포분석 및 이식을 위해 형광 표지된 BCP-ALL 세포를 준비하려면 1x PBS: 350 x g 에서 5분 동안 원심분리로 세포를 세척하고 20mL의 PBS에 재현탁합니다.
- 세포를 계수하고 염색되지 않은 3 x 105 세포를 0일(주입 후 0일, dpi) 유세포 분석을 위해 FACS 튜브로 이동합니다. 얼음에 보관하세요.
- 플레이트 3 x 105 셀, 3mL의 RPMI-complete를 6웰 플레이트의 한 웰에서 완료하고 3dpi 제어를 위해 37°C로 유지합니다.
- CTV 라벨링을 위해 1 x 107 세포를 15mL 원심분리 튜브로 옮깁니다. 350 x g 에서 상온에서 5분 동안 원심분리기를 하고, 상층액을 붓고(나머지는 피펫 사용), 1μL의 CTV 원액과 함께 2.5mL의 PBS(RT)에 펠렛을 재현탁합니다.
- 37°C의 어둠 속에서 5분 동안 배양하고 12.5mL의 RPMI-complete로 반응을 중단한 다음 37°C의 어둠 속에서 10분 동안 배양합니다.
- 350 x g 에서 상온 온도에서 5분 동안 원심분리기를 하고 10mL의 RPMI-complete로 한 번 세척합니다. 다시 원심분리기를 하고 10mL의 RPMI-complete에 재현탁합니다.
- 10μm 필터를 사용하여 350 x g 에서 5분 동안 원심분리하여 세포를 필터링합니다. 펠릿을 재현탁하고, 세포를 계수하고, 3 x 105 CTV 표지 세포를 FACS 튜브로 옮깁니다. 6-well 플레이트의 한 well에 3mL의 RPMI-complete로 3x 10^5 셀을 플레이트화하고 3dpi 증식 제어를 위해 37°C를 유지합니다. 이식할 때까지 얼음에 1mL의 PBS에 남아 있는 세포를 보관하십시오.
- 신선/냉동 환자 자료 준비
- 37°C에서 각각 10mL의 RPMI가 완료된 2개의 15mL 원심분리 튜브를 예열합니다. 5-10 x 106 셀이 들어 있는 바이알을 37°C 수조에서 해동합니다.
- 소량의 얼음만 남으면 예열된 배지를 사용하여 세포를 원심분리 튜브로 옮깁니다. RT에서 5분 동안 350 x g 에서 원심분리기를 하고 상층액을 버리고 예열된 RPMI-complete의 두 번째 튜브에 펠릿을 다시 현탁시킵니다.
- trypan blue를 사용하여 생존 가능한 세포를 계산합니다. 1x 10^5 세포를 1,5 mL 원심분리 튜브에 분취하고 실온에서 5분 동안 350 x g 의 FACS 튜브에서 이 세포 분취액을 원심분리한 후 상등액을 버리고 펠릿을 300 μL의 PBS에 재현탁합니다.
- 재현탁된 부분 표본을 유세포 분석을 위해 처리되지 않은 대조군으로 얼음에 보관하십시오.
참고: 충분한 샘플 크기가 허용되는 경우 7일째에 유세포 분석을 위해 배양에서 처리되지 않은 대조군을 유지하십시오. - 1 x 106 세포마다 2.5mL의 PBS(RT)에 1μL의 CTV 원액을 추가합니다. 사용 가능한 세포 수가 더 적은 경우 CTV 원액의 부피를 조정합니다.
- 어둠 속에서 37°C에서 5분 동안 CTV로 세포를 배양하고, 예열된(37°C) RPMI-complete 12.5mL를 첨가하여 반응을 중지한 후 37°C의 어둠 속에서 10분 동안 배양합니다.
- RT에서 5분 동안 350 x g 에서 세포를 원심분리하고 10mL의 RPMI-complete로 세포를 한 번 세척합니다. RT에서 5분 동안 350 x g 에서 다시 원심분리하고 10mL의 RPMI-complete로 세포를 재현탁합니다.
- 10μm 필터를 사용하여 새 50mL 원심분리 튜브에 세포 현탁액을 여과하고 350 x g 에서 5분 동안 원심분리합니다.
- 상등액을 버리지 마십시오. 펠릿을 재현탁하고 세포를 계수합니다. 3 x 105 CTV 표지 세포를 하나의 FACS 튜브로 전달합니다.
- 나머지 세포를 350 x g 에서 RT에서 5분 동안 원심분리하고 상층액을 버립니다. PBS 1mL에 남은 세포를 재현탁하고 이식에 사용할 때까지 얼음에 보관합니다.
참고: 충분한 CTV 양성 세포가 남아 있는 경우, 증식 속도 비교를 위해 이종이식편과 병행하여 2D 배양으로 유지할 수 있습니다.
- 유세포 분석 측정
참고: 0 dpi의 유세포 분석은 이식 전에 세포가 얼음에 남아 있는 시간을 최소화하기 위해 두 번째 사람이 수행해야 합니다. 지정된 염색 패널(CTV, CD19-Alexa488, APC-Annexin V 및 7AAD)을 사용하여 첫 번째 유세포 분석을 수행하기 전에 제조업체의 지침에 따라 보상 테스트를 수행합니다.- 다음과 같이 두 개의 FACS 튜브를 준비합니다: 튜브 1: 염색되지 않은 대조 세포; 튜브 2: CTV, CD19, 7AAD 및 Annexin으로 염색된 세포.
참고: 염색 및 라벨: CellTrace Violet(CTV)은 표지된 이식 세포와 숙주 어류 세포를 식별하고 3일 후 증식 속도를 평가합니다. 세포 표면 마커인 CD19 항체는 인간 BCP-ALL 이식 세포를 식별하기 위한 추가 마커 역할을 합니다. 다른 암 유형의 경우 대체 마커 항체가 필요할 수 있습니다. Annexin V는 세포 생존율 평가를 위한 초기 단계의 세포사멸을 표시합니다. 7AAD는 세포 생존력 평가를 위한 후기 단계의 세포사멸 또는 괴사를 표시합니다. - 원심분리 튜브(하나는 CTV로 염색된 세포를 포함하고 다른 하나는 염색되지 않은 세포를 포함)를 350 x g 에서 RT에서 5분 동안 투여하고 튜브 1에서 상층액을 버립니다. 310μL의 Annexin Binding Buffer(ABB)에 펠릿을 재현탁합니다.
- 튜브 2: 아래와 같이 항체 및 생존도 염색을 수행합니다.
참고: 이 염색 프로토콜은 CD19 B 세포 염색에 최적화되어 있습니다. 다양한 세포 유형을 표지하는 데 사용되는 다른 인간 항체의 경우 프로토콜에 적응이 필요할 수 있습니다.- 98μL의 ABB를 Tube 2(CTV 표지 세포 포함)에 추가합니다. 첨가된 98μL의 ABB에 2μL의 CD19-Alexa488 항체(1:50 희석)를 추가합니다. 잘 섞는다.
- 혼합물을 4°C에서 30분 동안 배양하고 ABB 500μL를 첨가하여 반응을 중지합니다. 350 x g에서 튜브를 4°C에서 5분 동안 원심분리합니다. 상층액을 제거하고 세척 단계를 반복합니다.
- 세포 펠릿을 100μL의 ABB에 재현탁하고 7AAD 및 APC-Annexin V 염색을 진행합니다. 아래와 같이 7AAD 및 APC Annexin V 염색 및 유세포 분석을 수행합니다.
- 재현탁 세포에 5μL의 7AAD와 5μL의 APC-Annexin V를 추가합니다. 부드럽게 섞이도록 소용돌이. RT에서 어둠 속에서 15분 동안 튜브를 배양합니다. 200μL의 ABB를 추가하여 최종 부피 310μL에 도달합니다.
- 교차 오염을 방지하기 위해 이식 당일 염색되지 않은 대조 세포(튜브 1), Alexa488-CD19, APC-Annexin V 및 7AAD(튜브 2)로 염색된 CTV 표지 세포의 순서로 유세포 분석을 수행합니다. 충분한 분석을 위해 샘플당 최소 10,000개의 이벤트를 기록합니다.
- 다음과 같이 두 개의 FACS 튜브를 준비합니다: 튜브 1: 염색되지 않은 대조 세포; 튜브 2: CTV, CD19, 7AAD 및 Annexin으로 염색된 세포.
5. 이식
- 이식 플레이트: E3/P/S로 채워진 10cm 페트리 접시 2개를 준비하고 28°C의 인큐베이터에 최소 30분 동안 넣어 예열합니다.
- 세포 준비: RT에서 5분 동안 350 x g 에서 세포를 원심분리하고 상층액을 버리고 마이크로 피펫을 사용하여 남아 있는 액체를 제거합니다. PBS를 추가하면 20 μL의 최종 부피를 얻을 수 있습니다. 농축된 세포 현탁액을 얼음 위에 유지합니다.
참고: 이식 절차 중 세포가 얼음 위에 2시간 이상 남아 있으면 안 됩니다. - 이식 바늘 및 숙주 배아 준비
- 25-30개의 배아를 E3/P/S가 들어 있는 예열된 페트리 접시 중 하나에 옮기고 대조군 역할을 하는 유리 파스퇴르 피펫을 사용합니다. micro loader tip을 사용하여 4 μL의 세포 현탁액을 이식 바늘에 로드합니다.
알림: 로딩은 1-2분 이내에 원활하게 진행되어야 합니다. 그렇지 않은 경우 세포 현탁액에 PBS를 조심스럽게 더 추가합니다. - 마이크로인젝터를 조정하여 주입 압력과 펄스 길이를 보정합니다. 한 번의 주입으로 약 1,000개의 모든 세포 또는 2nL의 세포 현탁액이 배출될 때까지 조정합니다(20μL의 1x 107 개 세포의 경우). 1,000개의 세포를 추정하려면 배지로 덮인 아가로스 표면으로 부피의 현탁액을 방출합니다. 작은 영역에서 100개의 세포를 세고, 그 분포를 전체 세포 집단에 외삽하고, 총 수를 추정합니다.
- 트리카인을 함유한 E3 50mL를 준비합니다(최종 농도: 80mg/L). 숙주 배아를 트리카인 용액에 이식하고 적절한 마취를 보장하기 위해 최소 2분 동안 배양합니다. 배아는 운동 반응이 관찰되지 않을 때 적절하게 마취됩니다.
알림: 마이크로 로더 팁 또는 집게를 사용하여 배아에 조심스럽게 접근하거나 만질 수 있습니다. - 15-20개의 탈수소 배아를 아가로스로 코팅된 주사 접시(이전 준비 지침 참조)에 이식하여 배아가 미끄러지는 것을 방지하기 위해 가능한 한 적은 액체를 사용합니다.
- 그림 2A와 같이 배아를 배열합니다. 약 1,000개의 CTV 양성 BCP-ALL 세포를 심낭강에 주입합니다. 그림 2B와 같이 등-꼬리 방향에서 45° 각도로 바늘을 삽입하여 세포를 주입합니다.
참고: 작은 백혈병 세포를 위해 특별히 설계된 20μm 개구부 직경의 시중에서 판매되는 미리 당겨진 뭉툭한 끝 바늘을 사용하십시오(재료 목록 참조). 바늘이 막히면 필요에 따라 다듬되 나중에 주입량과 세포 수를 다시 보정합니다. - 15-20개의 배아가 모두 주입되면 E3/P/S로 채워진 예열된 페트리 접시에 옮기고 28°C를 유지합니다.
- 3개의 약물 농도와 1개의 대조군을 포함해야 하는 하나의 약물 치료 분석을 위해 약 100 - 150개의 배아가 이식될 때까지 단계를 반복합니다.
- 약물 치료를 시작하기 전에 이식된 배아와 이식되지 않은 대조군을 모두 28°C에서 1-3시간 동안 배양합니다.
- 25-30개의 배아를 E3/P/S가 들어 있는 예열된 페트리 접시 중 하나에 옮기고 대조군 역할을 하는 유리 파스퇴르 피펫을 사용합니다. micro loader tip을 사용하여 4 μL의 세포 현탁액을 이식 바늘에 로드합니다.
- In vivo 약물 처리(96웰 플레이트)
- 형광 입체현미경을 사용하여 배아를 스크리닝하여 성공적인 생착을 확인합니다(그림 2C). 난황 환경이 이식 세포에 독성이 있을 수 있으므로 난황이 손상되지 않았는지 확인하십시오21. 난황에 세포가 있는 배아는 버립니다.
- 0.5% DMSO를 사용하여 E3/P/S에서 테스트할 각 약물 상태에 대해 2x 농축 용액 2.5mL를 준비합니다. 또한 E3/P/S에 0.5% DMSO를 함유한 5mL 차량 제어 용액을 준비합니다.
- 96웰 플레이트의 각 웰에 100μL의 E3/P/S + 0.5% DMSO를 추가합니다. 이 단계는 웰 간에 최소한의 약물 양이 의도하지 않게 전달되는 것을 방지합니다.
- 생착된 배아 하나를 각 웰에 조심스럽게 이식합니다. 유리 파스퇴르 피펫을 사용하여 가능한 한 적은 E3 배지에서 각 배아를 집어 올립니다.
- 피펫을 부드럽게 기울여 배아가 피펫 팁의 바닥으로 가라앉도록 하고 모세관 힘을 사용하여 웰로 방출합니다. 옮기는 동안 우물에 있는 매체를 만지지 마십시오.
- 플레이트에 약물 용액 추가: 96웰 플레이트의 24웰(2열)에 100μL의 차량 제어 용액 또는 3개의 2x 농축 약물 용액 중 하나를 채웁니다.
참고: 효과적인 약물 농도는 테스트 중인 각 약물에 특정한 이전 실험에서 결정해야 합니다. - 이식되지 않은 배아를 포함하여 배아를 35°C에서 72시간 동안 유지하며, 이는 7일째 유세포 분석을 위한 대조군 역할을 합니다.
6. 7일차
- 배아/이식편 해리
- 건강한 제브라피시 배아를 식별하고 선택하기 위해 입체현미경을 사용하여 96웰 플레이트를 스크리닝합니다. 각 조건의 건강한 숙주 배아 10개를 1.5mL 마이크로 원심분리 튜브에 무작위로 풀링합니다(이상적으로는 조건당 2개의 튜브가 생성됨).
- 각 배아 함유 튜브에서 가능한 한 많은 액체를 제거하고 튜브를 얼음 위에서 1시간 동안 배양하여 저온 충격으로 배아를 희생합니다.
- 각 튜브에 칼슘 및 마그네슘이 없는 Hank's Balanced Salt Solution(HBSS) 500μL를 추가합니다. 200 μL 마이크로피펫 팁을 사용하여 약 15회 위아래로 피펫팅하여 배아와 이식 세포를 기계적으로 해리합니다.
- RT에서 5분 동안 350 x g 에서 원심분리하여 조직 조각을 펠렛화합니다. 그 동안 조건당 2mL의 PBS가 들어 있는 35μm 미세 메쉬 필터 스트레이너 캡이 있는 FACS 튜브를 준비합니다(총 4개의 튜브).
- 효소 해리를 위해 500μL의 효소 혼합물(칼슘 및 마그네슘이 없는 HBSS에서 0.01% 파파인, 0.1% 디옥시리보뉴클레아제 I, 12.4mM MgSO4 )에 각 펠릿을 재현탁합니다. RT에서 15분 동안 배양합니다.
- 배양 중에는 조직 손실을 방지하기 위해 각 개별 튜브에 대해 동일한 피펫 팁을 사용하여 5분마다 혼합물을 위아래로 반복적으로 피펫팅합니다.
- 유세포 분석 측정
- 해리된 세포를 FACS 튜브의 35μm 미세 메쉬 필터 스트레이너 캡으로 옮기고 350 x g 에서 5분 동안 원심분리합니다.
- 원심분리하는 동안 CD19 B-cell 표면 염색을 위한 마스터 믹스를 준비합니다. 각 조건에 대해 98μL의 ABB와 2μL의 Alexa Fluor 488 항인간 CD19 항체를 결합합니다.
- 해리된 세포 펠릿에서 상등액을 버리고 CD19 염색 마스터 믹스 100μL에 펠릿을 재현탁합니다.
- 가능한 경우 병렬 세포 배양에서 3 x 105 CTV 양성 세포를 포함한 모든 ZefiX 샘플에 대해 CD19, 7AAD 및 APC Annexin V 염색 프로토콜을 수행합니다.
- 순서에 따라 유세포 분석을 수행하고 표 2에 요약된 이벤트 수를 기록합니다. 숙주 세포와 이식편 세포를 포함하는 모든 샘플을 가능한 한 완벽하게 실행하여 총 이식편 세포 수를 평가합니다.
- 상용 소프트웨어를 사용한 결과 분석.
- 세포 배양 샘플에 대한 게이팅 전략: 소프트웨어를 열고 FCS 파일을 작업 공간에 로드합니다. CD19 및 CTV로 점도표를 만들어 신호가 겹치는지 확인하고 암세포의 존재를 확인합니다. 다음으로, FSC-A(x축) 및 SSC-A(y축)로 점도표를 만들어 온전한 세포(Q2)와 파편(Q4; 그림 3A').
- Intact Cells 모집단을 사용하여 SSC-H(x축) 및 SSC-A(y축)가 있는 새 플롯을 만들어 단일 세포를 식별합니다(그림 3A'').
- Single Cells 모집단을 사용하여 Annexin V(x축) 및 7AAD(y축)가 있는 다른 점도표를 만듭니다(그림 3A'''). 세포를 4개의 집단으로 구별: 생존 가능한 세포: Annexin V 음성, 7AAD 음성(Q4); 초기 세포사멸 세포: Annexin V 양성, 7AAD 음성(Q3); 후기 세포사멸/괴사 세포: Annexin V 양성, 7AAD 양성(Q2); 괴사 세포: Annexin V 음성, 7AAD 양성(Q1).
- 3dpi 샘플에 대해 이 단계를 반복합니다(그림 3B).
- 이식 및 숙주 배아 세포에 대한 게이팅 전략
- CTV(x축) 및 CD19(y축)가 있는 점도표를 사용하여 숙주 세포에서 인간 이식 세포를 분리합니다. CTV/CD19 이중 양성 이식 세포를 식별하고 분리합니다(그림 3C).
- 3 dpi 배양 세포에 대해 설명한 것과 동일한 게이팅 전략(그림 3B' - B''')을 이식 세포 집단에 적용합니다. 일관성을 위해 게이팅 전략을 복사합니다.
- 모든 Annexin V- 및 7AAD 음성 세포 집단을 x축에 CTV 값이 있는 히스토그램으로 병합합니다(그림 3D). 5개 표본 모두에 대한 기하 평균을 계산하여 증식 속도를 확인합니다.
- 처리 반응 평가를 위한 계산
- 3일 후의 세포 분열 수를 결정하려면 다음 공식을 사용하십시오.
n = 로그2 (I0/I)
여기서, I0 = 초기 CTV 형광 강도(기하 평균, 0dpi), I = 72시간에서의 CTV 형광 강도, n = 세포 분열 수.
예: ZefiX 로그2에서 2.6배 분할된 신선 냉동 환자 세포(88317/14644) = 2.6
2D 배양 로그에서 2.8배(88317/12992) = 2.8 - 물고기당 이식 세포의 총 수를 3일 후에 측정하려면 총 암세포 수(세포자멸사 세포는 포함되지만 파편은 제외)를 샘플에 모인 물고기의 수(일반적으로 n = 10)로 나눕니다.
- 3일 후 CTV 양성 이식 세포의 생존력을 확인하려면 다음 공식을 사용하십시오.
V = (C/100) x ᅡ
여기서: V = 생존력, C = 파편이 없는 온전한 단일 세포의 분율(백분율), A = Annexin V- 및 7AAD 음성 세포의 분획(백분율).
- 3일 후의 세포 분열 수를 결정하려면 다음 공식을 사용하십시오.
결과
신선 냉동 1차 BCP-ALL 세포 샘플의 이종 이식 및 약물 처리를 포함하여 ZefiX 프로토콜에 대한 자세한 과학적 평가는 이전에 발표된 원고21을 참조하십시오. 지역 의료 연구 윤리 위원회에 의해 ALL-REZ BFM 2002 임상시험(NCT00114348) 및 ALL-REZ BFM 레지스트리 및 바이오뱅크(EA2/055/12)에 대한 추가 연구의 일환으로 전임상 약물 검사를 위한 연구에 환자 샘플을 사용할 수 있도록 승인되었으며, 국가 당국에 의한 IntReALL SR 2010 국제 임상시험(NCT01802814)도 승인되었습니다. 환자 및/또는 그 보호자가 등록된 해당 임상시험 또는 등록부를 통해 사전 동의서를 받았습니다.
그림 2는 주입 전 아가로스 접시에서 배아 정렬의 예를 보여주며, 이는 주입 과정을 간소화하는 데 도움이 됩니다. 주사는 발달 중인 심장을 둘러싼 구멍을 정확하게 겨냥하기 위해 묘사된 각도로 수행되어야 합니다. 또한, 그림 2C 는 주입 전에 CTV로 표지된 인간 이식 세포(파란색)를 포함하는 성공적으로 주입된 2개의 dpf 배아에 대한 참조를 제공합니다. 그림 2C 에 나타난 것과 다른 주입 결과를 가진 배아는 제외되었으며, 특히 3일간의 배양 기간 동안 이식 세포의 생존력을 보장하기 위해 난황낭 천공을 피하는 데 중점을 두었습니다.
3일의 배양 기간 후, 숙주 배아는 유세포 분석을 위해 10개의 풀에서 처리됩니다. 효소 해리 후, 세포 현탁액은 anti-human-CD19 항체와 두 가지 생존 마커(초기 세포사멸 세포에 대한 Annexin V와 후기 세포사멸 및 괴사 세포에 대한 7AAD)로 염색됩니다.
그림 3은 BCP-ALL 환자의 ZefiX 확장 BCP-ALL 세포의 유세포 분석 데이터를 보여줍니다. 패널 A, A', A'', 및 A''는 이식 당일 0dpi에서 수집된 데이터를 보여줍니다. 그림 3A 는 3dpi에서 숙주 이식 세포 현탁액에 적용되는 게이팅 전략에 대한 참조로 총 10,000개 세포에 대한 CTV 및 CD19 형광 값을 표시합니다(그림 3C). 그림 3A'에서, 전방 산란 영역(FSC-A) 및 측면 산란 영역(SSC-A)을 사용하여 세포의 일반 게이팅을 통해 파편을 배제합니다. 그림 3A''에서, 단일 셀은 SSC-A에 대한 SSC 높이(SSC-H)의 그래프를 사용하여 이중선에서 분리됩니다. 이 단일 세포 집단은 그림 3A''의 생존력 평가에 사용되며, 여기서 생존 세포(Q4)는 초기 세포사멸 세포(Q3, 더 높은 Annexin V 값) 및 후기 세포사멸 또는 괴사 세포(Q2, 더 높은 7AAD 수준)와 구별됩니다.
비교를 위해, 기존 2D 조건에서 배양된 환자 세포도 동일한 게이팅 전략에 따라 3일 후에 유세포 분석으로 분석됩니다(그림 3B,B',B'',B'). 2D 배양에서 72시간 후 환자 세포의 생존율은 그림 2B' 의 Q2 및 그림 2B''의 Q4에서 계산됩니다: (95.0%/100)*61.9% = 58.8%.
그림 3C에서, 출발 물질은 이식 세포를 포함하는 숙주 배아의 세포 현탁액입니다. in vitro 측정과 달리 튜브의 모든 세포는 유세포 분석으로 분석됩니다. CD19 및 CTV 양성 이식 세포는 CD19 및 CTV 음성 어류 세포와 분리하기 위해 게이트를 삽입합니다. 온전한 이식 세포 집단은 파편이 제외된 그림 3C'에서 추가로 분석됩니다. 그런 다음 단일 이식 세포의 생존 가능성은 그림 3B와 동일한 게이팅 전략을 사용하여 평가됩니다.
그 결과, 배아에서 팽창된 생존 가능한 단일 세포의 비율은 95.2%이며, 이는 접시에서 배양된 세포의 생존율보다 1.6배 더 높다는 것을 나타냅니다(그림 3B'''). 세포 분열 속도는 각 집단에서 CTV 형광 강도의 감소를 0 dpi에서 3 dpi까지 분석하여 in vivo 및 in vitro를 계산했습니다(그림 3D). 세포 분열의 수는 섹션 6.4.1의 공식과 각 CTV 곡선의 기하 평균을 사용하여 결정되었습니다(그림 3D). 계산된 분열률(in vivo 2.59 분열 및 in vitro 2.77 분열)은 생존 가능한 세포가 3일 동안 두 조건 모두에서 유사한 속도로 분열한다는 것을 시사합니다.
마지막으로, 3일 후 배아당 온전한 이식 세포의 평균 수는 온전한 이식 세포의 수(파편은 제외, 그림 3C')를 튜브에 모인 배아의 수로 나누어 결정하였다(21).
결론적으로, 제브라피시 배아에 생착된 신선한 BCP-ALL 샘플은 접시에서 기존 배양에 비해 3일 후에 더 높은 생존력을 나타내며 생존 세포는 두 조건 모두에서 비슷한 속도로 분열합니다.
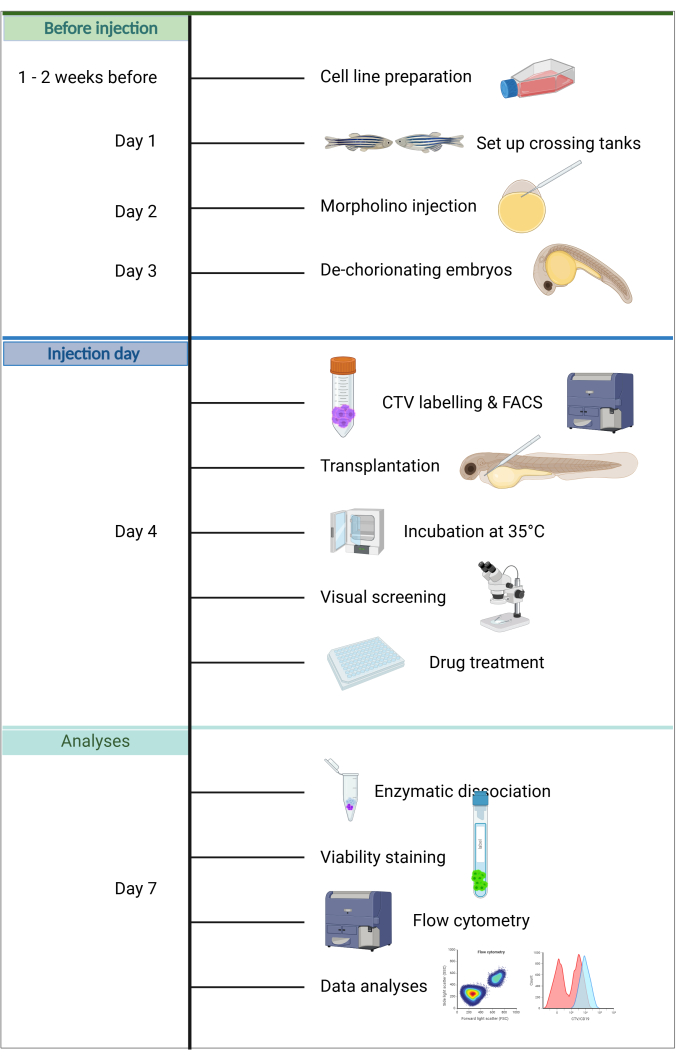
그림 1. ALL-ZefiX 파이프라인의 워크플로. https://BioRender.com 년에 생성되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
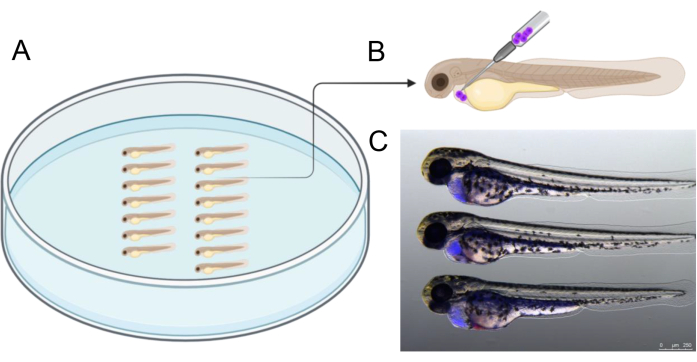
그림 2: 주입 배열. (A) 그림과 같이 배아를 배열하면 주입이 용이합니다. 배아는 겸자를 사용하거나 팁 길이가 2.5 - 3cm가 되도록 절단된 20 μL 마이크로로더 피펫 팁을 사용하여 배열할 수 있습니다. (B) 2 dpf 배아의 심낭에 세포를 이식하기 위한 권장 주입 각도의 개략도. (C) 이식된 암세포의 양을 정확하게 추정하기 위한 시각 보조 도구. 이 그림은 이전에 CellTrace Violet으로 표지된 인간 암세포를 주입 후 3시간 후에 48 hpf 배아를 보여줍니다. https://BioRender.com 년에 생성되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 제브라피시 배아에서 2D 생착 배양 후 분리된 BCP-ALL 모세포 세포의 환자 유래 신선 냉동 샘플의 게이팅 전략 및 유세포 분석 분석. (가, 나) 배양 전에 환자 세포를 CTV(CellTrace Violet)로 라벨링했습니다. 세포는 유세포 분석 전에 37°C에서 0시간(A) 또는 72시간(B) 동안 조직 배양 플라스틱에서 배양했습니다. (C) CTV로 표지되고 숙주 제브라피시 배아의 이식편으로 35°C에서 72시간 동안 성장한 환자 세포. 유세포 분석을 위해 단일 세포 해리 전에 10개의 배아 그룹을 통합했습니다. (B)의 게이팅 전략을 적용하고 생존 가능한 이식 세포 분획을 식별하고 정량화했습니다. 이를 위해 CTV 양성 이식 세포(Q2)를 자동 형광 제브라피시 세포(Q1/4)에서 분리하여 분석을 위해 이식 세포 집단을 분류했습니다. 이 이식 세포 집단에서 CTV 라벨링 강도를 분석했습니다. (D) 생존 가능한 세포 선택에서만 CTV 라벨의 세포 수 및 평균 강도. 3일(3dpi) 후 CTV 강도의 변화를 주목하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 사용된 솔루션 표. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 유세포 분석으로 측정한 샘플. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
제브라피시 배아는 높은 처리 능력과 비용 효율성으로 인해 약물 스크리닝 및 암 연구에서 점점 더 인기 있는 이종 이식 모델이 되었습니다. 이러한 이종이식편은 중개 의학의 중요한 기둥으로서 전임상 연구 및 의사 결정을 돕는 유망한 역할을 합니다 9,21. 그러나 인간 백혈병 세포 확장 및 치료를 위한 제브라피시 이종 이식 모델은 고형 종양 이식편에 대한 광범위한 작업에 비해 과소 대표되고 있습니다. 이 프로토콜은 백혈병 연구에서 제브라피시 이종이식편을 활용하면서 고형 종양에 사용할 수 있도록 적응할 수 있는 자세한 지침을 제공합니다.
일관된 암세포 이식을 달성하는 것은 어려울 수 있으며, 표준화된 분석과 더 높은 통계적 신뢰성의 필요성이 강조되고 있습니다. 이 프로토콜은 문제 해결 권장 사항과 함께 준비, 이식 및 다운스트림 유세포 분석을 위한 포괄적인 파이프라인을 제시하여 이러한 문제를 해결합니다.
일시적 면역 억제를 위한 Morpholino 주사
제브라피시 배아는 발달 초기 며칠 동안 선천면역 체계에 의존하며, 이는 이 실험 파이프라인의 기간을 정의합니다20. 원시 대식세포는 약 12hpf에서 나타나며, 일부는 33hpf 20,31,32로 호중구로 분화합니다. T 세포는 수정 후 약 8 일에 순환에 들어갑니다20,33. 선천면역 반응의 일부인 대식세포와 호중구는 이전 연구에서 이식 3일 후 관찰된 BCP-ALL 세포의 생존율 감소와 관련이 있습니다21.
spi1 및 csf3r을 표적으로 하는 Morpholino 매개 측두면역 억제는 대식세포 및 호중구 분화를 효과적으로 억제하여 배아 생존력에 영향을 미치지 않으면서 BCP-ALL 세포의 생착을 개선합니다21. 이 방법은 spi1 및 csf3r의 완전한 녹아웃이 치명적이므로 영구적인 고갈을 달성할 수는 없지만 이 파이프라인에 가장 적합한 접근 방식으로 남아 있습니다.
계수선을 사용한 주입량의 보정과 단일 세포 단계에서 난황낭으로의 정확한 전달을 통해 높은 생존율로 일관된 Morpholino 주입을 보장합니다. 대식세포 고갈을 위한 리포솜 클로드로네이트 주사제(클로드로솜)와 같은 대안이 가능성을 보여주었지만 이 파이프라인에 대한 추가 검증이 필요합니다 34,35.
세포 준비
충분히 조밀하고 생존 가능한 세포 집단은 이 프로토콜에서 성공적인 BCP-ALL 확장에 매우 중요합니다. CellTrace Violet(CTV)은 0dpi에서 이식 성공을 평가하고 실험 전반에 걸쳐 증식 속도를 추적하기 위한 형광 표지에 사용됩니다. 다른 표지와 달리 CTV는 세포 거동을 변화시키지 않기 때문에 정밀한 단일 세포 수준의 증식 분석이 가능합니다. 이는 증식 중에만 세포를 포착하고 이미 세포 주기를 벗어난 세포는 분열하지 않는 Ki-67 항체 염색에 비해 이점을 제공합니다.
CTV는 또한 세포 생존율을 반영하는 데 있어 CellTracker CM-DiI(DiI)를 능가합니다. DiI 및 그 유도체는 보다 안정적인 형광단이며, 종종 세포 사멸 이후에도 지속되어 실험 결과를 혼란스럽게 할 수 있습니다2. 또한 유세포 분석에 CD19에 대한 BCP-ALL 특이적 항체를 포함하면 이식 세포를 정밀하게 식별할 수 있습니다. 항-HLA와 같은 인간 특이적 항체는 다른 암세포 유형에 대한 대안으로 작용할 수 있다36.
암세포 이식
일관된 생착을 위해서는 세포 현탁액의 최적 희석과 농도가 필요합니다. 현탁액은 주입을 방해하는 점도를 피하면서 충분한 밀도를 유지해야 합니다. 이 프로토콜은 난황낭을 통해 심낭낭 또는 심낭낭낭(perivitelline space, PVS)으로 주입하는 것을 우선시하는데, 이는 이러한 부위가 더 나은 혈관형성과 저산소 상태를 제공하기 때문이다37. 난황낭 이식은 접근성이 좋지만 사망률이 높고 세포 생존율이 낮은 경우가 많다21.
미세입자로 인한 바늘 막힘은 절차상의 문제로 남아 있습니다. 세포 현탁액을 여과하고 막힌 바늘을 트리밍한 후 주입량을 재조정하는 것은 필수적인 단계입니다. 심낭이 조밀하게 채워진 배아만 후속 약물 치료에 사용해야 한다21,36.
제안된 배양 온도인 35°C는 인간 암세포의 자연 온도(37°C)와 표준 제브라피시 사육 온도(28°C)의 균형을 이룹니다21. 제브라피시 배아는 최소한의 발달 변형으로 이 온도에 적응하며, 환경은 신선한 환자 유래 세포의 증식과 생존을 향상시킵니다38.
약물 치료
제브라피시 이종이식 모델은 고처리량 약물 스크리닝을 용이하게 하기 위해 개발되었습니다. 그러나 약물 치료는 ZefiX 분석에서 가장 어려운 측면 중 하나로 남아 있습니다. 많은 표준 치료 약물 및 표적 치료법은 in vivo 이식 세포에 효과적으로 도달하지 못합니다. 또한 더 큰 약물 농도 패널의 테스트가 필요할 수도 있습니다. venetoclax 및 dasatinib과 같은 성공적인 사례는 기존 2D 배양 분석보다 훨씬 더 높은 농도를 필요로 합니다21.
또는 이식 전에 체외에서 세포를 전처리하면 특정 전신 및 국소 효과를 연구할 수도 있습니다. 예를 들어, 이 접근법은 교모세포종에서 아데노 관련 바이러스(AAV) 기반 치료에 적합할 수 있다39.
약물 치료의 효과가 in vitro에서 관찰되지만 이 파이프라인을 사용하여 in vivo가 아닌 경우, 대안은 예를 들어 1k 세포 단계(3hpf) 또는 포반기에 이식하고 24hpf에서 약물 치료를 시작하는 것일 수 있습니다40,41. 이를 통해 48시간 된 배아에서 성공하지 못한 이식 세포에 약물이 도달하거나 세포와 약물을 동시에 주입할 수 있습니다25.
Dissociation 및 유세포 분석
조직 해리는 총 이식 세포 수를 분석하고 실험 결과를 안정적으로 해석하는 데 중요합니다. 기계적 해리와 효소 해리의 조합은 세포 표면 단백질의 무결성을 유지하면서 고품질 단일 세포 현탁액을 보장합니다. 해리 조건(예: 효소 조성, 피펫팅 또는 Dounce 균질화 장치 사용)을 조정하는 것은 다양한 암 유형에 필요할 수 있습니다.
유세포 분석기의 막힘을 방지하기 위해 샘플을 여과해야 하며, 끈적한 단백질 또는 지질은 해리 전에 EDTA 또는 배아 탈노킹으로 완화할 수 있습니다.
요약
ZefiX 프로토콜은 전임상 암 연구, 약물 내성 연구 및 맞춤형 치료 평가를 위한 빠르고 비용 효율적인 실험 파이프라인을 제공합니다. 제브라피시 이종이식 모델에는 한계가 있고 모든 약물 유형을 수용할 수 없지만, 이 표준화된 프로토콜은 신선한 환자 백혈병 세포 및 세포주의 생체 내 증식을 가능하게 합니다. 다른 암 유형에도 적용할 수 있는 이 제품은 임상 의사 결정 기간 내에 빠르고 개인화된 약물 반응을 예측할 수 있는 유망한 도구를 제공합니다.
공개
모든 저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 Deutsche Forschungsgemeinschaft(DFG, 독일 연구 재단)의 지원을 받았으며, CRC1588 Collaborative Research Center , 프로젝트 번호 493872418 및 베를린 Dr. Kleist Stiftung, Deutsche José Carreras Leukämie Stiftung(R03/2016), Berliner Krebsgesellschaft(HEFF201633KK) 및 German Cancer Consortium(DKTK, Joint Funding Call 2016)의 지원을 받았습니다. 원고를 비판적으로 읽어준 율리아 쾨프케(Julia Köppke)와 마레이케 볼프(Mareike Wolff)에게 감사한다.
자료
| Name | Company | Catalog Number | Comments |
| Petri dish (10 cm) | Greiner | P7237 | |
| 7-AAD viability staining solution | Invitrogen | 00-6993-50 | |
| Agarose (LE, analytic grade) | Biozym | 840004 | |
| Air pressure injector | Narishige | IM400 | with external gas supply |
| Alexa Fluor 488 anti-human CD19 antibody | Biolegend | 302219 | |
| Annexin binding buffer | Biolegend | 422201 | Or see solutions for preparation |
| APC annexin V | Biolegend | 640941 | |
| Capillaries (10 cm, OD 1.0 mm, with filaments) | WPIINC | TW100F-4 | 1.0 OD; 0.75 ID |
| Cell culture flask (T-175) | Sarstedt | 83,39,12,002 | |
| CellTrace Violet | Invitrogen | C34557 | |
| Dimethyl sulphoxide (DMSO) | Roth | A994.1 | |
| Dispase II | Sigma Aldrich | D4693-1g | |
| DNase I | AppliChem GmbH | A3778 | |
| Eppendorf tubes (1.5 ml) | Eppendorf | 30120086 | |
| FACS tube (Polystyrene round botton Tube with Cell strainer Cap, 5 ml) | Falcon | 352235 | |
| Falcon tubes (50 ml) | Falcon | 352070 | |
| Fetal calf serum (FCS) | Sigma Aldrich | C8056 | |
| Fine mesh filter (10 µm) | PluriStrainer | 435001050 | |
| Fine mesh filter (20 µm) | PluriStrainer | 431002040 | |
| Flow cytometer | Becton Dickinson | BD LSRFortessa X-20 | |
| Fluorescent stereomicroscope | Leica | ||
| Fluorescent stereomicroscope with camera | Leica | M165 FC | Camera: DFC7000 T |
| Hank’s Balanced Salt Solution (HBSS, Calcium and Magnesium free ) | Sigma Aldrich | 88284 | |
| Injection mold (Zebrafish MI/Transplant KIT) | World Precision Instruments | Z-MOLDS | |
| Injection needles (without filament) | Biomedical instruments | VZIPbl-20-10-55 | Zebrafish injection pipette, blunt, OD: 20μm ± 1, TL:~10mm, PL: 55mm, Glass: BM100T-10P |
| Macro-centrifuge | Eppendorf | ||
| Micro-centrifuge | |||
| Morpholino (csf3r) | Gene Tools LLC | csf3r (GAAGCACAAGCGA GACGGATGCCA) | |
| Morpholino (spi1) | Gene Tools LLC | spi1(GATATACTGATAC TCCATTGGTGGT) | |
| Papain | Sigma Aldrich | P3125 | |
| Penicillin-Streptomycin (Penstrep; 10.000 U/ml) | Gibco | 15140122 | |
| Plates (4-well) | Greiner Bio one | 657160 | |
| Plates (96-well) | Greiner Bio one | 657180 | |
| Roswell Park Memorial Institute (RPMI) 1640 Medium | Gibco | 21875-034 | |
| Tricaine (MS-222) | Sigma Aldrich | E10521-50G | Ethy-3 aminobenzoate methanesulfenate |
참고문헌
- Fontana, C. M., Van Doan, H. Zebrafish xenograft as a tool for the study of colorectal cancer: a review. Cell Death Dis. 15, 1-12 (2024).
- Sturtzel, C., et al. Refined high-content imaging-based phenotypic drug screening in zebrafish xenografts. NPJ Precis Oncol. 7 (1), 1-16 (2023).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24, 2288(2023).
- Gamble, J. T., Elson, D. J., Greenwood, J. A., Tanguay, R. L., Kolluri, S. K. The zebrafish xenograft models for investigating cancer and cancer therapeutics. Biology. 10 (4), 252(2021).
- Costa, B., Estrada, M. F., Mendes, R. V., Fior, R. Zebrafish avatars towards personalized medicine-A comparative review between avatar models. Cells. 9 (2), 293(2020).
- Wang, W., et al. Progress in building clinically relevant patient-derived tumor xenograft models for cancer research. Animal Model Exp Med. 6 (5), 381-398 (2023).
- Xiao, J., Glasgow, E., Agarwal, S. Zebrafish xenografts for drug discovery and personalized medicine. Trend Cancer. 6 (7), 569-579 (2020).
- Fazio, M., Ablain, J., Chuan, Y., Langenau, D. M., Zon, L. I. Zebrafish patient avatars in cancer biology and precision cancer therapy. Nat Rev Cancer. 20 (5), 263-273 (2020).
- Costa, B., et al. Zebrafish avatar-test forecasts clinical response to chemotherapy in patients with colorectal cancer. Nat Comm. 15 (1), 4771(2024).
- Grissenberger, S., et al. Chapter 8 - Preclinical testing of CAR T cells in zebrafish xenografts. Method Cell Biol. 167, 133-147 (2022).
- Yan, C., et al. Single-cell imaging of T cell immunotherapy responses in vivo. J Exp Med. 218 (10), 20210314(2021).
- Pascoal, S., et al. A preclinical embryonic zebrafish xenograft model to investigate CAR T cells in vivo. Cancers. 12 (3), 567(2020).
- Pal, D., et al. Long-term in vitro maintenance of clonal abundance and leukaemia-initiating potential in acute lymphoblastic leukaemia. Leukemia. 30 (8), 1691-1700 (2016).
- Beneduce, G., et al. Blinatumomab in children and adolescents with relapsed/refractory B cell precursor acute lymphoblastic leukemia: A real-life multicenter retrospective study in seven AIEOP (Associazione Italiana di Ematologia e Oncologia Pediatrica) Centers. Cancers. 14 (2), 426(2022).
- Xie, J., et al. Short-course blinatumomab for refractory/relapse precursor B acute lymphoblastic leukemia in children. Front Pediatr. 11, 1187607(2023).
- Mengxuan, S., Fen, Z., Runming, J. Novel treatments for pediatric relapsed or refractory acute B-cell lineage lymphoblastic leukemia: Precision medicine era. Front Pediatr. 10, 923419(2022).
- Howe, K. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Lee, H. C., Lin, C. Y., Tsai, H. J. Zebrafish, an in vivo platform to screen drugs and proteins for biomedical use. Pharmaceuticals. 14 (6), 500(2021).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. J Clin Investigation. 122 (7), 2337-2343 (2012).
- Miao, K. Z., Kim, G. Y., Meara, G. K., Qin, X., Feng, H. Tipping the scales with zebrafish to understand adaptive tumor immunity. Front Cell Dev Biol. 9, 660969(2021).
- Gauert, A., et al. Fast, in vivo model for drug-response prediction in patients with B-cell precursor acute lymphoblastic leukemia. Cancers. 12 (7), 1883(2020).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. Mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), e49-e56 (2011).
- Pase, L., et al. Neutrophil-delivered myeloperoxidase dampens the hydrogen peroxide burst after tissue wounding in zebrafish. Current Biol. 22 (19), 1818-1824 (2012).
- Wijk, R. C. V., et al. Mechanistic and quantitative understanding of pharmacokinetics in Zebrafish larvae through nanoscale blood sampling and metabolite modeling of paracetamol. J Pharmacol Exp Ther. 371 (1), 15-24 (2019).
- Lázaro-Navarro, J., et al. Inhibiting casein kinase 2 sensitizes acute lymphoblastic leukemia cells to venetoclax via MCL1 degradation. Blood Advances. 5 (24), 5501(2021).
- Rhodes, J., et al. Interplay of pu.1 and gata1 determines myelo-erythroid progenitor cell fate in zebrafish. Developmental Cell. 8 (1), 97-108 (2005).
- Zakaria, Z. Z., Eisa-Beygi, S., Benslimane, F. M., Ramchandran, R., Yalcin, H. C. Design and microinjection of Morpholino antisense oligonucleotides and mRNA into zebrafish embryos to elucidate specific gene function in heart dvelopment. J Vis Exp. (186), e63324(2022).
- ZFIN: Zebrafish Book: Contents. , https://zfin.org/zf_info/zfbook/cont.html (2025).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Hasegawa, E. H., Gist H Farr, I. I. I., Maves, L. Comparison of pronase versus manual dechorionation of zebrafish embryos for small molecule treatments. J Dev Biol. 11 (2), 16(2023).
- Wattrus, S. J., Zon, L. I. Stem cell safe harbor: the hematopoietic stem cell niche in zebrafish. Blood Adv. 2 (21), 3063-3069 (2018).
- Harvie, E. A., Huttenlocher, A. Neutrophils in host defense: new insights from zebrafish. J Leukocyte Biol. 98 (4), 523-537 (2015).
- Page, D. M., et al. An evolutionarily conserved program of B-cell development and activation in zebrafish. Blood. 122 (8), e1-e11 (2013).
- Nguyen-Chi, M., et al. TNF signaling and macrophages govern fin regeneration in zebrafish larvae. Cell Death Dis. 8 (8), e2979-e2979 (2017).
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Dis Models Mech. 13 (1), dmm041889(2020).
- Rebelo de Almeida, C., et al. Zebrafish xenografts as a fast screening platform for bevacizumab cancer therapy. Comm Biol. 3 (1), 1-13 (2020).
- Pringle, E. S., et al. The zebrafish xenograft platform-A novel tool for modeling KSHV-associated diseases. Viruses. 12 (1), 12(2020).
- Pype, C., et al. Incubation at 32.5 °C and above causes malformations in the zebrafish embryo. Reprod Toxicol. 56, 56-63 (2015).
- Xu, X., et al. Adeno-associated virus (AAV)-based gene therapy for glioblastoma. Cancer Cell Int. 21 (1), 76(2021).
- Siebert, J., et al. Rhabdomyosarcoma xenotransplants in zebrafish embryos. Pediat Blood Cancer. 70 (1), e30053(2023).
- van Bree, N., et al. Development of an orthotopic medulloblastoma zebrafish model for rapid drug testing. Neuro-Oncol. noae210, (2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유