Method Article
ゼブラフィッシュ胚における白血病細胞移植片を用いた迅速な in vivo 薬物応答予測
要約
このプロトコールは、一過性免疫抑制ゼブラフィッシュ胚の細胞株および新鮮な患者材料からヒト急性リンパ芽球性白血病(ALL)異種移植片を作製およびトラブルシューティングするためのステップバイステップの手順と、フローサイトメトリーを使用した薬物反応評価のガイドラインを提供します。実験パイプラインは、固形腫瘍にも適応できます。
要約
ゼブラフィッシュ異種移植は、ヒトのがんの病因を調査し、個々の薬物反応を予測するための極めて重要な技術です。この文書では、一過性免疫抑制されたゼブラフィッシュ胚の初代B細胞前駆体急性リンパ芽球性白血病(BCP-ALL)患者サンプルまたは不死化細胞株を増殖するための合理化されたプロトコール(ZefiX)を紹介し、治療反応の高分解能シングルセル解析にフローサイトメトリーを利用します。固形腫瘍の生着と比較して、白血病細胞は、モルフォリンアンチセンスオリゴヌクレオチドベースのマクロファージおよび好中球分化因子のアッセイ中の抑制から大きな利益を得ます。解離した移植片細胞のフローサイトメトリー解析により、細胞ごとに細胞数、増殖速度、および処理後の活力を正確に評価できます。このアプローチは、ベネトクラクスやダサチニブなどの標的治療薬を用いて検証されており、治療結果は、関連する患者サンプルの臨床記録や従来の2D培養コントロールと比較されています。特に、このプロトコルは7日以内に完了し、臨床上の意思決定のタイムラインと一致しています。この方法論は、固形腫瘍を含むさまざまな種類のがんで選択した薬剤の試験に適応できるため、個別化された治療戦略をサポートします。しかし、評価できる薬剤の数には制限があり、おそらくゼブラフィッシュの胚における薬物動態学的制約によるものと思われる。
概要
ゼブラフィッシュの異種移植は、がんの病因を理解し、薬物反応を予測するための重要なin vivoモデルとなっています1,2,3,4,5。動物モデルは前臨床薬物試験にとって依然として重要であり、ゼブラフィッシュモデルは、ハイスループットとコスト効率6,7,8など、他のin vivoシステムに比べて大きな利点を提供します。 このモデルは、分子標的療法やCAR-T細胞療法9,10,11,12など、個別化治療の反応予測にも役立つ可能性があります。
BCP-ALLは、培養中の初代患者細胞の増殖が依然として困難であるため、ゼブラフィッシュ異種移植から特に恩恵を受けることができます13。ALLには、新しい治療アプローチの必要性が否定できません。BCP-ALLの小児では80%〜85%の高い寛解率にもかかわらず、再発または難治性疾患の患者の長期生存率は約30%〜60%の範囲にすぎない14,15,16。そのような場合、提案されたパイプラインを使用した薬物試験を臨床現場に統合して、最適な患者特異的な治療法を特定することができる14,15。この個別化されたアプローチは、複数の薬剤耐性に対処する際に重要であり、重篤な副作用を伴う効果のない薬物や最適でない薬剤を避けることで、患者の治療負担を大幅に軽減します。
いくつかの特徴により、ゼブラフィッシュの胚異種移植は適切なモデルとなっています。ヒトとゼブラフィッシュの遺伝的類似性(遺伝的相同性が70%、疾患関連遺伝子が84%の共有)は、遺伝子と薬物の相互作用研究を裏付けています17。したがって、トランスジェニック宿主胚を用いることで、薬物感受性に影響を与える遺伝的素因を明らかにすることができる18。あるいは、特定の遺伝子改変を施した細胞を移植して、薬剤の感受性または耐性が in vitro 所見と一致するかどうかを評価することもできます。ゼブラフィッシュの胚異種移植片は、薬物の潜在的な全身作用についての洞察も提供します。生後2〜3日の胚の臓器発生は完全には成熟していないが、臓器は正しく局在しており、細胞組成を成体と部分的に共有している19。
このモデルのさらなる利点には、生着に必要ながん細胞が数個しかないこと、生後5日以内に摂食が不要なため宿主胚の維持が簡単であること、胚の透明性とサイズにより注入の成功を迅速に評価できることなどがあります。ユニークな特徴は、この発達段階では自然免疫のみが活動し、効率的な生着を促進することです20。ここで説明するZefiXプロトコル(図1の要約を参照)では、マクロファージと好中球の分化を阻害するspi1およびcsf3rを標的とする安定なモルフォリノアンチセンスオリゴヌクレオチドを使用して、生後4日間の自然免疫系を抑制することにより、免疫不全がさらに強化されます21,22,23。
また、このプロトコルは、主に固形腫瘍移植片用に開発され、通常はホールマウントイメージングベースの薬物反応評価法を使用する以前のゼブラフィッシュ異種移植プロトコルとも異なります。ZefiXは、BCP-ALL細胞などの液体がん細胞に最適化されており、新鮮または新鮮凍結の患者材料21の増殖に成功しています。ZefiXは、組織の解離に適した酵素を選択することにより、接着がん細胞にも適応させることができます。
また、フローサイトメトリーを用いたダウンストリーム解析には、(i)多数のグラフト細胞を迅速に処理できるため、シングルセルレベルでの堅牢な統計解析が可能、(ii)個々の細胞で増殖速度と生存率を同時に評価できる、(iii)臨床研究の現場で一般的に利用可能なフローサイトメーターなど、いくつかの利点があります。 数時間以内に単一細胞レベルでの移植片細胞の薬物応答評価を可能にします。再現性を確保するために、このプロトコルは、調製から移植、フローサイトメトリー分析までの標準化されたパイプラインを提供し、1週間以内にすべての細胞の薬物反応を予測することを可能にします。
プロトコル
すべてのゼブラフィッシュ実験は、ベルリン自由大学実験医学研究所のガイドラインおよび公的機関に準拠しています。すべての研究は、ゼブラフィッシュの胚を受精後6日(dpf)<、動物保護法から免除することを対象としていました。ゼブラフィッシュ(Danio rerio)は、標準的なプロトコルに従って、ドイツのベルリンにあるベルリンのCharité-Universitätsmedizinの動物施設で飼育および維持されました。それらは28°Cで収容され、14時間のライトサイクルと10時間のダークサイクルで収容されました。すべての実験には、AB系統またはTüLF系統の野生魚を使用しました。
注:ZefiXを適用する前に、各目的の薬物に最適な治療条件を確立するには、いくつかの必要な手順が含まれます。まず、従来の2D培養システム内の適切な細胞株を使用して、各薬物の半値阻害濃度(IC50)を決定します。これまでの経験に基づくと、ZefiX治療のための有効薬物濃度は、典型的な細胞培養条件下で使用されるものよりも5倍〜50倍高くなる可能性がある21,24。生着胚を治療する前に、確立された濃度範囲を使用して、移植されていない宿主胚内の毒性を評価することが不可欠です。毒性を評価した後、細胞株生着胚を、2D培養で以前に決定されたIC50値の約50倍のさまざまな薬物濃度に曝露します。移植された細胞がIC50の100倍までの投与量に反応を示さない場合、その薬剤はZefiXに対して効果がないと考えられます。有効性を高める可能性を秘めている1つの選択肢は、移植細胞を胚に移植する直前に、移植細胞を薬剤で予示することである25。ここで使用するすべてのソリューションについては、表 1 を参照してください。
1. 1日目:実験の準備
- E3培地調製:胚の維持に使用する2 LのオートクレーブE3培地を調製します。
- モルフォリノアンチセンスオリゴヌクレオチド(MO)調製:ヌクレアーゼフリー水を使用して、1.5 mLの微量遠心チューブに両方のMOを含む50 μMのストック溶液を調製します。原液は室温(RT)で保存してください。MOを注入用に調製するには、溶液を65°Cの加熱ブロックで10分間インキュベートします。
注:MOは、参考文献22、23、26に記載されているように、マクロファージと好中球細胞の分化を阻害するためにspi1とcsf3rに向けられています。 - インジェクションプレートの調製
- 4〜5枚のプレートを調製するには、1%アガロースをE3培地に溶解して100mLの溶液を作成します。移植プレートの場合は、各10cmのシャーレに~20mLの溶液を注ぎ、半分満たされていることを確認します。渦巻き状にして液体を均等に分配します。
- モルフォリノ注射プレートの場合、射出成形金型を2つのペトリ皿の液体アガロースに置き、気泡が形成されないようにします。蓋を傾けて皿を覆い、アガロースが固まるまでRTに置いておきます。固まったら、型を取り出し、プレートを逆さまにして4°Cで密封されたビニール袋に保管します。
- 注射針の調製
- モルフォリノ注射の場合:ニードルプラーを使用して10cmの毛細血管から針を生成し、先端を折って推定直径10μm(27で説明)を達成します。
- 細胞移植の場合:外径20μmの市販のプル済み鈍端注射針を使用してください。
- 移植片細胞培養:10%FCSと1%P/S(RPMI-完全)を添加したRPMI培地を添加したT175細胞培養フラスコで、4日目に70%〜80%の目標密度を目指して細胞(Nalm6など)を分割します。適切な増殖速度を確保するために、使用前に細胞を3〜4回分割してください。
注:移植用の新鮮または新鮮/冷凍の患者材料の準備については、手順4.3に記載されています。その後、移植の日に細胞を調製します。 - ゼブラフィッシュの繁殖:午後に野生型のゼブラフィッシュを飼育水槽に設置し、オスとメスを分けます。
注:ゼブラフィッシュは、参考文献28に記載されているように飼育され、ステージングされました。時間参照(hpfまたはdpf)は、受精後の数時間または数日を示します。
2. 2日目:モルフォリノ注射
- オートクレーブ滅菌したE3培地500mLに1%ペニシリン/ストレプトマイシン(E3/P/S)を添加し、10 cmのシャーレ2枚を満たします。インジェクションプレートを冷蔵庫から取り出して、RTで予温します。
- 繁殖タンクのゲート開口部をずらして、一度に一部のタンクでしか受精が行えないように(注射速度に応じて)、1細胞ステージのゼブラフィッシュ胚へのモルフォリノ溶液のタイムリーなマイクロインジェクションを確保します28,29。インジェクターの速度に応じて1つまたは2つのゲートを開くことから始め、1つのバッチの卵が容易に注入されるときに、別のゲートまたは2つのゲートを開きます。
- 受精卵を100個ずつ、できるだけ液体を含まずに、前に作成した注入プレートに移します。プレートの溝に胚を位置合わせします。
- 1細胞ステージ29の間に、両方のモルフォリノの50μM混合物を細胞または細胞のすぐ下の卵黄嚢に1nL注入します。その後の処置のために十分な卵子を注入します(例えば、96ウェルプレート1枚につき、移植前にドロップアウトの可能性に備えて十分なバックアップを確保するために、最大200個の卵子を注入します)。
- 注入した卵をE3/P/Sを含むシャーレに移し、注入した卵を28°Cでインキュベートします。 注入されていない卵をコントロール魚として保持し、フローサイトメトリー分析を5 dpfで行います。残りのE3/P/S培地は4°Cで保存します。
3. 3日目:脱絨毛症
- ゼブラフィッシュの胚の脱絨毛症:24 hpfより古い胚の胚を手動で脱絨毛します29。
- 心拍や動きを示さず、不透明に見える死んだ胚や不規則な形の胚をパスツールピペットで皿から取り出します。
- 精密鉗子で絨毛膜をつまんで所定の位置に保持します。精密鉗子の先端のすぐ横をつまみ、2番目の鉗子で胚を所定の位置に保持し、絨毛膜を慎重に引き離して胚を解放します
注:24 hpf未満の胚を解体するには、プラスチックに付着しないように、アガロースでコーティングされた皿に保管する必要があります。手動の脱絨毛術は、胚にとってより優しいため、好ましいです。代替の酵素的脱絨毛法は、他の場所で記載されている30。
- 脱絨毛膜化胚を28°Cで一晩インキュベートします。
4. 4日目:異種移植と薬物治療
- 宿主胚の調製:準備したアガロースプレートとE3/P/Sを冷蔵庫から取り出し、実体顕微鏡を使用して48 hpfで適切な発生段階の胚をRT.スクリーニングします。適切に病期分類され、形態学的に典型的な胚のみをワークフローに含める(他の場所で述べられているように29)。すべての健康な胚を数え、さらなる治療を計画します。酸素不足による不均一な発生速度を避けるために、10cmのペトリ皿あたり28°Cあたり100個以下の胚を保管してください。
注意: 手順4.2に従います。細胞株用。新鮮/冷凍材料の場合は、ステップ4.3に直接進んでください。 - 細胞株の調製
- フローサイトメトリーおよび移植用の蛍光標識BCP-ALL細胞を調製するには、細胞(ステップ1.5以降)を1x PBSで洗浄します:350 x g で5分間遠心分離し、20 mLのPBSに再懸濁します。
- 細胞をカウントし、3 x 105 未染色細胞を FACS チューブに移して、0 日目 (注射後 0 日、dpi) フローサイトメトリー分析を行います。氷の上に保存します。
- 6ウェルプレートの1ウェルで3 mLのRPMI-completeに5細胞を 3 x 10 5細胞でプレートし、37°Cで3 dpi制御します。
- 1 x 107 細胞を15 mL遠心チューブに移し、CTV標識を行います。350 x g で5分間RTで遠心分離し、上清を注ぎ(残りはピペットを使用)、ペレットを2.5 mLのPBS(RT)と1 μLのCTVストック溶液に再懸濁します。
- 暗所37°Cで5分間インキュベートし、12.5 mLのRPMI-completeで反応を停止し、暗所37°Cで10分間インキュベートします。
- 350 x g でRTで5分間遠心分離し、10 mLのRPMI-completeで1回洗浄します。再度遠心分離し、10 mLのRPMI-completeに再懸濁します。
- 10 μmフィルターを使用して、350 x g で5分間遠心分離することにより、細胞をろ過します。ペレットを再懸濁し、細胞をカウントし、3 x 105 CTV標識細胞をFACSチューブに移します。6ウェルプレートの1ウェルで3 mLのRPMI-completeを含む3x 10^5細胞をプレートし、37°Cで3 dpiの増殖制御を維持します。残りの細胞は、移植するまで氷上のPBS1 mLで保存します。
- 新鮮/冷凍患者用材料の調製
- 2本の15 mL遠心分離チューブを、それぞれ10 mLのRPMI-completeで37°Cで予温します。 5-10 x 106 細胞を含むバイアルを37°Cの水浴で解凍します。
- 氷が少量しか残らなくなったら、あらかじめ温めた培地で細胞を遠心分離管に移します。350 x g で5分間RTで遠心分離し、上清を捨てて、事前に温めたRPMI-completeの2番目のチューブにペレットを再懸濁します。
- トリパンブルーを使用して生細胞をカウントします。1x 10^5細胞を1.5mLの遠心チューブに分注し、このFACSチューブ内の細胞のこの分注を350 x g でRTで5分間遠心分離し、上清を廃棄し、ペレットを300μLのPBSに再懸濁します。
- 再懸濁したアリコートを、フローサイトメトリー解析のための未処理のコントロールとして氷上に保存します。
注:十分なサンプルサイズが許す場合は、7日目にフローサイトメトリー測定のために培養物で未処理のコントロールを維持してください。 - 1 x 106細胞ごとに、1 μLのCTVストック溶液を2.5 mLのPBS(RT)に加えます。利用可能なセルが少ない場合は、CTVストック溶液の容量を調整します。
- 暗所で細胞をCTVと5分間、37°Cでインキュベートし、予熱した(37°C)RPMI-completeを12.5 mL加えて反応を停止し、暗所、37°Cで10分間インキュベートします。
- 細胞を350 x g でRTで5分間遠心分離し、10 mLのRPMI-completeで細胞を1回洗浄します。350 x g でRTで5分間再度遠心分離し、細胞を10 mLのRPMI-completeに再懸濁します。
- 10 μmフィルターを使用して細胞懸濁液を新鮮な50 mL遠心チューブにろ過し、350 x g で5分間遠心分離します。
- 上清を捨てないでください。ペレットを再懸濁し、細胞をカウントします。3 x 105 CTV標識細胞を1つのFACSチューブに移します。
- 残りの細胞を350 x g でRTで5分間遠心分離し、上清を捨てます。残りの細胞をPBS1 mLに再懸濁し、移植に使用するまで氷上に保存します。
注:十分なCTV陽性細胞が残っている場合は、増殖速度の比較のために異種移植片と並行して2D培養で維持することができます。
- フローサイトメトリー測定
注:0 dpiでのフローサイトメトリーは、移植前に細胞が氷上に留まる時間を最小限に抑えるために、2人目の人が行う必要があります。指定の染色パネル(CTV、CD19-Alexa488、APC-Annexin V、および7AAD)を使用して最初のフローサイトメトリー測定を行う前に、製造元の指示に従ってコンペンセーション試験を実施してください。- 次のように2つのFACSチューブを準備します:チューブ1:未染色のコントロール細胞;チューブ2:CTV、CD19、7AAD、およびアネキシンで染色した細胞。
注:染色と標識:CellTrace Violet(CTV)は、標識された移植片細胞と宿主魚細胞を同定し、3日後の増殖速度を評価します。細胞表面マーカーであるCD19抗体は、ヒトBCP-ALLグラフト細胞を同定するための追加マーカーとして機能します。他の種類のがんについては、代替のマーカー抗体が必要な場合があります。アネキシンVは、細胞生存率評価のための初期段階のアポトーシスを示します。7AADは、細胞生存率評価のための後期アポトーシスまたは壊死を示します。 - チューブ(1つはCTV染色細胞を含み、もう1つは未染色細胞を含む)を350 x g で5分間RTで遠心分離し、チューブ1から上清を捨てます。ペレットを310 μLのアネキシン結合バッファー(ABB)に再懸濁します。
- チューブ2:以下に説明するように抗体および生存率の染色を行います。
注:この染色プロトコルは、CD19 B細胞の染色に最適化されています。異なる細胞タイプの標識に使用される他のヒト抗体については、プロトコールの適応が必要な場合があります。- 98 μL の ABB をチューブ 2 (CTV 標識細胞を含む) に加えます。添加した98 μLのABBに2 μLのCD19-Alexa488抗体(1:50希釈)を加えます。よく混ぜます。
- 混合物を4°Cで30分間インキュベートし、500 μLのABBを加えて反応を停止させます。チューブを350 x gで4°Cで5分間遠心分離します。 上澄みを取り除き、洗浄手順を繰り返します。
- 細胞ペレットを100 μLのABBに再懸濁し、7AADおよびAPC-アネキシンV染色に進みます。以下に説明するように、7AADおよびAPCアネキシンV染色およびフローサイトメトリー測定を実施します。
- 再懸濁細胞に5 μLの7AADと5 μLのAPC-Annexin Vを添加します。やさしく渦を巻いて混ぜます。室温でチューブを15分間インキュベートし、ABBを200 μL加えて最終容量310 μLにします。
- 移植当日にフローサイトメトリー解析を、クロスコンタミネーションを避けるために、未染色のコントロール細胞(チューブ1)、Alexa488-CD19、APC-アネキシンV、および7AAD(チューブ2)で染色したCTV標識細胞の順に行ってください。十分な分析のために、サンプルあたり少なくとも10,000のイベントを記録します。
- 次のように2つのFACSチューブを準備します:チューブ1:未染色のコントロール細胞;チューブ2:CTV、CD19、7AAD、およびアネキシンで染色した細胞。
5. 移植
- 移植プレート:E3 / P / Sで満たされた2つの1cmシャーレを準備し、28°Cのインキュベーターに少なくとも30分間置いて予温します。
- 細胞調製:細胞を350 x g でRTで5分間遠心分離し、上清を廃棄し、マイクロピペットを使用して残りの液体を除去します。PBSを添加して最終容量を20 μLにします。濃縮した細胞懸濁液を氷上に保ちます。
注:移植手順中に細胞を2時間以上氷上に残さないでください。 - 移植針と宿主胚調製
- 25-30個の胚を、E3/P/Sを含む予熱済みのシャーレの1つに、ガラス製のパスツールピペットを使用してコントロールとして移します。マイクロローダーチップを使用して、細胞懸濁液の4μLを移植針にロードします。
注:ロードは1〜2分以内にスムーズに進行します。そうでない場合は、細胞懸濁液にPBSを慎重に追加します。 - マイクロインジェクターを調整して、注入圧力とパルス長を校正します。1回の注入で約1,000個のALL細胞または2 nLの細胞懸濁液が排出されるまで調整します(20 μL中の1x 107 細胞の場合)。1,000個の細胞を推定するには、培地で覆われたアガロース表面に大量の懸濁液を排出します。小さな領域で100個の細胞を数え、それらの分布を全細胞集団に外挿し、総数を推定します。
- トリカインを含むE3を50mL調製します(最終濃度:80 mg / L)。宿主胚をトリカイン溶液に移し、適切な麻酔を確保するために少なくとも2分間インキュベートします。胚は、運動反応が観察できない場合に適切に麻酔されます
注:マイクロローダーチップまたは鉗子を使用して、胚に慎重に近づいたり、触れたりすることができます。 - 15〜20個のデコレーション胚をアガロースコーティングされた注射皿に移します(以前の準備手順を参照)できるだけ少ない液体を使用して、胚が滑るのを防ぎます。.
- 図2Aに示すように胚を配置します。約1,000個のCTV陽性BCP-ALL細胞を心膜腔に注入します。図2Bに示すように、背尾方向から45°の角度で針を導入して細胞を注入します。
注:小さな白血病細胞用に特別に設計された、開口径20μmの市販の引っ張られた鈍い端の針を使用してください(材料リストを参照)。針が詰まった場合は、必要に応じてトリミングしますが、後で注入量と細胞数を再調整します。 - すべての15〜20個の胚を注入したら、E3 / P / Sで満たされた予熱したペトリ皿に移し、28°Cに維持します。
- 約100〜150個の胚が1つの薬物治療アッセイに移植されるまで、この手順を繰り返します。これには、3つの薬物濃度と1つのコントロールが含まれている必要があります。
- 移植した胚と移植していないコントロールの両方を28°Cで1〜3時間インキュベートしてから、薬物治療を開始します。
- 25-30個の胚を、E3/P/Sを含む予熱済みのシャーレの1つに、ガラス製のパスツールピペットを使用してコントロールとして移します。マイクロローダーチップを使用して、細胞懸濁液の4μLを移植針にロードします。
- In vivo 薬物治療(96ウェルプレート)
- 蛍光立体顕微鏡を使用して、胚をスクリーニングし、生着が成功したことを確認します(図2C)。卵黄環境は移植片細胞21に有毒である可能性があるため、卵黄が無傷であることを確認してください。卵黄に細胞がある胚を捨てます。
- E3/P/S で 0.5% DMSO を使用して試験する薬物状態ごとに、2x 濃縮溶液 2.5 mL を調製します。さらに、E3/P/S に 0.5% DMSO を含む 5 mL のビヒクル制御溶液を調製します。
- 100 μL の E3/P/S + 0.5% DMSO を 96 ウェルプレートの各ウェルに添加します。このステップにより、ウェル間での最小限の薬物量の意図しない移動が防止されます。
- 生着した胚を1つずつ慎重に各ウェルに移します。ガラス製のパスツールピペットを使用して、できるだけ少ないE3培地で各胚をピックアップします。
- ピペットを静かに傾けて胚をピペットチップの底に沈め、毛細管現象の力でウェルに放出します。移し替え中は、ウェル内の培地に触れないでください。
- プレートに薬物溶液を添加する:96ウェルプレートの24ウェル(2列)に、ビヒクル制御溶液または3つの2倍濃縮薬物溶液のいずれか100μLを充填します。
注:有効薬物濃度は、試験対象の各薬物に固有の以前の実験で決定する必要があります。 - 移植されていない胚を含む胚を35°Cで72時間維持します。これは、7日目のフローサイトメトリー分析のコントロールとして機能します。
6. 7日目
- 胚/移植片の解離
- 実体顕微鏡を使用して96ウェルプレートをスクリーニングし、健康なゼブラフィッシュの胚を同定して選択します。各条件から10個の健康な宿主胚を1.5 mLの微量遠心チューブにランダムにプールします(理想的には、条件ごとに2つのチューブになります)。
- 各胚を含むチューブからできるだけ多くの液体を取り除き、チューブを氷上で1時間インキュベートすることにより、低熱ショックによって胚を犠牲にします。
- カルシウムおよびマグネシウムを含まないハンク平衡塩溶液(HBSS)を各チューブに500 μL加えます。200 μLのマイクロピペットチップを使用したトリチュレーションにより、胚と移植片細胞を機械的に解離し、約15倍にピペッティングします。
- 組織片を350 x g で5分間RTで遠心分離することにより、ペレット化します。その間に、条件ごとに2mLのPBSを含む35μmのファインメッシュフィルターストレーナキャップ(合計4本のチューブ)でFACSチューブを準備します。
- 各ペレットを500 μLの酵素ミックス(0.01%パパイン、0.1%ディスパーゼII、0.01%デオキシリボヌクレアーゼI、および12.4 mM MgSO4 、カルシウムおよびマグネシウムフリーHBSS)に再懸濁して、酵素的解離を行います。室温で15分間インキュベートします。
- インキュベーション中は、組織の損失を防ぐために、個々のチューブごとに同じピペットチップを使用して、混合物を5分ごとに繰り返しピペットで上下させます。
- フローサイトメトリー測定
- 解離した細胞をFACSチューブの35μmファインメッシュフィルターストレーナキャップに移し、350 x g で5分間遠心分離します。
- 遠心分離中に、CD19 B細胞表面染色用のマスターミックスを調製します。各疾患について、98 μL の ABB と 2 μL の Alexa Fluor 488 抗ヒト CD19 抗体を併用します。
- 解離した細胞ペレットから上清を捨て、ペレットをCD19染色マスターミックス100μLに再懸濁します。
- パラレルセルカルチャーからの3 x 105 CTV陽性細胞(利用可能な場合)を含むすべてのZefiXサンプルに対して、CD19、7AAD、およびAPC Annexin V染色プロトコルを実施します。
- 順序に従ってフローサイトメトリー解析を実施し、 表2に概説されているイベントの数を記録します。宿主細胞と移植片細胞を含むすべてのサンプルを可能な限り完全に分析して、移植片細胞の総数を評価します。
- 商用ソフトウェアを使用した結果の分析。
- 細胞培養サンプルのゲーティング戦略:ソフトウェアを開き、FCSファイルをワークスペースにロードします。CD19とCTVでドットプロットを作成し、シグナルが重なっていることを確認し、がん細胞の存在を確認します。次に、FSC-A(x軸)とSSC-A(y軸)のドットプロットを作成し、無傷の細胞(Q2)と破片(Q4; 図3A')。
- Intact Cells集団を使用して、SSC-H(x軸)とSSC-A(y軸)の新しいプロットを作成し、単一細胞を同定します(図3A'')。
- シングルセル集団を使用して、Annexin V(x軸)と7AAD(y軸)で別のドットプロットを作成します(図3A''')。細胞を4つの集団に区別します:生存細胞:アネキシンV陰性、7AAD陰性(Q4);初期アポトーシス細胞:アネキシンV陽性、7AAD陰性(Q3);後期アポトーシス/壊死細胞:アネキシンV陽性、7AAD陽性(Q2);壊死細胞:アネキシンV陰性、7AAD陽性(Q1)。
- 3 dpi のサンプルに対してこれらの手順を繰り返します (図 3B)。
- 移植片および宿主胚細胞のゲーティング戦略
- CTV(x軸)とCD19(y軸)のドットプロットを使用して、宿主細胞からヒト移植片細胞を分離します。CTV/CD19ダブルポジティブグラフト細胞を同定し、単離します(図3C)。
- 3 dpi培養細胞(図3B'-B''')について説明したのと同じゲーティング戦略をグラフト細胞集団に適用します。一貫性を保つために、ゲーティング戦略をコピーします。
- すべてのアネキシンV陰性および7AAD陰性の細胞集団を、X軸にCTV値を持つヒストグラムに統合します(図3D)。5つのサンプルすべての幾何平均を計算して、増殖速度を決定します。
- 治療反応評価の計算
- 3日後の細胞分裂数を決定するには、次の式を使用します。
n = log2 (I0/I)
ここで、I0 = 初期 CTV 蛍光強度 (幾何平均、0 dpi)、I = 72 時間での CTV 蛍光強度、n = 細胞分裂の数。
例:ZefiXログ2(88317/14644)= 2.6で2.6倍に分割された新鮮凍結患者細胞
2D培養ログで2.8倍(88317/12992)= 2.8 - 魚1匹あたりの移植片細胞の総数を決定するには、3日後にがん細胞の総数(アポトーシス細胞を含むが、破片は除く)をサンプルにプールされた魚の数(通常はn = 10)で割ります。
- 3日後のCTV陽性移植片細胞の生存率を判断するには、次の式を使用します。
V = (C/100) x A
ここで、V = 生存率、C = 破片のない無傷の単一細胞の割合 (パーセンテージ)、A = アネキシン V および 7AAD 陰性細胞の割合 (パーセンテージ)
- 3日後の細胞分裂数を決定するには、次の式を使用します。
結果
新鮮凍結の初代BCP-ALL細胞サンプルの異種移植および薬物処理を含むZefiXプロトコルの詳細な科学的評価については、以前に発表された原稿21を参照してください。前臨床薬物試験の研究における患者サンプルの使用は、ALL-REZ BFM 2002試験(NCT00114348)およびALL-REZ BFMレジストリおよびバイオバンク(EA2/055/12)の追加試験の一部として、また、国内当局によるIntReALL SR 2010国際試験(NCT01802814)の追加試験の一部として承認されました。インフォームドコンセントは、患者および/またはその保護者から、彼らが登録されたそれぞれの試験またはレジストリを通じて得られました。
図2は、注入前のアガロース皿内の胚の整列の例を示しており、注入プロセスの効率化に役立ちます。注射は、発達中の心臓を囲む空洞を正確に標的にするために描かれた角度で実行する必要があります。.さらに、 図2C は、注入前にCTVで標識されたヒト移植片細胞(青)を含む2つのdpf胚を首尾よく注入した参考文献を提供する。 図2C に示されているものとは異なる注入結果を持つ胚を除外し、特に卵黄嚢の穿孔を避けて、その後の3日間のインキュベーション中に移植片細胞の生存率を確保することに重点を置きました。
3日間のインキュベーション期間の後、宿主胚はフローサイトメトリー分析のために10個のプールで処理されます。酵素解離後、細胞懸濁液を抗ヒトCD19抗体と2つの生存マーカー(初期アポトーシス細胞用のアネキシンVと後期アポトーシス細胞および壊死細胞用の7AAD)で染色します。
図3は、BCP-ALL患者様のZefiX増大BCP-ALL細胞のフローサイトメトリーデータを示しています。パネルA、A'、A''、A''、およびA'''は、移植日に0dpiで収集されたデータを示しています。 図3A は、3dpiの宿主グラフト細胞懸濁液に適用されるゲーティング戦略の参照として、合計10,000個の細胞のCTVおよびCD19蛍光値を示しています(図3C)。 図3A'では、前方散乱領域(FSC-A)と側面散乱領域(SSC-A)を使用して細胞を規則的にゲーティングすることにより、破片が排除されています。 図3A''では、SSCの高さ(SSC-H)とSSC-Aのグラフを使用して、単一のセルをダブレットから分離しています。この単一細胞集団は、 図3A'''の生存率評価に使用され、生存細胞(Q4)は初期のアポトーシス細胞(Q3、より高いアネキシンV値)および後期のアポトーシス細胞または壊死細胞(Q2、より高い7AADレベル)と区別されます。
比較のために、従来の2D条件下で培養した患者細胞は、同じゲーティング戦略に従って、3日後にフローサイトメトリーでも分析されます(図3B、B'、B''、B''')。2D培養における72時間後の患者細胞の生存率は、 図2B' のQ2と 図2B'''のQ4から計算されます:(95.0%/100)*61.9%= 58.8%。
図3Cにおいて、出発物質は、移植片細胞を含む宿主胚からの細胞懸濁液である。in vitro測定とは異なり、チューブ内のすべての細胞はフローサイトメトリーによって分析されます。CD19およびCTV陽性移植片細胞は、CD19およびCTV陰性の魚細胞からそれらを分離するためにゲーティングされています。無傷の移植片細胞集団は、破片が除外されている図3C'でさらに分析されます。次に、シングルグラフト細胞の生存率を、図3Bと同じゲーティング戦略を使用して評価します。
結果は、胚で増殖した生存細胞の単一細胞の割合が95.2%であり、これは皿で培養された細胞の生存率よりも1.6倍高いことを示しています(図3B'''')。細胞分裂速度は、各集団におけるCTV蛍光強度の0dpiから3dpiへの減少を分析することにより、in vivoおよびin vitroで計算しました(図3D)。細胞分裂の数は、セクション6.4.1の式と各CTV曲線の幾何平均を使用して決定しました(図3D)。計算された分裂率(in vivoで2.59分裂、in vitroで2.77分裂)は、生存細胞が両方の条件下で3日間にわたって同様の速度で分裂することを示唆しています。
最後に、3日後の胚当たりの無傷の移植片細胞の平均数を、無傷の移植片細胞の数(破片を除く、 図3C')をチューブ21にプールされた胚の数で割ることによって決定した。
結論として、ゼブラフィッシュの胚に生着させた新鮮なBCP-ALLサンプルは、従来のディッシュでの培養と比較して3日後に高い生存率を示し、生存細胞は両方の条件で同等の速度で分裂します。
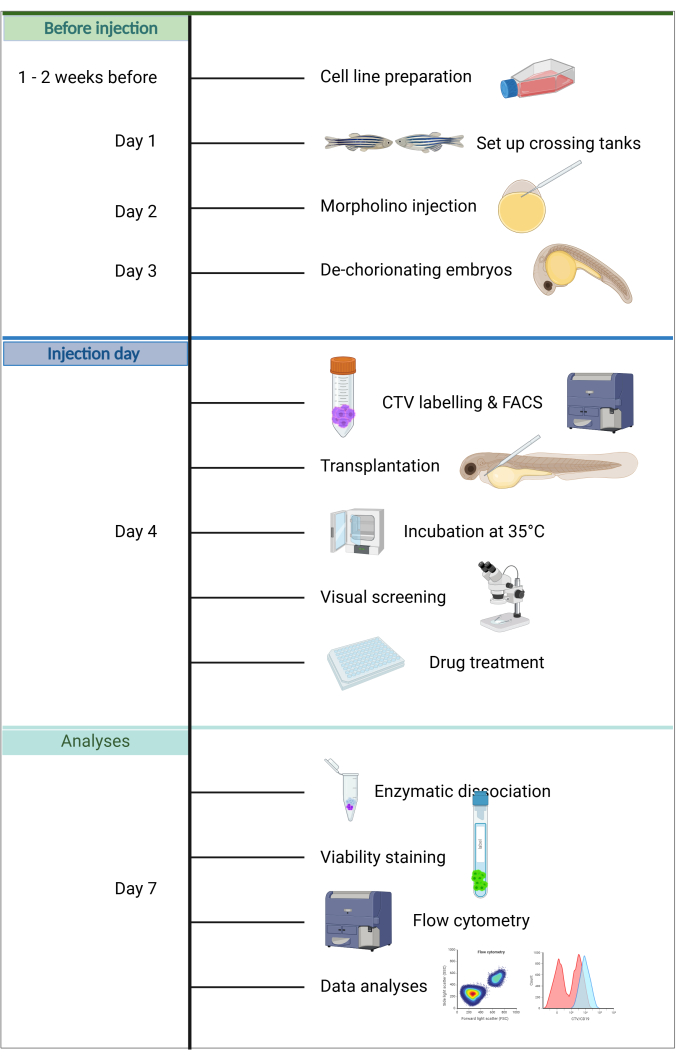
図 1.ALL-ZefiX パイプラインのワークフロー。 https://BioRender.com 年に作成されました。この図の拡大版を表示するには、ここをクリックしてください。
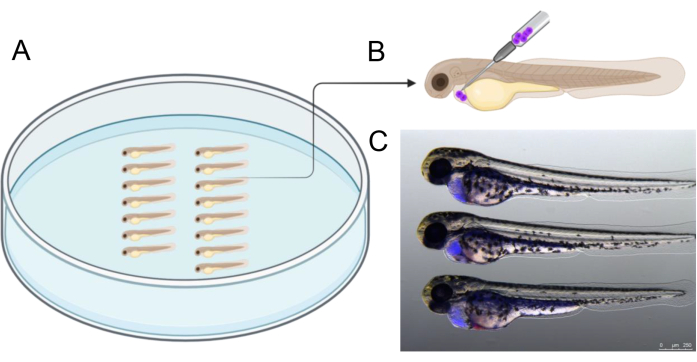
図2:注入配置 (A)描かれているように胚を配置すると、注入が容易になります。胚は、鉗子を使用するか、先端が2.5〜3cmの長さになるように切断された20μLマイクロローダーピペットチップを使用して配置できます。(B)2 dpf胚の心膜に細胞を移植するための推奨注入角度の概略図。(C)移植された癌細胞の量を正しく推定するための視覚補助。この写真は、以前にCellTrace Violetで標識されたヒトがん細胞を用いた注射後3時間での48hpf胚を示しています。https://BioRender.com 年に作成されました。この図の拡大版を表示するには、ここをクリックしてください。

図3:ゼブラフィッシュ胚の生着2D培養後の単離されたBCP-ALL芽細胞の新鮮凍結サンプルを得られた患者のゲーティング戦略とフローサイトメトリー解析。 (A、B)患者細胞は、培養前にCellTrace Violet(CTV)で標識しました。細胞は、フローサイトメトリー分析の前に、37°Cで0時間(A)または72時間(B)の組織培養プラスチック上で培養しました。(C)CTVで標識し、宿主ゼブラフィッシュ胚の移植片として35°Cで72時間増殖させた患者細胞。10個の胚のグループを、フローサイトメトリー分析のために単一細胞解離の前にプールしました。(B)のゲーティング戦略を適用し、生細胞の作画を同定し、定量化しました。そのために、CTV陽性グラフト細胞(Q2)を自己蛍光ゼブラフィッシュ細胞(Q1/4)から分離し、グラフト細胞集団を選別して解析しました。CTV標識強度は、この移植片細胞集団で分析されました。(D)生細胞選択のみからのCTV標識の細胞数と平均強度。3日後(3dpi)のCTV強度の変化に注意してください。 この図の拡大版を表示するには、ここをクリックしてください。
表1:使用したソリューションの表。この表をダウンロードするには、ここをクリックしてください。
表2:フローサイトメトリーで測定したサンプル。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
ゼブラフィッシュの胚は、その高い処理能力と費用対効果により、薬物スクリーニングやがん研究のための異種移植モデルとしてますます人気が高まっています。これらの異種移植片は、トランスレーショナル医療の重要な柱として有望であり、前臨床研究と意思決定を支援します9,21。しかし、ヒト白血病細胞の増殖と治療のためのゼブラフィッシュ異種移植モデルは、固形腫瘍移植片に関する広範な研究と比較して、依然として過小評価されています。このプロトコールは、白血病研究におけるゼブラフィッシュ異種移植片を活用するための詳細なガイダンスを提供しますが、その一方で、固形腫瘍での使用にも適応性を保ちます。
一貫したがん細胞移植を達成することは困難な場合があり、標準化された分析とより高い統計的信頼性の必要性が浮き彫りになっています。このプロトコルは、調製、移植、およびダウンストリームフローサイトメトリー解析のための包括的なパイプラインと、トラブルシューティングの推奨事項を提示することで、これらの問題に対処します。
一過性免疫抑制のためのモルフォリノ注射
ゼブラフィッシュの胚は、発生の最初の数日間は自然免疫系に依存しており、これがこの実験パイプラインの時間枠を定義しています20。原始的なマクロファージは12 hpf付近で出現し、一部は33 hpfで好中球に分化します20,31,32。T細胞は、受精後約8日で循環に入る20,33。マクロファージと好中球は、自然免疫応答の一部として、以前の研究で移植後3日目に観察されたBCP-ALL細胞の生存率の低下に関与していると考えられてきた21。
spi1およびcsf3rを標的とするモルフォリン媒介性時間的免疫抑制は、マクロファージおよび好中球の分化を効果的に阻害し、胚の生存率に影響を与えることなくBCP-ALL細胞の生着を改善する21。この方法では、SPI1とcsf3rの完全なノックアウトは致死的であるため、恒久的な枯渇を達成することはできませんが、このパイプラインにとって最良のアプローチであることに変わりはありません。
経緯線を用いた注入量のキャリブレーションと、1細胞段階での卵黄嚢への正確な送達により、高い生存率で一貫したモルフォリノ注入が保証されます。マクロファージの枯渇に対するリポソームクロドロン酸注射(クロドロソーム)のような代替手段は有望であることが示されていますが、このパイプライン34,35のさらなる検証が必要です。
細胞調製
このプロトコルでBCP-ALLの増殖を成功させるには、十分に密度が高く生存率の高い細胞集団が重要です。CellTrace Violet(CTV)は、0 dpiでの移植成功を評価し、実験全体の増殖速度を追跡するための蛍光標識に使用されます。他の標識とは異なり、CTVは細胞の挙動を変化させないため、正確な単一細胞レベルの増殖解析が可能です。これは、増殖中にのみ細胞を捕捉し、すでに細胞周期から離脱した分裂細胞を捕捉しないKi-67抗体染色よりも優れています。
また、CTVは細胞生存率の反映においてCellTracker CM-DiI(DiI)を上回っています。DiIとその誘導体はより安定な蛍光色素であり、細胞死後も持続することが多く、実験結果を混乱させる可能性があります2。さらに、CD19に対するBCP-ALL特異的抗体をフローサイトメトリーに含めることで、グラフト細胞の正確な同定が可能になります。抗HLAなどのヒト特異的抗体は、他のがん細胞型の代替として役立つことができる36。
がん細胞移植
一貫した生着には、細胞懸濁液の最適な希釈と濃縮が必要です。懸濁液は、注入を損なう粘度を避けながら、十分な密度を維持する必要があります。このプロトコルは、心膜腔または卵黄嚢よりも心膜腔または胎周囲腔(PVS)への注射を優先します。これらの部位は、より良い血管新生と低酸素状態を提供するためです37。卵黄嚢移植は、アクセス可能ですが、多くの場合、死亡率が高く、細胞生存率が低下します21。
微粒子による針の詰まりは、依然として手続き上の課題です。細胞懸濁液をろ過し、詰まった針をトリミングした後の注入量の再キャリブレーションは、重要なステップです。心膜が密集している胚のみを、その後の薬物治療に使用するべきである21,36。
推奨インキュベーション温度35°Cは、ヒト癌細胞の自然温度(37°C)と標準的なゼブラフィッシュの住居温度(28°C)とのバランスが取れています21。ゼブラフィッシュの胚は、発生上の変形を最小限に抑えてこの温度に適応し、環境は新鮮な患者由来の細胞の増殖と生存を促進する38。
薬物治療
ゼブラフィッシュ異種移植モデルは、ハイスループットの薬物スクリーニングを容易にするために開発されました。しかし、薬物治療は依然としてZefiXアッセイの最も困難な側面の1つです。多くの標準治療薬や標的療法は、in vivoでグラフト細胞に効果的に到達しません。また、薬物濃度のより大きなパネルのテストが必要になる場合もあります。ベネトクラクスやダサチニブなどの成功例は、従来の2D培養アッセイよりも大幅に高い濃度を必要とします21。
あるいは、移植前にin vitroで細胞を前処理することで、特定の全身的および局所的な影響を研究することもできます。例えば、このアプローチは、膠芽腫39のアデノ随伴ウイルス(AAV)ベースの治療に適している可能性があります。
薬物治療の効果がin vitroで観察されるが、このパイプラインを使用してin vivoでは観察されない場合、代替手段は、例えば、1k細胞期(3 hpf)または胞胚期に移植し、24 hpf40,41で薬物治療を開始することである可能性があります。これにより、48時間前の胚で成功しなかった移植片細胞に薬物が到達するか、細胞と薬物の同時注射が可能になる可能性がある25。
解離およびフローサイトメトリー解析
組織の解離は、グラフト細胞の総数を分析し、実験結果を確実に解釈するために重要です。機械的解離と酵素的解離の組み合わせにより、細胞表面タンパク質の完全性を維持しながら、高品質の単一細胞懸濁液が保証されます。解離条件の調整(酵素組成、ピペッティング、またはDounceホモジナイザーの使用など)は、がんの種類によって異なる場合があります。
サンプルは、フローサイトメーターの目詰まりを防ぐためにろ過する必要があり、粘着性のあるタンパク質や脂質は、解離前にEDTAまたは胚の脱ヨールクで軽減できます。
概要
ZefiXプロトコルは、前臨床がん研究、薬剤耐性研究、および個別化治療評価のための迅速で費用対効果の高い実験パイプラインを提供します。ゼブラフィッシュ異種移植モデルには制限があり、すべての薬剤タイプに対応できるわけではありませんが、この標準化されたプロトコルにより、新鮮な患者の白血病細胞と細胞株の in vivo 増殖が可能になります。他の種類のがんにも適応可能で、臨床上の意思決定の時間枠内で迅速かつ個別化された薬物反応予測のための有望なツールを提供します。
開示事項
すべての著者は、利益相反がないことを宣言します。
謝辞
本研究は、493872418 CRC1588共同研究センター内のドイツ研究振興財団(DFG、ドイツ研究財団)、ベルリンのクライスト博士財団、ドイツホセ・カレーラス・ロイカミー財団(R03/2016)、ベルリン・クレブスゲゼルシャフト(HEFF201633KK)、ドイツがんコンソーシアム(DKTK、Joint Funding Call 2016)の支援を受けた。私たちは、原稿を批判的に読んでくださったJulia Köppke氏とMareike Wolff氏に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Petri dish (10 cm) | Greiner | P7237 | |
| 7-AAD viability staining solution | Invitrogen | 00-6993-50 | |
| Agarose (LE, analytic grade) | Biozym | 840004 | |
| Air pressure injector | Narishige | IM400 | with external gas supply |
| Alexa Fluor 488 anti-human CD19 antibody | Biolegend | 302219 | |
| Annexin binding buffer | Biolegend | 422201 | Or see solutions for preparation |
| APC annexin V | Biolegend | 640941 | |
| Capillaries (10 cm, OD 1.0 mm, with filaments) | WPIINC | TW100F-4 | 1.0 OD; 0.75 ID |
| Cell culture flask (T-175) | Sarstedt | 83,39,12,002 | |
| CellTrace Violet | Invitrogen | C34557 | |
| Dimethyl sulphoxide (DMSO) | Roth | A994.1 | |
| Dispase II | Sigma Aldrich | D4693-1g | |
| DNase I | AppliChem GmbH | A3778 | |
| Eppendorf tubes (1.5 ml) | Eppendorf | 30120086 | |
| FACS tube (Polystyrene round botton Tube with Cell strainer Cap, 5 ml) | Falcon | 352235 | |
| Falcon tubes (50 ml) | Falcon | 352070 | |
| Fetal calf serum (FCS) | Sigma Aldrich | C8056 | |
| Fine mesh filter (10 µm) | PluriStrainer | 435001050 | |
| Fine mesh filter (20 µm) | PluriStrainer | 431002040 | |
| Flow cytometer | Becton Dickinson | BD LSRFortessa X-20 | |
| Fluorescent stereomicroscope | Leica | ||
| Fluorescent stereomicroscope with camera | Leica | M165 FC | Camera: DFC7000 T |
| Hank’s Balanced Salt Solution (HBSS, Calcium and Magnesium free ) | Sigma Aldrich | 88284 | |
| Injection mold (Zebrafish MI/Transplant KIT) | World Precision Instruments | Z-MOLDS | |
| Injection needles (without filament) | Biomedical instruments | VZIPbl-20-10-55 | Zebrafish injection pipette, blunt, OD: 20μm ± 1, TL:~10mm, PL: 55mm, Glass: BM100T-10P |
| Macro-centrifuge | Eppendorf | ||
| Micro-centrifuge | |||
| Morpholino (csf3r) | Gene Tools LLC | csf3r (GAAGCACAAGCGA GACGGATGCCA) | |
| Morpholino (spi1) | Gene Tools LLC | spi1(GATATACTGATAC TCCATTGGTGGT) | |
| Papain | Sigma Aldrich | P3125 | |
| Penicillin-Streptomycin (Penstrep; 10.000 U/ml) | Gibco | 15140122 | |
| Plates (4-well) | Greiner Bio one | 657160 | |
| Plates (96-well) | Greiner Bio one | 657180 | |
| Roswell Park Memorial Institute (RPMI) 1640 Medium | Gibco | 21875-034 | |
| Tricaine (MS-222) | Sigma Aldrich | E10521-50G | Ethy-3 aminobenzoate methanesulfenate |
参考文献
- Fontana, C. M., Van Doan, H. Zebrafish xenograft as a tool for the study of colorectal cancer: a review. Cell Death Dis. 15, 1-12 (2024).
- Sturtzel, C., et al. Refined high-content imaging-based phenotypic drug screening in zebrafish xenografts. NPJ Precis Oncol. 7 (1), 1-16 (2023).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24, 2288 (2023).
- Gamble, J. T., Elson, D. J., Greenwood, J. A., Tanguay, R. L., Kolluri, S. K. The zebrafish xenograft models for investigating cancer and cancer therapeutics. Biology. 10 (4), 252 (2021).
- Costa, B., Estrada, M. F., Mendes, R. V., Fior, R. Zebrafish avatars towards personalized medicine-A comparative review between avatar models. Cells. 9 (2), 293 (2020).
- Wang, W., et al. Progress in building clinically relevant patient-derived tumor xenograft models for cancer research. Animal Model Exp Med. 6 (5), 381-398 (2023).
- Xiao, J., Glasgow, E., Agarwal, S. Zebrafish xenografts for drug discovery and personalized medicine. Trend Cancer. 6 (7), 569-579 (2020).
- Fazio, M., Ablain, J., Chuan, Y., Langenau, D. M., Zon, L. I. Zebrafish patient avatars in cancer biology and precision cancer therapy. Nat Rev Cancer. 20 (5), 263-273 (2020).
- Costa, B., et al. Zebrafish avatar-test forecasts clinical response to chemotherapy in patients with colorectal cancer. Nat Comm. 15 (1), 4771 (2024).
- Grissenberger, S., et al. Chapter 8 - Preclinical testing of CAR T cells in zebrafish xenografts. Method Cell Biol. 167, 133-147 (2022).
- Yan, C., et al. Single-cell imaging of T cell immunotherapy responses in vivo. J Exp Med. 218 (10), 20210314 (2021).
- Pascoal, S., et al. A preclinical embryonic zebrafish xenograft model to investigate CAR T cells in vivo. Cancers. 12 (3), 567 (2020).
- Pal, D., et al. Long-term in vitro maintenance of clonal abundance and leukaemia-initiating potential in acute lymphoblastic leukaemia. Leukemia. 30 (8), 1691-1700 (2016).
- Beneduce, G., et al. Blinatumomab in children and adolescents with relapsed/refractory B cell precursor acute lymphoblastic leukemia: A real-life multicenter retrospective study in seven AIEOP (Associazione Italiana di Ematologia e Oncologia Pediatrica) Centers. Cancers. 14 (2), 426 (2022).
- Xie, J., et al. Short-course blinatumomab for refractory/relapse precursor B acute lymphoblastic leukemia in children. Front Pediatr. 11, 1187607 (2023).
- Mengxuan, S., Fen, Z., Runming, J. Novel treatments for pediatric relapsed or refractory acute B-cell lineage lymphoblastic leukemia: Precision medicine era. Front Pediatr. 10, 923419 (2022).
- Howe, K. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Lee, H. C., Lin, C. Y., Tsai, H. J. Zebrafish, an in vivo platform to screen drugs and proteins for biomedical use. Pharmaceuticals. 14 (6), 500 (2021).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. J Clin Investigation. 122 (7), 2337-2343 (2012).
- Miao, K. Z., Kim, G. Y., Meara, G. K., Qin, X., Feng, H. Tipping the scales with zebrafish to understand adaptive tumor immunity. Front Cell Dev Biol. 9, 660969 (2021).
- Gauert, A., et al. Fast, in vivo model for drug-response prediction in patients with B-cell precursor acute lymphoblastic leukemia. Cancers. 12 (7), 1883 (2020).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. Mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), e49-e56 (2011).
- Pase, L., et al. Neutrophil-delivered myeloperoxidase dampens the hydrogen peroxide burst after tissue wounding in zebrafish. Current Biol. 22 (19), 1818-1824 (2012).
- Wijk, R. C. V., et al. Mechanistic and quantitative understanding of pharmacokinetics in Zebrafish larvae through nanoscale blood sampling and metabolite modeling of paracetamol. J Pharmacol Exp Ther. 371 (1), 15-24 (2019).
- Lázaro-Navarro, J., et al. Inhibiting casein kinase 2 sensitizes acute lymphoblastic leukemia cells to venetoclax via MCL1 degradation. Blood Advances. 5 (24), 5501 (2021).
- Rhodes, J., et al. Interplay of pu.1 and gata1 determines myelo-erythroid progenitor cell fate in zebrafish. Developmental Cell. 8 (1), 97-108 (2005).
- Zakaria, Z. Z., Eisa-Beygi, S., Benslimane, F. M., Ramchandran, R., Yalcin, H. C. Design and microinjection of Morpholino antisense oligonucleotides and mRNA into zebrafish embryos to elucidate specific gene function in heart dvelopment. J Vis Exp. (186), e63324 (2022).
- . ZFIN: Zebrafish Book: Contents Available from: https://zfin.org/zf_info/zfbook/cont.html (2025)
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Hasegawa, E. H., Gist H Farr, I. I. I., Maves, L. Comparison of pronase versus manual dechorionation of zebrafish embryos for small molecule treatments. J Dev Biol. 11 (2), 16 (2023).
- Wattrus, S. J., Zon, L. I. Stem cell safe harbor: the hematopoietic stem cell niche in zebrafish. Blood Adv. 2 (21), 3063-3069 (2018).
- Harvie, E. A., Huttenlocher, A. Neutrophils in host defense: new insights from zebrafish. J Leukocyte Biol. 98 (4), 523-537 (2015).
- Page, D. M., et al. An evolutionarily conserved program of B-cell development and activation in zebrafish. Blood. 122 (8), e1-e11 (2013).
- Nguyen-Chi, M., et al. TNF signaling and macrophages govern fin regeneration in zebrafish larvae. Cell Death Dis. 8 (8), e2979-e2979 (2017).
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Dis Models Mech. 13 (1), dmm041889 (2020).
- Rebelo de Almeida, C., et al. Zebrafish xenografts as a fast screening platform for bevacizumab cancer therapy. Comm Biol. 3 (1), 1-13 (2020).
- Pringle, E. S., et al. The zebrafish xenograft platform-A novel tool for modeling KSHV-associated diseases. Viruses. 12 (1), 12 (2020).
- Pype, C., et al. Incubation at 32.5 °C and above causes malformations in the zebrafish embryo. Reprod Toxicol. 56, 56-63 (2015).
- Xu, X., et al. Adeno-associated virus (AAV)-based gene therapy for glioblastoma. Cancer Cell Int. 21 (1), 76 (2021).
- Siebert, J., et al. Rhabdomyosarcoma xenotransplants in zebrafish embryos. Pediat Blood Cancer. 70 (1), e30053 (2023).
- van Bree, N., et al. Development of an orthotopic medulloblastoma zebrafish model for rapid drug testing. Neuro-Oncol. noae210, (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved