Method Article
חיזוי מהיר של תגובת תרופות in vivo באמצעות שתלי תאי לוקמיה בעוברי דג זברה
In This Article
Summary
פרוטוקול זה מספק הוראות שלב אחר שלב ליצירה ופתרון בעיות של השתלות קסנוגרפים של לוקמיה לימפובלסטית חריפה אנושית (ALL) מקווי תאים וחומר מטופל טרי בעוברי דג זברה מדוכאי חיסון חולפים, יחד עם הנחיות להערכת תגובה לתרופות באמצעות ציטומטריית זרימה. ניתן להתאים את צינור הניסוי גם לגידולים מוצקים.
Abstract
השתלת דג זברה היא טכניקה מרכזית לחקירת פתוגנזה של סרטן אנושי וחיזוי תגובות תרופות בודדות. מסמך זה מציג פרוטוקול יעיל (ZefiX) להרחבת דגימות חולים ראשוניות של לוקמיה לימפובלסטית חריפה (BCP-ALL) או קווי תאים אימורטליים בעוברי דג זברה מדוכאי חיסון חולפים, תוך שימוש בזרימה ציטומטרית לניתוח תא בודד ברזולוציה גבוהה של תגובות הטיפול. בהשוואה להשתלות גידול מוצק, תאי לוקמיה מרוויחים באופן משמעותי מדיכוי מבוסס אוליגונוקלאוטידים של מורפולינו אנטיסנס של גורמים מבדלים של מקרופאגים ונויטרופילים במהלך הבדיקה. ניתוח זרימה ציטומטרית של תאי שתל מנותקים מאפשר הערכה מדויקת של ספירת התאים, קצב ההתפשטות והחיוניות לאחר הטיפול על בסיס כל תא. גישה זו אומתה באמצעות טיפולים ממוקדים כגון ונטוקלקס ודאסטיניב, עם תוצאות טיפול בהשוואה לרשומות קליניות של דגימות מטופלים קשורות ובקרות תרבית דו-ממדיות מסורתיות. יש לציין כי הפרוטוקול מסתיים תוך 7 ימים, בהתאם ללוחות הזמנים של קבלת ההחלטות הקליניות. המתודולוגיה ניתנת להתאמה לבדיקת תרופות נבחרות בסוגי סרטן שונים, כולל גידולים מוצקים, ובכך תומכת באסטרטגיות טיפוליות מותאמות אישית. עם זאת, יש לשקול מגבלות על מספר התרופות שניתן להעריך, ככל הנראה עקב אילוצים פרמקוקינטיים בעוברי דג הזברה.
Introduction
השתלת דג הזברה הפכה למודל חיוני in vivo להבנת פתוגנזה של סרטן וחיזוי תגובות לתרופות 1,2,3,4,5. מודלים של בעלי חיים נותרו קריטיים לבדיקת תרופות פרה-קליניות, ומודל דג הזברה מציע יתרונות משמעותיים על פני מערכות in vivo אחרות, כולל תפוקה גבוהה וחסכון 6,7,8. מודל זה יכול גם לסייע בחיזוי תגובה לטיפול מותאם אישית, כולל טיפולים ממוקדים מולקולריים וטיפול בתאי CAR-T 9,10,11,12.
BCP-ALL יכול להפיק תועלת במיוחד מהשתלת דג הזברה, מכיוון שהרחבת תאי החולה הראשוניים בתרבית נותרה מאתגרת13. יש צורך בלתי ניתן להכחשה בגישות טיפול חדשות ב-ALL. למרות שיעור הפוגה גבוה של 80%-85% בילדים עם BCP-ALL, שיעורי ההישרדות לטווח ארוך עבור חולים עם מחלה חוזרת או עמידה נעים בין כ-30%-60%14,15,16 בלבד. במקרים כאלה, ניתן לשלב בדיקות תרופות באמצעות הצינור המוצע במסגרת הקלינית כדי לזהות את הטיפול האופטימלי הספציפי למטופל14,15. גישה מותאמת אישית זו יכולה להיות חיונית בעת התמודדות עם עמידות לתרופות מרובות, ולהפחית משמעותית את נטל הטיפול בחולים על ידי הימנעות מתרופות לא יעילות או לא אופטימליות עם תופעות לוואי חמורות.
מספר תכונות הופכות את השתלת עובר דג הזברה לדגם מתאים. הדמיון הגנטי בין בני אדם לדגי הזברה - 70% הומולוגיה גנטית ו-84% גנים משותפים הקשורים למחלה - תומכים במחקרי אינטראקציה בין גנים לתרופות17. שימוש בעובר מארח טרנסגני יכול אפוא לחשוף נטיות גנטיות המשפיעות על רגישות לתרופות18. לחלופין, ניתן להשתיל תאים עם שינויים גנטיים ספציפיים כדי להעריך אם הרגישות או העמידות לתרופה תואמת את הממצאים במבחנה . השתלות עובר של דג הזברה מספקות גם תובנות לגבי ההשפעות המערכתיות הפוטנציאליות של תרופות. למרות שהתפתחות האיברים בעוברים בני 2-3 ימים אינה בשלה לחלוטין, האיברים ממוקמים בצורה נכונה וחולקים חלקית את ההרכב התאי עם עמיתיהם הבוגרים19.
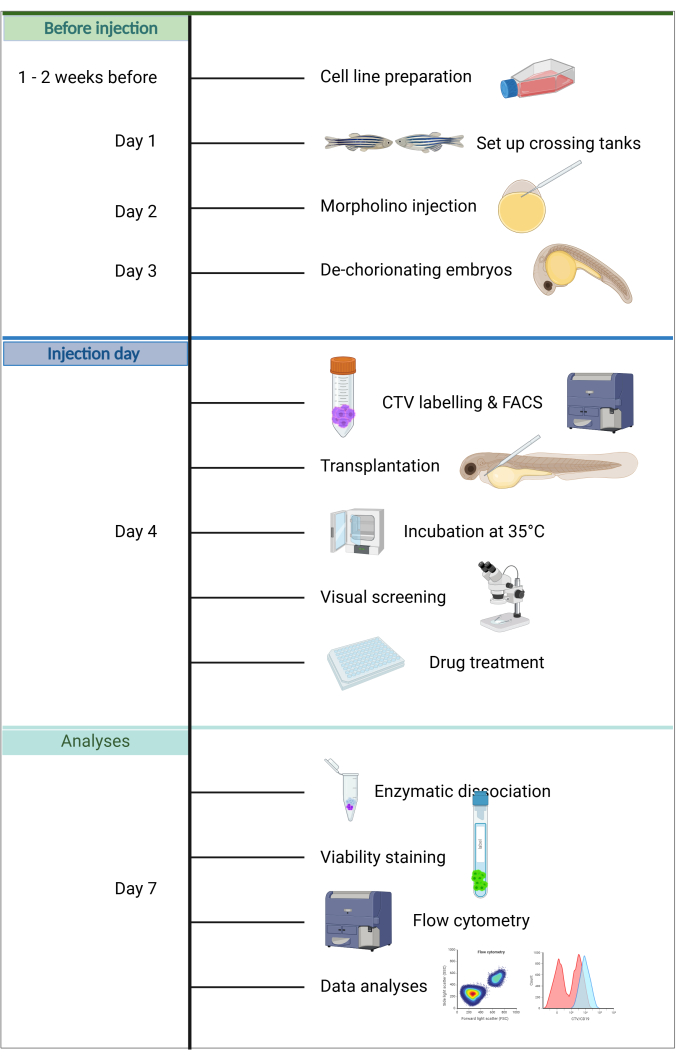
יתרונות נוספים של מודל זה כוללים שרק כמה תאים סרטניים נדרשים להשתלה, תחזוקת עוברי המארח היא פשוטה, מכיוון שאין צורך בהאכלה במהלך 5 הימים הראשונים לחיים, וניתן להעריך במהירות את הצלחת ההזרקה בשל השקיפות והגודל של העוברים. מאפיין ייחודי הוא שרק חסינות מולדת פעילה בשלב התפתחותי זה, מה שמקל על השתלה יעילה20. בפרוטוקול ZefiX המתואר כאן (ראה סיכום באיור 1), כשל חיסוני מוגבר עוד יותר על ידי דיכוי מערכת החיסון המולדת במהלך 4 הימים הראשונים לחיים באמצעות אוליגונוקלאוטידים אנטי-סנס יציבים של מורפולינו המכוונים ל-spi1 ו-csf3r, החוסמים התמיינות מקרופאגים ונויטרופילים 21,22,23.
פרוטוקול זה שונה גם מפרוטוקולי השתלת דגי זברה קודמים, שפותחו בעיקר עבור השתלות גידול מוצק ומשתמשים בדרך כלל בשיטות הערכת תגובה לתרופות מבוססות הדמיה מלאה. ZefiX מותאם לתאי סרטן נוזליים, כגון תאי BCP-ALL, ושימש בהצלחה להרחבת חומר מטופל טרי או קפואטרי 21. ניתן להתאים את ZefiX גם לתאי סרטן דבקים על ידי בחירת אנזימים מתאימים לדיסוציאציה של רקמות.
יתרון מרכזי נוסף הוא הניתוח במורד הזרם באמצעות ציטומטריית זרימה, המציעה מספר יתרונות: (i) ניתן לעבד מספר רב של תאי שתל במהירות, מה שמאפשר ניתוח סטטיסטי חזק ברמת התא הבודד, (ii) ניתן להעריך את קצב ההתפשטות והכדאיות בו זמנית בתאים בודדים, ו (iii) ציטומטרים זרימה זמינים בדרך כלל במסגרות מחקר קליניות, מאפשר הערכת תגובה לתרופות של תאי שתל ברמת תא בודד תוך מספר שעות. כדי להבטיח שחזור, פרוטוקול זה מספק צינור סטנדרטי מהכנה דרך השתלה ועד לניתוח זרימה ציטומטרית, המאפשר חיזוי תגובה לתרופות בכל התאים תוך שבוע.
Protocol
כל הניסויים בדגי הזברה עומדים בהנחיות מכוני המחקר לרפואה ניסויית בברלין ולרשויות הרשמיות. כל המחקרים כללו עוברי דג זברה < 6 ימים לאחר ההפריה (dpf), מה שפוטר אותם מחוק הגנת בעלי חיים. דג הזברה (Danio rerio) גודלו והוחזקו במתקן בעלי החיים של Charité-Universitätsmedizin Berlin, ברלין, גרמניה, על פי פרוטוקולים סטנדרטיים. הם שוכנו בטמפרטורה של 28 מעלות צלזיוס עם מחזור אור של 14 שעות ו-10 שעות חושך. דגי בר מסוג AB או TüLF שימשו לכל הניסויים.
הערה: קביעת תנאי טיפול אופטימליים לכל תרופה רצויה לפני יישום ZefiX כוללת מספר שלבים הכרחיים. ראשית, קבע את הריכוז המעכב החצי מקסימלי (IC50) של כל תרופה באמצעות קו תאים מתאים בתוך מערכת תרבית דו-ממדית קונבנציונלית. בהתבסס על ניסיון קודם, ריכוזי התרופות האפקטיביים לטיפול ב-ZefiX עשויים להיות גדולים פי 5 עד פי 50 מאלה המשמשים בתנאי תרבית תאים טיפוסיים21,24. לפני הטיפול בעוברים מושתלים, חיוני להעריך את הרעילות בתוך העוברים המארחים שלא הושתלו באמצעות טווח הריכוז שנקבע. לאחר הערכת הרעילות, חשוף עוברים מושתלים בקו תאים למגוון ריכוזי תרופות בסביבות פי 50 מערך ה-IC50 שנקבע בעבר בתרבית דו-ממדית. אם התאים המושתלים אינם מראים תגובה למינונים של עד פי 100 מה-IC50, התרופה עשויה להיחשב כלא יעילה עבור ZefiX. כדי לשפר את היעילות, אפשרות אחת היא להתנות תאי השתלה בתרופה זמן קצר לפני השתלתם בעוברים25. ראה טבלה 1 עבור כל הפתרונות המשמשים כאן.
1. יום 1: הכנה לניסוי
- הכנת מדיום E3: הכן 2 ליטר של מדיום E3 אוטוקלאב שישמש לתחזוקת עובר.
- הכנת אוליגונוקלאוטידים אנטי-סנס (MO) של מורפולינו: הכן תמיסת מלאי של 50 מיקרומטר המכילה את שני ה-MOs בצינור מיקרו-צנטריפוגה של 1.5 מ"ל באמצעות מים נטולי נוקלאז. אחסן את תמיסת המלאי בטמפרטורת החדר (RT). הכן את ה-MOs להזרקה על ידי דגירה של התמיסה על בלוק חימום ב-65 מעלות צלזיוס למשך 10 דקות.
הערה: ה-MOs מכוונים נגד spi1 ו-csf3r כדי לעכב התמיינות מקרופאגים ותאי נויטרופילים, כמתואר בהפניות 22,23,26. - הכנת לוחות הזרקה
- להכנת 4-5 צלחות, ממיסים 1% אגרוז במדיום E3 ליצירת תמיסה של 100 מ"ל. לצלחות השתלה, שפכו ~20 מ"ל מהתמיסה לכל צלחת פטרי בגודל 10 ס"מ, וודאו שהם מלאים למחצה. מערבבים כדי להפיץ את הנוזל באופן שווה.
- עבור צלחות הזרקת מורפולינו, הנח את תבנית ההזרקה על האגרוז הנוזלי בשתי צלחות פטרי, וודא שלא ייווצרו בועות. מכסים את הכלים על ידי הטיית המכסים ומשאירים אותם ב- RT עד שהאגרוז מתמצק. לאחר ההתמצקות, הסר את התבנית ואחסן את הצלחות הפוכות ב-4 מעלות צלזיוס בשקית ניילון אטומה.
- הכנת מחטי הזרקה
- להזרקות מורפולינו: צור מחטים מנימים של 10 ס"מ באמצעות מושך מחט ושבר את הקצוות כדי להשיג קוטר משוער של 10 מיקרומטר (כמתוארב-27).
- להשתלת תאים: השתמש במחטי הזרקה קהות עם קצה קהה הזמינות מסחרית בקוטר חיצוני של 20 מיקרומטר.
- תרבית תאי שתל: תאים מפוצלים (למשל, Nalm6) המכוונים לצפיפות יעד של 70%-80% ביום הרביעי בבקבוק תרבית תאים T175 עם מדיום RPMI בתוספת 10% FCS ו-1% P/S (RPMI-complete). פצלו את התאים 3-4 פעמים לפני השימוש כדי להבטיח קצב התפשטות תקין.
הערה: להכנת חומר מטופל טרי או טרי/קפוא להשתלה, ניתן למצוא הוראות בשלב 4.3. לאחר מכן מכינים תאים ביום ההשתלה. - גידול דגי זברה: הקימו דג זברה מסוג בר במיכלי רבייה בשעות אחר הצהריים, תוך שמירה על הפרדה בין זכרים ונקבות.
הערה: דגי הזברה גודלו והוצבו כמתואר בהתייחסות28. ייחוסי זמן (hpf או dpf) מציינים שעות או ימים לאחר ההפריה.
2. יום 2: הזרקת מורפולינו
- הוסיפו 500 מ"ל של מדיום E3 שעבר חיטוי עם 1% פניצילין/סטרפטומיצין (E3/P/S) ומלאו שתי צלחות פטרי בגודל 10 ס"מ. הוציאו את לוחית ההזרקה מהמקרר לחימום מראש ב-RT.
- פתיחת שער מדהים של מיכלי הרבייה כך שההפריה יכולה להתרחש רק בשבריר של מיכלים בכל פעם (תלוי במהירות ההזרקה) כדי להבטיח מיקרו-הזרקות בזמן של תמיסת מורפולינו לעוברי דג הזברה בשלב התא האחד28,29. התחל בפתיחת שער אחד או שניים בהתאם למהירות המזרק, כאשר קבוצת ביצים אחת מוזרקת בקלות פתח שער נוסף או שני שערים וכן הלאה.
- העבירו ביציות מופרות בקבוצות של 100 עם כמה שפחות נוזלים לצלחת ההזרקה שנעשתה בעבר. יישר את העוברים בחריצי הצלחת.
- הזרקו 1 nL של תערובת של 50 מיקרומטר של שני המורפולינים לתא או לשק החלמון ממש מתחת לתא במהלך שלב התאהאחד 29. להזריק מספיק ביציות להליכים הבאים (למשל, עבור צלחת אחת של 96 בארות, להזריק עד 200 ביציות כדי שיהיה מספיק גיבוי לנשירה פוטנציאלית לפני ההשתלה).
- מעבירים את הביצים המוזרקות לצלחות פטרי המכילות E3/P/S. דוגרים על הביצים המוזרקות ב-28 מעלות צלזיוס. שמור ביצים שלא הוזרקו כדגי ביקורת לניתוח ציטומטריית זרימה ב-5 dpf. אחסן את המדיום הנותר E3/P/S ב-4 מעלות צלזיוס.
3. יום 3: דה-כוריון
- דה-כוריון של עוברי דג הזברה: דה-כוריונאציה ידנית של עוברים כשהם מעל 24 hpf באמצעות שני מלקחיים מדויקים29.
- הסר את כל העוברים המתים שאינם מראים פעימות לב או תנועה ונראים אטומים או עוברים בעלי צורות לא סדירות מהכלים בעזרת פיפטה פסטר.
- צבטו את הכוריון בעזרת מלקחיים מדויקים כדי להחזיק אותו במקומו. צבטו ממש ליד קצה המלקחיים המדויקים, החזיקו את העובר במקומו עם המלקחיים השניים, ומשכו בזהירות את הכוריון כדי לשחרר את העובר
הערה: כדי להוציא עוברים מתחת ל-24 hpf, יש לשמור אותם על צלחת מצופה אגרוז כדי למנוע מהם להידבק לפלסטיק. דה-כוריון ידני מועדף מכיוון שהוא עדין יותר לעוברים. שיטת דה-כוריון אנזימטית חלופית מתוארת במקום אחר30.
- דגירה על עוברים נטולי כוריון בטמפרטורה של 28 מעלות צלזיוס למשך הלילה.
4. יום 4: השתלה וטיפול תרופתי
- הכנת עוברי מארח: הוציאו את צלחות האגרוז המוכנות ואת E3/P/S מהמקרר ואפשרו להם להגיע ל-RT. סינון עוברים לשלב ההתפתחותי המתאים ב-48 hpf באמצעות מיקרוסקופ סטריאו. כלול רק עוברים מבוימים כהלכה ואופייניים מורפולוגית בזרימת העבודה, כמתואר במקום אחר29. ספור את כל העוברים הבריאים ותכנן טיפול נוסף. שמור לא יותר מ-100 עוברים לצלחת פטרי של 10 ס"מ ב-28 מעלות צלזיוס כדי למנוע מהירויות התפתחות לא אחידות הנגרמות ממחסור בחמצן.
הערה: בצע את שלב 4.2. עבור קווי תאים. לחומר טרי/קפוא, המשך ישירות לשלב 4.3. - הכנת קווי תאים
- כדי להכין תאי BCP-ALL עם תווית פלואורסצנטית לזרימה ציטומטרית והשתלה, שטפו תאים (משלב 1.5.) עם 1x PBS: צנטריפוגה ב-350 x גרם למשך 5 דקות, והשעו מחדש ב-20 מ"ל של PBS.
- ספירת תאים והעברת 3 x 105 תאים לא מוכתמים לתוך צינור FACS ליום 0 (0 ימים לאחר ההזרקה, dpi) ניתוח ציטומטריית זרימה. יש לאחסן על קרח.
- צלחת 3 x 105 תאים ב-3 מ"ל של RPMI-השלמה בבאר אחת של צלחת 6 בארות ושמירה על 37 מעלות צלזיוס לבקרת 3 dpi.
- העבר 1 x 107 תאים לצינור צנטריפוגה של 15 מ"ל לתיוג CTV. צנטריפוגה ב-350 x גרם למשך 5 דקות ב-RT, שפכו את הסופרנטנט (השתמשו בפיפטה לכל השאר), והשעו מחדש את הגלולה ב-2.5 מ"ל של PBS (RT) עם 1 מיקרוליטר של תמיסת מלאי CTV.
- דגירה למשך 5 דקות בחושך ב-37 מעלות צלזיוס, הפסקת התגובה עם 12.5 מ"ל RPMI-שלם, ולאחר מכן דגירה למשך 10 דקות בחושך ב-37 מעלות צלזיוס.
- צנטריפוגה ב-350 x גרם למשך 5 דקות ב-RT ושטיפה פעם אחת עם 10 מ"ל של RPMI-שלם. שוב צנטריפוגה והשעיה ב-10 מ"ל של RPMI-שלם.
- מסננים את התאים באמצעות מסנן של 10 מיקרומטר על ידי צנטריפוגה ב-350 x גרם למשך 5 דקות. השעו מחדש את הגלולה, ספרו את התאים והעבירו 3 x 105 תאים עם תווית CTV לתוך צינור FACS. צלחת 3x 10^5 תאים עם 3 מ"ל RPMI-שלמים בבאר אחת של צלחת 6 בארות ושומרים על 37 מעלות צלזיוס לבקרת התפשטות של 3 dpi. אחסן את התאים הנותרים ב-1 מ"ל PBS על קרח עד להשתלה.
- הכנת חומר מטופל טרי/קפוא
- יש לחמם מראש שני צינורות צנטריפוגה של 15 מ"ל עם 10 מ"ל RPMI-שלמים כל אחד ב-37 מעלות צלזיוס. הפשירו בקבוקון המכיל 5-10 x 106 תאים באמבט מים של 37 מעלות צלזיוס.
- ברגע שנותרה רק כמות קטנה של קרח, העבירו את התאים לצינור הצנטריפוגה עם המדיום שחומם מראש. צנטריפוגה ב-350 x גרם למשך 5 דקות ב-RT, השליכו את הסופרנטנט והשעו מחדש את הגלולה בצינור השני של RPMI-Complete מחומם מראש.
- ספרו תאים ברי קיימא באמצעות טריפן כחול. יש להכניס 1x 10^5 תאים לתוך צינור צנטריפוגה של 1,5 מ"ל ולצנטריפוגה את הכמות הזו של תאים בצינור FACS ב-350 x גרם למשך 5 דקות ב-RT, להשליך את הסופרנטנט ולהשעות מחדש את הגלולה ב-300 מיקרוליטר של PBS.
- אחסן את האליקוט התלוי על קרח כבקרה לא מטופלת לניתוח זרימה ציטומטרית.
הערה: אם גודל המדגם מספיק מאפשר, שמור על בקרה לא מטופלת בתרבית למדידת זרימה ציטומטרית ביום 7. - הוסף 1 μL של תמיסת מלאי CTV ל-2.5 מ"ל של PBS (RT) עבור כל 1 x 106 תאים. כוונן את עוצמת הקול של תמיסת מלאי CTV אם יש פחות תאים זמינים.
- דגרו תאים עם CTV למשך 5 דקות ב-37 מעלות צלזיוס בחושך, עצרו את התגובה על ידי הוספת 12.5 מ"ל של RPI מחומם מראש (37 מעלות צלזיוס) ודגרו במשך 10 דקות בחושך ב-37 מעלות צלזיוס.
- צנטריפוגה של התאים ב-350 x גרם למשך 5 דקות ב-RT ושטוף את התאים פעם אחת עם 10 מ"ל של RPMI-שלם. צנטריפוגה שוב ב-350 x גרם למשך 5 דקות ב-RT והשעיית התאים ב-10 מ"ל של RPMI-שלם.
- מסננים את מתלה התא לצינור צנטריפוגה טרי של 50 מ"ל באמצעות מסנן 10 מיקרומטר וצנטריפוגה ב-350 x גרם למשך 5 דקות.
- אין להשליך את הסופרנטנט. השעו מחדש את הגלולה וספרו את התאים. העבר 3 x 105 תאים עם תווית CTV לתוך צינור FACS אחד.
- צנטריפוגה את התאים הנותרים ב-350 x g למשך 5 דקות ב-RT והשליכו את הסופרנטנט. השעו מחדש את התאים הנותרים ב-1 מ"ל PBS ואחסנו על קרח עד לשימוש בהשתלה.
הערה: אם נותרו מספיק תאים חיוביים ל-CTV, ניתן לשמור אותם בתרבית דו-ממדית במקביל ל-xenografts לצורך השוואת קצב התפשטות.
- מדידת ציטומטריית זרימה
הערה: ציטומטריית זרימה ב-0 dpi צריכה להתבצע על ידי אדם שני כדי למזער את הזמן שהתאים נשארים על הקרח לפני ההשתלה. לפני מדידת ציטומטריית הזרימה הראשונה באמצעות לוח הצביעה הממונה (CTV, CD19-Alexa488, APC-Annexin V ו-7AAD), בצע בדיקת פיצוי בהתאם להוראות היצרן.- הכן שני צינורות FACS כדלקמן: צינור 1: תאי בקרה לא מוכתמים; שפופרת 2: תאים מוכתמים ב-CTV, CD19, 7AAD ו-Annexin.
הערה: צביעה ותוויות: CellTrace Violet (CTV) מזהה תאי שתל מסומנים לעומת תאי דגים מארחים ומעריך את קצב ההתפשטות לאחר 3 ימים. נוגדן CD19, סמן פני התא, משמש כסמן נוסף לזיהוי תאי השתל BCP-ALL אנושיים. עבור סוגי סרטן אחרים, ייתכן שיידרשו נוגדנים לסמנים חלופיים. נספח V מסמן אפופטוזיס בשלב מוקדם להערכת כדאיות התא. 7AAD מסמן אפופטוזיס או נמק בשלב מאוחר להערכת כדאיות התאים. - צינורות צנטריפוגה (אחד מכיל תאים מוכתמים ב-CTV והשני תאים לא מוכתמים) ב-350 x גרם למשך 5 דקות ב-RT ומשליכים את הסופרנטנט מצינור 1. השעו מחדש את הגלולה ב-310 מיקרוליטר של מאגר קשירה של נספח (ABB).
- צינור 2: בצע צביעת נוגדנים וכדאיות כמתואר להלן.
הערה: פרוטוקול צביעה זה מותאם לצביעה של תאי CD19 B. עבור נוגדנים אנושיים אחרים המשמשים לתיוג סוגי תאים שונים, הפרוטוקול עשוי להזדקק להתאמה.- הוסף 98 מיקרוליטר של ABB לצינור 2 (המכיל תאים עם תווית CTV). הוסף 2 מיקרוליטר של נוגדן CD19-Alexa488 (דילול 1:50) ל-98 מיקרוליטר של ABB שנוסף. מערבבים היטב.
- דוגרים את התערובת בטמפרטורה של 4 מעלות צלזיוס למשך 30 דקות ומוסיפים 500 מיקרוליטר ABB כדי לעצור את התגובה. צנטריפוגה את הצינור ב-350 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. הסירו את חומר הכביסה וחזרו על שלב הכביסה.
- השעו מחדש את גלולת התא ב-100 מיקרוליטר של ABB והמשיכו לצביעה של 7AAD ו-APC-Annexin V. בצע מדידת צביעה וזרימה של 7AAD ו-APC Annexin V כמתואר להלן.
- הוסף 5 מיקרוליטר של 7AAD ו-5 מיקרוליטר של APC-Annexin V לתאים התלויים. מערבולת בעדינות לערבב. דגרו את הצינור למשך 15 דקות בחושך ב-RT. הוסיפו 200 מיקרוליטר של ABB כדי להגיע לנפח סופי של 310 מיקרוליטר.
- בצע ניתוח ציטומטריית זרימה ביום ההשתלה בסדר הבא כדי למנוע זיהום צולב: תאי בקרה לא מוכתמים (צינור 1), תאים עם תווית CTV צבועים ב-Alexa488-CD19, APC-Annexin V ו-7AAD (צינור 2). רשום לפחות 10,000 אירועים לכל דגימה לניתוח מספיק.
- הכן שני צינורות FACS כדלקמן: צינור 1: תאי בקרה לא מוכתמים; שפופרת 2: תאים מוכתמים ב-CTV, CD19, 7AAD ו-Annexin.
5. השתלה
- צלחת השתלה: מכינים שתי צלחות פטרי בגודל 10 ס"מ ממולאות ב-E3/P/S ומניחים באינקובטור בטמפרטורה של 28 מעלות צלזיוס למשך 30 דקות לפחות לחימום מראש.
- הכנת תאים: צנטריפוגה של התאים ב-350 x גרם למשך 5 דקות ב-RT, השליכו את הסופרנטנט והוציאו את כל הנוזל שנותר באמצעות מיקרו-פיפטה. הוסף PBS כדי להשיג נפח סופי של 20 מיקרוליטר. שמור את תרחיף התאים המרוכז על קרח.
הערה: תאים לא צריכים להישאר על הקרח יותר משעתיים במהלך הליך ההשתלה. - הכנת מחט השתלה ועובר מארח
- העבירו 25-30 עוברים לאחת מצלחות הפטרי שחוממו מראש המכילות E3/P/S באמצעות פיפטת פסטר מזכוכית שתשמש כבקרה. טען 4 מיקרוליטר של מתלה התא לתוך מחט ההשתלה באמצעות קצה מעמיס מיקרו.
הערה: הטעינה אמורה להתבצע בצורה חלקה תוך 1-2 דקות. אם זה לא המקרה, הוסף בזהירות עוד PBS למתלה התא. - כייל את לחץ ההזרקה ואורך הדופק על ידי כוונון המיקרו-מזרק. התאם עד שהזרקה אחת מוציאה כ-1,000 כל התאים או 2 ננו"ל של תרחיף תאים (עבור 1x 107 תאים ב-20 מיקרוליטר). כדי להעריך 1,000 תאים, הוצא נפח של התרחיף על משטח אגרוז מכוסה במדיום. לספור 100 תאים באזור קטן, להעריך את התפלגות שלהם לאוכלוסיית התאים הכוללת ולהעריך את המספר הכולל.
- יש להכין 50 מ"ל של E3 המכיל טריקאין (ריכוז סופי: 80 מ"ג/ליטר). העבירו את העוברים המארחים לתמיסת הטריקאין ודגרו למשך 2 דקות לפחות כדי להבטיח הרדמה מתאימה. העובר מורדם כראוי כאשר לא ניתן להבחין בתגובה מוטורית
הערה: ניתן להשתמש בקצה מיקרו מעמיס או מלקחיים כדי להתקרב בזהירות ו/או לגעת בעובר. - העבירו 15-20 עוברים שעברו דה-כוריון על צלחת הזרקה מצופה אגרוז (ראו הוראות הכנה קודמות) תוך שימוש בכמה שפחות נוזלים כדי למנוע החלקה של העוברים.
- סדרו את העוברים כפי שמוצג באיור 2A. הזרקו כ-1,000 תאי BCP-ALL חיוביים ל-CTV לחלל קרום הלב. הכניסו את המחט בזווית של 45 מעלות מהכיוון הגב-זנבי, כפי שמוצג באיור 2B כדי להזריק את התאים.
הערה: השתמש במחטים משוכות מראש וקהות בקוטר פתיחה של 20 מיקרומטר, שתוכננו במיוחד עבור תאי לוקמיה קטנים (ראה רשימת חומרים). אם המחט נחסמת, חתוך אותה לפי הצורך, אך כייל מחדש את נפח ההזרקה וספירת התאים לאחר מכן. - לאחר הזרקת כל 15-20 העוברים, העבירו אותם לצלחת פטרי שחוממה מראש מלאה ב-E3/P/S ושמרו על 28 מעלות צלזיוס.
- חזור על השלבים עד להשתלת כ-100 - 150 עוברים לבדיקת טיפול תרופתי אחת, שאמורה לכלול שלושה ריכוזי תרופות וביקורת אחת.
- דגרו הן על העוברים המושתלים והן על הבקרות שלא הושתלו בטמפרטורה של 28 מעלות צלזיוס למשך 1-3 שעות לפני תחילת הטיפול התרופתי.
- העבירו 25-30 עוברים לאחת מצלחות הפטרי שחוממו מראש המכילות E3/P/S באמצעות פיפטת פסטר מזכוכית שתשמש כבקרה. טען 4 מיקרוליטר של מתלה התא לתוך מחט ההשתלה באמצעות קצה מעמיס מיקרו.
- טיפול תרופתי in vivo (צלחת 96 בארות)
- באמצעות סטריאומיקרוסקופיה פלואורסצנטית, מסננים עוברים כדי לאשר השתלה מוצלחת (איור 2C). ודא שהחלמון שלם, מכיוון שסביבת החלמון עלולה להיות רעילה לתאי השתלה21. השליכו עוברים עם תאים בחלמון.
- הכן 2.5 מ"ל של תמיסה מרוכזת פי 2 עבור כל מצב תרופה שייבדק ב-E3/P/S עם 0.5% DMSO. בנוסף, הכינו פתרון בקרת רכב של 5 מ"ל המכיל 0.5% DMSO ב-E3/P/S.
- הוסף 100 מיקרוליטר של E3/P/S + 0.5% DMSO לכל באר של צלחת של 96 בארות. צעד זה מונע העברה לא מכוונת של כמויות סמים מינימליות בין בארות.
- העבירו בזהירות עובר מושתל אחד לכל באר. השתמש בפיפטה פסטר מזכוכית כדי לאסוף כל עובר בכמה שפחות מדיום E3.
- אפשר לעובר לשקוע לתחתית קצה הפיפטה על ידי הטיה עדינה של הפיפטה ושחרר אותה לבאר באמצעות כוחות נימיים. הימנע מלגעת במדיום בבאר במהלך ההעברה.
- הוסף פתרונות תרופות לצלחת: מלא 24 בארות (2 שורות) של צלחת 96 הבארות ב-100 מיקרוליטר של תמיסת בקרת הרכב או אחת משלוש תמיסות התרופות המרוכזות פי 2.
הערה: יש לקבוע את ריכוזי התרופה היעילים בניסויים קודמים ספציפיים לכל תרופה הנבדקת. - שמור על עוברים בטמפרטורה של 35 מעלות צלזיוס למשך 72 שעות, כולל העוברים שלא הושתלו, שישמשו כבקרות לניתוח ציטומטריית זרימה ביום 7.
6. יום 7
- דיסוציאציה של עובר/שתל
- סנן את הצלחת בת 96 הבארות באמצעות סטריאומיקרוסקופיה כדי לזהות ולבחור עוברי דג זברה בריאים. אסוף באופן אקראי 10 עוברים מארחים בריאים מכל מצב לתוך צינור מיקרו-צנטריפוגה של 1.5 מ"ל (באופן אידיאלי התוצאה היא 2 צינורות לכל מצב).
- הסר כמה שיותר נוזלים מכל צינור המכיל עובר והקריב את העוברים על ידי הלם היפותרמי על ידי דגירה של הצינורות על קרח למשך שעה.
- הוסף 500 מיקרוליטר של תמיסת המלח המאוזנת של האנק (HBSS) ללא סידן ומגנזיום לכל שפופרת. פירוק מכני של העוברים ותאי השתל על ידי טריטורציה באמצעות קצה מיקרופיפטה של 200 מיקרוליטר ופיפט למעלה ולמטה בערך פי 15.
- גלולה את שברי הרקמה על ידי צנטריפוגה ב-350 x גרם למשך 5 דקות ב-RT. בינתיים, הכינו צינורות FACS עם מכסה מסננת רשת עדינה של 35 מיקרומטר המכיל 2 מ"ל PBS לכל מצב (סה"כ 4 צינורות).
- יש להשעות מחדש כל כדור ב-500 מיקרוליטר של תערובת אנזימים (0.01% פפאין, 0.1% דיספאז II, 0.01% דאוקסיריבונוקלאז I ו-12.4 מ"מ MgSO4 ב-HBSS נטול סידן ומגנזיום) לדיסוציאציה אנזימטית. דגירה ב- RT למשך 15 דקות.
- במהלך הדגירה, פיפטה את התערובת למעלה ולמטה כל 5 דקות שוב ושוב באמצעות אותו קצה פיפטה עבור כל צינור בודד כדי למנוע אובדן רקמות.
- מדידת ציטומטריית זרימה
- העבירו את התאים המנותקים למכסה מסננת הרשת העדינה של 35 מיקרומטר של צינורות ה-FACS והצנטריפוגה ב-350 x גרם למשך 5 דקות.
- בזמן הצנטריפוגה, הכינו תערובת מאסטר לצביעה על פני השטח של תאי B CD19. שלב 98 מיקרוליטר של ABB עם 2 מיקרוליטר של נוגדן CD19 אנטי אנושי Alexa Fluor 488 לכל מצב.
- השליכו את הסופרנטנט מכדור התא המנותק והשעו מחדש את הגלולה ב-100 מיקרוליטר של תערובת מאסטר הצביעה CD19.
- בצע את פרוטוקול הצביעה CD19, 7AAD ו-APC Annexin V עבור כל דגימות ZefiX, כולל 3 x 105 תאים חיוביים ל-CTV מתרבית תאים מקבילה אם זמינים.
- בצע ניתוח ציטומטריית זרימה לפי הסדר ורשום את מספר האירועים המתוארים בטבלה 2. הפעל את כל הדגימות המכילות תאי מארח ותאי שתל באופן מלא ככל האפשר כדי להעריך את מספר תאי השתל הכולל.
- ניתוח תוצאות באמצעות תוכנה מסחרית.
- אסטרטגיית שער לדגימת תרבית תאים: פתח את התוכנה וטען את קבצי ה-FCS לסביבת העבודה. צור תרשים נקודות עם CD19 ו-CTV כדי להבטיח שהאות חופף וכדי לאשר את נוכחות התאים הסרטניים. לאחר מכן, צור תרשים נקודות עם FSC-A (ציר x) ו-SSC-A (ציר y) כדי להבחין בין תאים שלמים (Q2) לפסולת (Q4; איור 3A).
- השתמש באוכלוסיית התאים השלמים כדי ליצור תרשים חדש עם SSC-H (ציר x) ו-SSC-A (ציר y) כדי לזהות תאים בודדים (איור 3A').
- צור תרשים נקודות נוסף עם Annexin V (ציר x) ו-7AAD (ציר y) באמצעות אוכלוסיית התאים הבודדים (איור 3A''). להבחין בין תאים לארבע אוכלוסיות: תאים ברי קיימא: Annexin V שלילי, 7AAD שלילי (Q4); תאים אפופטוטיים מוקדמים: אנקסין V חיובי, 7AAD שלילי (Q3); תאים אפופטוטיים/נמקיים מאוחרים: אנקסין V חיובי, 7AAD חיובי (Q2); תאים נמקיים: Annexin V שלילי, 7AAD חיובי (Q1).
- חזור על שלבים אלה עבור דגימות של 3 dpi (איור 3B).
- אסטרטגיית שער עבור תאי שתל ותאי עובר מארח
- הפרד תאי שתל אנושיים מתאי מארח באמצעות תרשים נקודות עם CTV (ציר x) ו-CD19 (ציר y). זהה ובודד תאי שתל חיוביים כפולים CTV/CD19 (איור 3C).
- החל את אותה אסטרטגיית שער שתוארה עבור תאי תרבית של 3 dpi (איור 3B' - B''') על אוכלוסיית תאי השתל. העתק את אסטרטגיית השער לעקביות.
- מיזגו את כל אוכלוסיות התאים השליליים של Annexin V ו-7AAD להיסטוגרמה עם ערכי CTV על ציר ה-x (איור 3D). חשב את הממוצע הגיאומטרי עבור כל חמש הדגימות כדי לקבוע את שיעורי ההתפשטות.
- חישובים להערכת תגובה לטיפול
- כדי לקבוע את מספר חלוקות התאים לאחר 3 ימים, השתמש בנוסחה:
n = log2 (I0/I)
כאשר, I0 = עוצמת הקרינה הראשונית של CTV (ממוצע גיאומטרי, 0 dpi), I = עוצמת הקרינה CTV ב-72 שעות, n = מספר חלוקות התאים.
דוגמה: תאי מטופלים שהוקפאו טריים מחולקים פי 2.6 ב-ZefiX log2(88317/14644) = 2.6
ו-2.8x ביומן תרבית דו-ממדית2(88317/12992) = 2.8 - כדי לקבוע את המספר הכולל של תאי השתל לדג לאחר 3 ימים, חלקו את המספר הכולל של תאי הסרטן (כולל תאים אפופטוטיים אך לא כולל פסולת) במספר הדגים שנאספו בדגימה (בדרך כלל n = 10).
- כדי לקבוע את הכדאיות של תאי שתל חיוביים ל-CTV לאחר 3 ימים, השתמש בנוסחה:
V = (C/100) x A
כאשר: V = כדאיות, C = חלק של תאים בודדים שלמים ללא פסולת (באחוזים), A = חלק של תאים שליליים של Annexin V ו- 7AAD (באחוזים).
- כדי לקבוע את מספר חלוקות התאים לאחר 3 ימים, השתמש בנוסחה:
תוצאות
להערכה מדעית מפורטת של פרוטוקול ZefiX, כולל קסנוגרפט וטיפול תרופתי בדגימות תאי BCP-ALL ראשוניות שהוקפאו טריות, אנא עיין בכתב היד שפורסם בעבר21. אישור לשימוש בדגימות מטופלים במחקר לבדיקת תרופות פרה-קליניות ניתן כחלק ממחקרים משלימים לניסוי ALL-REZ BFM 2002 (NCT00114348) ולרישום וביובנק ALL-REZ BFM (EA2/055/12) על ידי ועדות האתיקה המקומיות למחקר רפואי, כמו גם לניסוי הבינלאומי IntReALL SR 2010 (NCT01802814) על ידי הרשות הלאומית. הסכמה מדעת הושגה מהמטופלים ו/או האפוטרופוסים שלהם באמצעות הניסוי או הרישום המתאים אליו הם נרשמו.
איור 2 ממחיש דוגמה ליישור עוברים בצלחת אגרוז לפני ההזרקה, מה שעוזר לייעל את תהליך ההזרקה. ההזרקה צריכה להתבצע בזווית המתוארת כדי למקד במדויק את החלל המקיף את הלב המתפתח. בנוסף, איור 2C מספק התייחסות ל-2 עוברי dpf שהוזרקו בהצלחה המכילים תאי שתל אנושיים (כחול), שסומנו ב-CTV לפני ההזרקה. עוברים עם תוצאות הזרקה שונות מאלה המוצגים באיור 2C לא נכללו, עם דגש מיוחד על הימנעות מניקוב שק החלמון כדי להבטיח את כדאיות תאי השתל במהלך שלושת הימים הבאים.
לאחר תקופת הדגירה של שלושת הימים, עוברי המארח מעובדים במאגרים של 10 לניתוח ציטומטריית זרימה. לאחר דיסוציאציה אנזימטית, תרחיפי התאים מוכתמים בנוגדנים אנטי-אנושיים-CD19 ושני סמני כדאיות: Annexin V לתאים אפופטוטיים מוקדמים ו-7AAD לתאים אפופטוטיים ונמקיים מאוחרים.
איור 3 מציג נתוני ציטומטריית זרימה של תאי BCP-ALL מורחבים ZefiX מחולה עם BCP-ALL. לוחות A, A', A' ו-A''' מציגים נתונים שנאספו ב-0 dpi ביום ההשתלה. איור 3A מציג ערכי פלואורסצנטיות CTV ו-CD19 עבור סך של 10,000 תאים כהתייחסות לאסטרטגיית השער המיושמת על תרחיפי תאי שתל מארח ב-3 dpi (איור 3C). באיור 3A', פסולת אינה נכללת באמצעות שער רגיל של תאים באמצעות אזור פיזור קדימה (FSC-A) ואזור פיזור הצידה (SSC-A). באיור 3A', תאים בודדים מופרדים מכפילים באמצעות גרף של גובה SSC (SSC-H) לעומת SSC-A. אוכלוסיית תאים בודדים זו משמשת להערכת כדאיות באיור 3A''', כאשר תאים ברי קיימא (Q4) נבדלים מתאים אפופטוטיים מוקדמים (Q3, ערכי Annexin V גבוהים יותר) ותאים אפופטוטיים או נמקיים מאוחרים (Q2, רמות 7AAD גבוהות יותר).
לשם השוואה, תאי חולים שגודלו בתנאים דו-ממדיים קונבנציונליים מנותחים גם על ידי זרימה ציטומטרית לאחר שלושה ימים (איורים 3B,B',B'',B'''), בעקבות אותה אסטרטגיית שער. הכדאיות של תאי המטופל לאחר 72 שעות בתרבית דו-ממדית מחושבת מ-Q2 באיור 2B' ו-Q4 באיור 2B': (95.0%/100)*61.9% = 58.8%.
באיור 3C, חומר המוצא הוא תרחיף התאים מעוברים מארחים שמכילים תאי שתל. בניגוד למדידות מבחנה, כל התאים בצינור מנותחים על ידי ציטומטריית זרימה. תאי שתל חיוביים ל-CD19 ו-CTV מגודרים כדי להפריד אותם מתאי דגים שליליים CD19 ו-CTV. אוכלוסיית תאי השתל השלמים מנותחת עוד יותר באיור 3C', שם פסולת אינה נכללת. לאחר מכן מוערכת הכדאיות של תאי שתל בודדים באמצעות אותה אסטרטגיית שער כמו באיורים 3B.
התוצאות מצביעות על כך שאחוז התאים הבודדים ברי הקיימא המורחבים בעוברים הוא 95.2%, שהוא גבוה פי 1.6 מהכדאיות של תאים שגודלו בצלחת (איור 3B''). שיעורי חלוקת התאים חושבו in vivo ו-in vitro על ידי ניתוח הירידה בעוצמת הקרינה של CTV בכל אוכלוסייה מ-0 dpi ל-3 dpi (איור 3D). מספר חלוקות התאים נקבע באמצעות הנוסחה בסעיף 6.4.1 והממוצע הגיאומטרי של כל עקומת CTV (איור 3D). שיעורי החלוקה המחושבים (2.59 חלוקות in vivo ו-2.77 חלוקות במבחנה) מצביעים על כך שתאים ברי קיימא מתחלקים בקצב דומה בשני התנאים במשך שלושה ימים.
לבסוף, המספר הממוצע של תאי השתל השלמים לעובר לאחר שלושה ימים נקבע על ידי חלוקת מספר תאי השתל השלמים (לא כולל פסולת, איור 3C') במספר העוברים שנאספו בצינור21.
לסיכום, דגימות BCP-ALL טריות שהושתלו בעוברי דג זברה מציגות כדאיות גבוהה יותר לאחר שלושה ימים בהשוואה לתרבית קונבנציונלית בצלחת ותאים ברי קיימא מתחלקים בקצב דומה בשני התנאים.
איור 1. זרימת עבודה של צינור ALL-ZefiX. נוצר בשנת https://BioRender.com. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
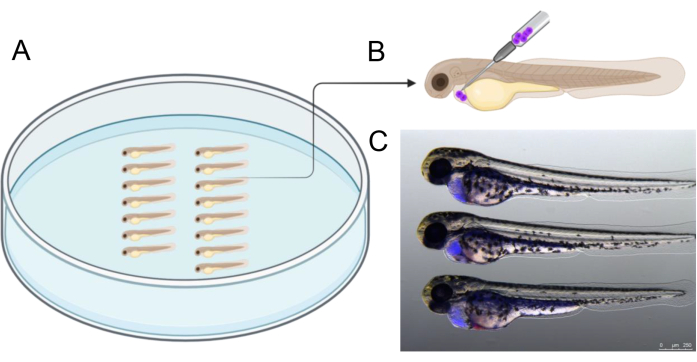
איור 2: סידור ההזרקה. (A) סידור העוברים כפי שמתואר מקל על ההזרקה. ניתן לסדר את העוברים באמצעות מלקחיים או עם קצה פיפטה מיקרו-מטען של 20 מיקרוליטר שנחתך לקצה באורך 2.5 - 3 ס"מ. (B) ייצוג סכמטי של זווית ההזרקה המומלצת להשתלת תאים לתוך קרום הלב של 2 עוברים dpf. (C) עזרים חזותיים להערכה נכונה של כמות התאים הסרטניים המושתלים. תמונה זו מציגה עובר של 48 hpf 3 שעות לאחר ההזרקה עם תאי סרטן אנושיים שסומנו בעבר עם CellTrace Violet). נוצר בשנת https://BioRender.com. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: אסטרטגיית שער וניתוח ציטומטריית זרימה של דגימה קפואה טרייה של תאי בלסט BCP-ALL מבודדים לאחר תרבית דו-ממדית של השתלה בעוברי דג זברה. (א, ב) תאי המטופלים סומנו ב-CellTrace Violet (CTV) לפני התרבית. התאים תורבבו על פלסטיק תרבית רקמה בטמפרטורה של 37 מעלות צלזיוס למשך 0 שעות (A) או 72 שעות (B) לפני ניתוח ציטומטריית זרימה. (C) תאי מטופלים שסומנו ב-CTV וגודלו ב-35 מעלות צלזיוס במשך 72 שעות כשתלים בעוברי דג זברה מארח. קבוצה של 10 עוברים אוגדה לפני דיסוציאציה של תא בודד לניתוח ציטומטריית זרימה. אסטרטגיית השער ב-(B) יושמה, ושבר תאי השתל בר-קיימא זוהה וכומת. לשם כך, תאי שתל חיוביים ל-CTV (Q2) הופרדו מתאי דג זברה פלואורסצנטיים (Q1/4) כדי למיין את אוכלוסיית תאי השתל לניתוח. עוצמת תיוג CTV נותחה באוכלוסיית תאי השתל הזו. (D) ספירת תאים ועוצמה ממוצעת של תוויות CTV מבחירת תאים בת קיימא בלבד. שימו לב לשינוי בעוצמת ה-CTV לאחר 3 ימים (3 dpi). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
טבלה 1: טבלת הפתרונות בשימוש. אנא לחץ כאן להורדת טבלה זו.
טבלה 2: דגימות שנמדדו על ידי ציטומטריית זרימה. אנא לחץ כאן להורדת טבלה זו.
Discussion
עוברי דג הזברה הפכו למודל קסנוגרפט פופולרי יותר ויותר לבדיקת תרופות וחקר סרטן בשל יכולת התפוקה הגבוהה והעלות-תועלת שלהם. xenografts אלה מבטיחים כעמוד תווך קריטי של רפואה תרגומית, המסייעים למחקר פרה-קליני וקבלת החלטות 9,21. עם זאת, מודלים של קסנוגרפט של דג הזברה להרחבה וטיפול בתאי לוקמיה אנושית נותרו מיוצגים בתת-ייצוג בהשוואה לגוף העבודה הנרחב על השתלות גידול מוצק. פרוטוקול זה מציע הנחיות מפורטות למינוף השתלות דג הזברה במחקר לוקמיה תוך שמירה על התאמה לשימוש בגידולים מוצקים.
השגת השתלת תאים סרטניים עקבית יכולה להיות מאתגרת, ולהדגיש את הצורך בניתוח סטנדרטי ואמינות סטטיסטית גבוהה יותר. פרוטוקול זה מטפל בבעיות אלו על ידי הצגת צינור מקיף להכנה, השתלה וניתוח ציטומטריית זרימה במורד הזרם, יחד עם המלצות לפתרון בעיות.
הזרקת מורפולינו לדיכוי חיסוני חולף
עוברי דג הזברה מסתמכים על מערכת החיסון המולדת שלהם במהלך הימים הראשונים להתפתחות, המגדירה את מסגרת הזמן לצינור ניסיוני זה20. מקרופאגים פרימיטיביים מופיעים בסביבות 12 hpf, כאשר חלקם מתמיינים לנויטרופילים ב-33 hpf 20,31,32. תאי T נכנסים למחזור הדם בערך 8 ימים לאחר ההפריה20,33. מקרופאגים ונויטרופילים, כחלק מהתגובה החיסונית המולדת, היו מעורבים בהישרדות מופחתת של תאי BCP-ALL שנצפתה שלושה ימים לאחר ההשתלה במחקרים קודמים21.
דיכוי חיסוני זמני בתיווך מורפולינו, המכוון ל-spi1 ו-csf3r, מעכב ביעילות את התמיינות המקרופאגים והנויטרופילים, מה שמוביל לשיפור ההשתלה של תאי BCP-ALL מבלי להשפיע על כדאיות העובר21. למרות ששיטה זו אינה יכולה להשיג דלדול קבוע, מכיוון שנוקאאוט מוחלט של spi1 ו-csf3r הוא קטלני, היא נותרה הגישה הטובה ביותר עבור צינור זה.
כיול נפחי ההזרקה באמצעות גרטיקול ואספקה מדויקת לשק החלמון בשלב התא האחד מבטיח הזרקות מורפולינו עקביות עם שיעורי הישרדות גבוהים. חלופות כמו זריקות קלודרונאט ליפוזומלי (קלודרוזום) לדלדול מקרופאגים הראו הבטחה אך דורשות אימות נוסף עבור צינור זה34,35.
הכנת תאים
אוכלוסיית תאים צפופה ובת קיימא מספיק היא קריטית להרחבה מוצלחת של BCP-ALL בפרוטוקול זה. CellTrace Violet (CTV) משמש לתיוג פלואורסצנטי כדי להעריך את הצלחת ההשתלה ב-0 dpi ולעקוב אחר שיעורי התפשטות לאורך הניסוי. בניגוד לתוויות אחרות, CTV אינו משנה את התנהגות התאים, ומאפשר ניתוח התפשטות מדויק ברמת התא הבודד. זה מציע יתרונות על פני צביעת נוגדנים Ki-67, הלוכדת תאים רק במהלך התפשטות אך לא תאים מחולקים שכבר יצאו ממחזור התא.
CTV גם עולה על CellTracker CM-DiI (DiI) בשיקוף כדאיות התא. DiI ונגזרותיו הם פלואורופורים יציבים יותר, לעתים קרובות נמשכים מעבר למוות תאי, מה שיכול לבלבל את תוצאות הניסוי2. בנוסף, הכללת נוגדן ספציפי ל-BCP-ALL כנגד CD19 בזרימה ציטומטרית מאפשרת זיהוי מדויק של תאי השתל. נוגדנים ספציפיים לבני אדם כגון אנטי-HLA יכולים לשמש כחלופות לסוגי תאים סרטניים אחרים36.
השתלת תאים סרטניים
חריטה עקבית דורשת דילול וריכוז אופטימליים של תרחיף התאים. המתלים צריכים לשמור על צפיפות מספקת תוך הימנעות מצמיגות הפוגעת בהזרקה. פרוטוקול זה נותן עדיפות להזרקה לחלל קרום הלב או לחלל הפריוויטלין (PVS) על פני שק החלמון, מכיוון שאתרים אלה מציעים כלי דם טובים יותר ותנאים פחות היפוקסיים37. השתלת שק חלמון, למרות שהיא נגישה, מביאה לעתים קרובות לשיעורי תמותה גבוהים ויכולת חיים ירודה של תאים21.
סתימת מחט עקב מיקרו-חלקיקים נותרה אתגר פרוצדורלי. סינון תרחיף התאים וכיול מחדש של נפחי ההזרקה לאחר חיתוך מחטים חסומות הם שלבים חיוניים. יש להשתמש רק בעוברים עם קרום הלב מלא בצפיפות לטיפולים תרופתיים עוקבים21,36.
טמפרטורת הדגירה המומלצת של 35 מעלות צלזיוס מאזנת את הטמפרטורה הטבעית של תאי סרטן אנושיים (37 מעלות צלזיוס) ואת טמפרטורת הדיור הסטנדרטית של דג הזברה (28 מעלות צלזיוס)21. עוברי דג הזברה מסתגלים לטמפרטורה זו עם עיוותים התפתחותיים מינימליים, והסביבה משפרת את ההתפשטות וההישרדות של תאים טריים שמקורם בחולה38.
טיפול תרופתי
מודלים של xenograft של דג הזברה פותחו כדי להקל על בדיקת תרופות בתפוקה גבוהה. עם זאת, טיפול תרופתי נותר אחד ההיבטים המאתגרים ביותר של בדיקת ZefiX. תרופות סטנדרטיות רבות וטיפולים ממוקדים אינם מגיעים ביעילות לתאי השתל in vivo. זה עשוי גם לדרוש בדיקה של פאנל גדול יותר של ריכוזי תרופות. דוגמאות מוצלחות, כגון ונטוקלקס ודאסטיניב, דורשות ריכוזים גבוהים משמעותית מאשר במבחני תרבית דו-ממדיים קונבנציונליים21.
לחלופין, טיפול מקדים בתאים במבחנה לפני ההשתלה מאפשר גם לחקור השפעות מערכתיות ומקומיות מסוימות. לדוגמה, גישה זו עשויה להתאים לטיפולים מבוססי וירוס הקשור לאדנו (AAV) בגליובלסטומה39.
אם השפעות הטיפול התרופתי נצפות במבחנה אך לא in vivo באמצעות צינור זה, חלופה יכולה להיות, למשל, השתלה לשלב תאי 1k (3 hpf) או שלב הבלסטולה והתחלת טיפול תרופתי ב-24 hpf40,41. זה יכול לאפשר לתרופות להגיע לתאי השתל שאינם מצליחים בעוברים בני 48 שעות או הזרקה משותפת של תאים ותרופות בו זמנית25.
ניתוח דיסוציאציה וזרימה ציטומטרית
דיסוציאציה של רקמות היא קריטית לניתוח מספר תאי השתל הכולל ולפירוש אמין של תוצאות ניסוי. שילוב של דיסוציאציה מכנית ואנזימטית מבטיח תרחיף תא בודד באיכות גבוהה תוך שמירה על שלמות החלבון על פני התא. התאמת תנאי דיסוציאציה (למשל, הרכב אנזים, פיפטינג או שימוש בהומוגנייזר Dounce) עשויה להיות נחוצה עבור סוגי סרטן שונים.
יש לסנן דגימות כדי למנוע סתימה של ציטומטר הזרימה, וניתן להפחית חלבונים או שומנים דביקים באמצעות EDTA או הסרת חלמון עובר לפני דיסוציאציה.
תקציר
פרוטוקול ZefiX מספק צינור ניסויים מהיר וחסכוני למחקר סרטן פרה-קליני, מחקרי עמידות לתרופות והערכות טיפול מותאמות אישית. בעוד שלמודלים של xenograft של דג הזברה יש מגבלות ואינם יכולים להכיל את כל סוגי התרופות, פרוטוקול סטנדרטי זה מאפשר הרחבה in vivo של תאי לוקמיה טריים של חולים וקווי תאים. ניתן להתאמה לסוגי סרטן אחרים, הוא מציע כלי מבטיח לחיזוי מהיר ומותאם אישית של תגובה לתרופות במסגרת הזמן לקבלת החלטות קליניות.
Disclosures
כל המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
עבודה זו נתמכה על ידי Deutsche Forschungsgemeinschaft (DFG, קרן המחקר הגרמנית) במסגרת המרכז למחקר שיתופי CRC1588, פרויקט מספר 493872418 וקרן ד"ר קלייסט בברלין, כמו גם על ידי Deutsche José Carreras Leukämie Stiftung (R03/2016), Berliner Krebsgesellschaft (HEFF201633KK) והקונסורציום הגרמני לסרטן (DKTK, Joint Funding Call 2016). אנו מודים לג'וליה קופקה ולמאריקה וולף על הקריאה הביקורתית של כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| Petri dish (10 cm) | Greiner | P7237 | |
| 7-AAD viability staining solution | Invitrogen | 00-6993-50 | |
| Agarose (LE, analytic grade) | Biozym | 840004 | |
| Air pressure injector | Narishige | IM400 | with external gas supply |
| Alexa Fluor 488 anti-human CD19 antibody | Biolegend | 302219 | |
| Annexin binding buffer | Biolegend | 422201 | Or see solutions for preparation |
| APC annexin V | Biolegend | 640941 | |
| Capillaries (10 cm, OD 1.0 mm, with filaments) | WPIINC | TW100F-4 | 1.0 OD; 0.75 ID |
| Cell culture flask (T-175) | Sarstedt | 83,39,12,002 | |
| CellTrace Violet | Invitrogen | C34557 | |
| Dimethyl sulphoxide (DMSO) | Roth | A994.1 | |
| Dispase II | Sigma Aldrich | D4693-1g | |
| DNase I | AppliChem GmbH | A3778 | |
| Eppendorf tubes (1.5 ml) | Eppendorf | 30120086 | |
| FACS tube (Polystyrene round botton Tube with Cell strainer Cap, 5 ml) | Falcon | 352235 | |
| Falcon tubes (50 ml) | Falcon | 352070 | |
| Fetal calf serum (FCS) | Sigma Aldrich | C8056 | |
| Fine mesh filter (10 µm) | PluriStrainer | 435001050 | |
| Fine mesh filter (20 µm) | PluriStrainer | 431002040 | |
| Flow cytometer | Becton Dickinson | BD LSRFortessa X-20 | |
| Fluorescent stereomicroscope | Leica | ||
| Fluorescent stereomicroscope with camera | Leica | M165 FC | Camera: DFC7000 T |
| Hank’s Balanced Salt Solution (HBSS, Calcium and Magnesium free ) | Sigma Aldrich | 88284 | |
| Injection mold (Zebrafish MI/Transplant KIT) | World Precision Instruments | Z-MOLDS | |
| Injection needles (without filament) | Biomedical instruments | VZIPbl-20-10-55 | Zebrafish injection pipette, blunt, OD: 20μm ± 1, TL:~10mm, PL: 55mm, Glass: BM100T-10P |
| Macro-centrifuge | Eppendorf | ||
| Micro-centrifuge | |||
| Morpholino (csf3r) | Gene Tools LLC | csf3r (GAAGCACAAGCGA GACGGATGCCA) | |
| Morpholino (spi1) | Gene Tools LLC | spi1(GATATACTGATAC TCCATTGGTGGT) | |
| Papain | Sigma Aldrich | P3125 | |
| Penicillin-Streptomycin (Penstrep; 10.000 U/ml) | Gibco | 15140122 | |
| Plates (4-well) | Greiner Bio one | 657160 | |
| Plates (96-well) | Greiner Bio one | 657180 | |
| Roswell Park Memorial Institute (RPMI) 1640 Medium | Gibco | 21875-034 | |
| Tricaine (MS-222) | Sigma Aldrich | E10521-50G | Ethy-3 aminobenzoate methanesulfenate |
References
- Fontana, C. M., Van Doan, H. Zebrafish xenograft as a tool for the study of colorectal cancer: a review. Cell Death Dis. 15, 1-12 (2024).
- Sturtzel, C., et al. Refined high-content imaging-based phenotypic drug screening in zebrafish xenografts. NPJ Precis Oncol. 7 (1), 1-16 (2023).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24, 2288(2023).
- Gamble, J. T., Elson, D. J., Greenwood, J. A., Tanguay, R. L., Kolluri, S. K. The zebrafish xenograft models for investigating cancer and cancer therapeutics. Biology. 10 (4), 252(2021).
- Costa, B., Estrada, M. F., Mendes, R. V., Fior, R. Zebrafish avatars towards personalized medicine-A comparative review between avatar models. Cells. 9 (2), 293(2020).
- Wang, W., et al. Progress in building clinically relevant patient-derived tumor xenograft models for cancer research. Animal Model Exp Med. 6 (5), 381-398 (2023).
- Xiao, J., Glasgow, E., Agarwal, S. Zebrafish xenografts for drug discovery and personalized medicine. Trend Cancer. 6 (7), 569-579 (2020).
- Fazio, M., Ablain, J., Chuan, Y., Langenau, D. M., Zon, L. I. Zebrafish patient avatars in cancer biology and precision cancer therapy. Nat Rev Cancer. 20 (5), 263-273 (2020).
- Costa, B., et al. Zebrafish avatar-test forecasts clinical response to chemotherapy in patients with colorectal cancer. Nat Comm. 15 (1), 4771(2024).
- Grissenberger, S., et al. Chapter 8 - Preclinical testing of CAR T cells in zebrafish xenografts. Method Cell Biol. 167, 133-147 (2022).
- Yan, C., et al. Single-cell imaging of T cell immunotherapy responses in vivo. J Exp Med. 218 (10), 20210314(2021).
- Pascoal, S., et al. A preclinical embryonic zebrafish xenograft model to investigate CAR T cells in vivo. Cancers. 12 (3), 567(2020).
- Pal, D., et al. Long-term in vitro maintenance of clonal abundance and leukaemia-initiating potential in acute lymphoblastic leukaemia. Leukemia. 30 (8), 1691-1700 (2016).
- Beneduce, G., et al. Blinatumomab in children and adolescents with relapsed/refractory B cell precursor acute lymphoblastic leukemia: A real-life multicenter retrospective study in seven AIEOP (Associazione Italiana di Ematologia e Oncologia Pediatrica) Centers. Cancers. 14 (2), 426(2022).
- Xie, J., et al. Short-course blinatumomab for refractory/relapse precursor B acute lymphoblastic leukemia in children. Front Pediatr. 11, 1187607(2023).
- Mengxuan, S., Fen, Z., Runming, J. Novel treatments for pediatric relapsed or refractory acute B-cell lineage lymphoblastic leukemia: Precision medicine era. Front Pediatr. 10, 923419(2022).
- Howe, K. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Lee, H. C., Lin, C. Y., Tsai, H. J. Zebrafish, an in vivo platform to screen drugs and proteins for biomedical use. Pharmaceuticals. 14 (6), 500(2021).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. J Clin Investigation. 122 (7), 2337-2343 (2012).
- Miao, K. Z., Kim, G. Y., Meara, G. K., Qin, X., Feng, H. Tipping the scales with zebrafish to understand adaptive tumor immunity. Front Cell Dev Biol. 9, 660969(2021).
- Gauert, A., et al. Fast, in vivo model for drug-response prediction in patients with B-cell precursor acute lymphoblastic leukemia. Cancers. 12 (7), 1883(2020).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. Mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), e49-e56 (2011).
- Pase, L., et al. Neutrophil-delivered myeloperoxidase dampens the hydrogen peroxide burst after tissue wounding in zebrafish. Current Biol. 22 (19), 1818-1824 (2012).
- Wijk, R. C. V., et al. Mechanistic and quantitative understanding of pharmacokinetics in Zebrafish larvae through nanoscale blood sampling and metabolite modeling of paracetamol. J Pharmacol Exp Ther. 371 (1), 15-24 (2019).
- Lázaro-Navarro, J., et al. Inhibiting casein kinase 2 sensitizes acute lymphoblastic leukemia cells to venetoclax via MCL1 degradation. Blood Advances. 5 (24), 5501(2021).
- Rhodes, J., et al. Interplay of pu.1 and gata1 determines myelo-erythroid progenitor cell fate in zebrafish. Developmental Cell. 8 (1), 97-108 (2005).
- Zakaria, Z. Z., Eisa-Beygi, S., Benslimane, F. M., Ramchandran, R., Yalcin, H. C. Design and microinjection of Morpholino antisense oligonucleotides and mRNA into zebrafish embryos to elucidate specific gene function in heart dvelopment. J Vis Exp. (186), e63324(2022).
- ZFIN: Zebrafish Book: Contents. , https://zfin.org/zf_info/zfbook/cont.html (2025).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Hasegawa, E. H., Gist H Farr, I. I. I., Maves, L. Comparison of pronase versus manual dechorionation of zebrafish embryos for small molecule treatments. J Dev Biol. 11 (2), 16(2023).
- Wattrus, S. J., Zon, L. I. Stem cell safe harbor: the hematopoietic stem cell niche in zebrafish. Blood Adv. 2 (21), 3063-3069 (2018).
- Harvie, E. A., Huttenlocher, A. Neutrophils in host defense: new insights from zebrafish. J Leukocyte Biol. 98 (4), 523-537 (2015).
- Page, D. M., et al. An evolutionarily conserved program of B-cell development and activation in zebrafish. Blood. 122 (8), e1-e11 (2013).
- Nguyen-Chi, M., et al. TNF signaling and macrophages govern fin regeneration in zebrafish larvae. Cell Death Dis. 8 (8), e2979-e2979 (2017).
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Dis Models Mech. 13 (1), dmm041889(2020).
- Rebelo de Almeida, C., et al. Zebrafish xenografts as a fast screening platform for bevacizumab cancer therapy. Comm Biol. 3 (1), 1-13 (2020).
- Pringle, E. S., et al. The zebrafish xenograft platform-A novel tool for modeling KSHV-associated diseases. Viruses. 12 (1), 12(2020).
- Pype, C., et al. Incubation at 32.5 °C and above causes malformations in the zebrafish embryo. Reprod Toxicol. 56, 56-63 (2015).
- Xu, X., et al. Adeno-associated virus (AAV)-based gene therapy for glioblastoma. Cancer Cell Int. 21 (1), 76(2021).
- Siebert, J., et al. Rhabdomyosarcoma xenotransplants in zebrafish embryos. Pediat Blood Cancer. 70 (1), e30053(2023).
- van Bree, N., et al. Development of an orthotopic medulloblastoma zebrafish model for rapid drug testing. Neuro-Oncol. noae210, (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved