Method Article
İmplant Yüzeylerinde M1 ve M2 İnsan Monosit Türevi Makrofajların Polarizasyonu ve Karakterizasyonu
Bu Makalede
Özet
Burada, mevcut protokollerin güvenilirliğini ve tekrarlanabilirliğini iyileştirmeyi ve daha fazla araştırmayı teşvik etmeyi amaçlayan, in vitro implant yüzeylerinin immünomodülatör potansiyelini değerlendirmek için ayrıntılı bir protokol sunuyoruz. Salgı sitokin profilleri, mRNA ekspresyonu ve hücre yüzey belirteçleri, titanyum üzerinde yetiştirilen makrofaj polarizasyonunu araştırmak için kan monositinden türetilmiş makrofajlar kullanılarak izlendi.
Özet
Bağışıklık aracılı karmaşık bir iyileşme süreci olan yabancı cisim reaksiyonu (FBR), implantların vücuda entegre edilmesinde çok önemli bir rol oynar. Makrofajlar, immün sistemin implant yüzeyleri ile etkileşiminin ilk hattı olarak, inflamasyon-rejenerasyon dengesinin modüle edilmesinde çift yönlü bir rol oynarlar. İmplant materyalleri ile immün yanıtlar arasındaki reaksiyonların derinlemesine anlaşılması ve değerlendirilmesi için güvenilir in vitro yöntemler ve protokoller çok önemlidir. Farklı in vitro modeller arasında, primer monosit kaynaklı makrofajlar (MDM'ler), makrofaj-implant etkileşimlerini araştırmak için mükemmel bir model sunar. MDM'lerin implant yüzeylerinde M1 (klasik olarak aktive edilmiş) ve M2 (alternatif olarak aktive edilmiş) makrofajlara polarizasyonunu değerlendirmek için deneysel bir protokol uyguladık. Sağlıklı donörlerden kan monositlerini izole ettik ve makrofaj koloni uyarıcı faktör (M-CSF) kullanarak makrofajlara ayırdık. Diferansiye makrofajlar implant yüzeylerinde kültürlendi ve M1 ve M2 alt tiplerine polarize edildi. M1 polarizasyonu interferon (IFN)-γ ve lipopolisakkarit (LPS) varlığında elde edilirken, M2 polarizasyonu interlökin (IL)-4 ve IL-13 içeren bir ortamda gerçekleştirildi. Makrofaj fenotiplerini, salgılanan sitokin panellerine, hücre yüzeyi belirteçlerine ve eksprese edilen genlere dayalı olarak Enzime Bağlı İmmünosorbent Testi (ELISA), konfokal lazer tarama mikroskobu (CLSM) ve kantitatif gerçek zamanlı PCR (qRT-PCR) ile değerlendirdik. Ekstrakte edilen RNA, tamamlayıcı DNA'ya (cDNA) dönüştürüldü ve M1 ve M2 makrofajları ile ilgili mRNA'yı ölçmek için qRT-PCR kullanıldı. Buna göre, M1 makrofajları, daha yüksek CD209 ve CCL13 seviyeleri sergileyen M2 makrofajlarına kıyasla daha yüksek proinflamatuar Tümör nekroz faktörü (TNF-α) sitokin ekspresyonu ve CCR7 yüzey belirteci ile karakterize edilmiştir. Sonuç olarak, CCR7 ve CD209, CLSM ile immün boyama ve görüntüleme yoluyla M1 ve M2 makrofaj alt tiplerinin spesifik ve güvenilir belirteçleri olarak tanımlandı. ELISA'nın M1'de yüksek TNF-ɑ seviyesini ve M2 hücrelerinde artmış CCL13'ü tespit etmesiyle daha fazla doğrulama sağlandı. Önerilen belirteçler ve deney düzeneği, implantların immünomodülatör potansiyelini değerlendirmek için etkili bir şekilde kullanılabilir.
Giriş
İmplante edilebilir biyomalzemeler, çeşitli insan hastalıkları için geleneksel bir çözüm haline gelmiştir ve doku mühendisliği, ilaç dağıtım sistemleri ve implantlar dahil olmak üzere biyomedikal araştırmalarda büyük rol oynamaktadır 1,2. Kalça protezleri, stentler, meshler, kalp kapakçıkları veya diş implantları gibi farklı yapı ve işlevlere sahip çeşitli malzemelerden yapılmış çok çeşitli implantlar vardır. İmplantasyon üzerine, doku-implant teması bir bağışıklık tepkisine neden olur, ardından çözünürlük, doku yeniden şekillenmesi ve homeostaz gelir. Bu süreçler, kullanılan biyomalzemelerin fiziksel, kimyasal ve biyoaktif özelliklerinden etkilenir. Bu özellikler, pro- ve anti-inflamatuar yanıtların yoğunluğunu ve spektrumunu, fibrotik kapsül oluşumunu, doku bozulmasını ve iyileşme fazını etkileyebilir 3,4. İyileşme sürecini ve uzun vadeli implant entegrasyonunu desteklemek ve optimize etmek için, mevcut araştırmanın ortaya çıkan bir yönü, implant yüzeyleri ve bağışıklık hücreleri arasındaki etkileşimi araştırmak ve aracılık etmektir.
Diğer bağışıklık hücrelerinin yanı sıra, vücudun her yerinde bulunan makrofajlar, iltihaplanma ve anti-patojenik savunmanın yanı sıra iyileşme süreçlerinde ve doku homeostazının korunmasında kilit oyunculardır 5,6. Makrofajlar, plastisitelerine ve yerel doku mikroçevresel uyaranlarına dayanarak, hücre metabolizması, hücresel fonksiyonlar ve sitokin sekresyon profillerinde büyük farklılıklar gösteren farklı fonksiyonel fenotiplere polarize olabilirler. Klasik olarak aktive olan M1 fenotipi, IL-1β, IL-6 ve TNF-α gibi proinflamatuar sitokinlerin salgılanması ile ayırt edilebilir ve travma ve yabancı biyomateryallere karşı ilk ve kronik inflamatuar yanıtta rol oynar. Buna karşılık, alternatif olarak, IL-4 ve IL-13 gibi sitokinler tarafından tetiklenen aktive edilmiş M2 makrofajları, inflamasyonun çözülmesi ve doku iyileşmesinin desteklenmesi gibi karakteristik özelliklere sahiptir. M2-polarize makrofajlar, CD206 gibi hücre yüzeyi belirteçlerinin ekspresyonu ve IL-10 ve IL-47 gibi sitokinlerin üretimi ile tanımlanabilir. Benzer şekilde, zaten polarize olmuş makrofajlar kendilerini yeni bir mikro ortamda yeniden programlayabilirler.
Hücre-biyomateryal etkileşimleri üzerine yapılan birçok çalışma, implante edilebilir biyomalzemelere yönelik immünolojik yanıtlar dizisinde ve implantla ilişkili komplikasyonların iyileşmesinde yer alan süreçlerin düzenlenmesinde makrofajların önemini göstermiştir 8,9,10. Biyomedikal mühendisliği son yıllarda önemli ilerlemeler kaydetmiş olsa da, implantların makrofaj davranışını ve polarizasyonu nasıl modüle ettiğini anlamak için daha fazla araştırmaya ihtiyaç vardır 11,12,13.
Hücre kültüründe, monosit kaynaklı periferik kan mononükleer hücreleri (PBMC'ler), sırasıyla LPS ve IFN-γ veya IL-4 kullanılarak M1 veya M2 fenotiplerine doğru indüklenmiş polarizasyonu takiben yapışık M0 makrofajlarına farklılaştırılabilir. Yeni biyomateryal örnekleriyle in vitro inkübasyondan sonra, in vitro14,15 biyomalzemelerin immünomodülatör potansiyelini tespit etmek için M1 ve M2 makrofajlarının farklı hücre yüzeyi reseptörlerini ve sitokin profillerini kullanmak mümkündür. Bu çalışma, farklı implant yüzeylerine yanıt olarak MDM'lerin polarizasyonunu araştırmak için kullanılabilecek bir in vitro protokol geliştirmeyi amaçladı. Gen ekspresyon analizleri, mikroskopi teknikleri ve ELISA, biyomateryal tarafından modüle edilen M1 ve M2 makrofajlarının fenotipik belirteçlerini ve spesifik sitokin profillerini belirlemek için kullanılabilir. Bu nedenle, makrofajlar ve biyomateryal yüzeyler arasındaki karmaşık etkileşimler aydınlatılabilir ve makrofaj-biyomateryal etkileşimlerini daha iyi anlamak için değerli bilgiler elde edilebilir. Son olarak, standartlaştırılmış bir in vitro protokol, deney düzeneğindeki değişkenliği en aza indirerek deneysel sonuçların tekrarlanabilirliğini, güvenilirliğini ve karşılaştırılabilirliğini sağlar.
Protokol
İnsan periferik kanı, Tübingen Üniversitesi tıp fakültesi Etik Kurulu tarafından onaylanan protokole uygun olarak sağlıklı kan bağışçılarından elde edildi (etik onay: 286/2021 BO). İnsan PBMC'leri, daha önce tarif edildiği gibi Yoğunluk Gradyan Santrifüjü kullanılarak izole edildi16. 24 mL kandan izole edilen PBMC'ler için aşağıdaki protokol özetlenmiştir. Protokolün şematik bir gösterimi Şekil 1'de gösterilmiştir.
NOT: Kan hacmi, kullanılan M0 makrofajlarının sayısına bağlı olarak ayarlanmalıdır.
24 mL kandan toplam 35.46 ± 9.1 milyon PBMC elde edildi, bu da 1.97 ± 0.46 milyon M0 makrofaj ile sonuçlandı (n = 5). Tüm reaktifler, sarf malzemeleri ve cihazlar Malzeme Tablosunda listelenmiştir. Arabellekler Tablo 1'de listelenmiştir.
1. İnsan kan monositlerinin makrofajlara farklılaşması
- İzole edilmiş PBMC'leri 15 mL önceden ısıtılmış monosit bağlanma ortamında yeniden süspanse edin ve bunları bir T75 hücre kültürü şişesine aktarın.
- Yapışmayı sağlamak için hücreleri 37 ° C ve% 5 CO2'de 90 dakika inkübe edin.
- Süpernatanı atın ve hücreleri, yapışmayan veya gevşek bir şekilde yapışmış hücreleri çıkarmak için hafifçe eğilerek önceden ısıtılmış tam ortamla bir kez yıkayın.
NOT: Bağlı hücreler, orijinal olarak şişeye eklenen toplam PBMC'lerin yaklaşık %10'unu oluşturan monositlerdir. - Yapışık hücrelere 10 ng/mL makrofaj koloni uyarıcı faktör (M-CSF) içeren 15 mL tam ortam ekleyin ve farklılaşmayı teşvik etmek için 6 gün inkübe edin.
- Besiyerini her 2 günde bir 10 ng/mL M-CSF içeren taze, tam besiyeri ile değiştirin.
2. MDM'lerin titanyum implant yüzeyinde yetiştirilmesi ve polarizasyonu
NOT: Farklılaşmanın 6. gününde, M0 makrofajları, tamamen polarize M1 veya M2 makrofajları elde etmek için 48 saat boyunca farklı uyaranlarla biyomateryal yüzeylere ekildi. İncelenen her yüzey için, M0, M1 ve M2 makrofajlarını tohumlamak için üç disk kullanıldı. Kontrol yüzeyleri olarak hücre kültürü ile muamele edilmiş plastik lameller kullanıldı.
- Kültür ortamını T75 şişelerinden çıkarın ve hücreleri 5 dakika boyunca 10 mL PBS ile yıkayın.
- Yapışık hücreleri, 10 mL önceden ısıtılmış hücre ayırma solüsyonu ile 30 dakika inkübe ederek ayırın.
- Hücrelere hafifçe vurun ve 50 mL'lik bir tüpe aktarın. Kalan hücreleri 10 mL PBS'de nazikçe kazıyarak ayırın.
- Ayrılan hücreleri 50 mL'lik tüpe aktarın ve 10 dakika boyunca 300 x g'da santrifüjleyin.
- Süpernatanı atın ve hücreleri 5 mL önceden ısıtılmış tam ortamda yeniden süspanse edin.
- Hücre sayısını ve canlılığını belirlemek için tripan mavisi boyama ve bir hemositometre kullanarak hücreleri sayın.
- Hücre sayısını 1 mL tam ortam başına 160.000 hücreye ayarlayarak hücre süspansiyonunu hazırlayın.
- Biyomateryal diskleri ultrasonik olarak 5 dakika boyunca% 70 etanol içinde temizleyin, ardından 30 dakika boyunca% 70 etanol içinde sterilizasyon yapın.
- Titanyum diskleri 1-2 saat kurutun, daha sonra işlenmemiş 24 oyuklu plakalara yerleştirin ve her oyuğa 1 mL hazırlanmış hücre süspansiyonu ekleyin.
- M1 polarize makrofajlar elde etmek için, sırasıyla 50 ng / mL ve 10 ng / mL konsantrasyonunda IFN-γ ve LPS ekleyin. M2 polarizasyonu için, her biri 20 ng/mL'lik bir konsantrasyonda IL-4 ve IL-13 ekleyin. M0 hücrelerinin herhangi bir polarizasyon maddesi olmadan büyütüldüğünden emin olun. Polarizasyonu indüklemek için hücreleri 37 ° C'de ve% 5 CO2'de 48 saat daha inkübe edin.
3. ELISA kullanılarak polarize makrofajların karakterizasyonu
NOT: Polarizasyonun 2. gününde, karakterizasyon analizleri için numuneler hazırlanmıştır. TNF-ɑ sitokin ve CCL13 kemokin, sırasıyla M1 ve M2 polarize makrofajları karakterize etmek için ölçüldü. Salgılanan proteinlerin konsantrasyonu, karşılık gelen süpernatantta salgılanan proteinlerin toplam konsantrasyonuna normalize edildi.
- Süpernatanı 1.5 mL'lik bir tüpte toplayın ve 5 dakika boyunca 300 x g'da santrifüjleyin. Süpernatanı yeni bir tüpe aktarın.
- Daha fazla deney için diskleri yeni bir 24 oyuklu plakaya aktarın. Amaç, işlenmemiş 24 oyuklu plakalarda ölü veya gevşek bir şekilde bağlanmış hücreleri ortadan kaldırmaktır.
NOT: Herhangi bir analiz yapılmadan önce hücre canlılığı yüzeyler üzerinde doğrulanmalıdır. Hücrelerin canlılığı, canlı/ölü hücre canlılık testleri ile veya dolaylı olarak hücre proliferasyonu ve sitotoksisite testleri ile belirlenebilir. - Sitokinleri ve kemokinleri üretici tarafından sağlanan özel talimatlara göre ölçün. Sitokinleri hemen ölçün veya ileride ölçüm yapmak üzere numuneleri -80 °C'de saklayın.
NOT: Her kit tipi için (ELISA kitinin hassasiyet ve tespit limitleri dikkate alınarak) uygun numune seyreltmesi belirlenmelidir. Bikinkoninik asit (BCA) testi için numuneler 1:5 oranında seyreltildi. TNF-ɑ için M1 numuneleri 1:10 oranında seyreltildi ve CCL13 için M2 numuneleri 1:12 oranında seyreltildi. - Salgılanan sitokinlerin/kemokinlerin konsantrasyonunu üretici talimatlarını izleyerek standart eğriyi kullanarak hesaplayın.
- BCA protein tahlil Kitini kullanarak toplam protein miktarını ölçün.
- Salgılanan proteinlerin konsantrasyonunu mg toplam proteine normalleştirin.
4. CLSM kullanılarak polarize makrofajların karakterizasyonu
NOT: Polarize makrofajlar, CD209 ve CCR7 hücre yüzey belirteçlerine karşı antikorlarla boyanarak daha da karakterize edildi. Çekirdekler DRAQ5 ile karşı boyandı. CD68 veya diğer belirteçler pan-makrofaj belirteçleri olarak kullanılabilir.
- Hücreleri 800 μL PBS'de 2 kez yıkayın. Diskleri oda sıcaklığında (RT) 400 μL fiksasyon tamponunda 20 dakika inkübe edin.
- Fiksasyon tamponunu çıkardıktan sonra, 400 μL PBS'de üç kez yıkayın. Numuneleri hemen boyayın veya 4 °C'de 1 mL saklama tamponunda saklayın.
NOT: Bu fiksasyon ve saklama protokolü ile numuneler, fiksasyondan sonraki 1-6 hafta içinde başarıyla boyandı ve görüntülendi. - Bir sonraki adımdan önce, sakladıktan sonra diskleri 800 μL PBS ile iki kez yıkayın.
- Spesifik olmayan bağlanma bölgelerini bloke etmek için diskleri RT'de 30 dakika boyunca 400 μL bloke edici tampon ile inkübe edin.
- Bloke edici tamponu atın ve diskleri 400 μL boyama tamponunda seyreltilmiş primer antikorlarla 1 saat RT'de inkübe edin.
- Bir numunede CCR7 ve CD209 ekspresyonunu incelemek için çift boyama kullanarak bir immünofloresan prosedürü gerçekleştirin. Bu amaçla, farklı türlerden (fare ve tavşan) elde edilen birincil antikorları aynı boyama adımında birleştirin.
NOT: Minimum arka plana sahip güçlü bir sinyal elde etmek için antikor konsantrasyonunu optimize edin. CCR7 antikoru 10 μg/mL'lik bir son konsantrasyonda kullanıldı ve CD209 antikoru 1/400 seyreltildi.
- Bir numunede CCR7 ve CD209 ekspresyonunu incelemek için çift boyama kullanarak bir immünofloresan prosedürü gerçekleştirin. Bu amaçla, farklı türlerden (fare ve tavşan) elde edilen birincil antikorları aynı boyama adımında birleştirin.
- Birincil antikorları çıkarın ve 3x'i 400 μL yıkama tamponu ile yıkayın.
- Boyama tamponunda seyreltilmiş florofor işaretli ikincil antikorları ekleyin ve karanlıkta RT'de 1 saat inkübe edin.
NOT: İkincil antikorların konsantrasyonu, minimum arka plan ile maksimum spesifik sinyaller elde etmek için optimize edilmelidir. Bu çalışmada boyama için 5 μg/mL konsantrasyonda sekonder antikorlar kullanılmıştır. - Süpernatanı çıkardıktan sonra, numuneleri her biri 3 dakika boyunca yıkama tamponunda üç kez yıkayın.
- PBS'ye 10 μM DRAQ5 ekleyin ve RT'de ışıktan korunarak 15 dakika inkübe edin.
- Süpernatanı çıkarın ve diskleri PBS'de bir kez yıkayın.
- Kalan PBS'yi çıkarın ve 1 damla montaj ortamı ekleyin.
- 5 dakika sonra kapak camlarını uygulayın ve numuneleri 1 saat kurumaya bırakın.
- Numuneleri kuruttuktan sonra kenarlarını şeffaf oje ile kapatın ve görüntülemeye kadar karanlıkta 4 °C'de saklayın.
- Hücrelere genel bir bakış elde etmek için örnekleri 25x büyütme ile görüntüleyin. Yüzey işaretleyicilerinin yapısını ve lokalizasyonunu daha fazla belirlemek için 63x büyütmeli görüntüler elde edin.
- ImageJ yazılımını kullanarak CCR7 ve CD209'un floresan yoğunluğunu ölçün.
NOT: Görüntü alımı, bir argon lazer (488 nm), DPSS lazer (561 nm) ve HeNe lazer (633 nm) ile donatılmış bir CLSM sistemi kullanılarak bir fotoçoğaltıcı (PMT) ile gerçekleştirildi.
5. Polarize makrofajların qRT-PCR kullanılarak karakterizasyonu
NOT: RNA izolasyonu için, cDNA sentezi için yeterli RNA elde etmek amacıyla numune başına iki disk kullanıldı.
- Diskleri 2x 800 μL PBS ile yıkayın.
- İlk diske 350 μL lizis tamponu ekleyin ve hücreleri yukarı ve aşağı pipetleyerek parçalayın.
- Lizatı ikinci diske aktarın ve parçalama işlemini tekrarlayın.
- Lizata 350 μL %70 etanol ekleyin ve homojen olana kadar yukarı ve aşağı pipetleyin.
- Lizatı döndürme kolonuna aktarın ve RNA izolasyonu için üreticinin talimatlarını izleyin.
- Bir nanodamla veya başka bir cihaz kullanarak RNA miktarını ölçün.
- Farklı numuneler için RNA konsantrasyonlarını normalleştirin ve Birinci İplikli cDNA Sentezi için RT-PCR sistemini kullanarak üreticinin talimatlarına göre cDNA'yı sentezleyin.
- Üreticinin protokolünü takip ederek 350 ng RNA kullanarak cDNA'yı sentezleyin ve qRT-PCR analizi yapılana kadar -20 °C'de saklayın.
NOT: Burada, 20 μL'de 4 μL RT Karışımı (5x) kullanılarak cDNA'yı sentezlemek için 350 ng saflaştırılmış RNA kullanıldı. - 96 oyuklu plakalarda ve ayrı ayrı 15 μL reaksiyonlarda (1x Syber green ana karışımı, 0.2 μM ileri ve geri primerler ve 4.5 μL 1:10 seyreltilmiş cDNA) gerçek zamanlı bir PCR sisteminde qRT-PCR gerçekleştirin.
NOT: PCR programı ısıtılmış bir kapakla (105 °C) başlar ve ardından üç adım gelir: 95 °C'de 3 dakika ilk denatürasyon, ardından 95 °C'de 15 saniye ve 40 döngü için 55 °C'de 30 saniye. - Çeşitli genlerin ekspresyon seviyelerini temizlik geni GAPDH'ye (veya β-aktin gibi diğer temizlik genlerine) normalleştirin.
- Doku kültürü lameller üzerinde kültürlenen M0 hücrelerini referans alarak 2−ΔΔCt yöntemini kullanarak bağıl gen ekspresyonunu hesaplayın. Tablo 2 , bu çalışmada kullanılan tüm primerleri listeler.
6. İstatistiksel analiz
- Tekrarlanabilirliği sağlamak için tüm verileri ortalama ± SEM olarak sunun. Tekrarlanabilirliği sağlamak için tüm tahlilleri tekrarlayın (bu çalışmada tahliller beş kez tekrarlanmıştır). Normal dağılımlı veriler arasındaki istatistiksel olarak anlamlı farklılıkları, tek yönlü bir varyans analizi (ANOVA) ve ardından Tukey'in çoklu testini kullanarak değerlendirin.
- Parametrik olmayan veri kümelerini analiz etmek için Friedman testini ve Dunn'ın çoklu karşılaştırma testini kullanın. Verileri analiz etmek için uygun veri analiz yazılımı kullanın ve istatistiksel anlamlılığı 0,05'ten küçük bir p değeri olarak tanımlayın.
Sonuçlar
Bu çalışmanın sonuçları, MDM'lerin titanyum yüzeylerde başarılı bir şekilde farklılaşmasını ve polarizasyonunu ve ardından M1 veya M2 polarize makrofajların karakterizasyonunu göstermektedir. İlk adımda, CLSM kullanarak polarize MDM'leri karakterize ettik. Ön çalışmalarımıza dayanarak, CD209 ve CCR7, M1'i M2 polarize MDM'lerden ayırt etmek için spesifik belirteçler olarak kullanıldı. Şekil 2A,B'de gösterildiği gibi, MDM'ler başarılı bir şekilde M1 ve M2 makrofajlarına polarize oldu. Titanyum yüzeyinde, CCR7, M1 polarize makrofajlarda, spesifik olarak M2 polarize makrofajlarda eksprese edilen CD209'dan daha güçlü bir şekilde eksprese edildi. Ayrıca, bağıl floresan yoğunluğunun ölçülmesi, M1 veya M2 alt tiplerine belirteçlerin atanmasını kolaylaştırdı (Şekil 2C).
Şekil 3 , titanyum ve lamel yüzeylerde MDM'lerin temsili bir qRT-PCR analizini göstermektedir. Sonuçlar, M1 (CCR7 ve TNF-ɑ) ve M2 (CD209 ve CCL13) polarizasyon belirteçlerinin yüksek ekspresyonu ile gösterildiği gibi, her iki yüzeydeki MDM'lerin başarılı bir şekilde polarize edildiğini gösterdi. Bu, sırasıyla M1 ve M2 polarize hücrelerde yüksek seviyelerde inflamatuar TNF-α sitokinleri (Şekil 4A) ve IL-13 kemokinleri (Şekil 4B) gözlenerek protein seviyesinde daha da doğrulandı.
Şekil 1: Protokolün şematik gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: CLSM kullanılarak polarize MDM'lerin karakterizasyonu. M1 ve M2 polarize makrofajların zenginleşmesi, tohumlamanın 2. gününde CCR7 ve CD209 antikorları kullanılarak spesifik antikor boyaması ve CLSM analizi ile doğrulandı. Floresan boyama ve CLSM analizine göre, (A) 25x büyütme ve (B) 63x büyütme, M1 hücreleri, M0 veya M2'den daha yüksek CCR7 (yeşil renkte) ifade etti. M2 hücreleri önemli bir CD209 ekspresyon paterni sergiler (yeşil renkte). (C) CCR7 ve CD209'un bağıl floresan yoğunluğunun kantitatif analizi. Çekirdekler DRAQ5 (mor renkte) ile boyandı. Sonuçlar, bağımsız olarak gerçekleştirilen 5 benzer deneyi temsil etmektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Gen ekspresyon profilleri kullanılarak polarize MDM'lerin karakterizasyonu. M1 (CCR7 ve TNF-ɑ) ve M2 (CD209 ve CCL13) polarizasyonu ile ilişkili farklı genlerin mRNA seviyelerini incelemek için kantitatif ters transkripsiyon polimeraz kullanıldı. Temizlik geni olarak GAPDH kullanıldı. Veriler ortalama ± SEM (n = 5) olarak sunulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
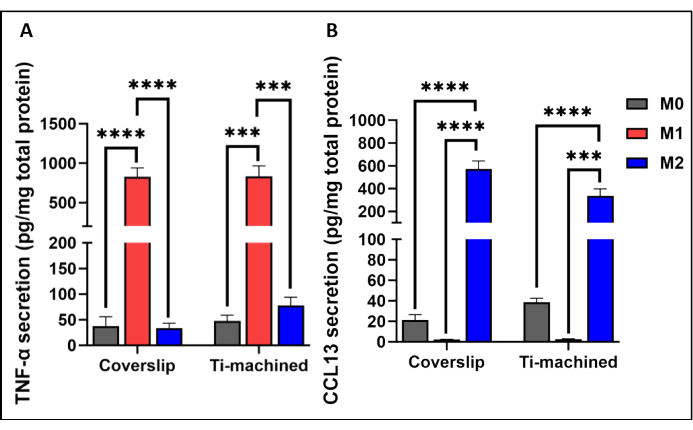
Şekil 4: Titanyum ve plastik lameller üzerinde kültürlenmiş M0, M1 ve M2 makrofajları tarafından sitokinlerin üretimi. Hücre kültürü süpernatantlarında (A) TNF-ɑ sitokin düzeyi ve (B) CCL13 düzeyleri ELISA kullanılarak ölçüldü. Sitokin sekresyonu, BCA testi ile ölçülen toplam protein sekresyonuna normalize edildi. Çubuk grafikler ortalama ± SEM'i temsil eder (n = 5). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Tampon/Çözelti | İçerik |
| Boyama/Engelleme tamponu | PBS + %1 BSA + %0,1 Tween 20 |
| Yıkama tamponu | PBS + %0.1 Ara 20 |
| Fiksasyon tamponu | PBS'deki Paraformaldehit'in (PFA) %3'ü |
| Depolama arabelleği | PBS'de penisilin ve streptomisinin% 1'i |
Tablo 1: Arabelleklerin listesi.
| Astar adı | İleri astar dizileri | Ters astar dizileri |
| GAPDH | 5'-GAGTCAACGGATTTGGTCGT-3' | 5'-TTGATTTTGGAGGGATCTCG-3' |
| CCR7 Serisi | 5'- TGGTGATCGGCTTTCTGGTC-3' | 5'- CACCTTGATGGCCTTGTTGC-3' |
| CD209 Serisi | 5'- GGAGCAGAACTTCCTACAGC-3' | 5'- CAACGTTGTTGGGCTCTCCT-3' |
| CCL13 Serisi | 5'-ATCTCCTTGCAGAGGCTGAA-3' | 5'-ACTTCCTTTGGGTCAGCA-3' |
| TNF-ɑ | 5'- GCTGCACTTTGGAGTGATCG-3' | 5'- TCACTCGGGGTTCGAGAAGA-3' |
Tablo 2. qRT-PCR'de kullanılan primer dizileri.
Tartışmalar
İmplante edilebilir materyallerin immünomodülatör özelliklerini anlamak için makrofaj davranışının kapsamlı bir şekilde anlaşılması esastır. Birkaç çalışma, in vitro17,18,19,20 makrofaj polarizasyonunu karakterize etmek için heterojen belirteçler, çeşitli hücre modelleri ve protokoller bildirmiştir. Deneysel sonuçların tekrarlanabilirliğini, güvenilirliğini ve karşılaştırılabilirliğini geliştirmek için, uygun bir hücre modeli ve konsensüs karakterizasyon belirteçleri ile birlikte standartlaştırılmış ve doğrulanmış protokoller gereklidir. Buna göre, implant materyallerinin immünomodülatör özelliklerinin doğru bir simülasyonu için öncelikle uygun bir hücre modeli gereklidir. Farklı çalışmalar, izole doku makrofajları, kan monositlerinden türetilen farklılaşmış makrofajlar ve ölümsüzleştirilmiş monositik hücre hatları gibi çok çeşitli hücre modellerini kullanmıştır. Doku izole makrofajların in vivo koşulları daha iyi temsil ettiği düşünülse de, teknik ve etik açıdan zorlayıcıdırlar21,22. Makrofajlar ayrıca sıklıkla THP1 hücreleri 23,24,25,26 gibi yerleşik ölümsüzleştirilmiş monositik hücre hatlarından elde edilir. Bu hücreler, yaşlanmayan hücrelerin sınırsız bir kaynağı olarak hücre yanıtında daha fazla homojenlik sunabilirken, genellikle hematolojik neoplazmları olan hastalardan elde edilir ve yanıtları normal hücrelerden önemli ölçüde farklı olabilir. Örneğin, monositik THP1 hücrelerinin M1 simülatörlerine daha duyarlı olduğu ve M1 özelliklerini sergileme olasılığının daha yüksek olduğu bildirilmiştir22. Bu çalışmanın sonuçları, ön çalışmamızdan elde edilen sonuçlarla uyumludur (veriler burada sunulmamıştır).
Ayrıca, kandan türetilen monositler, dokuda yerleşik makrofajların öncüleri olarak kabul edildiğinden ve daha yüksek verimlerde kolayca elde edilebildiğinden, makrofajlar için uygun bir alternatif olabilirler 27,28,29. Kan monosit türevi makrofajları kullanarak yaptığımız çalışmaya dayanarak, bu hücrelerin hem titanyum hem de hücre kültürü ile muamele edilmiş lameller üzerindeki M1 ve M2 stimülatörlerine eşit derecede duyarlı olduğunu bulduk. Ek olarak, bazıları temsili sonuçlarda gösterilen birden fazla M1 ve M2 konsensüs belirteci sergilediler. Sonuçlar, MDM'lerin implant-makrofaj etkileşimlerini simüle etmek için uygun bir in vitro model olarak kullanılabileceğini göstermiştir.
İmmünomodülasyon çalışmalarında daha fazla ilerleme için, sabit ve spesifik karakterizasyon belirteçleri gereklidir. Çalışmalar, makrofaj karakterizasyonu için sadece farklı kaynaklardan gelen makrofajlar arasında değil, aynı kaynaktan gelen makrofajlar arasında da farklılık gösteren çeşitli belirteçler sunmuştur 17,18,19,24. MDM'lerin karakteristik M1 ve M2 belirteçlerinden oluşan bir panel, rapor edilen farklı belirteçlerin değerlendirilmesi yoluyla belirlendi ve doğrulandı. En önemli anahtar belirteçlerden bazıları bu makalede sunulmuştur.
En uygun tespit yöntemlerinin belirlenmesi de değerlendirme sürecinin çok önemli bir parçasıdır. Hücre yüzeyi belirteçlerini değerlendirmek için yaygın olarak kullanılan analiz teknikleri, tipik olarak hücrelerin biyomalzemelerden çıkarılmasını gerektirir. Bununla birlikte, bu işlemin hücrelerin yüzey belirteçlerine zarar vererek hücreleri olumsuz etkilediği ve az sayıda müstakil hücre ile sonuçlandığı gözlemlenmiştir30. Sonuç olarak, hücre dekolmanı gerektiren akım sitometrisi, implantlara sıkıca bağlı makrofajları değerlendirmek için uygun değildir. Bu çalışmada CLSM kullanılarak hücre yüzey markörü tespiti yapılmıştır. Uygun belirteçleri kullanarak ve boyama işlemini optimize ederek, M1 ve M2 alt tiplerini birbirleriyle ve M0 hücreleriyle karşılaştırmalı olarak başarılı bir şekilde karakterize edebildik. Floresan boyamanın, sınırlamalarından biri olan yarı kantitatif olduğuna dikkat etmek önemlidir. Bu, önemli farklılıklar olmaksızın tüm alt tiplerde ifade edilen belirteçler kullanılarak hücrelerin değerlendirilmesini zorlaştırabilir. CCR7 ve CD209, CLSM kullanılarak MDM'leri karakterize etmek için farklı belirteçler test edildikten sonra seçildi. CCR7 ve CD209, sırasıyla M1 ve M2 alt tiplerinde tutarlı bir şekilde daha yüksek ifade edildi.
Bu çalışmanın sınırlamaları dahilinde, sonuçlar, implant yüzeylerindeki makrofajları polarize etmede ve bunları gen ekspresyonu, salgılanan proteinler ve hücre yüzeyi belirteçleri açısından doğru bir şekilde karakterize etmede uygulanan protokollerin faydasını ve etkinliğini vurgulamaktadır. Ek olarak, açıklanan belirteçlerin analizi, MDM'lerin farklı alt tiplerini ayırt etmek için kullanılabilecek tutarlı ve spesifik ifade modellerini ortaya çıkardı. Bununla birlikte, bu in vitro model, insan makrofajlarının fenotipik çeşitliliğini ve plastisitesini tam olarak yansıtmamaktadır. Şu anda çeşitli makrofaj alt tipleri (M2a, M2b, M2c, M2d) tanımlanmaktadır, bu da çeşitli biyomalzemelerin ve özelliklerinin (örneğin, fizikokimyasal özellikler) makrofaj plastisitesini ve polarizasyonunu nasıl etkilediğini incelemek için daha çeşitli in vitro modellere ihtiyaç olduğunu göstermektedir31,32. İn vitro modeller kullanılarak kompleks in vivo durumu yansıtmak mümkün olmasa da, yeni implante edilebilir biyomalzemelerin immünomodülatör potansiyelini etkili bir şekilde tanımlamak için sunulan in vitro protokol kullanılarak birçok sonuç elde edilebilir9. Son olarak, makrofajları karmaşık fizyolojik bağlamlarda diğer oyuncuların rolünü içeren daha karmaşık in vitro veya in vivo modellerde karakterize etmek için daha fazla kurulum gereklidir. Genel olarak, bu çalışma, uygun doku rejenerasyon süreçlerini ve başarılı implant entegrasyonunu iyileştirmek ve teşvik etmek ve ayrıca implantla ilişkili kronik inflamasyonu önlemek için immünomodülatör biyomalzemelerin geliştirilmesine ve tasarlanmasına katkıda bulunacaktır.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Diskler Medentis Medical, Bad-Neuenahr-Ahrweiler, Almanya tarafından sağlandı. Yazarlar, Ağız Diş ve Çene Cerrahisi Anabilim Dalı'nın (Tuebingen Üniversite Hastanesi) desteğini kabul eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 24-well plate, not-treated | Corning Incorporated (Kennebunk, USA) | 144530 | |
| Absorbance reader Infinite F50 | TECAN Austria GmbH (Grödig, Austria) | TCAT91000001 | |
| Accutase in DPBS, 0.5 mM EDTA | EMD Millipore Corp. (Burlington, USA) | SCR005 | |
| Anti-Fade Fluorescence Mounting Medium -Aqueous, Fluoroshield | abcam (Cambridge, UK) | ab104135 | |
| Bio-Rad MJ Research PTC-200 Peltier Thermal Cycler | Bio-Rad / MJ Research | 7212 | |
| Bovine serum albumin (BSA) | VWR International bvba (Leuven, Belgium) | 422361V | |
| Centrifuge 5804 R | Eppendorf SE (Hamburg, Germany) | 5804 R | |
| DC-SIGN (D7F5C) XP Rabbit mAb | Cell Signaling Technology | 13193 | |
| Dimethyl sulfoxide | Sigma Aldrich Co. (St.Louis, MO, USA) | D2438-5X10ML | |
| DRAQ5 Staining Solution | Milteny Biotec (Bergisch Gladbach, Germany) | 130-117-344 | |
| Ethanol ≥99.8% for molecularbiology | Carl Roth GmbH + CO. KG (Karlsruhe, Germany) | 1HPH.1 | |
| Goat Anti-Mouse IgG (H&L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | Invitrogen | A32723TR | |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Cyanine3 | Invitrogen | A10520 | |
| GraphPad Prism | GraphPad | Version 9.4.1 | |
| Human CCR7 Antibody | R&D Systems | MAB197 | |
| Human IFN-gamma Recombinant | Invitrogen (Rockford, USA) | RIFNG100 | |
| Human IL-13 | Milteny Biotec (Bergisch Gladbach, Germany) | 5230901032 | |
| Human IL-4 | Milteny Biotec (Bergisch Gladbach, Germany) | 130-095-373 | |
| Human M-CSF | Peprotech (Cranbury, USA) | 300-25 | |
| Leica TCS SP5 | Leica Microsystems CMS GmbH (Mannheim, Germany) | https://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp5/ | |
| Lipopolysaccharides from Escherichia | Sigma Aldrich Co. (Missouri, USA) | L4391-1MG | |
| Luna Universal qPCR Master Mix | New England Biolabs | NEB #M3003 | |
| LunaScript RT SuperMix Kit | New England Biolabs | E3010L | |
| Lymphocyte Separation Medium 1077 | PromoCell (Heidelberg, Germany) | C-44010 | |
| MCP-4/CCL13 Human ELISA Kit | Invitrogen | EHCCL13 | |
| MicroAmp Fast 96-Well Reaction Plate (0.1 mL) | Applied Biosystems (Waltham, USA) | 4346907 | |
| MicroAmp Optical Adhesive Film | Life Technologies Corporation (Carlsbad, USA) | 4311971 | |
| MicroAmp Splash Free 96-Well Base | Applied Biosystems (Waltham, USA) | 4312063 | |
| Microlitercentrifuge CD-3124R | Phoenix Instrument (Germany) | 9013111121 | |
| Microscope Cover Glasses, 10 mm | Carl Roth GmbH, Karlsruhe, Germany | 4HX4.1 | |
| Monocyte Attachment Medium | PromoCell (Heidelberg, Germany) | C-28051 | |
| Multiply-Pro Gefäß 0.5 mL, PP | Sarstedt AG & CO (Nümbrecht, Germany) | 7,27,35,100 | |
| Nanodrop One | Thermo Scientific (USA) | ND-ONE-W | |
| QuantStudio 3 System | Life Technologies GmbH (St. Leon-Rot, Germany) | A28567 | |
| RNeasy Micro Kit | Qiagen | 74007 | |
| RPMI 1640, 1x, with L-glutamine | Mediatech, Inc. (Manassas, USA) | 10-040-CV | |
| Sterile bench, LaminarAir HB 2472 | Heraeus instruments (Hanau, Germany) | 51012197 | |
| Tissue Culture Coverslips 13 mm (Plastic) | Sarstedt Inc. (Newton, USA) | 83,18,40,002 | |
| Titanium machinied discs 12 cm | Medentis Medical (Bad-Neuenahr-Ahrweiler, Germany) | N/A | |
| TNF alpha Human ELISA Kit | Invitrogen | KHC3011 | |
| Trypan blue solution 0.4% | Carl Roth GmbH + Co. KG (Karlsruhe, Germany) | 1680.1 |
Referanslar
- Othman, Z., Pastor, B. C., van Rijt, S., Habibovic, P. Understanding interactions between biomaterials and biological systems using proteomics. Biomaterials. 167, 191-204 (2018).
- Ikada, Y. Challenges in tissue engineering. J R Soc Interface. 3 (10), 589-601 (2006).
- Aamodt, J. M., Grainger, D. W. Extracellular matrix-based biomaterial scaffolds and the host response. Biomaterials. 86, 68-82 (2016).
- Batool, F., et al. Modulation of immune-inflammatory responses through surface modifications of biomaterials to promote bone healing and regeneration. J Tissue Eng. 12, 20417314211041428 (2021).
- Mantovani, A., Biswas, S. K., Galdiero, M. R., Sica, A., Locati, M. Macrophage plasticity and polarization in tissue repair and remodelling. J Pathol. 229 (2), 176-185 (2013).
- Shrivastava, R., Shukla, N. Attributes of alternatively activated (M2) macrophages. Life Sci. 224, 222-231 (2019).
- Gordon, S., Taylor, P. R. Monocyte and macrophage heterogeneity. Nat Rev Immunol. 5 (12), 953-964 (2005).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. 8 (12), 958-969 (2008).
- Murray, P. J., et al. Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity. 41 (1), 14-20 (2014).
- Kzhyshkowska, J., et al. Macrophage responses to implants: prospects for personalized medicine. J Leukoc Biol. 98 (6), 953-962 (2015).
- Browne, S., Pandit, A. Biomaterial-mediated modification of the local inflammatory environment. Front Bioeng Biotechnol. 3, 67 (2015).
- Piatnitskaia, S., et al. Modelling of macrophage responses to biomaterials in vitro: state-of-the-art and the need for the improvement. Front Immunol. 15, 1349461 (2024).
- Rayahin, J. E., Gemeinhart, R. A. Activation of macrophages in response to biomaterials. Results Probl Cell Differ. 62, 317-351 (2017).
- Murray, P. J. Macrophage polarization. Annu Rev Physiol. 79, 541-566 (2017).
- Gordon, S., Pluddemann, A. Tissue macrophages: heterogeneity and functions. BMC Biol. 15 (1), 53 (2017).
- Salma Iqbal, A. K. Characterization of in vitro generated human polarized macrophages. J Clin Cell Immunol. 6, 1-8 (2015).
- Hotchkiss, K. M., et al. Titanium surface characteristics, including topography and wettability, alter macrophage activation. Acta Biomater. 31, 425-434 (2016).
- Wang, Y., Zhang, Y., Sculean, A., Bosshardt, D. D., Miron, R. J. Macrophage behavior and interplay with gingival fibroblasts cultured on six commercially available titanium, zirconium, and titanium-zirconium dental implants. Clin Oral Investig. 23 (8), 3219-3227 (2019).
- Abaricia, J. O., Shah, A. H., Ruzga, M. N., Olivares-Navarrete, R. Surface characteristics on commercial dental implants differentially activate macrophages in vitro and in vivo. Clin Oral Implants Res. 32 (4), 487-497 (2021).
- Lu, W., et al. Improved osseointegration of strontium-modified titanium implants by regulating angiogenesis and macrophage polarization. Biomater Sci. 10 (9), 2198-2214 (2022).
- Murray, P. J., Wynn, T. A. Obstacles and opportunities for understanding macrophage polarization. J Leukoc Biol. 89 (4), 557-563 (2011).
- Nascimento, C. R., Fernandes, N. A. R., Maldonado, L. A. G., Junior, C. R. Comparison of monocytic cell lines U937 and THP-1 as macrophage models for in vitro studies. Biochem Biophys Rep. 32, 101383 (2022).
- Freytes, D. O., Kang, J. W., Marcos-Campos, I., Vunjak-Novakovic, G. Macrophages modulate the viability and growth of human mesenchymal stem cells. J Cell Biochem. 114 (1), 220-229 (2013).
- Zhang, Y., et al. Macrophage type modulates osteogenic differentiation of adipose tissue MSCs. Cell Tissue Res. 369 (2), 273-286 (2017).
- Cerqueira, A., et al. Evaluation of the inflammatory responses to sol-gel coatings with distinct biocompatibility levels. J Biomed Mater Res A. 109 (9), 1539-1548 (2021).
- Zhang, Y., Cheng, X., Jansen, J. A., Yang, F., van den Beucken, J. J. Titanium surfaces characteristics modulate macrophage polarization. Mater Sci Eng C Mater Biol Appl. 95, 143-151 (2019).
- Nobs, S. P., Kopf, M. Tissue-resident macrophages: guardians of organ homeostasis. Trends Immunol. 42 (6), 495-507 (2021).
- Sreejit, G., Fleetwood, A., Murphy, A., Nagareddy, P. Origins and diversity of macrophages in health and disease. Clin Transl Immunology. 9 (12), e1222 (2020).
- Parisi, L., et al. Preparation of human primary macrophages to study the polarization from monocyte-derived macrophages to pro-or anti-inflammatory macrophages at biomaterial interface in vitro. J Dent Sci. 18 (4), 1630-1637 (2023).
- Feuerer, N., et al. Macrophage retrieval from 3D biomaterials: A detailed comparison of common dissociation methods. J Immunol Regen Med. 11, 100035 (2021).
- Shapouri-Moghaddam, A., et al. Macrophage plasticity, polarization, and function in health and disease. J Cell Physiol. 233 (9), 6425-6440 (2018).
- Sridharan, R., Cameron, A. R., Kelly, D. J., Kearney, C. J., O'Brien, F. J. Biomaterial based modulation of macrophage polarization: a review and suggested design principles. Mater Today. 18 (6), 313-325 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır