Method Article
קיטוב ואפיון של מקרופאגים שמקורם במונוציטים אנושיים M1 ו-M2 על משטחי השתל
In This Article
Summary
כאן, אנו מציגים פרוטוקול מפורט להערכת הפוטנציאל החיסוני של משטחי שתלים במבחנה, במטרה לשפר את האמינות והשחזור של הפרוטוקולים הנוכחיים ולקדם מחקר נוסף. פרופילי ציטוקינים מפרישים, ביטוי mRNA וסמני פני התא נוטרו באמצעות מקרופאגים שמקורם במונוציטים בדם כדי לחקור קיטוב מקרופאגים המעובדים על טיטניום.
Abstract
תגובת גוף זר (FBR), תהליך ריפוי מורכב בתיווך מערכת החיסון, ממלאת תפקיד מכריע בשילוב שתלים בגוף. מקרופאגים, כקו הראשון של אינטראקציה של מערכת החיסון עם משטחי השתל, ממלאים תפקיד דו-כיווני בוויסות מאזן הדלקת-התחדשות. להבנה מעמיקה והערכה של התגובות בין חומרי השתל לתגובות החיסוניות, שיטות ופרוטוקולים אמינים במבחנה הם חיוניים. בין מודלים שונים במבחנה , מקרופאגים ראשוניים שמקורם במונוציטים (MDMs) מציגים מודל מצוין לחקירת אינטראקציות מקרופאגים-שתלים. יישמנו פרוטוקול ניסיוני להערכת הקיטוב של MDMs למקרופאגים M1 (מופעלים קלאסית) ו-M2 (מופעלים לחלופין) על משטחי השתל. בודדנו מונוציטים בדם מתורמים בריאים והבדלנו אותם למקרופאגים באמצעות גורם מגרה מושבת מקרופאגים (M-CSF). מקרופאגים מובחנים תורבבו על משטחי השתל וקוטבו לתת-סוגים M1 ו-M2. קיטוב M1 הושג בנוכחות אינטרפרון (IFN)-γ וליפופוליסכריד (LPS), בעוד שקיטוב M2 בוצע במדיום המכיל אינטרלוקין (IL)-4 ו-IL-13. הערכנו פנוטיפים של מקרופאגים על ידי בדיקת אימונוסורבנט מקושרת לאנזים (ELISA), מיקרוסקופ סריקת לייזר קונפוקלי (CLSM) ו-PCR כמותי בזמן אמת (qRT-PCR) על סמך פאנלים של ציטוקינים מופרשים, סמני פני התא וגנים מבוטאים. ה-RNA המופק הפך ל-DNA משלים (cDNA), ו-qRT-PCR שימש לכימות mRNA הקשור למקרופאגים M1 ו-M2. בהתאם לכך, מקרופאגים M1 אופיינו בביטוי גבוה יותר של ציטוקין גורם נמק גידול פרו-דלקתי (TNF-α) וסמן פני השטח CCR7 בהשוואה למקרופאגים M2, שהפגינו רמות גבוהות יותר של CD209 ו-CCL13. כתוצאה מכך, CCR7 ו-CD209 זוהו כסמנים ספציפיים ואמינים של תת-סוגים של מקרופאגים M1 ו-M2 על ידי צביעה חיסונית והדמיה על ידי CLSM. אישור נוסף הושג על ידי ELISA שזיהתה רמת TNF-ɑ מוגברת ב-M1 ועלייה ב-CCL13 בתאי M2. ניתן להשתמש ביעילות בסמנים המוצעים ובמערך הניסוי כדי להעריך את הפוטנציאל החיסוני של שתלים.
Introduction
ביו-חומרים מושתלים הפכו לפתרון קונבנציונלי למחלות אנושיות שונות וממלאים תפקיד גדול במחקר ביו-רפואי, כולל הנדסת רקמות, מערכות אספקת תרופות ושתלים 1,2. קיים מגוון רחב של שתלים העשויים מחומרים שונים בעלי מבנים ופונקציות שונות, כגון תותבות ירך, סטנטים, רשתות, מסתמי לב או שתלים דנטליים. עם ההשתלה, מגע הרקמה-שתל מעורר תגובה חיסונית, ואחריה רזולוציה, שיפוץ רקמות והומאוסטזיס. תהליכים אלה מושפעים מהמאפיינים הפיזיקליים, הכימיים והביו-אקטיביים של הביו-חומרים שבהם משתמשים. מאפיינים אלה עשויים להשפיע על העוצמה והספקטרום של תגובות פרו-דלקתיות ואנטי דלקתיות, היווצרות קפסולה פיברוטית, פירוק רקמות וריפוי שלב 3,4. על מנת לתמוך ולייעל את תהליך הריפוי ושילוב השתלים לטווח ארוך, היבט מתפתח אחד של המחקר הנוכחי הוא לחקור ולתווך את האינטראקציה בין משטחי השתל לתאי החיסון.
בין שאר תאי החיסון, מקרופאגים, הנמצאים בכל הגוף, הם שחקני מפתח בדלקת ובהגנה אנטי-פתוגנית, כמו גם בתהליכי ריפוי ושמירה על הומאוסטזיס רקמות 5,6. בהתבסס על הפלסטיות שלהם והגירויים המיקרו-סביבתיים של הרקמה המקומית, מקרופאגים מסוגלים לקטב לפנוטיפים פונקציונליים מובחנים, המציגים הבדלים גדולים בחילוף החומרים של התאים, בתפקודי התאים ובפרופילי הפרשת הציטוקינים. ניתן להבחין בפנוטיפ M1 המופעל באופן קלאסי על ידי הפרשת ציטוקינים פרו-דלקתיים, כגון IL-1β, IL-6 ו-TNF-α, והוא מעורב בתגובה הדלקתית הראשונית והכרונית לטראומה וביו-חומרים זרים. לעומת זאת, לחלופין, למקרופאגים M2 מופעלים, המופעלים על ידי ציטוקינים כמו IL-4 ו-IL-13, יש מאפיינים אופייניים כמו רזולוציה של דלקת וקידום ריפוי רקמות. ניתן לזהות מקרופאגים מקוטבים M2 על ידי ביטוי של סמני פני התא כגון CD206 וייצור ציטוקינים כמו IL-10 ו-IL-47. באופן דומה, מקרופאגים שכבר היו מקוטבים יכולים לתכנת את עצמם מחדש במיקרו-סביבה חדשה.
מחקרים רבים על אינטראקציות תא-ביו-חומרים הראו את חשיבותם של מקרופאגים במפל התגובות האימונולוגיות כלפי ביו-חומרים מושתלים ובתזמור תהליכים המעורבים בריפוי סיבוכים הקשורים לשתלים 8,9,10. למרות שההנדסה הביו-רפואית עשתה התקדמות משמעותית בשנים האחרונות, יש צורך במחקר נוסף כדי להבין כיצד שתלים מווסתים את התנהגות המקרופאגים ואת הקיטוב 11,12,13.
בתרבית תאים, ניתן להתמיין לתאים חד-גרעיניים בדם היקפי שמקורם במונוציטים למקרופאגים M0 דבקים ואחריהם קיטוב מושרה כלפי פנוטיפים M1 או M2 באמצעות LPS ו-IFN-γ או IL-4, בהתאמה. לאחר דגירה במבחנה עם דגימות ביו-חומרים חדשות, ניתן לנצל את הקולטנים השונים של פני התא ופרופילי הציטוקינים של מקרופאגים M1 ו-M2 כדי לזהות את הפוטנציאל האימונומודולטורי של ביו-חומרים במבחנה14,15. מחקר זה נועד לפתח פרוטוקול מבחנה שניתן להשתמש בו כדי לחקור את הקיטוב של MDMs בתגובה למשטחי שתלים שונים. ניתן להשתמש בניתוחי ביטוי גנים, טכניקות מיקרוסקופיה ו-ELISA כדי לקבוע את הסמנים הפנוטיפיים ופרופילי הציטוקינים הספציפיים של מקרופאגים M1 ו-M2 המווסתים על ידי החומר הביולוגי. לפיכך, ניתן להבהיר את האינטראקציות המורכבות בין מקרופאגים למשטחי ביו-חומר, וניתן לקבל מידע רב ערך כדי להבין טוב יותר אינטראקציות מקרופאגים-ביו-חומרים. לבסוף, פרוטוקול מבחנה סטנדרטי מבטיח שחזור, אמינות והשוואה של תוצאות הניסוי על ידי מזעור השונות במערך הניסוי.
Protocol
דם היקפי אנושי התקבל מתורמי דם בריאים בהתאם לפרוטוקול שאושר על ידי ועדת האתיקה של הפקולטה לרפואה באוניברסיטת טובינגן (אישור אתי: 286/2021 BO). PBMCs אנושיים בודדו באמצעות צנטריפוגה של שיפוע צפיפות, כפי שתואר קודם לכן16. הפרוטוקול הבא מתואר עבור PBMCs שבודדו מ-24 מ"ל דם. ייצוג סכמטי של הפרוטוקול מוצג באיור 1.
הערה: יש לכוונן את נפח הדם בהתאם למספר המקרופאגים M0 המשמשים.
בסך הכל התקבלו 35.46 ±-9.1 מיליון PBMCs מ-24 מ"ל דם, וכתוצאה מכך 1.97 ±-0.46 מיליון מקרופאגים M0 (n = 5). כל הריאגנטים, החומרים המתכלים וההתקנים מפורטים בטבלת החומרים. המאגרים מפורטים בטבלה 1.
1. התמיינות של מונוציטים בדם אנושי למקרופאגים
- השעו מחדש את ה-PBMCs המבודדים ב-15 מ"ל של מדיום חיבור מונוציטים מחומם מראש והעבירו אותם לבקבוק תרבית תאים T75 אחד.
- דגרו את התאים בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 למשך 90 דקות כדי לאפשר הידבקות.
- השליכו את הסופרנטנט ושטפו את התאים פעם אחת עם מדיום שלם שחומם מראש עם הטיה עדינה להסרת תאים שאינם נדבקים או דבוקים באופן רופף.
הערה: התאים המחוברים הם מונוציטים, המהווים כ-10% מסך ה-PBMCs שנוספו במקור לבקבוק. - יש להוסיף 15 מ"ל של מדיום שלם המכיל 10 ננוגרם/מ"ל גורם מגרה מושבת מקרופאגים (M-CSF) לתאים הדבקים ולדגור במשך 6 ימים כדי לקדם התמיינות.
- החלף את המדיום במדיום טרי ושלם המכיל 10 ננוגרם/מ"ל M-CSF כל יומיים.
2. טיפוח וקיטוב של MDMs על פני שתל הטיטניום
הערה: ביום השישי של ההתמיינות, מקרופאגים M0 נזרעו על משטחי הביו-חומר עם גירויים שונים במשך 48 שעות כדי להשיג מקרופאגים M1 או M2 מקוטבים לחלוטין. עבור כל משטח שנבדק, נעשה שימוש בשלושה דיסקים כדי לזרוע מקרופאגים M0, M1 ו-M2. כיסויי פלסטיק שטופלו בתרבית תאים שימשו כמשטחי בקרה.
- הסר את מדיום התרבות מצלוחיות T75 ושטוף את התאים עם 10 מ"ל PBS למשך 5 דקות.
- נתק תאים דבקים על ידי דגירה שלהם עם 10 מ"ל של תמיסת ניתוק תאים מחוממת מראש למשך 30 דקות.
- הקש בעדינות על התאים והעביר אותם לצינור של 50 מ"ל. נתק את התאים הנותרים על ידי גירוד עדין ב -10 מ"ל PBS.
- העבירו את התאים המנותקים לצינור של 50 מ"ל וצנטריפוגה אותם בטמפרטורה של 300 x גרם למשך 10 דקות.
- השליכו את הסופרנטנט והשעו מחדש את התאים ב-5 מ"ל של מדיום שלם שחומם מראש.
- ספרו את התאים באמצעות צביעה כחולה טריפן והמוציטומטר כדי לקבוע את מספר התאים ואת כדאיותם.
- הכן את תרחיף התאים על ידי התאמת מספר התא ל -160,000 תאים לכל 1 מ"ל של מדיום שלם.
- נקה את דיסקי הביו-חומר באופן קולי ב-70% אתנול למשך 5 דקות, ולאחר מכן עיקור ב-70% אתנול למשך 30 דקות.
- יבש את דיסקי הטיטניום למשך 1-2 שעות, ואז הניח אותם בצלחות 24 בארות לא מטופלות והוסף 1 מ"ל של תרחיף תאים מוכן לכל באר.
- כדי להשיג מקרופאגים מקוטבים M1, הוסף IFN-γ ו-LPS בריכוז של 50 ננוגרם/מ"ל ו-10 ננוגרם/מ"ל, בהתאמה. לקיטוב M2, הוסף IL-4 ו-IL-13 בריכוז של 20 ננוגרם/מ"ל כל אחד. ודא שתאי M0 גדלים ללא חומרי קיטוב. דגרו על התאים למשך 48 שעות נוספות בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 כדי לגרום לקיטוב.
3. אפיון מקרופאגים מקוטבים באמצעות ELISA
הערה: ביום השני של הקיטוב, הוכנו דגימות לניתוחי אפיון. ציטוקין TNF-ɑ וכימוקין CCL13 נמדדו כדי לאפיין מקרופאגים מקוטבים M1 ו-M2, בהתאמה. ריכוז החלבונים המופרשים נורמל לריכוז הכולל של חלבונים מופרשים בסופרנטנט המתאים.
- אוספים את הסופרנטנט בצינור של 1.5 מ"ל וצנטריפוגה ב-300 x גרם למשך 5 דקות. העבירו את הסופרנטנט לצינור חדש.
- העבירו את הדיסקים לצלחת חדשה של 24 בארות לניסויים נוספים. המטרה היא לחסל תאים מתים או מחוברים באופן רופף בצלחות 24 בארות שאינן מטופלות.
הערה: יש לאמת את כדאיות התא על פני משטחים לפני ביצוע ניתוח כלשהו. ניתן לקבוע את הכדאיות של תאים על ידי מבחני כדאיות של תאים חיים/מתים או בעקיפין באמצעות בדיקות התפשטות תאים וציטוטוקסיות. - מדוד את הציטוקינים והכימוקינים על פי ההוראות הספציפיות שסופקו על ידי היצרן. מדוד את הציטוקינים באופן מיידי או אחסן את הדגימות בטמפרטורה של -80 מעלות צלזיוס למדידה עתידית.
הערה: עבור כל סוג של ערכה (בהתחשב במגבלות הרגישות והזיהוי של ערכת ELISA), יש לקבוע דילול דגימה מתאים. עבור בדיקת חומצה ביסינצ'ונינית (BCA), הדגימות דוללו ביחס של 1:5. דגימות M1 עבור TNF-ɑ דוללו ב-1:10, ודגימות M2 עבור CCL13 דוללו ב-1:12. - חשב את ריכוז הציטוקינים/כימוקינים המופרשים באמצעות העקומה הסטנדרטית בהתאם להוראות היצרן.
- מדוד את כמות החלבון הכוללת באמצעות ערכת בדיקת חלבון BCA.
- לנרמל את ריכוז החלבונים המופרשים למ"ג חלבון כולל.
4. אפיון מקרופאגים מקוטבים באמצעות CLSM
הערה: מקרופאגים מקוטבים אופיינו עוד יותר על ידי צביעתם בנוגדנים לסמני פני השטח של תאי CD209 ו-CCR7. הגרעינים הוכתמו ב-DRAQ5. CD68 או סמנים אחרים יכולים לשמש כסמני פאן-מקרופאגים.
- שוטפים את התאים פי 2 ב 800 מיקרוליטר של PBS. דגרו את הדיסקים למשך 20 דקות בטמפרטורת החדר (RT) ב-400 מיקרוליטר של מאגר קיבוע.
- לאחר הסרת מאגר הקיבוע, יש לשטוף שלוש פעמים ב -400 מיקרוליטר PBS. מכתים את הדגימות מיד או מאחסנים ב-4 מעלות צלזיוס ב-1 מ"ל של מאגר אחסון.
הערה: עם פרוטוקול קיבוע ואחסון זה, הדגימות הוכתמו בהצלחה וצולמו תוך 1-6 שבועות מרגע הקיבוע. - לפני השלב הבא, שטפו את הדיסקים פעמיים עם 800 מיקרוליטר PBS לאחר האחסון.
- דגירה של דיסקים עם 400 מיקרוליטר של מאגר חוסם למשך 30 דקות ב-RT כדי לחסום את אתרי הקישור הלא ספציפיים.
- השליכו את המאגר החוסם ודגרו את הדיסקים ב-RT למשך שעה אחת עם נוגדנים ראשוניים מדוללים ב-400 מיקרוליטר של מאגר מכתים.
- בצע הליך אימונופלואורסצנטי באמצעות צביעה כפולה כדי לבחון את הביטוי של CCR7 ו-CD209 בדגימה אחת. לשם כך יש לשלב נוגדנים ראשוניים הגדלים ממינים שונים (עכבר וארנב) באותו שלב צביעה.
הערה: כדי להשיג אות חזק עם רקע מינימלי, מטב את ריכוז הנוגדנים. נוגדן CCR7 שימש בריכוז סופי של 10 מיקרוגרם/מ"ל, ונוגדני CD209 דולל ב-1/400.
- בצע הליך אימונופלואורסצנטי באמצעות צביעה כפולה כדי לבחון את הביטוי של CCR7 ו-CD209 בדגימה אחת. לשם כך יש לשלב נוגדנים ראשוניים הגדלים ממינים שונים (עכבר וארנב) באותו שלב צביעה.
- הסר את הנוגדנים העיקריים ושטוף פי 3 עם 400 מיקרוליטר של מאגר כביסה.
- הוסף נוגדנים משניים עם תווית פלואורופור מדולל במאגר צביעה ודגירה למשך שעה ב-RT בחושך.
הערה: יש לייעל את ריכוז הנוגדנים המשניים כדי להשיג אותות ספציפיים מקסימליים עם רקע מינימלי. במחקר זה נעשה שימוש בנוגדנים משניים בריכוז של 5 מיקרוגרם/מ"ל לצביעה. - לאחר הסרת הסופרנטנט, שטפו את הדגימות שלוש פעמים במאגר הכביסה למשך 3 דקות כל אחת.
- הוסף 10 μM DRAQ5 ב-PBS ודגירה למשך 15 דקות ב-RT, מוגן מפני אור.
- הסר את ה-supernatant ושטוף את הדיסקים פעם אחת ב-PBS.
- הסר את ה-PBS הנותר והוסף טיפה אחת של אמצעי הרכבה.
- לאחר 5 דקות יש למרוח את כוסות הכיסוי ולתת לדגימות להתייבש למשך שעה.
- לאחר ייבוש הדגימות, אטמו את הקצוות עם לק שקוף ואחסנו אותם בטמפרטורה של 4 מעלות צלזיוס בחושך עד להדמיה.
- כדי לקבל סקירה כללית של תאים, דמיין את הדגימות בהגדלה של פי 25. כדי לקבוע עוד יותר את המבנה והלוקליזציה של סמני פני השטח, רכוש תמונות בהגדלה של פי 63.
- כמת את עוצמת הקרינה של CCR7 ו-CD209 באמצעות תוכנת ImageJ.
הערה: רכישת התמונה בוצעה עם מכפיל פוטו (PMT) באמצעות מערכת CLSM, שהייתה מצוידת בלייזר ארגון (488 ננומטר), לייזר DPSS (561 ננומטר) ולייזר HeNe (633 ננומטר).
5. אפיון מקרופאגים מקוטבים באמצעות qRT-PCR
הערה: לבידוד RNA, נעשה שימוש בשני דיסקים לכל דגימה על מנת להשיג מספיק RNA לסינתזת cDNA.
- שטפו את הדיסקים פעמיים עם 800 מיקרוליטר PBS.
- הוסף 350 מיקרוליטר של מאגר ליזה לדיסק הראשון ולייז את התאים על ידי פיפטינג למעלה ולמטה.
- העבירו את הליזאט לדיסק השני וחזרו על תהליך הליזינג.
- הוסף 350 מיקרוליטר של 70% אתנול לליזאט ופיפטה למעלה ולמטה עד לקבלת תערובת אחידה.
- העבר את הליזט לעמודת הסיבוב ופעל לפי הוראות היצרן לבידוד RNA.
- כמת את כמות ה-RNA באמצעות ננו-טיפה או מכשיר אחר.
- לנרמל את ריכוזי ה-RNA עבור דגימות שונות ולסנתז cDNA לפי הוראות היצרן באמצעות מערכת RT-PCR לסינתזת cDNA של גדיל ראשון.
- סנתז את ה-cDNA באמצעות 350 ננוגרם של RNA בהתאם לפרוטוקול היצרן ואחסן אותו ב-20 מעלות צלזיוס עד לביצוע ניתוח qRT-PCR.
הערה: כאן, 350 ננוגרם של RNA מטוהר שימש לסינתזה של cDNA באמצעות 4 מיקרוליטר של RT Mix (5x) ב-20 מיקרוליטר. - בצע qRT-PCR במערכת PCR בזמן אמת בלוחות של 96 בארות ותגובות בודדות של 15 מיקרוליטר (1x תערובת מאסטר ירוקה של Syber, 0.2 מיקרומטר של פריימרים קדימה ואחורה, ו-4.5 מיקרוליטר של cDNA מדולל 1:10).
הערה: תוכנית ה-PCR מתחילה במכסה מחומם (105 מעלות צלזיוס) ואחריו שלושה שלבים: דנטורציה ראשונית ב-95 מעלות צלזיוס למשך 3 דקות, ואחריה 15 שניות ב-95 מעלות צלזיוס, ו-30 שניות ב-55 מעלות צלזיוס למשך 40 מחזורים. - לנרמל את רמות הביטוי של גנים שונים לגן משק הבית GAPDH (או גנים אחרים של משק בית כמו β-אקטין).
- חשב את ביטוי הגנים היחסי בשיטת 2−ΔΔCt על ידי לקיחת תאי M0 שגודלו על כיסויי תרבית רקמה כהפניה. טבלה 2 מפרטת את כל הפריימרים ששימשו במחקר זה.
6. ניתוח סטטיסטי
- הצג את כל הנתונים כממוצע ± SEM. חזור על כל הבדיקות (במחקר זה, הבדיקות חזרו על עצמן חמש פעמים) כדי להבטיח שחזור. העריכו את ההבדלים המובהקים סטטיסטית בין נתונים המופצים בדרך כלל באמצעות ניתוח שונות חד-כיווני (ANOVA) ואחריו מבחן הריבוי של טוקי.
- השתמש במבחן פרידמן ובמבחן ההשוואה המרובה של דאן כדי לנתח מערכי נתונים לא פרמטריים. השתמש בתוכנת ניתוח נתונים מתאימה כדי לנתח את הנתונים ולהגדיר מובהקות סטטיסטית כערך p של פחות מ-0.05.
תוצאות
תוצאות מחקר זה מדגימות התמיינות וקיטוב מוצלחים של MDMs על משטחי טיטניום, ואחריהם אפיון של מקרופאגים מקוטבים M1 או M2. בשלב הראשון, אפיינו MDMs מקוטבים באמצעות CLSM. בהתבסס על המחקרים הראשוניים שלנו, CD209 ו-CCR7 שימשו כסמנים ספציפיים להבדיל בין M1 ל-MDM מקוטב M2. כפי שמוצג באיור 2A,B, MDMs מקוטבים בהצלחה למקרופאגים M1 ו-M2. על פני השטח של הטיטניום, CCR7 התבטא בצורה חזקה יותר במקרופאגים מקוטבים M1 מאשר CD209, שהתבטא במיוחד במקרופאגים מקוטבים M2. יתר על כן, כימות עוצמת הקרינה היחסית הקל על הקצאת סמנים לתת-סוגים M1 או M2 (איור 2C).
איור 3 מציג ניתוח מייצג של qRT-PCR של MDMs על משטחי טיטניום וכיסוי. התוצאות הראו כי MDMs בשני המשטחים היו מקוטבים בהצלחה, כפי שהודגם על ידי ביטוי גבוה של סמני הקיטוב M1 (CCR7 ו-TNF-ɑ) ו-M2 (CD209 ו-CCL13). זה אושר עוד יותר ברמת החלבון על ידי התבוננות ברמות גבוהות של ציטוקינים דלקתיים TNF-α (איור 4A) וכימוקינים IL-13 (איור 4B) בתאים מקוטבים M1 ו-M2, בהתאמה.
איור 1: ייצוג סכמטי של הפרוטוקול. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: אפיון MDMs מקוטבים באמצעות CLSM. העשרה של מקרופאגים מקוטבים M1 ו-M2 אושרה על ידי צביעת נוגדנים ספציפיים וניתוח CLSM באמצעות נוגדנים CCR7 ו-CD209 ביום השני לאחר הזריעה. על פי צביעה פלואורסצנטית וניתוח CLSM, (A) הגדלה של פי 25 ו-(B) הגדלה של פי 63, תאי M1 ביטאו CCR7 גבוה יותר (בירוק) מאשר M0 או M2. תאי M2 מציגים דפוס ביטוי CD209 משמעותי (בירוק). (ג) הניתוח הכמותי של עוצמת הקרינה היחסית של CCR7 ו-CD209. הגרעינים נצבעו ב-DRAQ5 (בסגול). התוצאות מייצגות 5 ניסויים דומים שבוצעו באופן עצמאי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: אפיון MDMs מקוטבים באמצעות פרופילי ביטוי גנים. פולימראז שעתוק הפוך כמותי שימש לחקר רמות ה-mRNA של גנים שונים הקשורים לקיטוב M1 (CCR7 ו-TNF-ɑ) ו-M2 (CD209 ו-CCL13). GAPDH שימש כגן משק בית. הנתונים מוצגים כממוצע ± SEM (n = 5). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
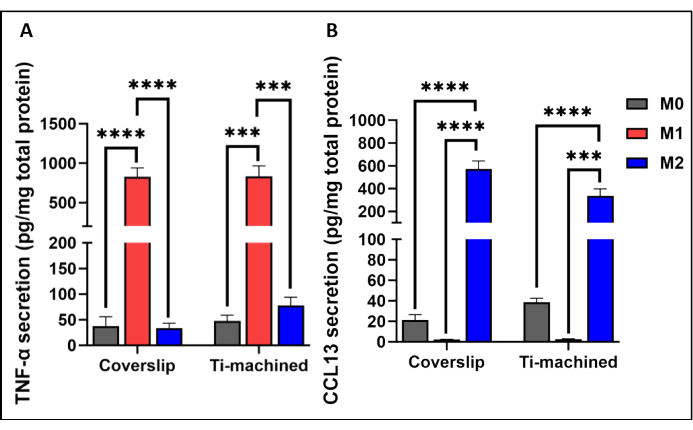
איור 4: ייצור ציטוקינים על ידי מקרופאגים M0, M1 ו-M2 שגודלו על כיסויי טיטניום ופלסטיק. (A) רמת ציטוקינים TNF-ɑ ו-(B) רמות CCL13 בסופרנטנטים של תרבית תאים נמדדו באמצעות ELISA. הפרשת הציטוקינים נורמלה להפרשת חלבון כוללת שנמדדה על ידי בדיקת BCA. גרפי עמודות מייצגים ממוצע ± SEM (n = 5). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| מאגר/פתרון | תוכן |
| מאגר צביעה/חסימה | PBS + 1% BSA + 0.1% טווין 20 |
| מאגר כביסה | PBS + 0.1% טווין 20 |
| מאגר קיבוע | 3% של פרפורמלדהיד (PFA) ב-PBS |
| מאגר אחסון | 1% של פניצילין וסטרפטומיצין ב-PBS |
טבלה 1: רשימת מאגרים.
| שם פריימר | רצפי פריימר קדימה | רצפי פריימר הפוכים |
| GAPDH | 5'-GAGTCAACGGATTTTTTCGT-3' | 5'-TTGATTTTGGAGGGATCTCG-3' |
| CCR7 | 5'- TGGTGATCGGCTCTCTGGTC-3' | 5'- CACCTTGATGGCCTTGTTGC-3' |
| תקליטור 209 | 5'- GGAGCAGAACTTCCTACAGC-3' | 5'- CAACGTTGTTGGGCTCTCCT-3' |
| CCL13 | 5'-ATCTCCTTGCAGAGGCTGAA-3' | 5'-ACTTCTCCTTTGGGTCAGCA-3' |
| TNF-ɑ | 5'- GCTGCACTTTGGAGTGATCG-3' | 5'- TCACTCGGGGTTCGAGAAGA-3' |
טבלה 2. רצפי פריימרים המשמשים ב-qRT-PCR.
Discussion
הבנה מעמיקה של התנהגות המקרופאגים חיונית להבנת התכונות האימונומודולטוריות של חומרים מושתלים. מספר מחקרים דיווחו על סמנים הטרוגניים, מגוון מודלים של תאים ופרוטוקולים לאפיון קיטוב מקרופאגים במבחנה 17,18,19,20. כדי לשפר את יכולת השחזור, האמינות וההשוואה של תוצאות הניסוי, פרוטוקולים סטנדרטיים ומאומתים, יחד עם מודל תאים מתאים וסמני אפיון קונצנזוס, הם חיוניים. בהתאם לכך, סימולציה מדויקת של התכונות האימונומודולטוריות של חומרי השתל דורשת תחילה מודל תא מתאים. מחקרים שונים השתמשו במגוון רחב של מודלים של תאים, כגון מקרופאגים מבודדים של רקמות, מקרופאגים מובחנים שמקורם במונוציטים בדם וקווי תאים מונוציטים אימורטליים. למרות שמקרופאגים מבודדים ברקמות עשויים להיחשב מייצגים יותר של תנאי in vivo, הם מאתגרים מבחינה טכנית ואתית21,22. מקרופאגים מתקבלים לעתים קרובות גם משורות תאים מונוציטיים אימורטליים מבוססים, כגון תאי THP1 23,24,25,26. בעוד שתאים אלה עשויים להציע הומוגניות רבה יותר בתגובת התאים כמקור בלתי מוגבל לתאים שאינם מזדקנים, הם מתקבלים בדרך כלל מחולים עם ניאופלזמות המטולוגיות, ותגובותיהם עשויות להיות שונות באופן משמעותי מתאים רגילים. תאי THP1 מונוציטים, למשל, דווחו כמגיבים יותר לסימולטורים של M1 וסביר יותר להפגין מאפייני M122. תוצאות מחקר זה תואמות את תוצאות המחקר הראשוני שלנו (נתונים שאינם מוצגים כאן).
יתר על כן, מכיוון שמונוציטים שמקורם בדם נחשבים לקודמנים של מקרופאגים השוכנים ברקמות וניתן להשיג אותם בקלות בתפוקות גבוהות יותר, הם עשויים להוות חלופה ריאלית למקרופאגים 27,28,29. בהתבסס על המחקר שלנו באמצעות מקרופאגים שמקורם במונוציטים בדם, מצאנו שתאים אלה הגיבו באותה מידה לממריצים M1 ו-M2 הן על טיטניום והן על כיסויים שטופלו בתרבית תאים. בנוסף, הם הציגו מספר סמני קונצנזוס M1 ו-M2, שחלקם מוצגים בתוצאות המייצגות. התוצאות הראו כי ניתן להשתמש ב-MDM כמודל מבחנה אפשרי להדמיית אינטראקציות שתל-מקרופאגים.
להתקדמות נוספת במחקרי אימונומודולציה, סמני אפיון קבועים וספציפיים חיוניים. מחקרים הציגו מגוון סמנים לאפיון מקרופאגים הנבדלים לא רק בין מקרופאגים ממקורות שונים אלא גם בין מקרופאגים מאותו מקור 17,18,19,24. פאנל של סמני M1 ו-M2 האופייניים ל-MDM נקבע ואומת באמצעות הערכה של סמנים מדווחים שונים. כמה מסמני המפתח החשובים ביותר מוצגים במאמר זה.
קביעת שיטות הזיהוי המתאימות ביותר היא גם חלק מכריע בתהליך ההערכה. טכניקות ניתוח המשמשות בדרך כלל להערכת סמני פני התא דורשות בדרך כלל הסרת תאים מביו-חומרים. עם זאת, תהליך זה נצפה כמשפיע לרעה על התאים על ידי פגיעה בסמני פני השטח שלהם וכתוצאה מכך מספר נמוך של תאים מנותקים30. כתוצאה מכך, ציטומטריית זרימה, הדורשת ניתוק תאים, אינה מתאימה להערכת מקרופאגים המחוברים היטב לשתלים. במחקר זה, זיהוי סמני פני התא בוצע באמצעות CLSM. על ידי שימוש בסמנים המתאימים ואופטימיזציה של תהליך הצביעה, הצלחנו לאפיין בהצלחה תת-סוגים M1 ו-M2 בהשוואה זה לזה ולתאי M0. חשוב לציין כי צביעה פלואורסצנטית היא חצי כמותית, וזו אחת ממגבלותיה. זה יכול לסבך את הערכת התאים באמצעות סמנים המתבטאים בכל תת-הסוגים ללא הבדלים משמעותיים. CCR7 ו-CD209 נבחרו לאחר בדיקת סמנים שונים לאפיון ה-MDM באמצעות CLSM. CCR7 ו-CD209 התבטאו באופן עקבי בתת-סוגים M1 ו-M2, בהתאמה.
במסגרת מגבלות מחקר זה, התוצאות מדגישות את התועלת והיעילות של פרוטוקולים מיושמים בקיטוב מקרופאגים על משטחי השתל ואפיונם המדויק במונחים של ביטוי גנים, חלבונים מופרשים וסמני פני התא. בנוסף, ניתוח הסמנים שתוארו חשף דפוסי ביטוי עקביים וספציפיים שניתן להשתמש בהם כדי להבחין בין תת-סוגים שונים של MDM. עם זאת, מודל זה במבחנה אינו משקף באופן מלא את המגוון הפנוטיפי והפלסטיות של מקרופאגים אנושיים. מספר תת-סוגים של מקרופאגים (M2a, M2b, M2c, M2d) מזוהים כעת, מה שמעיד על צורך במודלים מגוונים יותר במבחנה כדי לחקור כיצד ביו-חומרים שונים ומאפייניהם (למשל, תכונות פיזיקוכימיות) משפיעים על הפלסטיות והקיטוב של המקרופאגים31,32. למרות שלא ניתן לשקף את המצב המורכב in vivo באמצעות מודלים במבחנה, ניתן להשיג תוצאות רבות באמצעות פרוטוקול in vitro המוצג כדי לתאר ביעילות את הפוטנציאל האימונומודולטורי של ביו-חומרים מושתלים חדשים9. אחרון חביב, יש צורך בהקמה נוספת כדי לאפיין מקרופאגים במודלים מורכבים יותר במבחנה או in vivo הכוללים את תפקידם של שחקנים אחרים בהקשרים פיזיולוגיים מורכבים. בסך הכל, מחקר זה יתרום לפיתוח ועיצוב של ביו-חומרים אימונומודולטוריים כדי לשפר ולקדם תהליכי התחדשות רקמות חיוביים ושילוב שתלים מוצלח, כמו גם למניעת דלקת כרונית הקשורה לשתלים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
הדיסקים סופקו באדיבות על ידי Medentis Medical, Bad-Neuenahr-Ahrweiler, גרמניה. המחברים מודים על התמיכה של המחלקה לכירורגיית פה ולסתות (בית החולים האוניברסיטאי טובינגן).
Materials
| Name | Company | Catalog Number | Comments |
| 24-well plate, not-treated | Corning Incorporated (Kennebunk, USA) | 144530 | |
| Absorbance reader Infinite F50 | TECAN Austria GmbH (Grödig, Austria) | TCAT91000001 | |
| Accutase in DPBS, 0.5 mM EDTA | EMD Millipore Corp. (Burlington, USA) | SCR005 | |
| Anti-Fade Fluorescence Mounting Medium -Aqueous, Fluoroshield | abcam (Cambridge, UK) | ab104135 | |
| Bio-Rad MJ Research PTC-200 Peltier Thermal Cycler | Bio-Rad / MJ Research | 7212 | |
| Bovine serum albumin (BSA) | VWR International bvba (Leuven, Belgium) | 422361V | |
| Centrifuge 5804 R | Eppendorf SE (Hamburg, Germany) | 5804 R | |
| DC-SIGN (D7F5C) XP Rabbit mAb | Cell Signaling Technology | 13193 | |
| Dimethyl sulfoxide | Sigma Aldrich Co. (St.Louis, MO, USA) | D2438-5X10ML | |
| DRAQ5 Staining Solution | Milteny Biotec (Bergisch Gladbach, Germany) | 130-117-344 | |
| Ethanol ≥99.8% for molecularbiology | Carl Roth GmbH + CO. KG (Karlsruhe, Germany) | 1HPH.1 | |
| Goat Anti-Mouse IgG (H&L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | Invitrogen | A32723TR | |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Cyanine3 | Invitrogen | A10520 | |
| GraphPad Prism | GraphPad | Version 9.4.1 | |
| Human CCR7 Antibody | R&D Systems | MAB197 | |
| Human IFN-gamma Recombinant | Invitrogen (Rockford, USA) | RIFNG100 | |
| Human IL-13 | Milteny Biotec (Bergisch Gladbach, Germany) | 5230901032 | |
| Human IL-4 | Milteny Biotec (Bergisch Gladbach, Germany) | 130-095-373 | |
| Human M-CSF | Peprotech (Cranbury, USA) | 300-25 | |
| Leica TCS SP5 | Leica Microsystems CMS GmbH (Mannheim, Germany) | https://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp5/ | |
| Lipopolysaccharides from Escherichia | Sigma Aldrich Co. (Missouri, USA) | L4391-1MG | |
| Luna Universal qPCR Master Mix | New England Biolabs | NEB #M3003 | |
| LunaScript RT SuperMix Kit | New England Biolabs | E3010L | |
| Lymphocyte Separation Medium 1077 | PromoCell (Heidelberg, Germany) | C-44010 | |
| MCP-4/CCL13 Human ELISA Kit | Invitrogen | EHCCL13 | |
| MicroAmp Fast 96-Well Reaction Plate (0.1 mL) | Applied Biosystems (Waltham, USA) | 4346907 | |
| MicroAmp Optical Adhesive Film | Life Technologies Corporation (Carlsbad, USA) | 4311971 | |
| MicroAmp Splash Free 96-Well Base | Applied Biosystems (Waltham, USA) | 4312063 | |
| Microlitercentrifuge CD-3124R | Phoenix Instrument (Germany) | 9013111121 | |
| Microscope Cover Glasses, 10 mm | Carl Roth GmbH, Karlsruhe, Germany | 4HX4.1 | |
| Monocyte Attachment Medium | PromoCell (Heidelberg, Germany) | C-28051 | |
| Multiply-Pro Gefäß 0.5 mL, PP | Sarstedt AG & CO (Nümbrecht, Germany) | 7,27,35,100 | |
| Nanodrop One | Thermo Scientific (USA) | ND-ONE-W | |
| QuantStudio 3 System | Life Technologies GmbH (St. Leon-Rot, Germany) | A28567 | |
| RNeasy Micro Kit | Qiagen | 74007 | |
| RPMI 1640, 1x, with L-glutamine | Mediatech, Inc. (Manassas, USA) | 10-040-CV | |
| Sterile bench, LaminarAir HB 2472 | Heraeus instruments (Hanau, Germany) | 51012197 | |
| Tissue Culture Coverslips 13 mm (Plastic) | Sarstedt Inc. (Newton, USA) | 83,18,40,002 | |
| Titanium machinied discs 12 cm | Medentis Medical (Bad-Neuenahr-Ahrweiler, Germany) | N/A | |
| TNF alpha Human ELISA Kit | Invitrogen | KHC3011 | |
| Trypan blue solution 0.4% | Carl Roth GmbH + Co. KG (Karlsruhe, Germany) | 1680.1 |
References
- Othman, Z., Pastor, B. C., van Rijt, S., Habibovic, P. Understanding interactions between biomaterials and biological systems using proteomics. Biomaterials. 167, 191-204 (2018).
- Ikada, Y. Challenges in tissue engineering. J R Soc Interface. 3 (10), 589-601 (2006).
- Aamodt, J. M., Grainger, D. W. Extracellular matrix-based biomaterial scaffolds and the host response. Biomaterials. 86, 68-82 (2016).
- Batool, F., et al. Modulation of immune-inflammatory responses through surface modifications of biomaterials to promote bone healing and regeneration. J Tissue Eng. 12, 20417314211041428 (2021).
- Mantovani, A., Biswas, S. K., Galdiero, M. R., Sica, A., Locati, M. Macrophage plasticity and polarization in tissue repair and remodelling. J Pathol. 229 (2), 176-185 (2013).
- Shrivastava, R., Shukla, N. Attributes of alternatively activated (M2) macrophages. Life Sci. 224, 222-231 (2019).
- Gordon, S., Taylor, P. R. Monocyte and macrophage heterogeneity. Nat Rev Immunol. 5 (12), 953-964 (2005).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. 8 (12), 958-969 (2008).
- Murray, P. J., et al. Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity. 41 (1), 14-20 (2014).
- Kzhyshkowska, J., et al. Macrophage responses to implants: prospects for personalized medicine. J Leukoc Biol. 98 (6), 953-962 (2015).
- Browne, S., Pandit, A. Biomaterial-mediated modification of the local inflammatory environment. Front Bioeng Biotechnol. 3, 67 (2015).
- Piatnitskaia, S., et al. Modelling of macrophage responses to biomaterials in vitro: state-of-the-art and the need for the improvement. Front Immunol. 15, 1349461 (2024).
- Rayahin, J. E., Gemeinhart, R. A. Activation of macrophages in response to biomaterials. Results Probl Cell Differ. 62, 317-351 (2017).
- Murray, P. J. Macrophage polarization. Annu Rev Physiol. 79, 541-566 (2017).
- Gordon, S., Pluddemann, A. Tissue macrophages: heterogeneity and functions. BMC Biol. 15 (1), 53 (2017).
- Salma Iqbal, A. K. Characterization of in vitro generated human polarized macrophages. J Clin Cell Immunol. 6, 1-8 (2015).
- Hotchkiss, K. M., et al. Titanium surface characteristics, including topography and wettability, alter macrophage activation. Acta Biomater. 31, 425-434 (2016).
- Wang, Y., Zhang, Y., Sculean, A., Bosshardt, D. D., Miron, R. J. Macrophage behavior and interplay with gingival fibroblasts cultured on six commercially available titanium, zirconium, and titanium-zirconium dental implants. Clin Oral Investig. 23 (8), 3219-3227 (2019).
- Abaricia, J. O., Shah, A. H., Ruzga, M. N., Olivares-Navarrete, R. Surface characteristics on commercial dental implants differentially activate macrophages in vitro and in vivo. Clin Oral Implants Res. 32 (4), 487-497 (2021).
- Lu, W., et al. Improved osseointegration of strontium-modified titanium implants by regulating angiogenesis and macrophage polarization. Biomater Sci. 10 (9), 2198-2214 (2022).
- Murray, P. J., Wynn, T. A. Obstacles and opportunities for understanding macrophage polarization. J Leukoc Biol. 89 (4), 557-563 (2011).
- Nascimento, C. R., Fernandes, N. A. R., Maldonado, L. A. G., Junior, C. R. Comparison of monocytic cell lines U937 and THP-1 as macrophage models for in vitro studies. Biochem Biophys Rep. 32, 101383 (2022).
- Freytes, D. O., Kang, J. W., Marcos-Campos, I., Vunjak-Novakovic, G. Macrophages modulate the viability and growth of human mesenchymal stem cells. J Cell Biochem. 114 (1), 220-229 (2013).
- Zhang, Y., et al. Macrophage type modulates osteogenic differentiation of adipose tissue MSCs. Cell Tissue Res. 369 (2), 273-286 (2017).
- Cerqueira, A., et al. Evaluation of the inflammatory responses to sol-gel coatings with distinct biocompatibility levels. J Biomed Mater Res A. 109 (9), 1539-1548 (2021).
- Zhang, Y., Cheng, X., Jansen, J. A., Yang, F., van den Beucken, J. J. Titanium surfaces characteristics modulate macrophage polarization. Mater Sci Eng C Mater Biol Appl. 95, 143-151 (2019).
- Nobs, S. P., Kopf, M. Tissue-resident macrophages: guardians of organ homeostasis. Trends Immunol. 42 (6), 495-507 (2021).
- Sreejit, G., Fleetwood, A., Murphy, A., Nagareddy, P. Origins and diversity of macrophages in health and disease. Clin Transl Immunology. 9 (12), e1222 (2020).
- Parisi, L., et al. Preparation of human primary macrophages to study the polarization from monocyte-derived macrophages to pro-or anti-inflammatory macrophages at biomaterial interface in vitro. J Dent Sci. 18 (4), 1630-1637 (2023).
- Feuerer, N., et al. Macrophage retrieval from 3D biomaterials: A detailed comparison of common dissociation methods. J Immunol Regen Med. 11, 100035 (2021).
- Shapouri-Moghaddam, A., et al. Macrophage plasticity, polarization, and function in health and disease. J Cell Physiol. 233 (9), 6425-6440 (2018).
- Sridharan, R., Cameron, A. R., Kelly, D. J., Kearney, C. J., O'Brien, F. J. Biomaterial based modulation of macrophage polarization: a review and suggested design principles. Mater Today. 18 (6), 313-325 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved