Method Article
植入物表面 M1 和 M2 人单核细胞衍生巨噬细胞的极化和表征
摘要
在这里,我们提出了一个详细的方案,用于评估植入物表面在 体外的免疫调节潜力,旨在提高当前方案的可靠性和可重复性并促进进一步的研究。使用血液单核细胞衍生的巨噬细胞监测分泌细胞因子谱、 mRNA 表达和细胞表面标志物,以研究在钛上培养的巨噬细胞极化。
摘要
异物反应 (FBR) 是一种免疫介导的复杂愈合过程,在将植入物整合到体内方面起着至关重要的作用。巨噬细胞作为免疫系统与植入物表面相互作用的第一线,在调节炎症-再生平衡方面起双向作用。为了深入了解和评估植入物材料与免疫反应之间的反应,可靠的 体外 方法和方案至关重要。在不同的 体外 模型中,原代单核细胞衍生的巨噬细胞 (MDM) 是研究巨噬细胞-植入物相互作用的极好模型。我们已经实施了一项实验方案,以评估 MDM 在植入物表面极化为 M1(经典激活)和 M2(选择性激活)巨噬细胞的情况。我们从健康供体中分离出血液单核细胞,并使用巨噬细胞集落刺激因子 (M-CSF) 将它们分化为巨噬细胞。分化的巨噬细胞在种植体表面培养并极化为 M1 和 M2 亚型。在干扰素 (IFN)-γ 和脂多糖 (LPS) 存在下实现 M1 极化,而 M2 极化在含有白细胞介素 (IL)-4 和 IL-13 的培养基中进行。我们通过酶联免疫吸附测定 (ELISA) 、共聚焦激光扫描显微镜 (CLSM) 和定量实时 PCR (qRT-PCR) 基于分泌的细胞因子、细胞表面标志物和表达基因的面板评估了巨噬细胞表型。将提取的 RNA 转化到互补 DNA (cDNA) 中,采用 qRT-PCR 定量与 M1 和 M2 巨噬细胞相关的 mRNA。因此,与 M2 巨噬细胞相比,M1 巨噬细胞的特征是促炎肿瘤坏死因子 (TNF-α) 细胞因子和 CCR7 表面标志物的表达更高,而 M2 巨噬细胞表现出更高水平的 CD209 和 CCL13。因此,通过 CLSM 免疫染色和可视化,CCR7 和 CD209 被鉴定为 M1 和 M2 巨噬细胞亚型的特异性和可靠标志物。通过 ELISA 检测 M1 细胞中 TNF-ɑ 水平升高和 M2 细胞中 CCL13 升高,进一步证实。所提出的标记物和实验设置可以有效地用于评估植入物的免疫调节潜力。
引言
植入式生物材料已成为各种人类疾病的常规解决方案,并在生物医学研究中发挥着重要作用,包括组织工程、药物递送系统和植入物 1,2。由具有不同结构和功能的各种材料制成的植入物种类繁多,例如髋关节假体、支架、网片、心脏瓣膜或牙科植入物。植入后,组织-植入物接触会引发免疫反应,然后是消退、组织重塑和体内平衡。这些过程受所用生物材料的物理、化学和生物活性特性的影响。这些特性可能会影响促炎和抗炎反应的强度和范围、纤维化包膜形成、组织降解和愈合期 3,4。为了支持和优化愈合过程和长期植入物整合,当前研究的一个新兴方面是研究和介导植入物表面和免疫细胞之间的相互作用。
在其他免疫细胞中,遍布全身的巨噬细胞在炎症和抗病原防御以及愈合过程和维持组织稳态方面发挥着关键作用 5,6。基于它们的可塑性和局部组织微环境刺激,巨噬细胞能够极化成不同的功能表型,这些表型在细胞代谢、细胞功能和细胞因子分泌谱方面表现出很大差异。经典激活的 M1 表型可以通过分泌促炎细胞因子(如 IL-1β、IL-6 和 TNF-α)来区分,并参与对创伤和外来生物材料的初始和慢性炎症反应。相反,由 IL-4 和 IL-13 等细胞因子触发的活化 M2 巨噬细胞具有炎症消退和促进组织愈合等特征。M2 极化巨噬细胞可以通过细胞表面标志物(如 CD206)的表达和 IL-10 和 IL-47 等细胞因子的产生来识别。同样,已经极化的巨噬细胞可以在新的微环境中重新编程。
许多关于细胞-生物材料相互作用的研究表明,巨噬细胞在对植入式生物材料的免疫反应级联反应中以及在协调涉及植入相关并发症愈合的过程中的重要性 8,9,10。尽管生物医学工程近年来取得了重大进展,但仍需要进一步的研究来了解植入物如何调节巨噬细胞行为和极化 11,12,13。
在细胞培养中,单核细胞衍生的外周血单核细胞 (PBMC) 可以分化为贴壁的 M0 巨噬细胞,然后分别使用 LPS 和 IFN-γ 或 IL-4 诱导极化为 M1 或 M2 表型。与新的生物材料样本体外孵育后,可以利用 M1 和 M2 巨噬细胞的不同细胞表面受体和细胞因子谱来检测生物材料的体外免疫调节潜力 14,15。本研究旨在开发一种体外方案,可用于研究 MDM 响应不同植入物表面的极化。基因表达分析、显微镜技术和 ELISA 可用于确定受生物材料调节的 M1 和 M2 巨噬细胞的表型标志物和特异性细胞因子谱。因此,可以阐明巨噬细胞和生物材料表面之间的复杂相互作用,并获得有价值的信息以更好地了解巨噬细胞-生物材料相互作用。最后,标准化的体外方案通过最大限度地减少实验装置的可变性来确保实验结果的可重复性、可靠性和可比性。
研究方案
根据图宾根大学医学院伦理委员会批准的方案(伦理批准:286/2021 BO)从健康献血者那里获得人外周血。如前所述,使用密度梯度离心分离人 PBMC16。以下方案概述了从 24 mL 血液中分离的 PBMC。该协议的示意图如图 1 所示。
注意:应根据使用的 M0 巨噬细胞的数量调整血容量。
从 24 mL 血液中共获得 35.46 ± 910 万个 PBMC,产生 1.97 ± 46 万个 M0 巨噬细胞 (n = 5)。所有试剂、耗材和设备均列在 材料表中。 表 1 中列出了缓冲区。
1. 人血单核细胞向巨噬细胞的分化
- 将分离的 PBMC 重悬于 15 mL 预热的单核细胞附着培养基中,并将它们转移到一个 T75 细胞培养瓶中。
- 将细胞在 37 °C 和 5% CO2 下孵育 90 分钟以允许粘附。
- 弃去上清液,用预热的完全培养基洗涤细胞一次,轻轻倾斜以去除非贴壁或松散粘附的细胞。
注:附着的细胞是单核细胞,约占最初添加到培养瓶中的总 PBMC 的 10%。 - 向贴壁细胞中加入 15 mL 含有 10 ng/mL 巨噬细胞集落刺激因子 (M-CSF) 的完全培养基,并孵育 6 天以促进分化。
- 每 2 天用含有 10 ng/mL M-CSF 的新鲜完全培养基更换培养基。
2. MDM 在钛植入物表面的培养和极化
注意:在分化的第 6 天,将 M0 巨噬细胞接种在具有不同刺激的生物材料表面上 48 小时,以获得完全极化的 M1 或 M2 巨噬细胞。对于检查的每个表面,使用三个圆盘接种 M0、M1 和 M2 巨噬细胞。使用细胞培养处理的塑料盖玻片作为对照表面。
- 从 T75 培养瓶中取出培养基,用 10 mL PBS 洗涤细胞 5 分钟。
- 通过将贴壁细胞与 10 mL 预热的细胞分离溶液孵育 30 分钟来分离贴壁细胞。
- 轻轻敲击细胞并将其转移到 50 mL 试管中。通过在 10 mL PBS 中轻轻刮擦剩余细胞来分离它们。
- 将分离的细胞转移到 50 mL 试管中,并以 300 x g 离心 10 分钟。
- 弃去上清液,将细胞重悬于 5 mL 预热的完全培养基中。
- 使用台盼蓝染色和血细胞计数器对细胞进行计数,以确定细胞数量和活力。
- 通过将细胞数量调整为每 1 mL 完全培养基 160,000 个细胞来制备细胞悬液。
- 在 70% 乙醇中超声清洁生物材料盘 5 分钟,然后在 70% 乙醇中消毒 30 分钟。
- 将钛盘干燥 1-2 小时,然后将它们放入未经处理的 24 孔板中,并向每个孔中加入 1 mL 制备的细胞悬液。
- 为了获得 M1 极化巨噬细胞,添加浓度分别为 50 ng/mL 和 10 ng/mL 的 IFN-γ 和 LPS。对于 M2 极化,添加浓度为 20 ng/mL 的 IL-4 和 IL-13。确保 M0 细胞在没有任何极化剂的情况下生长。将细胞在 37 °C 和 5% CO2 下再孵育 48 小时以诱导极化。
3. 使用 ELISA 表征极化巨噬细胞
注:在极化的第 2 天,准备了用于表征分析的样品。测量 TNF-ɑ 细胞因子和 CCL13 趋化因子,分别表征 M1 和 M2 极化巨噬细胞。将分泌蛋白的浓度归一化为相应上清液中分泌蛋白的总浓度。
- 将上清液收集在 1.5 mL 试管中,并以 300 x g 离心 5 分钟。将上清液转移到新试管中。
- 将圆盘转移到新的 24 孔板上进行进一步实验。目的是消除未经处理的 24 孔板中的死细胞或松散附着的细胞。
注意:在进行任何分析之前,应在表面上验证细胞活力。细胞活力可以通过活/死细胞活力测定来确定,也可以通过细胞增殖和细胞毒性试验间接确定。 - 根据制造商提供的具体说明测量细胞因子和趋化因子。立即测量细胞因子或将样品储存在 -80 °C 以备将来测量。
注:对于每种类型的试剂盒(考虑到 ELISA 试剂盒的灵敏度和检测限),应确定适当的样品稀释度。对于二辛可宁酸 (BCA) 测定,样品按 1:5 稀释。TNF-ɑ 的 M1 样品以 1:10 稀释,CCL13 的 M2 样品以 1:12 稀释。 - 按照制造商的说明使用标准曲线计算分泌的细胞因子/趋化因子的浓度。
- 使用 BCA 蛋白测定试剂盒测量总蛋白量。
- 将分泌蛋白的浓度标准化为 mg 总蛋白。
4. 使用 CLSM 表征极化巨噬细胞
注:通过用 CD209 和 CCR7 细胞表面标志物抗体染色来进一步表征极化巨噬细胞。细胞核用 DRAQ5 复染。CD68 或其他标志物可用作泛巨噬细胞标志物。
- 在 800 μL PBS 中洗涤细胞 2 次。将圆盘在室温 (RT) 下在 400 μL 固定缓冲液中孵育 20 分钟。
- 去除固定缓冲液后,在 400 μL PBS 中洗涤 3 次。立即对样品进行染色或在 4 °C 下储存在 1 mL 储存缓冲液中。
注:使用这种固定和储存方案,样品在固定后 1-6 周内成功染色和成像。 - 在下一步之前,储存后用 800 μL PBS 洗涤圆盘两次。
- 在 RT 下将圆盘与 400 μL 封闭缓冲液孵育 30 分钟,以阻断非特异性结合位点。
- 丢弃封闭缓冲液,并在 RT 下用在 400 μL 染色缓冲液中稀释的一抗孵育圆盘 1 小时。
- 使用双重染色执行免疫荧光程序,以检查一个样品中 CCR7 和 CD209 的表达。为此,将来自不同物种(小鼠和兔)的一抗混合在同一染色步骤中。
注:为了获得具有最小背景的强信号,请优化抗体浓度。使用终浓度为 10 μg/mL 的 CCR7 抗体,并将 CD209 抗体稀释为 1/400。
- 使用双重染色执行免疫荧光程序,以检查一个样品中 CCR7 和 CD209 的表达。为此,将来自不同物种(小鼠和兔)的一抗混合在同一染色步骤中。
- 去除一抗,用 400 μL 洗涤缓冲液洗涤 3 次。
- 加入用染色缓冲液稀释的荧光团标记的二抗,并在 RT 下避光孵育 1 小时。
注:应优化二抗的浓度,以最小的背景获得最大的特异性信号。在本研究中,使用浓度为 5 μg/mL 的二抗进行染色。 - 去除上清液后,在洗涤缓冲液中洗涤样品 3 次,每次 3 分钟。
- 在 PBS 中加入 10 μM DRAQ5,并在 RT 下避光孵育 15 分钟。
- 去除上清液并在 PBS 中洗涤圆盘一次。
- 去除剩余的 PBS 并加入 1 滴封固剂。
- 5 分钟后,盖上盖玻片,让样品干燥 1 小时。
- 干燥样品后,用透明指甲油密封边缘,并将其储存在 4 °C 的黑暗中直至成像。
- 为了获得细胞的概览,请用 25 倍放大倍率对样品进行成像。为了进一步确定表面标记的结构和定位,请以 63 倍放大倍率采集图像。
- 使用 ImageJ 软件量化 CCR7 和 CD209 的荧光强度。
注:使用 CLSM 系统通过光电倍增管 (PMT) 进行图像采集,该系统配备氩激光器 (488 nm)、DPSS 激光器 (561 nm) 和 HeNe 激光器 (633 nm)。
5. 使用 qRT-PCR 表征极化巨噬细胞
注:对于 RNA 分离,每个样品使用两个圆盘,以获得足够的 RNA 用于 cDNA 合成。
- 用 800 μL PBS 洗涤光盘 2 次。
- 向第一个圆盘中加入 350 μL 裂解缓冲液,并通过上下吹打裂解细胞。
- 将裂解物转移到第二个圆盘上,然后重复裂解过程。
- 向裂解物中加入 350 μL 70% 乙醇,上下移液直至均匀。
- 将裂解物转移到离心柱上,并按照制造商的说明进行 RNA 分离。
- 使用 nanodrop 或其他设备定量 RNA 量。
- 根据制造商的说明,使用用于第一链 cDNA 合成的 RT-PCR 系统对不同样品的 RNA 浓度进行标准化并合成 cDNA。
- 按照制造商的方案使用 350 ng RNA 合成 cDNA,并将其储存在 -20 °C 直至进行 qRT-PCR 分析。
注:此处使用 350 ng 纯化的 RNA 在 20 μL 中使用 4 μL RT Mix (5x) 合成 cDNA。 - 在 96 孔板中的实时 PCR 系统上进行 qRT-PCR,并单独进行 15 μL 反应(1x Syber green 预混液、0.2 μM 正向和反向引物以及 4.5 μL 1:10 稀释的 cDNA)。
注:PCR 程序从加热盖 (105 °C) 开始,然后进行三个步骤:在 95 °C 下初始变性 3 分钟,然后在 95 °C 下 15 秒,在 55 °C 下 30 秒,持续 40 个循环。 - 将各种基因的表达水平标准化为管家基因 GAPDH(或其他管家基因,如 β-肌动蛋白)。
- 以组织培养盖玻片上培养的 M0 细胞为参考,使用 2 -ΔΔCt 方法计算相对基因表达。 表 2 列出了本研究中使用的所有引物。
6. 统计分析
- 将所有数据作为 SEM ±平均值。重复所有测定(在本研究中,测定重复了 5 次)以确保可重复性。使用单因素方差分析 (ANOVA) 和 Tukey 多重检验评估正态分布数据之间的统计显著性差异。
- 使用 Friedman 检验和 Dunn 多重比较检验可以分析非参数数据集。使用适当的数据分析软件分析数据并将统计显著性定义为小于 0.05 的 p 值。
结果
本研究的结果表明,MDM 在钛表面成功分化和极化,然后表征 M1 或 M2 极化巨噬细胞。第一步,我们使用 CLSM 表征极化 MDM。根据我们的初步研究,CD209 和 CCR7 被用作区分 M1 和 M2 极化 MDM 的特异性标志物。如图 2A、B 所示,MDM 成功极化成 M1 和 M2 巨噬细胞。在钛表面,CCR7 在 M1 极化巨噬细胞中的表达比 CD209 更强,在 M2 极化巨噬细胞中特异性表达。此外,量化相对荧光强度有助于将标记物分配给 M1 或 M2 亚型(图 2C)。
图 3 显示了钛和盖玻片表面 MDM 的代表性 qRT-PCR 分析。结果表明,两个表面上的 MDM 都成功极化,M1 (CCR7 和 TNF-ɑ) 和 M2 (CD209 和 CCL13) 极化标志物的高表达证明了这一点。通过分别在 M1 和 M2 极化细胞中观察到高水平的炎性 TNF-α 细胞因子(图 4A)和 IL-13 趋化因子(图 4B),在蛋白质水平上进一步证实了这一点。
图 1:协议的示意图。请单击此处查看此图的较大版本。

图 2:使用 CLSM 表征极化 MDM。 在接种后第 2 天,使用 CCR7 和 CD209 抗体通过特异性抗体染色和 CLSM 分析证实 M1 和 M2 极化巨噬细胞的富集。根据荧光染色和 CLSM 分析,(A) 25 倍放大倍率和 (B) 63 倍放大倍率,M1 细胞表达的 CCR7(绿色)高于 M0 或 M2。M2 细胞表现出显著的 CD209 表达模式(绿色)。(C) CCR7 和 CD209 相对荧光强度的定量分析。细胞核用 DRAQ5(紫色)染色。结果代表了独立进行的 5 个类似实验。 请单击此处查看此图的较大版本。

图 3:使用基因表达谱表征极化 MDM。 采用定量逆转录聚合酶研究与 M1 (CCR7 和 TNF-ɑ) 和 M2 (CD209 和 CCL13) 极化相关的不同基因的 mRNA 水平。GAPDH 用作管家基因。数据以 SEM 的平均±表示 (n = 5)。请单击此处查看此图的较大版本。
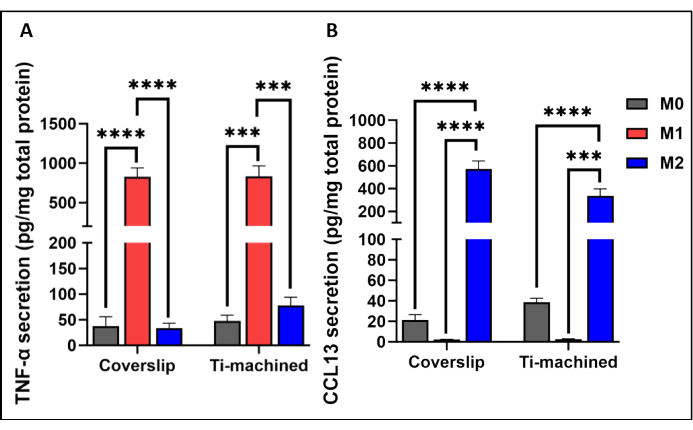
图 4:在钛和塑料盖玻片上培养的 M0、M1 和 M2 巨噬细胞产生细胞因子。使用 ELISA 测量细胞培养上清液中的 TNF-ɑ 细胞因子水平和 (B) CCL13 水平。细胞因子分泌与 BCA 测定测量的总蛋白分泌标准化。条形图表示 SEM 的平均± (n = 5)。请单击此处查看此图的较大版本。
| 缓冲液/溶液 | 内容 |
| 染色/封闭缓冲液 | PBS + 1% BSA + 0.1% 吐温 20 |
| 洗涤缓冲液 | PBS + 0.1% 吐温 20 |
| 固定缓冲液 | PBS 中 3% 的多聚甲醛 (PFA) |
| 储存缓冲区 | 1% 青霉素和链霉素的 PBS 溶液 |
表 1:缓冲区列表。
| 引物名称 | 正向引物序列 | 反向引物序列 |
| GAPDH | 5'-GAGTCAACGGATTTGGTCGT-3' | 5'-TTGATTTTGGAGGAGGCTCG-3' |
| CCR7 | 5'- TGGTGATCGGCTTTCTGGTC-3' | 5'- CACCTTGATGGCCTTGTTGC-3' |
| CD209的 | 5'- GGAGCAGAACTTCCTACAGC-3' | 5'- CAACGTTGTTGGGCTCTCCT-3' |
| CCL13 | 5'-ATCTCCTTGCAGAGGCTGAA-3' | 5'-ACTTCTCCTTTGGGTCAGCA-3' |
| TNF-ɑ | 5'- GCTGCACTTTGGAGTGATCG-3' | 5'- TCACTCGGGGTTCGAGAAGA-3' |
表 2.qRT-PCR 中使用的引物序列。
讨论
对巨噬细胞行为的透彻理解对于理解植入材料的免疫调节特性至关重要。几项研究报道了异质性标志物、多种细胞模型和体外表征巨噬细胞极化的方案 17、18、19、20。为了提高实验结果的可重复性、可靠性和可比性,标准化和经过验证的方案以及合适的细胞模型和共有表征标记物是必不可少的。因此,准确模拟植入物材料的免疫调节特性首先需要一个合适的细胞模型。不同的研究利用了广泛的细胞模型,例如分离的组织巨噬细胞、来源于血液单核细胞的分化巨噬细胞和永生化单核细胞系。尽管组织分离的巨噬细胞可能被认为更能代表体内条件,但它们在技术和伦理上都具有挑战性21,22。巨噬细胞也经常从已建立的永生化单核细胞系中获得,例如 THP1 细胞 23,24,25,26。虽然这些细胞作为非衰老细胞的无限来源可能提供更高的细胞反应同质性,但它们通常是从血液肿瘤患者那里获得的,它们的反应可能与正常细胞显着不同。例如,据报道,单核细胞 THP1 细胞对 M1 模拟器的反应更灵敏,并且更有可能表现出 M1 特性22。这项研究的结果与我们的初步研究结果一致(此处未提供数据)。
此外,由于血液来源的单核细胞被认为是组织驻留巨噬细胞的前体,并且可以很容易地以更高的产量获得,因此它们可能是巨噬细胞的可行替代品 27,28,29。根据我们使用血液单核细胞衍生的巨噬细胞的研究,我们发现这些细胞对钛和细胞培养处理的盖玻片上的 M1 和 M2 刺激剂的反应相同。此外,他们表现出多个 M1 和 M2 共有标志物,其中一些显示在代表性结果中。结果表明,MDM 可以用作模拟植入物-巨噬细胞相互作用的可行体外模型。
为了进一步推进免疫调节研究,恒定和特异性的特征标记物是必不可少的。研究引入了多种用于巨噬细胞表征的标志物,这些标志物不仅在不同来源的巨噬细胞之间不同,而且在同一来源的巨噬细胞之间也不同 17,18,19,24。通过评估不同报告的标志物,确定并验证一组 MDM 特征的 M1 和 M2 标志物。本文介绍了一些最重要的关键标志。
确定最合适的检测方法也是评估过程的关键部分。通常用于评估细胞表面标志物的分析技术通常需要从生物材料中去除细胞。然而,已观察到这个过程会通过破坏细胞的表面标志物并导致细胞分离数量减少而对细胞产生负面影响30。因此,需要细胞分离的流式细胞术不适用于评估紧密附着在植入物上的巨噬细胞。在本研究中,使用 CLSM 进行细胞表面标志物检测。通过使用适当的标记物和优化染色过程,我们能够成功地表征 M1 和 M2 亚型彼此之间以及与 M0 细胞的比较。需要注意的是,荧光染色是半定量的,这是它的局限性之一。这可能会使使用在所有亚型中表达的标记物的细胞评估复杂化,而没有显著差异。在测试 CLSM 表征 MDM 的不同标志物后选择 CCR7 和 CD209。CCR7 和 CD209 分别在 M1 和 M2 亚型中表达较高。
在本研究的局限性内,结果强调了所实施方案在植入物表面极化巨噬细胞并根据基因表达、分泌蛋白和细胞表面标志物准确表征它们方面的实用性和有效性。此外,对所描述的标记物的分析揭示了可用于区分 MDM 的不同亚型的一致和特异性表达模式。然而,这种体外模型并不能完全反映人类巨噬细胞的表型多样性和可塑性。现在正在确定几种巨噬细胞亚型 (M2a、M2b、M2c、M2d),这表明需要更多样化的体外模型来研究各种生物材料及其特性(例如,物理化学性质)如何影响巨噬细胞的可塑性和极化31,32。虽然无法使用体外模型来反映复杂的体内情况,但使用提出的体外方案可以获得许多结果,以有效描述新型植入式生物材料的免疫调节潜力9。最后但并非最不重要的一点是,有必要进一步建立以在更复杂的体外或体内模型中表征巨噬细胞,涉及其他参与者在复杂生理环境中的作用。总体而言,本研究将有助于免疫调节生物材料的开发和设计,以改善和促进有利的组织再生过程和成功的植入物整合,以及预防与植入物相关的慢性炎症。
披露声明
作者没有什么可披露的。
致谢
这些光盘由德国 Bad-Neuenahr-Ahrweiler 的 Medentis Medical 友情提供。作者感谢口腔颌面外科(Tuebingen 大学医院)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 24-well plate, not-treated | Corning Incorporated (Kennebunk, USA) | 144530 | |
| Absorbance reader Infinite F50 | TECAN Austria GmbH (Grödig, Austria) | TCAT91000001 | |
| Accutase in DPBS, 0.5 mM EDTA | EMD Millipore Corp. (Burlington, USA) | SCR005 | |
| Anti-Fade Fluorescence Mounting Medium -Aqueous, Fluoroshield | abcam (Cambridge, UK) | ab104135 | |
| Bio-Rad MJ Research PTC-200 Peltier Thermal Cycler | Bio-Rad / MJ Research | 7212 | |
| Bovine serum albumin (BSA) | VWR International bvba (Leuven, Belgium) | 422361V | |
| Centrifuge 5804 R | Eppendorf SE (Hamburg, Germany) | 5804 R | |
| DC-SIGN (D7F5C) XP Rabbit mAb | Cell Signaling Technology | 13193 | |
| Dimethyl sulfoxide | Sigma Aldrich Co. (St.Louis, MO, USA) | D2438-5X10ML | |
| DRAQ5 Staining Solution | Milteny Biotec (Bergisch Gladbach, Germany) | 130-117-344 | |
| Ethanol ≥99.8% for molecularbiology | Carl Roth GmbH + CO. KG (Karlsruhe, Germany) | 1HPH.1 | |
| Goat Anti-Mouse IgG (H&L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | Invitrogen | A32723TR | |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Cyanine3 | Invitrogen | A10520 | |
| GraphPad Prism | GraphPad | Version 9.4.1 | |
| Human CCR7 Antibody | R&D Systems | MAB197 | |
| Human IFN-gamma Recombinant | Invitrogen (Rockford, USA) | RIFNG100 | |
| Human IL-13 | Milteny Biotec (Bergisch Gladbach, Germany) | 5230901032 | |
| Human IL-4 | Milteny Biotec (Bergisch Gladbach, Germany) | 130-095-373 | |
| Human M-CSF | Peprotech (Cranbury, USA) | 300-25 | |
| Leica TCS SP5 | Leica Microsystems CMS GmbH (Mannheim, Germany) | https://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp5/ | |
| Lipopolysaccharides from Escherichia | Sigma Aldrich Co. (Missouri, USA) | L4391-1MG | |
| Luna Universal qPCR Master Mix | New England Biolabs | NEB #M3003 | |
| LunaScript RT SuperMix Kit | New England Biolabs | E3010L | |
| Lymphocyte Separation Medium 1077 | PromoCell (Heidelberg, Germany) | C-44010 | |
| MCP-4/CCL13 Human ELISA Kit | Invitrogen | EHCCL13 | |
| MicroAmp Fast 96-Well Reaction Plate (0.1 mL) | Applied Biosystems (Waltham, USA) | 4346907 | |
| MicroAmp Optical Adhesive Film | Life Technologies Corporation (Carlsbad, USA) | 4311971 | |
| MicroAmp Splash Free 96-Well Base | Applied Biosystems (Waltham, USA) | 4312063 | |
| Microlitercentrifuge CD-3124R | Phoenix Instrument (Germany) | 9013111121 | |
| Microscope Cover Glasses, 10 mm | Carl Roth GmbH, Karlsruhe, Germany | 4HX4.1 | |
| Monocyte Attachment Medium | PromoCell (Heidelberg, Germany) | C-28051 | |
| Multiply-Pro Gefäß 0.5 mL, PP | Sarstedt AG & CO (Nümbrecht, Germany) | 7,27,35,100 | |
| Nanodrop One | Thermo Scientific (USA) | ND-ONE-W | |
| QuantStudio 3 System | Life Technologies GmbH (St. Leon-Rot, Germany) | A28567 | |
| RNeasy Micro Kit | Qiagen | 74007 | |
| RPMI 1640, 1x, with L-glutamine | Mediatech, Inc. (Manassas, USA) | 10-040-CV | |
| Sterile bench, LaminarAir HB 2472 | Heraeus instruments (Hanau, Germany) | 51012197 | |
| Tissue Culture Coverslips 13 mm (Plastic) | Sarstedt Inc. (Newton, USA) | 83,18,40,002 | |
| Titanium machinied discs 12 cm | Medentis Medical (Bad-Neuenahr-Ahrweiler, Germany) | N/A | |
| TNF alpha Human ELISA Kit | Invitrogen | KHC3011 | |
| Trypan blue solution 0.4% | Carl Roth GmbH + Co. KG (Karlsruhe, Germany) | 1680.1 |
参考文献
- Othman, Z., Pastor, B. C., van Rijt, S., Habibovic, P. Understanding interactions between biomaterials and biological systems using proteomics. Biomaterials. 167, 191-204 (2018).
- Ikada, Y. Challenges in tissue engineering. J R Soc Interface. 3 (10), 589-601 (2006).
- Aamodt, J. M., Grainger, D. W. Extracellular matrix-based biomaterial scaffolds and the host response. Biomaterials. 86, 68-82 (2016).
- Batool, F., et al. Modulation of immune-inflammatory responses through surface modifications of biomaterials to promote bone healing and regeneration. J Tissue Eng. 12, 20417314211041428 (2021).
- Mantovani, A., Biswas, S. K., Galdiero, M. R., Sica, A., Locati, M. Macrophage plasticity and polarization in tissue repair and remodelling. J Pathol. 229 (2), 176-185 (2013).
- Shrivastava, R., Shukla, N. Attributes of alternatively activated (M2) macrophages. Life Sci. 224, 222-231 (2019).
- Gordon, S., Taylor, P. R. Monocyte and macrophage heterogeneity. Nat Rev Immunol. 5 (12), 953-964 (2005).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. 8 (12), 958-969 (2008).
- Murray, P. J., et al. Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity. 41 (1), 14-20 (2014).
- Kzhyshkowska, J., et al. Macrophage responses to implants: prospects for personalized medicine. J Leukoc Biol. 98 (6), 953-962 (2015).
- Browne, S., Pandit, A. Biomaterial-mediated modification of the local inflammatory environment. Front Bioeng Biotechnol. 3, 67 (2015).
- Piatnitskaia, S., et al. Modelling of macrophage responses to biomaterials in vitro: state-of-the-art and the need for the improvement. Front Immunol. 15, 1349461 (2024).
- Rayahin, J. E., Gemeinhart, R. A. Activation of macrophages in response to biomaterials. Results Probl Cell Differ. 62, 317-351 (2017).
- Murray, P. J. Macrophage polarization. Annu Rev Physiol. 79, 541-566 (2017).
- Gordon, S., Pluddemann, A. Tissue macrophages: heterogeneity and functions. BMC Biol. 15 (1), 53 (2017).
- Salma Iqbal, A. K. Characterization of in vitro generated human polarized macrophages. J Clin Cell Immunol. 6, 1-8 (2015).
- Hotchkiss, K. M., et al. Titanium surface characteristics, including topography and wettability, alter macrophage activation. Acta Biomater. 31, 425-434 (2016).
- Wang, Y., Zhang, Y., Sculean, A., Bosshardt, D. D., Miron, R. J. Macrophage behavior and interplay with gingival fibroblasts cultured on six commercially available titanium, zirconium, and titanium-zirconium dental implants. Clin Oral Investig. 23 (8), 3219-3227 (2019).
- Abaricia, J. O., Shah, A. H., Ruzga, M. N., Olivares-Navarrete, R. Surface characteristics on commercial dental implants differentially activate macrophages in vitro and in vivo. Clin Oral Implants Res. 32 (4), 487-497 (2021).
- Lu, W., et al. Improved osseointegration of strontium-modified titanium implants by regulating angiogenesis and macrophage polarization. Biomater Sci. 10 (9), 2198-2214 (2022).
- Murray, P. J., Wynn, T. A. Obstacles and opportunities for understanding macrophage polarization. J Leukoc Biol. 89 (4), 557-563 (2011).
- Nascimento, C. R., Fernandes, N. A. R., Maldonado, L. A. G., Junior, C. R. Comparison of monocytic cell lines U937 and THP-1 as macrophage models for in vitro studies. Biochem Biophys Rep. 32, 101383 (2022).
- Freytes, D. O., Kang, J. W., Marcos-Campos, I., Vunjak-Novakovic, G. Macrophages modulate the viability and growth of human mesenchymal stem cells. J Cell Biochem. 114 (1), 220-229 (2013).
- Zhang, Y., et al. Macrophage type modulates osteogenic differentiation of adipose tissue MSCs. Cell Tissue Res. 369 (2), 273-286 (2017).
- Cerqueira, A., et al. Evaluation of the inflammatory responses to sol-gel coatings with distinct biocompatibility levels. J Biomed Mater Res A. 109 (9), 1539-1548 (2021).
- Zhang, Y., Cheng, X., Jansen, J. A., Yang, F., van den Beucken, J. J. Titanium surfaces characteristics modulate macrophage polarization. Mater Sci Eng C Mater Biol Appl. 95, 143-151 (2019).
- Nobs, S. P., Kopf, M. Tissue-resident macrophages: guardians of organ homeostasis. Trends Immunol. 42 (6), 495-507 (2021).
- Sreejit, G., Fleetwood, A., Murphy, A., Nagareddy, P. Origins and diversity of macrophages in health and disease. Clin Transl Immunology. 9 (12), e1222 (2020).
- Parisi, L., et al. Preparation of human primary macrophages to study the polarization from monocyte-derived macrophages to pro-or anti-inflammatory macrophages at biomaterial interface in vitro. J Dent Sci. 18 (4), 1630-1637 (2023).
- Feuerer, N., et al. Macrophage retrieval from 3D biomaterials: A detailed comparison of common dissociation methods. J Immunol Regen Med. 11, 100035 (2021).
- Shapouri-Moghaddam, A., et al. Macrophage plasticity, polarization, and function in health and disease. J Cell Physiol. 233 (9), 6425-6440 (2018).
- Sridharan, R., Cameron, A. R., Kelly, D. J., Kearney, C. J., O'Brien, F. J. Biomaterial based modulation of macrophage polarization: a review and suggested design principles. Mater Today. 18 (6), 313-325 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。