Method Article
Поляризация и характеризация макрофагов, полученных из моноцитов человека M1 и M2, на поверхностях имплантатов
В этой статье
Резюме
В данной статье мы представляем подробный протокол оценки иммуномодулирующего потенциала поверхностей имплантатов in vitro, направленный на повышение надежности и воспроизводимости существующих протоколов и содействие дальнейшим исследованиям. Профили секреторных цитокинов, экспрессия мРНК и маркеры клеточной поверхности контролировались с использованием макрофагов, полученных из моноцитов крови, для изучения поляризации макрофагов, культивируемых на титане.
Аннотация
Реакция инородного тела (FBR), иммуноопосредованный сложный процесс заживления, играет решающую роль в интеграции имплантатов в организм. Макрофаги, являясь первой линией взаимодействия иммунной системы с поверхностями имплантатов, играют двунаправленную роль в модуляции баланса воспаления и регенерации. Для глубокого понимания и оценки реакций между материалами имплантатов и иммунными реакциями решающее значение имеют надежные методы и протоколы in vitro . Среди различных моделей in vitro первичные моноцитарные макрофаги (МДМ) представляют собой отличную модель для исследования взаимодействий макрофагов и имплантатов. Мы реализовали экспериментальный протокол для оценки поляризации МДМ на макрофаги М1 (классически активируемые) и М2 (альтернативно активируемые) на поверхностях имплантатов. Мы выделили моноциты крови от здоровых доноров и дифференцировали их в макрофаги с помощью макрофагального колониестимулирующего фактора (M-CSF). Дифференцированные макрофаги культивировали на поверхностях имплантатов и поляризовали на подтипы M1 и M2. Поляризация М1 достигалась в присутствии интерферона (ИФН)-γ и липополисахарида (ЛПС), в то время как поляризация М2 проводилась в среде, содержащей интерлейкин (ИЛ)-4 и ИЛ-13. Мы оценивали фенотипы макрофагов с помощью иммуноферментного анализа (ИФА), конфокальной лазерной сканирующей микроскопии (CLSM) и количественной ПЦР в реальном времени (qRT-PCR) на основе панелей секретируемых цитокинов, маркеров клеточной поверхности и экспрессированных генов. Извлеченную РНК трансформировали в комплементарную ДНК (кДНК), а для количественного определения мРНК, относящихся к макрофагам М1 и М2, использовали кОТ-ПЦР. Соответственно, макрофаги M1 характеризовались более высокой экспрессией цитокина провоспалительного фактора некроза опухоли (TNF-α) и поверхностного маркера CCR7 по сравнению с макрофагами M2, которые демонстрировали более высокие уровни CD209 и CCL13. Следовательно, CCR7 и CD209 были идентифицированы как специфические и надежные маркеры подтипов макрофагов M1 и M2 путем иммуноокрашивания и визуализации с помощью CLSM. Дальнейшее подтверждение было получено с помощью ИФА, обнаруживающего повышенный уровень TNF-ɑ в M1 и повышенный CCL13 в клетках M2. Предложенные маркеры и экспериментальная установка могут быть эффективно использованы для оценки иммуномодулирующего потенциала имплантатов.
Введение
Имплантируемые биоматериалы стали традиционным решением для лечения различных заболеваний человека и играют большую роль в биомедицинских исследованиях, включая тканевую инженерию, системы доставки лекарств иимплантаты. Существует широкий ассортимент имплантатов, изготовленных из различных материалов с различной структурой и функциональностью, таких как протезы тазобедренного сустава, стенты, сетки, сердечные клапаны или зубные имплантаты. После имплантации контакт ткани с имплантатом вызывает иммунный ответ, за которым следует разрешение, ремоделирование тканей и гомеостаз. На эти процессы влияют физические, химические и биологически активные характеристики используемых биоматериалов. Эти характеристики могут влиять на интенсивность и спектр про- и противовоспалительных реакций, образование фиброзных капсул, деградацию тканей и фазу заживления 3,4. Для поддержки и оптимизации процесса заживления и долгосрочной интеграции имплантатов одним из новых аспектов современных исследований является изучение и посредничество взаимодействия между поверхностями имплантатов и иммунными клетками.
Среди других иммунных клеток макрофаги, которые обнаруживаются по всему организму, являются ключевыми игроками в воспалении и антипатогенной защите, а также в процессах заживления и поддержании гомеостаза тканей 5,6. Основываясь на своей пластичности и местных стимулах микроокружения тканей, макрофаги способны поляризоваться в различные функциональные фенотипы, которые демонстрируют большие различия в клеточном метаболизме, клеточных функциях и профилях секреции цитокинов. Классически активированный фенотип М1 можно отличить по секреции провоспалительных цитокинов, таких как IL-1β, IL-6 и TNF-α, и он участвует в начальной и хронической воспалительной реакции на травму и чужеродные биоматериалы. Напротив, активированные М2-макрофаги, которые запускаются цитокинами, такими как IL-4 и IL-13, имеют характерные особенности, такие как разрешение воспаления и содействие заживлению тканей. M2-поляризованные макрофаги могут быть идентифицированы по экспрессии маркеров клеточной поверхности, таких как CD206, и продукции цитокинов, таких как IL-10 и IL-47. Точно так же макрофаги, которые уже были поляризованы, могут перепрограммировать себя в новом микроокружении.
Многие исследования клеточных взаимодействий с биоматериалом показали важность макрофагов в каскаде иммунологических реакций на имплантируемые биоматериалы и в организации процессов, участвующих в заживлении осложнений, связанных с имплантатами 8,9,10. Несмотря на то, что биомедицинская инженерия достигла значительного прогресса в последние годы, необходимы дальнейшие исследования, чтобы понять, как имплантаты модулируют поведение макрофагов и поляризацию 11,12,13.
В клеточной культуре мононуклеарные клетки периферической крови (PBMC), полученные из моноцитов, могут быть дифференцированы в адгезивные макрофаги M0 с последующей индуцированной поляризацией в сторону фенотипов M1 или M2 с использованием ЛПС и ИФН-γ или IL-4 соответственно. После инкубации in vitro с новыми образцами биоматериала можно использовать различные рецепторы клеточной поверхности и цитокиновые профили макрофагов М1 и М2 для выявления иммуномодулирующего потенциала биоматериалов in vitro 14,15. Это исследование было направлено на разработку протокола in vitro, который может быть использован для изучения поляризации МДМ в ответ на различные поверхности имплантатов. Анализ экспрессии генов, методы микроскопии и ИФА могут быть использованы для определения фенотипических маркеров и специфических цитокиновых профилей макрофагов М1 и М2, модулированных биоматериалом. Следовательно, можно прояснить сложные взаимодействия между макрофагами и поверхностями биоматериала, а также получить ценную информацию для лучшего понимания взаимодействий макрофагов и биоматериала. Наконец, стандартизированный протокол in vitro обеспечивает воспроизводимость, надежность и сопоставимость экспериментальных результатов за счет минимизации вариабельности в экспериментальной установке.
протокол
Периферическая кровь человека была получена от здоровых доноров крови в соответствии с протоколом, утвержденным Этическим комитетом медицинского факультета Тюбингенского университета (этическое одобрение: 286/2021 BO). Человеческие PBMC выделяли с помощью центрифугирования с градиентом плотности, как описано ранее16. Ниже приведен протокол для ПМЦ, выделенных из 24 мл крови. Схематическое изображение протокола показано на рисунке 1.
ПРИМЕЧАНИЕ: Объем крови следует корректировать в зависимости от количества используемых макрофагов М0.
Всего из 24 мл крови было получено 35,46 ± 9,1 млн ПБМК, в результате чего получено 1,97 ± 0,46 млн М0 макрофагов (n = 5). Все реагенты, расходные материалы и устройства перечислены в Таблице материалов. Буферы перечислены в таблице 1.
1. Дифференцировка моноцитов крови человека к макрофагам
- Ресуспендируйте выделенные PBMC в 15 мл предварительно подогретой среды для присоединения моноцитов и перенесите их в одну колбу для клеточной культуры T75.
- Инкубируйте клетки при 37 °C и 5%CO2 в течение 90 минут, чтобы обеспечить адгезию.
- Выбросьте надосадочную жидкость и промойте клетки предварительно подогретой готовой средой с легким наклоном, чтобы удалить неадгезивные или слабо прилипшие клетки.
Примечание: Прикрепленные клетки представляют собой моноциты, которые составляют около 10% от общего количества PBMC, первоначально добавленных в колбу. - Добавьте 15 мл готовой среды, содержащей 10 нг/мл макрофагального колониестимулирующего фактора (M-CSF), к адгезивным клеткам и инкубируйте в течение 6 дней для стимуляции дифференцировки.
- Заменяйте среду на свежую, полноценную среду, содержащую 10 нг/мл M-CSF, каждые 2 дня.
2. Культивирование и поляризация МДМ на поверхности титанового имплантата
Примечание: На 6-е сутки дифференцировки макрофаги M0 засеивали на поверхности биоматериала различными стимулами в течение 48 ч для получения полностью поляризованных макрофагов M1 или M2. Для каждой исследованной поверхности использовали три диска для посева макрофагов M0, M1 и M2. В качестве контрольных поверхностей использовались обработанные клеточными культурами пластиковые покровные стекла.
- Извлеките питательную среду из колб Т75 и промойте клетки 10 мл PBS в течение 5 минут.
- Отсоедините адгезивные клетки, инкубируя их с 10 мл предварительно подогретого раствора для отсоединения клеток в течение 30 минут.
- Легкими постукивающими движениями постучите по клеткам и переложите их в пробирку объемом 50 мл. Отделите оставшиеся клетки, аккуратно соскоблив их в 10 мл PBS.
- Перенесите отделенные клетки в пробирку объемом 50 мл и центрифугируйте их при давлении 300 x g в течение 10 минут.
- Выбросьте надосадочную жидкость и повторно суспендируйте клетки в 5 мл предварительно подогретой полной среды.
- Подсчитайте клетки с помощью окрашивания трипановым синим цветом и гемоцитометра, чтобы определить количество клеток и жизнеспособность.
- Приготовьте клеточную суспензию, доведя количество клеток до 160 000 клеток на 1 мл готовой среды.
- Очистите диски биоматериала ультразвуком в 70% этаноле в течение 5 минут, а затем стерилизуйте в 70% этаноле в течение 30 минут.
- Титановые диски просушить в течение 1-2 ч, затем поместить их в необработанные 24-луночные планшеты и добавить в каждую лунку по 1 мл приготовленной клеточной суспензии.
- Для получения М1 поляризованных макрофагов добавляют ИФН-γ и ЛПС в концентрации 50 нг/мл и 10 нг/мл соответственно. Для поляризации М2 добавьте ИЛ-4 и ИЛ-13 в концентрации 20 нг/мл каждый. Убедитесь, что клетки M0 выращены без каких-либо поляризационных агентов. Инкубируйте клетки еще 48 ч при 37 °C и 5%CO2 , чтобы вызвать поляризацию.
3. Характеристика поляризованных макрофагов с помощью ИФА
ПРИМЕЧАНИЕ: На 2-й день поляризации образцы были подготовлены для характеризационного анализа. Цитокин TNF-ɑ и хемокин CCL13 были измерены для характеристики поляризованных макрофагов M1 и M2 соответственно. Концентрацию секретируемых белков нормализовали до общей концентрации секретируемых белков в соответствующей надосадочной жидкости.
- Соберите надосадочную жидкость в пробирку объемом 1,5 мл и центрифугируйте при 300 x g в течение 5 минут. Переложите надосадочную жидкость в новую трубку.
- Перенесите диски на новую 24-луночную пластину для дальнейших экспериментов. Цель состоит в том, чтобы устранить мертвые или слабо прикрепленные клетки в необработанных 24-луночных планшетах.
ПРИМЕЧАНИЕ: Жизнеспособность клеток должна быть проверена на поверхностях перед проведением любого анализа. Жизнеспособность клеток может быть определена с помощью анализов жизнеспособности живых/мертвых клеток или косвенно с помощью тестов на пролиферацию клеток и цитотоксичность. - Измеряйте цитокины и хемокины в соответствии с конкретными инструкциями, предоставленными производителем. Измерьте цитокины либо сразу, либо сохраните образцы при температуре -80 °C для будущих измерений.
ПРИМЕЧАНИЕ: Для каждого типа набора (с учетом чувствительности и пределов обнаружения набора ELISA) следует определить соответствующее разведение пробы. Для анализа бицинхониновой кислоты (БЦА) образцы разбавляли в соотношении 1:5. Образцы M1 для TNF-ɑ были разбавлены в соотношении 1:10, а образцы M2 для CCL13 были разбавлены в соотношении 1:12. - Рассчитайте концентрацию секретируемых цитокинов/хемокинов с помощью стандартной кривой, следуя инструкциям производителя.
- Измерьте общее количество белка с помощью набора для анализа белка BCA.
- Нормализуют концентрацию секретируемых белков до мг общего белка.
4. Характеристика поляризованных макрофагов с помощью CLSM
Примечание: Поляризованные макрофаги дополнительно характеризовали путем окрашивания их антителами к маркерам клеточной поверхности CD209 и CCR7. Ядра окрашивали с помощью DRAQ5. CD68 или другие маркеры могут быть использованы в качестве панмакрофагальных маркеров.
- Промойте ячейки 2 раза в 800 мкл PBS. Инкубируйте диски в течение 20 минут при комнатной температуре (RT) в 400 мкл фиксирующего буфера.
- После снятия фиксирующего буфера промойте три раза в 400 мкл PBS. Немедленно окрасьте образцы или храните при температуре 4 °C в 1 мл буфера для хранения.
ПРИМЕЧАНИЕ: С помощью этого протокола фиксации и хранения образцы были успешно окрашены и визуализированы в течение 1-6 недель после фиксации. - Перед следующим этапом дважды промойте диски 800 мкл PBS после хранения.
- Инкубируйте диски с 400 мкл блокирующего буфера в течение 30 минут при РТ для блокировки неспецифических сайтов связывания.
- Выбросьте блокирующий буфер и инкубируйте диски при ОТ в течение 1 ч с первичными антителами, разведенными в 400 мкл окрашивающего буфера.
- Проведите процедуру иммунофлюоресценции с использованием двойного окрашивания для изучения экспрессии CCR7 и CD209 в одном образце. Для этого объедините первичные антитела, полученные от разных видов (мышей и кроликов) на одной стадии окрашивания.
ПРИМЕЧАНИЕ: Чтобы получить сильный сигнал с минимальным фоном, оптимизируйте концентрацию антител. Антитело CCR7 использовали в конечной концентрации 10 мкг/мл, а антитело CD209 разбавляли в 1/400.
- Проведите процедуру иммунофлюоресценции с использованием двойного окрашивания для изучения экспрессии CCR7 и CD209 в одном образце. Для этого объедините первичные антитела, полученные от разных видов (мышей и кроликов) на одной стадии окрашивания.
- Удалите первичные антитела и промойте 3 раза 400 мкл буфера для промывки.
- Добавьте меченные флуорофорами вторичные антитела, разведенные в окрашивающем буфере, и инкубируйте в течение 1 ч при ЛТ в темноте.
ПРИМЕЧАНИЕ: Концентрация вторичных антител должна быть оптимизирована для получения максимальных специфических сигналов с минимальным фоном. В данном исследовании для окрашивания использовали вторичные антитела в концентрации 5 мкг/мл. - После удаления надосадочной жидкости промойте образцы три раза в буфере для промывки по 3 мин каждый.
- Добавьте 10 μM DRAQ5 в PBS и инкубируйте в течение 15 минут при RT в защищенном от света месте.
- Удалите надосадочную жидкость и промойте диски один раз в PBS.
- Удалите оставшуюся PBS и добавьте 1 каплю монтажной среды.
- Через 5 минут наденьте покровные стекла и дайте образцам высохнуть в течение 1 часа.
- После высыхания образцов заклейте края прозрачным лаком для ногтей и храните их при температуре 4 °C в темноте до создания образа.
- Чтобы получить обзор клеток, визуализируйте образцы с 25-кратным увеличением. Для дальнейшего определения структуры и локализации поверхностных маркеров получите изображения с 63-кратным увеличением.
- Количественно оцените интенсивность флуоресценции CCR7 и CD209 с помощью программного обеспечения ImageJ.
ПРИМЕЧАНИЕ: Получение изображения было выполнено с помощью фотоумножителя (ФЭУ) с использованием системы CLSM, которая была оснащена аргоновым лазером (488 нм), лазером DPSS (561 нм) и гелий-неоновым лазером (633 нм).
5. Характеристика поляризованных макрофагов с помощью qRT-PCR
Примечание: Для выделения РНК использовали два диска на образец, чтобы получить достаточное количество РНК для синтеза кДНК.
- Промойте диски 2 раза 800 мкл PBS.
- Добавьте 350 мкл буфера для лизиса в первый диск и лизируйте клетки путем пипетирования вверх и вниз.
- Перенесите лизат на второй диск и повторите процесс лизирования.
- Добавьте в лизат 350 μл 70% этанола и пипеткой вверх и вниз до однородности.
- Перенесите лизат в спиновую колонку и следуйте инструкциям производителя по выделению РНК.
- Количественно определите количество РНК с помощью нанокапли или другого устройства.
- Нормализуйте концентрации РНК для различных образцов и синтезируйте кДНК в соответствии с инструкциями производителя с помощью системы ОТ-ПЦР для синтеза кДНК первой цепи.
- Синтезируйте кДНК с использованием 350 нг РНК в соответствии с протоколом производителя и храните ее при температуре -20 °C до проведения анализа qRT-PCR.
Примечание: Здесь для синтеза кДНК использовали 350 нг очищенной РНК с использованием 4 мкл RT Mix (5x) в 20 мкл. - Проведите qRT-PCR на системе ПЦР в реальном времени в 96-луночных планшетах и отдельных реакциях объемом 15 мкл (1x Syber green master mix, 0,2 мкМ прямых и обратных праймеров и 4,5 мкл 1:10 разбавленной кДНК).
ПРИМЕЧАНИЕ: Программа ПЦР начинается с нагрева крышки (105 °C), за которой следуют три этапа: первоначальная денатурация при 95 °C в течение 3 минут, затем 15 с при 95 °C и 30 с при 55 °C в течение 40 циклов. - Нормализуйте уровни экспрессии различных генов хозяйственного гена GAPDH (или других хозяйственных генов, таких как β-актин).
- Рассчитайте относительную экспрессию генов с помощью метода 2−ΔΔCt , взяв за образец клетки M0, культивируемые на покровных стеклах для тканевых культур. В таблице 2 перечислены все праймеры, использованные в данном исследовании.
6. Статистический анализ
- Представьте все данные в виде среднего значения ± SEM. Повторите все анализы (в этом исследовании анализы повторялись пять раз) для обеспечения воспроизводимости. Оцените статистически значимые различия между нормально распределенными данными с помощью одностороннего дисперсионного анализа (ANOVA) с последующим множественным тестом Тьюки.
- Используйте тест Фридмана и тест множественного сравнения Данна для анализа непараметрических наборов данных. Используйте соответствующее программное обеспечение для анализа данных для анализа данных и определите статистическую значимость как p-значение менее 0,05.
Результаты
Результаты данного исследования демонстрируют успешную дифференцировку и поляризацию МДМ на титановых поверхностях с последующей характеризацией поляризованных макрофагов М1 или М2. На первом этапе мы охарактеризовали поляризованные МДМ с помощью CLSM. Основываясь на наших предварительных исследованиях, CD209 и CCR7 были использованы в качестве специфических маркеров для дифференциации M1 от M2 поляризованных MDM. Как показано на рисунках 2A, B, MDM успешно поляризуются в макрофаги M1 и M2. На поверхности титана CCR7 экспрессировался сильнее в поляризованных макрофагах M1, чем CD209, экспрессируясь специфически в поляризованных макрофагах M2. Кроме того, количественная оценка относительной интенсивности флуоресценции облегчила присвоение маркеров подтипам M1 или M2 (рис. 2C).
На рисунке 3 представлен репрезентативный анализ МДМ с помощью qRT-PCR на титановых и покровных поверхностях. Результаты показали, что MDM на обеих поверхностях были успешно поляризованы, о чем свидетельствует высокая экспрессия поляризационных маркеров M1 (CCR7 и TNF-ɑ) и M2 (CD209 и CCL13). Это было дополнительно подтверждено на уровне белка путем наблюдения высоких уровней воспалительных цитокинов TNF-α (рисунок 4A) и хемокинов IL-13 (рисунок 4B) в поляризованных клетках M1 и M2 соответственно.
Рисунок 1: Схематическое изображение протокола. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Определение характеристик поляризованных MDM с помощью CLSM. Обогащение поляризованных макрофагов M1 и M2 было подтверждено окрашиванием специфическими антителами и CLSM-анализом с использованием антител CCR7 и CD209 на 2-е сутки после посева. Согласно флуоресцентному окрашиванию и анализу CLSM, (A) 25-кратное увеличение и (B) 63-кратное увеличение, клетки M1 экспрессировали более высокий CCR7 (зеленым цветом), чем M0 или M2. Клетки M2 демонстрируют значительный паттерн экспрессии CD209 (выделен зеленым цветом). (C) Количественный анализ относительной интенсивности флуоресценции CCR7 и CD209. Ядра окрашивали DRAQ5 (фиолетовым цветом). Результаты являются репрезентативными для 5 аналогичных экспериментов, проведенных независимо друг от друга. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Характеристика поляризованных MDM с использованием профилей экспрессии генов. Количественная полимераза обратной транскрипции была использована для изучения уровней мРНК различных генов, ассоциированных с поляризацией M1 (CCR7 и TNF-ɑ) и M2 (CD209 и CCL13). В качестве гена домашнего хозяйства использовался GAPDH. Данные представлены в виде среднего значения ± SEM (n = 5). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
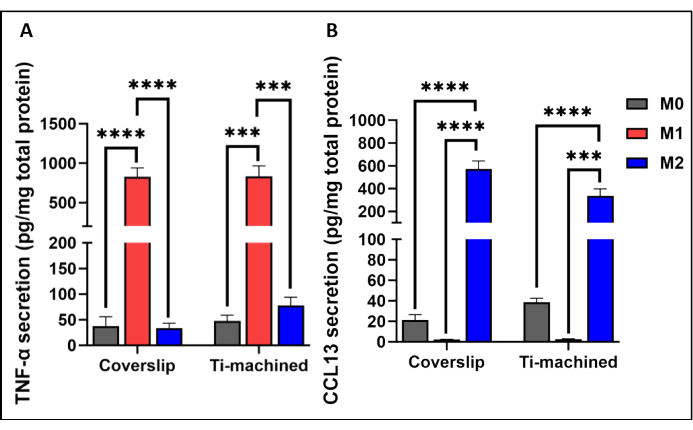
Рисунок 4: Продукция цитокинов макрофагами M0, M1 и M2, культивируемыми на титановых и пластиковых покровных стеклах. (A) уровень цитокинов TNF-ɑ и (B) уровни CCL13 в надосадочной жидкости клеточных культур измеряли с помощью иммуноферментного анализа. Секреция цитокинов нормализовалась до общей секреции белка, измеренной с помощью анализа БЦА. Гистограммы представляют среднее значение ± SEM (n = 5). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Буфер/раствор | Содержание |
| Буфер для окрашивания/блокировки | PBS + 1% BSA + 0,1% Tween 20 |
| Буфер для промывки | PBS + 0,1% Твин 20 |
| Фиксирующий буфер | 3% параформальдегида (PFA) в PBS |
| Буфер хранения | 1% пенициллина и стрептомицина в PBS |
Таблица 1: Список буферов.
| Название грунтовки | Последовательности прямых праймеров | Обратные последовательности праймеров |
| ГАПДХ | 5'-GAGTCAACGGATTTGGTCGT-3' | 5'-TTGATTTTGGAGGGATCTCG-3' |
| ККР7 | 5'- TGGTGATCGGCTTTCTGGTC-3' | 5'- CACCTTGATGGCCTTTGC-3' |
| СД209 | 5'- GGAGCAGAACTTCCTACAGC-3' | 5'- CAACGTTGTTGGGCTCTCCT-3' |
| ССЛ13 | 5'-ATCTCCTTGCAGAGGCTGAA-3' | 5'-ACTTCCTTTGGGTCAGCA-3' |
| ФНО-ɑ | 5'- GCTGCACTTTGGAGTGATCG-3' | 5'- TCACTCGGGGTTCGAGAAGA-3' |
Таблица 2. Последовательности праймеров, используемых в qRT-PCR.
Обсуждение
Глубокое понимание поведения макрофагов имеет важное значение для понимания иммуномодулирующих свойств имплантируемых материалов. В нескольких исследованиях сообщалось о гетерогенных маркерах, различных моделях клеток и протоколах для характеристики поляризации макрофагов in vitro 17,18,19,20. Для повышения воспроизводимости, надежности и сопоставимости экспериментальных результатов необходимы стандартизированные и верифицированные протоколы, а также подходящая модель клетки и маркеры консенсусных характеристик. Соответственно, точное моделирование иммуномодулирующих свойств материалов имплантатов требует, прежде всего, правильной клеточной модели. В различных исследованиях использовался широкий спектр клеточных моделей, таких как изолированные тканевые макрофаги, дифференцированные макрофаги, полученные из моноцитов крови, и иммортализированные моноцитарные клеточные линии. Несмотря на то, что тканевые изолированные макрофаги можно считать более репрезентативными для условий in vivo, они являются технически и этически сложными21,22. Макрофаги также часто получают из установленных иммортализованных моноцитарных клеточных линий, таких как клетки THP1 23,24,25,26. В то время как эти клетки могут обеспечивать большую гомогенность клеточного ответа в качестве неограниченного источника нестареющих клеток, они обычно получают от пациентов с гематологическими новообразованиями, и их реакция может значительно отличаться от нормальных клеток. Например, сообщалось, что моноцитарные клетки THP1 более чувствительны к симуляциям M1 и с большей вероятностью проявляютхарактеристики M1. Результаты этого исследования согласуются с результатами нашего предварительного исследования (данные здесь не представлены).
Кроме того, поскольку моноциты, полученные из крови, считаются предшественниками тканевых резидентных макрофагов и могут быть легко получены в более высоких дозах, они могут быть реальной альтернативой макрофагам 27,28,29. Основываясь на нашем исследовании с использованием макрофагов, полученных из моноцитов крови, мы обнаружили, что эти клетки одинаково чувствительны к стимуляторам M1 и M2 как на титановых, так и на обработанных клеточными культурами покровных стеклах. Кроме того, они продемонстрировали несколько маркеров консенсуса M1 и M2, некоторые из которых показаны в репрезентативных результатах. Результаты показали, что MDM могут быть использованы в качестве возможной модели in vitro для моделирования взаимодействия имплантата и макрофага.
Для дальнейшего прогресса в исследованиях иммуномодуляции необходимы маркеры постоянных и специфических характеристик. В исследованиях были введены различные маркеры для характеристики макрофагов, которые различаются не только между макрофагами из разных источников, но и между макрофагами из одного и того же источника 17,18,19,24. Панель маркеров M1 и M2, характерных для MDM, была определена и верифицирована путем оценки различных зарегистрированных маркеров. Некоторые из наиболее важных ключевых маркеров представлены в этой статье.
Определение наиболее подходящих методов обнаружения также является важной частью процесса оценки. Методы анализа, обычно используемые для оценки маркеров клеточной поверхности, обычно требуют удаления клеток из биоматериалов. Тем не менее, было замечено, что этот процесс оказывает негативное воздействие на клетки, повреждая их поверхностные маркеры и приводя к низкому количеству отделенныхклеток30. Следовательно, проточная цитометрия, которая требует отделения клеток, не подходит для оценки макрофагов, которые плотно прикреплены к имплантатам. В этом исследовании обнаружение маркеров клеточной поверхности проводилось с помощью CLSM. Используя соответствующие маркеры и оптимизируя процесс окрашивания, мы смогли успешно охарактеризовать подтипы M1 и M2 в сравнении друг с другом и с клетками M0. Важно отметить, что флуоресцентное окрашивание является полуколичественным, что является одним из его ограничений. Это может усложнить оценку клеток с использованием маркеров, экспрессированных по всем подтипам без существенных различий. CCR7 и CD209 были выбраны после тестирования различных маркеров для характеристики MDM с помощью CLSM. CCR7 и CD209 были стабильно более экспрессированы в подтипах M1 и M2 соответственно.
Несмотря на ограничения данного исследования, результаты подчеркивают полезность и эффективность реализованных протоколов в поляризации макрофагов на поверхностях имплантатов и их точную характеристику с точки зрения экспрессии генов, секретируемых белков и маркеров клеточной поверхности. Кроме того, анализ описанных маркеров выявил последовательные и специфические паттерны экспрессии, которые могут быть использованы для различения различных подтипов МДМ. Эта модель in vitro, однако, не полностью отражает фенотипическое разнообразие и пластичность макрофагов человека. В настоящее время идентифицируется несколько подтипов макрофагов (M2a, M2b, M2c, M2d), что указывает на необходимость более разнообразных моделей in vitro для изучения того, как различные биоматериалы и их характеристики (например, физико-химические свойства) влияют на пластичность и поляризацию макрофагов31,32. Несмотря на то, что невозможно отразить сложную ситуацию in vivo с помощью моделей in vitro, многие результаты могут быть получены с использованием представленного протокола in vitro для эффективного описания иммуномодулирующего потенциала новых имплантируемыхбиоматериалов. И последнее, но не менее важное: необходимы дальнейшие исследования для характеристики макрофагов в более сложных моделях in vitro или in vivo, включающих роль других участников в сложных физиологических контекстах. В целом, данное исследование будет способствовать разработке и конструированию иммуномодулирующих биоматериалов для улучшения и содействия благоприятным процессам регенерации тканей и успешной интеграции имплантатов, а также для предотвращения хронического воспаления, ассоциированного с имплантатами.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Диски были любезно предоставлены компанией Medentis Medical, Бад-Нойенар-Арвайлер, Германия. Авторы выражают признательность за поддержку со стороны отделения челюстно-лицевой хирургии (университетская клиника Тюбингена).
Материалы
| Name | Company | Catalog Number | Comments |
| 24-well plate, not-treated | Corning Incorporated (Kennebunk, USA) | 144530 | |
| Absorbance reader Infinite F50 | TECAN Austria GmbH (Grödig, Austria) | TCAT91000001 | |
| Accutase in DPBS, 0.5 mM EDTA | EMD Millipore Corp. (Burlington, USA) | SCR005 | |
| Anti-Fade Fluorescence Mounting Medium -Aqueous, Fluoroshield | abcam (Cambridge, UK) | ab104135 | |
| Bio-Rad MJ Research PTC-200 Peltier Thermal Cycler | Bio-Rad / MJ Research | 7212 | |
| Bovine serum albumin (BSA) | VWR International bvba (Leuven, Belgium) | 422361V | |
| Centrifuge 5804 R | Eppendorf SE (Hamburg, Germany) | 5804 R | |
| DC-SIGN (D7F5C) XP Rabbit mAb | Cell Signaling Technology | 13193 | |
| Dimethyl sulfoxide | Sigma Aldrich Co. (St.Louis, MO, USA) | D2438-5X10ML | |
| DRAQ5 Staining Solution | Milteny Biotec (Bergisch Gladbach, Germany) | 130-117-344 | |
| Ethanol ≥99.8% for molecularbiology | Carl Roth GmbH + CO. KG (Karlsruhe, Germany) | 1HPH.1 | |
| Goat Anti-Mouse IgG (H&L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | Invitrogen | A32723TR | |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Cyanine3 | Invitrogen | A10520 | |
| GraphPad Prism | GraphPad | Version 9.4.1 | |
| Human CCR7 Antibody | R&D Systems | MAB197 | |
| Human IFN-gamma Recombinant | Invitrogen (Rockford, USA) | RIFNG100 | |
| Human IL-13 | Milteny Biotec (Bergisch Gladbach, Germany) | 5230901032 | |
| Human IL-4 | Milteny Biotec (Bergisch Gladbach, Germany) | 130-095-373 | |
| Human M-CSF | Peprotech (Cranbury, USA) | 300-25 | |
| Leica TCS SP5 | Leica Microsystems CMS GmbH (Mannheim, Germany) | https://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp5/ | |
| Lipopolysaccharides from Escherichia | Sigma Aldrich Co. (Missouri, USA) | L4391-1MG | |
| Luna Universal qPCR Master Mix | New England Biolabs | NEB #M3003 | |
| LunaScript RT SuperMix Kit | New England Biolabs | E3010L | |
| Lymphocyte Separation Medium 1077 | PromoCell (Heidelberg, Germany) | C-44010 | |
| MCP-4/CCL13 Human ELISA Kit | Invitrogen | EHCCL13 | |
| MicroAmp Fast 96-Well Reaction Plate (0.1 mL) | Applied Biosystems (Waltham, USA) | 4346907 | |
| MicroAmp Optical Adhesive Film | Life Technologies Corporation (Carlsbad, USA) | 4311971 | |
| MicroAmp Splash Free 96-Well Base | Applied Biosystems (Waltham, USA) | 4312063 | |
| Microlitercentrifuge CD-3124R | Phoenix Instrument (Germany) | 9013111121 | |
| Microscope Cover Glasses, 10 mm | Carl Roth GmbH, Karlsruhe, Germany | 4HX4.1 | |
| Monocyte Attachment Medium | PromoCell (Heidelberg, Germany) | C-28051 | |
| Multiply-Pro Gefäß 0.5 mL, PP | Sarstedt AG & CO (Nümbrecht, Germany) | 7,27,35,100 | |
| Nanodrop One | Thermo Scientific (USA) | ND-ONE-W | |
| QuantStudio 3 System | Life Technologies GmbH (St. Leon-Rot, Germany) | A28567 | |
| RNeasy Micro Kit | Qiagen | 74007 | |
| RPMI 1640, 1x, with L-glutamine | Mediatech, Inc. (Manassas, USA) | 10-040-CV | |
| Sterile bench, LaminarAir HB 2472 | Heraeus instruments (Hanau, Germany) | 51012197 | |
| Tissue Culture Coverslips 13 mm (Plastic) | Sarstedt Inc. (Newton, USA) | 83,18,40,002 | |
| Titanium machinied discs 12 cm | Medentis Medical (Bad-Neuenahr-Ahrweiler, Germany) | N/A | |
| TNF alpha Human ELISA Kit | Invitrogen | KHC3011 | |
| Trypan blue solution 0.4% | Carl Roth GmbH + Co. KG (Karlsruhe, Germany) | 1680.1 |
Ссылки
- Othman, Z., Pastor, B. C., van Rijt, S., Habibovic, P. Understanding interactions between biomaterials and biological systems using proteomics. Biomaterials. 167, 191-204 (2018).
- Ikada, Y. Challenges in tissue engineering. J R Soc Interface. 3 (10), 589-601 (2006).
- Aamodt, J. M., Grainger, D. W. Extracellular matrix-based biomaterial scaffolds and the host response. Biomaterials. 86, 68-82 (2016).
- Batool, F., et al. Modulation of immune-inflammatory responses through surface modifications of biomaterials to promote bone healing and regeneration. J Tissue Eng. 12, 20417314211041428 (2021).
- Mantovani, A., Biswas, S. K., Galdiero, M. R., Sica, A., Locati, M. Macrophage plasticity and polarization in tissue repair and remodelling. J Pathol. 229 (2), 176-185 (2013).
- Shrivastava, R., Shukla, N. Attributes of alternatively activated (M2) macrophages. Life Sci. 224, 222-231 (2019).
- Gordon, S., Taylor, P. R. Monocyte and macrophage heterogeneity. Nat Rev Immunol. 5 (12), 953-964 (2005).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. 8 (12), 958-969 (2008).
- Murray, P. J., et al. Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity. 41 (1), 14-20 (2014).
- Kzhyshkowska, J., et al. Macrophage responses to implants: prospects for personalized medicine. J Leukoc Biol. 98 (6), 953-962 (2015).
- Browne, S., Pandit, A. Biomaterial-mediated modification of the local inflammatory environment. Front Bioeng Biotechnol. 3, 67 (2015).
- Piatnitskaia, S., et al. Modelling of macrophage responses to biomaterials in vitro: state-of-the-art and the need for the improvement. Front Immunol. 15, 1349461 (2024).
- Rayahin, J. E., Gemeinhart, R. A. Activation of macrophages in response to biomaterials. Results Probl Cell Differ. 62, 317-351 (2017).
- Murray, P. J. Macrophage polarization. Annu Rev Physiol. 79, 541-566 (2017).
- Gordon, S., Pluddemann, A. Tissue macrophages: heterogeneity and functions. BMC Biol. 15 (1), 53 (2017).
- Salma Iqbal, A. K. Characterization of in vitro generated human polarized macrophages. J Clin Cell Immunol. 6, 1-8 (2015).
- Hotchkiss, K. M., et al. Titanium surface characteristics, including topography and wettability, alter macrophage activation. Acta Biomater. 31, 425-434 (2016).
- Wang, Y., Zhang, Y., Sculean, A., Bosshardt, D. D., Miron, R. J. Macrophage behavior and interplay with gingival fibroblasts cultured on six commercially available titanium, zirconium, and titanium-zirconium dental implants. Clin Oral Investig. 23 (8), 3219-3227 (2019).
- Abaricia, J. O., Shah, A. H., Ruzga, M. N., Olivares-Navarrete, R. Surface characteristics on commercial dental implants differentially activate macrophages in vitro and in vivo. Clin Oral Implants Res. 32 (4), 487-497 (2021).
- Lu, W., et al. Improved osseointegration of strontium-modified titanium implants by regulating angiogenesis and macrophage polarization. Biomater Sci. 10 (9), 2198-2214 (2022).
- Murray, P. J., Wynn, T. A. Obstacles and opportunities for understanding macrophage polarization. J Leukoc Biol. 89 (4), 557-563 (2011).
- Nascimento, C. R., Fernandes, N. A. R., Maldonado, L. A. G., Junior, C. R. Comparison of monocytic cell lines U937 and THP-1 as macrophage models for in vitro studies. Biochem Biophys Rep. 32, 101383 (2022).
- Freytes, D. O., Kang, J. W., Marcos-Campos, I., Vunjak-Novakovic, G. Macrophages modulate the viability and growth of human mesenchymal stem cells. J Cell Biochem. 114 (1), 220-229 (2013).
- Zhang, Y., et al. Macrophage type modulates osteogenic differentiation of adipose tissue MSCs. Cell Tissue Res. 369 (2), 273-286 (2017).
- Cerqueira, A., et al. Evaluation of the inflammatory responses to sol-gel coatings with distinct biocompatibility levels. J Biomed Mater Res A. 109 (9), 1539-1548 (2021).
- Zhang, Y., Cheng, X., Jansen, J. A., Yang, F., van den Beucken, J. J. Titanium surfaces characteristics modulate macrophage polarization. Mater Sci Eng C Mater Biol Appl. 95, 143-151 (2019).
- Nobs, S. P., Kopf, M. Tissue-resident macrophages: guardians of organ homeostasis. Trends Immunol. 42 (6), 495-507 (2021).
- Sreejit, G., Fleetwood, A., Murphy, A., Nagareddy, P. Origins and diversity of macrophages in health and disease. Clin Transl Immunology. 9 (12), e1222 (2020).
- Parisi, L., et al. Preparation of human primary macrophages to study the polarization from monocyte-derived macrophages to pro-or anti-inflammatory macrophages at biomaterial interface in vitro. J Dent Sci. 18 (4), 1630-1637 (2023).
- Feuerer, N., et al. Macrophage retrieval from 3D biomaterials: A detailed comparison of common dissociation methods. J Immunol Regen Med. 11, 100035 (2021).
- Shapouri-Moghaddam, A., et al. Macrophage plasticity, polarization, and function in health and disease. J Cell Physiol. 233 (9), 6425-6440 (2018).
- Sridharan, R., Cameron, A. R., Kelly, D. J., Kearney, C. J., O'Brien, F. J. Biomaterial based modulation of macrophage polarization: a review and suggested design principles. Mater Today. 18 (6), 313-325 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены