Method Article
Semoreuin ve lipopolisakkarit intraperitoneal enjeksiyonunun bir kombinasyonu ile şiddetli akut pankreatitin bir fare modelinin hazırlanması
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
İntraperitoneal ilaç uygulaması, pankreas hasarını indüklemek için güvenli ve etkili bir non-invaziv yaklaşımdır. Bu çalışma, değişen derecelerde pankreas hasarını indüklemek için fareler üzerinde beş farklı intraperitoneal enjeksiyon protokolünü karşılaştırdı ve şiddetli akut pankreatit (SAP) için patolojik değişiklikleri ve tedavi stratejilerini araştırmak için bir ciddi pankreas hasarı modeli oluşturdu.
Özet
Yüksek mortalite oranlarına sahip şiddetli akut pankreatitin (SAP) tedavisi önemli bir klinik zorluk teşkil etmektedir. Hayvan modelleri kullanılarak SAP ile ilişkili patolojik değişikliklerin araştırılması, potansiyel terapötik hedeflerin belirlenmesine ve yeni tedavi yaklaşımlarının araştırılmasına yardımcı olabilir. Önceki çalışmalar öncelikle sodyum taviaurokolatın retrograd safra kanalı enjeksiyonu yoluyla pankreas hasarına neden olmuştur, ancak cerrahi hasarın hayvan modelinin kalitesi üzerindeki etkisi belirsizliğini korumaktadır. Bu çalışmada, C57BL / 6J farelerinde pankreas hasarını indüklemek için farklı dozlarda LPS ile birlikte çeşitli intraperitoneal Caerulein enjeksiyonları kullandık ve beş intraperitoneal enjeksiyon protokolünde yaralanma derecesini karşılaştırdık. Farelerde akut pankreatitin indüklenmesi ile ilgili olarak, 5 gün içinde% 80 gibi yüksek bir mortalite oranıyla sonuçlanan bir intraperitoneal enjeksiyon protokolü önerilmektedir. Spesifik olarak, farelere on günlük intraperitoneal Caerulein enjeksiyonu (50 μg / kg) verildi, ardından son Caerulein uygulamasından bir saat sonra bir LPS (15 mg / kg) enjeksiyonu yapıldı. Enjekte edilen ilaçların sıklığını ve dozajını ayarlayarak, pankreas hasarının ciddiyetini etkili bir şekilde manipüle edebilirsiniz. Bu model, güçlü kontrol edilebilirlik sergiler ve kısa bir çoğaltma döngüsüne sahiptir, bu da pahalı ekipman gerektirmeden tek bir araştırmacı tarafından tamamlanmasını mümkün kılar. İnsan SAP'sinde gözlemlenen temel hastalık özelliklerini uygun ve doğru bir şekilde simüle ederken, yüksek derecede tekrarlanabilirlik gösterir.
Giriş
Şiddetli akut pankreatit, sindirim sistemi hastalığı alanında hızlı başlangıç, hızlı ilerleme ve yüksek mortalite oranları ile karakterizedir1. Yüksek ölüm oranı her zaman klinik araştırmaların önemli bir odak noktası olmuştur. Klinik koşullardaki öngörülemeyen değişiklikler, hastalık belirtilerinin heterojenliği ve insan örneklerinin sınırlı mevcudiyeti nedeniyle, hayvan modellerinin oluşturulması hastalık araştırmaları için giderek daha önemli hale gelmiştir.
Sodyum taurokolatın ortak safra kanalına retrograd enjeksiyonu, SAP2'nin bir sıçan modelini oluşturmak için yaygın olarak kullanılır. Pankreatikobiliyer obstrüksiyonu simüle ederek ve safra ve pankreas sıvısının reflüsünü indükleyerek, bu modelleme tekniği SAP hayvan modellerinin çoğaltılmasında yüksek bir başarı oranı sergiler. Bununla birlikte, invaziv cerrahinin hayvan modelinin kendisi üzerinde bir etkisi olduğu unutulmamalıdır. Ayrıca, bu yöntem, öncelikle deney denekleri olarak kullanılan fareler ve köpekler gibi daha büyük hayvanlarla sınırlıdır. Duodenal entübasyon3, direkt duodenal ponksiyon4 ve safra kanalı-pankreas kanalının5 direkt delinmesi gibi alternatif teknikler modelleme amacıyla sıklıkla kullanılmaktadır.
İntraperitoneal enjeksiyon ve diyet modelleme yöntemleri, her büyüklükteki hayvana uygulanabilen non-invaziv avantajlar sunar. Kolin eksikliği olan etiyonin (CDE)6 ile beslenen SAP'nin fare modeli, kötü kontrol edilebilen hiperglisemi ve hipokalsemi gibi bazı komplikasyonlar sunar ve bu da onu yeni tanı ve tedavi yaklaşımlarını değerlendirmek için uygun hale getirmez. Öte yandan, L-arginin7 ile kombine edilen Caerulein'in intraperitoneal enjeksiyonu, farelerde akut pankreatiti indüklemek için en yaygın kullanılan yöntemi temsil eder. Spesifik olarak, bir kolesistokinin analoğu olan Caerulein'in tekrarlanan intraperitoneal uygulaması, patogenez, inflamasyon ve rejenerasyon süreçleri dahil olmak üzere bu yıkıcı hastalıkla ilgili çeşitli yönleri araştırmak için oldukça uygun bir yaklaşım sağlar. Kolesistokinin (CCK) ile yapısal benzerliği nedeniyle, Caerulein safra kesesi kasılmasını ve pankreas enzim salgılanmasını etkili bir şekilde uyarır, bu da enzim salgılanmasında bir dengesizliğe ve ardından kendi kendini yok etmeye yol açar8. Lipopolisakkarit (LPS), her yerde bulunan ve patojenle ilişkili bir moleküler model molekülü olarak kapsamlı bir şekilde incelenen, etkili bir SAP fare modeli oluşturmak için intraperitoneal enjeksiyon yoluyla Caerulein ile birleştirilebilir. Bu kombinasyon, önemli sayıda inflamatuar sitokini hızla tetikler ve serbest bırakır, bu da aşırı lokal ve sistemik inflamasyona neden olur. Birkaç çalışma, LPS ile kombine edilmiş Caerulein'in intraperitoneal enjeksiyonu yoluyla farelerde SAP modellerinin indüksiyonunu bildirmiştir. Bu, Caerulein'in intraperitoneal enjeksiyonunun farelerde pankreas ödemi ve kanamaya neden olabileceği gerçeğine bağlanabilirken, LPS ilavesi hemen pankreas nekrozunu indükleyebilir ve sistemik inflamatuar yanıtı, sepsisi ve hatta organ yetmezliğini şiddetlendirebilir. Şu anda, intraperitoneal Caerulein enjeksiyonlarının dozajında ve sıklığında farklılıklar ve ek LPS dozajında tutarsızlık vardır. Fare SAP modellerinde tutarlılık elde etmek zordur 9,10,11,12; Bu nedenle, ideal bir model elde etmek için standart bir protokol oluşturmak gerekir. Bu yazıda, farelerde intraperitoneal enjeksiyon için bir protokol açıklıyoruz ve optimal enjeksiyon sıklığını ve ek LPS dozunu araştırıyoruz.
Protokol
Bu protokol, Anhui Bilim ve Teknoloji Üniversitesi (Huainan, Çin) Birinci Bağlı Hastanesi Etik Kurulu tarafından gözden geçirilmiş ve onaylanmıştır (Etik Kodu: 2023-KY-905-001). Çalışma, tüm hayvan prosedürlerinde araştırma kemirgenlerinin bakımı ve kullanımı için Ulusal Sağlık Enstitüleri yönergelerini takip etti. Bu çalışma için 20-30 g ağırlığındaki C57BL/6J yetişkin fareler kullanıldı. Fareler, kontrollü koşullar altında (12 saatlik alternatif gündüz-gece döngüsü ile yaklaşık 21 ° C) bir hafta boyunca bir hayvan laboratuvarında barındırıldı. Farelerin boyunca yiyecek ve suya ad libitum erişimi vardı. Çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. Hayvan hazırlama
- Kontrol grubu, Pankreas hasarı (PI) I, PI II, PI III, PI IV ve PI V dahil olmak üzere altı gruba 84 sağlıklı C57BL / 6J faresi atayın.
- Modelleme prosedürünü başlatmadan önce, her bir fare grubunu kulak çentikleriyle etiketleyin ve 12 saat oruç tutmalarına izin verin.
2. İndüklenmiş ilaç seyrelticinin hazırlanması
- Caerulein'i (1 mg) 1 mL PBS'ye çözün ve -20 ° C'de soğutun.
- İlacın intraperitoneal enjeksiyonundan 1 saat önce deneysel farelerin ağırlığını ölçün ve kaydedin.
- Tüm farelerin toplam ağırlığına bağlı olarak 50 μg / kg oranında gereken toplam Caerulein kütlesini çıkarın.
- Elde edilen Caerulein ilacını tekrar PBS ile seyreltin.
NOT: PBS seyreltmesinin toplam hacmi, tüm farelerin toplam ağırlık değerinin 5 katına eşdeğer olmalıdır. LPS seyreltici elde etmek için aynı seyreltme yöntemi kullanıldı.
3. İntraperitoneal enjeksiyon
NOT: Modeli indüklemek için Ek Tablo 1'de belirtilen protokole göre her bir fare grubuna intraperitoneal enjeksiyonlar uygulandı. Ek bir 10 fare gruplandırıldı ve 7 günlük sağkalım oranlarını gözlemleyerek tedavi edildi.
- Şırıngayı yerleştirirken organlara zarar vermemek için fareleri, farelerin göbeği yukarı bakacak ve baş kısmı kuyruktan daha aşağıda olacak şekilde tutun ve tutun.
- % 75 alkollü pamuk topları kullanarak farelerin karnını dezenfekte edin.
- Şırıngayı sağ elinizde tutun (≤0.5 / ≥0.3 ölçülerinde bir iğne kullanarak) ve iğneyi karın beyaz çizgisinin sol tarafındaki deri altı derisine yerleştirin.
NOT: Bir sonraki enjeksiyon için sağ tarafa geçin. - İğne deri altı tabakasına ulaştığında, yaklaşık 3-5 mm ileri hareket ettirin ve ardından şırınga iğnesini karın boşluğuna 45 ° 'lik bir açıyla yerleştirin. Bu noktada, kişi biraz direnç hissetmelidir.
- İğneyi sabit tutun ve maddeyi yavaşça enjekte edin.
NOT: Tek bir intraperitoneal enjeksiyonun hacmi olarak farelerin ağırlık değerinin 5 katını aşmayın. - Enjeksiyondan sonra, iğneyi dışarı çekin ve ilacı farelerin karın boşluğuna tamamen yaymak için enjeksiyon bölgesine steril bir pamuklu çubukla hafifçe masaj yapın ve bastırın.
- Bir sonraki deneysel farelerle tekrarlamak için yeni bir şırınga kullanın.
4. Açık alan davranışsal yetenek testi
NOT: Son intraperitoneal enjeksiyondan 12 saat sonra, farelerin toplam aktivite mesafesini ve hareketsizlik süresini değerlendirmek için açık alan davranışsal yetenek testi yapılmıştır.
- Dört adet aynı beyaz kutuyu doğrudan kameranın altına yerleştirin.
- Kamerayı bir video kablosu kullanarak bilgisayara bağlayın.
- Deneye başlamadan önce deney kutusunun temiz olduğundan ve herhangi bir koku içermediğinden emin olun.
- Hayvanı ızgaranın ortasına, deneyciden uzağa bakacak şekilde yerleştirin ve 10 dakika boyunca çevreye uyum sağlamasına izin verin.
- Video izleme yazılımını başlatın ve yeni bir deney oluşturmak için Dosya menüsüne tıklayın.
- İzlemeyi aynı anda dört görüş alanı için ayarlayın.
- Gerçek zamanlı izleme ekranında kutu içinde hareket edebilen deney nesnesinin uzunluğunu × genişliğini işaretleyin (30 cm 30 cm).
- Kurulum tamamlandıktan sonra video gözetimine ve kayda başlayın.
- Farelerin aktivitesini 15 dakika boyunca kaydedin.
- Testten sonra, hayvanı ızgaradan çıkarın ve kafesine geri koyun. Klor dioksit içeren bir sterilant kullanarak ızgarayı iyice temizleyin.
5. Farelerin periferik kanının toplanması ve test edilmesi
- Farelere ötenazi yapın (kurumsal olarak onaylanmış protokolü takip edin).
- İntraperitoneal enjeksiyondan 36 saat sonra deneysel farelerde ötenazi yapın. Ötenaziden önce farelerin vücut ağırlığını ölçün ve kaydedin.
NOT: İntraperitoneal olarak 0.18 mL% 10 kloral hidrat uygulayın, ayak parmağının veya kuyruğun uyarılmasına reaksiyon göstermemesini sağlayın. - Sol elinizle fareleri sabitleyin ve sağ elinizle farelerin bir tarafındaki bıyıkları kesmek için makası tutun.
- Göz küresinin tıkanmasına ve çıkıntısına neden olmak için göz çevresindeki cilde hafifçe bastırın.
- Göz küresini kavramak için kavisli forseps kullanın ve periferik kanı bir mikrosantrifüj tüpünde toplayarak hızlı bir şekilde çıkarın.
NOT: Biri antikoagülan içeren ve diğeri içermeyen iki farklı tipte mikrosantrifüj tüpü kullanılmıştır. - Aynı anda, kalbin pompalama hızını artırmak için sol elin orta parmağıyla farelerin kalp bölgesine hafifçe bastırın.
- İntraperitoneal enjeksiyondan 36 saat sonra deneysel farelerde ötenazi yapın. Ötenaziden önce farelerin vücut ağırlığını ölçün ve kaydedin.
- Periferik kanı antikoagülan olmadan oda sıcaklığında 30 dakika bekletin.
- Enzim hızı yöntemi ve enzim dolaşım yöntemi (üreticinin talimatlarını izleyerek) aracılığıyla otomatik bir biyokimyasal analizör kullanarak serum amilaz (Amy) ve lipaz (Lip) konsantrasyonlarını ölçün.
- Ticari bir kemilüminesans görüntüleyici kullanarak (üreticinin talimatlarını izleyerek) kemilüminesans yöntemini kullanarak plazmadaki Pro Kalsitonin (PCT) gibi enflamatuar göstergelerin seviyelerini belirleyin.
- Fare serumundaki HMGB-1, IL-6 ve TNF-α seviyelerini ölçmek için ELISA kitlerini kullanın (üreticinin talimatlarını izleyerek).
- İlgili parametreleri değerlendirmek için tam otomatik bir kan hücresi analizörü kullanarak antikoagülan ile tedavi edilen periferik kanı analiz edin.
6. Pankreas dokusunun toplanması ve parafin kesitinin hazırlanması
- Fareleri sırtüstü pozisyona getirin ve bir köpük tabağa sabitleyin.
- Bölgeyi tıraş edin ve dezenfekte edin, ardından abdominal medyan bir kesi yapın ve pankreası tamamen ortaya çıkarmak için ince bağırsak tüpünü sağa çevirin.
- Oniki parmak bağırsağı ve pilor kanalını ayırın ve ince bağırsağı pankreasın altına yerleştirin. Bağırsak kanalı boyunca pankreas dokusunu tamamen serbest bırakın.
- Dalağı sıkıştırmak için dişsiz forseps kullanın ve yavaşça yukarı doğru çekin.
NOT: Pankreas dokusuna doğrudan dokunmayın ve tüm ayrışma süreci boyunca aşırı güç kullanmaktan kaçının. - Arka pankreas ligament dokusunu pankreasın başına kadar keskin bir şekilde inceleyin ve safra kanalını ve kan damarlarını ayırın.
- Pankreas dokusunu çıkarın, yüzey nemini emici kağıtla kurulayın, tartın ve kaydedin.
- Pankreas dokusunun yarısını %4 paraformaldehit ile sabitleyin ve diğer yarısını -80 °C'de buzdolabında saklayın.
- Aşağıdaki adımları izleyerek pankreas parafin bölümlerini hazırlayın.
- Sabit pankreas dokusunu %75 alkol ile temizleyin ve yaklaşık 0,5 cm × 0,5 cm boyutunda kesin.
- Dokuyu 20 dakika boyunca %70 etanole, 20 dakika daha %80 etanole ve 15 dakika boyunca %90 etanole batırın.
- Dokuyu her seferinde 15 dakika boyunca% 95 etanol ile iki kez ve daha sonra her seferinde 5 dakika boyunca% 100 etanol ile iki kez tedavi edin.
- Dokuyu şeffaflık için ksilen çözeltisi ile 12 dakikalık ve 5 dakikalık iki tur tedaviye tabi tutun.
- Şeffaf dokuyu 1 saat boyunca 65 ° C'de bir balmumu tankında bekletin.
- Dokuyu erimiş parafine gömün ve soğumaya bırakın. Bir dilimleyici ile pankreas parafin bölümleri elde edin (kalınlık: 5 μm).
- Elde edilen parafin dilimlerini 45 °C suda düzleştirin, monte edin ve kurutun (pişirme koşulları: 14-16 saat boyunca 40 °C).
7. Hematoksilen ve Eozin (H & E) boyama
- Pankreas parafin bölümlerini 30 dakika ksilen I ve II'ye, ardından susuz, %95, %85 ve %75 alkole 5'er dakika ve ultra saf suya 5 dakika yerleştirin.
- Hücre çekirdeğini 160 saniye boyunca hematoksilen ile boyayın, ardından akan su ile yavaşça durulayın.
- 5-10 saniye boyunca bir hidroklorik asit alkol farklılaştırma çözeltisi uygulayın, ardından hızlı bir şekilde akan su ile durulayın.
- Bölümlere 5 dakika susuz alkol uygulayın.
- Sitoplazmayı eozin ile 30 saniye inkübe edin, ardından akan su ile durulayın.
- Bölümleri her biri 10 saniye boyunca %75, %85, %95 ve %100 etanole daldırın, ardından kurutmak için 5 dakika ksilen ile muamele edin.
- Son olarak, bölümleri nötr reçine ile kapatın ve mikroskop altında gözlemleyin.
- Patolojik skorlama ve standartlarıgerçekleştirir 13.
NOT: Ödem, asiner nekroz, kanama, kanama ve yağ nekrozu ve inflamatuar ve perivasküler inflamasyon gibi göstergelere dayanarak pankreatitin şiddetini belirleyin. 13 puanlama için daha önce yayımlanmış uygulama yönergelerini kullanın.
8. İmmünohistokimyasal boyama
- Pankreas dokusunun parafine gömülü bölümlerini ksilen içinde mumdan arındırın ve ardından bunları bir etanol çözeltileri gradyanında yeniden sulandırın.
- 30 dakikalık bir membran yırtılmasından sonra 20 dakika boyunca% 3 H2O2 kullanarak endojen enzim blokajı gerçekleştirin.
- Antikoru oda sıcaklığında% 5 sığır serumu ile 30 dakika bloke edin, daha sonra 1:1500 tavşan anti-HMGB1 seyreltimi ile gece boyunca 4 ° C'de inkübe edin.
- Bölümleri PBS ile durulayın, ardından 37 ° C'de 30 dakika boyunca karşılık gelen ikincil antikorlarda inkübe edin. Bundan sonra, DAB renk geliştirme, hematoksilen karşı boyama yapın ve nötr sakızla kapatın.
9. Pankreas kesitlerinde apoptozu tespit etmek için TUNEL yöntemi
- Pankreas parafin bölümlerini ksilen içinde 5 dakika mumdan arındırın, iki kez tekrarlayın ve gradyan etanol ile yıkayın (5 dakika boyunca %100, 2 dakika boyunca %90, 2 dakika boyunca %70 ve 2 dakika damıtılmış su).
- Parafin bölümlerini çevreleyen fazla sıvıyı PBS kullanarak yıkayın. Her numuneyi 100 μL Proteinaz K ile tedavi edin ve dokunun tam olarak kaplanmasını sağlayın. Numuneleri 37 °C'de 20 dakika inkübe edin. Daha sonra, numuneleri her seferinde 5 dakika olmak üzere 3 kez PBS'ye batırın.
NOT: Proteinaz K çözeltisi, orijinal Proteinaz K (200 μg/mL) çözeltisinin PBS ile 1:9 (hacim) oranında seyreltilmesiyle hazırlandı ve DNaz hariç 20 μg/mL'lik bir nihai konsantrasyon elde edildi. Sonraki etiketleme reaksiyonlarına müdahaleyi önlemek için Proteinaz K'nin kapsamlı bir şekilde yıkanması gereklidir. - Dokuya tamamen sızmak için uygun miktarda% 3 H2O2 (PBS ile seyreltilmiş) ekleyin ve 20 dakika inkübe edin. Dokuyu PBS ile her biri 5 dakika boyunca 3 kez durulayın.
NOT: Parafin bölümleri nemli tutulmalıdır. Dokudaki endojen peroksidazları inaktive etmek için,% 3H2O2'nin neden olduğu DNA kırılmasına bağlı yanlış pozitifleri önlemek için inkübasyon süresi çok uzunolmamalıdır. - Test edilecek numunenin tüm alanını 50 μL Dengeleme tamponu ile kaplayın ve 10 dakika inkübe edin.
- Mümkün olduğu kadar çok Dengeleme tamponunu çıkarın. Daha sonra, her doku örneğine 56 μL TdT İnkübasyon tamponu ekleyin ve 1 saat (oda sıcaklığında) inkübe edin.
NOT: Kaydırağın kurumasına izin verilmemeli ve ışığa maruz kalmaktan kaçınılmalıdır. TdT İnkübasyon tamponu, üreticinin talimatlarına göre hazırlanmıştır (Rekombinant TdT enzimi: Biotin-dUTP Etiketleme Karışımı: Dengeleme Tamponu = 1 μL: 5 μL: 50 μL). - Doku örneklerini hemen PBS ile yıkayın. Her birini 5 dakika boyunca 4 kez durulayın. Numunelerin etrafındaki fazla PBS solüsyonunu filtre kağıdı ile nazikçe çıkarın.
- Streptavidin-HRP reaksiyonu için her doku örneğine 100 μL önceden seyreltilmiş Streptavidin-HRP reaksiyon çözeltisi (Streptavidin-HRP: TBST = 1: 300) ekleyin. 30 dakika inkübe edin. Daha sonra numuneleri PBS ile yıkayın ve her biri 5 dakika boyunca 3 kez durulayın.
- Her parafin bölümüne 50 μL DAB ekleyerek DAB boyama yapın. Lekelenmeyi gerçek zamanlı olarak mikroskop altında gözlemleyin. Pozitif lekelenme göründükten sonra, slaytları hemen nemli bir kutuya yerleştirin. Saf su ile yıkayarak reaksiyonu durdurun.
- Slaytları 3-5 dakika hematoksilen boyama solüsyonuna batırın, ardından saf su ile durulayın.
- Hematoksilen farklılaşma solüsyonunda yaklaşık 2 saniye boyunca farklılaştırın, ardından saf su ile hemen durulayın.
- Birkaç saniye boyunca hematoksilen yeniden doldurma solüsyonu kullanarak mavi renklenme elde edin ve slaytları saf suyla durulayın.
NOT: Nükleer boyamadan sonra mikroskobik inceleme yapın. Boyama çok koyuysa, slaytları farklılaştırma çözeltisine geri koyun. Boyama çok hafifse, boyama işlemini nükleer boyama adımından yeniden başlatın. - Numuneleri her biri 5 dakika boyunca 4 tur taze susuz etanol ile kurutun. Daha sonra 5 dakika bütanol ve 5 dakika ksilen içinde bekletin. Son olarak, 5 dakika daha taze ksilen kullanın.
- Slaytları nötr sakız kullanarak monte edin. Doğal olarak kurumaya bırakın veya 60 °C fırında kurutun.
- Beyaz ışık mikroskobu kullanarak histolojik inceleme yapın. Apoptotik çekirdekler kahverengi görünecektir.
- Karşılık gelen apoptotik indeksi (AI) hesaplayın.
NOT: Slaytları çift kör bir şekilde gözlemleyin. TUNEL-pozitif slaytlarda, yüksek büyütme (400x) altında rastgele 5 pozitif alan seçin ve pozitif hücrelerin yüzdesini belirlemek için her alanda en az 100 asiner hücre sayın. AI = (toplam apoptotik hücre sayısı/toplam hücre sayısı) × %100.
10. Akış sitometrisi
- Taze pankreas dokuları elde edin ve PBS ile perfüze ettikten sonra iyice yıkayın.
- % 0.5'lik bir kollajenaz IV sindirim çözeltisi hazırlayın ve pankreas dokularını yeterince sindirmek için steril doku makası kullanın.
- Pankreas fragmanlarının durumuna ve sıvı bulanıklığına bağlı olarak% 5'lik bir BSA sindirim sonlandırma çözeltisi ekleyin ve karışımı düşük sıcaklıkta 5 dakika (~ 300 x g, 4 ° C) santrifüjleyin.
- Sindirimi sonlandırmak için süpernatanı atın.
- Pankreas hücrelerini yeniden süspanse etmek için fenil metan sülfonil florür (PMSF) ve% 2.5 fetal sığır serum hücresi süspansiyonu içeren bir hücre kültürü ortamı hazırlayın.
- Hücre filtreleme yoluyla hücre süspansiyonları elde etmek için pankreas asiner hücre süspansiyonlarını 200 gözenekli bir naylon ağdan süzün.
- Pankreas asiner hücre süspansiyonunu düşük sıcaklıkta santrifüjleyin (adım 10.3'te belirtilen koşulları izleyin).
- Süpernatanı atın.
- Hücreleri önceden soğutulmuş PBS ile yıkayın.
- Santrifüjlü yeniden süspansiyon yoluyla önceden soğutulmuş 1x bağlayıcı tampondaki hücreleri nazikçe yeniden süspanse edin.
- Hücre konsantrasyonunu ayarladıktan sonra pankreas asiner hücrelerini üreticinin talimatlarına göre Annexin V-FITC/PI ile etiketleyin.
- Pankreas asiner hücrelerinde apoptozu tespit etmek için 1 saat içinde akış sitometrisi kullanın.
11. Kaspaz-3 ve HMGB-1'in batı lekesi tespiti
- Pankreas proteinini çıkarın.
- 50 mg pankreas dokusunu çıkarın ve küçük parçalar halinde kesin.
- 1 mL RIPA lizis tamponu (PMSF ve fosforile proteaz inhibitörü içeren) ekleyin.
- Pankreas dokusunu elektrikli bir öğütücü kullanarak 5 dakika boyunca buz üzerinde homojenize edin.
- Homojenize dokuyu 2 saat boyunca hafifçe çalkalayarak buz üzerinde inkübe edin.
- Homojenatı 4 °C'de 10 dakika boyunca 4.500 x g'da santrifüjleyin.
- Süpernatan çözeltiyi toplayın ve -80 °C'de saklayın.
- Protein miktar tayini yapın.
- Belirli bir hacimde BSA standart numunesini (25 mg / mL) 0.5 mg / mL'lik bir konsantrasyona seyreltin.
- 50 hacim BCA çözeltisi A'yı 1 hacim BCA çözeltisi B ile karıştırarak belirli bir miktarda BCA çalışma çözeltisi hazırlayın, iyice ve eşit bir şekilde karıştırmayı sağlayın.
- BSA standart numunesini 0, 1, 2, 4, 8, 12, 16 ve 20 μL sırasına göre 96 oyuklu bir plaka üzerindeki standart numune deliklerine yerleştirin. Her deliğin hacmini damıtılmış su ile dengeleyin, böylece toplam hacim 20 μL'dir.
- Numune deliklerine 2 μL numune ekleyin, ardından seyreltme için sırayla 18 μL damıtılmış su ekleyin (1:9).
- Her kuyucuğu 200 μL BCA çalışma solüsyonu ile doldurun ve yaklaşık 20-30 dakika boyunca 37 ° C'de bekletin.
- Absorpsiyonu 562 nm dalga boyunda ölçün. Standart eğriye göre numunelerin protein konsantrasyonunu hesaplayın.
- Numuneleri, konsantrasyon uygun kabul edilen 5-10 μg/μL'ye ulaşana kadar seyreltmek için belirli bir hacimde RIPA parçalama çözeltisi ve seyreltme tamponu ekleyin.
- Protein denatürasyonundan sonra numuneleri -20 °C'de saklayın (100 °C; 10 dakika).
- Batı lekeleme işlemini gerçekleştirin.
- SDS-PAGE için hazırlıklar yapın.
- Tutkal yapma kalıplarını takın ve sızdırmazlık performanslarını kontrol edin.
- %10'luk ayırma yapıştırıcısına TEMED ekleyin ve eşit şekilde karıştırın.
- Karışımı, kabarcıklardan kaçınırken, hacmin yaklaşık üçte ikisini oluşturan kalıba enjekte edin.
- Kalıba izopropanol ekleyin ve yapıştırıcıyı yaklaşık 40 dakika bastırın.
- %5 konsantre yapıştırıcıyı yapılandırmak için aynı programı kullanın.
- İzopropanolü dökün ve yapıştırıcıyı hemen ekleyin.
- Tutkal tamamen polimerize olana kadar tarağı dikey olarak yerleştirin.
- Elektroforez işlemini gerçekleştirin.
- Test edilecek numuneyi, beklenen deneysel kontrol sırasına göre, ters sırada, SDS-PAGE yapıştırıcısının numune alma deliklerine ekleyin.
- Hedef proteinin ve dahili referans proteinin yerini belirlemek için Protein İşaretini aynı anda ekleyin.
- Numune ekleme işlemi tamamlandıktan sonra numuneyi elektroforez tankına yerleştirin.
- Başlangıçta, 30 dakika boyunca 80 V'ta çalıştırın, ardından proteini 60 dakika boyunca 100 V'ta ayırmak için jeli çalıştırın.
NOT: Aşırı elektroforezden kaçınmak için bromofenol mavisinin konumuna dikkat edilmelidir.
- Protein transferini gerçekleştirin.
- Bir işaret görevi görmesi için PVDF filmi sağ üst köşeden kesin.
- PVDF filmini aktifleşmesi için 5-10 saniye boyunca bir metanol çözeltisine yerleştirin.
- PVDF filmi yaklaşık 15 dakika boyunca bir elektroforez tamponunda bekletin.
- Elektroforezden sonra jeli dikkatlice çıkarın ve fazla jeli kesin, böylece jelin işlem boyunca ıslak kalmasını sağlayın.
- Ateli aşağıdaki sırayla monte edin: negatif plaka → sünger → üç kat filtre kağıdı → jel → PVDF film → üç kat filtre kağıdı → sünger → pozitif plaka.
NOT: Jel ve PVDF film arasında kabarcık olmadığından emin olun. - Monte edilmiş kelepçeyi, etrafına buz küpleri yerleştirilmiş şekilde ıslak döner oluğa (siyahtan siyaha) yerleştirin.
- Gücü açın ve 100 dakika boyunca 400 mA'da film aktarımını başlatın.
- PVDF film sızdırmazlığını ve birincil ve ikincil antikorların inkübasyonunu gerçekleştirin.
- Aktarımdan sonra PVDF filmi nazikçe çıkarın ve işlemi 3-5 kez tekrarlayarak 10 dakika TBST ile durulayın.
- PVDF filmi %5 yağsız sütte 2 saat kapatın.
- PVDF filmi çıkarın ve TBST ile 10 dakika durulayın, işlemi 4 kez tekrarlayın.
- PVDF filmi ve seyreltilmiş primer antikoru hafifçe çalkalayarak 4 ° C'de bir buzdolabına yerleştirin ve gece boyunca inkübe edin.
- Ertesi gün PVDF filmi çıkarın ve TBST ile 10 dakika durulayın, işlemi 4 kez tekrarlayın.
- PVDF filmini HRP etiketli ikincil antikor seyrelticide yaklaşık 2 saat inkübe edin.
- PVDF filmi TBST ile 10 dakika durulayın ve işlemi 4 kez tekrarlayın.
- Filmi ortaya çıkarın ve analiz edin.
- Hazırlanan ECL solüsyonunu filmin üzerine eşit şekilde uygulayın.
- Filmi karanlık bir odada pozlama ölçer ile yaklaşık 2-3 dakika pozlayın ve ardından saklayın.
- Analizi image J yazılımını kullanarak gerçekleştirin.
- SDS-PAGE için hazırlıklar yapın.
Sonuçlar
Deneysel fare modelleme süreci Şekil 1'de gösterilmiştir. Enjeksiyonun tamamlanmasından 12 saat sonra, 5 döngü boyunca farklı deney fare gruplarının hareket mesafesini ve hareketsizlik süresini izlemek için bir açık alan video kaydedici kullanıldı (Şekil 2A). 5 döngü boyunca, PI V grubundaki fareler 3 dakika içinde düşük bir hareket mesafesi seviyesini korurken, 3 dakika içindeki hareketsizlik oranı sonraki her döngüde artmıştır (Şekil 2B, C). Ek olarak, 5 döngü boyunca farklı deney gruplarından farelerin toplam hareket mesafesi üzerinde istatistiksel analiz yapıldı. PI V grubu, diğer deney gruplarına kıyasla en küçük toplam hareket mesafesini gösterdi ve fark istatistiksel olarak anlamlıydı (p < 0.001) (Şekil 2D,E). Kontrol grubu ve PI I grubu hariç, diğer deney gruplarındaki fareler D-Değer ağırlığında negatif büyüme gösterdi. Bunlar arasında, PI V grubu ağırlıkta en büyük değişikliği gösterdi ve diğer deney gruplarına kıyasla ağırlık değişimindeki fark istatistiksel olarak anlamlıydı (Şekil 2F). Her deney grubunda ek 10 farenin hayatta kalma oranı değerlendirildikten sonra, sonuçlar PI V grubundaki farelerin mortalite oranının 5. günde% 80'e ulaştığını gösterdi. Bununla birlikte, diğer dört deney grubu ile kontrol grubu fareleri arasında mortalite oranında istatistiksel olarak anlamlı bir fark yoktu (Şekil 2G).
Yüksek güçlü bir mikroskop kullanılarak, farelerin PI IV ve PI V gruplarında önemli hücresel şişme, nekroz ve inflamatuar hücre infiltrasyonu gözlenmiştir (Şekil 3A, B). Ek Tablo 2'de verilen derecelendirme kriterleri kullanılarak, farklı deney fare gruplarının pankreas patolojisi değerlendirildi ve kontrol grubu farelerine kıyasla pankreas patolojisi skorunda önemli farklılıklar gözlendi (p < 0.001) (Şekil 3C; Ek Şekil 1). Ek olarak, kontrol grubu ile karşılaştırıldığında, ölçülen farelerde serum amilaz ve lipaz seviyeleri PI II ila PI V deney gruplarında anlamlı olarak daha yüksekti ve farklılıklar istatistiksel olarak anlamlıydı. İlginç bir şekilde, PI I grubu farelerde istatistiksel olarak anlamlı bir fark yoktu (Şekil 3D, E). ELISA yöntemi, farelerin serumunda TNF-α ve IL-6 dahil olmak üzere inflamatuar belirteçlerin14 seviyelerini değerlendirmek için kullanıldı. Bulgular, PI V grubu farelerde TNF-α ve IL-6 düzeylerinin diğer deney gruplarına göre anlamlı derecede yüksek olduğunu ve farklılıkların istatistiksel olarak anlamlı olduğunu ortaya koydu (Şekil 3F,G). Kontrol grubu ile karşılaştırıldığında, PCT seviyeleri dört deney grubunun hepsinde arttı, ancak sadece PI V grubundaki fark istatistiksel olarak anlamlıydı (p < 0.05) (Şekil 3H).
Farklı deney fare gruplarında pankreas dokularının apoptotik durumu
Her fare grubunun pankreas dokularında TUNEL boyaması yapılarak, farklı deney gruplarının pankreas dokularında hücresel nekroz durumu gözlenmiştir (Şekil 4A). Pankreas dokusu kesitlerinin birim alanı başına gri tonlama değerleri (OD) ve pozitif hücresel nekroz oranı, Image J yazılımı kullanılarak yarı kantitatif olarak analiz edildi. Sonuçlar, diğer deney gruplarıyla karşılaştırıldığında, PI V grubu farelerin pankreas dokularındaki hücre nekroz seviyesinin önemli ölçüde arttığını ve farkın istatistiksel olarak anlamlı olduğunu gösterdi (p < 0.001) (Şekil 4B,C). Farklı deney gruplarından farelerin pankreas dokularında hücresel bir nekroz belirteci olan sisteinil aspartat spesifik proteinaz-3'ün (Kaspaz-3) ekspresyon seviyelerini değerlendirmek için protein immünoblotlama deneyleri yapıldı (Şekil 4D). Kaspaz-3 ekspresyonunun miktar tayini, PI V grubunun pankreas dokularında kaspaz-3 proteininin ekspresyon seviyesinin anlamlı olarak arttığını ve farkın istatistiksel olarak anlamlı olduğunu gösterdi (p < 0.001). Protein ekspresyon seviyeleri ölçüldü ve iç kontrol GapDH'ye normalize edildi (Şekil 4E). Ek olarak, taze pankreatik asiner hücre süspansiyonları Annexin V-FITC/PI ile etiketlendi ve akış sitometrisi ile analiz edildi. Diğer deney fare gruplarıyla karşılaştırıldığında, PI V grubunun anlamlı olarak daha yüksek pozitif hücre ölümü oranına sahip olduğu bulundu, bu da istatistiksel olarak anlamlıydı (p < 0.001) (Şekil 4F,G).
Periferik serumda HMGB-1 içeriği ve pankreas dokusunda HMGB-1 ekspresyon seviyesi
HMGB-1 proteini ile pankreas hasarı arasındaki ilişkiyi araştırmak için her deney grubundaki farelerin pankreas dokularında immünohistokimyasal boyama ve miktar tayini yapıldı. Deney ve kontrol grupları arasında istatistiksel olarak anlamlı fark vardı (p < 0.001) (Şekil 5A,B). ELISA, farklı deney gruplarından farelerin serumundaki HMGB-1 seviyelerini ölçmek için kullanıldı. Sonuçlar, kontrol grubu ile karşılaştırıldığında, HMGB-1'in serum seviyelerinin tüm deney gruplarında anlamlı olarak daha yüksek olduğunu, en yüksek seviyenin PI V grubunda gözlendiğini ve farkın istatistiksel olarak anlamlı olduğunu gösterdi (p < 0.001) (Şekil 5C). Ayrıca, Western blot analizi, tüm deney gruplarında farelerin pankreas dokularında HMGB-1 proteininin yüksek ekspresyonunu tespit etti ve kontrol grubuna kıyasla istatistiksel olarak anlamlı farklılıklar gösterdi (p < 0.001) (Şekil 5D, E).
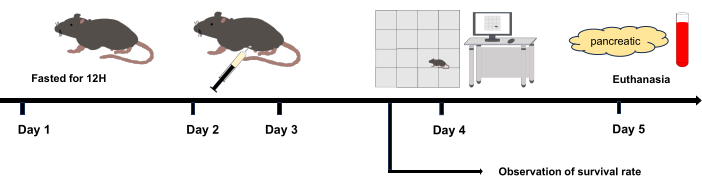
Şekil 1: Deneysel akış şeması. 2. Gün ve 3. Gün: İntraperitoneal enjeksiyon. 4. Gün: Açık alan deneyi, son intraperitoneal enjeksiyondan 12 saat sonra başlatıldı. 5. Gün: İntraperitoneal enjeksiyondan 36 saat sonra ötenazi yapıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: PI fare modelindeki makroskopik değişiklikler. (A) Farelerin gerçek zamanlı hareket yörüngesi grafiği tasvir edilmiştir. (B) Farklı deney fare grupları için her izleme periyodu içindeki toplam hareket mesafesi. (C) Farklı deney fare grupları için her izleme periyodu içindeki hareketsizlik süresinin yüzdesi. (D,E) 15 dakika boyunca toplam hareket mesafesi ve hareketsizlik süresi yüzdesi, farklı deney gruplarındaki fareler için analiz edildi. (F) Modelleme işleminden önce ve sonra farelerin ağırlığını temsil eden D değeri gösterilir. (G) İntraperitoneal enjeksiyonu takip eden 7 gün boyunca her grupta 10 farenin sağkalımı gözlendi. Veriler SEM, n = 4 ± ortalama olarak ifade edilir. "ns" önemli değil, *P < 0.05, ****P < 0.001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Farklı deney grupları arasında fare pankreatitindeki patolojik değişiklikler. (A) Farklı deney gruplarında farelerin pankreas dokusunun H&E ile boyanmış histolojik kesitleri (hematoksilen ve eozin ile boyanmış parafine gömülü pankreas dokusu kesitleri, sırasıyla 100 kat büyütme ve 200 μm ölçek çubukları ve 400 kat büyütme ve 50 μm ölçek çubukları. Sarı uzun oklar adacıkları gösterir; kırmızı uzun oklar asiner hücreleri gösterir; kahverengi uzun oklar kan damarlarını gösterir; mavi uzun oklar kanalları gösterir). (B) Farelerde pankreas ağırlığının vücut ağırlığına oranının hesaplanması. (C) Farelerin patolojik skorlaması pankreas. (D,E) Farelerde serum amilaz ve lipaz seviyelerinin tespiti. (F-G) Farelerde serum TNF-α ve IL-6 seviyelerinin ELISA ölçümü. (H) PCT seviyesinin değerlendirilmesi. Veriler SEM, n = 4 ± ortalama olarak ifade edilir. "ns" önemli değil, *P < 0.05, ****P < 0.001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
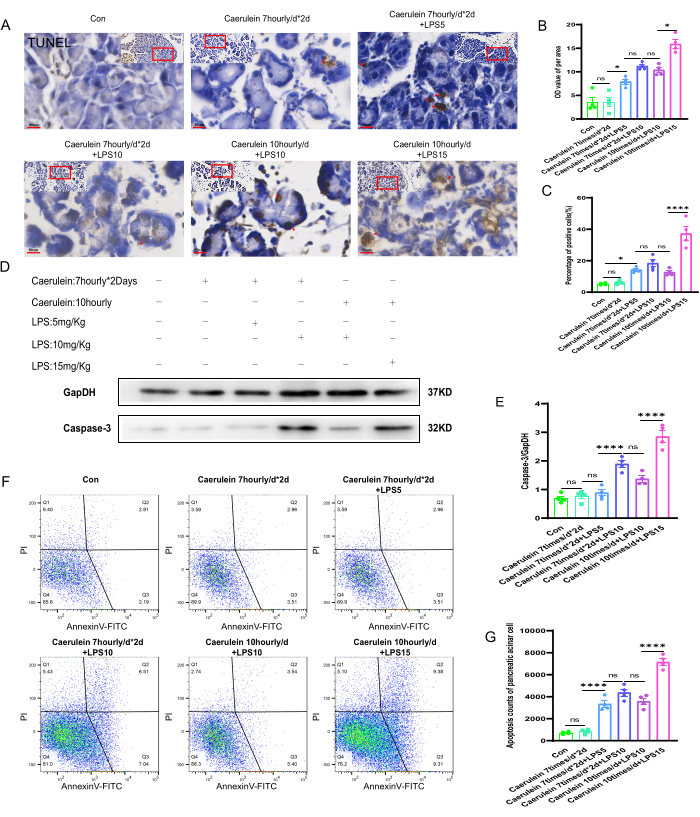
Şekil 4: Farelerde pankreas dokusunun apoptozu. (A) TUNEL boyamanın temsili görüntüleri, farelerin pankreas parafin kesitlerinden ve genişlemiş alan görüntülerinden elde edildi. (400x, ölçek çubuğu 50 μm, kahverengimsi sarı pozitif hücrelerdir). (B,C) Farelerin pankreas dokusunun TUNEL ile boyanmış bölümlerinin birim alanı başına gri tonlama değerinin ve pozitif lekeli ölü hücrelerin yüzdesinin kantitatif analizi. (D) Pankreas dokusunda Kaspaz-3 ekspresyon seviyesi Western blot ile tespit edildi. (E) Pankreas dokusunda Kaspaz-3 ekspresyonunun miktarının belirlenmesi. (F) Farelerin pankreas asiner hücrelerinde hücre ölümünün derecesini değerlendirmek için akış sitometrisi kullanıldı. (G) Fare pankreas asiner hücrelerinde geç evre ölü hücrelerin sayımı. Veriler SEM, n = 4 ± ortalama olarak ifade edilir. "ns" önemli değil, *P < 0.05, ****P < 0.001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Farelerin pankreas dokusunda HMGB-1 ekspresyonu. (A) Pankreas kesitlerinde HMGB-1'in immünohistokimyasal boyanmasının temsili görüntüleri ve büyütülmüş görüntüleri (x400, ölçek çubuğu 50 μm). Kahverengimsi sarı renk pozitif hücreleri gösterir (n = 4). (B) Pankreas dokusu kesitlerindeki HMGB-1 pozitif hücrelerin yüzdesi (n = 24). (C) Fare serumundaki HMGB-1 seviyesi (n = 4). (D,E) Pankreas dokusunda HMGB-1 ekspresyon seviyesini tespit etmek ve kantifikasyon sonuçlarını elde etmek için Western blot yapıldı (n=4). Veriler SEM ± ortalama olarak ifade edilir, "ns" anlamlı değil, *P < 0.05, ****P < 0.001 olarak ifade edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: PI V grubu fare modelinde çoklu organ yaralanması. (A) CON ve PI V grubu farelerden toplanan pankreas, akciğer, karaciğer ve böbrek dokularındaki histolojik değişikliklerin temsili görüntüleri, H&E boyama (200x büyütme, ölçek çubuğu 50 μm) kullanılarak analiz edildi. Asiner hücre nekrozu ile ilişkili patolojik değişiklikler siyah oklarla gösterilir. Sarı oklar, alveollerde interstisyel kanama ve ödem ile karakterize patolojik değişiklikleri gösterir. Hepatosit ödemi ve nekrozu yeşil oklarla gösterilir. Glomerüler kanama ile ilgili patolojik değişiklikler kırmızı oklarla işaretlenir. (B) Histolojik skorların hesaplanması CON grubu ve PI V grubu farelerden elde edilen pankreas, akciğer, karaciğer ve böbrek dokuları üzerinde yapıldı. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Tablo 1: İntraperitoneal enjeksiyon protokolü. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Tablo 2: Pankreatit şiddeti için patolojik skorlama kriterleri. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Şu anda, şiddetli akut pankreatitli hastalarda yüksek mortalite oranını iyileştirmek için etkili bir araç eksikliği vardır. İmmün stabilite mekanizmalarını arttırmada ilaçların etkinliğinin araştırılması çok önemlidir. Şiddetli akut pankreatit için ideal bir hayvan modeline acil ihtiyaç vardır. C57BL / 6J genetik geçmişine sahip fareler, SAP patofizyolojisi çalışmaları da dahil olmak üzere biyomedikal araştırmalarda yaygın olarak kullanılmaktadır. B6J farelerinde 70 yılı aşkın genetik farklılaşma, birkaç ekzonun15 kendiliğinden silinmesine neden olmuş ve bu da Caerulein kaynaklı pankreas hasarına karşı duyarlılığın azalmasına yol açmıştır16. Ek olarak, akut pankreatitin mevcut hayvan modellerinin, cerrahi travma veya sadece daha büyük hayvanlara uygulanabilirlik gibi sınırlamaları vardır ve bu da bu modellerin kullanılarak yapılan bilimsel araştırmaları engellemektedir. Bu nedenle, bu spesifik gen türünü kullanarak kararlı, verimli ve uygun bir hayvan modeli oluşturmak son derece değerlidir.
Caerulein, farelerin açlık tuttuğu ve yeterli miktarda sindirim sıvısı depoladığı kısa bir süre içinde yüksek frekanslı enjeksiyonlar yoluyla pankreas sindirim sıvısının ve enzim salgılanmasının göreceli tıkanmasına neden olarak pankreas dokusu hasarına neden olan bir kolesistokinin analoğudur17. LPS, bakteri hücre duvarlarında bulunan ana bileşendir ve farelerde MODS ve SIRS'ye neden olabilir18. Önceki bir çalışma, farklı frekanslarda Caerulein enjeksiyonlarının intraperitoneal enjeksiyon yoluyla uygulanan değişen dozlarda LPS ile birleştirilmesinin, insan SAP'sinde gözlenen benzer patolojik değişikliklere neden olduğunu göstermiştir19,20. Bu çalışma, farklı derecelerde pankreas hasarını indüklemek için invaziv olmayan bir yaklaşım kullandı ve farklı Caerulein enjeksiyonlarını farelere intraperitoneal olarak uygulanan farklı LPS dozları ile birleştirdi. Protokol geliştirme sırasında periton tarafından homojen emilimin sağlanması çok önemliydi. Bu gerekliliği yerine getirmek için, her bir ilaç uygulaması üzerinde hassas kontrol sağlamak için intraperitoneal enjeksiyon adımlarına sıkı sıkıya bağlı kalmak çok önemlidir. Ek olarak, her ilaç enjeksiyonundan sonra steril bir pamuklu çubukla enjeksiyon bölgesine nazikçe sürtünme ve uygun basınç uygulanması, ilacın periton boşluğu boyunca eşit dağılımı için gereklidir. Ayrıca, iğne başının periton boşluğuna doğru ve hassas bir şekilde yerleştirilmesi, iğne üst karın bölgesinin merkezi bölgesine bakacak şekilde son derece önemlidir. Operatörlerin iğneyi karın boşluğuna sokarken herhangi bir direnç eksikliğini doğru bir şekilde algılamalarını sağlamak için önceden eğitim yapılmalıdır. Manuel çalıştırma yerine mikro kantitatif bir infüzyon pompasının kullanılması, ilaç enjeksiyon kalitesini potansiyel olarak artırabilir; Ne yazık ki, bu çalışmada bu uygulanmadı. Bununla birlikte, farklı enjeksiyon şemaları kullanarak, farklı derecelerde pankreas hasarına neden olduk ve LPS enjeksiyonları ile kombine edilen Caerulein tarafından indüklenen aynı teknik koşullar altında farklı frekanslar ve dozların neden olduğu pankreas hasarında farklılıklar gözlemledik. Bu, şiddetli akut pankreatit indüksiyonu için invaziv olmayan hayvan modellerinde Caerulein'in gelecekteki kullanımı için değerli bilgiler sağlar.
Caerulein ve LPS kombinasyonu, hematoksilen ve eozin (HE) boyama ile gösterildiği gibi, önemli ölçüde yüksek serum amilaz ve lipaz seviyeleri, artmış pankreas ağırlığı ve enflamatuar hücrelerin geniş infiltrasyonu, pankreas asiner hücre ödemi, nekroz ve kanama dahil olmak üzere histolojik değişiklikler ile sonuçlandı. Ayrıca, artan bir LPS dozu ile pankreastaki patolojik değişiklikler daha belirgin hale geldi. Bununla birlikte, PI IV ve PI V grupları arasında pankreas patoloji skorlarında belirgin bir fark bulunmadığı, pankreas dokusu hücre nekrozunun yaygınlığının PI III grubunda PI IV grubuna göre daha belirgin olduğu dikkat çekicidir. Bu gözlem, Caerulein doz sıklığının pankreas hasarına katkıda bulunan birincil faktör olarak hizmet edebileceğini, LPS'nin ilerlemesini şiddetlendirerek sistemik inflamatuar hasara yol açabileceğini düşündürmektedir18,21. HMGB-1, konumuna bağlı olarak işlev gören bir proteindir22. Hücre dışı HMGB-1, inflamasyonun uyarı sinyallerinde yer alan bir protein görevi görür ve akut pankreatitin şiddeti ile yakından ilişkilidir 23,24,25. Bu çalışmada, tüm deney gruplarından farelerde serum HMGB-1 seviyeleri, kontrol grubuna göre anlamlı derecede yüksekti ve PI V grubu en önemli artışı gösterdi. İmmünohistokimyasal ve protein elektroforezi deneyleri de pankreas dokusunda HMGB-1'in yüksek ekspresyonunu doğruladı. Bu önemli protein, şiddetli akut pankreatitte inflamatuar fırtınayı inhibe etmek için terapötik bir hedef olarak hizmet edebilir.
Özetle, farelerde invaziv olmayan, basit ve gerçekleştirmesi kolay bir SAP modeli geliştirmek çok önemlidir. Bu deneysel protokolde, LPS ile birlikte Caerulein kullanılarak pankreas hasarının indüksiyonu güvenilir ve etkilidir. Caerulein'i 50 μg / kg'lık bir dozda art arda on gün boyunca intraperitoneal olarak uygulayarak, ardından 15 mg / kg LPS'nin tek bir intraperitoneal enjeksiyonu ile stabil, güvenilir, uygun maliyetli ve verimli bir SAP hayvan modeli oluşturulabilir.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Huainan Şehrindeki Sağlık ve Tıp Bilimi Araştırma Projeleri tarafından desteklenmiştir (No. HNWJ2023005); Huainan Şehrinde Belediye Rehberlik Bilim ve Teknoloji Planı Programı (No.2023151); Anhui İl Koleji Öğrencilerinin İnovasyon ve Girişimcilik Eğitim Programı (No. S202310361254); dokuzuncu parti "50· Bilim ve Teknoloji Yıldızları "Huainan Şehri ve Anhui İli Anahtar Klinik Özel İnşaat Projesi'ndeki inovasyon ekipleri. Anhui Bilim ve Teknoloji Üniversitesi Birinci Bağlı Hastanesi Laboratuvar Bölümüne, ilgili test verilerini sağladıkları için şükranlarımızı sunarız.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 20× Citric Acid Antigen Repair Solution (pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1202-250 ml | |
| Amylase | Mindray,China | ||
| Annexin V-FITC/PI | Wuhan servicebio Technology Co.,Ltd, China | G1511 | diluted at 1:20 |
| Anti-HMGB1 Rabbit pAB | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1800 |
| BCA protein quantitative detection kit | Wuhan servicebio Technology Co.,Ltd, China | G2026-200T | |
| BD FACSCanto II Flow Cytometer | BD Life Sciences, San Jose, CA, 95131, USA | BD FACSCanto II | |
| BSA | Wuhan servicebio Technology Co.,Ltd, China | GC305010-100g | |
| C57BL/6J | Cavion Experimental Animal Co., Changzhou, China | license number SCXY (Su) 2011–0003 | |
| Ceruletide | MCE, New Jersey, USA | 17650-98-5 | 50 µg/kg |
| Chemiluminescence imager | Cytiva CO.,LTD.;USA | ||
| Citric acid antigen repair Solution (Dry powder pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1201-5 L | |
| Collagenase IV | Wuhan servicebio Technology Co.,Ltd, China | GC305014 | 0.5 mg/mL |
| DAB (SA-HRP) Tunel Cell Apoptosis Detection Kit | Wuhan servicebio Technology Co.,Ltd, China | G1507-100 T | |
| Dimension EXL with LM Integrated Chemistry System | Siemens Healthcare Diagnostics Inc.Brookfield,USA | YZB/USA 8311-2014 | |
| ECL developer | Wuhan servicebio Technology Co.,Ltd, China | ||
| Eosin dye (alcohol soluble) | Wuhan servicebio Technology Co.,Ltd, China | G1001-100 ml | |
| EthoVision XT | Noldus, Netherlands | ||
| FITC-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB22303 | diluted at 1:50 |
| Fully automatic blood cell analyzer | Zybio Inc. China | Zybio-Z3 CRP | |
| GapDH | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1500 |
| Hematoxylin blue return solution | Wuhan servicebio Technology Co.,Ltd, China | G1040-500 ml | |
| Hematoxylin differentiation solution | Wuhan servicebio Technology Co.,Ltd, China | G1039-500 ml | |
| Hematoxylin dye | Wuhan servicebio Technology Co.,Ltd, China | G1004-100 ml | |
| HMGB-1 ELISA kits | njjcbio Co., Ltd, China | ||
| HOMOGENIZER | Wuhan servicebio Technology Co.,Ltd, China | KZ-III-F;IC111150 100222 | |
| HRP-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB23303 | diluted at 1:1500 |
| IL-6 ELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0001 | |
| Lipase | Mindray,China | ||
| Lipopolysaccharide | Wuhan servicebio Technology Co.,Ltd, China | GC205009 | 15 mg/kg |
| Low temperature high speed centrifuge | Changsha Pingfan Apparatus&Instrument Co.,Ltd.,China | TGL-20M | |
| Membrane breaking liquid | Wuhan servicebio Technology Co.,Ltd, China | G1204 | |
| microtome | Jinhua Craftek Instrument Co., Ltd.;China | CR-601ST | |
| Nylon mesh | Wuhan servicebio Technology Co.,Ltd, China | 200-mesh | |
| One-step TUNEL cell apoptosis detection kit (DAB staining method) | Wuhan servicebio Technology Co.,Ltd, China | G1507-100T | |
| Paraffin tissue embedding machine | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PBM-A | |
| Pathological tissue drying apparatus | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PHY-III | |
| Phosphate-buffered saline | Wuhan servicebio Technology Co.,Ltd, China | G4202-100ML | |
| PMSF | Wuhan servicebio Technology Co.,Ltd, China | G2008-1 ml | |
| Positive fluorescence microscope | Olympus Corporation,Tokyo, Japan | BX53 | |
| Pro Calcitonin | Mindray,China | ||
| PVDF membrane | Millipore, USA | 0.22 µm | |
| RIPA | Wuhan servicebio Technology Co.,Ltd, China | G2002-100 ml | |
| SDS-PAGE | Beyotime Biotechnology,China | P0012A | |
| TNF-αELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0004 | |
| Ultrasonic water bath | DONGGUAN KQAO ULTRASONIC EQUIPMENT CO.,LTD.;China | KQ-200KDE | |
| Western Blot | Bio-Rad Laboratories, Inc.,USA | ||
| Western blot imaging System | Global Life Sciences IP Holdco LLC, JAPAN | Amersham ImageQuant 800 | |
| Whirlpool mixer | SCILOGEX;USA |
Referanslar
- Gliem, N., Ammer-Herrmenau, C., Ellenrieder, V., Neesse, A. Management of severe acute pancreatitis: An update. Digestion. 102 (4), 503-507 (2021).
- Duan, F., et al. GDF11 ameliorates severe acute pancreatitis through modulating macrophage M1 and M2 polarization by targeting the TGFbetaR1/SMAD-2 pathway. Int Immunopharmacol. 108, 108777 (2022).
- Zhang, X. P., et al. Preparation method of an ideal model of multiple organ injury of rat with severe acute pancreatitis. World J Gastroenterol. 13 (34), 4566-4573 (2007).
- Bluth, M. H., Patel, S. A., Dieckgraefe, B. K., Okamoto, H., Zenilman, M. E. Pancreatic regenerating protein (reg I) and reg I receptor mRNA are upregulated in rat pancreas after induction of acute pancreatitis. World J Gastroenterol. 12 (28), 4511-4516 (2006).
- Qiu, F., Lu, X. S., Huang, Y. K. Effect of low molecular weight heparin on pancreatic micro-circulation in severe acute pancreatitis in a rodent model. Chin Med J (Engl). 120 (24), 2260-2263 (2007).
- Lombardi, B., Estes, L. W., Longnecker, D. S. Acute hemorrhagic pancreatitis (massive necrosis) with fat necrosis induced in mice by DL-ethionine fed with a choline-deficient diet. Am J Pathol. 79 (3), 465-480 (1975).
- Liu, Y., et al. Deletion of XIAP reduces the severity of acute pancreatitis via regulation of cell death and nuclear factor-kappaB activity. Cell Death Dis. 8 (3), e2685 (2017).
- Niederau, C., Ferrell, L. D., Grendell, J. H. Caerulein-induced acute necrotizing pancreatitis in mice: Protective effects of proglumide, benzotript, and secretin. Gastroenterology. 88, 1192-1204 (1985).
- Zhou, X., et al. DPP4 inhibitor attenuates severe acute pancreatitis-associated intestinal inflammation via Nrf2 signaling. Oxid Med Cell Longev. 2019, 6181754 (2019).
- Yang, J., et al. Heparin protects severe acute pancreatitis by inhibiting HMGB-1 active secretion from macrophages. Polymers (Basel). 14 (12), 2470 (2022).
- Kong, L., et al. Sitagliptin activates the p62-Keap1-Nrf2 signalling pathway to alleviate oxidative stress and excessive autophagy in severe acute pancreatitis-related acute lung injury. Cell Death Dis. 12 (10), 928 (2021).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Schmidt, J., et al. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 215 (1), 44-56 (1992).
- Luo, C., et al. Abdominal paracentesis drainage attenuates severe acute pancreatitis by enhancing cell apoptosis via PI3K/AKT signaling pathway. Apoptosis. 25 (3-4), 290-303 (2020).
- Fontaine, D. A., Davis, D. B. Attention to background strain is essential for metabolic research: C57BL/6 and the international knockout mouse consortium. Diabetes. 65 (1), 25-33 (2016).
- Wan, J., et al. Pancreas-specific CHRM3 activation causes pancreatitis in mice. JCI Insight. 6 (17), e132585 (2021).
- Sah, R. P., et al. Cerulein-induced chronic pancreatitis does not require intra-acinar activation of trypsinogen in mice. Gastroenterology. 144 (5), 1076-1085 (2013).
- Wang, K., et al. Activation of AMPK ameliorates acute severe pancreatitis by suppressing pancreatic acinar cell necroptosis in obese mice models. Cell Death Discov. 9 (1), 363 (2023).
- Jin, C., Li, J. C. Establishment of a severe acute pancreatitis model in mice induced by combined Rain Frog Peptide and lipopolysaccharide and exploration of its mechanism. Acta Exp Bio Sinica. 36 (2), 91-96 (2003).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Roy, R. V., et al. Pancreatic Ubap2 deletion regulates glucose tolerance, inflammation, and protection from Caerulein-induced pancreatitis. Cancer Lett. 578, 216455 (2023).
- Chen, R., Kang, R., Tang, D. The mechanism of HMGB1 secretion and release. Exp Mol Med. 54 (2), 91-102 (2022).
- Murao, A., Aziz, M., Wang, H., Brenner, M., Wang, P. Release mechanisms of major DAMPs. Apoptosis. 26 (3-4), 152-162 (2021).
- Liu, T., et al. Accuracy of circulating histones in predicting persistent organ failure and mortality in patients with acute pancreatitis. Br J Surg. 104 (9), 1215-1225 (2017).
- Li, N., Wang, B. M., Cai, S., Liu, P. L. The role of serum high mobility Group Box 1 and Interleukin-6 levels in acute pancreatitis: A meta-analysis. J Cell Biochem. 119 (1), 616-624 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır