Method Article
Preparando um modelo de camundongos de pancreatite aguda grave por meio de uma combinação de injeção intraperitoneal de ceruleína e lipopolissacarídeo
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
A administração intraperitoneal de medicamentos é uma abordagem não invasiva segura e eficaz para induzir lesão pancreática. Este estudo comparou cinco protocolos distintos de injeção intraperitoneal em camundongos para induzir graus variados de lesão pancreática e estabeleceu um modelo de lesão pancreática grave para investigar as alterações patológicas e estratégias de tratamento para pancreatite aguda grave (SAP).
Resumo
O tratamento da pancreatite aguda grave (PAS), com altas taxas de mortalidade, representa um desafio clínico significativo. Investigar as alterações patológicas associadas à SAP usando modelos animais pode ajudar a identificar potenciais alvos terapêuticos e explorar novas abordagens de tratamento. Estudos anteriores induziram principalmente lesão pancreática por meio da injeção retrógrada do ducto biliar de taviaurocolato de sódio, mas o impacto do dano cirúrgico na qualidade do modelo animal permanece obscuro. Neste estudo, empregamos várias frequências de injeções intraperitoneais de caeruleína combinadas com diferentes doses de LPS para induzir lesão pancreática em camundongos C57BL / 6J e comparamos a extensão da lesão em cinco protocolos de injeção intraperitoneal. Em relação à indução de pancreatite aguda em camundongos, é proposto um protocolo de injeção intraperitoneal que resulta em uma taxa de mortalidade de até 80% em 5 dias. Especificamente, os camundongos receberam dez injeções intraperitoneais diárias de Caerulein (50 μg / kg), seguidas por uma injeção de LPS (15 mg / kg) uma hora após a última administração de Caerulein. Ao ajustar a frequência e a dosagem dos medicamentos injetados, pode-se manipular a gravidade da lesão pancreática de forma eficaz. Este modelo apresenta forte controlabilidade e tem um ciclo de replicação curto, tornando-o viável para conclusão por um único pesquisador sem a necessidade de equipamentos caros. Ele simula de forma conveniente e precisa as principais características da doença observadas na SAP humana, demonstrando um alto grau de reprodutibilidade.
Introdução
A pancreatite aguda grave é caracterizada por início rápido, progressão rápida e altas taxas de mortalidade no domínio1 da doença do sistema digestivo. Sua alta taxa de mortalidade sempre foi um foco proeminente da pesquisa clínica. Devido a mudanças imprevisíveis nas condições clínicas, heterogeneidade das manifestações da doença e disponibilidade limitada de espécimes humanos, o estabelecimento de modelos animais tornou-se cada vez mais crucial para a pesquisa de doenças.
A injeção retrógrada de taurocolato de sódio no ducto colédoco comum é comumente usada para criar um modelo de SAP2 em ratos. Ao simular a obstrução pancreatobiliar e induzir o refluxo da bile e do líquido pancreático, essa técnica de modelagem exibe uma alta taxa de sucesso na replicação de modelos animais SAP. No entanto, deve-se notar que a cirurgia invasiva tem impacto no próprio modelo animal. Além disso, este método é limitado a animais maiores, como ratos e cães, que são usados principalmente como sujeitos experimentais. Técnicas alternativas, incluindo intubação duodenal3, punção duodenal direta4 e punção direta do ducto biliar-ducto pancreático5, são frequentemente utilizadas para fins de modelagem.
Os métodos de injeção intraperitoneal e modelagem dietética oferecem vantagens não invasivas que podem ser aplicadas a animais de qualquer tamanho. O modelo de camundongo de SAP induzido pela alimentação com etionina deficiente em colina (CDE)6 apresenta algumas complicações, como hiperglicemia e hipocalcemia pouco controláveis, tornando-o inadequado para avaliar novas abordagens diagnósticas e terapêuticas. Por outro lado, a injeção intraperitoneal de Caerulein combinada com L-arginina7 representa o método mais comumente empregado para induzir pancreatite aguda em camundongos. Especificamente, a administração intraperitoneal repetida de Caeruleína - um análogo da colecistocinina - fornece uma abordagem altamente adequada para investigar vários aspectos relacionados a essa doença destrutiva, incluindo patogênese, inflamação e processos de regeneração. Devido à sua semelhança estrutural com a colecistocinina (CCK), a ceruleína estimula efetivamente a contração da vesícula biliar e a secreção enzimática pancreática, levando a um desequilíbrio na secreção enzimática seguido de subsequente autodestruição8. O lipopolissacarídeo (LPS), sendo onipresente e extensivamente estudado como uma molécula de padrão molecular associada a patógenos, pode ser combinado com Caeruleína via injeção intraperitoneal para estabelecer um modelo eficaz de SAP em camundongos. Essa combinação desencadeia e libera rapidamente um número significativo de citocinas inflamatórias, resultando em inflamação local e sistêmica excessiva. Vários estudos relataram a indução de modelos SAP em camundongos por meio da injeção intraperitoneal de Caeruleína combinada com LPS. Isso pode ser atribuído ao fato de que a injeção intraperitoneal de ceruleína pode causar edema pancreático e hemorragia em camundongos, enquanto a adição de LPS pode induzir imediatamente necrose pancreática e exacerbar a resposta inflamatória sistêmica, sepse e até falência de órgãos. Atualmente, há variação na dosagem e frequência de injeções intraperitoneais de caeruleína, bem como inconsistência na dosagem adicional de LPS. Alcançar consistência em modelos SAP de mouse é um desafio 9,10,11,12; Portanto, é necessário estabelecer um protocolo padronizado para a obtenção de um modelo ideal. Neste artigo, descrevemos um protocolo para injeção intraperitoneal em camundongos e investigamos a frequência ideal de injeção e dosagem adicional de LPS.
Protocolo
Este protocolo foi revisado e aprovado pelo Comitê de Ética do Primeiro Hospital Afiliado da Universidade de Ciência e Tecnologia de Anhui (Huainan, China) (Código de Ética: 2023-KY-905-001). O estudo seguiu as diretrizes do National Institutes of Health para o cuidado e uso de roedores de pesquisa em todos os procedimentos com animais. Camundongos adultos C57BL/6J pesando 20-30 g foram usados para o presente estudo. Os camundongos foram alojados em um laboratório animal por uma semana sob condições controladas (aproximadamente 21 ° C com um ciclo dia-noite alternado de 12 horas). Os ratos tiveram acesso ad libitum a comida e água por toda parte. Os detalhes dos reagentes e equipamentos usados no estudo estão listados na Tabela de Materiais.
1. Preparação animal
- Atribua 84 camundongos C57BL / 6J saudáveis a seis grupos, incluindo o grupo controle, lesão pancreática (PI) I, PI II, PI III, PI IV e PI V.
- Antes de iniciar o procedimento de modelagem, rotule cada grupo de camundongos com entalhes nas orelhas e deixe-os jejuar por 12 horas.
2. Preparação do diluente de fármaco induzido
- Dissolva a caeruleína (1 mg) em 1 ml de PBS e leve ao frigorífico a -20 °C.
- Meça e registre o peso dos camundongos experimentais 1 h antes da injeção intraperitoneal da droga.
- Extrair a massa total de Caeruleína necessária numa proporção de 50 μg/kg, com base no peso total de todos os ratinhos.
- Dilua novamente o medicamento Caeruleína obtido com PBS.
NOTA: O volume total de diluição de PBS deve ser equivalente a 5 vezes o valor do peso total de todos os camundongos. O mesmo método de diluição foi utilizado para obter o diluente LPS.
3. Injeção intraperitoneal
NOTA: Injeções intraperitoneais foram administradas a cada grupo de camundongos de acordo com o protocolo descrito na Tabela Suplementar 1 para induzir o modelo. Outros 10 camundongos foram agrupados e tratados observando as taxas de sobrevida de 7 dias.
- Agarre e segure os ratos de forma que a barriga dos ratos fique voltada para cima e a cabeça fique posicionada abaixo da cauda para evitar danos aos órgãos ao inserir a seringa.
- Desinfete o abdômen dos camundongos usando bolas de algodão com álcool 75%.
- Segure a seringa com a mão direita (usando uma agulha medindo ≤0,5/≥0,3) e insira a agulha na pele subcutânea em qualquer lado esquerdo da linha branca abdominal.
NOTA: Mude para o lado direito para a próxima injeção. - Assim que a agulha atingir a camada subcutânea, mova-a para frente aproximadamente 3-5 mm e, em seguida, insira a agulha da seringa na cavidade abdominal em um ângulo de 45°. Neste ponto, deve-se sentir alguma resistência.
- Mantenha a agulha estacionária e injete a substância lentamente.
NOTA: Não exceda 5 vezes o valor do peso dos camundongos como o volume de uma única injeção intraperitoneal. - Após a injeção, retire a agulha e massageie suavemente e pressione o local da injeção com um cotonete estéril para difundir totalmente o medicamento na cavidade abdominal dos camundongos.
- Use uma nova seringa para repetir com os próximos camundongos experimentais.
4. Teste de habilidade comportamental em campo aberto
NOTA: 12 h após a última injeção intraperitoneal, foi realizado um teste de habilidade comportamental em campo aberto para avaliar a distância total da atividade e o tempo de imobilidade dos camundongos.
- Coloque quatro caixas brancas idênticas diretamente abaixo da câmera.
- Conecte a câmera ao computador usando um cabo de vídeo.
- Certifique-se de que a caixa experimental esteja limpa e livre de odores antes de iniciar o experimento.
- Posicione o animal no meio da grade, de costas para o experimentador, e deixe-o se adaptar ao ambiente por 10 min.
- Inicie o software de rastreamento de vídeo e clique no menu Arquivo para criar um novo experimento.
- Configure o monitoramento para quatro campos de visão simultâneos.
- Marque o comprimento e a largura do objeto experimental que pode se mover dentro da caixa na tela de monitoramento em tempo real (30 cm × 30 cm).
- Quando a configuração estiver concluída, comece a vigilância e gravação por vídeo.
- Registre a atividade dos camundongos por 15 min.
- Após o teste, retire o animal da grade e devolva-o à gaiola. Limpe completamente a grade usando um esterilizante contendo dióxido de cloro.
5. Coleta e teste do sangue periférico de camundongos
- Eutanasiar os camundongos (seguindo o protocolo aprovado institucionalmente).
- Realizar a eutanásia nos camundongos experimentais 36 h após a injeção intraperitoneal. Meça e registre o peso corporal dos camundongos antes da eutanásia.
NOTA: Administre 0,18 mL de hidrato de cloral a 10% por via intraperitoneal, garantindo que não haja reação à estimulação do dedo do pé ou cauda. - Com a mão esquerda, prenda os ratos e, com a mão direita, segure a tesoura para aparar os bigodes de um lado dos ratos.
- Pressione suavemente a pele ao redor do olho para induzir congestão e protrusão do globo ocular.
- Use uma pinça curva para agarrar o globo ocular e removê-lo rapidamente, coletando sangue periférico em um tubo de microcentrífuga.
NOTA: Foram utilizados dois tipos diferentes de tubos de microcentrífuga, um contendo anticoagulante e outro sem. - Simultaneamente, pressione levemente a área do coração dos camundongos com o dedo médio da mão esquerda para aumentar a velocidade de bombeamento do coração.
- Realizar a eutanásia nos camundongos experimentais 36 h após a injeção intraperitoneal. Meça e registre o peso corporal dos camundongos antes da eutanásia.
- Deixe o sangue periférico sem anticoagulante em temperatura ambiente por 30 min.
- Meça as concentrações de amilase sérica (Amy) e lipase (Lip) usando um analisador bioquímico automatizado por meio do método de taxa enzimática e método de circulação enzimática (seguindo as instruções do fabricante).
- Determine os níveis de indicadores inflamatórios, como Pro Calcitonina (PCT) no plasma usando o método de quimioluminescência usando um gerador de imagens de quimioluminescência comercial (seguindo as instruções do fabricante).
- Use kits ELISA para medir os níveis de HMGB-1, IL-6 e TNF-α no soro de camundongos (seguindo as instruções do fabricante).
- Analise o sangue periférico tratado com anticoagulante usando um analisador de células sanguíneas totalmente automático para avaliar os parâmetros relevantes.
6. Coleta do tecido pancreático e preparação de uma seção de parafina
- Coloque os ratos em decúbito dorsal e prenda-os em uma placa de espuma.
- Faça a barba e desinfete a área, faça uma incisão mediana abdominal e vire o tubo do intestino delgado para a direita para expor totalmente o pâncreas.
- Desconecte o duodeno e o ducto pilórico e localize o intestino delgado abaixo do pâncreas. Libere totalmente o tecido pancreático ao longo do ducto intestinal.
- Use uma pinça desdentada para prender o baço e puxe suavemente para cima.
NOTA: Não toque diretamente no tecido pancreático e evite usar força excessiva durante todo o processo de dissociação. - Disseque bruscamente o tecido do ligamento pancreático posterior até a cabeça do pâncreas e desconecte o ducto biliar e os vasos sanguíneos.
- Remova o tecido pancreático, seque a umidade da superfície com papel absorvente, pese e registre.
- Fixe metade do tecido pancreático com paraformaldeído a 4% e guarde a outra metade na geladeira a -80 °C.
- Prepare as seções de parafina pancreática seguindo as etapas abaixo.
- Limpe o tecido pancreático fixo com álcool 75% e corte-o em um tamanho de aproximadamente 0,5 cm × 0,5 cm.
- Mergulhe o tecido em etanol a 70% por 20 min, etanol a 80% por mais 20 min e etanol a 90% por 15 min.
- Trate o tecido duas vezes com etanol a 95% por 15 minutos de cada vez e depois duas vezes com etanol a 100% por 5 minutos de cada vez.
- Submeter o tecido a duas rodadas de tratamentos de 12 min e 5 min com solução de xileno para transparência.
- Mergulhe o tecido transparente em um tanque de cera a 65 ° C por 1 h.
- Incorpore o tecido em parafina derretida e deixe esfriar. Obtenha cortes de parafina pancreática com um fatiador (espessura: 5 μm).
- Alise as fatias de parafina obtidas em água a 45 °C, monte-as e seque-as (condições de cozimento: 40 °C por 14-16 h).
7. Coloração de hematoxilina e eosina (H & E)
- Coloque as seções de parafina pancreática em xileno I e II por 30 min, depois em álcool anidro, 95%, 85% e 75% por 5 min cada e água ultrapura por 5 min.
- Manchar o núcleo da célula com hematoxilina por 160 s e depois enxaguar lentamente com água corrente.
- Aplique uma solução de diferenciação de álcool com ácido clorídrico por 5-10 s e depois enxágue com água corrente rapidamente.
- Trate as seções com álcool anidro por 5 min.
- Incubar o citoplasma com eosina durante 30 s e depois enxaguar com água corrente.
- Mergulhe as seções em etanol 75%, 85%, 95% e 100% por 10 s cada e, em seguida, trate com xileno por 5 min para desidratar.
- Por fim, sele as seções com resina neutra e observe ao microscópio.
- Realizar a pontuação patológica e os padrões13.
NOTA: Determine a gravidade da pancreatite com base em indicadores como edema, necrose acinar, sangramento, hemorragia e necrose gordurosa e inflamação inflamatória e perivascular. Use as diretrizes de implementação publicadas anteriormente para pontuar13.
8. Coloração imuno-histoquímica
- Desparafinar as seções de tecido pancreático embebidas em parafina em xileno e, em seguida, reidratá-las em um gradiente de soluções de etanol.
- Realize o bloqueio enzimático endógeno usando 3% H2O2 por 20 min após uma ruptura de membrana de 30 min.
- Bloquear o anticorpo com soro bovino a 5% à temperatura ambiente durante 30 min e, em seguida, incubar durante a noite a 4 °C com uma diluição de 1:1500 de anti-HMGB1 de coelho.
- Enxágue as seções com PBS e, em seguida, incube-as em anticorpos secundários correspondentes por 30 min a 37 ° C. Depois disso, realize o desenvolvimento da cor DAB, a contracoloração da hematoxilina e sele com goma neutra.
9. Método TUNEL para detecção de apoptose em cortes pancreáticos
- Desparafinar as seções de parafina pancreática em xileno por 5 min, repetir duas vezes e lavar com etanol gradiente (100% por 5 min, 90% por 2 min, 70% por 2 min e água destilada por 2 min).
- Lave o excesso de líquido ao redor das seções de parafina usando PBS. Trate cada amostra com 100 μL de Proteinase K, garantindo a cobertura completa do tecido. Incubar as amostras a 37 °C durante 20 min. Em seguida, mergulhe as amostras em PBS 3 vezes, cada vez por 5 min.
NOTA: A solução de proteinase K foi preparada diluindo a solução original de proteinase K (200 μg/mL) com PBS na proporção de 1:9 (volume), resultando em uma concentração final de 20 μg/mL, excluindo DNase. A lavagem completa da proteinase K é essencial para evitar interferência nas reações de rotulagem subsequentes. - Adicione uma quantidade adequada de 3% de H2O2 (diluído por PBS) no tecido para infiltrá-lo totalmente e incubar por 20 min. Enxágue o lenço com PBS 3 vezes por 5 min cada.
NOTA: As seções de parafina devem ser mantidas úmidas. Para inativar as peroxidases endógenas no tecido, o tempo de incubação não deve ser muito longo para evitar falsos positivos devido à quebra do DNA causada por 3% H2O2. - Cubra toda a área da amostra a ser testada com 50 μL de tampão de equilíbrio e incube por 10 min.
- Remova o máximo possível de buffer de equilíbrio. Em seguida, adicione 56 μL de tampão de incubação TdT a cada amostra de tecido e incube por 1 h (à temperatura ambiente).
NOTA: A lâmina não deve secar e a exposição à luz deve ser evitada. O tampão de incubação TdT foi preparado de acordo com as instruções do fabricante (enzima TdT recombinante: Mistura de marcação Biotina-dUTP: Tampão de equilíbrio = 1 μL: 5 μL: 50 μL). - Lave as amostras de tecido com PBS imediatamente. Enxágue-os 4 vezes por 5 min cada. Remova cuidadosamente qualquer excesso de solução de PBS ao redor das amostras com papel de filtro.
- Adicione 100 μL de solução de reação Streptavidin-HRP previamente diluída (Streptavidin-HRP: TBST = 1: 300) a cada amostra de tecido para a reação Streptavidin-HRP. Incubar por 30 min. Em seguida, lave as amostras com PBS e enxágue-as 3 vezes por 5 min cada.
- Realize a coloração DAB adicionando 50 μL de DAB a cada seção de parafina. Observe a coloração ao microscópio em tempo real. Depois que a coloração positiva aparecer, coloque imediatamente as lâminas em uma caixa úmida. Pare a reação lavando-o com água pura.
- Mergulhe as lâminas em solução de coloração de hematoxilina por 3-5 min e depois enxágue com água pura.
- Diferenciar em solução de diferenciação de hematoxilina por cerca de 2 s, seguido de enxágue imediato com água pura.
- Obtenha a coloração azul usando a solução de hematoxilina por alguns segundos e enxágue as lâminas com água pura.
NOTA: Realize um exame microscópico após a coloração nuclear. Se a coloração for muito escura, retorne as lâminas para a solução de diferenciação. Se a coloração for muito leve, reinicie o processo de coloração a partir da etapa de coloração nuclear. - Desidrate as amostras com 4 rodadas de etanol anidro fresco por 5 min cada. Em seguida, mergulhe-os em butanol por 5 min e em xileno por 5 min. Por fim, use xileno fresco por mais 5 min.
- Monte as lâminas usando goma neutra. Deixe-os secar naturalmente ou seque-os em um forno a 60 °C.
- Realize o exame histológico usando um microscópio de luz branca. Os núcleos apoptóticos aparecerão marrons.
- Calcule o índice apoptótico (IA) correspondente.
NOTA: Observe os slides de maneira duplo-cega. Em lâminas positivas para TUNEL, selecione aleatoriamente 5 áreas positivas sob alta ampliação (400x) e conte pelo menos 100 células acinares em cada área para determinar a porcentagem de células positivas. IA = (número total de células apoptóticas/número total de células) × 100%.
10. Citometria de fluxo
- Obtenha tecidos pancreáticos frescos e lave-os bem após a perfusão com PBS.
- Prepare uma solução de digestão IV de colagenase a 0,5% e use uma tesoura de tecido estéril para digerir adequadamente os tecidos pancreáticos.
- Adicione uma solução de terminação de digestão BSA a 5%, dependendo da condição dos fragmentos pancreáticos e da turbidez do líquido, e centrifugue a mistura em baixa temperatura por 5 min (~ 300 x g, 4 ° C).
- Rejeitar o sobrenadante para terminar a digestão.
- Preparar um meio de cultura celular contendo fluoreto de fenilmetano sulfonil (PMSF) e 2,5% de suspensão de células de soro bovino fetal para ressuspender as células pancreáticas.
- Filtre as suspensões de células acinares pancreáticas através de uma malha de nylon de 200 malhas para obter suspensões celulares através da filtragem celular.
- Centrifugue a suspensão de células acinares pancreáticas a baixa temperatura (siga as condições mencionadas na etapa 10.3).
- Descarte o sobrenadante.
- Lave as células com PBS pré-resfriado.
- Ressuspenda suavemente as células em tampão de ligação 1x pré-resfriado por meio de ressuspensão centrífuga.
- Rotule as células acinares pancreáticas com Anexina V-FITC/PI de acordo com as instruções do fabricante após ajustar a concentração celular.
- Use citometria de fluxo dentro de 1 h para detectar apoptose em células acinares pancreáticas.
11. Detecção de Western blot de Caspase-3 e HMGB-1
- Extraia a proteína pancreática.
- Extraia 50 mg de tecido pancreático e corte-o em pequenos fragmentos.
- Adicione 1 mL de tampão de lise RIPA (contendo PMSF e inibidor de protease fosforilada).
- Homogeneizar o tecido pancreático no gelo por 5 min usando um moedor elétrico.
- Incubar o tecido homogeneizado no gelo com agitação suave por 2 h.
- Centrifugar o homogenato a 4 °C durante 10 min a 4.500 x g.
- Recolher a solução sobrenadante e conservá-la a -80 °C.
- Realize a quantificação de proteínas.
- Diluir um determinado volume de amostra padrão BSA (25 mg/ml) até uma concentração de 0,5 mg/ml.
- Prepare uma quantidade específica de solução de trabalho BCA misturando 50 volumes de solução BCA A com 1 volume de solução BCA B, garantindo uma mistura completa e uniforme.
- Coloque a amostra padrão BSA nos orifícios de amostra padrão em uma placa de 96 poços na ordem de 0, 1, 2, 4, 8, 12, 16 e 20 μL. Equilibre o volume de cada orifício com água destilada, resultando em um volume total de 20 μL.
- Adicione 2 μL de amostras nos orifícios de amostra e, em seguida, adicione sequencialmente 18 μL de água destilada para diluição (1:9).
- Encha cada poço com 200 μL de solução de trabalho BCA e deixe-o repousar a 37 °C por aproximadamente 20-30 min.
- Medir a absorvância no comprimento de onda de 562 nm. Calcule a concentração de proteína das amostras com base na curva padrão.
- Adicionar um volume específico de solução de craqueamento RIPA e tampão diluente para diluir as amostras até que a concentração atinja 5-10 μg/μL, o que é considerado adequado.
- Armazenar as amostras a -20 °C após a desnaturação das proteínas (100 °C; 10 min).
- Execute o Western blotting.
- Faça os preparativos para o SDS-PAGE.
- Instale os moldes de fabricação de cola e inspecione seu desempenho de vedação.
- Adicione TEMED ao adesivo de separação de 10% e misture uniformemente.
- Injete a mistura no molde, representando aproximadamente dois terços do volume, evitando bolhas.
- Adicione isopropanol ao molde e pressione o adesivo por cerca de 40 min.
- Use o mesmo programa para configurar o adesivo concentrado a 5%.
- Despeje o isopropanol e adicione o adesivo imediatamente.
- Coloque o pente na vertical até que a cola polimerize completamente.
- Execute a operação de eletroforese.
- Adicione a amostra a ser testada na ordem de controle experimental esperada, na ordem inversa, nos orifícios de amostragem do adesivo SDS-PAGE.
- Adicione simultaneamente a Marca de Proteína para determinar a localização da proteína alvo e da proteína de referência interna.
- Coloque a amostra no tanque de eletroforese após a conclusão da adição da amostra.
- Inicialmente, execute a 80 V por 30 min, seguido de executar o gel para separar a proteína a 100 V por 60 min.
NOTA: Deve-se prestar atenção à posição do azul de bromofenol para evitar eletroforese excessiva.
- Realize a transferência de proteínas.
- Corte o filme PVDF no canto superior direito para servir como uma marca.
- Coloque o filme de PVDF em uma solução de metanol por 5 a 10 s para ativar.
- Mergulhe o filme de PVDF em um tampão de eletroforese por aproximadamente 15 min.
- Remova cuidadosamente o gel após a eletroforese e corte o excesso de gel, garantindo que o gel permaneça úmido durante todo o processo.
- Monte a tala na seguinte ordem: placa negativa → esponja → três camadas de papel de filtro → gel → filme de PVDF → três camadas de papel de filtro → esponja → placa positiva.
NOTA: Certifique-se de que não haja bolhas entre o gel e o filme de PVDF. - Coloque o clamp montado na ranhura rotativa úmida (preto com preto) com cubos de gelo posicionados ao seu redor.
- Ligue a energia e inicie a transferência do filme a 400 mA por 100 min.
- Realize a selagem do filme de PVDF e a incubação de anticorpos primários e secundários.
- Remova suavemente o filme de PVDF após a transferência e enxágue com TBST por 10 min, repetindo o processo 3-5 vezes.
- Sele o filme de PVDF em leite desnatado a 5% por 2 h.
- Remova o filme de PVDF e enxágue com TBST por 10 min, repetindo o processo 4 vezes.
- Colocar a película de PVDF e o anticorpo primário diluído juntos num frigorífico a 4 °C agitando suavemente e incubar durante a noite.
- Retire o filme de PVDF no dia seguinte e enxágue com TBST por 10 min, repetindo o processo 4 vezes.
- Incube o filme de PVDF em diluente de anticorpo secundário marcado com HRP por aproximadamente 2 h.
- Enxágue o filme de PVDF com TBST por 10 min, repetindo o processo 4 vezes.
- Exponha o filme e analise-o.
- Aplique a solução ECL preparada no filme uniformemente.
- Exponha o filme em uma sala escura com um medidor de exposição por aproximadamente 2-3 min e depois guarde-o.
- Realize a análise usando o software de imagem J.
- Faça os preparativos para o SDS-PAGE.
Resultados
O processo de modelagem experimental de camundongos é ilustrado na Figura 1. Após 12 h do término da injeção, um gravador de vídeo de campo aberto foi usado para monitorar a distância de movimento e a duração da imobilidade de diferentes grupos experimentais de camundongos por 5 ciclos (Figura 2A). Durante os 5 ciclos, os camundongos do grupo PI V mantiveram um baixo nível de distância de movimento em 3 minutos, enquanto a taxa de imobilidade em 3 minutos aumentou a cada ciclo subsequente ( Figura 2B , C ). Além disso, foi realizada análise estatística da distância total de movimento de camundongos de diferentes grupos experimentais durante os 5 ciclos. O grupo PI V apresentou a menor distância total de movimento em comparação com os outros grupos experimentais, e a diferença foi estatisticamente significativa (p < 0,001) (Figura 2D,E). Com exceção do grupo controle e do grupo PI I, os camundongos dos outros grupos experimentais exibiram crescimento negativo no peso do valor D. Dentre eles, o grupo PI V apresentou a maior mudança de peso, e a diferença na mudança de peso em relação aos demais grupos experimentais foi estatisticamente significativa (Figura 2F). Após avaliar a taxa de sobrevivência de mais 10 camundongos em cada grupo experimental, os resultados mostraram que a taxa de mortalidade dos camundongos do grupo PI V atingiu 80% no5º dia. No entanto, não houve diferença estatisticamente significativa na taxa de mortalidade entre os outros quatro grupos experimentais e os camundongos do grupo controle (Figura 2G).
Usando um microscópio de alta potência, inchaço celular significativo, necrose e infiltração de células inflamatórias foram observados nos grupos PI IV e PI V de camundongos (Figura 3A, B). Usando os critérios de classificação fornecidos na Tabela Suplementar 2, a patologia pancreática de diferentes grupos experimentais de camundongos foi avaliada e observadas diferenças significativas no escore de patologia pancreática em comparação com os camundongos do grupo controle (p < 0,001) (Figura 3C; Figura Suplementar 1). Além disso, em comparação com o grupo controle, os níveis séricos de amilase e lipase nos camundongos medidos foram significativamente maiores nos grupos experimentais PI II a PI V, e as diferenças foram estatisticamente significativas. Curiosamente, não houve diferença estatisticamente significativa nos camundongos do grupo PI I (Figura 3D, E). O método ELISA foi empregado para avaliar os níveis de marcadores inflamatórios14, incluindo TNF-α e IL-6, no soro de camundongos. Os achados revelaram que os níveis de TNF-α e IL-6 nos camundongos do grupo PI V foram significativamente maiores do que nos outros grupos experimentais, e as diferenças foram estatisticamente significativas (Figura 3F, G). Em comparação com o grupo controle, os níveis de PCT aumentaram em todos os quatro grupos experimentais, mas apenas a diferença no grupo PI V foi estatisticamente significativa (p < 0,05) (Figura 3H).
Estado apoptótico dos tecidos pancreáticos em diferentes grupos experimentais de camundongos
Ao realizar a coloração TUNEL nos tecidos pancreáticos de cada grupo de camundongos, foi observado o estado de necrose celular nos tecidos pancreáticos de diferentes grupos experimentais (Figura 4A). Os valores da escala de cinza (DO) por unidade de área de cortes de tecido pancreático e a taxa positiva de necrose celular foram analisados semiquantitativamente usando o software Image J. Os resultados mostraram que, em comparação com os outros grupos experimentais, o nível de necrose celular nos tecidos pancreáticos do grupo PI V de camundongos aumentou significativamente, e a diferença foi estatisticamente significativa (p < 0,001) (Figura 4B,C). Experimentos de immunoblotting de proteínas foram realizados para avaliar os níveis de expressão da proteinase-3 específica do aspartato de cisteínil (Caspase-3), um marcador de necrose celular, nos tecidos pancreáticos de camundongos de diferentes grupos experimentais (Figura 4D). A quantificação da expressão da caspase-3 mostrou que o nível de expressão da proteína caspase-3 nos tecidos pancreáticos do grupo PI V foi significativamente aumentado, e a diferença foi estatisticamente significativa (p < 0,001). Os níveis de expressão proteica foram quantificados e normalizados para o controle interno GapDH (Figura 4E). Além disso, suspensões frescas de células acinares pancreáticas foram marcadas com Anexina V-FITC/PI e analisadas por citometria de fluxo. Verificou-se que, em comparação com os outros grupos experimentais de camundongos, o grupo PI V apresentou uma taxa positiva significativamente maior de morte celular, que foi estatisticamente significativa (p < 0,001) (Figura 4F,G).
O conteúdo de HMGB-1 no soro periférico e o nível de expressão de HMGB-1 no tecido pancreático
A fim de investigar a relação entre a proteína HMGB-1 e a lesão pancreática, foram realizadas colorações imuno-histoquímicas e quantificação nos tecidos pancreáticos de camundongos em cada grupo experimental. Houve diferença estatisticamente significativa entre os grupos experimental e controle (p < 0,001) (Figura 5A,B). O ELISA foi utilizado para medir os níveis de HMGB-1 no soro de camundongos de diferentes grupos experimentais. Os resultados mostraram que, em comparação com o grupo controle, os níveis séricos de HMGB-1 foram significativamente maiores em todos os grupos experimentais, com o maior nível observado no grupo PI V, e a diferença foi estatisticamente significativa (p < 0,001) (Figura 5C). Além disso, a análise de Western blot detectou expressão elevada da proteína HMGB-1 nos tecidos pancreáticos de camundongos em todos os grupos experimentais, com diferenças estatisticamente significativas em relação ao grupo controle (p < 0,001) (Figura 5D,E).
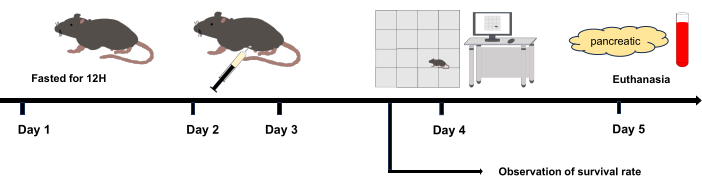
Figura 1: Fluxograma experimental. Dia 2 e Dia 3: Injeção intraperitoneal. Dia 4: O experimento de campo aberto foi iniciado após 12 h da última injeção intraperitoneal. Dia 5: Eutanasiado 36 h após a injeção intraperitoneal. Clique aqui para ver uma versão maior desta figura.

Figura 2: Mudanças macroscópicas no modelo de camundongos PI. (A) O gráfico de trajetória de movimento em tempo real de camundongos é representado. (B) A distância total de movimento dentro de cada período de monitoramento para diferentes grupos experimentais de camundongos. (C) A porcentagem de tempo de imobilidade dentro de cada período de monitoramento para diferentes grupos experimentais de camundongos. (D, E) A distância total de movimento e a porcentagem de tempo de imobilidade durante 15 min foram analisadas para camundongos em diferentes grupos experimentais. (F) O valor D que representa o peso dos camundongos antes e depois do processo de modelagem é mostrado. (G) A sobrevivência de 10 camundongos em cada grupo foi observada nos 7 dias seguintes à injeção intraperitoneal. Os dados são expressos como médias ± EPM, n = 4. "ns" denota não significativo, *P < 0,05, ****P < 0,001. Clique aqui para ver uma versão maior desta figura.

Figura 3: Alterações patológicas na pancreatite de camundongos entre diferentes grupos experimentais. (A) As seções histológicas coradas com H & E do tecido pancreático de camundongos em diferentes grupos experimentais (seções de tecido pancreático embebidas em parafina coradas com hematoxilina e eosina, ampliações de 100 vezes e barras de escala de 200 μm e barras de escala de 400 vezes e barras de escala de 50 μm, respectivamente. Setas longas amarelas indicam ilhotas; setas longas vermelhas indicam células acinares; setas longas marrons indicam vasos sanguíneos; setas longas azuis indicam dutos). (B) Cálculo da relação entre o peso pancreático e o peso corporal em camundongos. (C) Pontuação patológica do pâncreas de camundongos. (D, E) Detecção dos níveis séricos de amilase e lipase em camundongos. (F-G) Medição ELISA dos níveis séricos de TNF-α e IL-6 em camundongos. (H) Avaliação do nível PCT. Os dados são expressos como médias ± EPM, n = 4. "ns" denota não significativo, *P < 0,05, ****P < 0,001. Clique aqui para ver uma versão maior desta figura.
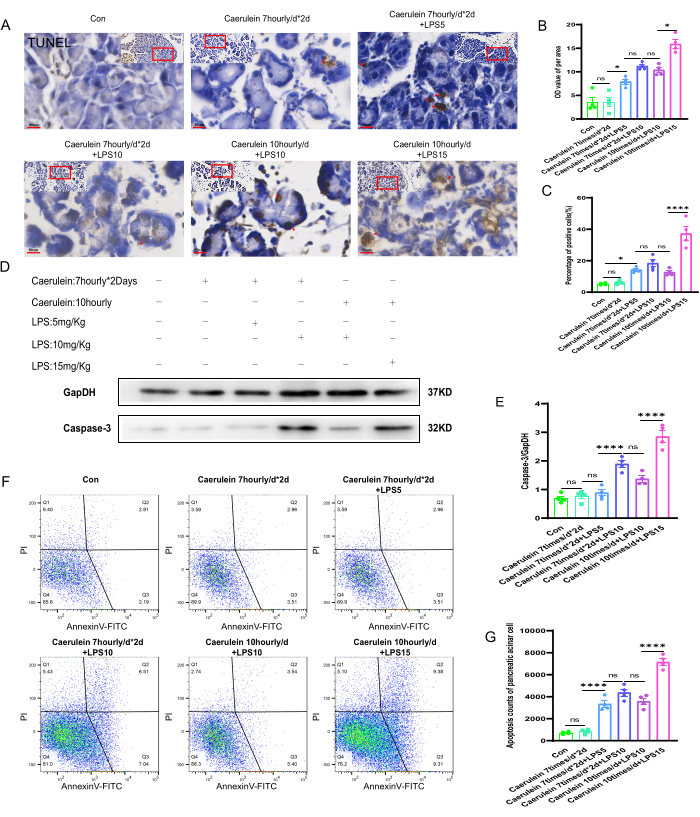
Figura 4: Apoptose do tecido pancreático em camundongos. (A) Imagens representativas da coloração TUNEL foram obtidas a partir de seções de parafina pancreática de camundongos e imagens de área ampliada. (400x, barra de escala 50 μm, amarelo acastanhado são células positivas). (B, C) Análise quantitativa do valor da escala de cinza por unidade de área de seções coradas com TUNEL de tecido pancreático de camundongos e a porcentagem de células mortas coradas positivamente. (D) O nível de expressão de Caspase-3 no tecido pancreático foi detectado por Western blot. (E) Quantificação da expressão de Caspase-3 no tecido pancreático. (F) A citometria de fluxo foi empregada para avaliar a extensão da morte celular em células acinares pancreáticas de camundongos. (G) Enumeração de células mortas em estágio avançado em células acinares pancreáticas de camundongo. Os dados são expressos como médias ± EPM, n = 4. "ns" denota não significativo, *P < 0,05, ****P < 0,001. Clique aqui para ver uma versão maior desta figura.

Figura 5: A expressão de HMGB-1 no tecido pancreático de camundongos. (A) Imagens representativas e imagens ampliadas (x400, barra de escala de 50 μm) de coloração imuno-histoquímica de HMGB-1 em cortes pancreáticos. A cor amarelo-acastanhada indica células positivas (n = 4). (B) A porcentagem de células positivas para HMGB-1 em seções de tecido pancreático (n = 24). (C) O nível de HMGB-1 no soro de camundongo (n = 4). (D, E) Um Western blot foi realizado para detectar o nível de expressão de HMGB-1 no tecido pancreático e para obter os resultados da quantificação (n = 4). Os dados são expressos como médias ± EPM, "ns" denota não significativo, *P < 0,05, ****P < 0,001. Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: Lesão de múltiplos órgãos no modelo de camundongos do grupo PI V. (A) Imagens representativas de alterações histológicas nos tecidos do pâncreas, pulmão, fígado e rim coletadas dos camundongos do grupo CON e PI V foram analisadas usando coloração H & E (aumento de 200x, barra de escala de 50 μm). As alterações patológicas associadas à necrose das células acinares são indicadas por setas pretas. Setas amarelas indicam alterações patológicas caracterizadas por hemorragia intersticial e edema nos alvéolos. O edema e a necrose dos hepatócitos são denotados por setas verdes. As alterações patológicas relacionadas à hemorragia glomerular são marcadas por setas vermelhas. (B) O cálculo dos escores histológicos foi realizado nos tecidos do pâncreas, pulmão, fígado e rim obtidos dos camundongos do grupo CON e do grupo PI V. Clique aqui para baixar este arquivo.
Tabela Suplementar 1: Protocolo de injeção intraperitoneal. Clique aqui para baixar este arquivo.
Tabela Suplementar 2: Critérios de pontuação patológica para gravidade da pancreatite. Clique aqui para baixar este arquivo.
Discussão
Atualmente, faltam meios eficazes para melhorar a alta taxa de mortalidade em pacientes com pancreatite aguda grave. É crucial investigar a eficácia dos medicamentos no aumento dos mecanismos de estabilidade imunológica. Existe uma necessidade urgente de um modelo animal ideal para pancreatite aguda grave. Camundongos com histórico genético C57BL/6J são amplamente utilizados em pesquisas biomédicas, incluindo estudos sobre fisiopatologia SAP. Mais de 70 anos de diferenciação genética em camundongos B6J resultaram na deleção espontânea de vários éxons15, levando à redução da sensibilidade à lesão pancreática induzida por Caeruleína16. Além disso, os modelos animais existentes de pancreatite aguda apresentam limitações como trauma cirúrgico ou aplicabilidade apenas em animais maiores, o que dificulta as investigações científicas utilizando esses modelos. Portanto, é altamente valioso estabelecer um modelo animal estável, eficiente e conveniente usando essa cepa genética específica.
A ceruleína é um análogo da colecistocinina que induz danos ao tecido pancreático, causando obstrução relativa do fluido digestivo pancreático e da secreção enzimática por meio de injeções de alta frequência em um curto período quando os camundongos jejuaram e armazenaram quantidades suficientes de fluido digestivo17. O LPS é o principal componente encontrado nas paredes celulares bacterianas e pode causar MODS e SIRS em camundongos18. Um estudo anterior demonstrou que a combinação de injeções de caeruleína em diferentes frequências com doses variadas de LPS administradas por injeção intraperitoneal induziu alterações patológicas semelhantes às observadas na PAS humana19,20. Este estudo usou uma abordagem não invasiva para induzir vários graus de lesão pancreática, combinando diferentes frequências de injeções de ceruleína com diferentes doses de LPS administradas por via intraperitoneal em camundongos. Garantir a absorção uniforme pelo peritônio foi crucial durante o desenvolvimento do protocolo. Para cumprir esse requisito, é crucial seguir rigorosamente as etapas da injeção intraperitoneal para garantir um controle preciso sobre a administração de cada medicamento. Além disso, a fricção suave e a aplicação de pressão adequada no local da injeção com um cotonete estéril após cada injeção de medicamento são essenciais para a distribuição uniforme do medicamento por toda a cavidade peritoneal. Além disso, a colocação exata e precisa da cabeça do alfinete na cavidade peritoneal, com a agulha apontando para a área central do abdome superior, é de extrema importância. Deve ser realizado um treino prévio para permitir que os operadores percebam com precisão qualquer ausência de resistência ao inserir a agulha na cavidade abdominal. A utilização de uma bomba de infusão microquantitativa em vez da operação manual pode potencialmente melhorar a qualidade da injeção de medicamentos; Infelizmente, isso não foi implementado neste estudo. No entanto, empregando diferentes esquemas de injeção, induzimos vários graus de lesão pancreática e observamos efetivamente diferenças na lesão pancreática causada por diferentes frequências e doses sob condições técnicas idênticas induzidas por Caerulein combinada com injeções de LPS. Isso fornece informações valiosas para o uso futuro de Caerulein em modelos animais não invasivos para indução de pancreatite aguda grave.
A combinação de ceruleína e LPS resultou em níveis séricos significativamente elevados de amilase e lipase, aumento do peso pancreático e alterações histológicas, incluindo infiltração extensa de células inflamatórias, edema de células acinares pancreáticas, necrose e hemorragia, conforme demonstrado pela coloração de hematoxilina e eosina (HE). Além disso, com uma dose crescente de LPS, as alterações patológicas no pâncreas tornaram-se mais pronunciadas. No entanto, vale ressaltar que não houve diferenças perceptíveis nos escores de patologia pancreática entre os grupos PI IV e PI V, enquanto a extensão da necrose das células do tecido pancreático foi mais pronunciada no grupo PI III em comparação com o grupo PI IV. Essa observação sugere que a frequência de dosagem de ceruleína pode servir como um fator primário que contribui para a lesão pancreática, enquanto o LPS exacerba sua progressão, levando a danos inflamatórios sistêmicos18,21. HMGB-1 é uma proteína que funciona dependendo de sua localização22. O HMGB-1 extracelular atua como uma proteína envolvida nos sinais de alerta da inflamação e está intimamente associado à gravidade da pancreatite aguda 23,24,25. Neste estudo, os níveis séricos de HMGB-1 em camundongos de todos os grupos experimentais foram significativamente maiores em comparação com o grupo controle, com o grupo PI V apresentando o aumento mais significativo. Experimentos imuno-histoquímicos e de eletroforese de proteínas também confirmaram a alta expressão de HMGB-1 no tecido pancreático. Esta importante proteína pode servir como alvo terapêutico para inibir a tempestade inflamatória na pancreatite aguda grave.
Em resumo, é crucial desenvolver um modelo não invasivo, simples e de fácil execução de SAP em camundongos. Neste protocolo experimental, a indução de lesão pancreática usando Caeruleína combinada com LPS é confiável e eficaz. Ao administrar Caerulein por via intraperitoneal por dez dias consecutivos na dose de 50 μg/kg, seguida por uma única injeção intraperitoneal de 15 mg/kg de LPS, um modelo animal estável, confiável, econômico e eficiente de SAP pode ser estabelecido.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este estudo foi apoiado por Projetos de Pesquisa em Saúde e Ciências Médicas na cidade de Huainan (No. HNWJ2023005); Programa do Plano Municipal de Ciência e Tecnologia na Cidade de Huainan (No.2023151); Programa de Treinamento em Inovação e Empreendedorismo para Estudantes do Colégio Provincial de Anhui (nº S202310361254); O nono lote do "50 · Estrelas da Ciência e Tecnologia" na cidade de Huainan e no Projeto de Construção de Especialidades Clínicas Chave da Província de Anhui. Gostaríamos de expressar nossa gratidão ao Departamento de Laboratório do Primeiro Hospital Afiliado da Universidade de Ciência e Tecnologia de Anhui por fornecer os dados de teste relevantes.
Materiais
| Name | Company | Catalog Number | Comments |
| 20× Citric Acid Antigen Repair Solution (pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1202-250 ml | |
| Amylase | Mindray,China | ||
| Annexin V-FITC/PI | Wuhan servicebio Technology Co.,Ltd, China | G1511 | diluted at 1:20 |
| Anti-HMGB1 Rabbit pAB | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1800 |
| BCA protein quantitative detection kit | Wuhan servicebio Technology Co.,Ltd, China | G2026-200T | |
| BD FACSCanto II Flow Cytometer | BD Life Sciences, San Jose, CA, 95131, USA | BD FACSCanto II | |
| BSA | Wuhan servicebio Technology Co.,Ltd, China | GC305010-100g | |
| C57BL/6J | Cavion Experimental Animal Co., Changzhou, China | license number SCXY (Su) 2011–0003 | |
| Ceruletide | MCE, New Jersey, USA | 17650-98-5 | 50 µg/kg |
| Chemiluminescence imager | Cytiva CO.,LTD.;USA | ||
| Citric acid antigen repair Solution (Dry powder pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1201-5 L | |
| Collagenase IV | Wuhan servicebio Technology Co.,Ltd, China | GC305014 | 0.5 mg/mL |
| DAB (SA-HRP) Tunel Cell Apoptosis Detection Kit | Wuhan servicebio Technology Co.,Ltd, China | G1507-100 T | |
| Dimension EXL with LM Integrated Chemistry System | Siemens Healthcare Diagnostics Inc.Brookfield,USA | YZB/USA 8311-2014 | |
| ECL developer | Wuhan servicebio Technology Co.,Ltd, China | ||
| Eosin dye (alcohol soluble) | Wuhan servicebio Technology Co.,Ltd, China | G1001-100 ml | |
| EthoVision XT | Noldus, Netherlands | ||
| FITC-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB22303 | diluted at 1:50 |
| Fully automatic blood cell analyzer | Zybio Inc. China | Zybio-Z3 CRP | |
| GapDH | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1500 |
| Hematoxylin blue return solution | Wuhan servicebio Technology Co.,Ltd, China | G1040-500 ml | |
| Hematoxylin differentiation solution | Wuhan servicebio Technology Co.,Ltd, China | G1039-500 ml | |
| Hematoxylin dye | Wuhan servicebio Technology Co.,Ltd, China | G1004-100 ml | |
| HMGB-1 ELISA kits | njjcbio Co., Ltd, China | ||
| HOMOGENIZER | Wuhan servicebio Technology Co.,Ltd, China | KZ-III-F;IC111150 100222 | |
| HRP-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB23303 | diluted at 1:1500 |
| IL-6 ELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0001 | |
| Lipase | Mindray,China | ||
| Lipopolysaccharide | Wuhan servicebio Technology Co.,Ltd, China | GC205009 | 15 mg/kg |
| Low temperature high speed centrifuge | Changsha Pingfan Apparatus&Instrument Co.,Ltd.,China | TGL-20M | |
| Membrane breaking liquid | Wuhan servicebio Technology Co.,Ltd, China | G1204 | |
| microtome | Jinhua Craftek Instrument Co., Ltd.;China | CR-601ST | |
| Nylon mesh | Wuhan servicebio Technology Co.,Ltd, China | 200-mesh | |
| One-step TUNEL cell apoptosis detection kit (DAB staining method) | Wuhan servicebio Technology Co.,Ltd, China | G1507-100T | |
| Paraffin tissue embedding machine | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PBM-A | |
| Pathological tissue drying apparatus | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PHY-III | |
| Phosphate-buffered saline | Wuhan servicebio Technology Co.,Ltd, China | G4202-100ML | |
| PMSF | Wuhan servicebio Technology Co.,Ltd, China | G2008-1 ml | |
| Positive fluorescence microscope | Olympus Corporation,Tokyo, Japan | BX53 | |
| Pro Calcitonin | Mindray,China | ||
| PVDF membrane | Millipore, USA | 0.22 µm | |
| RIPA | Wuhan servicebio Technology Co.,Ltd, China | G2002-100 ml | |
| SDS-PAGE | Beyotime Biotechnology,China | P0012A | |
| TNF-αELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0004 | |
| Ultrasonic water bath | DONGGUAN KQAO ULTRASONIC EQUIPMENT CO.,LTD.;China | KQ-200KDE | |
| Western Blot | Bio-Rad Laboratories, Inc.,USA | ||
| Western blot imaging System | Global Life Sciences IP Holdco LLC, JAPAN | Amersham ImageQuant 800 | |
| Whirlpool mixer | SCILOGEX;USA |
Referências
- Gliem, N., Ammer-Herrmenau, C., Ellenrieder, V., Neesse, A. Management of severe acute pancreatitis: An update. Digestion. 102 (4), 503-507 (2021).
- Duan, F., et al. GDF11 ameliorates severe acute pancreatitis through modulating macrophage M1 and M2 polarization by targeting the TGFbetaR1/SMAD-2 pathway. Int Immunopharmacol. 108, 108777 (2022).
- Zhang, X. P., et al. Preparation method of an ideal model of multiple organ injury of rat with severe acute pancreatitis. World J Gastroenterol. 13 (34), 4566-4573 (2007).
- Bluth, M. H., Patel, S. A., Dieckgraefe, B. K., Okamoto, H., Zenilman, M. E. Pancreatic regenerating protein (reg I) and reg I receptor mRNA are upregulated in rat pancreas after induction of acute pancreatitis. World J Gastroenterol. 12 (28), 4511-4516 (2006).
- Qiu, F., Lu, X. S., Huang, Y. K. Effect of low molecular weight heparin on pancreatic micro-circulation in severe acute pancreatitis in a rodent model. Chin Med J (Engl). 120 (24), 2260-2263 (2007).
- Lombardi, B., Estes, L. W., Longnecker, D. S. Acute hemorrhagic pancreatitis (massive necrosis) with fat necrosis induced in mice by DL-ethionine fed with a choline-deficient diet. Am J Pathol. 79 (3), 465-480 (1975).
- Liu, Y., et al. Deletion of XIAP reduces the severity of acute pancreatitis via regulation of cell death and nuclear factor-kappaB activity. Cell Death Dis. 8 (3), e2685 (2017).
- Niederau, C., Ferrell, L. D., Grendell, J. H. Caerulein-induced acute necrotizing pancreatitis in mice: Protective effects of proglumide, benzotript, and secretin. Gastroenterology. 88, 1192-1204 (1985).
- Zhou, X., et al. DPP4 inhibitor attenuates severe acute pancreatitis-associated intestinal inflammation via Nrf2 signaling. Oxid Med Cell Longev. 2019, 6181754 (2019).
- Yang, J., et al. Heparin protects severe acute pancreatitis by inhibiting HMGB-1 active secretion from macrophages. Polymers (Basel). 14 (12), 2470 (2022).
- Kong, L., et al. Sitagliptin activates the p62-Keap1-Nrf2 signalling pathway to alleviate oxidative stress and excessive autophagy in severe acute pancreatitis-related acute lung injury. Cell Death Dis. 12 (10), 928 (2021).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Schmidt, J., et al. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 215 (1), 44-56 (1992).
- Luo, C., et al. Abdominal paracentesis drainage attenuates severe acute pancreatitis by enhancing cell apoptosis via PI3K/AKT signaling pathway. Apoptosis. 25 (3-4), 290-303 (2020).
- Fontaine, D. A., Davis, D. B. Attention to background strain is essential for metabolic research: C57BL/6 and the international knockout mouse consortium. Diabetes. 65 (1), 25-33 (2016).
- Wan, J., et al. Pancreas-specific CHRM3 activation causes pancreatitis in mice. JCI Insight. 6 (17), e132585 (2021).
- Sah, R. P., et al. Cerulein-induced chronic pancreatitis does not require intra-acinar activation of trypsinogen in mice. Gastroenterology. 144 (5), 1076-1085 (2013).
- Wang, K., et al. Activation of AMPK ameliorates acute severe pancreatitis by suppressing pancreatic acinar cell necroptosis in obese mice models. Cell Death Discov. 9 (1), 363 (2023).
- Jin, C., Li, J. C. Establishment of a severe acute pancreatitis model in mice induced by combined Rain Frog Peptide and lipopolysaccharide and exploration of its mechanism. Acta Exp Bio Sinica. 36 (2), 91-96 (2003).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Roy, R. V., et al. Pancreatic Ubap2 deletion regulates glucose tolerance, inflammation, and protection from Caerulein-induced pancreatitis. Cancer Lett. 578, 216455 (2023).
- Chen, R., Kang, R., Tang, D. The mechanism of HMGB1 secretion and release. Exp Mol Med. 54 (2), 91-102 (2022).
- Murao, A., Aziz, M., Wang, H., Brenner, M., Wang, P. Release mechanisms of major DAMPs. Apoptosis. 26 (3-4), 152-162 (2021).
- Liu, T., et al. Accuracy of circulating histones in predicting persistent organ failure and mortality in patients with acute pancreatitis. Br J Surg. 104 (9), 1215-1225 (2017).
- Li, N., Wang, B. M., Cai, S., Liu, P. L. The role of serum high mobility Group Box 1 and Interleukin-6 levels in acute pancreatitis: A meta-analysis. J Cell Biochem. 119 (1), 616-624 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados