Method Article
Préparation d’un modèle murin de pancréatite aiguë sévère par une combinaison de céruleine et d’injection intrapéritonéale de lipopolysaccharide
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L’administration intrapéritonéale de médicaments est une approche non invasive sûre et efficace pour induire des lésions pancréatiques. Cette étude a comparé cinq protocoles d’injection intrapéritonéale distincts sur des souris pour induire divers degrés de lésions pancréatiques et a établi un modèle de lésions pancréatiques sévères pour étudier les changements pathologiques et les stratégies de traitement de la pancréatite aiguë sévère (PAS).
Résumé
Le traitement de la pancréatite aiguë sévère (PAS), avec des taux de mortalité élevés, pose un défi clinique important. L’étude des changements pathologiques associés au SAP à l’aide de modèles animaux peut aider à identifier des cibles thérapeutiques potentielles et à explorer de nouvelles approches de traitement. Des études antérieures ont principalement induit des lésions pancréatiques par injection rétrograde de taviaurocholate de sodium dans les voies biliaires, mais l’impact des lésions chirurgicales sur la qualité du modèle animal reste incertain. Dans cette étude, nous avons utilisé différentes fréquences d’injections intrapéritonéales de Cærulein combinées à différentes doses de LPS pour induire des lésions pancréatiques chez les souris C57BL/6J et avons comparé l’étendue des lésions dans cinq protocoles d’injection intrapéritonéale. En ce qui concerne l’induction d’une pancréatite aiguë chez la souris, un protocole d’injection intrapéritonéale est proposé qui entraîne un taux de mortalité pouvant atteindre 80% en 5 jours. Plus précisément, les souris ont reçu dix injections intrapéritonéales quotidiennes de céruleine (50 μg/kg), suivies d’une injection de LPS (15 mg/kg) une heure après la dernière administration de céruleine. En ajustant la fréquence et la posologie des médicaments injectés, on peut manipuler efficacement la gravité des lésions pancréatiques. Ce modèle présente une forte contrôlabilité et a un cycle de réplication court, ce qui permet à un seul chercheur de le réaliser sans nécessiter d’équipement coûteux. Il simule de manière pratique et précise les principales caractéristiques de la maladie observées dans le SAP humain tout en démontrant un haut degré de reproductibilité.
Introduction
La pancréatite aiguë sévère se caractérise par une apparition rapide, une progression rapide et des taux de mortalité élevés dans le domaine1 des maladies du système digestif. Son taux de mortalité élevé a toujours été un objectif majeur de la recherche clinique. En raison de l’évolution imprévisible des conditions cliniques, de l’hétérogénéité des manifestations de la maladie et de la disponibilité limitée d’échantillons humains, l’établissement de modèles animaux est devenu de plus en plus crucial pour la recherche sur les maladies.
L’injection rétrograde de taurocholate de sodium dans le canal cholédoque est couramment utilisée pour créer un modèle de rat de SAP2. En simulant l’obstruction pancréaticobiliaire et en induisant un reflux de la bile et du liquide pancréatique, cette technique de modélisation présente un taux de réussite élevé dans la réplication de modèles animaux SAP. Cependant, il convient de noter que la chirurgie invasive a un impact sur le modèle animal lui-même. De plus, cette méthode est limitée aux animaux plus grands, tels que les rats et les chiens, qui sont principalement utilisés comme sujets d’expérience. D’autres techniques, notamment l’intubation duodénale3, la ponction duodénale directe4 et la ponction directe du canal biliaire-canal pancréatique5, sont fréquemment utilisées à des fins de modélisation.
Les méthodes d’injection intrapéritonéale et de modélisation diététique offrent des avantages non invasifs qui peuvent être appliqués à des animaux de toutes tailles. Le modèle murin de SAP induit par l’alimentation de l’éthionine déficiente en choline (CDE)6 présente certaines complications, telles qu’une hyperglycémie et une hypocalcémie peu contrôlables, ce qui le rend impropre à l’évaluation de nouvelles approches diagnostiques et thérapeutiques. D’autre part, l’injection intrapéritonéale de Caerulein associée à la L-arginine7 représente la méthode la plus couramment utilisée pour induire une pancréatite aiguë chez la souris. Plus précisément, l’administration intrapéritonéale répétée de Caerulein, un analogue de la cholécystokinine, constitue une approche très appropriée pour étudier divers aspects liés à cette maladie destructrice, notamment la pathogenèse, l’inflammation et les processus de régénération. En raison de sa similitude structurelle avec la cholécystokinine (CCK), la céruleine stimule efficacement la contraction de la vésicule biliaire et la sécrétion d’enzymes pancréatiques, entraînant un déséquilibre de la sécrétion d’enzymes suivi d’une autodestruction ultérieure8. Le lipopolysaccharide (LPS), omniprésent et largement étudié en tant que molécule moléculaire associée à un agent pathogène, peut être combiné à la céruleine par injection intrapéritonéale pour établir un modèle de souris efficace de SAP. Cette combinaison déclenche et libère rapidement un nombre important de cytokines inflammatoires, entraînant une inflammation locale et systémique excessive. Plusieurs études ont rapporté l’induction de modèles SAP chez la souris par injection intrapéritonéale de Caerulein combinée à du LPS. Cela peut être attribué au fait que l’injection intrapéritonéale de Caerulein peut provoquer un œdème pancréatique et une hémorragie chez la souris, tandis que l’ajout de LPS peut induire immédiatement une nécrose pancréatique et exacerber la réponse inflammatoire systémique, la septicémie et même la défaillance d’organe. À l’heure actuelle, il existe des variations dans la posologie et la fréquence des injections intrapéritonéales de céruleine, ainsi qu’une incohérence dans la posologie supplémentaire de LPS. Assurer la cohérence des modèles SAP de souris est un défi 9,10,11,12 ; Par conséquent, il est nécessaire d’établir un protocole standardisé pour obtenir un modèle idéal. Dans cet article, nous décrivons un protocole d’injection intrapéritonéale chez la souris et étudions la fréquence d’injection optimale et la dose supplémentaire de LPS.
Protocole
Ce protocole a été examiné et approuvé par le comité d’éthique du premier hôpital affilié de l’Université des sciences et technologies d’Anhui (Huainan, Chine) (Code d’éthique : 2023-KY-905-001). L’étude a suivi les directives des National Institutes of Health pour le soin et l’utilisation des rongeurs de recherche dans toutes les procédures animales. Des souris adultes C57BL/6J pesant de 20 à 30 g ont été utilisées pour la présente étude. Les souris ont été hébergées dans un laboratoire animalier pendant une semaine dans des conditions contrôlées (environ 21 °C avec un cycle alterné jour-nuit de 12 heures). Les souris avaient un accès ad libitum à la nourriture et à l’eau partout. Les détails des réactifs et de l’équipement utilisés dans l’étude sont énumérés dans la table des matériaux.
1. Préparation des animaux
- Attribuez 84 souris C57BL/6J en bonne santé à six groupes, y compris le groupe témoin, Lésion pancréatique (PI) I, PI II, PI III, PI IV et PI V.
- Avant de lancer la procédure de modélisation, étiquetez chaque groupe de souris avec des encoches d’oreille et laissez-les jeûner pendant 12 h.
2. Préparation du diluant médicamenteux induit
- Dissoudre la céruleine (1 mg) dans 1 mL de PBS et réfrigérer à -20 °C.
- Mesurer et consigner le poids des souris expérimentales 1 h avant l’injection intrapéritonéale du médicament.
- Extraire la masse totale de céruleine requise dans un rapport de 50 μg/kg, sur la base du poids total de toutes les souris.
- Diluez à nouveau le médicament Caerulein obtenu avec du PBS.
REMARQUE : Le volume total de dilution PBS doit être équivalent à 5 fois la valeur pondérale totale de toutes les souris. La même méthode de dilution a été utilisée pour obtenir le diluant LPS.
3. Injection intrapéritonéale
REMARQUE : Des injections intrapéritonéales ont été administrées à chaque groupe de souris selon le protocole décrit dans le tableau supplémentaire 1 pour induire le modèle. 10 autres souris ont été regroupées et traitées pour observer les taux de survie à 7 jours.
- Saisissez et tenez les souris de manière à ce que le ventre des souris soit orienté vers le haut et que la tête soit positionnée plus bas que la queue pour éviter d’endommager les organes lors de l’insertion de la seringue.
- Désinfectez l’abdomen des souris à l’aide de boules de coton à 75 % d’alcool.
- Tenez la seringue dans la main droite (à l’aide d’une aiguille mesurant ≤0,5/≥0,3) et insérez l’aiguille dans la peau sous-cutanée du côté gauche de la ligne blanche abdominale.
REMARQUE :Passez du côté droit pour la prochaine injection. - Une fois que l’aiguille a atteint la couche sous-cutanée, avancez-la d’environ 3 à 5 mm, puis insérez l’aiguille de la seringue dans la cavité abdominale à un angle de 45°. À ce stade, on devrait ressentir une certaine résistance.
- Gardez l’aiguille immobile et injectez la substance lentement.
REMARQUE : Ne dépassez pas 5 fois la valeur du poids des souris par rapport au volume d’une seule injection intrapéritonéale. - Après l’injection, retirez l’aiguille et massez doucement et appuyez sur le site d’injection avec un coton-tige stérile pour diffuser complètement le médicament dans la cavité abdominale des souris.
- Utilisez une nouvelle seringue pour répéter avec les prochaines souris expérimentales.
4. Test d’aptitude comportementale en plein champ
REMARQUE : 12 h après la dernière injection intrapéritonéale, des tests d’aptitude comportementale en champ libre ont été effectués pour évaluer la distance d’activité totale et le temps d’immobilité des souris.
- Placez quatre cases blanches identiques directement sous l’appareil photo.
- Connectez l’appareil photo à l’ordinateur à l’aide d’un câble vidéo.
- Assurez-vous que la boîte expérimentale est propre et exempte de toute odeur avant de commencer l’expérience.
- Placez l’animal au milieu de la grille, face à l’expérimentateur, et laissez-le s’adapter à l’environnement pendant 10 min.
- Démarrez le logiciel de suivi vidéo et cliquez sur le menu Fichier pour créer une nouvelle expérience.
- Configurez la surveillance pour quatre champs de vision simultanés.
- Marquez la longueur et la largeur de l’objet expérimental qui peut se déplacer à l’intérieur de la boîte sur l’écran de surveillance en temps réel (30 cm × 30 cm).
- Une fois la configuration terminée, commencez la surveillance vidéo et l’enregistrement.
- Enregistrez l’activité des souris pendant 15 min.
- Après le test, retirez l’animal de la grille et remettez-le dans sa cage. Nettoyez soigneusement la grille à l’aide d’un stérilisant contenant du dioxyde de chlore.
5. Prélèvement et analyse du sang périphérique de souris
- Euthanasier les souris (selon le protocole approuvé par l’établissement).
- Effectuer l’euthanasie sur les souris expérimentales 36 h après l’injection intrapéritonéale. Mesurer et consigner le poids corporel des souris avant l’euthanasie.
REMARQUE : Administrer 0,18 mL d’hydrate de chloral à 10 % par voie intrapéritonéale, en s’assurant qu’il n’y a pas de réaction à la stimulation de l’orteil ou de la queue. - Avec la main gauche, fixez les souris, et avec la main droite, tenez les ciseaux pour couper les moustaches d’un côté des souris.
- Appuyez doucement sur la peau autour de l’œil pour induire la congestion et la protrusion du globe oculaire.
- À l’aide d’une pince incurvée, saisissez le globe oculaire et retirez-le rapidement, en recueillant le sang périphérique dans un tube de microcentrifugation.
REMARQUE : Deux types différents de tubes de microcentrifugation ont été utilisés, l’un contenant de l’anticoagulant et l’autre sans. - Simultanément, appuyez légèrement sur la zone du cœur de la souris avec le majeur de la main gauche pour augmenter la vitesse de pompage du cœur.
- Effectuer l’euthanasie sur les souris expérimentales 36 h après l’injection intrapéritonéale. Mesurer et consigner le poids corporel des souris avant l’euthanasie.
- Laissez le sang périphérique sans anticoagulant à température ambiante pendant 30 min.
- Mesurez les concentrations sériques d’amylase (Amy) et de lipase (Lip) à l’aide d’un analyseur biochimique automatisé selon la méthode du taux enzymatique et la méthode de circulation enzymatique (en suivant les instructions du fabricant).
- Déterminez les niveaux d’indicateurs inflammatoires tels que la pro-calcitonine (PCT) dans le plasma à l’aide de la méthode de chimiluminescence à l’aide d’un imageur de chimiluminescence commercial (en suivant les instructions du fabricant).
- Utilisez des kits ELISA pour mesurer les niveaux de HMGB-1, IL-6 et TNF-α dans le sérum de souris (en suivant les instructions du fabricant).
- Analysez le sang périphérique traité avec un anticoagulant à l’aide d’un analyseur de cellules sanguines entièrement automatique pour évaluer les paramètres pertinents.
6. Prélèvement du tissu pancréatique et préparation d’une section de paraffine
- Placez les souris en position couchée et fixez-les sur une plaque de mousse.
- Rasez et désinfectez la zone, puis faites une incision abdominale médiane et retournez le tube de l’intestin grêle vers la droite pour exposer complètement le pancréas.
- Déconnectez le duodénum et le canal pylorique et localisez l’intestin grêle sous le pancréas. Libérez complètement le tissu pancréatique le long du canal intestinal.
- Utilisez une pince édentée pour serrer la rate et tirez doucement vers le haut.
REMARQUE : Ne touchez pas directement le tissu pancréatique et évitez d’utiliser une force excessive pendant tout le processus de dissociation. - Disséquez brusquement le tissu ligamentaire pancréatique postérieur jusqu’à la tête du pancréas et déconnectez les canaux biliaires et les vaisseaux sanguins.
- Retirez le tissu pancréatique, séchez l’humidité de surface avec du papier absorbant, pesez et enregistrez.
- Fixez la moitié du tissu pancréatique avec 4% de paraformaldéhyde et conservez l’autre moitié au réfrigérateur à -80 °C.
- Préparez les sections de paraffine pancréatique en suivant les étapes ci-dessous.
- Nettoyez le tissu pancréatique fixé avec de l’alcool à 75 % et coupez-le à une taille d’environ 0,5 cm × 0,5 cm.
- Immergez le tissu dans de l’éthanol à 70 % pendant 20 min, de l’éthanol à 80 % pendant 20 minutes et de l’éthanol à 90 % pendant 15 min.
- Traitez le tissu deux fois avec de l’éthanol à 95 % pendant 15 minutes à chaque fois, puis deux fois avec de l’éthanol à 100 % pendant 5 minutes à chaque fois.
- Soumettez le tissu à deux séries de traitements de 12 minutes et 5 minutes avec une solution de xylène pour plus de transparence.
- Faites tremper le tissu transparent dans une cuve de cire à 65 °C pendant 1 h.
- Incorporez le tissu dans de la paraffine fondue et laissez-le refroidir. Obtenez des coupes de paraffine pancréatique à l’aide d’une trancheuse (épaisseur : 5 μm).
- Aplatissez les tranches de paraffine obtenues dans de l’eau à 45 °C, montez-les et séchez-les (conditions de cuisson : 40 °C pendant 14-16 h).
7. Coloration à l’hématoxyline et à l’éosine (H&E)
- Placez les sections de paraffine pancréatique dans du xylène I et II pendant 30 min, puis dans de l’alcool anhydre, à 95 %, 85 % et à 75 % pendant 5 min chacun, et de l’eau ultrapure pendant 5 min.
- Teindre le noyau cellulaire avec de l’hématoxyline pendant 160 s, puis rincer lentement à l’eau courante.
- Appliquez une solution de différenciation d’alcool à l’acide chlorhydrique pendant 5 à 10 s, puis rincez rapidement à l’eau courante.
- Traitez les sections avec de l’alcool anhydre pendant 5 min.
- Incuber le cytoplasme avec de l’éosine pendant 30 s, puis rincer à l’eau courante.
- Immergez les sections dans de l’éthanol à 75 %, 85 %, 95 % et 100 % pendant 10 s chacune, puis traitez avec du xylène pendant 5 minutes pour les déshydrater.
- Enfin, scellez les sections avec de la résine neutre et observez au microscope.
- Effectuer la notation pathologique et les normes13.
REMARQUE : Déterminez la gravité de la pancréatite en fonction d’indicateurs tels que l’œdème, la nécrose acineuse, les saignements, l’hémorragie et la nécrose graisseuse, ainsi que l’inflammation inflammatoire et périvasculaire. Utilisez les directives de mise en œuvre publiées précédemment pour obtenir une notede 13.
8. Coloration immunohistochimique
- Déparaffiné les sections de tissu pancréatique incluses dans de la paraffine dans du xylène, puis réhydratez-les dans un gradient de solutions d’éthanol.
- Effectuer un blocage enzymatique endogène à l’aide de 3%de H2O2 pendant 20 min après une rupture membranaire de 30 min.
- Bloquez l’anticorps avec 5 % de sérum bovin à température ambiante pendant 30 min, puis incubez pendant une nuit à 4 °C avec une dilution de 1:1500 d’anti-HMGB1 de lapin.
- Rincez les sections avec du PBS, puis incubez-les dans les anticorps secondaires correspondants pendant 30 min à 37 °C. Après cela, effectuez le développement de la couleur DAB, la contre-coloration à l’hématoxyline et scellez avec de la gomme neutre.
9. Méthode TUNEL pour la détection de l’apoptose dans les coupes pancréatiques
- Décaffinez les sections de paraffine pancréatique dans du xylène pendant 5 min, répétez deux fois et lavez avec de l’éthanol dégradé (100 % pendant 5 min, 90 % pendant 2 min, 70 % pendant 2 min et de l’eau distillée pendant 2 min).
- Lavez l’excès de liquide entourant les sections de paraffine à l’aide de PBS. Traitez chaque échantillon avec 100 μL de protéinase K, en assurant une couverture complète du tissu. Incuber les échantillons à 37 °C pendant 20 min. Par la suite, faites tremper les échantillons dans du PBS 3 fois, à chaque fois pendant 5 min.
REMARQUE : La solution de protéinase K a été préparée en diluant la solution originale de protéinase K (200 μg/mL) avec du PBS dans un rapport de 1:9 (volume), ce qui a donné une concentration finale de 20 μg/mL, à l’exclusion de la DNase. Un lavage minutieux de la protéinase K est essentiel pour éviter d’interférer avec les réactions d’étiquetage ultérieures. - Ajouter une quantité appropriée de 3% deH2O2 (diluée par PBS) sur le tissu pour l’infiltrer complètement et incuber pendant 20 min. Rincez le mouchoir avec du PBS 3 fois pendant 5 minutes chacune.
REMARQUE : Les sections de paraffine doivent être maintenues humides. Pour inactiver les peroxydases endogènes dans le tissu, le temps d’incubation ne doit pas être trop long afin d’éviter les faux positifs dus à la rupture de l’ADN causée par 3%H2O2. - Couvrez toute la surface de l’échantillon à tester avec 50 μL de tampon d’équilibrage et incubez pendant 10 min.
- Retirez autant de tampon d’équilibrage que possible. Ensuite, ajoutez 56 μL de tampon d’incubation TdT à chaque échantillon de tissu et incubez pendant 1 h (à température ambiante).
REMARQUE : La diapositive ne doit pas sécher et l’exposition à la lumière doit être évitée. Le tampon d’incubation TdT a été préparé conformément aux instructions du fabricant (Enzyme TdT recombinante : Mélange d’étiquetage Biotine-dUTP : Tampon d’équilibrage = 1 μL : 5 μL : 50 μL). - Lavez immédiatement les échantillons de tissus avec du PBS. Rincez-les 4 fois pendant 5 min chacune. Retirez délicatement tout excès de solution PBS autour des échantillons avec du papier filtre.
- Ajouter 100 μL de solution réactionnelle Streptavidine-HRP préalablement diluée (Streptavidine-HRP : TBST = 1:300) à chaque échantillon de tissu pour la réaction Streptavidine-HRP. Incuber pendant 30 min. Ensuite, lavez les échantillons avec du PBS et rincez-les 3 fois pendant 5 minutes chacune.
- Effectuez la coloration DAB en ajoutant 50 μL de DAB à chaque section de paraffine. Observez la coloration au microscope en temps réel. Une fois qu’une coloration positive apparaît, placez immédiatement les lames dans une boîte humide. Arrêtez la réaction en le lavant à l’eau pure.
- Immergez les lames dans une solution de coloration à l’hématoxyline pendant 3 à 5 minutes, puis rincez à l’eau pure.
- Différencier dans une solution de différenciation d’hématoxyline pendant environ 2 s, suivi d’un rinçage immédiat à l’eau pure.
- Obtenez une coloration bleue à l’aide d’une solution de rebluing à l’hématoxyline pendant quelques secondes et rincez les lames à l’eau pure.
REMARQUE : Effectuer un examen microscopique après la coloration nucléaire. Si la coloration est trop foncée, remettez les lames dans la solution de différenciation. Si la coloration est trop légère, redémarrez le processus de coloration à partir de l’étape de coloration nucléaire. - Déshydratez les échantillons avec 4 doses d’éthanol anhydre frais pendant 5 minutes chacune. Ensuite, faites-les tremper dans du butanol pendant 5 min et dans du xylène pendant 5 min. Enfin, utilisez du xylène frais pendant encore 5 min.
- Montez les lames à l’aide de gomme neutre. Laissez-les sécher à l’air libre ou dans un four à 60 °C.
- Effectuer un examen histologique à l’aide d’un microscope à lumière blanche. Les noyaux apoptotiques apparaîtront bruns.
- Calculez l’indice apoptotique (AI) correspondant.
REMARQUE : Observez les diapositives en double aveugle. Dans les lames positives à TUNEL, sélectionnez au hasard 5 zones positives sous un fort grossissement (400x) et comptez au moins 100 cellules acineuses dans chaque zone pour déterminer le pourcentage de cellules positives. IA = (nombre total de cellules apoptotiques/nombre total de cellules) × 100%.
10. Cytométrie en flux
- Procurez-vous des tissus pancréatiques frais et lavez-les soigneusement après avoir perfusé avec du PBS.
- Préparez une solution de digestion IV de collagénase à 0,5 % et utilisez des ciseaux à tissus stériles pour digérer correctement les tissus pancréatiques.
- Ajouter une solution de terminaison de digestion BSA à 5 % en fonction de l’état des fragments pancréatiques et de la turbidité du liquide, et centrifuger le mélange à basse température pendant 5 min (~300 x g, 4 °C).
- Jetez le surnageant pour terminer la digestion.
- Préparez un milieu de culture cellulaire contenant du fluorure de phénylméthane sulfonyle (PMSF) et une suspension de cellules sériques fœtales bovines à 2,5 % pour remettre en suspension les cellules pancréatiques.
- Filtrez les suspensions de cellules acineuses pancréatiques à travers un maillage en nylon de 200 mailles pour obtenir des suspensions cellulaires par filtrage cellulaire.
- Centrifugez la suspension de cellules acineuses pancréatiques à basse température (suivez les conditions mentionnées à l’étape 10.3).
- Jetez le surnageant.
- Lavez les cellules avec du PBS pré-réfrigéré.
- Remettez doucement les cellules en suspension dans un tampon de liaison 1x pré-refroidi par resuspension centrifuge.
- Étiquetez les cellules acineuses pancréatiques avec l’Annexine V-FITC/PI selon les instructions du fabricant après avoir ajusté la concentration cellulaire.
- Utilisez la cytométrie en flux dans les 1 h pour détecter l’apoptose dans les cellules acineuses pancréatiques.
11. Détection par transfert Western de la caspase-3 et de la HMGB-1
- Extrayez la protéine pancréatique.
- Extrayez 50 mg de tissu pancréatique et coupez-le en petits fragments.
- Ajouter 1 mL de tampon de lyse RIPA (contenant du PMSF et un inhibiteur de protéase phosphorylé).
- Homogénéiser le tissu pancréatique sur de la glace pendant 5 min à l’aide d’un broyeur électrique.
- Incuber le tissu homogénéisé sur de la glace en secouant doucement pendant 2 h.
- Centrifuger l’homogénat à 4 °C pendant 10 min à 4 500 x g.
- Prélever la solution surnageante et la conserver à -80 °C.
- Effectuer la quantification des protéines.
- Diluer un certain volume d’échantillon étalon BSA (25 mg/mL) à une concentration de 0,5 mg/mL.
- Préparez une quantité spécifique de solution de travail BCA en mélangeant 50 volumes de solution BCA A avec 1 volume de solution BCA B, en assurant un mélange complet et uniforme.
- Placez l’échantillon étalon BSA dans les trous d’échantillonnage standard d’une plaque à 96 puits dans l’ordre de 0, 1, 2, 4, 8, 12, 16 et 20 μL. Équilibrez le volume de chaque trou avec de l’eau distillée, ce qui donne un volume total de 20 μL.
- Ajouter 2 μL d’échantillons dans les trous d’échantillonnage, puis ajouter séquentiellement 18 μL d’eau distillée pour la dilution (1:9).
- Remplissez chaque puits avec 200 μL de solution de travail BCA et laissez-le reposer à 37 °C pendant environ 20 à 30 min.
- Mesurez l’absorbance à une longueur d’onde de 562 nm. Calculer la concentration en protéines des échantillons sur la base de la courbe standard.
- Ajouter un volume spécifique de solution de craquage RIPA et de tampon de dilution pour diluer les échantillons jusqu’à ce que la concentration atteigne 5-10 μg/μL, ce qui est considéré comme approprié.
- Stocker les échantillons à -20 °C après la dénaturation des protéines (100 °C ; 10 min).
- Effectuez le Western blot.
- Préparez-vous pour SDS-PAGE.
- Installez les moules de fabrication de colle et inspectez leurs performances d’étanchéité.
- Ajoutez TEMED à l’adhésif de séparation à 10 % et mélangez uniformément.
- Injecter le mélange dans le moule, représentant environ les deux tiers du volume, tout en évitant les bulles.
- Ajoutez l’isopropanol dans le moule et appuyez sur l’adhésif pendant environ 40 min.
- Utilisez le même programme pour configurer l’adhésif concentré à 5 %.
- Versez l’isopropanol et ajoutez l’adhésif immédiatement.
- Placez le peigne verticalement jusqu’à ce que la colle polymérise complètement.
- Effectuez l’opération d’électrophorèse.
- Ajoutez l’échantillon à tester dans l’ordre de contrôle expérimental attendu, dans l’ordre inverse, dans les trous d’échantillonnage de l’adhésif SDS-PAGE.
- Ajoutez simultanément le repère protéique pour déterminer l’emplacement de la protéine cible et de la protéine de référence interne.
- Placez l’échantillon dans le réservoir d’électrophorèse une fois l’ajout d’échantillon terminé.
- Au départ, exécutez à 80 V pendant 30 min, puis faites fonctionner le gel pour séparer la protéine à 100 V pendant 60 min.
REMARQUE : Une attention particulière doit être portée à la position du bleu de bromophénol pour éviter une électrophorèse excessive.
- Effectuez le transfert de protéines.
- Coupez le film PVDF dans le coin supérieur droit pour servir de marque.
- Placez le film PVDF dans une solution de méthanol pendant 5 à 10 s pour l’activer.
- Faites tremper le film PVDF dans un tampon d’électrophorèse pendant environ 15 min.
- Retirez soigneusement le gel après l’électrophorèse et coupez l’excès de gel, en vous assurant que le gel reste humide tout au long du processus.
- Assemblez l’attelle dans l’ordre suivant : plaque négative → éponge → trois couches de papier filtre → de gel → film PVDF → trois couches de papier filtre → éponge → plaque positive.
REMARQUE : Assurez-vous qu’il n’y a pas de bulles entre le gel et le film PVDF. - Placez la pince assemblée dans la rainure rotative humide (noire à noire) avec des glaçons positionnés autour d’elle.
- Mettez l’appareil sous tension et lancez le transfert de film à 400 mA pendant 100 min.
- Effectuer l’étanchéité du film PVDF et l’incubation des anticorps primaires et secondaires.
- Retirez délicatement le film PVDF après le transfert et rincez au TBST pendant 10 min, en répétant le processus 3 à 5 fois.
- Sceller le film PVDF dans du lait écrémé à 5 % pendant 2 h.
- Retirez le film PVDF et rincez au TBST pendant 10 min, en répétant le processus 4 fois.
- Placez le film PVDF et l’anticorps primaire dilué ensemble dans un réfrigérateur à 4 °C en agitant doucement et incubez pendant la nuit.
- Retirez le film PVDF le lendemain et rincez au TBST pendant 10 min, en répétant le processus 4 fois.
- Incuber le film PVDF dans un diluant d’anticorps secondaire marqué HRP pendant environ 2 h.
- Rincez le film PVDF avec du TBST pendant 10 min, en répétant le processus 4 fois.
- Exposez le film et analysez-le.
- Appliquez uniformément la solution ECL préparée sur le film.
- Exposez le film dans une pièce sombre avec un posemètre pendant environ 2-3 minutes, puis stockez-le.
- Effectuez l’analyse à l’aide du logiciel image J.
- Préparez-vous pour SDS-PAGE.
Résultats
Le processus de modélisation expérimentale de la souris est illustré à la figure 1. Après 12 h de fin d’injection, un enregistreur vidéo en champ ouvert a été utilisé pour surveiller la distance de mouvement et la durée d’immobilité de différents groupes expérimentaux de souris pendant 5 cycles (Figure 2A). Au cours des 5 cycles, les souris du groupe PI V ont maintenu un faible niveau de distance de mouvement en 3 minutes, tandis que le taux d’immobilité en 3 minutes a augmenté à chaque cycle suivant (figures 2B et C). De plus, une analyse statistique a été effectuée sur la distance de déplacement totale des souris de différents groupes expérimentaux au cours des 5 cycles. Le groupe PI V présentait la plus petite distance totale de mouvement par rapport aux autres groupes expérimentaux, et la différence était statistiquement significative (p < 0,001) (Figure 2D, E). À l’exception du groupe témoin et du groupe PI I, les souris des autres groupes expérimentaux ont présenté une croissance négative du poids de la valeur D. Parmi eux, le groupe PI V a montré le changement de poids le plus important, et la différence de changement de poids par rapport aux autres groupes expérimentaux était statistiquement significative (figure 2F). Après avoir évalué le taux de survie de 10 souris supplémentaires dans chaque groupe expérimental, les résultats ont montré que le taux de mortalité des souris du groupe PI V atteignait 80% le 5e jour. Cependant, il n’y avait pas de différence statistiquement significative dans le taux de mortalité entre les quatre autres groupes expérimentaux et les souris du groupe témoin (figure 2G).
À l’aide d’un microscope de haute puissance, un gonflement cellulaire important, une nécrose et une infiltration de cellules inflammatoires ont été observés dans les groupes PI IV et PI V de souris (figures 3A, B). À l’aide des critères d’évaluation fournis dans le tableau supplémentaire 2, la pathologie pancréatique de différents groupes expérimentaux de souris a été évaluée et a observé des différences significatives dans le score de pathologie pancréatique par rapport aux souris du groupe témoin (p < 0,001) (Figure 3C ; Figure supplémentaire 1). De plus, par rapport au groupe témoin, les taux sériques d’amylase et de lipase chez les souris mesurées étaient significativement plus élevés dans les groupes expérimentaux PI II à PI V, et les différences étaient statistiquement significatives. Il est intéressant de noter qu’il n’y avait pas de différence statistiquement significative chez les souris du groupe PI I (figures 3D, E). La méthode ELISA a été utilisée pour évaluer les niveaux de marqueurs inflammatoires14, y compris le TNF-α et l’IL-6, dans le sérum de souris. Les résultats ont révélé que les niveaux de TNF-α et d’IL-6 chez les souris du groupe PI V étaient significativement plus élevés que ceux des autres groupes expérimentaux, et les différences étaient statistiquement significatives (Figure 3F,G). Par rapport au groupe témoin, les niveaux de PCT ont augmenté dans les quatre groupes expérimentaux, mais seule la différence dans le groupe PI V était statistiquement significative (p < 0,05) (figure 3H).
L’état apoptotique des tissus pancréatiques dans différents groupes expérimentaux de souris
En effectuant une coloration TUNEL sur les tissus pancréatiques de chaque groupe de souris, l’état de nécrose cellulaire dans les tissus pancréatiques de différents groupes expérimentaux a été observé (Figure 4A). Les valeurs en niveaux de gris (DO) par unité de surface des coupes de tissu pancréatique et le taux positif de nécrose cellulaire ont été analysés semi-quantitativement à l’aide du logiciel Image J. Les résultats ont montré que, par rapport aux autres groupes expérimentaux, le niveau de nécrose cellulaire dans les tissus pancréatiques du groupe PI V de souris était significativement augmenté, et la différence était statistiquement significative (p < 0,001) (Figure 4B, C). Des expériences d’immunotransfert de protéines ont été réalisées pour évaluer les niveaux d’expression de la protéinase 3 spécifique de l’aspartate de cystéinyle (Caspase-3), un marqueur de nécrose cellulaire, dans les tissus pancréatiques de souris de différents groupes expérimentaux (Figure 4D). La quantification de l’expression de la caspase-3 a montré que le niveau d’expression de la protéine caspase-3 dans les tissus pancréatiques du groupe PI V était significativement augmenté, et la différence était statistiquement significative (p < 0,001). Les niveaux d’expression des protéines ont été quantifiés et normalisés par rapport au contrôle interne GapDH (Figure 4E). De plus, des suspensions fraîches de cellules acineuses pancréatiques ont été marquées avec de l’annexine V-FITC/PI et analysées par cytométrie en flux. Il a été constaté que, par rapport aux autres groupes expérimentaux de souris, le groupe PI V présentait un taux positif de mort cellulaire significativement plus élevé, ce qui était statistiquement significatif (p < 0,001) (Figure 4F, G).
La teneur en HMGB-1 dans le sérum périphérique et le niveau d’expression de HMGB-1 dans le tissu pancréatique
Afin d’étudier la relation entre la protéine HMGB-1 et les lésions pancréatiques, une coloration et une quantification immunohistochimiques ont été effectuées sur les tissus pancréatiques de souris de chaque groupe expérimental. Il y avait une différence statistiquement significative entre le groupe expérimental et le groupe témoin (p < 0,001) (figures 5A, B). L’ELISA a été utilisé pour mesurer les niveaux de HMGB-1 dans le sérum de souris de différents groupes expérimentaux. Les résultats ont montré que, par rapport au groupe témoin, les taux sériques de HMGB-1 étaient significativement plus élevés dans tous les groupes expérimentaux, le niveau le plus élevé étant observé dans le groupe PI V, et que la différence était statistiquement significative (p < 0,001) (Figure 5C). De plus, l’analyse par transfert Western a détecté une expression élevée de la protéine HMGB-1 dans les tissus pancréatiques des souris dans tous les groupes expérimentaux, avec des différences statistiquement significatives par rapport au groupe témoin (p < 0,001) (Figure 5D, E).
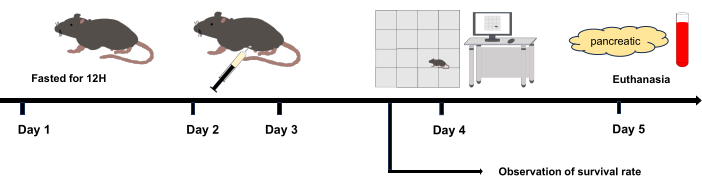
Figure 1 : Organigramme expérimental. Jour 2 et Jour 3 : Injection intrapéritonéale. Jour 4 : L’expérience en plein champ a été initiée 12 h après la dernière injection intrapéritonéale. Jour 5 : Euthanasié 36 h après l’injection intrapéritonéale. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Changements macroscopiques dans le modèle de souris PI. (A) Le tracé de la trajectoire de mouvement en temps réel des souris est représenté. (B) La distance totale de déplacement au cours de chaque période de surveillance pour différents groupes expérimentaux de souris. (C) Le pourcentage de temps d’immobilité au cours de chaque période de surveillance pour différents groupes expérimentaux de souris. (D, E) La distance totale de mouvement et le pourcentage de temps d’immobilité pendant 15 minutes ont été analysés pour des souris dans différents groupes expérimentaux. (F) La valeur D représentant le poids des souris avant et après le processus de modélisation. (G) La survie de 10 souris dans chaque groupe a été observée pendant les 7 jours suivant l’injection intrapéritonéale. Les données sont exprimées en moyennes ± SEM, n = 4. « ns » signifie non significatif, *P < 0,05, ****P < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Changements pathologiques dans la pancréatite de souris parmi différents groupes expérimentaux. (A) Les coupes histologiques colorées en H&E du tissu pancréatique de souris dans différents groupes expérimentaux (coupes de tissu pancréatique incluses en paraffine colorées à l’hématoxyline et à l’éosine, grossissements de 100 fois et barres d’échelle de 200 μm, et 400 fois et barres d’échelle de 50 μm, respectivement. De longues flèches jaunes indiquent les îlots ; de longues flèches rouges indiquent des cellules acineuses ; de longues flèches brunes indiquent des vaisseaux sanguins ; de longues flèches bleues indiquent les conduits). (B) Calcul du rapport entre le poids pancréatique et le poids corporel chez la souris. (C) Marquage pathologique du pancréas de souris. (D, E) Détection des taux sériques d’amylase et de lipase chez la souris. (F-G) Mesure ELISA des taux sériques de TNF-α et d’IL-6 chez la souris. h) Évaluation du niveau du PCT. Les données sont exprimées en moyennes ± SEM, n = 4. « ns » signifie non significatif, *P < 0,05, ****P < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
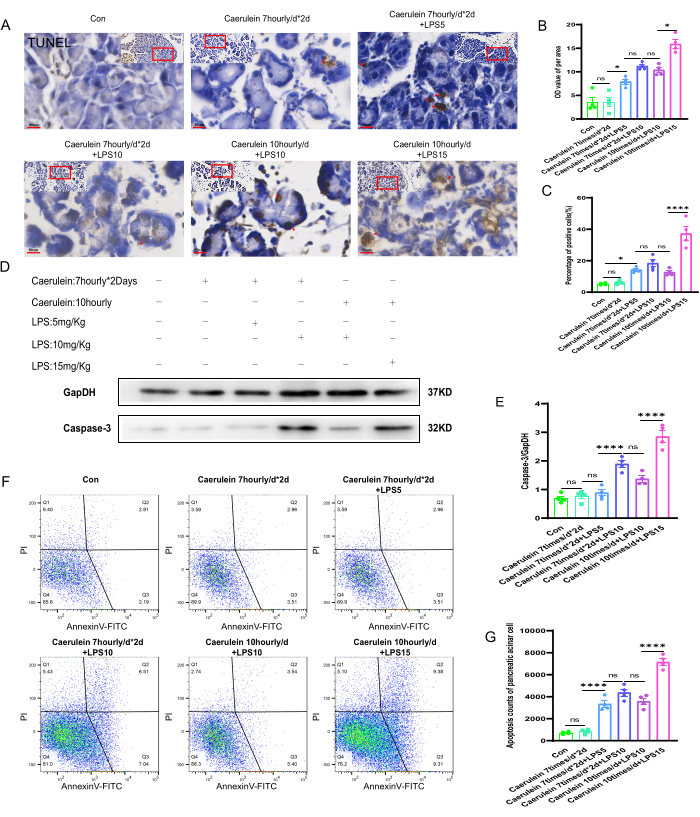
Figure 4 : Apoptose du tissu pancréatique chez la souris. (A) Des images représentatives de la coloration TUNEL ont été obtenues à partir de coupes de paraffine pancréatique de souris et d’images de zones élargies. (400x, barre d’échelle 50 μm, le jaune brunâtre est une cellule positive). (B, C) Analyse quantitative de la valeur en niveaux de gris par unité de surface de coupes de tissu pancréatique de souris colorées par TUNEL et du pourcentage de cellules mortes colorées positivement. (D) Le niveau d’expression de la caspase-3 dans le tissu pancréatique a été détecté par Western blot. (E) Quantification de l’expression de la caspase-3 dans le tissu pancréatique. (F) La cytométrie en flux a été utilisée pour évaluer l’étendue de la mort cellulaire dans les cellules acineuses pancréatiques de souris. (G) Dénombrement des cellules mortes à un stade avancé dans les cellules acineuses pancréatiques de souris. Les données sont exprimées en moyennes ± SEM, n = 4. « ns » signifie non significatif, *P < 0,05, ****P < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : L’expression de HMGB-1 dans le tissu pancréatique de souris. (A) Images représentatives et images agrandies (x400, barre d’échelle 50 μm) de la coloration immunohistochimique de HMGB-1 sur des coupes pancréatiques. La couleur jaune brunâtre indique des cellules positives (n = 4). (B) Le pourcentage de cellules HMGB-1 positives dans les coupes de tissu pancréatique (n = 24). (C) Le taux de HMGB-1 dans le sérum de souris (n = 4). (D, E) Un Western blot a été effectué pour détecter le niveau d’expression de HMGB-1 dans le tissu pancréatique et pour obtenir les résultats de quantification (n = 4). Les données sont exprimées en moyens ± MEB, « ns » signifie non significatif, *P < 0,05, ****P < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Lésions multiviscérales dans le modèle de souris du groupe PI V. (A) Des images représentatives des changements histologiques dans les tissus du pancréas, des poumons, du foie et des reins recueillies chez les souris des groupes CON et PI V ont été analysées à l’aide de la coloration H&E (grossissement 200x, barre d’échelle 50 μm). Les altérations pathologiques associées à la nécrose des cellules acineuses sont indiquées par des flèches noires. Les flèches jaunes indiquent des changements pathologiques caractérisés par une hémorragie interstitielle et un œdème dans les alvéoles. L’œdème et la nécrose des hépatocytes sont indiqués par des flèches vertes. Les modifications pathologiques liées à l’hémorragie glomérulaire sont signalées par des flèches rouges. (B) Le calcul des scores histologiques a été effectué sur des tissus pancréatiques, pulmonaires, hépatiques et rénaux obtenus chez les souris du groupe CON et du groupe PI V. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 1 : Protocole d’injection intrapéritonéale. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 2 : Critères de notation pathologique de la gravité de la pancréatite. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
À l’heure actuelle, il n’existe pas de moyens efficaces d’améliorer le taux de mortalité élevé chez les patients atteints de pancréatite aiguë sévère. Il est crucial d’étudier l’efficacité des médicaments dans l’amélioration des mécanismes de stabilité immunitaire. Il existe un besoin urgent d’un modèle animal idéal pour la pancréatite aiguë sévère. Les souris avec un patrimoine génétique C57BL/6J sont largement utilisées dans la recherche biomédicale, y compris les études sur la physiopathologie SAP. Plus de 70 ans de différenciation génétique chez les souris B6J ont entraîné la délétion spontanée de plusieurs exons15, entraînant une sensibilité réduite aux lésions pancréatiques induites par la céruleine16. De plus, les modèles animaux existants de pancréatite aiguë ont des limites telles que le traumatisme chirurgical ou l’applicabilité uniquement à des animaux plus grands, ce qui entrave les recherches scientifiques utilisant ces modèles. Par conséquent, il est très utile d’établir un modèle animal stable, efficace et pratique à l’aide de cette souche génétique spécifique.
La céruleine est un analogue de la cholécystokinine qui induit des lésions du tissu pancréatique en provoquant une obstruction relative du liquide digestif pancréatique et de la sécrétion d’enzymes par des injections à haute fréquence dans un court laps de temps lorsque les souris ont jeûné et stocké des quantités suffisantes de liquide digestif17. Le LPS est le principal composant présent dans les parois cellulaires bactériennes et peut provoquer le MODS et le SIRS chez la souris18. Une étude antérieure a démontré que la combinaison d’injections de Caerulein à différentes fréquences avec des doses variables de LPS administrées par injection intrapéritonéale induisait des changements pathologiques similaires observés chez l’hommeSAP 19,20. Cette étude a utilisé une approche non invasive pour induire divers degrés de lésions pancréatiques en combinant différentes fréquences d’injections de Cærulein avec différentes doses de LPS administrées par voie intrapéritonéale chez la souris. Assurer une absorption uniforme par le péritoine a été crucial lors de l’élaboration du protocole. Pour répondre à cette exigence, il est crucial de respecter strictement les étapes de l’injection intrapéritonéale afin d’assurer un contrôle précis de chaque administration de médicament. De plus, un frottement doux et l’application d’une pression appropriée sur le site d’injection à l’aide d’un coton-tige stérile après chaque injection de médicament sont essentiels pour une distribution uniforme du médicament dans toute la cavité péritonéale. De plus, il est de la plus haute importance de placer la tête d’épingle dans la cavité péritonéale, l’aiguille pointant vers la zone centrale de la partie supérieure de l’abdomen. Une formation préalable doit être dispensée pour permettre aux opérateurs de percevoir avec précision toute absence de résistance lors de l’insertion de l’aiguille dans la cavité abdominale. L’utilisation d’une pompe à perfusion micro-quantitative au lieu d’un fonctionnement manuel pourrait potentiellement améliorer la qualité de l’injection de médicaments ; Malheureusement, cela n’a pas été mis en œuvre dans la présente étude. Néanmoins, en utilisant différents schémas d’injection, nous avons induit divers degrés de lésions pancréatiques et observé efficacement des différences de lésions pancréatiques causées par différentes fréquences et doses dans des conditions techniques identiques induites par Caerulein combiné à des injections de LPS. Cela fournit des informations précieuses pour l’utilisation future de Caerulein dans des modèles animaux non invasifs pour l’induction de la pancréatite aiguë sévère.
L’association de la céruleine et du LPS a entraîné une augmentation significative des taux sériques d’amylase et de lipase, une augmentation du poids du pancréas et des changements histologiques, notamment une infiltration importante de cellules inflammatoires, un œdème des cellules acineuses pancréatiques, une nécrose et une hémorragie, comme le démontrent les colorations à l’hématoxyline et à l’éosine (HE). De plus, avec une dose croissante de LPS, les changements pathologiques dans le pancréas sont devenus plus prononcés. Cependant, il convient de noter qu’il n’y avait pas de différences perceptibles dans les scores de pathologie pancréatique entre les groupes PI IV et PI V, tandis que l’étendue de la nécrose cellulaire du tissu pancréatique était plus prononcée dans le groupe PI III que dans le groupe PI IV. Cette observation suggère que la fréquence d’administration de la céruleine peut servir de facteur principal contribuant aux lésions pancréatiques, tandis que le LPS exacerbe sa progression, entraînant des lésions inflammatoires systémiques18,21. HMGB-1 est une protéine qui fonctionne en fonction de sa localisation22. Le HMGB-1 extracellulaire agit comme une protéine impliquée dans les signaux d’alerte de l’inflammation et est étroitement associé à la gravité de la pancréatite aiguë 23,24,25. Dans cette étude, les taux sériques de HMGB-1 chez les souris de tous les groupes expérimentaux étaient significativement plus élevés par rapport au groupe témoin, le groupe PI V montrant l’augmentation la plus significative. Des expériences immunohistochimiques et d’électrophorèse protéique ont également confirmé l’expression élevée de HMGB-1 dans le tissu pancréatique. Cette protéine importante peut servir de cible thérapeutique pour inhiber la tempête inflammatoire dans la pancréatite aiguë sévère.
En résumé, il est crucial de développer un modèle non invasif, simple et facile à réaliser de SAP chez la souris. Dans ce protocole expérimental, l’induction de lésions pancréatiques à l’aide de Caerulein associée au LPS est fiable et efficace. En administrant Caerulein par voie intrapéritonéale pendant dix jours consécutifs à une dose de 50 μg/kg, suivie d’une injection intrapéritonéale unique de 15 mg/kg de LPS, il est possible d’établir un modèle animal stable, fiable, rentable et efficace de SAP.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Cette étude a été financée par des projets de recherche en sciences de la santé et en sciences médicales dans la ville de Huainan (No. HNWJ2023005) ; Programme municipal d’orientation scientifique et technologique dans la ville de Huainan (n° 2023151) ; Programme de formation à l’innovation et à l’entrepreneuriat pour les étudiants des collèges provinciaux de l’Anhui (n° S202310361254) ; La neuvième promotion de la série « 50· Étoiles de la science et de la technologie » dans la ville de Huainan et le projet de construction d’une spécialité clinique clé dans la province de l’Anhui. Nous tenons à exprimer notre gratitude au département de laboratoire du premier hôpital affilié de l’Université des sciences et technologies d’Anhui pour avoir fourni les données de test pertinentes.
matériels
| Name | Company | Catalog Number | Comments |
| 20× Citric Acid Antigen Repair Solution (pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1202-250 ml | |
| Amylase | Mindray,China | ||
| Annexin V-FITC/PI | Wuhan servicebio Technology Co.,Ltd, China | G1511 | diluted at 1:20 |
| Anti-HMGB1 Rabbit pAB | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1800 |
| BCA protein quantitative detection kit | Wuhan servicebio Technology Co.,Ltd, China | G2026-200T | |
| BD FACSCanto II Flow Cytometer | BD Life Sciences, San Jose, CA, 95131, USA | BD FACSCanto II | |
| BSA | Wuhan servicebio Technology Co.,Ltd, China | GC305010-100g | |
| C57BL/6J | Cavion Experimental Animal Co., Changzhou, China | license number SCXY (Su) 2011–0003 | |
| Ceruletide | MCE, New Jersey, USA | 17650-98-5 | 50 µg/kg |
| Chemiluminescence imager | Cytiva CO.,LTD.;USA | ||
| Citric acid antigen repair Solution (Dry powder pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1201-5 L | |
| Collagenase IV | Wuhan servicebio Technology Co.,Ltd, China | GC305014 | 0.5 mg/mL |
| DAB (SA-HRP) Tunel Cell Apoptosis Detection Kit | Wuhan servicebio Technology Co.,Ltd, China | G1507-100 T | |
| Dimension EXL with LM Integrated Chemistry System | Siemens Healthcare Diagnostics Inc.Brookfield,USA | YZB/USA 8311-2014 | |
| ECL developer | Wuhan servicebio Technology Co.,Ltd, China | ||
| Eosin dye (alcohol soluble) | Wuhan servicebio Technology Co.,Ltd, China | G1001-100 ml | |
| EthoVision XT | Noldus, Netherlands | ||
| FITC-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB22303 | diluted at 1:50 |
| Fully automatic blood cell analyzer | Zybio Inc. China | Zybio-Z3 CRP | |
| GapDH | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1500 |
| Hematoxylin blue return solution | Wuhan servicebio Technology Co.,Ltd, China | G1040-500 ml | |
| Hematoxylin differentiation solution | Wuhan servicebio Technology Co.,Ltd, China | G1039-500 ml | |
| Hematoxylin dye | Wuhan servicebio Technology Co.,Ltd, China | G1004-100 ml | |
| HMGB-1 ELISA kits | njjcbio Co., Ltd, China | ||
| HOMOGENIZER | Wuhan servicebio Technology Co.,Ltd, China | KZ-III-F;IC111150 100222 | |
| HRP-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB23303 | diluted at 1:1500 |
| IL-6 ELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0001 | |
| Lipase | Mindray,China | ||
| Lipopolysaccharide | Wuhan servicebio Technology Co.,Ltd, China | GC205009 | 15 mg/kg |
| Low temperature high speed centrifuge | Changsha Pingfan Apparatus&Instrument Co.,Ltd.,China | TGL-20M | |
| Membrane breaking liquid | Wuhan servicebio Technology Co.,Ltd, China | G1204 | |
| microtome | Jinhua Craftek Instrument Co., Ltd.;China | CR-601ST | |
| Nylon mesh | Wuhan servicebio Technology Co.,Ltd, China | 200-mesh | |
| One-step TUNEL cell apoptosis detection kit (DAB staining method) | Wuhan servicebio Technology Co.,Ltd, China | G1507-100T | |
| Paraffin tissue embedding machine | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PBM-A | |
| Pathological tissue drying apparatus | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PHY-III | |
| Phosphate-buffered saline | Wuhan servicebio Technology Co.,Ltd, China | G4202-100ML | |
| PMSF | Wuhan servicebio Technology Co.,Ltd, China | G2008-1 ml | |
| Positive fluorescence microscope | Olympus Corporation,Tokyo, Japan | BX53 | |
| Pro Calcitonin | Mindray,China | ||
| PVDF membrane | Millipore, USA | 0.22 µm | |
| RIPA | Wuhan servicebio Technology Co.,Ltd, China | G2002-100 ml | |
| SDS-PAGE | Beyotime Biotechnology,China | P0012A | |
| TNF-αELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0004 | |
| Ultrasonic water bath | DONGGUAN KQAO ULTRASONIC EQUIPMENT CO.,LTD.;China | KQ-200KDE | |
| Western Blot | Bio-Rad Laboratories, Inc.,USA | ||
| Western blot imaging System | Global Life Sciences IP Holdco LLC, JAPAN | Amersham ImageQuant 800 | |
| Whirlpool mixer | SCILOGEX;USA |
Références
- Gliem, N., Ammer-Herrmenau, C., Ellenrieder, V., Neesse, A. Management of severe acute pancreatitis: An update. Digestion. 102 (4), 503-507 (2021).
- Duan, F., et al. GDF11 ameliorates severe acute pancreatitis through modulating macrophage M1 and M2 polarization by targeting the TGFbetaR1/SMAD-2 pathway. Int Immunopharmacol. 108, 108777 (2022).
- Zhang, X. P., et al. Preparation method of an ideal model of multiple organ injury of rat with severe acute pancreatitis. World J Gastroenterol. 13 (34), 4566-4573 (2007).
- Bluth, M. H., Patel, S. A., Dieckgraefe, B. K., Okamoto, H., Zenilman, M. E. Pancreatic regenerating protein (reg I) and reg I receptor mRNA are upregulated in rat pancreas after induction of acute pancreatitis. World J Gastroenterol. 12 (28), 4511-4516 (2006).
- Qiu, F., Lu, X. S., Huang, Y. K. Effect of low molecular weight heparin on pancreatic micro-circulation in severe acute pancreatitis in a rodent model. Chin Med J (Engl). 120 (24), 2260-2263 (2007).
- Lombardi, B., Estes, L. W., Longnecker, D. S. Acute hemorrhagic pancreatitis (massive necrosis) with fat necrosis induced in mice by DL-ethionine fed with a choline-deficient diet. Am J Pathol. 79 (3), 465-480 (1975).
- Liu, Y., et al. Deletion of XIAP reduces the severity of acute pancreatitis via regulation of cell death and nuclear factor-kappaB activity. Cell Death Dis. 8 (3), e2685 (2017).
- Niederau, C., Ferrell, L. D., Grendell, J. H. Caerulein-induced acute necrotizing pancreatitis in mice: Protective effects of proglumide, benzotript, and secretin. Gastroenterology. 88, 1192-1204 (1985).
- Zhou, X., et al. DPP4 inhibitor attenuates severe acute pancreatitis-associated intestinal inflammation via Nrf2 signaling. Oxid Med Cell Longev. 2019, 6181754 (2019).
- Yang, J., et al. Heparin protects severe acute pancreatitis by inhibiting HMGB-1 active secretion from macrophages. Polymers (Basel). 14 (12), 2470 (2022).
- Kong, L., et al. Sitagliptin activates the p62-Keap1-Nrf2 signalling pathway to alleviate oxidative stress and excessive autophagy in severe acute pancreatitis-related acute lung injury. Cell Death Dis. 12 (10), 928 (2021).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Schmidt, J., et al. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 215 (1), 44-56 (1992).
- Luo, C., et al. Abdominal paracentesis drainage attenuates severe acute pancreatitis by enhancing cell apoptosis via PI3K/AKT signaling pathway. Apoptosis. 25 (3-4), 290-303 (2020).
- Fontaine, D. A., Davis, D. B. Attention to background strain is essential for metabolic research: C57BL/6 and the international knockout mouse consortium. Diabetes. 65 (1), 25-33 (2016).
- Wan, J., et al. Pancreas-specific CHRM3 activation causes pancreatitis in mice. JCI Insight. 6 (17), e132585 (2021).
- Sah, R. P., et al. Cerulein-induced chronic pancreatitis does not require intra-acinar activation of trypsinogen in mice. Gastroenterology. 144 (5), 1076-1085 (2013).
- Wang, K., et al. Activation of AMPK ameliorates acute severe pancreatitis by suppressing pancreatic acinar cell necroptosis in obese mice models. Cell Death Discov. 9 (1), 363 (2023).
- Jin, C., Li, J. C. Establishment of a severe acute pancreatitis model in mice induced by combined Rain Frog Peptide and lipopolysaccharide and exploration of its mechanism. Acta Exp Bio Sinica. 36 (2), 91-96 (2003).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Roy, R. V., et al. Pancreatic Ubap2 deletion regulates glucose tolerance, inflammation, and protection from Caerulein-induced pancreatitis. Cancer Lett. 578, 216455 (2023).
- Chen, R., Kang, R., Tang, D. The mechanism of HMGB1 secretion and release. Exp Mol Med. 54 (2), 91-102 (2022).
- Murao, A., Aziz, M., Wang, H., Brenner, M., Wang, P. Release mechanisms of major DAMPs. Apoptosis. 26 (3-4), 152-162 (2021).
- Liu, T., et al. Accuracy of circulating histones in predicting persistent organ failure and mortality in patients with acute pancreatitis. Br J Surg. 104 (9), 1215-1225 (2017).
- Li, N., Wang, B. M., Cai, S., Liu, P. L. The role of serum high mobility Group Box 1 and Interleukin-6 levels in acute pancreatitis: A meta-analysis. J Cell Biochem. 119 (1), 616-624 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon