Method Article
Preparazione di un modello murino di pancreatite acuta grave tramite una combinazione di iniezione intraperitoneale di ceruleina e lipopolisaccaride
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
La somministrazione intraperitoneale di farmaci è un approccio non invasivo sicuro ed efficace per indurre lesioni pancreatiche. Questo studio ha confrontato cinque distinti protocolli di iniezione intraperitoneale sui topi per indurre vari gradi di danno pancreatico e ha stabilito un modello di grave danno pancreatico per studiare i cambiamenti patologici e le strategie di trattamento per la pancreatite acuta grave (SAP).
Abstract
Il trattamento della pancreatite acuta grave (SAP), con alti tassi di mortalità, rappresenta una sfida clinica significativa. Studiare i cambiamenti patologici associati alla SAP utilizzando modelli animali può aiutare a identificare potenziali bersagli terapeutici ed esplorare nuovi approcci terapeutici. Studi precedenti hanno indotto principalmente lesioni pancreatiche attraverso l'iniezione retrograda del dotto biliare di taviaurocolato di sodio, ma l'impatto del danno chirurgico sulla qualità del modello animale rimane poco chiaro. In questo studio, abbiamo impiegato varie frequenze di iniezioni intraperitoneali di Caeruleina combinate con diverse dosi di LPS per indurre lesioni pancreatiche nei topi C57BL/6J e abbiamo confrontato l'entità della lesione attraverso cinque protocolli di iniezione intraperitoneale. Per quanto riguarda l'induzione della pancreatite acuta nei topi, viene proposto un protocollo di iniezione intraperitoneale che si traduce in un tasso di mortalità fino all'80% entro 5 giorni. In particolare, i topi hanno ricevuto dieci iniezioni intraperitoneali giornaliere di Caerulein (50 μg/kg), seguite da un'iniezione di LPS (15 mg/kg) un'ora dopo l'ultima somministrazione di Caerulein. Regolando la frequenza e il dosaggio dei farmaci iniettati, è possibile manipolare efficacemente la gravità del danno pancreatico. Questo modello presenta una forte controllabilità e ha un ciclo di replica breve, che lo rende fattibile per il completamento da parte di un singolo ricercatore senza richiedere attrezzature costose. Simula in modo pratico e accurato le caratteristiche chiave della malattia osservate nella SAP umana, dimostrando al contempo un alto grado di riproducibilità.
Introduzione
La pancreatite acuta grave è caratterizzata da una rapida insorgenza, una rapida progressione e alti tassi di mortalità all'interno del dominio1 della malattia dell'apparato digerente. Il suo alto tasso di mortalità è sempre stato al centro dell'attenzione della ricerca clinica. A causa dei cambiamenti imprevedibili delle condizioni cliniche, dell'eterogeneità delle manifestazioni della malattia e della limitata disponibilità di campioni umani, la creazione di modelli animali è diventata sempre più cruciale per la ricerca sulle malattie.
L'iniezione retrograda di taurocolato di sodio nel dotto biliare comune è comunemente usata per creare un modello di ratto di SAP2. Simulando l'ostruzione pancreatico-biliare e inducendo il reflusso della bile e del liquido pancreatico, questa tecnica di modellazione mostra un alto tasso di successo nella replicazione di modelli animali SAP. Tuttavia, va notato che la chirurgia invasiva ha un impatto sul modello animale stesso. Inoltre, questo metodo è limitato agli animali più grandi, come ratti e cani, che vengono utilizzati principalmente come soggetti sperimentali. Tecniche alternative, tra cui l'intubazione duodenale3, la puntura duodenale diretta4 e la puntura diretta del dotto biliare-dotto pancreatico5, sono spesso utilizzate a scopo di modellazione.
L'iniezione intraperitoneale e i metodi di modellazione dietetica offrono vantaggi non invasivi che possono essere applicati ad animali di qualsiasi taglia. Il modello murino di SAP indotto dall'alimentazione con colina-deficiente-etionina (CDE)6 presenta alcune complicanze, come iperglicemia scarsamente controllabile e ipocalcemia, che lo rendono inadatto per valutare nuovi approcci diagnostici e terapeutici. D'altra parte, l'iniezione intraperitoneale di Caeruleina combinata con L-arginina7 rappresenta il metodo più comunemente impiegato per indurre la pancreatite acuta nei topi. In particolare, la somministrazione ripetuta intraperitoneale di Caeruleina, un analogo della colecistochinina, fornisce un approccio altamente adatto per studiare vari aspetti correlati a questa malattia distruttiva, tra cui la patogenesi, l'infiammazione e i processi di rigenerazione. A causa della sua somiglianza strutturale con la colecistochinina (CCK), la caeruleina stimola efficacemente la contrazione della cistifellea e la secrezione enzimatica pancreatica, portando a uno squilibrio nella secrezione enzimatica seguito da una successiva autodistruzione8. Il lipopolisaccaride (LPS), essendo ubiquitario e ampiamente studiato come molecola di pattern molecolare associato a patogeni, può essere combinato con la caeruleina tramite iniezione intraperitoneale per stabilire un modello efficace di SAP nei topi. Questa combinazione innesca e rilascia rapidamente un numero significativo di citochine infiammatorie, con conseguente eccessiva infiammazione locale e sistemica. Diversi studi hanno riportato l'induzione di modelli SAP nei topi attraverso l'iniezione intraperitoneale di Caeruleina combinata con LPS. Ciò può essere attribuito al fatto che l'iniezione intraperitoneale di ceruleina può causare edema pancreatico ed emorragia nei topi, mentre l'aggiunta di LPS può indurre immediatamente necrosi pancreatica ed esacerbare la risposta infiammatoria sistemica, la sepsi e persino l'insufficienza d'organo. Attualmente, vi è una variazione nel dosaggio e nella frequenza delle iniezioni intraperitoneali di Caeruleina, nonché un'incoerenza nel dosaggio aggiuntivo di LPS. Raggiungere la coerenza nei modelli SAP del topo è impegnativo 9,10,11,12; Pertanto, è necessario stabilire un protocollo standardizzato per ottenere un modello ideale. In questo articolo, descriviamo un protocollo per l'iniezione intraperitoneale nei topi e studiamo la frequenza di iniezione ottimale e il dosaggio aggiuntivo di LPS.
Protocollo
Questo protocollo è stato esaminato e approvato dal Comitato Etico presso il Primo Ospedale Affiliato dell'Università di Scienza e Tecnologia di Anhui (Huainan, Cina) (Codice Etico: 2023-KY-905-001). Lo studio ha seguito le linee guida del National Institutes of Health per la cura e l'uso dei roditori da ricerca in tutte le procedure animali. Per il presente studio sono stati utilizzati topi adulti C57BL/6J del peso di 20-30 g. I topi sono stati ospitati in un laboratorio animale per una settimana in condizioni controllate (circa 21 °C con un ciclo alternato giorno-notte di 12 ore). I topi avevano accesso ad libitum a cibo e acqua per tutto il tempo. I dettagli dei reagenti e delle attrezzature utilizzate nello studio sono elencati nella tabella dei materiali.
1. Preparazione degli animali
- Assegnare 84 topi C57BL/6J sani a sei gruppi, incluso il gruppo di controllo, Lesione pancreatica (PI) I, PI II, PI III, PI IV e PI V.
- Prima di iniziare la procedura di modellazione, etichettare ogni gruppo di topi con tacche per le orecchie e lasciarli digiunare per 12 ore.
2. Preparazione del diluente farmacologico indotto
- Sciogliere la ceruleina (1 mg) in 1 mL di PBS e conservare in frigorifero a -20 °C.
- Misurare e registrare il peso dei topi sperimentali 1 ora prima dell'iniezione intraperitoneale del farmaco.
- Estrarre la massa totale di Caeruleina richiesta in un rapporto di 50 μg/kg, in base al peso totale di tutti i topi.
- Diluire nuovamente il farmaco Caerulein ottenuto con PBS.
NOTA: Il volume totale della diluizione di PBS deve essere equivalente a 5 volte il valore del peso totale di tutti i topi. Lo stesso metodo di diluizione è stato utilizzato per ottenere il diluente LPS.
3. Iniezione intraperitoneale
NOTA: Le iniezioni intraperitoneali sono state somministrate a ciascun gruppo di topi secondo il protocollo delineato nella Tabella supplementare 1 per indurre il modello. Altri 10 topi sono stati raggruppati e trattati con i tassi di sopravvivenza a 7 giorni.
- Afferra e tieni i topi in modo che la pancia dei topi sia rivolta verso l'alto e la testa sia posizionata più in basso della coda per evitare danni agli organi durante l'inserimento della siringa.
- Disinfetta l'addome dei topi usando batuffoli di cotone al 75% di alcol.
- Tenere la siringa con la mano destra (utilizzando un ago di misura ≤0,5/≥0,3) e inserire l'ago nella cute sottocutanea sul lato sinistro della linea bianca addominale.
NOTA: Passare al lato destro per l'iniezione successiva. - Una volta che l'ago ha raggiunto lo strato sottocutaneo, spostarlo in avanti di circa 3-5 mm, quindi inserire l'ago della siringa nella cavità addominale con un angolo di 45°. A questo punto, si dovrebbe sentire una certa resistenza.
- Tenere fermo l'ago e iniettare lentamente la sostanza.
NOTA: Non superare 5 volte il valore di peso dei topi come il volume di una singola iniezione intraperitoneale. - Dopo l'iniezione, estrarre l'ago e massaggiare delicatamente e premere il sito di iniezione con un batuffolo di cotone sterile per diffondere completamente il farmaco nella cavità addominale dei topi.
- Usa una nuova siringa per ripetere con i prossimi topi sperimentali.
4. Test di abilità comportamentali in campo aperto
NOTA: 12 ore dopo l'ultima iniezione intraperitoneale, è stato condotto un test di abilità comportamentale in campo aperto per valutare la distanza totale di attività e il tempo di immobilità dei topi.
- Posiziona quattro caselle bianche identiche direttamente sotto la fotocamera.
- Collegare la fotocamera al computer utilizzando un cavo video.
- Assicurarsi che la scatola sperimentale sia pulita e priva di odori prima di iniziare l'esperimento.
- Posiziona l'animale al centro della griglia, rivolto lontano dallo sperimentatore, e lascialo adattare all'ambiente per 10 minuti.
- Avvia il software di tracciamento video e fai clic sul menu File per creare un nuovo esperimento.
- Impostare il monitoraggio per quattro campi visivi simultanei.
- Segna la lunghezza e la larghezza dell'oggetto sperimentale che può muoversi all'interno della scatola nella schermata di monitoraggio in tempo reale (30 cm × 30 cm).
- Una volta completata la configurazione, inizia la videosorveglianza e la registrazione.
- Registra l'attività dei topi per 15 minuti.
- Dopo il test, rimuovere l'animale dalla griglia e rimetterlo nella sua gabbia. Pulire accuratamente la griglia utilizzando uno sterilizzante contenente biossido di cloro.
5. Raccolta e analisi del sangue periferico dei topi
- Eutanasia dei topi (seguendo il protocollo approvato istituzionalmente).
- Eseguire l'eutanasia sui topi sperimentali 36 ore dopo l'iniezione intraperitoneale. Misurare e registrare il peso corporeo dei topi prima dell'eutanasia.
NOTA: Somministrare 0,18 ml di idrato di cloralio al 10% per via intraperitoneale, assicurando che non reagisca alla stimolazione della punta o della coda. - Con la mano sinistra, fissa i topi e con la mano destra tieni le forbici per tagliare i baffi su un lato dei topi.
- Premere delicatamente la pelle intorno all'occhio per indurre la congestione e la sporgenza del bulbo oculare.
- Usa una pinza curva per afferrare il bulbo oculare e rimuoverlo rapidamente, raccogliendo il sangue periferico in una provetta da microcentrifuga.
NOTA: Sono stati utilizzati due diversi tipi di provette per microcentrifuga, una contenente anticoagulante e l'altra senza. - Contemporaneamente, premere leggermente l'area del cuore dei topi con il dito medio della mano sinistra per aumentare la velocità di pompaggio del cuore.
- Eseguire l'eutanasia sui topi sperimentali 36 ore dopo l'iniezione intraperitoneale. Misurare e registrare il peso corporeo dei topi prima dell'eutanasia.
- Lasciare il sangue periferico senza anticoagulante a temperatura ambiente per 30 min.
- Misurare le concentrazioni sieriche di amilasi (Amy) e lipasi (Lip) utilizzando un analizzatore biochimico automatizzato attraverso il metodo del tasso enzimatico e il metodo della circolazione enzimatica (seguendo le istruzioni del produttore).
- Determinare i livelli di indicatori infiammatori come la Pro Calcitonina (PCT) nel plasma utilizzando il metodo della chemiluminescenza utilizzando un imager a chemiluminescenza commerciale (seguendo le istruzioni del produttore).
- Utilizzare i kit ELISA per misurare i livelli di HMGB-1, IL-6 e TNF-α nel siero dei topi (seguendo le istruzioni del produttore).
- Analizzare il sangue periferico trattato con anticoagulante utilizzando un analizzatore di cellule del sangue completamente automatico per valutare i parametri rilevanti.
6. Raccolta del tessuto pancreatico e preparazione di una sezione di paraffina
- Metti i topi in posizione supina e fissali su un piatto di schiuma.
- Radere e disinfettare l'area, quindi praticare un'incisione mediana addominale e capovolgere il tubo dell'intestino tenue verso destra per esporre completamente il pancreas.
- Scollegare il duodeno e il dotto pilorico e localizzare l'intestino tenue sotto il pancreas. Liberare completamente il tessuto pancreatico lungo il dotto intestinale.
- Usa una pinza senza denti per bloccare la milza e tirare delicatamente verso l'alto.
NOTA: Non toccare direttamente il tessuto pancreatico ed evitare di usare una forza eccessiva durante l'intero processo di dissociazione. - Sezionare bruscamente il tessuto del legamento pancreatico posteriore fino alla testa del pancreas e scollegare il dotto biliare e i vasi sanguigni.
- Rimuovere il tessuto pancreatico, asciugare l'umidità superficiale con carta assorbente, pesare e registrare.
- Fissare metà del tessuto pancreatico con il 4% di paraformaldeide e conservare l'altra metà in frigorifero a -80 °C.
- Preparare le sezioni di paraffina pancreatica seguendo i passaggi seguenti.
- Pulire il tessuto pancreatico fissato con alcol al 75% e tagliarlo a una dimensione di circa 0,5 cm × 0,5 cm.
- Immergere il fazzoletto in etanolo al 70% per 20 minuti, etanolo all'80% per altri 20 minuti ed etanolo al 90% per 15 minuti.
- Trattare il tessuto due volte con etanolo al 95% per 15 minuti ogni volta e poi due volte con etanolo al 100% per 5 minuti ogni volta.
- Sottoporre il tessuto a due cicli di trattamenti di 12 minuti e 5 minuti con una soluzione di xilene per la trasparenza.
- Immergere il fazzoletto trasparente in una vasca di cera a 65 °C per 1 ora.
- Incorporare il fazzoletto nella paraffina fusa e lasciarlo raffreddare. Ottenere sezioni di paraffina pancreatica con un'affettatrice (spessore: 5 μm).
- Appiattire le fette di paraffina ottenute in acqua a 45 °C, montarle e asciugarle (condizioni di cottura: 40 °C per 14-16 h).
7. Colorazione con ematossilina ed eosina (H&E)
- Posizionare le sezioni di paraffina pancreatica nello xilene I e II per 30 minuti, quindi in alcol anidro, 95%, 85% e 75% per 5 minuti ciascuno e acqua ultrapura per 5 minuti.
- Colorare il nucleo cellulare con ematossilina per 160 s, quindi risciacquare lentamente con acqua corrente.
- Applicare una soluzione di differenziazione dell'alcol dell'acido cloridrico per 5-10 s, quindi risciacquare rapidamente con acqua corrente.
- Trattare le sezioni con alcol anidro per 5 minuti.
- Incubare il citoplasma con eosina per 30 s, quindi risciacquare con acqua corrente.
- Immergere le sezioni in etanolo al 75%, 85%, 95% e 100% per 10 secondi ciascuna, quindi trattare con xilene per 5 minuti per disidratare.
- Infine, sigillare le sezioni con resina neutra e osservare al microscopio.
- Eseguire il punteggio patologico e gli standard13.
NOTA: Determinare la gravità della pancreatite in base a indicatori quali edema, necrosi acina, sanguinamento, emorragia e necrosi adiposa e infiammazione infiammatoria e perivascolare. Utilizzare le linee guida per l'implementazione pubblicate in precedenza per il punteggio13.
8. Colorazione immunoistochimica
- Decerare le sezioni di tessuto pancreatico incluse in paraffina in xilene e successivamente reidratarle in un gradiente di soluzioni di etanolo.
- Eseguire il blocco enzimatico endogeno utilizzando il 3% di H2O2 per 20 minuti dopo una rottura della membrana di 30 minuti.
- Bloccare l'anticorpo con siero bovino al 5% a temperatura ambiente per 30 minuti, quindi incubare per una notte a 4 °C con una diluizione 1:1500 di coniglio anti-HMGB1.
- Sciacquare le sezioni con PBS, quindi incubarle negli anticorpi secondari corrispondenti per 30 minuti a 37 °C. Successivamente, eseguire lo sviluppo del colore DAB, la controcolorazione dell'ematossilina e sigillare con gomma neutra.
9. Metodo TUNEL per rilevare l'apoptosi nelle sezioni pancreatiche
- Decerare le sezioni di paraffina pancreatica in xilene per 5 minuti, ripetere due volte e lavare con etanolo a gradiente (100% per 5 minuti, 90% per 2 minuti, 70% per 2 minuti e acqua distillata per 2 minuti).
- Lavare via il liquido in eccesso che circonda le sezioni di paraffina usando il PBS. Trattare ogni campione con 100 μL di proteinasi K, garantendo una copertura completa del tessuto. Incubare i campioni a 37 °C per 20 minuti. Successivamente, immergere i campioni in PBS 3 volte, ogni volta per 5 minuti.
NOTA: La soluzione di proteinasi K è stata preparata diluendo la soluzione originale di proteinasi K (200 μg/mL) con PBS in un rapporto di 1:9 (volume), ottenendo una concentrazione finale di 20 μg/mL, esclusa la DNasi. Un lavaggio accurato della proteinasi K è essenziale per evitare interferenze con le successive reazioni di marcatura. - Aggiungere una quantità adeguata di 3% H2O2 (diluito da PBS) sul tessuto per infiltrarlo completamente e incubare per 20 minuti. Risciacquare il fazzoletto con PBS 3 volte per 5 minuti ciascuna.
NOTA: Le sezioni di paraffina devono essere mantenute umide. Per inattivare le perossidasi endogene nel tessuto, il tempo di incubazione non deve essere troppo lungo per evitare falsi positivi dovuti alla rottura del DNA causata dal 3% di H2O2. - Coprire l'intera area del campione da testare con 50 μL di tampone di equilibratura e incubare per 10 minuti.
- Rimuovere il più possibile il buffer di equilibratura. Quindi, aggiungere 56 μl di tampone di incubazione TdT a ciascun campione di tessuto e incubare per 1 ora (a temperatura ambiente).
NOTA: Il vetrino non deve essere lasciato asciugare e l'esposizione alla luce deve essere evitata. Il tampone di incubazione TdT è stato preparato secondo le istruzioni del produttore (Enzima TdT ricombinante: Biotina-dUTP Miscela di marcatura: Tampone di equilibrio = 1 μL: 5 μL: 50 μL). - Lavare immediatamente i campioni di tessuto con PBS. Sciacquateli 4 volte per 5 minuti ciascuno. Rimuovere delicatamente l'eventuale soluzione di PBS in eccesso attorno ai campioni con carta da filtro.
- Aggiungere 100 μL di soluzione di reazione Streptavidina-HRP precedentemente diluita (Streptavidina-HRP: TBST = 1: 300) a ciascun campione di tessuto per la reazione Streptavidina-HRP. Incubare per 30 min. Quindi, lavare i campioni con PBS e sciacquarli 3 volte per 5 minuti ciascuno.
- Eseguire la colorazione DAB aggiungendo 50 μL di DAB a ciascuna sezione di paraffina. Osserva la colorazione al microscopio in tempo reale. Dopo la comparsa di una colorazione positiva, posizionare immediatamente i vetrini in una scatola umida. Ferma la reazione lavandolo con acqua pura.
- Immergere i vetrini in una soluzione colorante di ematossilina per 3-5 minuti, quindi risciacquare con acqua pura.
- Differenziare in soluzione di differenziazione dell'ematossilina per circa 2 s, seguito da risciacquo immediato con acqua pura.
- Ottenere la colorazione blu utilizzando la soluzione rebluante di ematossilina per alcuni secondi e risciacquare i vetrini con acqua pura.
NOTA: Condurre un esame microscopico dopo la colorazione nucleare. Se la colorazione è troppo scura, riportare i vetrini nella soluzione di differenziazione. Se la colorazione è troppo chiara, riavviare il processo di colorazione dalla fase di colorazione nucleare. - Disidratare i campioni con 4 cicli di etanolo anidro fresco per 5 minuti ciascuno. Quindi, immergili nel butanolo per 5 minuti e nello xilene per 5 minuti. Infine, usa lo xilene fresco per altri 5 minuti.
- Montare i vetrini utilizzando una gomma neutra. Lasciarli asciugare naturalmente all'aria o in forno a 60 °C.
- Eseguire l'esame istologico utilizzando un microscopio a luce bianca. I nuclei apoptotici appariranno marroni.
- Calcola l'indice apoptotico (AI) corrispondente.
NOTA: Osservare le diapositive in doppio cieco. Nei vetrini positivi a TUNEL, selezionare in modo casuale 5 aree positive ad alto ingrandimento (400x) e contare almeno 100 cellule acinose in ciascuna area per determinare la percentuale di cellule positive. AI = (numero totale di cellule apoptotiche/numero totale di cellule) × 100%.
10. Citometria a flusso
- Procurare tessuti pancreatici freschi e lavarli accuratamente dopo averli perfusi con PBS.
- Preparare una soluzione digestiva per via endovenosa di collagenasi allo 0,5% e utilizzare forbici per tessuti sterili per digerire adeguatamente i tessuti pancreatici.
- Aggiungere una soluzione di terminazione della digestione BSA al 5% a seconda delle condizioni dei frammenti pancreatici e della torbidità del liquido, e centrifugare la miscela a bassa temperatura per 5 minuti (~300 x g, 4 °C).
- Scartare il surnatante per terminare la digestione.
- Preparare un terreno di coltura cellulare contenente fenilmetanosulfonilfluoruro (PMSF) e il 2,5% di sospensione di cellule di siero fetale bovino per risospendere le cellule pancreatiche.
- Filtrare le sospensioni di cellule acinose pancreatiche attraverso una rete di nylon da 200 maglie per ottenere sospensioni cellulari attraverso il filtraggio cellulare.
- Centrifugare la sospensione di cellule acinose pancreatiche a bassa temperatura (seguire le condizioni indicate al punto 10.3).
- Scartare il surnatante.
- Lavare le celle con PBS pre-raffreddato.
- Risospendere delicatamente le cellule in un tampone legante 1x pre-raffreddato mediante risospensione centrifuga.
- Etichettare le cellule acinose pancreatiche con l'annessina V-FITC/PI secondo le istruzioni del produttore dopo aver regolato la concentrazione cellulare.
- Utilizzare la citometria a flusso entro 1 ora per rilevare l'apoptosi nelle cellule acinose pancreatiche.
11. Rilevamento Western blot di Caspasi-3 e HMGB-1
- Estrarre la proteina pancreatica.
- Estrarre 50 mg di tessuto pancreatico e tagliarlo in piccoli frammenti.
- Aggiungere 1 mL di tampone di lisi RIPA (contenente PMSF e inibitore della proteasi fosforilata).
- Omogeneizzare il tessuto pancreatico su ghiaccio per 5 minuti utilizzando un tritatutto elettrico.
- Incubare il tessuto omogeneizzato su ghiaccio agitando delicatamente per 2 ore.
- Centrifugare l'omogeneizzato a 4 °C per 10 minuti a 4.500 x g.
- Raccogliere la soluzione surnatante e conservarla a -80 °C.
- Eseguire la quantificazione delle proteine.
- Diluire un certo volume di campione standard BSA (25 mg/mL) a una concentrazione di 0,5 mg/mL.
- Preparare una quantità specifica di soluzione di lavoro BCA mescolando 50 volumi di soluzione BCA A con 1 volume di soluzione BCA B, assicurando una miscelazione accurata e uniforme.
- Posizionare il campione standard BSA nei fori standard su una piastra a 96 pozzetti nell'ordine di 0, 1, 2, 4, 8, 12, 16 e 20 μl. Bilanciare il volume di ciascun foro con acqua distillata, ottenendo un volume totale di 20 μl.
- Aggiungere 2 μL di campioni nei fori del campione, quindi aggiungere in sequenza 18 μL di acqua distillata per la diluizione (1:9).
- Riempire ogni pozzetto con 200 μL di soluzione di lavoro BCA e lasciarlo riposare a 37 °C per circa 20-30 minuti.
- Misurare l'assorbanza a una lunghezza d'onda di 562 nm. Calcolare la concentrazione proteica dei campioni in base alla curva standard.
- Aggiungere un volume specifico di soluzione di cracking RIPA e tampone di diluizione per diluire i campioni fino a raggiungere la concentrazione di 5-10 μg/μL, che è considerata appropriata.
- Conservare i campioni a -20 °C dopo la denaturazione delle proteine (100 °C; 10 min).
- Eseguire il Western blotting.
- Preparatevi per SDS-PAGE.
- Installa gli stampi per la produzione di colla e controlla le loro prestazioni di tenuta.
- Aggiungere TEMED all'adesivo di separazione al 10% e mescolare uniformemente.
- Iniettare il composto nello stampo, che rappresenta circa i due terzi del volume, evitando la formazione di bolle.
- Aggiungere l'isopropanolo allo stampo e premere l'adesivo per circa 40 minuti.
- Utilizzare lo stesso programma per configurare l'adesivo concentrato al 5%.
- Versare l'isopropanolo e aggiungere immediatamente l'adesivo.
- Posizionare il pettine verticalmente fino a quando la colla non polimerizza completamente.
- Eseguire l'operazione di elettroforesi.
- Aggiungere il campione da testare nell'ordine di controllo sperimentale previsto, in ordine inverso, nei fori di campionamento dell'adesivo SDS-PAGE.
- Aggiungere contemporaneamente il Protein Mark per determinare la posizione della proteina target e della proteina di riferimento interna.
- Posizionare il campione nella vasca per elettroforesi al termine dell'aggiunta del campione.
- Inizialmente, eseguire a 80 V per 30 minuti, quindi eseguire il gel per separare la proteina a 100 V per 60 minuti.
NOTA: Prestare attenzione alla posizione del blu di bromofenolo per evitare un'eccessiva elettroforesi.
- Eseguire il trasferimento delle proteine.
- Taglia la pellicola in PVDF nell'angolo in alto a destra per fungere da segno.
- Mettere il film PVDF in una soluzione di metanolo per 5-10 s per attivarlo.
- Immergere la pellicola di PVDF in un tampone per elettroforesi per circa 15 minuti.
- Rimuovere con cura il gel dopo l'elettroforesi e tagliare il gel in eccesso, assicurandosi che il gel rimanga umido durante tutto il processo.
- Assemblare la stecca nel seguente ordine: piastra negativa → spugna → tre strati di carta da filtro → gel → pellicola PVDF → tre strati di carta da filtro → spugna → piastra positiva.
NOTA: Assicurarsi che non vi siano bolle tra il gel e la pellicola in PVDF. - Posizionare il morsetto assemblato nella scanalatura rotante bagnata (da nero a nero) con i cubetti di ghiaccio posizionati attorno ad esso.
- Accendere l'alimentazione e avviare il trasferimento della pellicola a 400 mA per 100 min.
- Eseguire la sigillatura del film PVDF e l'incubazione di anticorpi primari e secondari.
- Rimuovere delicatamente la pellicola di PVDF dopo il trasferimento e risciacquare con TBST per 10 minuti, ripetendo il processo 3-5 volte.
- Sigillare il film PVDF in latte scremato al 5% per 2 ore.
- Rimuovere la pellicola di PVDF e risciacquare con TBST per 10 minuti, ripetendo il processo 4 volte.
- Mettere insieme la pellicola di PVDF e l'anticorpo primario diluito in frigorifero a 4 °C agitando delicatamente e incubare per una notte.
- Rimuovere la pellicola in PVDF il giorno successivo e risciacquare con TBST per 10 minuti, ripetendo il processo 4 volte.
- Incubare il film PVDF in un diluente per anticorpi secondari marcato con HRP per circa 2 ore.
- Sciacquare la pellicola in PVDF con TBST per 10 minuti, ripetendo il processo 4 volte.
- Esponi il film e analizzalo.
- Applicare uniformemente la soluzione ECL preparata sulla pellicola.
- Esporre la pellicola in una stanza buia con un esposimetro per circa 2-3 minuti e poi conservarla.
- Condurre l'analisi utilizzando il software di immagine J.
- Preparatevi per SDS-PAGE.
Risultati
Il processo di modellazione sperimentale dei topi è illustrato nella Figura 1. Dopo 12 ore dal completamento dell'iniezione, è stato utilizzato un videoregistratore in campo aperto per monitorare la distanza di movimento e la durata dell'immobilità di diversi gruppi sperimentali di topi per 5 cicli (Figura 2A). Durante i 5 cicli, i topi del gruppo PI V hanno mantenuto un basso livello di distanza di movimento entro 3 minuti, mentre il rapporto di immobilità entro 3 minuti è aumentato ad ogni ciclo successivo (Figura 2B, C). Inoltre, è stata condotta un'analisi statistica sulla distanza di movimento totale di topi di diversi gruppi sperimentali durante i 5 cicli. Il gruppo PI V ha mostrato la distanza di movimento totale più piccola rispetto agli altri gruppi sperimentali e la differenza era statisticamente significativa (p < 0,001) (Figura 2D, E). Con l'eccezione del gruppo di controllo e del gruppo PI I, i topi degli altri gruppi sperimentali hanno mostrato una crescita negativa del peso del valore D. Tra questi, il gruppo PI V ha mostrato la maggiore variazione di peso e la differenza di variazione di peso rispetto agli altri gruppi sperimentali è stata statisticamente significativa (Figura 2F). Dopo aver valutato il tasso di sopravvivenza di altri 10 topi in ciascun gruppo sperimentale, i risultati hanno mostrato che il tasso di mortalità dei topi nel gruppo PI V ha raggiunto l'80% il 5° giorno. Tuttavia, non c'era alcuna differenza statisticamente significativa nel tasso di mortalità tra gli altri quattro gruppi sperimentali e i topi del gruppo di controllo (Figura 2G).
Utilizzando un microscopio ad alta potenza, sono stati osservati un significativo rigonfiamento cellulare, necrosi e infiltrazione cellulare infiammatoria nei gruppi di topi PI IV e PI V (Figura 3A, B). Utilizzando i criteri di valutazione forniti nella Tabella supplementare 2, è stata valutata la patologia pancreatica di diversi gruppi sperimentali di topi e sono state osservate differenze significative nel punteggio della patologia pancreatica rispetto ai topi del gruppo di controllo (p < 0,001) (Figura 3C; Figura supplementare 1). Inoltre, rispetto al gruppo di controllo, i livelli sierici di amilasi e lipasi nei topi misurati erano significativamente più alti nei gruppi sperimentali da PI II a PI V e le differenze erano statisticamente significative. È interessante notare che non c'era alcuna differenza statisticamente significativa nei topi del gruppo PI I (Figura 3D, E). Il metodo ELISA è stato impiegato per valutare i livelli dei marcatori infiammatori14, tra cui TNF-α e IL-6, nel siero dei topi. I risultati hanno rivelato che i livelli di TNF-α e IL-6 nei topi del gruppo PI V erano significativamente più alti di quelli degli altri gruppi sperimentali e le differenze erano statisticamente significative (Figura 3F, G). Rispetto al gruppo di controllo, i livelli di PCT sono aumentati in tutti e quattro i gruppi sperimentali, ma solo la differenza nel gruppo PI V è stata statisticamente significativa (p < 0,05) (Figura 3H).
Lo stato apoptotico dei tessuti pancreatici in diversi gruppi sperimentali di topi
Eseguendo la colorazione TUNEL sui tessuti pancreatici di ciascun gruppo di topi, è stato osservato lo stato di necrosi cellulare nei tessuti pancreatici di diversi gruppi sperimentali (Figura 4A). I valori della scala di grigi (OD) per unità di area delle sezioni di tessuto pancreatico e il tasso positivo di necrosi cellulare sono stati analizzati semi-quantitativamente utilizzando il software Image J. I risultati hanno mostrato che, rispetto agli altri gruppi sperimentali, il livello di necrosi cellulare nei tessuti pancreatici del gruppo di topi PI V era significativamente aumentato e la differenza era statisticamente significativa (p < 0,001) (Figura 4B, C). Sono stati eseguiti esperimenti di immunoblotting proteico per valutare i livelli di espressione della cisteinil aspartato specifica proteinasi-3 (Caspasi-3), un marcatore di necrosi cellulare, nei tessuti pancreatici di topi di diversi gruppi sperimentali (Figura 4D). La quantificazione dell'espressione della caspasi-3 ha mostrato che il livello di espressione della proteina caspasi-3 nei tessuti pancreatici del gruppo PI V era significativamente aumentato e la differenza era statisticamente significativa (p < 0,001). I livelli di espressione proteica sono stati quantificati e normalizzati al controllo interno GapDH (Figura 4E). Inoltre, le sospensioni di cellule acinose pancreatiche fresche sono state marcate con annessina V-FITC/PI e analizzate mediante citometria a flusso. È stato riscontrato che, rispetto agli altri gruppi sperimentali di topi, il gruppo PI V aveva un tasso di morte cellulare positivo significativamente più alto, che era statisticamente significativo (p < 0,001) (Figura 4F, G).
Il contenuto di HMGB-1 nel siero periferico e il livello di espressione di HMGB-1 nel tessuto pancreatico
Al fine di studiare la relazione tra la proteina HMGB-1 e il danno pancreatico, sono state eseguite la colorazione immunoistochimica e la quantificazione sui tessuti pancreatici dei topi in ciascun gruppo sperimentale. C'era una differenza statisticamente significativa tra il gruppo sperimentale e quello di controllo (p < 0,001) (Figura 5A, B). L'ELISA è stato utilizzato per misurare i livelli di HMGB-1 nel siero di topi di diversi gruppi sperimentali. I risultati hanno mostrato che, rispetto al gruppo di controllo, i livelli sierici di HMGB-1 erano significativamente più alti in tutti i gruppi sperimentali, con il livello più alto osservato nel gruppo PI V, e la differenza era statisticamente significativa (p < 0,001) (Figura 5C). Inoltre, l'analisi Western blot ha rilevato un'elevata espressione della proteina HMGB-1 nei tessuti pancreatici dei topi in tutti i gruppi sperimentali, con differenze statisticamente significative rispetto al gruppo di controllo (p < 0,001) (Figura 5D,E).
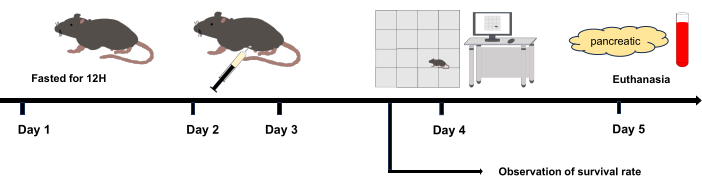
Figura 1: Diagramma di flusso sperimentale. Giorno 2 e Giorno 3: Iniezione intraperitoneale. Giorno 4: L'esperimento in campo aperto è stato avviato dopo 12 ore dall'ultima iniezione intraperitoneale. Giorno 5: Soppressione 36 ore dopo l'iniezione intraperitoneale. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Cambiamenti macroscopici nel modello di topi PI. (A) Viene illustrato il grafico della traiettoria di movimento in tempo reale dei topi. (B) La distanza totale di movimento all'interno di ciascun periodo di monitoraggio per diversi gruppi sperimentali di topi. (C) La percentuale di tempo di immobilità all'interno di ciascun periodo di monitoraggio per diversi gruppi sperimentali di topi. (D,E) La distanza totale di movimento e la percentuale di tempo di immobilità durante 15 minuti sono state analizzate per i topi in diversi gruppi sperimentali. (F) Viene mostrato il valore D che rappresenta il peso dei topi prima e dopo il processo di modellazione. (G) La sopravvivenza di 10 topi in ciascun gruppo è stata osservata per i 7 giorni successivi all'iniezione intraperitoneale. I dati sono espressi come medie ± SEM, n = 4. "ns" indica non significativo, *P < 0,05, ****P < 0,001. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Cambiamenti patologici nella pancreatite dei topi tra diversi gruppi sperimentali. (A) Le sezioni istologiche colorate con H&E del tessuto pancreatico dei topi in diversi gruppi sperimentali (sezioni di tessuto pancreatico incluse in paraffina colorate con ematossilina ed eosina, ingrandimenti di 100 volte e barre di scala di 200 μm e 400 volte e barre di scala di 50 μm, rispettivamente). Le lunghe frecce gialle indicano gli isolotti; le lunghe frecce rosse indicano le cellule acinose; lunghe frecce marroni indicano i vasi sanguigni; le frecce lunghe blu indicano i condotti). (B) Calcolo del rapporto tra il peso pancreatico e il peso corporeo nei topi. (C) Punteggio patologico del pancreas di topo. (D,E) Rilevamento dei livelli sierici di amilasi e lipasi nei topi. (F-G) Misurazione ELISA dei livelli sierici di TNF-α e IL-6 nei topi. (H) Valutazione del livello di PCT. I dati sono espressi come medie ± SEM, n = 4. "ns" indica non significativo, *P < 0,05, ****P < 0,001. Clicca qui per visualizzare una versione più grande di questa figura.
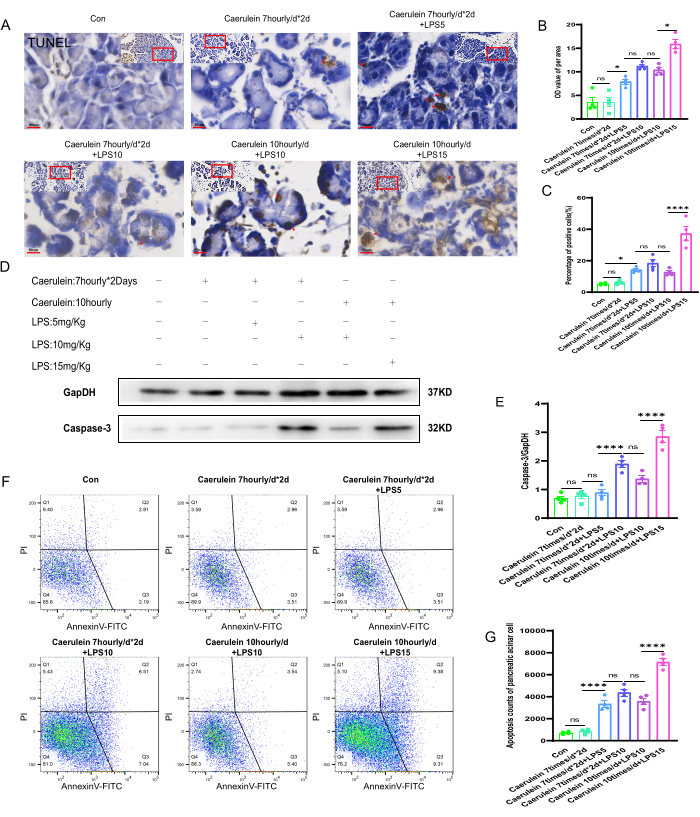
Figura 4: Apoptosi del tessuto pancreatico nei topi. (A) Immagini rappresentative della colorazione TUNEL sono state ottenute da sezioni di paraffina pancreatica di topi e immagini di area ingrandita. (400x, barra della scala 50 μm, il giallo brunastro è costituito da celle positive). (B,C) Analisi quantitativa del valore della scala di grigi per unità di area di sezioni di tessuto pancreatico di topi colorati con TNEL e della percentuale di cellule morte colorate positivamente. (D) Il livello di espressione della Caspasi-3 nel tessuto pancreatico è stato rilevato mediante Western blot. (E) Quantificazione dell'espressione della caspasi-3 nel tessuto pancreatico. (F) La citometria a flusso è stata impiegata per valutare l'entità della morte cellulare nelle cellule acinose pancreatiche dei topi. (G) Enumerazione delle cellule morte in stadio avanzato nelle cellule acinose pancreatiche di topo. I dati sono espressi come medie ± SEM, n = 4. "ns" indica non significativo, *P < 0,05, ****P < 0,001. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: L'espressione di HMGB-1 nel tessuto pancreatico dei topi. (A) Immagini rappresentative e immagini ingrandite (x400, barra della scala 50 μm) della colorazione immunoistochimica di HMGB-1 su sezioni pancreatiche. Il colore giallo-brunastro indica celle positive (n = 4). (B) La percentuale di cellule HMGB-1 positive nelle sezioni di tessuto pancreatico (n = 24). (C) Il livello di HMGB-1 nel siero di topo (n = 4). (D,E) È stato eseguito un Western blot per rilevare il livello di espressione di HMGB-1 nel tessuto pancreatico e per ottenere i risultati della quantificazione (n = 4). I dati sono espressi come medie ± SEM, "ns" indica non significativo, *P < 0,05, ****P < 0,001. Clicca qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1: Lesione multiorgano nel modello di topi del gruppo PI V. (A) Le immagini rappresentative dei cambiamenti istologici nei tessuti del pancreas, del polmone, del fegato e dei reni raccolte dai topi del gruppo CON e PI V sono state analizzate utilizzando la colorazione H&E (ingrandimento 200x, barra della scala 50 μm). Le alterazioni patologiche associate alla necrosi delle cellule acinose sono indicate dalle frecce nere. Le frecce gialle indicano alterazioni patologiche caratterizzate da emorragia interstiziale ed edema negli alveoli. L'edema e la necrosi degli epatociti sono indicati da frecce verdi. Le alterazioni patologiche correlate all'emorragia glomerulare sono contrassegnate da frecce rosse. (B) Il calcolo dei punteggi istologici è stato eseguito su tessuti del pancreas, del polmone, del fegato e dei reni ottenuti dal gruppo CON e dai topi del gruppo PI V. Clicca qui per scaricare questo file.
Tabella supplementare 1: Protocollo di iniezione intraperitoneale. Clicca qui per scaricare questo file.
Tabella supplementare 2: Criteri di punteggio patologico per la gravità della pancreatite. Clicca qui per scaricare questo file.
Discussione
Attualmente, mancano mezzi efficaci per migliorare l'alto tasso di mortalità nei pazienti con pancreatite acuta grave. È fondamentale studiare l'efficacia dei farmaci nel migliorare i meccanismi di stabilità immunitaria. Esiste un urgente bisogno di un modello animale ideale per la pancreatite acuta grave. I topi con un background genetico C57BL/6J sono ampiamente utilizzati nella ricerca biomedica, compresi gli studi sulla fisiopatologia SAP. Oltre 70 anni di differenziazione genetica nei topi B6J hanno portato alla delezione spontanea di diversi esoni15, portando a una ridotta sensibilità al danno pancreatico indotto dalla ceruleina16. Inoltre, i modelli animali esistenti di pancreatite acuta presentano limitazioni come traumi chirurgici o applicabilità solo ad animali più grandi, che ostacolano le indagini scientifiche che utilizzano questi modelli. Pertanto, è molto utile stabilire un modello animale stabile, efficiente e conveniente utilizzando questo specifico ceppo genetico.
La ceruleina è un analogo della colecistochinina che induce il danno del tessuto pancreatico causando l'ostruzione relativa del liquido digestivo pancreatico e la secrezione enzimatica attraverso iniezioni ad alta frequenza entro un breve periodo in cui i topi hanno digiunato e immagazzinato quantità sufficienti di liquido digestivo17. L'LPS è il componente principale che si trova nelle pareti cellulari batteriche e può causare MODS e SIRS nei topi18. Uno studio precedente ha dimostrato che la combinazione di iniezioni di Caeruleina a frequenze diverse con dosi variabili di LPS somministrate tramite iniezione intraperitoneale ha indotto cambiamenti patologici simili osservati nella SAP19,20 umana. Questo studio ha utilizzato un approccio non invasivo per indurre vari gradi di danno pancreatico combinando diverse frequenze di iniezioni di Caeruleina con diverse dosi di LPS somministrate per via intraperitoneale nei topi. Garantire un assorbimento uniforme da parte del peritoneo è stato fondamentale durante lo sviluppo del protocollo. Per soddisfare questo requisito, è fondamentale attenersi rigorosamente alle fasi dell'iniezione intraperitoneale al fine di garantire un controllo preciso su ogni somministrazione di farmaco. Inoltre, uno sfregamento delicato e l'applicazione di una pressione appropriata sul sito di iniezione con un batuffolo di cotone sterile dopo ogni iniezione di farmaco sono essenziali per una distribuzione uniforme del farmaco in tutta la cavità peritoneale. Inoltre, è di fondamentale importanza il posizionamento accurato e preciso della capocchia di spillo nella cavità peritoneale, con l'ago rivolto verso la zona centrale della parte superiore dell'addome. È necessario condurre una formazione preliminare per consentire agli operatori di percepire con precisione l'eventuale assenza di resistenza durante l'inserimento dell'ago nella cavità addominale. L'utilizzo di una pompa per infusione microquantitativa invece del funzionamento manuale potrebbe potenzialmente migliorare la qualità dell'iniezione del farmaco; Sfortunatamente, questo non è stato implementato in questo studio. Tuttavia, impiegando diversi schemi di iniezione, abbiamo indotto vari gradi di danno pancreatico e abbiamo osservato efficacemente differenze nel danno pancreatico causato da diverse frequenze e dosi in condizioni tecniche identiche indotte da Caerulein in combinazione con iniezioni di LPS. Ciò fornisce preziose informazioni per l'uso futuro della caeruleina in modelli animali non invasivi per l'induzione di pancreatite acuta grave.
La combinazione di caeruleina e LPS ha determinato livelli sierici significativamente elevati di amilasi e lipasi, aumento del peso pancreatico e cambiamenti istologici, tra cui un'estesa infiltrazione di cellule infiammatorie, edema a cellule acinose pancreatiche, necrosi ed emorragia, come dimostrato dalla colorazione con ematossilina ed eosina (HE). Inoltre, con l'aumentare della dose di LPS, le alterazioni patologiche nel pancreas sono diventate più pronunciate. Tuttavia, è interessante notare che non ci sono state differenze distinguibili nei punteggi della patologia pancreatica tra i gruppi PI IV e PI V, mentre l'estensione della necrosi delle cellule del tessuto pancreatico era più pronunciata nel gruppo PI III rispetto al gruppo PI IV. Questa osservazione suggerisce che la frequenza di somministrazione di Caeruleina può fungere da fattore primario che contribuisce al danno pancreatico, mentre l'LPS ne esacerba la progressione, portando a danno infiammatorio sistemico18,21. HMGB-1 è una proteina che funziona a seconda della sua posizione22. L'HMGB-1 extracellulare agisce come una proteina coinvolta nei segnali di allarme dell'infiammazione ed è strettamente associata alla gravità della pancreatite acuta 23,24,25. In questo studio, i livelli sierici di HMGB-1 nei topi di tutti i gruppi sperimentali erano significativamente più alti rispetto al gruppo di controllo, con il gruppo PI V che mostrava l'aumento più significativo. Esperimenti di immunoistochimica ed elettroforesi proteica hanno anche confermato l'elevata espressione di HMGB-1 nel tessuto pancreatico. Questa importante proteina può fungere da bersaglio terapeutico per inibire la tempesta infiammatoria nella pancreatite acuta grave.
In sintesi, è fondamentale sviluppare un modello non invasivo, semplice e facile da eseguire di SAP nei topi. In questo protocollo sperimentale, l'induzione del danno pancreatico utilizzando Caeruleina in combinazione con LPS è affidabile ed efficace. Somministrando Caeruleina per via intraperitoneale per dieci giorni consecutivi alla dose di 50 μg/kg, seguita da una singola iniezione intraperitoneale di 15 mg/kg di LPS, è possibile stabilire un modello animale stabile, affidabile, economico ed efficiente di SAP.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo studio è stato sostenuto da Progetti di ricerca in salute e scienze mediche nella città di Huainan (n. HNWJ2023005); Programma di guida municipale per la scienza e la tecnologia nella città di Huainan (n. 2023151); Programma di formazione per l'innovazione e l'imprenditorialità degli studenti dell'Anhui Provincial College (n. S202310361254); Il nono lotto del "50· Stars of Science and Technology" team di innovazione nella città di Huainan e nel progetto di costruzione di specialità cliniche chiave provinciali di Anhui. Vorremmo esprimere la nostra gratitudine al Dipartimento di Laboratorio del Primo Ospedale Affiliato dell'Università di Scienza e Tecnologia di Anhui per aver fornito i dati dei test pertinenti.
Materiali
| Name | Company | Catalog Number | Comments |
| 20× Citric Acid Antigen Repair Solution (pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1202-250 ml | |
| Amylase | Mindray,China | ||
| Annexin V-FITC/PI | Wuhan servicebio Technology Co.,Ltd, China | G1511 | diluted at 1:20 |
| Anti-HMGB1 Rabbit pAB | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1800 |
| BCA protein quantitative detection kit | Wuhan servicebio Technology Co.,Ltd, China | G2026-200T | |
| BD FACSCanto II Flow Cytometer | BD Life Sciences, San Jose, CA, 95131, USA | BD FACSCanto II | |
| BSA | Wuhan servicebio Technology Co.,Ltd, China | GC305010-100g | |
| C57BL/6J | Cavion Experimental Animal Co., Changzhou, China | license number SCXY (Su) 2011–0003 | |
| Ceruletide | MCE, New Jersey, USA | 17650-98-5 | 50 µg/kg |
| Chemiluminescence imager | Cytiva CO.,LTD.;USA | ||
| Citric acid antigen repair Solution (Dry powder pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1201-5 L | |
| Collagenase IV | Wuhan servicebio Technology Co.,Ltd, China | GC305014 | 0.5 mg/mL |
| DAB (SA-HRP) Tunel Cell Apoptosis Detection Kit | Wuhan servicebio Technology Co.,Ltd, China | G1507-100 T | |
| Dimension EXL with LM Integrated Chemistry System | Siemens Healthcare Diagnostics Inc.Brookfield,USA | YZB/USA 8311-2014 | |
| ECL developer | Wuhan servicebio Technology Co.,Ltd, China | ||
| Eosin dye (alcohol soluble) | Wuhan servicebio Technology Co.,Ltd, China | G1001-100 ml | |
| EthoVision XT | Noldus, Netherlands | ||
| FITC-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB22303 | diluted at 1:50 |
| Fully automatic blood cell analyzer | Zybio Inc. China | Zybio-Z3 CRP | |
| GapDH | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1500 |
| Hematoxylin blue return solution | Wuhan servicebio Technology Co.,Ltd, China | G1040-500 ml | |
| Hematoxylin differentiation solution | Wuhan servicebio Technology Co.,Ltd, China | G1039-500 ml | |
| Hematoxylin dye | Wuhan servicebio Technology Co.,Ltd, China | G1004-100 ml | |
| HMGB-1 ELISA kits | njjcbio Co., Ltd, China | ||
| HOMOGENIZER | Wuhan servicebio Technology Co.,Ltd, China | KZ-III-F;IC111150 100222 | |
| HRP-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB23303 | diluted at 1:1500 |
| IL-6 ELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0001 | |
| Lipase | Mindray,China | ||
| Lipopolysaccharide | Wuhan servicebio Technology Co.,Ltd, China | GC205009 | 15 mg/kg |
| Low temperature high speed centrifuge | Changsha Pingfan Apparatus&Instrument Co.,Ltd.,China | TGL-20M | |
| Membrane breaking liquid | Wuhan servicebio Technology Co.,Ltd, China | G1204 | |
| microtome | Jinhua Craftek Instrument Co., Ltd.;China | CR-601ST | |
| Nylon mesh | Wuhan servicebio Technology Co.,Ltd, China | 200-mesh | |
| One-step TUNEL cell apoptosis detection kit (DAB staining method) | Wuhan servicebio Technology Co.,Ltd, China | G1507-100T | |
| Paraffin tissue embedding machine | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PBM-A | |
| Pathological tissue drying apparatus | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PHY-III | |
| Phosphate-buffered saline | Wuhan servicebio Technology Co.,Ltd, China | G4202-100ML | |
| PMSF | Wuhan servicebio Technology Co.,Ltd, China | G2008-1 ml | |
| Positive fluorescence microscope | Olympus Corporation,Tokyo, Japan | BX53 | |
| Pro Calcitonin | Mindray,China | ||
| PVDF membrane | Millipore, USA | 0.22 µm | |
| RIPA | Wuhan servicebio Technology Co.,Ltd, China | G2002-100 ml | |
| SDS-PAGE | Beyotime Biotechnology,China | P0012A | |
| TNF-αELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0004 | |
| Ultrasonic water bath | DONGGUAN KQAO ULTRASONIC EQUIPMENT CO.,LTD.;China | KQ-200KDE | |
| Western Blot | Bio-Rad Laboratories, Inc.,USA | ||
| Western blot imaging System | Global Life Sciences IP Holdco LLC, JAPAN | Amersham ImageQuant 800 | |
| Whirlpool mixer | SCILOGEX;USA |
Riferimenti
- Gliem, N., Ammer-Herrmenau, C., Ellenrieder, V., Neesse, A. Management of severe acute pancreatitis: An update. Digestion. 102 (4), 503-507 (2021).
- Duan, F., et al. GDF11 ameliorates severe acute pancreatitis through modulating macrophage M1 and M2 polarization by targeting the TGFbetaR1/SMAD-2 pathway. Int Immunopharmacol. 108, 108777 (2022).
- Zhang, X. P., et al. Preparation method of an ideal model of multiple organ injury of rat with severe acute pancreatitis. World J Gastroenterol. 13 (34), 4566-4573 (2007).
- Bluth, M. H., Patel, S. A., Dieckgraefe, B. K., Okamoto, H., Zenilman, M. E. Pancreatic regenerating protein (reg I) and reg I receptor mRNA are upregulated in rat pancreas after induction of acute pancreatitis. World J Gastroenterol. 12 (28), 4511-4516 (2006).
- Qiu, F., Lu, X. S., Huang, Y. K. Effect of low molecular weight heparin on pancreatic micro-circulation in severe acute pancreatitis in a rodent model. Chin Med J (Engl). 120 (24), 2260-2263 (2007).
- Lombardi, B., Estes, L. W., Longnecker, D. S. Acute hemorrhagic pancreatitis (massive necrosis) with fat necrosis induced in mice by DL-ethionine fed with a choline-deficient diet. Am J Pathol. 79 (3), 465-480 (1975).
- Liu, Y., et al. Deletion of XIAP reduces the severity of acute pancreatitis via regulation of cell death and nuclear factor-kappaB activity. Cell Death Dis. 8 (3), e2685 (2017).
- Niederau, C., Ferrell, L. D., Grendell, J. H. Caerulein-induced acute necrotizing pancreatitis in mice: Protective effects of proglumide, benzotript, and secretin. Gastroenterology. 88, 1192-1204 (1985).
- Zhou, X., et al. DPP4 inhibitor attenuates severe acute pancreatitis-associated intestinal inflammation via Nrf2 signaling. Oxid Med Cell Longev. 2019, 6181754 (2019).
- Yang, J., et al. Heparin protects severe acute pancreatitis by inhibiting HMGB-1 active secretion from macrophages. Polymers (Basel). 14 (12), 2470 (2022).
- Kong, L., et al. Sitagliptin activates the p62-Keap1-Nrf2 signalling pathway to alleviate oxidative stress and excessive autophagy in severe acute pancreatitis-related acute lung injury. Cell Death Dis. 12 (10), 928 (2021).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Schmidt, J., et al. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 215 (1), 44-56 (1992).
- Luo, C., et al. Abdominal paracentesis drainage attenuates severe acute pancreatitis by enhancing cell apoptosis via PI3K/AKT signaling pathway. Apoptosis. 25 (3-4), 290-303 (2020).
- Fontaine, D. A., Davis, D. B. Attention to background strain is essential for metabolic research: C57BL/6 and the international knockout mouse consortium. Diabetes. 65 (1), 25-33 (2016).
- Wan, J., et al. Pancreas-specific CHRM3 activation causes pancreatitis in mice. JCI Insight. 6 (17), e132585 (2021).
- Sah, R. P., et al. Cerulein-induced chronic pancreatitis does not require intra-acinar activation of trypsinogen in mice. Gastroenterology. 144 (5), 1076-1085 (2013).
- Wang, K., et al. Activation of AMPK ameliorates acute severe pancreatitis by suppressing pancreatic acinar cell necroptosis in obese mice models. Cell Death Discov. 9 (1), 363 (2023).
- Jin, C., Li, J. C. Establishment of a severe acute pancreatitis model in mice induced by combined Rain Frog Peptide and lipopolysaccharide and exploration of its mechanism. Acta Exp Bio Sinica. 36 (2), 91-96 (2003).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Roy, R. V., et al. Pancreatic Ubap2 deletion regulates glucose tolerance, inflammation, and protection from Caerulein-induced pancreatitis. Cancer Lett. 578, 216455 (2023).
- Chen, R., Kang, R., Tang, D. The mechanism of HMGB1 secretion and release. Exp Mol Med. 54 (2), 91-102 (2022).
- Murao, A., Aziz, M., Wang, H., Brenner, M., Wang, P. Release mechanisms of major DAMPs. Apoptosis. 26 (3-4), 152-162 (2021).
- Liu, T., et al. Accuracy of circulating histones in predicting persistent organ failure and mortality in patients with acute pancreatitis. Br J Surg. 104 (9), 1215-1225 (2017).
- Li, N., Wang, B. M., Cai, S., Liu, P. L. The role of serum high mobility Group Box 1 and Interleukin-6 levels in acute pancreatitis: A meta-analysis. J Cell Biochem. 119 (1), 616-624 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon