Method Article
カエルレインとリポ多糖の腹腔内注射の組み合わせによる重症急性膵炎のマウスモデルの準備
* これらの著者は同等に貢献しました
要約
腹腔内薬物投与は、膵臓損傷を誘発するための安全で効果的な非侵襲的アプローチです。この研究では、マウスに対する5つの異なる腹腔内注射プロトコルを比較して、さまざまな程度の膵臓損傷を誘発し、重度の膵臓損傷のモデルを確立して、重度の急性膵炎(SAP)の病理学的変化と治療戦略を調査しました。
要約
死亡率が高い重症急性膵炎(SAP)の治療は、重大な臨床的課題を提起しています。動物モデルを使用してSAPに関連する病理学的変化を調査することは、潜在的な治療標的を特定し、新しい治療アプローチを探求するのに役立ちます。以前の研究では、主にタビアウロコール酸ナトリウムの逆行性胆管注射による膵臓損傷を誘発しましたが、動物モデルの品質に対する外科的損傷の影響は不明のままです。この研究では、C57BL/6Jマウスの膵臓損傷を誘発するために、さまざまな頻度の腹腔内Caerulein注射とさまざまな用量のLPSを組み合わせて使用し、5つの腹腔内注射プロトコル間で損傷の程度を比較しました。マウスの急性膵炎の誘発に関して、腹腔内注射プロトコルが提案されています 5日以内に80%もの死亡率をもたらします。具体的には、マウスにカエルレイン(50μg/kg)を1日10回腹腔内注射し、続いて最後のカエルレイン投与の1時間後にLPS(15mg/kg)を注射しました。注射された薬の頻度と投与量を調整することにより、膵臓損傷の重症度を効果的に操作できます。このモデルは、強力な制御性を示し、複製サイクルが短いため、高価な機器を必要とせずに、1人の研究者で完成させることが可能です。ヒトのSAPで観察される主要な疾患特性を便利かつ正確にシミュレートし、高い再現性を実証します。
概要
重度の急性膵炎は、消化器系疾患領域1内での急速な発症、急速な進行、および高い死亡率を特徴としています。その高い致死率は、常に臨床研究の顕著な焦点でした。臨床状態の予測不可能な変化、疾患症状の不均一性、ヒト検体の入手可能性の制限などにより、動物モデルの確立は疾患研究にとってますます重要になっています。
総胆管へのタウロコール酸ナトリウムの逆行性注射は、SAP2 のラット モデルを作成するために一般的に使用されます。膵胆道閉塞をシミュレートし、胆汁と膵液の逆流を誘発することにより、このモデリング手法は SAP 動物モデルの複製で高い成功率を示します。ただし、侵襲的な手術は動物モデル自体に影響を与えることに注意する必要があります。さらに、この方法は、主に実験対象として使用されるラットやイヌなどの大型動物に限定されています。十二指腸挿管3、直接十二指腸穿刺4、胆管-膵管5の直接穿刺などの代替技術は、モデリング目的で頻繁に利用されます。
腹腔内注射と食事モデリング法は、あらゆるサイズの動物に適用できる非侵襲的な利点を提供します。コリン欠乏エチオニン(CDE)6の摂食によって誘導されるSAPのマウスモデルは、制御が不十分な高血糖や低カルシウム血症などの特定の合併症を呈するため、新しい診断および治療アプローチの評価には適していません。一方、L-アルギニン7と組み合わせたカエルレインの腹腔内注射は、マウスの急性膵炎を誘発するために最も一般的に使用される方法です。具体的には、カエルレイン(コレシストキニン類似体)の腹腔内反復投与は、病因、炎症、再生過程など、この破壊的な疾患に関連するさまざまな側面を調査するための非常に適切なアプローチを提供します。コレシストキニン(CCK)との構造的類似性により、カエルラインは胆嚢の収縮と膵臓の酵素分泌を効果的に刺激し、酵素分泌の不均衡を引き起こし、その後の自己破壊を引き起こします8。リポ多糖(LPS)は、病原体に関連する分子パターン分子として広く研究されており、腹腔内注射によりカエルレインと組み合わせることで、SAPの効果的なマウスモデルを確立することができます。この組み合わせは、かなりの数の炎症性サイトカインを急速に引き起こして放出し、過剰な局所的および全身的な炎症を引き起こします。いくつかの研究で、LPSと組み合わせたCaeruleinの腹腔内注射によるマウスでのSAPモデルの誘導が報告されています。これは、Caeruleinの腹腔内注射がマウスに膵臓浮腫と出血を引き起こす可能性があるという事実に起因する可能性がありますが、LPSの添加はすぐに膵臓壊死を誘発し、全身性炎症反応、敗血症、さらには臓器不全を悪化させる可能性があります。現在、腹腔内カエルレイン注射の投与量と頻度にはばらつきがあり、追加のLPS投与量にも一貫性がありません。.マウスのSAPモデルで一貫性を達成することは困難です9,10,11,12;したがって、理想的なモデルを得るためには、標準化されたプロトコルを確立する必要があります。この記事では、マウスの腹腔内注射のプロトコルについて説明し、LPSの最適な注射頻度と追加投与量を調査します。
プロトコル
このプロトコルは、安徽科技大学 (中国、淮南) の第一付属病院の倫理委員会によって審査され、承認されました (倫理コード: 2023-KY-905-001)。この研究は、すべての動物処置における研究用げっ歯類のケアと使用に関する国立衛生研究所のガイドラインに従っています。本研究では、体重20-30gのC57BL/6J成体マウスを用いた。マウスを動物実験室に1週間、制御された条件(約21°C、12時間の昼夜交互サイクル)で飼育しました。マウスは、全体を通して自由に餌と水にアクセスできました。本試験で使用した試薬および機器の詳細は、 資料表に記載されています。
1.動物の調理
- 健康なC57BL/6Jマウス84匹を、対照群、膵臓損傷(PI)I、PI II、PI III、PI IV、PI Vの6群に割り付けます。
- モデリング手順を開始する前に、マウスの各グループに耳のノッチをラベル付けし、12時間絶食させます。
2. 誘導薬物希釈剤の調製
- カエルレイン(1 mg)をPBS1 mLに溶解し、-20°Cで冷蔵します。
- 薬物の腹腔内注射の1時間前に実験マウスの体重を測定し、記録します。
- 必要なCaeruleinの総質量を、すべてのマウスの総重量に基づいて50μg / kgの比率で抽出します。
- 得られたカエルレイン薬を再びPBSで希釈します。
注:PBS希釈の総量は、すべてのマウスの総重量値の5倍に等しい必要があります。LPS希釈液を得るためにも、同じ希釈法を使用しました。
3.腹腔内注射
注:腹腔内注射は、モデルを誘導するために 、補足表1 に概説されているプロトコルに従ってマウスの各グループに投与されました。さらに10匹のマウスをグループ化して治療し、7日間の生存率を観察しました。
- マウスの腹が上を向くようにマウスをつかんで保持し、シリンジを挿入するときに臓器が損傷しないように、頭を尾よりも低く配置します。
- マウスの腹部をアルコール75%のコットンボールで消毒します。
- 注射器を右手に持ち(≤0.5/≥0.3の針を使用)、腹部の白い線の左側のいずれかの皮下皮膚に針を挿入します。
注:次の注入のために右側に変更してください。 - 針が皮下層に到達したら、針を約3〜5 mm前方に動かし、シリンジ針を45°の角度で腹腔に挿入します。この時点で、多少の抵抗を感じるはずです。
- 針を静止させ、物質をゆっくりと注入します。
注:マウスの体重値の5倍を、1回の腹腔内注射の体積として超えないでください。. - 注射後、針を引き出し、滅菌綿棒で注射部位を優しくマッサージして押し、薬物をマウスの腹腔内に完全に拡散させます。.
- 新しい注射器を使用して、次の実験マウスで繰り返します。
4. オープンフィールド行動能力テスト
注: 最後の腹腔内注射の 12 時間後、マウスの総活動距離と不動時間を評価するために、オープンフィールド行動能力テストを実施しました。
- カメラの真下に4つの同一の白いボックスを配置します。
- ビデオケーブルを使用してカメラをコンピューターに接続します。
- 実験を開始する前に、実験ボックスが清潔で臭いがないことを確認してください。
- 動物をグリッドの中央に配置し、実験者から背を向け、10分間環境に適応させます。
- ビデオトラッキングソフトウェアを起動し、[ ファイル ]メニューをクリックして新しい実験を作成します。
- 4 つの同時視野の監視を設定します。
- リアルタイムモニタリング画面でボックス内を移動できる実験物体の長さと幅(30cm×30cm)をマークします。
- セットアップが完了したら、ビデオ監視と録画を開始します。
- マウスの活動を15分間記録します。
- テスト後、動物をグリッドから取り出し、ケージに戻します。二酸化塩素を含む滅菌剤を使用してグリッドを徹底的に清掃します。
5. マウスの末梢血の採取と検査
- マウスを安楽死させます(制度的に承認されたプロトコルに従います)。
- 腹腔内注射の36時間後に実験マウスで安楽死を行います。安楽死前のマウスの体重を測定して記録します。
注:0.18 mLの10%クロラール水和物を腹腔内に投与し、つま先や尾の刺激に反応しないようにします。. - 左手でマウスを固定し、右手でハサミを持ってマウスの片側のひげをトリミングします。
- 目の周りの皮膚をやさしく押して、眼球のうっ血や突出を誘発します。
- 湾曲した鉗子を使用して眼球をつかみ、すばやく取り除き、末梢血を微量遠心チューブに集めます。
注:2種類の微量遠心チューブが使用され、1つは抗凝固剤を含み、もう1つは含みませんでした。 - 同時に、左手の中指でマウスの心臓部分を軽く押して、心臓のポンピング速度を上げます。
- 腹腔内注射の36時間後に実験マウスで安楽死を行います。安楽死前のマウスの体重を測定して記録します。
- 末梢血を抗凝固剤なしで室温で30分間放置します。
- 自動生化学分析装置を用いて、酵素速度法と酵素循環法(メーカーの指示に従って)により、血清アミラーゼ(Amy)とリパーゼ(Lip)の濃度を測定します。
- 血漿中のプロカルシトニン(PCT)などの炎症性指標のレベルを、市販の化学発光イメージャーを使用した化学発光法で測定します(製造元の指示に従ってください)。
- ELISAキットを使用して、マウス血清中のHMGB-1、IL-6、およびTNF-αレベルを測定します(製造元の指示に従ってください)。
- 全自動血球分析装置を使用して抗凝固剤で処理した末梢血を分析し、関連するパラメータを評価します。
6. 膵臓組織の採取とパラフィン切片の作製
- マウスを仰臥位に置き、発泡スチロールプレートに固定します。
- その領域を剃って消毒し、腹部の中央切開を行い、小腸管を右にひっくり返して膵臓を完全に露出させます。
- 十二指腸と幽門管を切断し、膵臓の下の小腸を見つけます。腸管に沿って膵臓組織を完全に解放します。
- 歯のない鉗子を使用して脾臓を固定し、ゆっくりと上に引っ張ります。
注:膵臓組織に直接触れたり、解離プロセス全体で過度の力を加えたりしないでください。 - 膵臓の後部靭帯組織を膵臓の頭まで鋭く解剖し、胆管と血管を切断します。
- 膵臓組織を取り除き、吸収紙で表面の水分を軽くたたいて乾かし、体重を量って記録します。
- 膵臓組織の半分を4%パラホルムアルデヒドで固定し、残りの半分を-80°Cの冷蔵庫で保存します。
- 以下の手順に従って、膵臓パラフィン切片を準備します。
- 固定した膵臓組織を75%アルコールで洗浄し、約0.5cm×0.5cmのサイズにトリミングします。
- 組織を70%エタノールに20分間、80%エタノールにさらに20分間、90%エタノールに15分間浸します。
- 組織を95%エタノールで毎回15分間2回処理し、次に100%エタノールで毎回5分間2回処理します。
- 組織をキシレン溶液による12分と5分の2回の治療にさらし、透明性を確保します。
- 透明ティッシュをワックスタンクに65°Cで1時間浸します。
- 溶かしたパラフィンに組織を埋め込み、冷まします。スライサー(厚さ:5μm)で膵臓パラフィン切片を取得します。
- 得られたパラフィンスライスを45°Cの水で平らにし、マウントして乾燥させます(ベーキング条件:40°Cで14〜16時間)。
7. ヘマトキシリンおよびエオシン(H&E)染色
- 膵臓パラフィン切片をキシレンIおよびIIに30分間置き、次に無水アルコール、95%、85%、75%アルコールにそれぞれ5分間、超純水に5分間置きます。
- 細胞核をヘマトキシリンで160秒間染色し、流水でゆっくりとすすいでください。
- 塩酸アルコール分化溶液を5〜10秒間塗布し、流水ですばやくすすいでください。
- 切片を無水アルコールで5分間処理します。
- 細胞質をエオシンで30秒間インキュベートし、流水ですすいでください。
- 切片を75%、85%、95%、100%のエタノールにそれぞれ10秒間浸漬し、キシレンで5分間処理して脱水します。
- 最後に、切片を中性樹脂で密封し、顕微鏡で観察します。
- 病理学的スコアリングと標準13.
注:浮腫、腺房壊死、出血、出血および脂肪壊死、炎症性および血管周囲炎症などの指標に基づいて、膵炎の重症度を判断します。以前に公開された実装ガイドラインを使用して、13 を採点します。
8. 免疫組織化学染色
- 膵臓組織のパラフィン包埋切片をキシレンで脱ワックスし、続いてエタノール溶液の勾配でそれらを再水和します。.
- 30分間の膜破裂後、3%H2O2 を使用して20分間内因性酵素ブロッキングを実施する。
- 抗体を5%ウシ血清で室温で30分間ブロックした後、1:1500に希釈したウサギ抗HMGB1を用いて4°Cで一晩インキュベートします。
- 切片をPBSで洗い流し、対応する二次抗体で37°Cで30分間インキュベートします。 その後、DAB発色、ヘマトキシリン対比染色、中性ガムでのシールを行います。
9. 膵臓切片のアポトーシスを検出するためのTUNEL法
- キシレン中の膵臓パラフィン切片を5分間脱ろうし、2回繰り返し、勾配エタノール(100%で5分、90%で2分、70%で2分、蒸留水で2分)で洗浄します。
- パラフィン切片の周囲の余分な液体をPBSで洗い流します。各サンプルを100 μLのプロテイナーゼKで処理し、組織が完全にカバーされるようにします。サンプルを37°Cで20分間インキュベートします。その後、サンプルをPBSに3回、毎回5分間浸します。
注:プロテイナーゼK溶液は、元のプロテイナーゼK(200μg/mL)溶液をPBSで1:9(容量)の比率で希釈することによって調製され、DNaseを除く最終濃度は20μg/mLになりました。プロテイナーゼKの徹底的な洗浄は、その後の標識反応への干渉を避けるために不可欠です。 - 組織に3%H2O2(PBSで希釈)を適量加えて完全に浸潤させ、20分間インキュベートします。ティッシュをPBSで3回、それぞれ5分間すすぎます。
注:パラフィン切片は湿らせておく必要があります。組織内の内因性ペルオキシダーゼを不活性化するためには、3%H2O2によって引き起こされるDNA切断による偽陽性を防ぐために、インキュベーション時間が長すぎないようにする必要があります。 - 試験するサンプルの全領域を50 μLの平衡化バッファーで覆い、10分間インキュベートします。
- できるだけ多くの平衡化バッファーを削除します。次に、56 μLのTdTインキュベーションバッファーを各組織サンプルに加え、1時間(室温)インキュベートします。
注意: スライドを乾燥させず、光にさらされないようにする必要があります。TdTインキュベーションバッファーは、製造元の指示に従って調製しました(組換えTdT酵素:ビオチン-dUTPラベリングミックス:平衡化バッファー= 1 μL:5 μL:50 μL)。 - 組織サンプルはすぐにPBSで洗浄してください。それらをそれぞれ5分間4回すすぎます。サンプルの周りの余分なPBS溶液を濾紙でやさしく取り除きます。
- Streptavidin-HRP反応のために、あらかじめ希釈したStreptavidin-HRP反応液(Streptavidin-HRP:TBST = 1:300)を各組織サンプルに100 μL加えてください。30分間インキュベートします。次に、サンプルをPBSで洗浄し、それぞれ5分間3回すすぎます。
- 各パラフィン切片に50 μLのDABを添加してDAB染色を行います。顕微鏡で染色をリアルタイムで観察します。陽性染色が現れたら、すぐにスライドを湿った箱に入れます。純水で洗って反応を止めます。
- スライドをヘマトキシリン染色溶液に3〜5分間浸し、純水ですすいでください。
- ヘマトキシリン分化溶液で約2秒間分化し、その後すぐに純水ですすいでください。
- ヘマトキシリン再ブルーイング溶液を使用して数秒間青色に着色し、スライドを純水できれいにすすいでください。
注:核染色後は顕微鏡検査を実施してください。染色が濃すぎる場合は、スライドを分化溶液に戻します。染色が薄すぎる場合は、核染色ステップから染色プロセスを再開してください。 - サンプルを4ラウンドの新鮮な無水エタノールでそれぞれ5分間脱水します。次に、ブタノールに5分間、キシレンに5分間浸します。最後に、新鮮なキシレンをさらに5分間使用します。
- 中性ガムを使用してスライドを取り付けます。自然乾燥させるか、60°Cのオーブンで乾燥させます。
- 白色光顕微鏡を用いて組織学的検査を行います。アポトーシス核は茶色に見えます。
- 対応するアポトーシス指数(AI)を計算します。
注意: スライドは二重盲検法で観察してください。TUNEL陽性スライドでは、高倍率(400倍)で5つの陽性領域をランダムに選択し、各領域に少なくとも100個の腺房細胞をカウントして、陽性細胞の割合を決定します。AI = (アポトーシス細胞の総数/細胞の総数) × 100%。
10. フローサイトメトリー
- 新鮮な膵臓組織を入手し、PBSで灌流した後、それらを徹底的に洗浄します。
- 0.5%コラゲナーゼIV消化溶液を調製し、滅菌組織ハサミを使用して膵臓組織を適切に消化します。.
- 膵臓の断片の状態と液体の濁りに応じて5% BSA消化終結液を添加し、混合物を低温で5分間(~300 x g、4°C)遠心分離します。
- 上清を捨てて消化を終了します。
- フェニルメタンスルホニルフッ化物(PMSF)と2.5%ウシ胎児血清細胞懸濁液を含む細胞培養培地を調製して、膵臓細胞を再懸濁します。
- 200メッシュのナイロンメッシュを介して膵臓腺房細胞懸濁液をろ過し、細胞ろ過を通じて細胞懸濁液を取得します。
- 膵臓腺房細胞懸濁液を低温で遠心分離します(ステップ10.3で説明した条件に従ってください)。
- 上清を捨てます。
- 予め冷却したPBSで細胞を洗浄します。
- 遠心再懸濁により、事前に冷却した1x結合バッファーに細胞を穏やかに再懸濁します。
- 細胞濃度を調整した後、製造元の指示に従って、膵臓腺房細胞をAnnexin V-FITC/PIで標識します。
- 1時間以内にフローサイトメトリーを使用して、膵臓腺房細胞のアポトーシスを検出します。
11. カスパーゼ-3およびHMGB-1のウェスタンブロット検出
- 膵臓タンパク質を抽出します。
- 50mgの膵臓組織を抽出し、それを小さな断片に切ります。
- 1 mLのRIPA溶解バッファー(PMSFおよびリン酸化プロテアーゼ阻害剤を含む)を加えます。
- 膵臓組織を氷上で電動グラインダーを使用して5分間均質化します。
- 均質化した組織を氷上で2時間穏やかに振とうしながらインキュベートします。
- ホモジネートを4°Cで10分間、4,500 x gで遠心分離します。
- 上清液を採取し、-80°Cで保存します。
- タンパク質の定量を行います。
- 一定量のBSA標準サンプル(25 mg/mL)を0.5 mg/mLの濃度に希釈します。
- 50容量のBCA溶液Aと1容量のBCA溶液Bを混合することにより、一定量のBCAワーキング溶液を調製し、完全かつ均一に混合します。
- BSA標準サンプルを96ウェルプレート上の標準サンプル穴に0、1、2、4、8、12、16、20 μLの順で入れます。各穴の容量を蒸留水とバランスさせ、合計容量を20 μLにします。
- サンプルホールに2 μLのサンプルを加え、次に18 μLの蒸留水を順次加えて希釈します(1:9)。
- 各ウェルに200 μLのBCAワーキング溶液を充填し、37°Cで約20〜30分間静置します。
- 562nmの波長で吸光度を測定します。サンプルのタンパク質濃度を標準曲線に基づいて計算します。
- 特定の容量のRIPAクラッキング溶液と希釈バッファーを添加して、濃度が適切と考えられる5〜10 μg/μLに達するまでサンプルを希釈します。
- タンパク質変性後(100°C、10分)にサンプルを-20°Cで保存します。
- ウェスタンブロッティングを行います。
- SDS-PAGEの準備をします。
- 糊製造型を取り付け、シール性能を点検します。
- 10%分離接着剤にTEMEDを添加し、均一に混合します。
- 気泡を避けながら、体積の約3分の2を占める混合物を金型に注入します。
- イソプロパノールを型に添加し、接着剤を約40分間押します。
- 同じプログラムを使用して、5%の濃縮接着剤を構成します。
- イソプロパノールを注ぎ、すぐに接着剤を追加します。
- 接着剤が完全に重合するまで、コームを垂直に置きます。
- 電気泳動操作を行います。
- 予想される実験制御順序で試験するサンプルを逆の順序で、SDS-PAGE接着剤のサンプリング穴に追加します。
- 同時にProtein Markを添加して、標的タンパク質と内部参照タンパク質の位置を決定します。
- サンプルの添加が完了したら、サンプルを電気泳動タンクに入れます。
- 最初に、80 Vで30分間泳動し、続いてゲルを泳動して100 Vで60分間タンパク質を分離します。
注:過度の電気泳動を避けるために、ブロモフェノールブルーの位置に注意を払う必要があります。
- タンパク質の転写を行います。
- 右上隅のPVDFフィルムをマークとしてカットします。
- PVDFフィルムをメタノール溶液に5〜10秒間置いて活性化します。
- PVDFフィルムを電気泳動バッファーに約15分間浸します。
- 電気泳動後にゲルを慎重に除去し、余分なゲルをトリミングして、プロセス全体でゲルが濡れたままになるようにします。
- マイナスプレート→スポンジ→3層の濾紙→ゲル→PVDF→フィルム、3層の濾紙→スポンジ→ポジティブプレートの順にスプリントを組み立てます。
注:ゲルとPVDFフィルムの間に気泡がないことを確認してください。 - 組み立てたclを置きますamp 濡れた回転溝(黒から黒)に、その周りに角氷を配置します。
- 電源を入れ、400mAで100分間フィルム移送を開始します。
- PVDFフィルムのシーリング、および一次抗体と二次抗体のインキュベーションを行います。
- 転写後、PVDFフィルムを静かに剥がし、TBSTで10分間すすぎ、このプロセスを3〜5回繰り返します。
- PVDFフィルムを5%スキムミルクで2時間密封します。
- PVDFフィルムをはがし、TBSTで10分間すすぎ、このプロセスを4回繰り返します。
- PVDFフィルムと希釈した一次抗体を一緒に4°Cの冷蔵庫に静かに振とうしながら置き、一晩インキュベートします。
- 翌日PVDFフィルムをはがし、TBSTで10分間すすぎ、このプロセスを4回繰り返します。
- PVDFフィルムをHRP標識二次抗体希釈液で約2時間インキュベートします。
- PVDFフィルムをTBSTで10分間すすぎ、このプロセスを4回繰り返します。
- フィルムを露光して分析します。
- 調製したECL溶液をフィルムに均一に塗布します。
- フィルムを露出計のある暗い部屋に約2〜3分間露光し、保管します。
- image Jソフトウェアを使用して解析を行います。
- SDS-PAGEの準備をします。
結果
マウスモデリングの実験プロセスを図1に示します。注入完了の12時間後、オープンフィールドビデオレコーダーを使用して、マウスのさまざまな実験グループの移動距離と不動時間を5サイクルモニターしました(図2A)。5サイクルの間、PI V群のマウスは3分以内に低いレベルの移動距離を維持しましたが、3分以内の不動率はその後のサイクルごとに増加しました(図2B、C)。さらに、5サイクル間の異なる実験グループのマウスの総移動距離について統計解析を行いました。PI V群は、他の実験群と比較して総移動距離が最も小さく、その差は統計的に有意でした(p < 0.001)(図2D、E)。対照群とPI I群を除いて、他の実験群のマウスはD値の重みがマイナスに成長しました。その中で、PI V群は体重の変化が最も大きく、他の実験群と比較した体重変化の差は統計的に有意でした(図2F)。各実験群でさらに10匹のマウスの生存率を評価した結果、PI V群のマウスの死亡率は5日目に80%に達したことが示された。しかし、他の4つの実験群と対照群のマウスとの間には、死亡率に統計的に有意な差はありませんでした(図2G)。
高倍率顕微鏡を用いて、マウスのPI IV群およびPI V群において、有意な細胞腫脹、壊死、および炎症性細胞浸潤が観察されました(図3A、B)。 補足表2に規定されている評価基準を用いて、マウスの異なる実験群の膵病理を評価し、対照群マウスと比較して膵臓病理スコアの有意差(p < 0.001)を観察した(図3C;補足図1)。また、対照群と比較して、測定マウスの血清アミラーゼおよびリパーゼのレベルは、PI II実験群とPI V実験群で有意に高く、その差は統計的に有意であった。興味深いことに、PI I群マウスには統計的に有意な差はありませんでした(図3D、E)。ELISA法を用いて、マウスの血清中のTNF-αおよびIL-6を含む炎症マーカー14のレベルを評価した。その結果、PI V群マウスのTNF-αおよびIL-6レベルは他の実験グループよりも有意に高く、その差は統計的に有意であることが明らかになりました(図3F、G)。対照群と比較すると、PCTレベルは4つの実験群すべてで増加しましたが、PI V群の差のみが統計的に有意でした(p < 0.05)(図3H)。
マウスの異なる実験グループにおける膵臓組織のアポトーシス状態
マウスの各グループの膵臓組織でTUNEL染色を行うことにより、異なる実験グループの膵臓組織における細胞壊死状態が観察されました(図4A)。膵臓組織切片の単位面積あたりのグレースケール値(OD)と細胞壊死の陽性率を、Image Jソフトウェアを使用して半定量的に分析しました。その結果、PI V群マウスの膵臓組織における細胞壊死のレベルは、他の実験群と比較して有意に増加し、その差は統計的に有意(p < 0.001)であることが示されました(図4B、C)。タンパク質免疫ブロッティング実験を行い、細胞壊死マーカーであるシステインアスパラギン酸特異的プロテイナーゼ-3(Caspase-3)の発現レベルを、さまざまな実験群のマウスの膵臓組織で評価しました(図4D)。カスパーゼ-3の発現を定量したところ、PI V群の膵臓組織におけるカスパーゼ-3タンパク質の発現レベルが有意に増加し、その差は統計的に有意であった(p < 0.001)。タンパク質の発現レベルを定量化し、内部制御のGapDHに正規化しました(図4E)。さらに、新鮮な膵臓腺房細胞懸濁液をAnnexin V-FITC/PIで標識し、フローサイトメトリーで分析しました。マウスの他の実験グループと比較して、PI Vグループは細胞死の陽性率が有意に高く、これは統計的に有意であることがわかりました(p < 0.001)(図4F、G)。
末梢血清中のHMGB-1の含有量と膵臓組織におけるHMGB-1の発現レベル
HMGB-1タンパク質と膵臓損傷との関係を調べるために、各実験群のマウスの膵臓組織に対して免疫組織化学染色と定量を行った。実験群と対照群の間には統計学的に有意な差がありました(p <0.001)(図5A、B)。ELISAは、さまざまな実験グループのマウスの血清中のHMGB-1のレベルを測定するために使用されました。その結果、対照群と比較して、HMGB-1の血清レベルはすべての実験群で有意に高く、PI V群で最も高いレベルが観察され、その差は統計的に有意であった(p < 0.001)ことが示された(図5C)。さらに、ウェスタンブロット分析では、すべての実験群でマウスの膵臓組織におけるHMGB-1タンパク質の発現上昇が検出され、対照群と比較して統計的に有意な差がありました(p < 0.001)(図5D、E)。
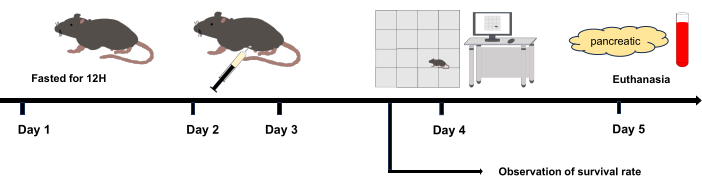
図1:実験フローチャート。 2日目と3日目:腹腔内注射。4日目:オープンフィールド実験は、最後の腹腔内注射の12時間後に開始されました。5日目:腹腔内注射の36時間後に安楽死させました。 この図の拡大版を表示するには、ここをクリックしてください。

図2:PIマウスモデルの巨視的変化 (A)マウスのリアルタイム運動軌跡プロットが示されています。(B)マウスの異なる実験群についての各モニタリング期間内の移動の合計距離。(C)マウスの異なる実験群について、各モニタリング期間内の不動時間の割合。(D,E)15分間の総移動距離と不動時間の割合を、さまざまな実験グループのマウスについて分析しました。(F)モデリング処理前後のマウスの体重を表すD値を示す。(G)腹腔内注射後7日間、各群のマウス10匹の生存が観察された。データは平均±SEM、n = 4で表されます。「ns」は有意ではない、*P < 0.05、****P < 0.001 を示します。 この図の拡大版を表示するには、ここをクリックしてください。

図3:異なる実験群間でのマウス膵炎の病理学的変化 (A)異なる実験群におけるマウス膵臓組織のH&E染色組織切片(ヘマトキシリンおよびエオシンで染色したパラフィン包埋膵組織切片、100倍およびスケールバー200μmの倍率、および400倍およびスケールバー50μmの倍率。黄色の長い矢印は小島を示しています。赤い長い矢印は腺房細胞を示します。茶色の長い矢印は血管を示します。青い長い矢印はダクトを示します)。(B)マウスの膵臓重量と体重の比率の計算。(C)マウス膵臓の病理学的スコアリング。(D,E)マウスの血清アミラーゼおよびリパーゼレベルの検出。(F-G)マウスの血清TNF-αおよびIL-6レベルのELISA測定。(H) PCTレベルの評価。データは平均±SEM、n = 4で表されます。「ns」は有意ではない、*P < 0.05、****P < 0.001 を示します。この図の拡大版を表示するには、ここをクリックしてください。
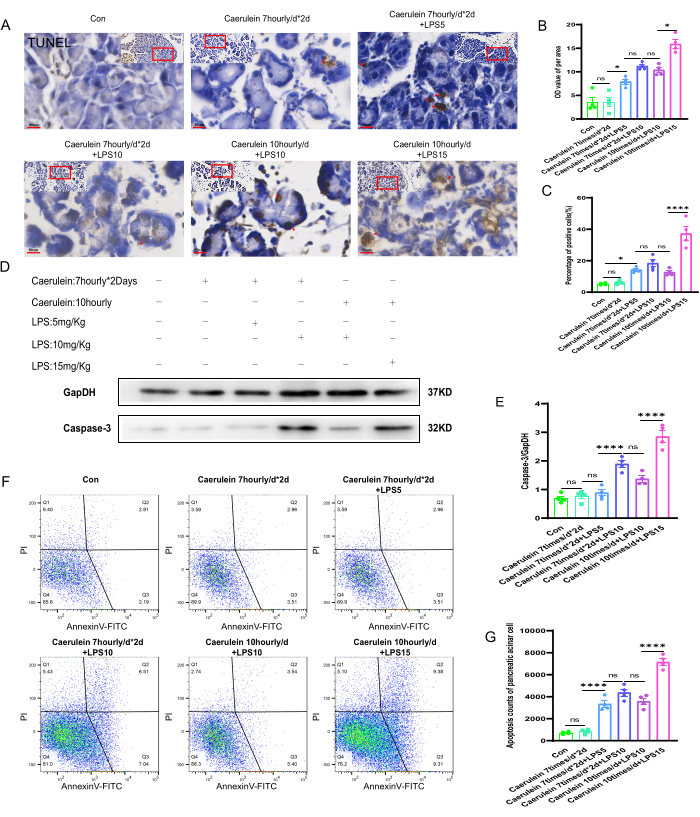
図4:マウスにおける膵臓組織のアポトーシス (A) マウスの膵臓パラフィン切片および拡大領域画像からTUNEL染色の代表的な画像を得た。(400倍、スケールバー50μm、茶色がかった黄色が陽性細胞)。(B,C)マウス膵臓組織のTUNEL染色切片の単位面積当たりのグレースケール値と陽性染色死細胞の割合の定量解析。(D)膵臓組織におけるカスパーゼ-3の発現レベルは、ウェスタンブロットによって検出されました。(E)膵臓組織におけるカスパーゼ-3発現の定量化。(F)フローサイトメトリーを用いて、マウス膵臓腺房細胞における細胞死の程度を評価した。(G)マウス膵臓腺房細胞における後期死細胞の列挙。データは平均±SEM、n = 4で表されます。「ns」は有意ではない、*P < 0.05、****P < 0.001 を示します。 この図の拡大版を表示するには、ここをクリックしてください。

図5:マウス膵臓組織におけるHMGB-1の発現 (A)膵切片上のHMGB-1の免疫組織化学染色の代表画像と拡大画像(x400、スケールバー50μm)。茶色がかった黄色は陽性細胞(n = 4)を示します。(B)膵臓組織切片におけるHMGB-1陽性細胞の割合(n = 24)。(C)マウス血清中のHMGB-1のレベル(n = 4)。(D,E)膵臓組織におけるHMGB-1の発現レベルを検出し、定量結果を得るためにウェスタンブロットを行いました(n = 4)。データはSEM±平均値で表され、「ns」は有意でないことを示します、*P < 0.05、****P < 0.001を示します。 この図の拡大版を表示するには、ここをクリックしてください。
補足図1:PI Vグループマウスモデルにおける多臓器損傷。 (A)CONおよびPI V群マウスから採取した膵臓、肺、肝臓、腎臓組織の組織学的変化の代表的な画像を、H&E染色(倍率200倍、スケールバー50μm)を用いて解析した。腺房細胞壊死に関連する病理学的変化は、黒い矢印で示されています。黄色の矢印は、間質性出血と肺胞の浮腫を特徴とする病理学的変化を示しています。肝細胞浮腫と壊死は緑色の矢印で示されます。糸球体出血に関連する病理学的変化は、赤い矢印でマークされています。(B)組織学的スコアの計算は、CONグループおよびPI Vグループマウスから得られた膵臓、肺、肝臓、および腎臓組織で行われました。 このファイルをダウンロードするには、ここをクリックしてください。
補足表1:腹腔内注射プロトコル。このファイルをダウンロードするには、ここをクリックしてください。
補足表2:膵炎の重症度の病理学的スコアリング基準。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
現在、重度の急性膵炎患者の高い死亡率を改善するための効果的な手段が不足しています。免疫安定性メカニズムの強化における薬剤の有効性を調べることは非常に重要です。重症急性膵炎の理想的な動物モデルが急務となっています。C57BL/6Jの遺伝的背景を持つマウスは、SAPの病態生理学の研究を含む生物医学研究で広く使用されています。B6Jマウスにおける70年以上にわたる遺伝的分化により、いくつかのエクソンが自然に欠失し15、Caerulein誘発性膵臓損傷に対する感受性が低下している16。また、既存の急性膵炎動物モデルには、外科的外傷や大型動物への適用性などの限界があり、これらのモデルを用いた科学的な研究には支障をきたしています。したがって、この特定の遺伝子系統を用いて、安定的で効率的かつ簡便な動物モデルを確立することは非常に価値があります。
カエルレインは、コレシストキニンの類似体であり、マウスが絶食して十分な量の消化液を貯蔵した短時間内に、高周波注射を通じて膵臓消化液および酵素分泌の相対的閉塞を引き起こすことにより、膵臓組織の損傷を誘発する17。LPSは細菌の細胞壁に見られる主成分であり、マウスにMODおよびSIRSを引き起こす可能性があります18。以前の研究では、異なる頻度でのカエルレイン注射と腹腔内注射によるさまざまな用量のLPSを組み合わせると、ヒトのSAPで観察された同様の病理学的変化が引き起こされることが示されました19,20。この研究では、非侵襲的アプローチを使用して、さまざまな頻度のCaerulein注射とマウスに腹腔内投与されたLPSの異なる用量を組み合わせることにより、さまざまな程度の膵臓損傷を誘発しました。腹膜による均一な吸収を確保することは、プロトコール開発において非常に重要でした。この要件を満たすためには、各薬物投与を正確に制御するために、腹腔内注射のステップを厳守することが重要です。さらに、各投薬注射後に滅菌綿棒で注射部位を穏やかにこすり、適切な圧力を加えることは、腹腔全体に薬を均一に分配するために不可欠です。さらに、ピンヘッドを腹腔内に正確かつ精密に配置し、針を上腹部の中央部に向けて配置することが最も重要です。オペレーターが腹腔内に針を挿入する際の抵抗の不在を正確に認識できるように、事前のトレーニングを実施する必要があります。手動操作の代わりに微量輸液ポンプを利用すると、薬物注射の品質が向上する可能性があります。残念ながら、これはこの研究では実施されませんでした。それにもかかわらず、異なる注射スキームを採用することにより、さまざまな程度の膵臓損傷を誘発し、CaeruleinとLPS注射の組み合わせによって誘発される同一の技術的条件下で、異なる周波数と用量によって引き起こされる膵臓損傷の違いを効果的に観察しました。これは、重度の急性膵炎誘発のための非侵襲的動物モデルにおけるカエルレインの将来の使用に関する貴重な洞察を提供します。
カエルレインとLPSの併用により、血清アミラーゼとリパーゼのレベルが有意に上昇し、膵臓の重量が増加し、炎症細胞の広範な浸潤、膵臓腺房細胞の浮腫、壊死、出血などの組織学的変化がもたらされました。これは、ヘマトキシリンとエオシン(HE)の染色で示されています。さらに、LPSの投与量が増加すると、膵臓の病理学的変化がより顕著になりました。しかし、PI IV群とPI V群の間で膵臓の病理スコアに識別可能な差がなかったのに対し、膵臓組織細胞の壊死の程度はPI IV群と比較してPI III群でより顕著であったことは注目に値します。この観察結果は、Caeruleinの投与頻度が膵臓損傷に寄与する主要な要因として役立つ可能性があることを示唆していますが、LPSはその進行を悪化させ、全身性炎症性損傷を引き起こします18,21。HMGB-1は、その位置に応じて機能するタンパク質です22。細胞外HMGB-1は、炎症の警告信号に関与するタンパク質として作用し、急性膵炎の重症度と密接に関連しています23,24,25。本研究では、すべての実験群のマウスの血清HMGB-1レベルは、対照群と比較して有意に高く、PI V群が最も有意な増加を示しました。免疫組織化学的およびタンパク質電気泳動実験でも、膵臓組織におけるHMGB-1の高発現が確認されました。この重要なタンパク質は、重症急性膵炎における炎症性ストームを抑制するための治療標的として役立つ可能性があります。
要約すると、マウスで非侵襲的で、シンプルで、実行が容易なSAPモデルを開発することが重要です。この実験プロトコルでは、CaeruleinとLPSを組み合わせた膵臓損傷の誘発は信頼性が高く効果的です。カエルレインを50μg/kgの用量で10日間連続して腹腔内投与し、その後、15mg/kgのLPSを腹腔内注射を1回行うことで、安定した、信頼性、費用対効果、効率的なSAPの動物モデルを確立することができます。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
本研究は、淮南市の健康・医療科学研究プロジェクト(No.HNWJ2023005);淮南市市市指導科学技術計画プログラム(第2023151号)安徽省省大学の学生のイノベーションと起業家精神のトレーニングプログラム(第S202310361254号)。「50·Stars of Science and Technology」イノベーションチームは、淮南市と安徽省の主要な臨床専門建設プロジェクトにあります。安徽科技大学第一付属病院の検査部に、関連する検査データを提供してくださったことに感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| 20× Citric Acid Antigen Repair Solution (pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1202-250 ml | |
| Amylase | Mindray,China | ||
| Annexin V-FITC/PI | Wuhan servicebio Technology Co.,Ltd, China | G1511 | diluted at 1:20 |
| Anti-HMGB1 Rabbit pAB | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1800 |
| BCA protein quantitative detection kit | Wuhan servicebio Technology Co.,Ltd, China | G2026-200T | |
| BD FACSCanto II Flow Cytometer | BD Life Sciences, San Jose, CA, 95131, USA | BD FACSCanto II | |
| BSA | Wuhan servicebio Technology Co.,Ltd, China | GC305010-100g | |
| C57BL/6J | Cavion Experimental Animal Co., Changzhou, China | license number SCXY (Su) 2011–0003 | |
| Ceruletide | MCE, New Jersey, USA | 17650-98-5 | 50 µg/kg |
| Chemiluminescence imager | Cytiva CO.,LTD.;USA | ||
| Citric acid antigen repair Solution (Dry powder pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1201-5 L | |
| Collagenase IV | Wuhan servicebio Technology Co.,Ltd, China | GC305014 | 0.5 mg/mL |
| DAB (SA-HRP) Tunel Cell Apoptosis Detection Kit | Wuhan servicebio Technology Co.,Ltd, China | G1507-100 T | |
| Dimension EXL with LM Integrated Chemistry System | Siemens Healthcare Diagnostics Inc.Brookfield,USA | YZB/USA 8311-2014 | |
| ECL developer | Wuhan servicebio Technology Co.,Ltd, China | ||
| Eosin dye (alcohol soluble) | Wuhan servicebio Technology Co.,Ltd, China | G1001-100 ml | |
| EthoVision XT | Noldus, Netherlands | ||
| FITC-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB22303 | diluted at 1:50 |
| Fully automatic blood cell analyzer | Zybio Inc. China | Zybio-Z3 CRP | |
| GapDH | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1500 |
| Hematoxylin blue return solution | Wuhan servicebio Technology Co.,Ltd, China | G1040-500 ml | |
| Hematoxylin differentiation solution | Wuhan servicebio Technology Co.,Ltd, China | G1039-500 ml | |
| Hematoxylin dye | Wuhan servicebio Technology Co.,Ltd, China | G1004-100 ml | |
| HMGB-1 ELISA kits | njjcbio Co., Ltd, China | ||
| HOMOGENIZER | Wuhan servicebio Technology Co.,Ltd, China | KZ-III-F;IC111150 100222 | |
| HRP-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB23303 | diluted at 1:1500 |
| IL-6 ELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0001 | |
| Lipase | Mindray,China | ||
| Lipopolysaccharide | Wuhan servicebio Technology Co.,Ltd, China | GC205009 | 15 mg/kg |
| Low temperature high speed centrifuge | Changsha Pingfan Apparatus&Instrument Co.,Ltd.,China | TGL-20M | |
| Membrane breaking liquid | Wuhan servicebio Technology Co.,Ltd, China | G1204 | |
| microtome | Jinhua Craftek Instrument Co., Ltd.;China | CR-601ST | |
| Nylon mesh | Wuhan servicebio Technology Co.,Ltd, China | 200-mesh | |
| One-step TUNEL cell apoptosis detection kit (DAB staining method) | Wuhan servicebio Technology Co.,Ltd, China | G1507-100T | |
| Paraffin tissue embedding machine | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PBM-A | |
| Pathological tissue drying apparatus | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PHY-III | |
| Phosphate-buffered saline | Wuhan servicebio Technology Co.,Ltd, China | G4202-100ML | |
| PMSF | Wuhan servicebio Technology Co.,Ltd, China | G2008-1 ml | |
| Positive fluorescence microscope | Olympus Corporation,Tokyo, Japan | BX53 | |
| Pro Calcitonin | Mindray,China | ||
| PVDF membrane | Millipore, USA | 0.22 µm | |
| RIPA | Wuhan servicebio Technology Co.,Ltd, China | G2002-100 ml | |
| SDS-PAGE | Beyotime Biotechnology,China | P0012A | |
| TNF-αELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0004 | |
| Ultrasonic water bath | DONGGUAN KQAO ULTRASONIC EQUIPMENT CO.,LTD.;China | KQ-200KDE | |
| Western Blot | Bio-Rad Laboratories, Inc.,USA | ||
| Western blot imaging System | Global Life Sciences IP Holdco LLC, JAPAN | Amersham ImageQuant 800 | |
| Whirlpool mixer | SCILOGEX;USA |
参考文献
- Gliem, N., Ammer-Herrmenau, C., Ellenrieder, V., Neesse, A. Management of severe acute pancreatitis: An update. Digestion. 102 (4), 503-507 (2021).
- Duan, F., et al. GDF11 ameliorates severe acute pancreatitis through modulating macrophage M1 and M2 polarization by targeting the TGFbetaR1/SMAD-2 pathway. Int Immunopharmacol. 108, 108777 (2022).
- Zhang, X. P., et al. Preparation method of an ideal model of multiple organ injury of rat with severe acute pancreatitis. World J Gastroenterol. 13 (34), 4566-4573 (2007).
- Bluth, M. H., Patel, S. A., Dieckgraefe, B. K., Okamoto, H., Zenilman, M. E. Pancreatic regenerating protein (reg I) and reg I receptor mRNA are upregulated in rat pancreas after induction of acute pancreatitis. World J Gastroenterol. 12 (28), 4511-4516 (2006).
- Qiu, F., Lu, X. S., Huang, Y. K. Effect of low molecular weight heparin on pancreatic micro-circulation in severe acute pancreatitis in a rodent model. Chin Med J (Engl). 120 (24), 2260-2263 (2007).
- Lombardi, B., Estes, L. W., Longnecker, D. S. Acute hemorrhagic pancreatitis (massive necrosis) with fat necrosis induced in mice by DL-ethionine fed with a choline-deficient diet. Am J Pathol. 79 (3), 465-480 (1975).
- Liu, Y., et al. Deletion of XIAP reduces the severity of acute pancreatitis via regulation of cell death and nuclear factor-kappaB activity. Cell Death Dis. 8 (3), e2685 (2017).
- Niederau, C., Ferrell, L. D., Grendell, J. H. Caerulein-induced acute necrotizing pancreatitis in mice: Protective effects of proglumide, benzotript, and secretin. Gastroenterology. 88, 1192-1204 (1985).
- Zhou, X., et al. DPP4 inhibitor attenuates severe acute pancreatitis-associated intestinal inflammation via Nrf2 signaling. Oxid Med Cell Longev. 2019, 6181754 (2019).
- Yang, J., et al. Heparin protects severe acute pancreatitis by inhibiting HMGB-1 active secretion from macrophages. Polymers (Basel). 14 (12), 2470 (2022).
- Kong, L., et al. Sitagliptin activates the p62-Keap1-Nrf2 signalling pathway to alleviate oxidative stress and excessive autophagy in severe acute pancreatitis-related acute lung injury. Cell Death Dis. 12 (10), 928 (2021).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Schmidt, J., et al. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 215 (1), 44-56 (1992).
- Luo, C., et al. Abdominal paracentesis drainage attenuates severe acute pancreatitis by enhancing cell apoptosis via PI3K/AKT signaling pathway. Apoptosis. 25 (3-4), 290-303 (2020).
- Fontaine, D. A., Davis, D. B. Attention to background strain is essential for metabolic research: C57BL/6 and the international knockout mouse consortium. Diabetes. 65 (1), 25-33 (2016).
- Wan, J., et al. Pancreas-specific CHRM3 activation causes pancreatitis in mice. JCI Insight. 6 (17), e132585 (2021).
- Sah, R. P., et al. Cerulein-induced chronic pancreatitis does not require intra-acinar activation of trypsinogen in mice. Gastroenterology. 144 (5), 1076-1085 (2013).
- Wang, K., et al. Activation of AMPK ameliorates acute severe pancreatitis by suppressing pancreatic acinar cell necroptosis in obese mice models. Cell Death Discov. 9 (1), 363 (2023).
- Jin, C., Li, J. C. Establishment of a severe acute pancreatitis model in mice induced by combined Rain Frog Peptide and lipopolysaccharide and exploration of its mechanism. Acta Exp Bio Sinica. 36 (2), 91-96 (2003).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Roy, R. V., et al. Pancreatic Ubap2 deletion regulates glucose tolerance, inflammation, and protection from Caerulein-induced pancreatitis. Cancer Lett. 578, 216455 (2023).
- Chen, R., Kang, R., Tang, D. The mechanism of HMGB1 secretion and release. Exp Mol Med. 54 (2), 91-102 (2022).
- Murao, A., Aziz, M., Wang, H., Brenner, M., Wang, P. Release mechanisms of major DAMPs. Apoptosis. 26 (3-4), 152-162 (2021).
- Liu, T., et al. Accuracy of circulating histones in predicting persistent organ failure and mortality in patients with acute pancreatitis. Br J Surg. 104 (9), 1215-1225 (2017).
- Li, N., Wang, B. M., Cai, S., Liu, P. L. The role of serum high mobility Group Box 1 and Interleukin-6 levels in acute pancreatitis: A meta-analysis. J Cell Biochem. 119 (1), 616-624 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved