Method Article
הכנת מודל עכברים של דלקת לבלב חריפה חמורה באמצעות שילוב של Caerulein ו Lipopolysaccharide הזרקה intraperitoneal
* These authors contributed equally
In This Article
Summary
מתן תרופות תוך צפקיות הוא גישה לא פולשנית בטוחה ויעילה לגרימת פגיעה בלבלב. מחקר זה השווה חמישה פרוטוקולים שונים של הזרקה תוך צפקית בעכברים כדי לגרום לדרגות שונות של פגיעה בלבלב וקבע מודל של פגיעה חמורה בלבלב כדי לחקור את השינויים הפתולוגיים ואת אסטרטגיות הטיפול בדלקת לבלב חריפה חמורה (SAP).
Abstract
הטיפול בדלקת לבלב חריפה חמורה (SAP), בעלת שיעורי תמותה גבוהים, מהווה אתגר קליני משמעותי. חקירת השינויים הפתולוגיים הקשורים ל-SAP באמצעות מודלים של בעלי חיים יכולה לסייע בזיהוי מטרות טיפוליות פוטנציאליות ובבחינת גישות טיפול חדשניות. מחקרים קודמים גרמו בעיקר לפגיעה בלבלב באמצעות הזרקת צינור מרה מדרדר של נתרן taviaurocholate, אך ההשפעה של נזק כירורגי על איכות המודל החייתי עדיין אינה ברורה. במחקר זה, השתמשנו בתדרים שונים של זריקות Caerulein תוך צפקיות בשילוב עם מינונים שונים של LPS כדי לגרום לפגיעה בלבלב בעכברי C57BL/6J והשווינו את היקף הפגיעה בחמישה פרוטוקולים של הזרקה תוך צפקית. לגבי גרימת דלקת לבלב חריפה בעכברים, מוצע פרוטוקול הזרקה תוך צפקית המביא לשיעור תמותה גבוה עד 80% תוך 5 ימים. באופן ספציפי, עכברים קיבלו עשר זריקות תוך צפקיות יומיות של Caerulein (50 מיקרוגרם / ק"ג), ולאחר מכן זריקה של LPS (15 מ"ג / ק"ג) שעה לאחר מתן Caerulein האחרון. על ידי התאמת התדירות והמינון של תרופות מוזרקות, ניתן לתפעל את חומרת הפגיעה בלבלב ביעילות. מודל זה מפגין יכולת שליטה חזקה ובעל מחזור שכפול קצר, מה שהופך אותו לריאלי להשלמתו על ידי חוקר יחיד ללא צורך בציוד יקר. הוא מדמה בנוחות ובמדויק מאפייני מחלה מרכזיים שנצפו ב- SAP האנושי תוך הפגנת רמה גבוהה של יכולת שחזור.
Introduction
דלקת לבלב חריפה חמורה מאופיינת בהתפרצות מהירה, התקדמות מהירה ושיעורי תמותה גבוהים בתחום מחלות מערכת העיכול1. שיעור התמותה הגבוה שלה תמיד היה מוקד בולט של המחקר הקליני. בשל שינויים בלתי צפויים בתנאים קליניים, הטרוגניות של ביטויי מחלות, וזמינות מוגבלת של דגימות אנושיות, ביסוס מודלים של בעלי חיים הפך חיוני יותר ויותר לחקר מחלות.
הזרקה מדרדרית של נתרן טאורוכולט לתוך צינור המרה הנפוץ משמשת בדרך כלל ליצירת מודל חולדה של SAP2. על ידי הדמיית חסימת לבלב וגרימת רפלוקס של מרה ונוזל הלבלב, טכניקת מידול זו מציגה שיעור הצלחה גבוה בשכפול מודלים של בעלי חיים SAP. עם זאת, יש לציין כי לניתוח פולשני יש השפעה על מודל בעלי החיים עצמו. יתר על כן, שיטה זו מוגבלת לבעלי חיים גדולים יותר, כגון חולדות וכלבים, המשמשים בעיקר כנבדקים ניסיוניים. טכניקות חלופיות, כולל אינטובציה בתריסריון3, ניקוב תריסריון ישיר4 וניקוב ישיר של צינור המרה-צינור לבלב5, משמשות לעתים קרובות למטרות דוגמנות.
הזרקה תוך צפקית ושיטות מידול תזונתי מציעות יתרונות לא פולשניים שניתן ליישם על בעלי חיים בכל גודל. מודל העכבר של SAP המושרה על ידי הזנת אתיונין חסר כולין (CDE)6 מציג סיבוכים מסוימים, כגון היפרגליקמיה והיפוקלצמיה שאינם ניתנים לשליטה, מה שהופך אותו ללא מתאים להערכת גישות אבחון וטיפול חדשות. מצד שני, הזרקה intraperitoneal של Caerulein בשילוב עם L-arginine7 מייצג את השיטה הנפוצה ביותר לגרימת דלקת לבלב חריפה בעכברים. באופן ספציפי, מתן intraperitoneal חוזר של Caerulein - אנלוגי cholecystokinin - מספק גישה מתאימה מאוד לחקר היבטים שונים הקשורים למחלה הרסנית זו, כולל פתוגנזה, דלקת, ותהליכי התחדשות. בשל הדמיון המבני שלו לכולציסטוקינין (CCK), Caerulein מגרה ביעילות התכווצות כיס המרה והפרשת אנזים הלבלב, מה שמוביל לחוסר איזון בהפרשת האנזים ואחריוהרס עצמי 8. Lipopolysaccharide (LPS), להיות בכל מקום נחקר בהרחבה כמולקולת דפוס מולקולרית הקשורים לפתוגן, ניתן לשלב עם Caerulein באמצעות הזרקה intraperitoneal כדי לבסס מודל עכברים יעיל של SAP. שילוב זה מעורר ומשחרר במהירות מספר משמעותי של ציטוקינים דלקתיים, וכתוצאה מכך דלקת מקומית וסיסטמית מוגזמת. מספר מחקרים דיווחו על השראת מודלים של SAP בעכברים באמצעות הזרקה תוך צפקית של Caerulein בשילוב עם LPS. ניתן לייחס זאת לעובדה כי הזרקה intraperitoneal של Caerulein יכול לגרום בצקת הלבלב ודימום בעכברים, בעוד תוספת של LPS יכול מיד לגרום נמק הלבלב להחמיר תגובה דלקתית מערכתית, אלח דם ואפילו אי ספיקת איברים. נכון לעכשיו, קיימת שונות במינון ובתדירות של זריקות Caerulein intraperitoneal, כמו גם חוסר עקביות במינון LPS נוסף. השגת עקביות במודלים של SAP עכבר היא מאתגרת 9,10,11,12; לכן, יש צורך לקבוע פרוטוקול סטנדרטי להשגת מודל אידיאלי. במאמר זה נתאר פרוטוקול להזרקה תוך צפקית בעכברים ונחקור את תדירות ההזרקה האופטימלית ואת המינון הנוסף של LPS.
Protocol
פרוטוקול זה נבדק ואושר על ידי ועדת האתיקה בבית החולים המסונף הראשון של אוניברסיטת אנחווי למדע וטכנולוגיה (Huainan, סין) (קוד אתיקה: 2023-KY-905-001). המחקר פעל בהתאם להנחיות המכונים הלאומיים לבריאות לטיפול ושימוש במכרסמים מחקריים בכל ההליכים בבעלי חיים. במחקר הנוכחי נעשה שימוש בעכברים בוגרים C57BL/6J במשקל 20-30 גרם. העכברים שוכנו במעבדת בעלי חיים במשך שבוע בתנאים מבוקרים (כ-21 מעלות צלזיוס עם מחזור יום-לילה לסירוגין של 12 שעות). לעכברים הייתה גישה למזון ומים לאורך כל הדרך. פרטי הריאגנטים והציוד ששימשו במחקר מפורטים בטבלת החומרים.
1. הכנת בעלי חיים
- הקצו 84 עכברי C57BL/6J בריאים לשש קבוצות, כולל קבוצת הביקורת, פגיעה בלבלב (PI) I, PI II, PI III, PI IV ו-PI V.
- לפני תחילת הליך הדוגמנות, תייגו כל קבוצת עכברים עם חריצים באוזן ואפשרו להם לצום במשך 12 שעות.
2. הכנת מדלל סמים המושרה
- ממיסים את Caerulein (1 מ"ג) לתוך 1 מ"ל של PBS ומקררים ב -20 ° C.
- למדוד ולרשום את המשקל של עכברי הניסוי 1 שעות לפני הזרקת intraperitoneal של התרופה.
- לחלץ את המסה הכוללת של Caerulein נדרש ביחס של 50 מיקרוגרם / ק"ג, בהתבסס על המשקל הכולל של כל העכברים.
- לדלל את התרופה Caerulein שהושגה עם PBS שוב.
הערה: הנפח הכולל של דילול PBS צריך להיות שווה ערך פי 5 מערך המשקל הכולל של כל העכברים. אותה שיטת דילול שימשה להשגת מדלל LPS.
3. הזרקה intraperitoneal
הערה: זריקות תוך צפקיות ניתנו לכל קבוצת עכברים בהתאם לפרוטוקול המתואר בטבלה משלימה 1 לזירוז המודל. 10 עכברים נוספים קובצו וטופלו בשיעורי ההישרדות של 7 ימים.
- תפסו והחזיקו את העכברים באופן שבטן העכברים פונה כלפי מעלה והראש ממוקם נמוך יותר מהזנב כדי למנוע נזק לאיברים בעת החדרת המזרק.
- יש לחטא את בטן העכברים באמצעות כדורי צמר גפן עם 75% אלכוהול.
- החזיקו את המזרק ביד ימין (באמצעות מחט בגודל ≤0.5/≥0.3) והכניסו את המחט לעור התת עורי משני צדי הקו הלבן השמאלי של הבטן.
הערה: שנה לצד ימין עבור הזריקה הבאה. - לאחר שהמחט הגיעה לשכבה התת עורית, הזיזו אותה קדימה כ-3-5 מ"מ, ולאחר מכן הכניסו את מחט המזרק לחלל הבטן בזווית של 45 מעלות. בשלב זה, אדם צריך להרגיש התנגדות מסוימת.
- שמור על המחט נייחת והזריק את החומר לאט.
הערה: אין לחרוג מערך המשקל של העכברים פי 5 מנפח הזריקה התוך-צפקית היחידה. - לאחר ההזרקה, שלפו את המחט ועסו בעדינות ולחצו על מקום ההזרקה עם צמר גפן סטרילי כדי לפזר את התרופה במלואה לתוך חלל הבטן של העכברים.
- השתמש מזרק חדש כדי לחזור עם עכברי הניסוי הבא.
4. בדיקת יכולת התנהגותית בשדה פתוח
הערה: 12 שעות לאחר ההזרקה התוך-צפקית האחרונה, נערכה בדיקת יכולת התנהגותית בשדה פתוח כדי להעריך את מרחק הפעילות הכולל וזמן חוסר התנועה של העכברים.
- הניחו ארבע קופסאות לבנות זהות ישירות מתחת למצלמה.
- חבר את המצלמה למחשב באמצעות כבל וידאו.
- ודא שקופסת הניסוי נקייה ונטולת ריחות לפני תחילת הניסוי.
- מקמו את בעל החיים במרכז הרשת, עם הפנים הרחק מהנסיין, ואפשרו לו להסתגל לסביבה למשך 10 דקות.
- הפעל את תוכנת מעקב הווידאו ולחץ על קובץ בתפריט כדי ליצור ניסוי חדש.
- הגדר את הניטור עבור ארבעה שדות ראייה בו-זמנית.
- סמן את אורכו ורוחבו של אובייקט הניסוי שיכול לנוע בתוך הקופסה במסך הניטור בזמן אמת (30 ס"מ × 30 ס"מ).
- לאחר השלמת ההגדרה, התחל מעקב וידאו והקלטה.
- תעד את פעילות העכברים במשך 15 דקות.
- לאחר הבדיקה, הוציאו את בעל החיים מהרשת והחזירו אותו לכלוב שלו. נקו היטב את הרשת באמצעות חומר מעקר המכיל כלור דו חמצני.
5. איסוף ובדיקת הדם ההיקפי של עכברים
- הרדימו את העכברים (בהתאם לפרוטוקול שאושר על ידי המוסד).
- בצע המתת חסד על עכברי הניסוי 36 שעות לאחר הזרקת intraperitoneal. למדוד ולתעד את משקל הגוף של העכברים לפני המתת חסד.
הערה: יש לתת 0.18 מ"ל של 10% כלורל הידרט תוך צפקי, כדי להבטיח שאין תגובה לגירוי של הבוהן או הזנב. - ביד שמאל אבטחו את העכברים, וביד ימין אחזו במספריים כדי לקצץ את השפם בצד אחד של העכברים.
- לחץ בעדינות על העור סביב העין כדי לגרום לגודש ובליטה של גלגל העין.
- השתמש במלקחיים מעוקלים כדי לתפוס את גלגל העין ולהסיר אותו במהירות, איסוף דם היקפי בצינור מיקרוצנטריפוגה.
הערה: נעשה שימוש בשני סוגים שונים של צינורות מיקרוצנטריפוגה, האחד מכיל נוגד קרישה והשני ללא. - במקביל, לחץ קלות על אזור הלב של העכברים עם האצבע האמצעית של יד שמאל כדי להגביר את מהירות השאיבה של הלב.
- בצע המתת חסד על עכברי הניסוי 36 שעות לאחר הזרקת intraperitoneal. למדוד ולתעד את משקל הגוף של העכברים לפני המתת חסד.
- השאירו את הדם ההיקפי ללא נוגדי קרישה בטמפרטורת החדר למשך 30 דקות.
- יש למדוד את ריכוזי העמילאז בסרום (איימי) והליפאז (שפתיים) באמצעות מנתח ביוכימי אוטומטי בשיטת קצב האנזימים ובשיטת זרימת האנזימים (בהתאם להוראות היצרן).
- לקבוע את רמות המדדים הדלקתיים כגון Pro Calcitonin (PCT) בפלזמה באמצעות שיטת chemiluminescence באמצעות imager chemiluminescence מסחרי (בהתאם להוראות היצרן).
- השתמש בערכות ELISA כדי למדוד את רמות HMGB-1, IL-6 ו- TNF-α בסרום עכברים (בהתאם להוראות היצרן).
- לנתח את הדם ההיקפי שטופל בנוגדי קרישה באמצעות מנתח תאי דם אוטומטי לחלוטין כדי להעריך את הפרמטרים הרלוונטיים.
6. איסוף רקמת הלבלב והכנת קטע פרפין
- הניחו את העכברים במצב שכיבה ואבטחו אותם על צלחת קצף.
- יש לגלח ולחטא את האזור, ולאחר מכן לבצע חתך חציוני בבטן ולהפוך את צינור המעי הדק ימינה כדי לחשוף את הלבלב במלואו.
- נתקו את התריסריון ואת הצינור הפילורי ואתרו את המעי הדק מתחת ללבלב. שחרר לחלוטין את רקמת הלבלב לאורך צינור המעי.
- השתמש במלקחיים חסרי שיניים כדי להדק את הטחול ולמשוך בעדינות כלפי מעלה.
הערה: אין לגעת ישירות ברקמת הלבלב, ולהימנע משימוש בכוח מופרז במהלך כל תהליך הדיסוציאציה. - נתחו בחדות את רקמת רצועת הלבלב האחורית עד לראש הלבלב ונתק את צינור המרה וכלי הדם.
- מוציאים את רקמת הלבלב, מייבשים בטפיחות קלות את לחות פני השטח עם נייר סופג, שוקלים ורושמים.
- תקן מחצית מרקמת הלבלב עם 4% paraformaldehyde ואחסן את החצי השני במקרר ב -80 ° C.
- הכינו את חלקי פרפין הלבלב לפי השלבים הבאים.
- נקו את רקמת הלבלב הקבועה עם 75% אלכוהול וקצצו אותה לגודל של כ-0.5 ס"מ ×-0.5 ס"מ.
- טבלו את הרקמה באתנול 70% למשך 20 דקות, 80% אתנול למשך 20 דקות נוספות ו-90% אתנול למשך 15 דקות.
- טפל ברקמה פעמיים עם 95% אתנול במשך 15 דקות בכל פעם ולאחר מכן פעמיים עם 100% אתנול במשך 5 דקות בכל פעם.
- יש להעביר את הרקמה לשני סבבים של טיפולים של 12 דקות ו-5 דקות עם תמיסת קסילן לשקיפות.
- השרו את הרקמה השקופה במיכל שעווה בטמפרטורה של 65°C למשך שעה אחת.
- הטמיעו את הרקמה בפרפין מומס ואפשרו לה להתקרר. להשיג קטעי פרפין הלבלב עם פרוסה (עובי: 5 מיקרומטר).
- משטחים את פרוסות הפרפין המתקבלות במים של 45°C, מרכיבים אותן ומייבשים אותן (תנאי אפייה: 40°C למשך 14-16 שעות).
7. צביעת המטוקסילין ואוזין (H&E)
- מניחים את חלקי הפרפין בלבלב בקסילן I ו- II למשך 30 דקות, ולאחר מכן בנטול מים, 95%, 85% ו- 75% אלכוהול למשך 5 דקות כל אחד, ומים טהורים במיוחד למשך 5 דקות.
- מכתימים את גרעין התא עם hematoxylin במשך 160 שניות, ולאחר מכן לשטוף עם מים זורמים לאט.
- יש למרוח תמיסת התמיינות חומצה הידרוכלורית למשך 5-10 שניות, ולאחר מכן לשטוף במים זורמים במהירות.
- לטפל בחלקים עם אלכוהול נטול מים במשך 5 דקות.
- לדגור את הציטופלסמה עם eosin במשך 30 שניות, ולאחר מכן לשטוף עם מים זורמים.
- לטבול את החלקים 75%, 85%, 95%, ו 100% אתנול במשך 10 s כל אחד, ולאחר מכן לטפל עם xylene במשך 5 דקות כדי להתייבש.
- לבסוף, לאטום את החלקים עם שרף נייטרלי ולהתבונן תחת מיקרוסקופ.
- בצע את הניקוד הפתולוגי ואת הסטנדרטים13.
הערה: לקבוע את חומרת הלבלב בהתבסס על אינדיקטורים כגון בצקת, נמק acinar, דימום, דימום נמק שומן, דלקת דלקתית ו perivascular. השתמש בהנחיות היישום שפורסמו בעבר לקבלת ניקוד13.
8. צביעה אימונוהיסטוכימית
- Dewax חלקים משובצים פרפין של רקמת הלבלב ב xylene ולאחר מכן rehydate אותם בשיפוע של פתרונות אתנול.
- בצע חסימת אנזימים אנדוגנית באמצעות 3% H2O2 למשך 20 דקות לאחר קרע של 30 דקות בממברנה.
- יש לחסום את הנוגדן עם סרום בקר 5% בטמפרטורת החדר למשך 30 דקות, ולאחר מכן לדגור למשך הלילה בטמפרטורה של 4°C עם דילול של ארנב 1:1500 נגד HMGB1.
- שטפו את המקטעים עם PBS, ולאחר מכן דגרו אותם בנוגדנים משניים מתאימים למשך 30 דקות ב-37°C. לאחר מכן, לבצע פיתוח צבע DAB, hematoxylin counterstaining, ולאטום עם מסטיק נייטרלי.
9. שיטת טונל לגילוי אפופטוזיס במקטעי הלבלב
- מעלים את חלקי הפרפין של הלבלב בקסילן למשך 5 דקות, חוזרים על הפעולה פעמיים ושוטפים באתנול הדרגתי (100% למשך 5 דקות, 90% למשך 2 דקות, 70% למשך 2 דקות ומים מזוקקים למשך 2 דקות).
- יש לשטוף את עודפי הנוזלים המקיפים את חלקי הפרפין באמצעות PBS. טפל בכל דגימה עם 100 μL של פרוטאינאז K, הבטחת כיסוי מלא של הרקמה. לדגור את הדגימות ב 37 ° C במשך 20 דקות. לאחר מכן, השרו את הדגימות ב-PBS 3 פעמים, בכל פעם למשך 5 דקות.
הערה: תמיסת Proteinase K הוכנה על ידי דילול תמיסת Proteinase K המקורית (200 מיקרוגרם/מ"ל) עם PBS ביחס של 1:9 (נפח), וכתוצאה מכך ריכוז סופי של 20 מיקרוגרם/מ"ל, לא כולל DNase. שטיפה יסודית של Proteinase K חיונית כדי למנוע הפרעה לתגובות התיוג הבאות. - הוסיפו כמות מתאימה של 3% H2O2 (מדולל על ידי PBS) לרקמה כדי לחדור אליה במלואה ולדגור במשך 20 דקות. שטפו את הרקמה עם PBS 3 פעמים במשך 5 דקות כל אחת.
הערה: יש לשמור על לחות חלקי הפרפין. כדי להשבית את peroxidases אנדוגניים ברקמה, זמן הדגירה לא צריך להיות ארוך מדי כדי למנוע תוצאות חיוביות כוזבות עקב שבירת DNA הנגרמת על ידי 3% H2O2. - כסו את כל שטח הדגימה לבדיקה עם 50 μL של חיץ שיווי משקל ודגרו במשך 10 דקות.
- הסר מאגר שיווי משקל רב ככל האפשר. לאחר מכן, הוסף 56 μL של מאגר הדגירה TdT לכל דגימת רקמה ודגור במשך שעה אחת (בטמפרטורת החדר).
הערה: אין לאפשר למגלשה להתייבש ויש להימנע מחשיפה לאור. חיץ הדגירה TdT הוכן בהתאם להוראות היצרן (אנזים TdT רקומביננטי: Biotin-dUTP Labeling Mix: Equilibration Buffer = 1 μL: 5 μL: 50 μL). - שטפו מיד את דגימות הרקמה עם PBS. שטפו אותם 4 פעמים במשך 5 דקות כל אחד. הסר בעדינות כל תמיסת PBS עודפת סביב הדגימות באמצעות נייר סינון.
- הוסף 100 μL של תמיסת תגובת Streptavidin-HRP שדוללה בעבר (Streptavidin-HRP: TBST = 1: 300) לכל דגימת רקמה עבור תגובת Streptavidin-HRP. דוגרים במשך 30 דקות. לאחר מכן, שטפו את הדגימות עם PBS ושטפו אותן 3 פעמים במשך 5 דקות כל אחת.
- בצע צביעת DAB על ידי הוספת 50 μL של DAB לכל קטע פרפין. צפו בכתמים תחת מיקרוסקופ בזמן אמת. לאחר הופעת כתמים חיוביים, הניחו מיד את השקופיות בתיבה לחה. עצור את התגובה על ידי שטיפתו במים טהורים.
- יש לטבול את המגלשות בתמיסת צביעת המטוקסילין למשך 3-5 דקות, ולאחר מכן לשטוף במים טהורים.
- להבדיל בתמיסת התמיינות hematoxylin במשך כ 2 שניות, ולאחר מכן שטיפה מיידית עם מים טהורים.
- השיגו צבע כחול באמצעות תמיסת המטוקסילין למשך מספר שניות, ושטפו את המגלשות במים טהורים.
הערה: יש לבצע בדיקה מיקרוסקופית לאחר צביעה גרעינית. אם הכתמים כהים מדי, החזירו את השקופיות לפתרון הבידול. אם הצביעה קלה מדי, הפעל מחדש את תהליך הצביעה משלב הצביעה הגרעינית. - יש לייבש את הדגימות עם 4 סיבובים של אתנול נטול מים טרי למשך 5 דקות כל אחד. לאחר מכן, משרים אותם בבוטנול למשך 5 דקות ובקסילן למשך 5 דקות. לבסוף, השתמשו בקסילן טרי למשך 5 דקות נוספות.
- הרכיבו את המגלשות באמצעות מסטיק נייטרלי. הניחו להם להתייבש באוויר באופן טבעי או ייבשו אותם בתנור בטמפרטורה של 60°C.
- לבצע בדיקה היסטולוגית באמצעות מיקרוסקופ אור לבן. גרעינים אפופטוטיים ייראו חומים.
- חישוב האינדקס האפופטוטי המתאים (AI).
הערה: התבונן בשקופיות באופן כפול סמיות. בשקופיות חיוביות TUNEL, בחר באופן אקראי 5 אזורים חיוביים תחת הגדלה גבוהה (400x), וספור לפחות 100 תאים אצינאריים בכל אזור כדי לקבוע את אחוז התאים החיוביים. AI = (המספר הכולל של תאים אפופטוטיים / המספר הכולל של תאים) × 100%.
10. ציטומטריית זרימה
- להשיג רקמות לבלב טרי לשטוף אותם ביסודיות לאחר מבלבל עם PBS.
- הכינו תמיסת עיכול 0.5% collagenase IV והשתמשו במספריים סטריליים לרקמות כדי לעכל כראוי את רקמות הלבלב.
- הוסף תמיסת סיום עיכול של 5% BSA בהתאם למצב שברי הלבלב ועכירות הנוזל, וצנטריפוגה את התערובת בטמפרטורה נמוכה למשך 5 דקות (~ 300 x גרם, 4 ° C).
- השליכו את הסופרנאטנט כדי לסיים את העיכול.
- הכינו מדיום תרבית תאים המכיל פניל מתאן סולפוניל פלואוריד (PMSF) ותרחיף תאי סרום בקר עוברי 2.5% כדי להשעות מחדש את תאי הלבלב.
- סנן את מתלי תאי הלבלב דרך רשת ניילון של 200 רשת כדי לקבל מתלי תאים באמצעות סינון תאים.
- צנטריפוגה את תרחיף תאי הלבלב בטמפרטורה נמוכה (בצע את התנאים כאמור בשלב 10.3).
- השליכו את הסופרנטנט.
- שטפו את התאים עם PBS מקורר מראש.
- השהה מחדש בעדינות את התאים במאגר קשירה 1x מקורר מראש דרך מתלה צנטריפוגלי.
- יש לסמן את תאי הלבלב עם Annexin V-FITC/PI בהתאם להוראות היצרן לאחר התאמת ריכוז התא.
- השתמש cytometry זרימה בתוך 1 שעה כדי לזהות אפופטוזיס בתאי acinar הלבלב.
11. זיהוי כתמים מערביים של קספאז-3 ו-HMGB-1
- חלצו את חלבון הלבלב.
- לחלץ 50 מ"ג של רקמת הלבלב לחתוך אותו לשברים קטנים.
- הוסף 1 מ"ל של חיץ RIPA lysis (המכיל PMSF ומעכב פרוטאז זרחני).
- הומוגניזציה של רקמת הלבלב על קרח במשך 5 דקות באמצעות מטחנה חשמלית.
- לדגור על הרקמה ההומוגנית על קרח עם רעד עדין במשך 2 שעות.
- צנטריפוגה הומוגנט ב 4 ° C במשך 10 דקות ב 4,500 x גרם.
- אספו את תמיסת הסופרנאטנט ואחסנו אותה בטמפרטורה של -80°C.
- בצע כימות חלבון.
- יש לדלל נפח מסוים של דגימה סטנדרטית BSA (25 מ"ג/מ"ל) לריכוז של 0.5 מ"ג/מ"ל.
- הכן כמות ספציפית של פתרון עבודה BCA על ידי ערבוב 50 נפחים של תמיסת BCA A עם נפח אחד של BCA פתרון B, הבטחת ערבוב יסודי ואחיד.
- מקם את הדגימה הסטנדרטית של BSA לתוך חורי הדגימה הסטנדרטיים על צלחת של 96 בארות בסדר גודל של 0, 1, 2, 4, 8, 12, 16 ו- 20 μL. אזן את נפח כל חור עם מים מזוקקים, והתוצאה היא נפח כולל של 20 μL.
- הוסף 2 μL של דגימות לתוך חורי הדגימה, ולאחר מכן להוסיף ברצף 18 μL של מים מזוקקים לדילול (1: 9).
- מלא כל באר עם 200 μL של פתרון עבודה BCA ולאפשר לו לעמוד על 37 ° C במשך כ 20-30 דקות.
- מדוד את הבליעה באורך גל של 562 ננומטר. חשב את ריכוז החלבון של הדגימות בהתבסס על העקומה הסטנדרטית.
- הוסף נפח מסוים של תמיסת פיצוח RIPA ומאגר דילול כדי לדלל את הדגימות עד שהריכוז מגיע ל 5-10 מיקרוגרם / μL, אשר נחשב מתאים.
- אחסנו את הדגימות בטמפרטורה של -20°C לאחר דנטורציה של חלבון (100°C; 10 דקות).
- בצע את הכתם המערבי.
- בצע הכנות ל- SDS-PAGE.
- התקינו את התבניות לייצור דבק ובדקו את ביצועי האיטום שלהן.
- מוסיפים TEMED לדבק הפרדה של 10% ומערבבים באופן שווה.
- הזריקו את התערובת לתבנית, המהווה כשני שלישים מהנפח, תוך הימנעות מבועות.
- מוסיפים איזופרופנול לתבנית ולוחצים על הדבק כ-40 דקות.
- השתמש באותה תוכנית כדי להגדיר דבק מרוכז 5%.
- יוצקים החוצה איזופרופנול ומוסיפים את הדבק מיד.
- מניחים את המסרק במאונך עד שהדבק מתפלמר לחלוטין.
- בצע את פעולת האלקטרופורזה.
- הוסף את הדגימה שתיבדק בסדר הבקרה הניסויי הצפוי, בסדר הפוך, לתוך חורי הדגימה של דבק SDS-PAGE.
- הוסף בו זמנית את סימן החלבון כדי לקבוע את המיקום של חלבון המטרה וחלבון הייחוס הפנימי.
- הניחו את הדגימה במיכל האלקטרופורזה לאחר השלמת הוספת הדגימה.
- בתחילה, לרוץ ב 80 V במשך 30 דקות, ולאחר מכן להפעיל את הג'ל כדי להפריד את החלבון ב 100 V במשך 60 דקות.
הערה: יש לשים לב למיקום של ברומופנול כחול כדי למנוע אלקטרופורזה מוגזמת.
- בצע את העברת החלבון.
- גזור את סרט PVDF בפינה הימנית העליונה כדי לשמש סימן.
- הניחו את סרט ה-PVDF בתמיסת מתנול להפעלה של 5-10 שניות.
- השרו את סרט ה-PVDF במאגר אלקטרופורזה למשך כ-15 דקות.
- הסר בזהירות את הג'ל לאחר אלקטרופורזה וחתוך את עודפי הג'ל, כדי להבטיח שהג'ל יישאר רטוב לאורך כל התהליך.
- הרכיבו את הסד בסדר הבא: צלחת שלילית → ספוג → שלוש שכבות של נייר סינון → ג'ל → סרט PVDF → שלוש שכבות של נייר סינון → ספוג → צלחת חיובית.
הערה: ודא שאין בועות בין הג'ל לסרט PVDF. - מניחים את המהדק המורכב בחריץ המסתובב הרטוב (שחור עד שחור) עם קוביות קרח הממוקמות סביבו.
- הפעל את החשמל והתחל את העברת הסרט ב- 400 mA למשך 100 דקות.
- ביצוע איטום סרט PVDF, ודגירה של נוגדנים ראשוניים ומשניים.
- הסירו בעדינות את סרט ה-PVDF לאחר ההעברה ושטפו ב-TBST במשך 10 דקות, תוך חזרה על התהליך 3-5 פעמים.
- אטמו את יריעת ה-PVDF בחלב רזה 5% למשך שעתיים.
- הסירו את סרט ה-PVDF ושטפו ב-TBST במשך 10 דקות, חזרו על התהליך 4 פעמים.
- הניחו את יריעת ה-PVDF והנוגדן הראשוני המדולל יחד במקרר בטמפרטורה של 4°C עם ניעור עדין ודגרו למשך הלילה.
- הסר את סרט ה-PVDF למחרת ושטוף עם TBST במשך 10 דקות, תוך חזרה על התהליך 4 פעמים.
- יש לדגור על יריעת PVDF בנוגדן משני מדלל במשך כשעתיים.
- שטפו את סרט ה-PVDF עם TBST במשך 10 דקות, חזרו על התהליך 4 פעמים.
- לחשוף את הסרט ולנתח אותו.
- יש למרוח את תמיסת ה-ECL המוכנה על הסרט באופן שווה.
- חשוף את הסרט בחדר חשוך עם מד חשיפה למשך כ 2-3 דקות ולאחר מכן לאחסן אותו.
- בצע את הניתוח באמצעות תוכנת image J.
- בצע הכנות ל- SDS-PAGE.
תוצאות
התהליך של מידול עכברים ניסיוני מומחש באיור 1. לאחר 12 שעות של השלמת ההזרקה, נעשה שימוש במקליט וידיאו בשדה פתוח כדי לעקוב אחר מרחק התנועה ומשך חוסר התנועה של קבוצות ניסוי שונות של עכברים במשך 5 מחזורים (איור 2A). במהלך 5 המחזורים, עכברים בקבוצת PI V שמרו על רמה נמוכה של מרחק תנועה בתוך 3 דקות, בעוד שיחס חוסר התנועה בתוך 3 דקות גדל עם כל מחזור עוקב (איור 2B,C). בנוסף, נערך ניתוח סטטיסטי על מרחק התנועה הכולל של עכברים מקבוצות ניסוי שונות במהלך 5 המחזורים. קבוצת PI V הראתה את מרחק התנועה הכולל הקטן ביותר בהשוואה לקבוצות הניסוי האחרות, וההבדל היה מובהק סטטיסטית (p < 0.001) (איור 2D,E). למעט קבוצת הביקורת וקבוצת PI I, העכברים בקבוצות הניסוי האחרות הציגו צמיחה שלילית במשקל ערך D. ביניהם, קבוצת PI V הראתה את השינוי הגדול ביותר במשקל, וההבדל בשינוי במשקל בהשוואה לקבוצות הניסוי האחרות היה מובהק סטטיסטית (איור 2F). לאחר הערכת שיעור ההישרדות של 10 עכברים נוספים בכל קבוצת ניסוי, התוצאות הראו כי שיעור התמותה של עכברים בקבוצה PI V הגיע ל -80% ביום החמישי. אולם לא היה הבדל מובהק סטטיסטית בשיעור התמותה בין ארבע קבוצות הניסוי האחרות לבין עכברי קבוצת הביקורת (איור 2G).
באמצעות מיקרוסקופ בעל עוצמה גבוהה נצפו נפיחות תאית משמעותית, נמק וחדירת תאים דלקתיים בקבוצות העכברים PI IV ו-PI V (איור 3A,B). באמצעות קריטריוני הדירוג כפי שהם מופיעים בטבלה משלימה 2, הוערכה פתולוגיית הלבלב של קבוצות ניסוי שונות של עכברים, ונצפתה הבדלים משמעותיים בציון הפתולוגיה של הלבלב בהשוואה לעכברי קבוצת הביקורת (p < 0.001) (איור 3C; תרשים משלים 1). בנוסף, בהשוואה לקבוצת הביקורת, רמות העמילאז והליפאז בסרום בעכברים שנמדדו היו גבוהות משמעותית בקבוצות הניסוי PI II עד PI V, וההבדלים היו מובהקים סטטיסטית. באופן מעניין, לא היה הבדל מובהק סטטיסטית בעכברי קבוצת PI I (איור 3D,E). שיטת ELISA שימשה להערכת רמות הסמנים הדלקתיים14, כולל TNF-α ו- IL-6, בסרום של עכברים. הממצאים הראו כי רמות TNF-α ו-IL-6 בעכברי קבוצת PI V היו גבוהות משמעותית מאלה שבקבוצות הניסוי האחרות, וההבדלים היו מובהקים סטטיסטית (איור 3F,G). בהשוואה לקבוצת הביקורת, רמות ה-PCT עלו בכל ארבע קבוצות הניסוי, אך רק ההבדל בקבוצת PI V היה מובהק סטטיסטית (p < 0.05) (איור 3H).
המצב האפופטוטי של רקמות הלבלב בקבוצות ניסוי שונות של עכברים
על-ידי ביצוע צביעת טונל על רקמות הלבלב של כל קבוצת עכברים, נצפה מצב הנמק התאי ברקמות הלבלב של קבוצות ניסוי שונות (איור 4A). ערכי גווני האפור (OD) ליחידת שטח של מקטעי רקמת הלבלב והשיעור החיובי של נמק תאי נותחו באופן כמותי למחצה באמצעות תוכנת Image J. התוצאות הראו כי בהשוואה לקבוצות הניסוי האחרות, רמת נמק התאים ברקמות הלבלב של קבוצת PI V של עכברים עלתה באופן משמעותי, וההבדל היה מובהק סטטיסטית (p < 0.001) (איור 4B,C). ניסויי אימונובלוטציה של חלבונים בוצעו כדי להעריך את רמות הביטוי של ציסטניל אספרטט ספציפי פרוטאינאז-3 (קספאז-3), סמן נמק תאי, ברקמות הלבלב של עכברים מקבוצות ניסוי שונות (איור 4D). כימות ביטוי קספאז-3 הראה כי רמת הביטוי של חלבון קספאז-3 ברקמות הלבלב של קבוצת PI V עלתה באופן משמעותי, וההבדל היה מובהק סטטיסטית (p < 0.001). רמות ביטוי החלבונים כומתו ונורמלו לפער הבקרה הפנימי (איור 4E). בנוסף, מתלי תאי לבלב טריים סומנו עם Annexin V-FITC/PI ונותחו על ידי ציטומטריית זרימה. נמצא כי בהשוואה לקבוצות הניסוי האחרות של עכברים, לקבוצת PI V היה שיעור חיובי גבוה משמעותית של מוות תאי, שהיה מובהק סטטיסטית (p < 0.001) (איור 4F,G).
התוכן של HMGB-1 בסרום היקפי ורמת הביטוי של HMGB-1 ברקמת הלבלב
על מנת לחקור את הקשר בין חלבון HMGB-1 לבין פגיעה בלבלב, בוצעו צביעה וכימות אימונוהיסטוכימיים על רקמות הלבלב של עכברים בכל קבוצת ניסוי. היה הבדל מובהק סטטיסטית בין קבוצת הניסוי לבין קבוצת הביקורת (p < 0.001) (איור 5A,B). ELISA שימשה למדידת רמות HMGB-1 בסרום של עכברים מקבוצות ניסוי שונות. התוצאות הראו כי בהשוואה לקבוצת הביקורת, רמות הסרום של HMGB-1 היו גבוהות משמעותית בכל קבוצות הניסוי, כאשר הרמה הגבוהה ביותר נצפתה בקבוצת PI V, וההבדל היה מובהק סטטיסטית (p < 0.001) (איור 5C). יתר על כן, ניתוח כתמים מערביים זיהה ביטוי מוגבר של חלבון HMGB-1 ברקמות הלבלב של עכברים בכל קבוצות הניסוי, עם הבדלים מובהקים סטטיסטית בהשוואה לקבוצת הביקורת (p < 0.001) (איור 5D,E).
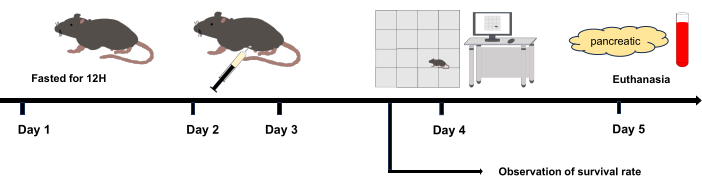
איור 1: תרשים זרימה ניסיוני. יום 2 ויום 3: הזרקה תוך צפקית. יום 4: ניסוי השדה הפתוח החל לאחר 12 שעות מהזריקה התוך-צפקית האחרונה. יום 5: המתת חסד 36 שעות לאחר הזריקה intraperitoneal. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: שינויים מקרוסקופיים במודל עכברי PI. (A) מתוארת עלילת מסלול התנועה בזמן אמת של עכברים. (B) מרחק התנועה הכולל בכל תקופת ניטור עבור קבוצות ניסוי שונות של עכברים. (C) אחוז זמן חוסר התנועה בכל תקופת ניטור עבור קבוצות ניסוי שונות של עכברים. (ד,ה) מרחק התנועה הכולל ואחוז זמן חוסר התנועה במהלך 15 דקות נותחו עבור עכברים בקבוצות ניסוי שונות. (F) מוצג ערך D המייצג את משקל העכברים לפני ואחרי תהליך המידול. (G) הישרדותם של 10 עכברים בכל קבוצה נצפתה במשך 7 הימים שלאחר הזריקה התוך-צפקית. הנתונים מבוטאים כאמצעים ± SEM, n = 4. "ns" מציין לא משמעותי, *P < 0.05, ****P < 0.001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: שינויים פתולוגיים בדלקת הלבלב של עכברים בקרב קבוצות ניסוי שונות. (A) החתכים ההיסטולוגיים המוכתמים ב-H&E ברקמת הלבלב של עכברים בקבוצות ניסוי שונות (קטעי רקמת לבלב משובצים בפרפין מוכתמים בהמטוקסילין ובאאוסין, הגדלות של פי 100 ומוטות קנה מידה של 200 מיקרומטר, ומוטות פי 400 וקנה מידה של 50 מיקרומטר, בהתאמה. חצים ארוכים צהובים מציינים איים; חיצים ארוכים אדומים מציינים תאי אסינר; חצים ארוכים חומים מצביעים על כלי דם; חצים ארוכים כחולים מציינים צינורות). (B) חישוב היחס בין משקל הלבלב למשקל הגוף בעכברים. (C) ניקוד פתולוגי של לבלב עכברים. (ד,ה) איתור רמות עמילאז וליפאז בסרום בעכברים. (פ-ג) מדידת ELISA של רמות TNF-α ו- IL-6 בסרום בעכברים. (ח) הערכת רמת PCT. הנתונים מבוטאים כאמצעים ± SEM, n = 4. "ns" מציין לא משמעותי, *P < 0.05, ****P < 0.001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
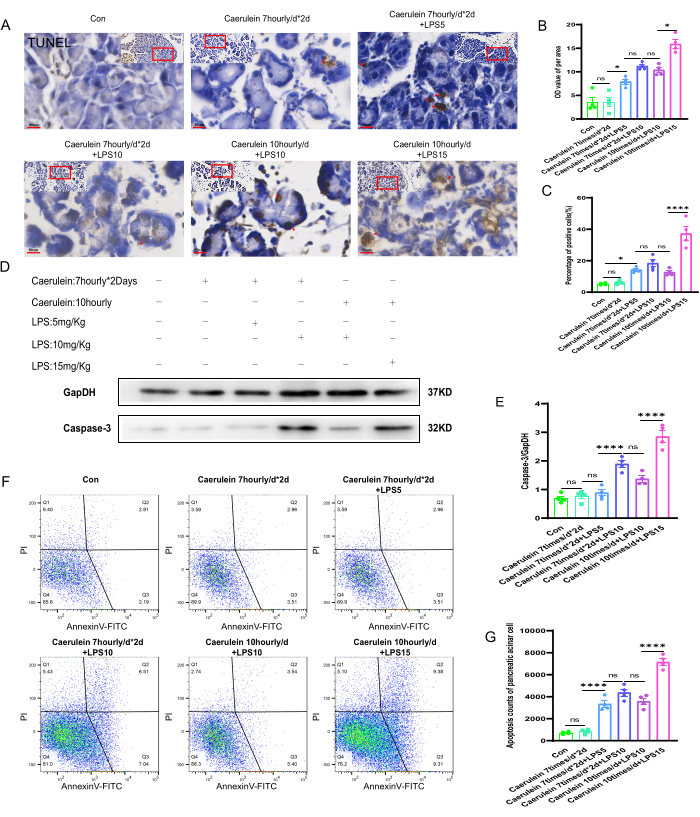
איור 4: אפופטוזיס של רקמת הלבלב בעכברים. (A) תמונות מייצגות של צביעת טונל התקבלו מקטעי פרפין בלבלב של עכברים ומתמונות של אזורים מוגדלים. (400x, סרגל קנה מידה 50 מיקרומטר, צהוב חום הוא תאים חיוביים). (ב,ג) ניתוח כמותי של ערך גווני אפור ליחידת שטח של מקטעים מוכתמים TUNEL של רקמת לבלב עכברים ואחוז תאים מתים מוכתמים חיובית. (D) רמת הביטוי של קספאז-3 ברקמת הלבלב זוהתה על ידי כתם מערבי. (E) כימות ביטוי קספאז-3 ברקמת הלבלב. (F) ציטומטריית זרימה שימשה להערכת מידת המוות של תאים בתאי לבלב של עכברים. (G) ספירה של תאים מתים בשלב מאוחר בתאי לבלב של עכבר. הנתונים מבוטאים כאמצעים ± SEM, n = 4. "ns" מציין לא משמעותי, *P < 0.05, ****P < 0.001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: ביטוי HMGB-1 ברקמת לבלב של עכברים. (A) תמונות מייצגות ותמונות מוגדלות (x400, סרגל קנה מידה 50 מיקרומטר) של צביעה אימונוהיסטוכימית של HMGB-1 על מקטעי הלבלב. הצבע החום-צהוב מציין תאים חיוביים (n = 4). (B) אחוז התאים החיוביים ל-HMGB-1 במקטעי רקמת הלבלב (n = 24). (C) רמת HMGB-1 בסרום עכבר (n = 4). (ד,ה) כתם מערבי בוצע כדי לזהות את רמת הביטוי של HMGB-1 ברקמת הלבלב ולקבל את תוצאות הכימות (n = 4). הנתונים מבוטא כאמצעי ± SEM, "ns" מציין לא משמעותי, *P < 0.05, ****P < 0.001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור משלים 1: פגיעה באיברים מרובים במודל עכברי קבוצת PI V. (A) תמונות מייצגות של שינויים היסטולוגיים ברקמות הלבלב, הריאות, הכבד והכליות שנאספו מעכברי קבוצת CON ו-PI V נותחו באמצעות צביעת H&E (הגדלה פי 200, סרגל קנה מידה 50 מיקרומטר). שינויים פתולוגיים הקשורים נמק תאים acinar מסומנים על ידי חצים שחורים. חיצים צהובים מצביעים על שינויים פתולוגיים המאופיינים בדימום אינטרסטיציאלי ובצקת בנאדיות. בצקת הפטוציטים ונמק מסומנים על ידי חצים ירוקים. שינויים פתולוגיים הקשורים לדימום גלומרולרי מסומנים על ידי חצים אדומים. (B) חישוב הציונים ההיסטולוגיים בוצע על רקמות הלבלב, הריאות, הכבד והכליות שהתקבלו מקבוצת CON ומעכברי קבוצת PI V. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה 1: פרוטוקול הזרקה תוך צפקית. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה 2: קריטריונים לניקוד פתולוגי לחומרת דלקת הלבלב. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
כיום, חסרים אמצעים יעילים לשיפור שיעור התמותה הגבוה בחולים עם דלקת לבלב חריפה חמורה. חיוני לחקור את יעילותן של תרופות בשיפור מנגנוני היציבות החיסונית. קיים צורך דחוף במודל חייתי אידיאלי לדלקת לבלב חריפה חמורה. עכברים עם רקע גנטי C57BL/6J נמצאים בשימוש נרחב במחקר ביו-רפואי, כולל מחקרים על פתופיזיולוגיה של SAP. יותר מ-70 שנה של התמיינות גנטית בעכברי B6J הביאו למחיקה ספונטנית של מספר אקסונים15, מה שהוביל לרגישות מופחתת לפגיעה בלבלב הנגרמת על ידי קרולין16. בנוסף, למודלים קיימים של בעלי חיים של דלקת לבלב חריפה יש מגבלות כגון טראומה כירורגית או תחולה רק על בעלי חיים גדולים יותר, מה שמעכב מחקרים מדעיים המשתמשים במודלים אלה. לכן, חשוב מאוד לבסס מודל יציב, יעיל ונוח של בעלי חיים באמצעות זן הגן הספציפי הזה.
Caerulein הוא אנלוגי של cholecystokinin הגורמת נזק לרקמת הלבלב על ידי גרימת חסימה יחסית של נוזל העיכול הלבלב והפרשת אנזימים באמצעות זריקות בתדירות גבוהה בתוך תקופה קצרה כאשר עכברים צמו ואחסנו כמויות מספיקות של נוזל העיכול17. LPS הוא המרכיב העיקרי שנמצא בדפנות תאי חיידקים ויכול לגרום ל-MODS ו-SIRS בעכברים18. מחקר קודם הראה כי שילוב של זריקות Caerulein בתדרים שונים עם מינונים משתנים של LPS הניתנים באמצעות הזרקה intraperitoneal גרם לשינויים פתולוגיים דומים שנצפו ב- SAPאנושי 19,20. מחקר זה השתמש בגישה לא פולשנית כדי לגרום לדרגות שונות של פגיעה בלבלב על ידי שילוב תדרים שונים של זריקות Caerulein עם מינונים שונים של LPS הניתנים תוך צפקית לעכברים. הבטחת ספיגה אחידה על ידי הצפק הייתה חיונית במהלך פיתוח הפרוטוקול. כדי למלא דרישה זו, חיוני להקפיד על השלבים של הזרקה intraperitoneal על מנת להבטיח שליטה מדויקת על כל מתן תרופה. בנוסף, שפשוף עדין והפעלת לחץ מתאים על מקום ההזרקה באמצעות צמר גפן סטרילי לאחר כל הזרקת תרופה חיוניים לפיזור אחיד של התרופה בכל חלל הצפק. יתר על כן, מיקום מדויק ומדויק של ראש הסיכה לתוך חלל הצפק, כאשר המחט מכוונת לאזור המרכזי של הבטן העליונה, הוא בעל חשיבות עליונה. יש לבצע אימון מוקדם כדי לאפשר למפעילים לתפוס במדויק כל חוסר התנגדות בעת החדרת המחט לחלל הבטן. שימוש במשאבת עירוי מיקרו-כמותית במקום הפעלה ידנית עשוי לשפר את איכות הזרקת התרופה; למרבה הצער, זה לא יושם במחקר זה. עם זאת, על ידי שימוש בתוכניות הזרקה שונות, גרמנו לדרגות שונות של פגיעה בלבלב וראינו ביעילות הבדלים בפגיעה בלבלב שנגרמה על ידי תדרים ומינונים שונים בתנאים טכניים זהים שנגרמו על ידי Caerulein בשילוב עם זריקות LPS. זה מספק תובנות חשובות לשימוש עתידי של Caerulein במודלים לא פולשניים של בעלי חיים עבור השראת דלקת לבלב חריפה חמורה.
השילוב של Caerulein ו-LPS הביא לרמות גבוהות משמעותית של עמילאז וליפאז בסרום, לעלייה במשקל הלבלב ולשינויים היסטולוגיים, כולל חדירה נרחבת של תאי דלקת, בצקת תאי לבלב אצינרית, נמק ודימום, כפי שהודגם על ידי צביעת המטוקסילין ואוזין (HE). יתר על כן, עם מינון הולך וגדל של LPS, השינויים הפתולוגיים בלבלב הפך בולט יותר. עם זאת, ראוי לציין כי לא היו הבדלים ניכרים בציוני פתולוגיית הלבלב בין קבוצות PI IV ו- PI V, בעוד שהיקף הנמק של תאי רקמת הלבלב היה בולט יותר בקבוצת PI III בהשוואה לקבוצת PI IV. תצפית זו מצביעה על כך שתדירות המינון של Caerulein עשויה לשמש כגורם עיקרי התורם לפגיעה בלבלב, בעוד LPS מחריף את התקדמותו, מה שמוביל לנזק דלקתי מערכתי 18,21. HMGB-1 הוא חלבון המתפקד בהתאם למיקומו22. HMGB-1 חוץ-תאי פועל כחלבון המעורב באותות האזהרה של דלקת והוא קשור קשר הדוק עם חומרת דלקת הלבלב החריפה 23,24,25. במחקר זה, רמות HMGB-1 בסרום בעכברים מכל קבוצות הניסוי היו גבוהות משמעותית בהשוואה לקבוצת הביקורת, כאשר קבוצת PI V הראתה את העלייה המשמעותית ביותר. ניסויים אימונוהיסטוכימיים ואלקטרופורזה חלבונית אישרו גם את הביטוי הגבוה של HMGB-1 ברקמת הלבלב. חלבון חשוב זה עשוי לשמש מטרה טיפולית לעיכוב הסערה הדלקתית בדלקת לבלב חריפה חמורה.
לסיכום, חיוני לפתח מודל לא פולשני, פשוט וקל לביצוע של SAP בעכברים. בפרוטוקול ניסיוני זה, השראת פגיעה בלבלב באמצעות Caerulein בשילוב עם LPS היא אמינה ויעילה. על ידי מתן Caerulein intraperitoneally במשך עשרה ימים רצופים במינון של 50 מיקרוגרם / ק"ג, ואחריו זריקה intraperitoneal יחיד של 15 מ"ג / ק"ג של LPS, מודל יציב, אמין, חסכוני, ויעיל של בעלי חיים של SAP ניתן לבסס.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
מחקר זה נתמך על ידי פרויקטים מחקריים בבריאות ובמדעי הרפואה בעיר Huainan (No. HNWJ2023005); תוכנית המדע והטכנולוגיה העירונית בעיר Huainan (מס '2023151); תוכנית הכשרת החדשנות והיזמות של סטודנטים במכללה המחוזית Anhui (מס 'S202310361254); האצווה התשיעית של "50· כוכבי מדע וטכנולוגיה" צוותי חדשנות בעיר Huainan ופרויקט הבנייה הקליני המיוחד של Anhui Provincial. ברצוננו להביע את תודתנו למחלקת המעבדות של בית החולים המסונף הראשון של אוניברסיטת אנחווי למדע וטכנולוגיה על אספקת נתוני הבדיקה הרלוונטיים.
Materials
| Name | Company | Catalog Number | Comments |
| 20× Citric Acid Antigen Repair Solution (pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1202-250 ml | |
| Amylase | Mindray,China | ||
| Annexin V-FITC/PI | Wuhan servicebio Technology Co.,Ltd, China | G1511 | diluted at 1:20 |
| Anti-HMGB1 Rabbit pAB | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1800 |
| BCA protein quantitative detection kit | Wuhan servicebio Technology Co.,Ltd, China | G2026-200T | |
| BD FACSCanto II Flow Cytometer | BD Life Sciences, San Jose, CA, 95131, USA | BD FACSCanto II | |
| BSA | Wuhan servicebio Technology Co.,Ltd, China | GC305010-100g | |
| C57BL/6J | Cavion Experimental Animal Co., Changzhou, China | license number SCXY (Su) 2011–0003 | |
| Ceruletide | MCE, New Jersey, USA | 17650-98-5 | 50 µg/kg |
| Chemiluminescence imager | Cytiva CO.,LTD.;USA | ||
| Citric acid antigen repair Solution (Dry powder pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1201-5 L | |
| Collagenase IV | Wuhan servicebio Technology Co.,Ltd, China | GC305014 | 0.5 mg/mL |
| DAB (SA-HRP) Tunel Cell Apoptosis Detection Kit | Wuhan servicebio Technology Co.,Ltd, China | G1507-100 T | |
| Dimension EXL with LM Integrated Chemistry System | Siemens Healthcare Diagnostics Inc.Brookfield,USA | YZB/USA 8311-2014 | |
| ECL developer | Wuhan servicebio Technology Co.,Ltd, China | ||
| Eosin dye (alcohol soluble) | Wuhan servicebio Technology Co.,Ltd, China | G1001-100 ml | |
| EthoVision XT | Noldus, Netherlands | ||
| FITC-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB22303 | diluted at 1:50 |
| Fully automatic blood cell analyzer | Zybio Inc. China | Zybio-Z3 CRP | |
| GapDH | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1500 |
| Hematoxylin blue return solution | Wuhan servicebio Technology Co.,Ltd, China | G1040-500 ml | |
| Hematoxylin differentiation solution | Wuhan servicebio Technology Co.,Ltd, China | G1039-500 ml | |
| Hematoxylin dye | Wuhan servicebio Technology Co.,Ltd, China | G1004-100 ml | |
| HMGB-1 ELISA kits | njjcbio Co., Ltd, China | ||
| HOMOGENIZER | Wuhan servicebio Technology Co.,Ltd, China | KZ-III-F;IC111150 100222 | |
| HRP-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB23303 | diluted at 1:1500 |
| IL-6 ELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0001 | |
| Lipase | Mindray,China | ||
| Lipopolysaccharide | Wuhan servicebio Technology Co.,Ltd, China | GC205009 | 15 mg/kg |
| Low temperature high speed centrifuge | Changsha Pingfan Apparatus&Instrument Co.,Ltd.,China | TGL-20M | |
| Membrane breaking liquid | Wuhan servicebio Technology Co.,Ltd, China | G1204 | |
| microtome | Jinhua Craftek Instrument Co., Ltd.;China | CR-601ST | |
| Nylon mesh | Wuhan servicebio Technology Co.,Ltd, China | 200-mesh | |
| One-step TUNEL cell apoptosis detection kit (DAB staining method) | Wuhan servicebio Technology Co.,Ltd, China | G1507-100T | |
| Paraffin tissue embedding machine | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PBM-A | |
| Pathological tissue drying apparatus | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PHY-III | |
| Phosphate-buffered saline | Wuhan servicebio Technology Co.,Ltd, China | G4202-100ML | |
| PMSF | Wuhan servicebio Technology Co.,Ltd, China | G2008-1 ml | |
| Positive fluorescence microscope | Olympus Corporation,Tokyo, Japan | BX53 | |
| Pro Calcitonin | Mindray,China | ||
| PVDF membrane | Millipore, USA | 0.22 µm | |
| RIPA | Wuhan servicebio Technology Co.,Ltd, China | G2002-100 ml | |
| SDS-PAGE | Beyotime Biotechnology,China | P0012A | |
| TNF-αELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0004 | |
| Ultrasonic water bath | DONGGUAN KQAO ULTRASONIC EQUIPMENT CO.,LTD.;China | KQ-200KDE | |
| Western Blot | Bio-Rad Laboratories, Inc.,USA | ||
| Western blot imaging System | Global Life Sciences IP Holdco LLC, JAPAN | Amersham ImageQuant 800 | |
| Whirlpool mixer | SCILOGEX;USA |
References
- Gliem, N., Ammer-Herrmenau, C., Ellenrieder, V., Neesse, A. Management of severe acute pancreatitis: An update. Digestion. 102 (4), 503-507 (2021).
- Duan, F., et al. GDF11 ameliorates severe acute pancreatitis through modulating macrophage M1 and M2 polarization by targeting the TGFbetaR1/SMAD-2 pathway. Int Immunopharmacol. 108, 108777 (2022).
- Zhang, X. P., et al. Preparation method of an ideal model of multiple organ injury of rat with severe acute pancreatitis. World J Gastroenterol. 13 (34), 4566-4573 (2007).
- Bluth, M. H., Patel, S. A., Dieckgraefe, B. K., Okamoto, H., Zenilman, M. E. Pancreatic regenerating protein (reg I) and reg I receptor mRNA are upregulated in rat pancreas after induction of acute pancreatitis. World J Gastroenterol. 12 (28), 4511-4516 (2006).
- Qiu, F., Lu, X. S., Huang, Y. K. Effect of low molecular weight heparin on pancreatic micro-circulation in severe acute pancreatitis in a rodent model. Chin Med J (Engl). 120 (24), 2260-2263 (2007).
- Lombardi, B., Estes, L. W., Longnecker, D. S. Acute hemorrhagic pancreatitis (massive necrosis) with fat necrosis induced in mice by DL-ethionine fed with a choline-deficient diet. Am J Pathol. 79 (3), 465-480 (1975).
- Liu, Y., et al. Deletion of XIAP reduces the severity of acute pancreatitis via regulation of cell death and nuclear factor-kappaB activity. Cell Death Dis. 8 (3), e2685 (2017).
- Niederau, C., Ferrell, L. D., Grendell, J. H. Caerulein-induced acute necrotizing pancreatitis in mice: Protective effects of proglumide, benzotript, and secretin. Gastroenterology. 88, 1192-1204 (1985).
- Zhou, X., et al. DPP4 inhibitor attenuates severe acute pancreatitis-associated intestinal inflammation via Nrf2 signaling. Oxid Med Cell Longev. 2019, 6181754 (2019).
- Yang, J., et al. Heparin protects severe acute pancreatitis by inhibiting HMGB-1 active secretion from macrophages. Polymers (Basel). 14 (12), 2470 (2022).
- Kong, L., et al. Sitagliptin activates the p62-Keap1-Nrf2 signalling pathway to alleviate oxidative stress and excessive autophagy in severe acute pancreatitis-related acute lung injury. Cell Death Dis. 12 (10), 928 (2021).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Schmidt, J., et al. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 215 (1), 44-56 (1992).
- Luo, C., et al. Abdominal paracentesis drainage attenuates severe acute pancreatitis by enhancing cell apoptosis via PI3K/AKT signaling pathway. Apoptosis. 25 (3-4), 290-303 (2020).
- Fontaine, D. A., Davis, D. B. Attention to background strain is essential for metabolic research: C57BL/6 and the international knockout mouse consortium. Diabetes. 65 (1), 25-33 (2016).
- Wan, J., et al. Pancreas-specific CHRM3 activation causes pancreatitis in mice. JCI Insight. 6 (17), e132585 (2021).
- Sah, R. P., et al. Cerulein-induced chronic pancreatitis does not require intra-acinar activation of trypsinogen in mice. Gastroenterology. 144 (5), 1076-1085 (2013).
- Wang, K., et al. Activation of AMPK ameliorates acute severe pancreatitis by suppressing pancreatic acinar cell necroptosis in obese mice models. Cell Death Discov. 9 (1), 363 (2023).
- Jin, C., Li, J. C. Establishment of a severe acute pancreatitis model in mice induced by combined Rain Frog Peptide and lipopolysaccharide and exploration of its mechanism. Acta Exp Bio Sinica. 36 (2), 91-96 (2003).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Roy, R. V., et al. Pancreatic Ubap2 deletion regulates glucose tolerance, inflammation, and protection from Caerulein-induced pancreatitis. Cancer Lett. 578, 216455 (2023).
- Chen, R., Kang, R., Tang, D. The mechanism of HMGB1 secretion and release. Exp Mol Med. 54 (2), 91-102 (2022).
- Murao, A., Aziz, M., Wang, H., Brenner, M., Wang, P. Release mechanisms of major DAMPs. Apoptosis. 26 (3-4), 152-162 (2021).
- Liu, T., et al. Accuracy of circulating histones in predicting persistent organ failure and mortality in patients with acute pancreatitis. Br J Surg. 104 (9), 1215-1225 (2017).
- Li, N., Wang, B. M., Cai, S., Liu, P. L. The role of serum high mobility Group Box 1 and Interleukin-6 levels in acute pancreatitis: A meta-analysis. J Cell Biochem. 119 (1), 616-624 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved