Method Article
Yan Etki Riski Düşük Olan Sıçanlarda İntrakameral Enjeksiyon
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, merkezi bir kornea insizyonu ve ön kamaraya uzun bir tünel kullanılarak sıçanlarda intrakameral enjeksiyon için bir tekniği tanımlar. Bu enjeksiyon yöntemi, yanlışlıkla doku hasarına neden olma riskini en aza indirir ve böylece hassasiyeti ve tekrarlanabilirliği artırır.
Özet
İntrakameral enjeksiyon, oftalmolojide standart bir uygulama rutinidir. Araştırma için kemirgenlerde intrakameral enjeksiyonun uygulanması, küçük sulu mizah hacmi, lens eğriliği ve lens kalınlığı dahil olmak üzere gözün sınırlayıcı boyutları ve anatomisi nedeniyle zordur. İntrakameral enjeksiyonlar sırasında potansiyel hasar, yan etkilere ve deneysel değişkenliğe neden olur. Bu protokol, sıçanlarda intrakameral enjeksiyon için bir prosedürü tanımlar ve hassasiyet ve tekrarlanabilirlik sağlar.
Deneysel model olarak Sprague-Dawley cinsi sıçanlar kullanılmıştır. Sıçanlarda lens pozisyonu ön kamaraya çıkıntı yaptığından, insanlarda olduğu gibi çevreden enjekte etmek sakıncalıdır. Bu nedenle, ön kamaraya kendiliğinden sızdırmaz bir tünel oluşturmak için 31 gauge 0.8 mm'lik bir stiletto bıçak kullanılarak merkezi kornea bölgesinde bir kesi oluşturulur. Düzlüğe yakın bir açıda bir kesi, sulu mizah kaybını ve ön kamaranın sığlaşmasını en aza indiren uzun bir tünel oluşturulmasına izin verir. Enjeksiyon için tünele 34 gauge nanoiğne yerleştirilir. Bu, minimum sürtünme direnci ile penetrasyon sağlar ve lense dokunmayı önler. Tripan mavisi enjeksiyonu, ön kamaradaki boyanın varlığının yarık mikroskobu ile görselleştirilmesine ve sızıntının dışlanmasına izin verir. Kornea endotel tabakasının biyoyararlanımı, enjeksiyondan sonra kornea endotel hücrelerinin çekirdeklerini boyayan Hoechst boyasının enjeksiyonu ile gösterilir.
Sonuç olarak, bu protokol sıçanlarda doğru intrakameral enjeksiyon için bir prosedür uygular. Bu prosedür, deneysel sıçan modellerinde çeşitli ilaçların ve bileşiklerin intrakameral olarak verilmesi için kullanılabilir ve oftalmik araştırmanın verimliliğini ve tekrarlanabilirliğini arttırır.
Giriş
Topikal uygulama ile göz yüzeyine verilen bileşiklerin biyoyararlanımı büyük ölçüde sınırlıdır, tipik olarak %<5'tir1. Göz damlaları ile uygulanan bileşikler esas olarak drenaj, indüklenmiş lakrimasyon, gözyaşı sıvısı döngüsü ve konjonktival emilim ile elimine edilir. Ek olarak, bileşiklerin oküler yüzeyden nüfuz etmesi, kornea-konjonktiva bariyeri 1,2,3 tarafından oldukça kısıtlanmıştır. Kornea üç ana katmandan oluşur: en dıştaki epitel, ara stroma ve en içteki endotel. Yüzeysel kornea epiteli, güçlü sıkı bağlantılarla birbirine bağlanır ve madde geçirgenliğinin ana engeli olan yüksek paraselüler direnç oluşturur. Çoklu epitel katmanları, kornea epitelinin hücreler arası boşlukları boyunca hidrofilik ve büyük moleküllerin nüfuzunu daha da sınırlar. Epitelin ardından gelen stroma, kollajen liflerinden oluşur ve sulu gözenekler içerir. Kornea epitelinin aksine, stroma hidrofilik ilaçların hareketine izin verir; Bununla birlikte, lipofilik bileşikler 1,2,3'e karşı büyük ölçüde geçirimsizdir. Kornea epiteli ve stromal tabakalar birlikte, ilaç emilimini sınırlayan ana doku bariyerleri sunar. Kornea endotelinin ilaç taşınmasını kısıtladığı düşünülmemektedir.
Kornea iletim yoluna alternatif konjonktival yoldur. Konjonktiva, göz kapaklarının iç tarafını ve skleranın ön kısmını kaplayan çok epitel tabakasıdır. Konjonktiva, kornea epitelinden daha az sıkı bağlantı ile karakterize edilir ve hidrofilik ilaçların daha iyi geçirgenliğine izin verir. Bununla birlikte, konjonktivanın vaskülarizasyonu, uygulanan moleküllerin büyük bir kısmının sistemik olarak emilmesine neden olurve yine verilen bileşiklerin ön kamaraya 1,2 biyoyararlanımını büyük ölçüde sınırlar. Dış oküler geçirgenlik bariyerlerini atlamanın etkili bir yolu, ilacı doğrudan ilgilenilen bölgeye vermektir. Örneğin, vitreus mizahına4 intravitreal enjeksiyon yaygındır. Benzer şekilde, ön kamaraya5 verilmesi için intrakameral enjeksiyon kullanılır. Ön kamarada verimli bir konsantrasyon oluşturmak, intrakameral antibiyotik enjeksiyonu ile enfeksiyon tedavisi ve katarakt ameliyatlarında postoperatif antienflamatuar tedaviler gibi çeşitli klinik durumlar için kritik öneme sahiptir. İntramcameral enjeksiyonla sağlanan gelişmiş madde biyoyararlanımının avantajına rağmen, dikkate alınması gereken önemli güvenlik endişeleri vardır. Örneğin, intrakameral ilaç enjeksiyonu artmış göz içi basıncına, toksik ön segment sendromuna ve toksik endotel hücre yıkım sendromunaneden olabilir 5,6. Bu nedenle, tedavi verimliliğini en üst düzeye çıkarmak ve hastalarda potansiyel yan etkileri en aza indirmek için intrakameral enjeksiyonlarla verilen ilaçların etkinliğini ve güvenliğini klinik öncesi çalışmalarda dikkatli bir şekilde değerlendirmek önemlidir.
Deney hayvanı modelleri, yeni tedavileri araştırmak için yapılan klinik öncesi çalışmalarda vazgeçilmezdir. Fareler ve sıçanlar gibi küçük kemirgenler, bu tür amaçlar için en yaygın kullanılan laboratuvar hayvanlarıdır. Bu hayvanlar, insan anatomisi ve fizyolojisi ile çok sayıda benzerlik sergileyerek değerli bilgiler sağlar. Ayrıca, küçük boyutları, bakım kolaylığı, hızlı gebelik ve çok sayıda yavru üretme yetenekleri nedeniyle kullanımları ekonomik olarak avantajlıdır7.
Küçük kemirgenlerin göz hastalığı modellerinde yaygın olarak kullanılmasına rağmen, benzersiz göz boyutları ve anatomileri deneysel manipülasyonlar sırasında önemli zorluklar ortaya çıkarmaktadır. Örneğin, insanlarda nispeten basit olan intrakameral enjeksiyonlar gibi prosedürler, farelerde ve sıçanlarda teknik olarak zorlu hale gelir. Zorluklar, küçük hacimli sulu mizah, nispeten büyük ve esnek olmayan lens ve lensin kemirgenlerin gözleri içindeki engelleyici konumu ve eğriliği gibi faktörlerden kaynaklanmaktadır (Şekil 1)8. Bu zorluklar, kemirgenlerde intrakameral enjeksiyonlar sırasında hasar riskini artırır, potansiyel olumsuz etkilere yol açar ve çalışma sonuçlarının geçerliliğini etkileyebilecek deneysel değişkenliğe neden olur. Araştırmamızda, sıçanlarda güvenli intrakameral enjeksiyon için başarılı bir prosedür geliştirdik. Teknik, korneada ön kamaraya uzun, düz, kendinden sızdırmaz bir tünel oluşturmayı içerir. Bu yöntem sadece hassasiyeti sağlamakla kalmaz, aynı zamanda küçük kemirgenlerde enjeksiyon teknikleriyle ilgili sorunları ele alarak deneysel tekrarlanabilirliği de geliştirir.
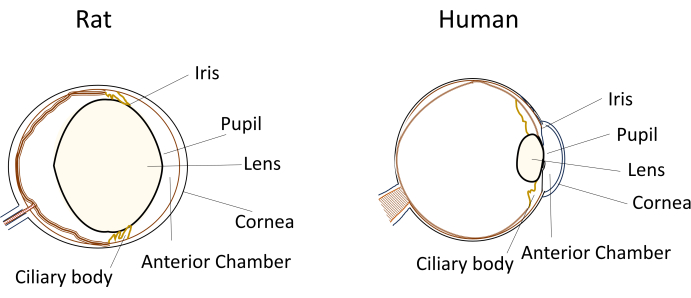
Şekil 1: Sıçan ve insan gözünün anatomik ön segment özelliklerinin şematik gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Protokoldeki deneyler, hayvan bilimi için Ulusal İzin Komitesi tarafından onaylandı ve hayvanların oftalmik ve görme araştırmalarında kullanılması olan ARVO Beyanı'na uygun hale geldi. Bu çalışma için 8-10 haftalık dişi Sprague-Dawley sıçanları kullanıldı ve 12/12 saat aydınlık-karanlık döngülerine maruz bırakıldı. Hayvanlar ticari bir kaynaktan elde edilmiştir (bkz.
1. Hayvan hazırlama
- Anestezik bir ketamin (0.8 mL'de 80 mg / kg vücut ağırlığı) ve ksilazin (0.2 mL'de 4 mg / kg vücut ağırlığı) karışımı hazırlayın ve sıçanları uyuşturmak için tek bir enjeksiyonda intraperitoneal olarak enjekte edin.
- Analjezik buprenorfin (0.03 mg / kg) tek bir enjeksiyonda intraperitoneal olarak enjekte edin.
- Her iki göze topikal oftalmik anestezik% 0.4 oksibuprokain uygulayın.
2. Kendinden sızdırmaz bir kornea tüneli oluşturma
- Cerrahi oftalmik forseps ile superior sklerayı korneoskleral bileşkenin yanındaki dikey orta hatta tutarak gözü stabilize edin.
- Cerrahi mikroskop altında, steril 0,8 mm, 31 G stiletto bıçağını parasantral kornea bölgesindeki dikey orta hatta (göz bebeğinin merkezinin üstünde) yataya mümkün olduğunca yakın bir açıyla düz bir pozisyonda yerleştirin (Şekil 2).
- Bu pozisyonda, bir kesi yapmak için korneayı delin ve ön kamaranın merkezi alanına nüfuz edene kadar uzun bir tünel (2-3 mm) oluşturun. Lense dokunmaktan kaçının (Şekil 2).
NOT: Başarılı bir tünel, sulu mizahın sızmasına ve ön kamaranın sığlaşmasına neden olmaz. - Enjekte edilen göze topikal% 0.3 ofloksasin ve% 0.1 deksametazon uygulayın.
- Yarık mikroskobu altında aşağıdaki gibi inceleyin.
- Enjekte edilen gözün ön kamarasının derinliğini, enjekte edilmeyen göze kıyasla gözlemleyin.
NOT: Derinlik benzer olmalıdır. - Enjekte edilen gözün merceğini, enjekte edilmeyen göze kıyasla gözlemleyin.
NOT: Lens şeffaf olmalıdır. Opaklık, cerrahi prosedür sırasında lens hasarını yansıtabilir.
- Enjekte edilen gözün ön kamarasının derinliğini, enjekte edilmeyen göze kıyasla gözlemleyin.

Şekil 2: Bıçağın ve insizyon açısının ve pozisyonunun şematik gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Seçenek 1: Ön kamaraya başarılı enjeksiyonu değerlendirmek için tripan mavisinin intrakameral enjeksiyonu
- 34 G künt iğne ile steril 10 μL cam Hamilton şırıngaya 5 μL tripan mavisi yükleyin.
NOT: Tripan mavisi enjeksiyonu, model kalibrasyonu veya kurulum aşamaları sırasında enjeksiyonun başarısını değerlendirmek için bir araç olarak tanımlanmaktadır. Deneysel ortamlarda, şırınga tercih edilen bileşiğin bir çözeltisi ile yüklenebilir. - Yüklenen şırınga iğnesini 2. bölümde oluşturulan tünelden ön kamaraya sokun.
- Enjeksiyondan sonra iğneyi enjekte edin ve tüm sıvı temizlenene kadar 2-3 saniye yerinde tutun.
- Kornea tünelinden sızıntıyı önlemek için iğneyi nazikçe ve yavaşça dışarı çekerek çıkarın.
- Yarık mikroskobu altında inceleyin. Sığlığı dışlamak için ön kamaranın derinliğini değerlendirin ve ön kamarada tripan mavisi varlığını doğrulayın.
- Yarık muayenesini 24 saat, 48 saat ve 72 saat sonra tekrarlayın.
4. Seçenek 2: Endotel hücre tabakasına enjekte edilen materyalin biyoyararlanımını değerlendirmek için Hoechst'in intrakameral enjeksiyonu
- 34 G künt iğne ile steril 10 μL cam Hamilton şırıngaya 5 μL Hoechst yükleyin.
NOT: Hoechst enjeksiyonu, enjekte edilen materyalin endotel hücre tabakasına alım yoluyla biyoyararlanımını değerlendirmek için bir araç olarak tanımlanır ve model kalibrasyonu veya kurulum aşamaları sırasında yararlıdır. Deneysel ortamlarda, şırınga tercih edilen bileşiğin bir çözeltisi ile yüklenebilir. - Yüklenen şırınga iğnesini 2. bölümde oluşturulan tünelden ön kamaraya sokun.
- Enjeksiyondan sonra iğneyi enjekte edin ve tüm sıvı temizlenene kadar 2-3 saniye yerinde tutun.
- Kornea tüneli kesisinden sızıntıyı önlemek için iğneyi nazikçe ve yavaşça dışarı çekerek çıkarın.
- Enjeksiyondan yaklaşık 15-20 dakika sonra, 500 mg / kg sodyum pentobarbiton intraperitoneal enjeksiyonu ile sıçanları ötenazi yapın.
- Her iki gözü de enüklee edin ve korneaları izole edin. Enjekte edilmemiş korneayı kontrol olarak toplayın.
- Endotel hücrelerini tanımlamak için her iki korneayı da üretici talimatlarına göre% 0.5 Alizarin Red S ile boyayın.
- Endotel hücrelerinin alizarin-kırmızı boyamasını görüntülemek için ışık mikroskobu altında ve kontrol olarak enjekte edilmeyen korneaya kıyasla Hoechst boyamasını gözlemlemek için floresan mikroskobu altında inceleyin.
Sonuçlar
Sprague Dawley sıçanlarına, yukarıda tarif edilen protokole göre intrakameral olarak 5 μL tripan mavisi enjekte edildi. Enjeksiyondan hemen sonra yarık lamba muayenesi, haznenin tripan mavisi ile boyandığını gösterdi, bu da enjekte edilen materyalin ön kamaraya ulaştığını gösterdi (Şekil 3). Ayrıca, ön kamara derinliği sağlamdı, bu da enjeksiyonun sulu hümör sızıntısına ve odanın sığlaşmasına neden olmadığını düşündürdü.

Şekil 3: İntrakameral enjeksiyonu takiben sağlam ön kamara. Tripan mavisi, farenin ön odasına enjekte edildi. Yarık mikroskobu incelemesi, ön kamarada sızıntı veya sığlık olmaksızın tripan mavisinin varlığını gösterir. Ölçek çubuğu = 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Daha sonra, DNA'yı bağlayan ve hücre çekirdeğini boyayan hücre geçirgen bir floresan boya olan Hoechst, tarif edilen intrakameral enjeksiyon yolu ile verilen ilaçların biyoyararlanımını değerlendirmek için enjekte edildi. Hoechst'in endotel hücreleri tarafından alımı, enjeksiyondan 15 dakika sonra korneaları izole ederek ve floresan mikroskobu altında gözlemleyerek değerlendirildi. Endotel hücrelerini tanımlamak için kornealar, endotel hücre tabakasının hücreler arası sınırlarını boyayan Alizarin Red S ile boyandı. Kontrol olarak, aynı sıçanın enjekte edilmemiş gözü incelendi. Sonuçlarımız, enjeksiyondan sonra endotel hücre tabakasının sağlam olduğunu ve açıklanan prosedürün endotelyuma zarar vermediğini desteklemektedir. Ayrıca, endotel hücreleri Hoechst nükleer boyaması için pozitifti ve intrakameral enjeksiyonu takiben enjekte edilen Hoechst'in alımını gösterdi (Şekil 4).
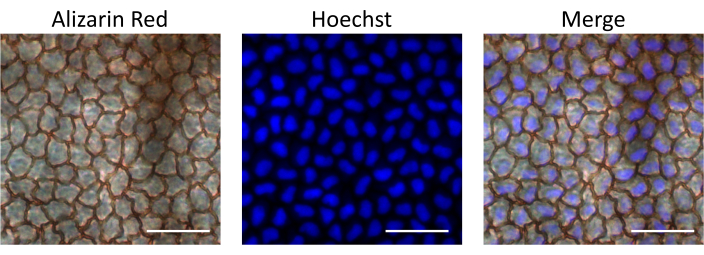
Şekil 4: Endotel hücre tabakasına intrakameral olarak enjekte edilen materyalin biyoyararlanımı. Hoechst, farenin ön odasına enjekte edildi. Kornea enjeksiyondan 15 dakika sonra izole edildi, endotel hücrelerini gözlemlemek için Alizarin Red S ile boyandı ve Hoechst boyamasını gözlemlemek için floresan mikroskop altında görüntülendi. Bindirme görüntüleri, kornea endotel hücrelerinde nükleer Hoechst boyamasını göstermektedir. Ölçek çubukları = 50 μM. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Klinik öncesi araştırma modelleri, bulguların güvenilirliğini ve uygulanabilirliğini sağlamak için kontrollü ve tekrarlanabilir bir ortam sağlamalıdır. Oftalmoloji araştırmalarında, göz enjeksiyon modelleri, hastalık modellerinin oluşturulmasından, yeni tedavilerin test edilmesine ve doku reaksiyonlarının ve potansiyel yan etkilerin değerlendirilmesine kadar çeşitli araştırma yönlerinde yaygın olarak kullanılmaktadır.
İntrakameral enjeksiyonlar, deneysel oftalmolojide yaygın bir teknik olarak hizmet eder ve dış oküler doku bariyerlerini atlarken bileşiklerin sulu mizaha doğrudan verilmesini kolaylaştırır5. İntrakameral enjeksiyon yoluyla bu hedefe yönelik yaklaşım, ilacın optimal bir konsantrasyonunun lens, trabeküler ağ veya kornea endotelyum gibi amaçlanan etki bölgesine ulaşmasını sağlar ve böylece terapötik faydaları en üst düzeye çıkarır.
Küçük kemirgenlerde intrakameral enjeksiyonların gerçekleştirilmesi, deneysel tekrarlanabilirliği ve başarıyı etkileyebilecek çeşitli teknik zorluklar sunar. İlk olarak, kemirgen gözünün küçük boyutları, oküler yapılara zarar vermeden erişim ve manipülasyonda zorluklar yaratır. Sıçanlar, bu bağlamda, daha büyük gözleri nedeniyle farelere göre bazı avantajlar sunar. İkincisi, lensin kapalı ön kamaradaki konumlandırılması, enjeksiyon bölgesine giden yolu tıkayabilir. İnsanlar da dahil olmak üzere diğer memelilerle karşılaştırıldığında, sıçanların çıkıntılı veya belirgin olduğu bilinen bir merceği vardır ve bu da göze göre nispeten büyük boyutuna katkıda bulunur (Şekil 1). Ek olarak, sıçan merceği, insan merceğinde görülen esneklikten yoksundur. Sonuç olarak, lensin etrafında hasara neden olmadan gezinmek için enjeksiyon iğnesinin dikkatli bir şekilde manevra yapması gerekir.
Manipülasyon sırasında doku hasarı, ön kamaranın sığlaşması, göz içi basıncının artması, iltihaplanma veya ön üveit, endotel hücrelerinde hasar, katarakt oluşumu, diğer yapısal değişiklikler veya deformiteler ve enfeksiyon riski gibi çeşitli komplikasyonlara yol açabilir. Bu zorluklar, küçük kemirgen modellerinde intrakameral enjeksiyonlar yapılırken kesin tekniklere ve anatomik farklılıkların dikkatli bir şekilde değerlendirilmesine olan ihtiyacı vurgulamaktadır.
Bu protokolde tarif edilen intrakameral enjeksiyon tekniği, enjeksiyon işlemi sırasında oküler dokulara zarar verme riskini en aza indirmek için tasarlanmıştır. Yöntem, minimum sürtünme direnci ile girişi kolaylaştıran, ön odaya kendinden sızdırmaz bir tünel oluşturmayı içerir. Ameliyat sonrası hipotoni ve sıvı sızıntısı riskini azaltmak ve göz kapaklarından ve kirpiklerden mikroorganizmaların neden olduğu enfeksiyonu önlemek için iyi kapatılmış bir kesi çok önemlidir. Kesinin açısı ve uzunluğu, yara dinamiği, yan etkilerin gelişimi ve sonraki iyileşme için kritik öneme sahiptir. Çok büyük kesiler görme eksenini opaklaştırabilir ve kornea strialarına veya ödemine neden olabilirken, kısa kesiler ön kamarayı dengesizleştirebilir ve iris prolapsusuna neden olabilir. Kornea düzlemi eksenine yakın bir açıda bir insizyon yapılması, ilgili riskler olmadan uzun bir tek düzlemli tünel oluşturulmasına izin verir. Daha da önemlisi, iğnenin kılavuzlu uzun bir tünel aracılığıyla ön kamaraya nüfuz etmesi, hassasiyeti artırarak lense yanlışlıkla dokunma olasılığını azaltır. Ek olarak, periferik insizyonların tercih edildiği insanlarda enjeksiyonun aksine, sıçanlarda tünel, ön kamaranın en derin olduğu merkezi korneada gerçekleştirilir. Deneysel doğrulama, bu yöntemin sulu hümör sızıntısı veya ön kamarada sığlaşma yaşamadan ve lense dokunmadan enjeksiyonlara izin verdiğini doğruladı.
Önceki çalışmalar, sıçanlarda ön kamaraya enjeksiyon için çeşitli yöntemler tanımlamıştır. Örneğin, Rosenstein grubu birkaç çalışmada korneoskleral limbus yoluyla ön kamaraya enjeksiyonu tanımlamıştır. 20 μL sıvının enjeksiyonu, haznenin derinliğini kademeli olarak arttırdı ve böylece iğneyi iristen ayırdı, bu da iğnenin lens ile temasını önlemeyi destekler. Enjeksiyonun yan etkileri geçici kornea ödemi ve yaklaşık% 5 katarakt insidansı olarak bildirilmiştir 14,15,16. Matsumoto ve ark. bir glokom modeli üretmek için sıçanlarda intrakameral bir mikroboncuk enjeksiyon tekniği tanımladılar. Yazarlar, tek aşamalı bir insizyon kullandılar ve 34 G'lik bir iğne kullanarak bir sklerokorneal tünel oluşturdular ve bu tünel ön kamaraya eğim şeklinde yerleştirildi. Yazarlar kornea veya irise çarpmaktan kaçındıklarını bildirdiler ve enjeksiyonlar sırasında endotel tabakasına zarar veren sadece birkaç vaka (incelenen hayvanların% <7'si) ile hiçbir enflamatuar olay kaydetmediler. Bununla birlikte, yazarlar bu modifiye enjeksiyonun tek başına ön kamaradan önemli bir sızıntıyı ve subkonjonktival boşluğa geri akışı önlemek için yeterli olmadığını açıkladılar. Bunun üstesinden gelmek için, dağıtıcı oftalmik viskozcerrahi cihazı (OVD; Viscoat) enjekte edildi. Bu, enjeksiyondan 4 hafta sonrasına kadar önemli ölçüde yüksek göz içi basıncı (GİB) seviyeleri ile sonuçlandı17. Benzer şekilde, Liu ve ark. limbus boyunca irise paralel olarak ön kamaraya yerleştirilen 32 G'lik bir iğne kullanarak intrakameral enjeksiyonu tanımladılar ve kendi kendine sızdırmaz bir kornea tünelioluşturdular 18. Yazarlar 3 μL sodyum hyaluronik asit hidrojel enjekte ettiler ve ön kamaradan sızıntıyı en aza indirmek için enjeksiyon bölgesini sıkıştırmak için bir pamuklu çubuk kullanıldı. Yüksek moleküler ağırlıklı jelin ön kamarada tutulduğu ve trabeküler ağörgüsü 18 boyunca sulu mizah çıkışını bloke ettiği tarif edildi. Burada tarif edilen modifiye intrakameral enjeksiyon yönteminin, viskoelastik ajanlar olmadan enjeksiyonu tolere etmesi ve bu nedenle çok çeşitli araştırma uygulamalarına uygulanabilir olması dikkat çekicidir. Bununla birlikte, bu çalışma 5 μL'den fazla olmayan bir hacimde sıvı çözeltilerin enjeksiyonu ile sınırlı olduğundan, en uygun tekniği belirlemek için özel araştırma amaçları için enjeksiyon yöntemlerinin ve enjekte edilen malzemelerin kesin bir karşılaştırması yapılmalıdır.
İntrakameral enjeksiyonların klinik uygulaması çeşitli ve kapsamlıdır. Örneğin, postoperatif enfeksiyonu ve endoftalmiyi önlemek için profilaktik bir önlem olarak katarakt ameliyatları sırasında sefuroksim ve moksifloksasin gibi kortikosteroidlerin ve antibiyotiklerin intrakameral uygulaması yaygındır 19,20,21,22,23,24,25. Rutin katarakt ameliyatları sırasında lokal anestezi ve midriyazis için göz içi doğum da kullanılmaktadır26,27. Ayrıca, glokom tedavisi, aköz mizah çıkışını artıran prostaglandin analogları veya muskarinik agonistler gibi göz içi basıncını azaltan çeşitli intrakameral olarak verilen ilaçların, skar ve fibrozisi önlemek için mitomisin C gibi antifibrotik ajanların ve neovasküler glokom için anti-vasküler endotelyal büyüme faktörü (anti-VEGF) ajanlarının kullanımını içerir 28,29,30. Bu çok çeşitli intrakameral tedaviler, çeşitli oftalmik durumların ele alınmasında ve hasta sonuçlarının iyileştirilmesindeki önemli rollerini yansıtmaktadır.
Burada tarif edilen intrakameral enjeksiyon yöntemi, intrakameral enjeksiyonların kapsamlı klinik uygulamalarını ilerletmeyi amaçlayan çeşitli klinik öncesi çalışmalar için avantajlı olacaktır. Örneğin, çeşitli ilaçların etkinliğini, optimal dozajlarını, zamanlamasını ve uzun vadeli sonuçlarını belirlemek için sıçan modellerinde intrakameral enjeksiyonun kullanılması, klinik çalışmalara ilerlemeden önce çok önemli bir ilk adımdır. Bu tür çalışmalarda, enjeksiyon tekniğinin hassasiyetinin ve tekrarlanabilirliğinin iyileştirilmesi, başarılı başarıların ve çalışma ilerlemesinin anahtarı olacaktır.
Ayrıca, tarif edilen intrakameral enjeksiyon yöntemi, ön kamaraya vektörler veya kimyasallar vererek farklı oküler patolojilerin deneysel modellerini oluşturmak için kullanılabilir. Bu tür deneysel modeller, hastalık mekanizmalarını araştırmak ve yeni tedaviler geliştirmek için anahtardır. Örneğin, kademeli görme kaybına neden olan ilerleyici bir kornea hastalığı olan Fuchs endotelyal distrofisi (FED), bir tedaviden yoksundur31. Birincil yönetim, genellikle geçici ödemin hafifletilmesi veya göz yağlanması için topikal ilaçlar yoluyla semptomların giderilmesini ve izlenmesini içerir. Hastalığın ilerlemesi veya ciddi görme bozukluğu durumlarında kornea nakli (endotelyal keratoplasti) gerekli bir müdahale haline gelir. Potansiyel olarak kornea nakline alternatifler sunan FED için yeni tedavi seçenekleri geliştirmeyi amaçlayan araştırmalar oldukça garantilidir. Kornea veya konjonktiva 1,2,3 yoluyla verilen ilaçların sınırlı biyoyararlanımı göz önüne alındığında, intrakameral uygulama endotel tabakasını tedavi etmek için avantajlı bir yol olarak ortaya çıkmaktadır. İntrakameral enjeksiyonun deneysel modelleri, FED için yeni terapötik yaklaşımların geliştirilmesinde çok önemli bir rol oynamaktadır. İntrakameral enjeksiyon için burada açıklanan yaklaşımın kullanılması, enjekte edilen materyalin kornea endotel tabakasına alımını indükleyebilir. Bu yöntemin intrakameral enjeksiyonda uygulanması, yüksek hassasiyet ve tekrarlanabilirlik ile FED tedavisi için deneysel modellerin oluşturulmasına olanak tanır. Bu sadece FED anlayışımızı ilerletmeye katkıda bulunmakla kalmaz, aynı zamanda hedefli ve etkili terapötik müdahaleler geliştirmek için yollar açar.
Özet olarak, burada tarif edilen, klinik öncesi oftalmoloji araştırmalarını iyileştirmek ve oküler patolojiler için yeni terapötik olasılıkların geliştirilmesine katkıda bulunmak için değerli olan, düşük yan etki riski olan sıçanlarda intrakameral enjeksiyon için optimize edilmiş bir prosedürdür.
Açıklamalar
Marcovich A. L., Steba Biotech, Yeda Weizmann, EyeYon Medical ve Mor Isum markalarında patentlere sahiptir ve EyeYon Medical ve Johnson & Johnson için danışmandır. Diğer tüm yazarların rekabet eden çıkarları yoktur.
Teşekkürler
Bu araştırma, İsrail Bilim Vakfı'nın 2670/23 ve 1304/20 no'lu hibeleri ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alizarin Red | Alpha Aesar | 042040.5 | |
| Buprenorphine | Richter pharma | 102047 | |
| Dexamethasone 0.1% | Fisher Pharmaceutical | 393102-0413 | |
| Hamilton glass syringe 10 μL | Hamilton Co. | 721711 | |
| Hoeschst | Merck | B2261 | |
| Ketamine | Bremer pharma GMBH (medimarket) | 17889 | |
| Ofloxacin 0.3% eye drops | Allergan | E92170 | |
| Oxybuprocaine Hydrochloride 0.4% | Fisher Pharmaceutical | N/A | |
| Pentobarbital sodium 200 mg/mL | CTS | N/A | |
| Slit microscope | Haag-streit bern | b-90019115 | |
| Sprague-Dawley Rats | Envigo | N/A | |
| Stiletto blade 31 G 0.8 mm | Tecfen medical (skymed) | QKN2808 | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Trypan Blue | Sartorius | 03-102-1B | |
| Xylazine | Eurovet Animal Health | 615648 |
Referanslar
- Ramsay, E., et al. Corneal and conjunctival drug permeability: Systematic comparison and pharmacokinetic impact in the eye. Eur J Pharm Sci. 119, 83-89 (2018).
- Cholkar, K., Dasari, S. R., Pal, D., Mitra, A. K. Eye: Anatomy, Physiology and Barriers to Drug Delivery. Ocular Transporters and Receptors. , Elsevier, Woodhead Publishing. (2013).
- Prausnitz, M. R. Permeability of cornea, sclera, and conjunctiva: A literature analysis for drug delivery to the eye. J Pharm Sci. 87 (12), 1479-1488 (1998).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the Eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 269(2020).
- Gautam, M., et al. Intracameral drug delivery: A Review of agents, indications, and outcomes. J Ocul Pharmacol Ther. 39 (2), 102-116 (2023).
- Shah, T. J., Conway, M. D., Peyman, G. A. Intracameral dexamethasone injection in the treatment of cataract surgery induced inflammation: design, development, and place in therapy. Clin Ophthalmol. 12, 2223-2235 (2018).
- Perlman, R. L. Mouse models of human disease: An evolutionary perspective. Evol Med Public Health. 2016 (1), 170-176 (2016).
- Chawla, S., Jena, S. The Anatomy and Physiology of Laboratory Rat.Essentials of Laboratory Animal Science: Principles and Practices. , Springer. Singapore. (2021).
- Lundström, M., Wejde, G., Stenevi, U., Thorburn, W., Montan, P. Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology. 114 (5), 866-870 (2007).
- Fine, I. H. Clear corneal incisions. Int Ophthalmol Clin. 34 (2), 59-72 (1994).
- Herretes, S., Stark, W. J., Pirouzmanesh, A., Reyes, J. M. G., McDonnell, P. J., Behrens, A. Inflow of ocular surface fluid into the anterior chamber after phacoemulsification through sutureless corneal cataract wounds. Am J Ophthalmol. 140 (4), 737-740 (2005).
- Masket, S., Belani, S. Proper wound construction to prevent short-term ocular hypotony after clear corneal incision cataract surgery. J Cataract Refract Surg. 33 (3), 383-386 (2007).
- Taban, M., Rao, B., Reznik, J., Zhang, J., Chen, Z., McDonnell, P. J. Dynamic morphology of sutureless cataract wounds - Effect of incision angle and location. Surv Ophthalmol. 49, Suppl 2 S62-S72 (2004).
- Belforte, N., Sande, P. H., de Zavalía, N., Dorfman, D., Rosenstein, R. E. Therapeutic benefit of radial optic neurotomy in a rat model of glaucoma. PLoS One. 7 (3), e34574(2012).
- Moreno, M. C., et al. A new experimental model of glaucoma in rats through intracameral injections of hyaluronic acid. Exp Eye Res. 81 (1), 71-80 (2005).
- Belforte, N., Sande, P., de Zavalía, N., Knepper, P., Rosenstein, R. Effect of chondroitin sulfate on intraocular pressure in rats. Invest Ophthalmol Vis Sci. 51 (11), 5768-5775 (2010).
- Matsumoto, Y., Kanamori, A., Nakamura, M., Negi, A. Rat chronic glaucoma model induced by intracameral injection of microbeads suspended in sodium sulfate-sodium hyaluronate. Jpn J Ophthalmol. 58 (3), 290-297 (2014).
- Liu, Y., et al. A novel rat model of ocular hypertension by a single intracameral injection of cross-linked hyaluronic acid hydrogel (Healaflow® ). Basic Clin Pharmacol Toxicol. 127 (5), 361-370 (2020).
- Bowen, R. C., et al. Comparative analysis of the safety and efficacy of intracameral cefuroxime, moxifloxacin and vancomycin at the end of cataract surgery: a meta-analysis. Br J Ophthalmol. 102 (9), 1268-1276 (2018).
- Kato, A., et al. Prophylactic antibiotics for postcataract surgery endophthalmitis: a systematic review and network meta-analysis of 6.8 million eyes. Sci Rep. 12 (1), 17416(2022).
- Wang, M., Liu, Y., Dong, H. Effect of cefuroxime intracameral injection antibiotic prophylactic on postoperative endophthalmitis wound post-cataract: A meta-analysis. Int Wound J. 20 (5), 1376-1383 (2023).
- Katz, G., et al. Intracameral cefuroxime and the incidence of post-cataract endophthalmitis: an Israeli experience. Graefes Arch Clin Exp Ophthalmol. 253 (10), 1729-1733 (2015).
- Lipnitzki, I., Ben Eliahu, S., Marcovitz, A. L., Ezov, N., Kleinmann, G. Intraocular concentration of moxifloxacin after intracameral injection combined with presoaked intraocular lenses. J Cataract Refract Surg. 40 (4), 639-643 (2014).
- Colleaux, K. M., Hamilton, W. K., Morgan, R. A. Effect of prophylactic antibiotics and incision type on the incidence of endophthalmitis after cataract surgery. Can J Ophthalmol. 35 (7), 373-378 (2000).
- Libre, P. E., Della-Latta, P., Chin, N. X. Intracameral antibiotic agents for endophthalmitis prophylaxis: A pharmacokinetic model. J Cataract Refract Surg. 29 (9), 1791-1794 (2003).
- Carino, N. S., Slomovic, A. R., Chung, F., Marcovich, A. L. Topical tetracaine versus topical tetracaine plus intracameral lidocaine for cataract surgery. J Cataract Refract Surg. 24 (12), 1602-1608 (1998).
- Minakaran, N., Ezra, D. G., Allan, B. D. Topical anaesthesia plus intracameral lidocaine versus topical anaesthesia alone for phacoemulsification cataract surgery in adults. Cochrane Database Syst Rev. 7 (7), CD005276 (2020).
- Dan-Ni, W., Li-Dian, H., Zhi-Guo, P., Qiang, W., Lei, S. Intracameral anti-VEGF injection for advanced neovascular glaucoma after vitrectomy with silicone oil tamponade. Int J Ophthalmol. 14 (3), 129-135 (2021).
- Bhagat, P. R., Agrawal, K. U., Tandel, D. Study of the effect of injection bevacizumab through various routes in neovascular glaucoma. J Curr Glaucoma Pract. 10 (2), 39-48 (2016).
- Al-Qaysi, Z. K., Beadham, I. G., Schwikkard, S. L., Bear, J. C., Al-Kinani, A. A., Alany, R. G. Sustained release ocular drug delivery systems for glaucoma therapy. Expert Opin Drug Deliv. 20 (7), 905-919 (2023).
- Eghrari, A. O., Gottsch, J. D. Fuchs' corneal dystrophy. Expert Rev Ophthalmol. 5 (2), 147-159 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır