Method Article
Injeção intracameral em ratos com baixo risco de efeitos adversos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve uma técnica para injeção intracameral em ratos usando uma incisão central na córnea e um longo túnel na câmara anterior. Este método de injeção minimiza o risco de induzir danos inadvertidos ao tecido e, assim, melhora a precisão e a reprodutibilidade.
Resumo
A injeção intracameral é uma rotina de administração padrão em oftalmologia. A aplicação da injeção intracameral em roedores para pesquisa é desafiadora devido às dimensões limitantes e anatomia do olho, incluindo o pequeno volume de humor aquoso, a curvatura do cristalino e a espessura do cristalino. Danos potenciais durante injeções intracamerais introduzem efeitos adversos e variabilidade experimental. Este protocolo descreve um procedimento para injeção intracameral em ratos, permitindo precisão e reprodutibilidade.
Ratos Sprague-Dawley foram usados como modelos experimentais. Como a posição do cristalino em ratos se projeta para a câmara anterior, a injeção da periferia, como feito em humanos, é desfavorável. Portanto, uma incisão é criada na região central da córnea usando uma lâmina de estilete de calibre 31 de 0,8 mm para formar um túnel autovedante na câmara anterior. Uma incisão em um ângulo próximo ao plano permite criar um túnel longo, o que minimiza a perda de humor aquoso e o raso da câmara anterior. Uma nanoagulha de calibre 34 é inserida no túnel para injeção. Isso permite a penetração com resistência mínima ao atrito e evita tocar na lente. A injeção de azul de tripano permite visualizar por microscopia de fenda a presença do corante na câmara anterior e excluir vazamentos. A biodisponibilidade para a camada endotelial da córnea é demonstrada pela injeção do corante Hoechst, que corou os núcleos das células endoteliais da córnea após a injeção.
Em conclusão, este protocolo implementa um procedimento para injeção intracameral precisa em ratos. Este procedimento pode ser usado para entrega intracameral de vários medicamentos e compostos em modelos experimentais de ratos, aumentando a eficiência e a reprodutibilidade da pesquisa oftalmológica.
Introdução
A biodisponibilidade dos compostos administrados por administração tópica à superfície do olho é muito limitada, normalmente <5%1. Os compostos administrados por colírios são eliminados principalmente por drenagem, lacrimejamento induzido, renovação do fluido lacrimal e absorção conjuntival. Além disso, a permeação de compostos através da superfície ocular é altamente restrita pela barreira córnea-conjuntiva 1,2,3. A córnea é composta por três camadas principais: o epitélio mais externo, o estroma intermediário e o endotélio mais interno. O epitélio superficial da córnea é interconectado por fortes junções apertadas e cria alta resistência paracelular, que é a principal barreira à permeabilidade da substância. Múltiplas camadas de epitélio limitam ainda mais a permeação de moléculas hidrofílicas e grandes através dos espaços intercelulares do epitélio da córnea. Sucedendo ao epitélio, o estroma é composto por fibras colágenas e contém poros aquosos. Em contraste com o epitélio da córnea, o estroma permite a movimentação de drogas hidrofílicas; no entanto, é muito impermeável a compostos lipofílicos 1,2,3. Juntos, o epitélio da córnea e as camadas estromais apresentam grandes barreiras teciduais que limitam a absorção do fármaco. O endotélio da córnea não é considerado como restritivo do transporte de medicamentos.
Alternativa à via de entrega da córnea é a via conjuntival. A conjuntiva é uma camada multiepitelial que cobre o lado interno das pálpebras e a parte anterior da esclera. A conjuntiva é caracterizada por menos junções apertadas do que o epitélio da córnea, permitindo melhor permeabilidade de drogas hidrofílicas. No entanto, a vascularização da conjuntiva resulta na absorção sistêmica de uma grande fração das moléculas administradas, novamente limitando muito a biodisponibilidade dos compostos entregues à câmara anterior 1,2. Uma maneira eficiente de contornar as barreiras externas de permeabilidade ocular é entregar o medicamento diretamente na região de interesse. Por exemplo, a injeção intravítrea é comum para entrega no humor vítreo4. Da mesma forma, a injeção intracameral é utilizada para entrega na câmara anterior5. O estabelecimento de uma concentração eficiente na câmara anterior é fundamental para várias situações clínicas, como o tratamento da infecção por injeção intracameral de antibióticos e tratamentos anti-inflamatórios pós-operatórios em cirurgias de catarata. Apesar da vantagem da biodisponibilidade aprimorada da substância concedida pela injeção intracameral, existem grandes preocupações de segurança que devem ser consideradas. Por exemplo, a injeção intracameral de drogas pode induzir aumento da pressão intraocular, síndrome tóxica do segmento anterior e síndrome tóxica de destruição de células endoteliais 5,6. É, portanto, essencial avaliar cuidadosamente em estudos pré-clínicos a eficácia e segurança dos medicamentos administrados por injeções intracamerais para maximizar a eficiência do tratamento e minimizar possíveis efeitos adversos nos pacientes.
Modelos animais experimentais são indispensáveis em estudos pré-clínicos para investigar novos tratamentos. Pequenos roedores, como camundongos e ratos, são os animais de laboratório mais comumente utilizados para tais fins. Esses animais exibem inúmeras semelhanças com a anatomia e fisiologia humanas, fornecendo informações valiosas. Além disso, seu uso é economicamente vantajoso devido ao seu pequeno tamanho, facilidade de manutenção, gestação rápida e capacidade de produzir um grande número de descendentes7.
Apesar do uso generalizado de pequenos roedores em modelos de doenças oculares, suas dimensões oculares e anatomia únicas representam desafios significativos durante as manipulações experimentais. Por exemplo, procedimentos como injeções intracamerais, que são relativamente simples em humanos, tornam-se tecnicamente exigentes em camundongos e ratos. Os desafios decorrem de fatores como o pequeno volume de humor aquoso, o cristalino relativamente grande e inflexível, o posicionamento obstrutivo e a curvatura do cristalino dentro dos olhos dos roedores (Figura 1)8. Esses desafios aumentam o risco de danos durante injeções intracamerais em roedores, levando a potenciais efeitos adversos e introduzindo variabilidade experimental que pode afetar a validade das conclusões do estudo. Em nossa pesquisa, desenvolvemos com sucesso um procedimento para injeção intracameral segura em ratos. A técnica envolve a criação de um túnel longo, plano e autovedante na córnea para a câmara anterior. Este método não apenas garante precisão, mas também aumenta a reprodutibilidade experimental, abordando os problemas associados às técnicas de injeção em pequenos roedores.
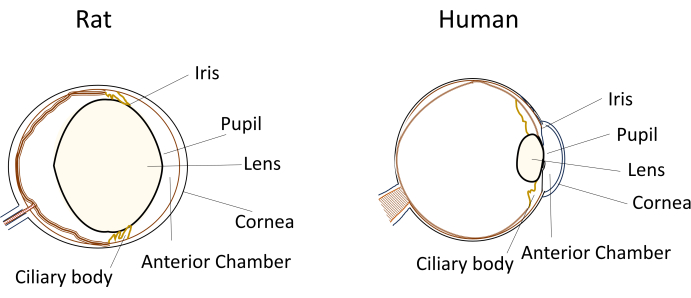
Figura 1: Representação esquemática das características anatômicas do segmento anterior dos olhos de ratos e humanos. Clique aqui para ver uma versão maior desta figura.
Protocolo
Os experimentos do protocolo foram aprovados pelo Comitê Nacional de Permissão - para ciência animal e cumprem a Declaração ARVO o uso de animais em pesquisas oftalmológicas e visuais. Ratos Sprague-Dawley, fêmeas, com idade entre 8 e 10 semanas, foram utilizados para o presente estudo e foram expostos a ciclos claro-escuro de 12/12 h. Os animais foram obtidos de uma fonte comercial (ver Tabela de Materiais).
1. Preparação animal
- Prepare uma mistura anestésica de cetamina (80 mg / kg de peso corporal em 0,8 mL) e xilazina (4 mg / kg de peso corporal em 0,2 mL) e injete-a por via intraperitoneal em uma única injeção para anestesiar os ratos.
- Injete o analgésico buprenorfina (0,03 mg / kg) por via intraperitoneal em uma única injeção.
- Aplique anestésico oftálmico tópico oxibuprocaína a 0,4% em ambos os olhos.
2. Criando um túnel de córnea autovedante
- Estabilize o olho segurando a esclera superior na linha média vertical ao lado da junção corneoescleral com uma pinça oftálmica cirúrgica.
- Sob um microscópio cirúrgico, coloque uma lâmina estéril de estilete de 0,8 mm, 31 G na região paracentral da córnea na linha média vertical (acima do centro da pupila) em uma posição plana em um ângulo o mais próximo possível da horizontal (Figura 2).
- Nesta posição, puncione a córnea para fazer uma incisão e criar um túnel longo (2-3 mm) até penetrar na área central da câmara anterior. Evite tocar na lente (Figura 2).
NOTA: Um túnel bem-sucedido não induzirá vazamento do humor aquoso e superficialidade da câmara anterior. - Aplique ofloxacina tópica a 0,3% e dexametasona a 0,1% no olho injetado.
- Examinar sob microscopia de fenda da seguinte forma.
- Observe a profundidade da câmara anterior do olho injetado em comparação com o olho não injetado.
NOTA: A profundidade deve ser semelhante. - Observe a lente do olho injetado em comparação com o olho não injetado.
NOTA: A lente deve estar clara. A opacidade pode refletir danos ao cristalino durante o procedimento cirúrgico.
- Observe a profundidade da câmara anterior do olho injetado em comparação com o olho não injetado.

Figura 2: Representação esquemática da lâmina e do ângulo e posição da incisão. Clique aqui para ver uma versão maior desta figura.
3. Opção 1: Injeção intracameral de azul de tripano para avaliar a injeção bem-sucedida na câmara anterior
- Carregue 5 μL de azul de tripano em uma seringa Hamilton de vidro estéril de 10 μL com uma agulha romba de 34 G.
NOTA: A injeção de azul de tripano é descrita como um meio de avaliar o sucesso da injeção durante os estágios de calibração ou configuração do modelo. Nos ambientes experimentais, a seringa pode ser carregada com uma solução do composto de sua escolha. - Insira a agulha da seringa carregada através do túnel criado na seção 2 na câmara anterior.
- Injete e segure a agulha no lugar após a injeção por 2-3 segundos até que todo o fluido desapareça.
- Remova a agulha puxando-a suavemente e lentamente para evitar vazamento do túnel da córnea.
- Examinar sob microscopia de fenda. Avalie a profundidade da câmara anterior para excluir rasos e verifique a presença de azul de tripano na câmara anterior.
- Repita o exame de fenda após 24 h, 48 h e 72 h.
4. Opção 2: injeção intracameral de Hoechst para avaliar a biodisponibilidade do material injetado na camada de células endoteliais
- Coloque 5 μL de Hoechst em uma seringa Hamilton de vidro estéril de 10 μL com uma agulha romba de 34 G.
NOTA: A injeção de Hoechst é descrita como um meio de avaliar a biodisponibilidade do material injetado por absorção na camada de células endoteliais e é útil durante os estágios de calibração ou configuração do modelo. Nos ambientes experimentais, a seringa pode ser carregada com uma solução do composto de sua escolha. - Insira a agulha da seringa carregada através do túnel criado na seção 2 na câmara anterior.
- Injete e segure a agulha no lugar após a injeção por 2-3 segundos até que todo o fluido desapareça.
- Remova a agulha puxando-a suave e lentamente para evitar vazamento da incisão do túnel da córnea.
- Aproximadamente 15-20 min após a injeção, eutanasiar os ratos por injeção intraperitoneal de 500 mg / kg de pentobarbital sódico.
- Enuclear ambos os olhos e isolar as córneas. Colete a córnea não injetada como controle.
- Pinte ambas as córneas com vermelho de alizarina S a 0,5% de acordo com as instruções do fabricante para identificar as células endoteliais.
- Examine ao microscópio óptico para obter imagens da coloração com vermelho de alizarina das células endoteliais e ao microscópio fluorescente para observar a coloração de Hoechst, em comparação com a córnea não injetada como controle.
Resultados
Ratos Sprague Dawley foram injetados intracameralmente com 5 μL de azul de tripano, de acordo com o protocolo descrito acima. O exame com lâmpada de fenda imediatamente após a injeção demonstrou que a câmara estava corada com azul de tripano, indicando que o material injetado atingiu a câmara anterior (Figura 3). Além disso, a profundidade da câmara anterior estava intacta, sugerindo que a injeção não causou vazamento de humor aquoso e superficialidade da câmara.

Figura 3: Câmara anterior intacta após injeção intracameral. O azul de tripano foi injetado na câmara anterior do rato. O exame de microscopia de fenda demonstra a presença de azul de tripano sem vazamento ou raso da câmara anterior. Barra de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.
Em seguida, Hoechst, um corante fluorescente permeável a células que se liga ao DNA e cora os núcleos das células, foi injetado para avaliar a biodisponibilidade de medicamentos administrados pela via de injeção intracameral descrita. A captação de Hoechst pelas células endoteliais foi avaliada 15 min após a injeção, isolando as córneas e observando ao microscópio fluorescente. Para identificar as células endoteliais, as córneas foram coradas com Vermelho de Alizarina S, que cora as bordas intercelulares da camada de células do endotélio. Como controle, examinamos o olho não injetado do mesmo rato. Nossos resultados demonstram que a camada de células endoteliais estava intacta após a injeção, sustentando que o procedimento descrito não causa danos ao endotélio. Além disso, as células endoteliais foram positivas para a coloração nuclear de Hoechst, demonstrando a captação do Hoechst injetado após a injeção intracameral (Figura 4).
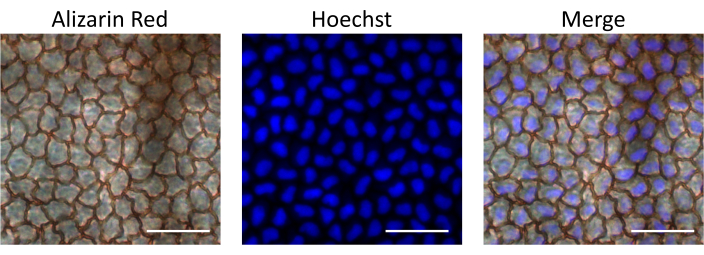
Figura 4: Biodisponibilidade do material injetado intracameralmente na camada de células endoteliais. Hoechst foi injetado na câmara anterior do rato. A córnea foi isolada 15 minutos após a injeção, corada com Vermelho de Alizarina S para observar as células endoteliais e fotografada em microscópio fluorescente para observar a coloração de Hoechst. As imagens de sobreposição demonstram coloração nuclear de Hoechst em células endoteliais da córnea. Barras de escala = 50 μM. Clique aqui para ver uma versão maior desta figura.
Discussão
Os modelos de pesquisa pré-clínica devem fornecer um ambiente controlado e reprodutível para garantir a confiabilidade e aplicabilidade dos achados. Na pesquisa oftalmológica, os modelos de injeção ocular são comumente usados em diversos aspectos de pesquisa, desde o estabelecimento de modelos de doenças, testes de novos tratamentos e avaliação de reações teciduais e potenciais efeitos adversos.
As injeções intracamerais servem como uma técnica comum em oftalmologia experimental, facilitando a entrega direta de compostos ao humor aquoso enquanto contornam as barreiras externas do tecido ocular5. Essa abordagem direcionada por meio de injeção intracameral garante que uma concentração ideal do medicamento atinja o local de ação pretendido, como o cristalino, a malha trabecular ou o endotélio da córnea, maximizando assim os benefícios terapêuticos.
A realização de injeções intracamerais em pequenos roedores apresenta vários desafios técnicos que podem afetar a reprodutibilidade e o sucesso experimental. Primeiro, as pequenas dimensões do olho do roedor apresentam dificuldades de acesso e manipulação sem causar danos às estruturas oculares. Os ratos, neste contexto, oferecem algumas vantagens sobre os camundongos devido aos seus olhos maiores. Em segundo lugar, o posicionamento da lente na câmara anterior confinada pode obstruir o caminho para o local da injeção. Em comparação com outros mamíferos, incluindo humanos, os ratos têm uma lente sabidamente saliente ou proeminente, contribuindo para seu tamanho relativamente grande em relação ao olho (Figura 1). Além disso, a lente do rato não tem a flexibilidade vista na lente humana. Como resultado, é necessária uma manobra cuidadosa da agulha de injeção para navegar ao redor da lente sem causar danos.
O dano tecidual durante a manipulação pode levar a várias complicações, incluindo superficialidade da câmara anterior, aumento da pressão intraocular, inflamação ou uveíte anterior, danos às células endoteliais, formação de catarata, outras alterações estruturais ou deformidades e risco de infecção. Esses desafios destacam a necessidade de técnicas precisas e consideração cuidadosa das diferenças anatômicas ao realizar injeções intracamerais em pequenos modelos de roedores.
A técnica de injeção intracameral descrita neste protocolo foi projetada para minimizar o risco de danos aos tecidos oculares durante o processo de injeção. O método envolve o estabelecimento de um túnel autovedante na câmara anterior, facilitando a entrada com resistência mínima ao atrito. Uma incisão bem vedada é crucial para reduzir o risco de hipotonia pós-operatória e vazamento de fluido e prevenir a infecção por microrganismos das pálpebras e cílios. O ângulo e o comprimento da incisão são críticos para a dinâmica da ferida, o desenvolvimento de efeitos adversos e a recuperação subsequente. Incisões muito grandes podem opacificar o eixo visual e induzir estrias ou edema da córnea, enquanto incisões curtas podem desestabilizar a câmara anterior e induzir prolapso da íris. A realização de uma incisão em um ângulo próximo ao eixo do plano da córnea permite a geração de um longo túnel uniplanar sem os riscos associados. É importante ressaltar que a penetração da agulha na câmara anterior através de um túnel longo guiado melhora a precisão, reduzindo a probabilidade de tocar inadvertidamente a lente. Além disso, ao contrário da injeção em humanos, onde as incisões periféricas são preferidas, o túnel em ratos é realizado na córnea central, onde a câmara anterior é mais profunda. A validação experimental confirmou que este método permite injeções sem sofrer vazamento de humor aquoso ou superficialidade da câmara anterior e sem tocar na lente.
Estudos anteriores descreveram vários métodos de injeção na câmara anterior em ratos. Por exemplo, o grupo de Rosenstein descreveu em vários estudos a injeção na câmara anterior através do limbo corneoescleral. A injeção de 20 μL de líquido aumentou progressivamente a profundidade da câmara e, assim, separou a agulha da íris, o que ajuda a evitar o contato da agulha com a lente. Os efeitos colaterais da injeção foram relatados como edema transitório da córnea e uma incidência de aproximadamente 5% de catarata 14,15,16. Matsumoto et al. descreveram uma técnica de injeção intracameral de microesferas em ratos para produzir um modelo de glaucoma. Os autores utilizaram uma incisão em um único passo, criando um túnel esclerocorneano usando uma agulha 34 G, que foi inserida na câmara anterior. Os autores relataram evitar atingir a córnea ou a íris e não observaram incidentes inflamatórios, com apenas alguns casos (<7% dos animais examinados) de danos à camada endotelial durante as injeções. No entanto, os autores descreveram que essa injeção modificada por si só não foi suficiente para evitar vazamento significativo para fora da câmara anterior e refluxo para o espaço subconjuntival. Para superar isso, uma mistura de 20 μL de microesferas com dispositivo viscocirúrgico oftálmico dispersivo (OVD; Viscoat) foi injetado. Isso resultou em níveis de pressão intraocular (PIO) significativamente elevados até 4 semanas após a injeção17. Da mesma forma, Liu et al. descreveram a injeção intracameral usando uma agulha 32 G inserida na câmara anterior paralela à íris ao longo do limbo, criando um túnel corneano autovedante18. Os autores injetaram 3 μL de hidrogel de ácido hialurônico de sódio e um cotonete foi usado para comprimir o local da injeção para minimizar o vazamento para fora da câmara anterior. O gel de alto peso molecular foi descrito como retido na câmara anterior e bloqueando a saída do humor aquoso através da malha trabecular18. Vale ressaltar que o método de injeção intracameral modificado descrito aqui tolera a injeção sem agentes viscoelásticos e, portanto, é aplicável a uma ampla gama de aplicações de pesquisa. No entanto, como este estudo se limitou à injeção de soluções líquidas em um volume não superior a 5 μL, uma comparação precisa dos métodos de injeção e dos materiais injetados deve ser realizada para fins específicos de pesquisa para determinar a técnica mais adequada.
A aplicação clínica de injeções intracamerais é diversa e extensa. Por exemplo, a administração intracameral de corticosteróides e antibióticos, como cefuroxima e moxifloxacina, é comum durante cirurgias de catarata como medida profilática para prevenir infecção pós-operatória e endoftalmite 19,20,21,22,23,24,25. O parto intraocular também é empregado para anestesia local e midríase durante cirurgias de catarata de rotina26,27. Além disso, o tratamento do glaucoma envolve o uso de vários medicamentos administrados intracameralmente que reduzem a pressão intraocular, como análogos de prostaglandinas ou agonistas muscarínicos, que aumentam o fluxo de humor aquoso, agentes antifibróticos como a mitomicina C para prevenir cicatrizes e fibrose e agentes anti-fator de crescimento endotelial vascular (anti-VEGF) para glaucoma neovascular 28,29,30. Essa gama diversificada de tratamentos intracamerais reflete seu papel crucial no tratamento de várias condições oftálmicas e na melhoria dos resultados dos pacientes.
O método de injeção intracameral descrito aqui será vantajoso para estudos pré-clínicos variados destinados a avançar nas extensas aplicações clínicas de injeções intracamerais. Por exemplo, o uso de injeção intracameral em modelos de ratos para determinar a eficácia, dosagens ideais, tempo e resultados de longo prazo de vários medicamentos é um passo inicial crucial antes de avançar para ensaios clínicos. Nesses estudos, melhorar a precisão e a reprodutibilidade da técnica de injeção será fundamental para o sucesso das conquistas e progressão do estudo.
Além disso, o método descrito de injeção intracameral pode ser empregado para gerar modelos experimentais de diferentes patologias oculares, entregando vetores ou produtos químicos à câmara anterior. Esses modelos experimentais são fundamentais para investigar os mecanismos da doença e desenvolver novos tratamentos. Por exemplo, a distrofia endotelial de Fuchs (FED), uma doença progressiva da córnea que causa perda gradual da visão, carece de cura31. O tratamento primário envolve o monitoramento e o alívio dos sintomas, geralmente por meio de medicamentos tópicos para alívio temporário do edema ou lubrificação ocular. Em casos de progressão da doença ou deficiência visual grave, o transplante de córnea (ceratoplastia endotelial) torna-se uma intervenção necessária. Pesquisas destinadas a desenvolver novas opções de tratamento para FED, potencialmente oferecendo alternativas ao transplante de córnea, são altamente justificadas. Dada a biodisponibilidade limitada dos fármacos administrados pela córnea ou conjuntiva 1,2,3, a administração intracameral surge como uma via vantajosa para o tratamento da camada endotélio. Modelos experimentais de injeção intracameral desempenham um papel crucial no desenvolvimento de novas abordagens terapêuticas para FED. O uso da abordagem aqui descrita para injeção intracameral pode induzir a captação de material injetado na camada endotelial da córnea. A implementação deste método na injeção intracameral permite a criação de modelos experimentais para o tratamento do FED com alta precisão e reprodutibilidade. Isso não apenas contribui para o avanço de nossa compreensão do FED, mas também abre caminhos para o desenvolvimento de intervenções terapêuticas direcionadas e eficazes.
Em resumo, é descrito aqui um procedimento otimizado para injeção intracameral em ratos com baixo risco de efeitos adversos, o que seria valioso para melhorar a pesquisa oftalmológica pré-clínica e contribuir para o desenvolvimento de novas possibilidades terapêuticas para patologias oculares.
Divulgações
Marcovich A. L. detém patentes na Steba Biotech, Yeda Weizmann, EyeYon Medical e Mor Isum e é consultor da EyeYon Medical e da Johnson & Johnson. Todos os outros autores não têm interesses conflitantes.
Agradecimentos
Esta pesquisa foi apoiada pelas bolsas 2670/23 e 1304/20 da Israel Science Foundation.
Materiais
| Name | Company | Catalog Number | Comments |
| Alizarin Red | Alpha Aesar | 042040.5 | |
| Buprenorphine | Richter pharma | 102047 | |
| Dexamethasone 0.1% | Fisher Pharmaceutical | 393102-0413 | |
| Hamilton glass syringe 10 μL | Hamilton Co. | 721711 | |
| Hoeschst | Merck | B2261 | |
| Ketamine | Bremer pharma GMBH (medimarket) | 17889 | |
| Ofloxacin 0.3% eye drops | Allergan | E92170 | |
| Oxybuprocaine Hydrochloride 0.4% | Fisher Pharmaceutical | N/A | |
| Pentobarbital sodium 200 mg/mL | CTS | N/A | |
| Slit microscope | Haag-streit bern | b-90019115 | |
| Sprague-Dawley Rats | Envigo | N/A | |
| Stiletto blade 31 G 0.8 mm | Tecfen medical (skymed) | QKN2808 | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Trypan Blue | Sartorius | 03-102-1B | |
| Xylazine | Eurovet Animal Health | 615648 |
Referências
- Ramsay, E., et al. Corneal and conjunctival drug permeability: Systematic comparison and pharmacokinetic impact in the eye. Eur J Pharm Sci. 119, 83-89 (2018).
- Cholkar, K., Dasari, S. R., Pal, D., Mitra, A. K. Eye: Anatomy, Physiology and Barriers to Drug Delivery. Ocular Transporters and Receptors. , Elsevier, Woodhead Publishing. (2013).
- Prausnitz, M. R. Permeability of cornea, sclera, and conjunctiva: A literature analysis for drug delivery to the eye. J Pharm Sci. 87 (12), 1479-1488 (1998).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the Eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 269(2020).
- Gautam, M., et al. Intracameral drug delivery: A Review of agents, indications, and outcomes. J Ocul Pharmacol Ther. 39 (2), 102-116 (2023).
- Shah, T. J., Conway, M. D., Peyman, G. A. Intracameral dexamethasone injection in the treatment of cataract surgery induced inflammation: design, development, and place in therapy. Clin Ophthalmol. 12, 2223-2235 (2018).
- Perlman, R. L. Mouse models of human disease: An evolutionary perspective. Evol Med Public Health. 2016 (1), 170-176 (2016).
- Chawla, S., Jena, S. The Anatomy and Physiology of Laboratory Rat.Essentials of Laboratory Animal Science: Principles and Practices. , Springer. Singapore. (2021).
- Lundström, M., Wejde, G., Stenevi, U., Thorburn, W., Montan, P. Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology. 114 (5), 866-870 (2007).
- Fine, I. H. Clear corneal incisions. Int Ophthalmol Clin. 34 (2), 59-72 (1994).
- Herretes, S., Stark, W. J., Pirouzmanesh, A., Reyes, J. M. G., McDonnell, P. J., Behrens, A. Inflow of ocular surface fluid into the anterior chamber after phacoemulsification through sutureless corneal cataract wounds. Am J Ophthalmol. 140 (4), 737-740 (2005).
- Masket, S., Belani, S. Proper wound construction to prevent short-term ocular hypotony after clear corneal incision cataract surgery. J Cataract Refract Surg. 33 (3), 383-386 (2007).
- Taban, M., Rao, B., Reznik, J., Zhang, J., Chen, Z., McDonnell, P. J. Dynamic morphology of sutureless cataract wounds - Effect of incision angle and location. Surv Ophthalmol. 49, Suppl 2 S62-S72 (2004).
- Belforte, N., Sande, P. H., de Zavalía, N., Dorfman, D., Rosenstein, R. E. Therapeutic benefit of radial optic neurotomy in a rat model of glaucoma. PLoS One. 7 (3), e34574(2012).
- Moreno, M. C., et al. A new experimental model of glaucoma in rats through intracameral injections of hyaluronic acid. Exp Eye Res. 81 (1), 71-80 (2005).
- Belforte, N., Sande, P., de Zavalía, N., Knepper, P., Rosenstein, R. Effect of chondroitin sulfate on intraocular pressure in rats. Invest Ophthalmol Vis Sci. 51 (11), 5768-5775 (2010).
- Matsumoto, Y., Kanamori, A., Nakamura, M., Negi, A. Rat chronic glaucoma model induced by intracameral injection of microbeads suspended in sodium sulfate-sodium hyaluronate. Jpn J Ophthalmol. 58 (3), 290-297 (2014).
- Liu, Y., et al. A novel rat model of ocular hypertension by a single intracameral injection of cross-linked hyaluronic acid hydrogel (Healaflow® ). Basic Clin Pharmacol Toxicol. 127 (5), 361-370 (2020).
- Bowen, R. C., et al. Comparative analysis of the safety and efficacy of intracameral cefuroxime, moxifloxacin and vancomycin at the end of cataract surgery: a meta-analysis. Br J Ophthalmol. 102 (9), 1268-1276 (2018).
- Kato, A., et al. Prophylactic antibiotics for postcataract surgery endophthalmitis: a systematic review and network meta-analysis of 6.8 million eyes. Sci Rep. 12 (1), 17416(2022).
- Wang, M., Liu, Y., Dong, H. Effect of cefuroxime intracameral injection antibiotic prophylactic on postoperative endophthalmitis wound post-cataract: A meta-analysis. Int Wound J. 20 (5), 1376-1383 (2023).
- Katz, G., et al. Intracameral cefuroxime and the incidence of post-cataract endophthalmitis: an Israeli experience. Graefes Arch Clin Exp Ophthalmol. 253 (10), 1729-1733 (2015).
- Lipnitzki, I., Ben Eliahu, S., Marcovitz, A. L., Ezov, N., Kleinmann, G. Intraocular concentration of moxifloxacin after intracameral injection combined with presoaked intraocular lenses. J Cataract Refract Surg. 40 (4), 639-643 (2014).
- Colleaux, K. M., Hamilton, W. K., Morgan, R. A. Effect of prophylactic antibiotics and incision type on the incidence of endophthalmitis after cataract surgery. Can J Ophthalmol. 35 (7), 373-378 (2000).
- Libre, P. E., Della-Latta, P., Chin, N. X. Intracameral antibiotic agents for endophthalmitis prophylaxis: A pharmacokinetic model. J Cataract Refract Surg. 29 (9), 1791-1794 (2003).
- Carino, N. S., Slomovic, A. R., Chung, F., Marcovich, A. L. Topical tetracaine versus topical tetracaine plus intracameral lidocaine for cataract surgery. J Cataract Refract Surg. 24 (12), 1602-1608 (1998).
- Minakaran, N., Ezra, D. G., Allan, B. D. Topical anaesthesia plus intracameral lidocaine versus topical anaesthesia alone for phacoemulsification cataract surgery in adults. Cochrane Database Syst Rev. 7 (7), CD005276 (2020).
- Dan-Ni, W., Li-Dian, H., Zhi-Guo, P., Qiang, W., Lei, S. Intracameral anti-VEGF injection for advanced neovascular glaucoma after vitrectomy with silicone oil tamponade. Int J Ophthalmol. 14 (3), 129-135 (2021).
- Bhagat, P. R., Agrawal, K. U., Tandel, D. Study of the effect of injection bevacizumab through various routes in neovascular glaucoma. J Curr Glaucoma Pract. 10 (2), 39-48 (2016).
- Al-Qaysi, Z. K., Beadham, I. G., Schwikkard, S. L., Bear, J. C., Al-Kinani, A. A., Alany, R. G. Sustained release ocular drug delivery systems for glaucoma therapy. Expert Opin Drug Deliv. 20 (7), 905-919 (2023).
- Eghrari, A. O., Gottsch, J. D. Fuchs' corneal dystrophy. Expert Rev Ophthalmol. 5 (2), 147-159 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados