Method Article
Внутрикамерная инъекция крысам с низким риском побочных эффектов
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает технику внутрикамерной инъекции крысам с использованием центрального разреза роговицы и длинного туннеля в переднюю камеру. Этот метод инъекции сводит к минимуму риск непреднамеренного повреждения тканей и тем самым повышает точность и воспроизводимость.
Аннотация
Внутрикамерная инъекция является стандартной процедурой введения в офтальмологии. Применение внутрикамерной инъекции у грызунов для исследований является сложной задачей из-за предельных размеров и анатомии глаза, включая небольшой объем водянистой влаги, кривизну хрусталика и толщину хрусталика. Потенциальное повреждение во время внутрикамерных инъекций приводит к неблагоприятным последствиям и экспериментальной вариабельности. Этот протокол описывает процедуру внутрикамерной инъекции крысам, обеспечивающую точность и воспроизводимость.
В качестве экспериментальных моделей использовались крысы Спрэг-Доули. Поскольку положение хрусталика у крыс выступает в переднюю камеру, введение с периферии, как это делается у человека, неблагоприятно. Таким образом, разрез создается в центральной области роговицы с помощью лезвия шпильки 31 калибра 0,8 мм, чтобы сформировать самогерметизирующийся туннель в переднюю камеру. Разрез под углом, близким к плоскому, позволяет создать длинный тоннель, что сводит к минимуму потерю водянистой влаги и обмеление передней камеры. Наноигла 34 калибра вводится в туннель для инъекции. Это обеспечивает проникновение с минимальным сопротивлением трению и позволяет избежать прикосновения к объективу. Введение трипан-синего позволяет визуализировать с помощью щелевой микроскопии наличие красителя в передней камере и исключить утечку. Биодоступность к эндотелиальному слою роговицы демонстрируется при введении красителя Hoechst, которым окрашиваются ядра эндотелиальных клеток роговицы после инъекции.
В заключение следует отметить, что в этом протоколе реализована процедура точной внутрикамерной инъекции крысам. Эта процедура может быть использована для внутрикамерной доставки различных лекарственных препаратов и соединений в экспериментальных моделях крыс, повышая эффективность и воспроизводимость офтальмологических исследований.
Введение
Биодоступность соединений, доставляемых при местном введении на поверхность глаза, сильно ограничена и обычно составляет <5%1. Соединения, вводимые глазными каплями, в основном устраняются за счет дренажа, индуцированного слезотечения, оборота слезной жидкости и всасывания конъюнктивы. Кроме того, проникновение соединений через поверхность глаза сильно ограничено роговично-конъюнктивным барьером 1,2,3. Роговица состоит из трех основных слоев: самого наружного эпителия, промежуточной стромы и самого внутреннего эндотелия. Поверхностный эпителий роговицы связан между собой прочными плотными соединениями и создает высокую парацеллюлярную резистентность, которая является основным барьером для проницаемости вещества. Множественные слои эпителия еще больше ограничивают проникновение гидрофильных и крупных молекул через межклеточные пространства эпителия роговицы. Следуя за эпителием, строма состоит из коллагеновых волокон и содержит водные поры. В отличие от эпителия роговицы, строма позволяет перемещаться гидрофильным препаратам; Однако он сильно непроницаем для липофильных соединений 1,2,3. Вместе эпителий роговицы и стромальные слои представляют собой основные тканевые барьеры, ограничивающие абсорбцию лекарственного средства. Считается, что эндотелий роговицы не ограничивает транспортировку лекарств.
Альтернативой роговичному пути доставки является конъюнктивальный путь. Конъюнктива представляет собой многоэпителиальный слой, который покрывает внутреннюю сторону век и переднюю часть склеры. Конъюнктива характеризуется меньшим количеством узких соединений, чем эпителий роговицы, что обеспечивает лучшую проницаемость гидрофильных препаратов. Однако васкуляризация конъюнктивы приводит к системной абсорбции большой фракции вводимых молекул, что также сильно ограничивает биодоступность доставляемых соединений в переднюю камеру 1,2. Эффективным способом обхода внешних барьеров проницаемости глаза является доставка препарата непосредственно в интересующую область. Например, интравитреальное введение является обычным для введения в стекловидное тело4. Аналогичным образом, внутрикамерная инъекция используется для доставки в переднюю камеру5. Установление эффективной концентрации в передней камере имеет решающее значение в различных клинических ситуациях, таких как лечение инфекции путем внутрикамерного введения антибиотиков и послеоперационное противовоспалительное лечение при операциях по удалению катаракты. Несмотря на преимущество улучшенной биодоступности вещества, обеспечиваемого внутрикамерным введением, существуют серьезные проблемы безопасности, которые следует учитывать. Например, внутрикамерное введение препарата может вызвать повышение внутриглазного давления, синдром токсического переднего сегмента и синдром токсического разрушения эндотелиальных клеток 5,6. Поэтому в доклинических исследованиях важно тщательно оценивать эффективность и безопасность лекарственных препаратов, вводимых в виде внутрикамерных инъекций, чтобы максимизировать эффективность лечения и свести к минимуму потенциальные побочные эффекты у пациентов.
Экспериментальные модели на животных незаменимы в доклинических исследованиях для изучения новых методов лечения. Мелкие грызуны, такие как мыши и крысы, являются наиболее часто используемыми лабораторными животными для таких целей. Эти животные демонстрируют множество сходств с анатомией и физиологией человека, предоставляя ценные сведения. Кроме того, их использование экономически выгодно благодаря небольшим размерам, простоте в уходе, быстрой беременности и способности производить большоеколичество потомства7.
Несмотря на широкое использование мелких грызунов в моделях глазных заболеваний, их уникальные размеры глаз и анатомия создают значительные проблемы при проведении экспериментальных манипуляций. Например, такие процедуры, как внутрикамерные инъекции, которые относительно просты у людей, становятся технически сложными у мышей и крыс. Проблемы возникают из-за таких факторов, как небольшой объем водянистой влаги, относительно большой и негибкий хрусталик, а также обструктивное расположение и кривизна хрусталика в глазах грызунов (рис. 1). Эти проблемы увеличивают риск повреждения во время внутрикамерных инъекций у грызунов, что приводит к потенциальным неблагоприятным эффектам и вносит экспериментальную вариабельность, которая может повлиять на достоверность выводов исследования. В наших исследованиях мы успешно разработали процедуру безопасной внутрикамерной инъекции крысам. Этот метод включает в себя создание длинного, плоского, самогерметизирующегося туннеля в роговице в переднюю камеру. Этот метод не только обеспечивает точность, но и повышает воспроизводимость экспериментов, решая проблемы, связанные с методами инъекций у мелких грызунов.
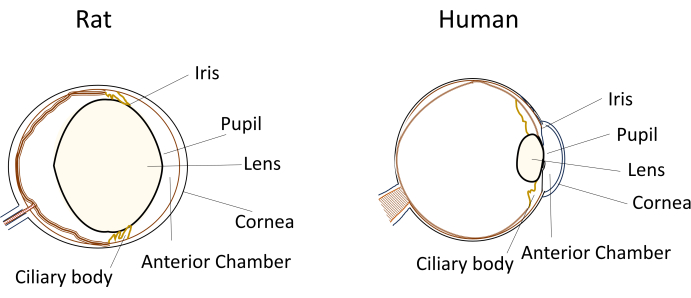
Рисунок 1: Схематическое изображение анатомических особенностей переднего сегмента глаз крысы и человека. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
Эксперименты в протоколе были одобрены Национальным комитетом по выдаче разрешений - для зоотехнии и соответствуют Заявлению ARVO об использовании животных в офтальмологических и зрительных исследованиях. Для настоящего исследования были использованы самки крыс Sprague-Dawley в возрасте 8-10 недель, которые подвергались 12-12-часовому циклу «свет-темнота». Животные были получены из коммерческого источника (см. Таблицу материалов).
1. Подготовка животных
- Приготовьте смесь анестетика из кетамина (80 мг/кг массы тела в 0,8 мл) и ксилазина (4 мг/кг массы тела в 0,2 мл) и введите ее внутрибрюшинно за одну инъекцию для обезболивания крыс.
- Вводите анальгетик бупренорфин (0,03 мг/кг) внутрибрюшинно за одну инъекцию.
- Нанесите местный офтальмотерапевтический анестетик 0,4% оксибупрокаин на оба глаза.
2. Создание самогерметизирующегося роговичного тоннеля
- Стабилизируйте глаз, удерживая верхнюю склеру по вертикальной средней линии рядом с корнеосклеральным соединением с помощью хирургических офтальмологических щипцов.
- Под хирургическим микроскопом поместите стерильное лезвие шпильки 0,8 мм и плотностью 31 G в парацентральную область роговицы по вертикальной средней линии (над центром зрачка) в плоском положении под углом, максимально приближенным к горизонтальному (рис. 2).
- В таком положении проколите роговицу, чтобы сделать разрез и создать длинный тоннель (2-3 мм) до тех пор, пока он не проникнет в центральную область передней камеры. Не прикасайтесь к объективу (Рисунок 2).
ПРИМЕЧАНИЕ: Успешный туннель не вызовет утечки водянистой влаги и обмеления передней камеры. - Нанесите внутрь внутрь глаз 0,3% офлоксацина и 0,1% дексаметазона.
- Исследовать под щелевой микроскопией можно следующим образом.
- Наблюдайте за глубиной передней камеры инъецируемого глаза по сравнению с неинъекционным глазом.
ПРИМЕЧАНИЕ: Глубина должна быть аналогичной. - Посмотрите на хрусталик инъекционного глаза по сравнению с неинъекционным глазом.
ПРИМЕЧАНИЕ: Объектив должен быть прозрачным. Помутнение может отражать повреждение хрусталика во время хирургической процедуры.
- Наблюдайте за глубиной передней камеры инъецируемого глаза по сравнению с неинъекционным глазом.

Рисунок 2: Схематическое изображение угла и положения лезвия и разреза. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Вариант 1: Внутрикамерное введение трипанового синего для оценки успешности инъекции в переднюю камеру
- Загрузите 5 μL трипанового синего в стерильный стеклянный шприц Hamilton объемом 10 μL с тупой иглой 34 G.
ПРИМЕЧАНИЕ: Инъекция трипанового синего описывается как средство оценки успешности инъекции на этапах калибровки или настройки модели. В экспериментальных условиях шприц может быть загружен раствором выбранного соединения. - Введите заряженную иглу шприца через туннель, созданный в разделе 2, в переднюю камеру.
- Введите и удерживайте иглу на месте после инъекции в течение 2-3 секунд, пока вся жидкость не исчезнет.
- Извлеките иглу, осторожно и медленно вытащив ее, чтобы избежать утечки из роговичного канала.
- Исследуйте под щелевой микроскопией. Оцените глубину залегания передней камеры, чтобы исключить обмеление и проверьте наличие трипанового синего в передней камере.
- Повторное исследование через 24 ч, 48 ч и 72 ч.
4. Вариант 2: Внутрикамерное введение Хёхста для оценки биодоступности вводимого материала в слой эндотелиальных клеток
- Загрузите 5 μL Hoechst в стерильный стеклянный шприц Hamilton объемом 10 μL с тупой иглой 34 G.
ПРИМЕЧАНИЕ: Инъекция Хёхста описывается как средство оценки биодоступности вводимого материала путем поглощения в слой эндотелиальных клеток и полезна на этапах калибровки или настройки модели. В экспериментальных условиях шприц может быть загружен раствором выбранного соединения. - Введите заряженную иглу шприца через туннель, созданный в разделе 2, в переднюю камеру.
- Введите и удерживайте иглу на месте после инъекции в течение 2-3 секунд, пока вся жидкость не исчезнет.
- Извлеките иглу, осторожно и медленно вытащив ее, чтобы избежать утечки из разреза роговичного канала.
- Примерно через 15-20 минут после инъекции усыпьте крыс путем внутрибрюшинного введения 500 мг/кг пентобарбитала натрия.
- Энуклеируйте оба глаза и изолируйте роговицу. Соберите неинъекционную роговицу в качестве контроля.
- Окрашивайте обе роговицы 0,5% Ализарин Ред S в соответствии с инструкциями производителя для выявления эндотелиальных клеток.
- Исследуйте под световым микроскопом, чтобы получить изображение ализариново-красного окрашивания эндотелиальных клеток, и под флуоресцентным микроскопом, чтобы наблюдать окрашивание по методу Хёхста, по сравнению с неинъецированной роговицей в качестве контроля.
Результаты
Крысам Sprague Dawley вводили интракамерально 5 мкл трипанового синего в соответствии с протоколом, описанным выше. Осмотр с помощью щелевой лампы сразу после инъекции показал, что камера окрашена трипановым синим, что указывает на то, что введенный материал достиг передней камеры (рис. 3). Кроме того, глубина передней камеры была неповрежденной, что позволяет предположить, что инъекция не вызвала утечку водянистой влаги и обмеление камеры.

Рисунок 3: Неповрежденная передняя камера после внутрикамерной инъекции. Трипановый синий был введен в переднюю камеру крысы. Щелевое микроскопическое исследование демонстрирует наличие трипанового синего без протекания или обмеления передней камеры. Масштабная линейка = 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Затем был введен Хёхст, проникающий в клетки флуоресцентный краситель, который связывает ДНК и окрашивает ядра клеток, для оценки биодоступности лекарств, доставляемых описанным внутрикамерным путем инъекции. Поглощение Хёхста эндотелиальными клетками оценивали через 15 минут после инъекции путем выделения роговицы и наблюдения под флуоресцентным микроскопом. Для идентификации эндотелиальных клеток роговицы окрашивали препаратом Alizarin Red S, который окрашивает межклеточные границы клеточного слоя эндотелия. В качестве контроля мы исследовали неинъекционный глаз той же крысы. Наши результаты показывают, что слой эндотелиальных клеток остался неповрежденным после инъекции, что подтверждает, что описанная процедура не вызывает повреждения эндотелия. Кроме того, эндотелиальные клетки были положительными на ядерное окрашивание Хёхста, что свидетельствует об усвоении введенного Хёхста после внутрикамеральной инъекции (рис. 4).
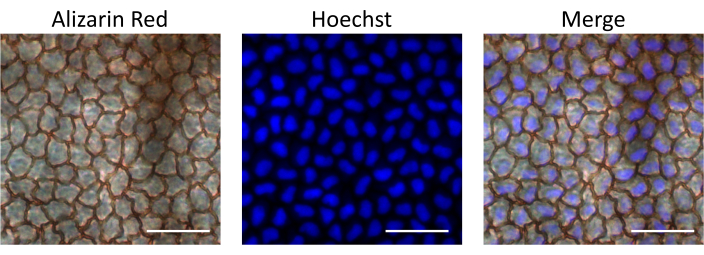
Рисунок 4: Биодоступность интракамерально вводимого материала в слой эндотелиальных клеток. Хёхст был введен в переднюю камеру крысы. Роговицу изолировали через 15 минут после инъекции, окрашивали Alizarin Red S для наблюдения за эндотелиальными клетками и визуализировали под флуоресцентным микроскопом для наблюдения за окрашиванием по Гехсту. Наложенные изображения демонстрируют ядерное окрашивание по методу Хёхста в эндотелиальных клетках роговицы. Масштабные линейки = 50 μM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Модели доклинических исследований должны обеспечивать контролируемую и воспроизводимую среду для обеспечения надежности и применимости результатов. В офтальмологических исследованиях модели глазных инъекций обычно используются в различных исследовательских аспектах, начиная от создания моделей заболеваний, тестирования новых методов лечения и заканчивая оценкой реакций тканей и потенциальных побочных эффектов.
Интракамеральные инъекции служат распространенным методом в экспериментальной офтальмологии, облегчая прямую доставку соединений в водную влагу в обход наружных барьеров глазной ткани5. Этот целенаправленный подход с помощью внутрикамерной инъекции гарантирует, что оптимальная концентрация препарата достигнет предполагаемого места действия, такого как хрусталик, трабекулярная сеть или эндотелий роговицы, тем самым максимизируя терапевтический эффект.
Выполнение внутрикамерных инъекций мелким грызунам сопряжено с рядом технических проблем, которые могут повлиять на воспроизводимость и успех эксперимента. Во-первых, малые размеры глаза грызуна создают трудности в доступе и манипуляциях без повреждения глазных структур. Крысы в этом контексте имеют некоторые преимущества перед мышами благодаря своим большим глазам. Во-вторых, расположение хрусталика в ограниченной передней камере может затруднить путь к месту инъекции. По сравнению с другими млекопитающими, включая человека, у крыс хрусталик известен как выступающий или выпуклый, что способствует его относительно большому размеру по сравнению с глазом (рис. 1). Кроме того, крысиному хрусталику не хватает гибкости, наблюдаемой в человеческом хрусталике. В результате требуется осторожное маневрирование инъекционной иглой, чтобы перемещаться вокруг линзы без нанесения повреждений.
Повреждение тканей во время манипуляции может привести к различным осложнениям, включая обветшалие передней камеры, повышение внутриглазного давления, воспаление или передний увеит, повреждение эндотелиальных клеток, образование катаракты, другие структурные изменения или деформации, а также риск инфицирования. Эти проблемы подчеркивают необходимость точных методов и тщательного учета анатомических различий при выполнении внутрикамерных инъекций на небольших моделях грызунов.
Описанная в этом протоколе методика внутрикамерного введения была разработана таким образом, чтобы свести к минимуму риск повреждения тканей глаза в процессе инъекции. Метод включает в себя создание самогерметизирующегося туннеля в переднюю камеру, облегчающего вход с минимальным сопротивлением трению. Хорошо закрытый разрез имеет решающее значение для снижения риска послеоперационной гипотонии и утечки жидкости, а также для предотвращения инфицирования микроорганизмами век и ресниц. Угол и длина разреза имеют решающее значение для динамики раны, развития побочных эффектов и последующего восстановления. Слишком большие разрезы могут помутнить зрительную ось и вызвать стрии роговицы или отек, в то время как короткие разрезы могут дестабилизировать переднюю камеру и вызвать пролапс радужной оболочки. Выполнение разреза под углом, близким к оси плоскости роговицы, позволяет создать длинный унипланарный туннель без связанных с этим рисков. Важно отметить, что проникновение иглы в переднюю камеру через управляемый длинный туннель повышает точность, снижая вероятность случайного прикосновения к линзе. Кроме того, в отличие от инъекций у людей, где предпочтительны периферические разрезы, туннель у крыс выполняется в центральной части роговицы, где передняя камера находится наиболее глубоко. Экспериментальная валидация подтвердила, что этот метод позволяет проводить инъекции без утечки водянистой влаги или обмеления передней камеры и без прикосновения к хрусталику.
В предыдущих исследованиях описывались различные методы инъекции в переднюю камеру у крыс. Например, группа Розенштейна в нескольких исследованиях описала инъекцию в переднюю камеру через корнеосклеральный лимб. Введение жидкости объемом 20 мкл постепенно увеличивало глубину камеры и тем самым отделяло иглу от радужной оболочки, что способствует предотвращению контакта иглы с линзой. Сообщалось о побочных эффектах инъекции в виде транзиторного отека роговицы и примерно 5% заболеваемости катарактой 14,15,16. Мацумото и др. описали технику внутрикамеральной инъекции микрогранул у крыс для создания модели глаукомы. Авторы использовали одноступенчатый разрез, создав склероророговый туннель с помощью иглы 34 G, которая была вставлена скосом в переднюю камеру. Авторы сообщили о том, что избегали попадания в роговицу или радужную оболочку глаза и отметили отсутствие воспалительных инцидентов, при этом было лишь несколько случаев (<7% обследованных животных) повреждения эндотелиального слоя во время инъекций. Тем не менее, авторы описали, что одной этой модифицированной инъекции было недостаточно для предотвращения значительной утечки из передней камеры и рефлюкса в субконъюнктивальное пространство. Чтобы преодолеть это, используется смесь микрогранул объемом 20 мкл с дисперсионным офтальмологическим вискохирургическим устройством (ОВД; Viscoat). Это привело к значительному повышению уровня внутриглазного давления (ВГД) в течение 4 недель после инъекции17. Аналогичным образом, Liu et al. описали внутрикамерную инъекцию с использованием иглы 32 G, введенной в переднюю камеру параллельно радужной оболочке вдоль лимба с целью создания самогерметизирующегося роговичного туннеля18. Авторы ввели 3 мкл гидрогеля гиалуроновой кислоты натрия, а ватный тампон был использован для сжатия места инъекции, чтобы свести к минимуму утечку из передней камеры. Было описано, что высокомолекулярный гель задерживается в передней камере и блокирует отток водянистой влаги через трабекулярную сеть18. Следует отметить, что описанный здесь модифицированный метод внутрикамерного впрыска допускает инъекцию без вязкоупругих агентов и поэтому применим для широкого спектра исследовательских приложений. Тем не менее, поскольку данное исследование было ограничено введением жидких растворов в объеме не более 5 мкл, необходимо провести точное сравнение методов инъекции и вводимых материалов для конкретных исследовательских целей, чтобы определить наиболее подходящую методику.
Клиническое применение внутрикамерных инъекций разнообразно и обширно. Например, внутрикамерное введение кортикостероидов и антибиотиков, таких как цефуроксим и моксифлоксацин, распространено во время операций по удалению катаракты в качестве профилактической меры для предотвращения послеоперационной инфекции и эндофтальмита 19,20,21,22,23,24,25. Внутриглазная доставка также используется для местной анестезии и мидриаза во время рутинных операций по удалению катаракты26,27. Кроме того, лечение глаукомы включает в себя использование различных интракамерально доставляемых препаратов, снижающих внутриглазное давление, таких как аналоги простагландинов или агонисты мускарина, которые увеличивают отток водянистой влаги, антифибротические средства, такие как митомицин С для предотвращения рубцевания и фиброза, и антиваскулярные эндотелиальные факторы роста (анти-VEGF) при неоваскулярной глаукоме 28,29,30 . Этот разнообразный спектр внутрикамерных методов лечения отражает их решающую роль в лечении различных офтальмологических состояний и улучшении результатов лечения пациентов.
Описанный здесь метод внутрикамерной инъекции будет полезен для различных доклинических исследований, направленных на продвижение широкого клинического применения внутрикамерных инъекций. Например, использование внутрикамерной инъекции на крысовых моделях для определения эффективности, оптимальных дозировок, сроков и долгосрочных результатов различных лекарств является важным начальным шагом перед переходом к клиническим испытаниям. В таких исследованиях повышение точности и воспроизводимости техники инъекции будет ключом к успешным достижениям и прогрессу в исследованиях.
Кроме того, описанный метод внутрикамерной инъекции может быть использован для создания экспериментальных моделей различных глазных патологий путем доставки векторов или химических веществ в переднюю камеру. Такие экспериментальные модели являются ключом к исследованию механизмов заболевания и разработке новых методов лечения. Например, эндотелиальная дистрофия Фукса (ФЭД), прогрессирующее заболевание роговицы, вызывающее постепенную потерю зрения, не поддаетсялечению. Первичное лечение включает в себя мониторинг и облегчение симптомов, часто с помощью местных препаратов для временного облегчения отека или смазки глаз. В случаях прогрессирования заболевания или выраженного нарушения зрения необходимым вмешательством становится трансплантация роговицы (эндотелиальная кератопластика). Исследования, направленные на разработку новых вариантов лечения ФЭД, потенциально предлагающих альтернативы трансплантации роговицы, являются крайне обоснованными. Учитывая ограниченную биодоступность препаратов, доставляемых через роговицу или конъюнктиву 1,2,3, внутрикамерное введение становится предпочтительным путем лечения слоя эндотелия. Экспериментальные модели внутрикамерных инъекций играют решающую роль в разработке новых терапевтических подходов к ФЭД. Использование описанного здесь подхода для внутрикамерной инъекции может индуцировать поглощение вводимого материала в эндотелиальный слой роговицы. Реализация этого метода при внутрикамерном введении позволяет создавать экспериментальные модели для лечения ФЭД с высокой точностью и воспроизводимостью. Это не только способствует углублению нашего понимания ФЭД, но и открывает возможности для разработки целенаправленных и эффективных терапевтических вмешательств.
Таким образом, здесь описана оптимизированная процедура внутрикамерной инъекции крысам с низким риском побочных эффектов, которая будет иметь важное значение для улучшения доклинических исследований в области офтальмологии и будет способствовать развитию новых терапевтических возможностей при глазных патологиях.
Раскрытие информации
Маркович А. Л. является владельцем патентов в компаниях Steba Biotech, Yeda Weizmann, EyeYon Medical и Mor Isum, а также консультантом в компаниях EyeYon Medical и Johnson & Johnson. У всех остальных авторов нет конкурирующих интересов.
Благодарности
Это исследование было поддержано грантами Израильского научного фонда 2670/23 и 1304/20.
Материалы
| Name | Company | Catalog Number | Comments |
| Alizarin Red | Alpha Aesar | 042040.5 | |
| Buprenorphine | Richter pharma | 102047 | |
| Dexamethasone 0.1% | Fisher Pharmaceutical | 393102-0413 | |
| Hamilton glass syringe 10 μL | Hamilton Co. | 721711 | |
| Hoeschst | Merck | B2261 | |
| Ketamine | Bremer pharma GMBH (medimarket) | 17889 | |
| Ofloxacin 0.3% eye drops | Allergan | E92170 | |
| Oxybuprocaine Hydrochloride 0.4% | Fisher Pharmaceutical | N/A | |
| Pentobarbital sodium 200 mg/mL | CTS | N/A | |
| Slit microscope | Haag-streit bern | b-90019115 | |
| Sprague-Dawley Rats | Envigo | N/A | |
| Stiletto blade 31 G 0.8 mm | Tecfen medical (skymed) | QKN2808 | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Trypan Blue | Sartorius | 03-102-1B | |
| Xylazine | Eurovet Animal Health | 615648 |
Ссылки
- Ramsay, E., et al. Corneal and conjunctival drug permeability: Systematic comparison and pharmacokinetic impact in the eye. Eur J Pharm Sci. 119, 83-89 (2018).
- Cholkar, K., Dasari, S. R., Pal, D., Mitra, A. K. Eye: Anatomy, Physiology and Barriers to Drug Delivery. Ocular Transporters and Receptors. , Elsevier, Woodhead Publishing. (2013).
- Prausnitz, M. R. Permeability of cornea, sclera, and conjunctiva: A literature analysis for drug delivery to the eye. J Pharm Sci. 87 (12), 1479-1488 (1998).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the Eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 269(2020).
- Gautam, M., et al. Intracameral drug delivery: A Review of agents, indications, and outcomes. J Ocul Pharmacol Ther. 39 (2), 102-116 (2023).
- Shah, T. J., Conway, M. D., Peyman, G. A. Intracameral dexamethasone injection in the treatment of cataract surgery induced inflammation: design, development, and place in therapy. Clin Ophthalmol. 12, 2223-2235 (2018).
- Perlman, R. L. Mouse models of human disease: An evolutionary perspective. Evol Med Public Health. 2016 (1), 170-176 (2016).
- Chawla, S., Jena, S. The Anatomy and Physiology of Laboratory Rat.Essentials of Laboratory Animal Science: Principles and Practices. , Springer. Singapore. (2021).
- Lundström, M., Wejde, G., Stenevi, U., Thorburn, W., Montan, P. Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology. 114 (5), 866-870 (2007).
- Fine, I. H. Clear corneal incisions. Int Ophthalmol Clin. 34 (2), 59-72 (1994).
- Herretes, S., Stark, W. J., Pirouzmanesh, A., Reyes, J. M. G., McDonnell, P. J., Behrens, A. Inflow of ocular surface fluid into the anterior chamber after phacoemulsification through sutureless corneal cataract wounds. Am J Ophthalmol. 140 (4), 737-740 (2005).
- Masket, S., Belani, S. Proper wound construction to prevent short-term ocular hypotony after clear corneal incision cataract surgery. J Cataract Refract Surg. 33 (3), 383-386 (2007).
- Taban, M., Rao, B., Reznik, J., Zhang, J., Chen, Z., McDonnell, P. J. Dynamic morphology of sutureless cataract wounds - Effect of incision angle and location. Surv Ophthalmol. 49, Suppl 2 S62-S72 (2004).
- Belforte, N., Sande, P. H., de Zavalía, N., Dorfman, D., Rosenstein, R. E. Therapeutic benefit of radial optic neurotomy in a rat model of glaucoma. PLoS One. 7 (3), e34574(2012).
- Moreno, M. C., et al. A new experimental model of glaucoma in rats through intracameral injections of hyaluronic acid. Exp Eye Res. 81 (1), 71-80 (2005).
- Belforte, N., Sande, P., de Zavalía, N., Knepper, P., Rosenstein, R. Effect of chondroitin sulfate on intraocular pressure in rats. Invest Ophthalmol Vis Sci. 51 (11), 5768-5775 (2010).
- Matsumoto, Y., Kanamori, A., Nakamura, M., Negi, A. Rat chronic glaucoma model induced by intracameral injection of microbeads suspended in sodium sulfate-sodium hyaluronate. Jpn J Ophthalmol. 58 (3), 290-297 (2014).
- Liu, Y., et al. A novel rat model of ocular hypertension by a single intracameral injection of cross-linked hyaluronic acid hydrogel (Healaflow® ). Basic Clin Pharmacol Toxicol. 127 (5), 361-370 (2020).
- Bowen, R. C., et al. Comparative analysis of the safety and efficacy of intracameral cefuroxime, moxifloxacin and vancomycin at the end of cataract surgery: a meta-analysis. Br J Ophthalmol. 102 (9), 1268-1276 (2018).
- Kato, A., et al. Prophylactic antibiotics for postcataract surgery endophthalmitis: a systematic review and network meta-analysis of 6.8 million eyes. Sci Rep. 12 (1), 17416(2022).
- Wang, M., Liu, Y., Dong, H. Effect of cefuroxime intracameral injection antibiotic prophylactic on postoperative endophthalmitis wound post-cataract: A meta-analysis. Int Wound J. 20 (5), 1376-1383 (2023).
- Katz, G., et al. Intracameral cefuroxime and the incidence of post-cataract endophthalmitis: an Israeli experience. Graefes Arch Clin Exp Ophthalmol. 253 (10), 1729-1733 (2015).
- Lipnitzki, I., Ben Eliahu, S., Marcovitz, A. L., Ezov, N., Kleinmann, G. Intraocular concentration of moxifloxacin after intracameral injection combined with presoaked intraocular lenses. J Cataract Refract Surg. 40 (4), 639-643 (2014).
- Colleaux, K. M., Hamilton, W. K., Morgan, R. A. Effect of prophylactic antibiotics and incision type on the incidence of endophthalmitis after cataract surgery. Can J Ophthalmol. 35 (7), 373-378 (2000).
- Libre, P. E., Della-Latta, P., Chin, N. X. Intracameral antibiotic agents for endophthalmitis prophylaxis: A pharmacokinetic model. J Cataract Refract Surg. 29 (9), 1791-1794 (2003).
- Carino, N. S., Slomovic, A. R., Chung, F., Marcovich, A. L. Topical tetracaine versus topical tetracaine plus intracameral lidocaine for cataract surgery. J Cataract Refract Surg. 24 (12), 1602-1608 (1998).
- Minakaran, N., Ezra, D. G., Allan, B. D. Topical anaesthesia plus intracameral lidocaine versus topical anaesthesia alone for phacoemulsification cataract surgery in adults. Cochrane Database Syst Rev. 7 (7), CD005276 (2020).
- Dan-Ni, W., Li-Dian, H., Zhi-Guo, P., Qiang, W., Lei, S. Intracameral anti-VEGF injection for advanced neovascular glaucoma after vitrectomy with silicone oil tamponade. Int J Ophthalmol. 14 (3), 129-135 (2021).
- Bhagat, P. R., Agrawal, K. U., Tandel, D. Study of the effect of injection bevacizumab through various routes in neovascular glaucoma. J Curr Glaucoma Pract. 10 (2), 39-48 (2016).
- Al-Qaysi, Z. K., Beadham, I. G., Schwikkard, S. L., Bear, J. C., Al-Kinani, A. A., Alany, R. G. Sustained release ocular drug delivery systems for glaucoma therapy. Expert Opin Drug Deliv. 20 (7), 905-919 (2023).
- Eghrari, A. O., Gottsch, J. D. Fuchs' corneal dystrophy. Expert Rev Ophthalmol. 5 (2), 147-159 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены