Method Article
副作用のリスクが低いラットにおける皮内注射
* これらの著者は同等に貢献しました
要約
このプロトコルは、中央角膜切開と前房への長いトンネルを使用したラットの皮内房内注射の技術を説明しています。この注入方法により、不注意による組織損傷を誘発するリスクが最小限に抑えられ、精度と再現性が向上します。
要約
皮内注射は、眼科における標準的な投与ルーチンです。げっ歯類への皮内注射の研究への適用は、小さな房水量、水晶体の湾曲、水晶体の厚さなど、眼の寸法と解剖学的構造に制限があるため、困難です。前房内注射中の潜在的な損傷は、悪影響と実験のばらつきをもたらします。このプロトコルは、ラットでの皮内注射の手順を説明しており、精度と再現性を可能にします。
実験モデルとしてSprague-Dawleyラットを使用しました。ラットの水晶体の位置は前房に突き出ているため、ヒトのように周辺から注射することは好ましくありません。したがって、31ゲージの0.8mmスティレットブレードを使用して角膜中央領域に切開を作成し、前房へのセルフシールトンネルを形成します。フラットに近い角度での切開は、長いトンネルを作り出すことを可能にし、これにより房水の損失と前房の浅さが最小限に抑えられます。34ゲージのナノニードルをトンネルに挿入して注入します。これにより、摩擦抵抗を最小限に抑えた貫通が可能になり、レンズへの接触を回避できます。トリパンブルーの注入により、スリット顕微鏡による前房内の色素の存在を可視化し、漏れを排除することができます。角膜内皮層へのバイオアベイラビリティは、注射後に角膜内皮細胞の核を染色したヘキスト色素の注射によって実証されます。
結論として、このプロトコルは、ラットでの正確な皮内注射の手順を実装します。この手順は、実験ラットモデルにおけるさまざまな薬物や化合物の皮内導入に使用でき、眼科研究の効率と再現性を向上させます。
概要
局所投与によって眼の表面に送達される化合物のバイオアベイラビリティは非常に限られており、通常は<5%1です。.点眼薬で投与される化合物は、主にドレナージ、誘発性流涙、涙液代謝回転、および結膜吸収によって排除されます。さらに、眼表面を通る化合物の透過は、角膜結膜バリア1,2,3によって高度に制限されています。角膜は、最も外側の上皮、中間間質、および最も内側の内皮の3つの主要な層で構成されています。表在性角膜上皮は、強力なタイトジャンクションによって相互接続されており、物質透過性に対する主な障壁である高い傍細胞抵抗性を生み出します。複数の上皮層は、角膜上皮の細胞間空間を通る親水性分子と高分子の透過をさらに制限します。上皮の後継として、間質はコラーゲン繊維で構成され、水性の細孔を含んでいます。角膜上皮とは対照的に、間質は親水性薬物の移動を可能にします。しかし、親油性化合物1,2,3に対しては非常に不透過性です。角膜上皮と間質層は一緒になって、薬物の吸収を制限する主要な組織障壁を示します。角膜内皮は薬物輸送を制限するとは考えられていません。.
角膜分娩ルートに代わるのは、結膜ルートです。結膜は、まぶたの内側と強膜の前部を覆う多重上皮層です。結膜は、角膜上皮よりもタイトジャンクションが少ないという特徴があり、親水性薬物の透過性が向上します。しかし、結膜の血管新生は、投与された分子の大部分が全身的に吸収されることになり、前房に送達された化合物のバイオアベイラビリティを再び大幅に制限します1,2。外側の眼透過性障壁を回避する効率的な方法は、薬物を関心領域に直接送達することです。例えば、硝子体内注射は、硝子体液4への送達に一般的である。同様に、前房内注射は、前房5への送達に利用される。前房での効率的な濃度を確立することは、抗生物質の皮内注射による感染症の治療や白内障手術の術後抗炎症治療など、さまざまな臨床状況にとって重要です。前房内注射によって物質のバイオアベイラビリティが向上するという利点があるにもかかわらず、考慮すべき重大な安全性上の懸念があります。例えば、皮内眼内薬物注射は、眼圧上昇、中毒性前眼部症候群、および毒性性内皮細胞破壊症候群を誘発する可能性があります5,6。したがって、前臨床試験では、治療効率を最大化し、患者への潜在的な副作用を最小限に抑えるために、前臨床試験で前皮内注射によって送達される薬物の有効性と安全性を慎重に評価することが不可欠です。
新しい治療法を検討するための前臨床試験には、実験動物モデルが不可欠です。マウスやラットなどの小さなげっ歯類は、そのような目的のために最も一般的に使用される実験動物です。これらの動物は、人間の解剖学や生理学と多くの類似点を示しており、貴重な洞察を提供しています。さらに、それらの使用は、サイズが小さく、メンテナンスが容易で、妊娠が速く、多数の子孫を産む能力があるため、経済的に有利です7。
眼疾患モデルでは小型のげっ歯類が広く使用されているにもかかわらず、そのユニークな眼の寸法と解剖学的構造は、実験操作中に大きな課題をもたらします。例えば、皮内注射のような手技は、人間では比較的簡単ですが、マウスやラットでは技術的に厳しいものになります。課題は、房水の量が少ないこと、水晶体が比較的大きく柔軟性に欠けていること、げっ歯類の眼内での水晶体の位置と湾曲が邪魔になることなどの要因に起因しています(図1)8。これらの課題は、げっ歯類の皮内注射中の損傷のリスクを高め、潜在的な悪影響を引き起こし、研究結論の妥当性に影響を与える可能性のある実験的ばらつきをもたらします。私たちの研究では、ラットに安全な皮内注射を施す方法の開発に成功しました。この技術には、角膜に前房への長くて平らなセルフシールトンネルを作成することが含まれます。この方法は、精度を確保するだけでなく、実験の再現性も向上させ、小型げっ歯類の注入技術に関連する問題に対処します。
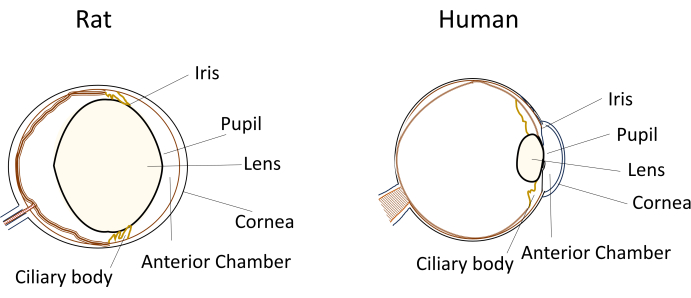
図1:ラットと人間の目の解剖学的前部の特徴の概略図。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
この議定書の実験は、動物科学のための国家許可委員会によって承認され、眼科および視覚研究における動物の使用に関するARVO声明に準拠しています。8〜10週齢の雌Sprague-Dawleyラットを本研究に使用し、12/12時間の明暗サイクルに曝露しました。動物は商業的な供給源から入手しました( 資料の表を参照)。
1.動物の調理
- ケタミン(0.8mL中80mg/kg体重)とキシラジン(0.2mL中4mg/kg体重)の麻酔薬混合物を調製し、ラットに麻酔をかけるために1回注射で腹腔内注射する。
- 鎮痛剤のブプレノルフィン(0.03 mg / kg)を1回の注射で腹腔内に注射します。.
- 局所眼科麻酔薬0.4%オキシブプロカインを両眼に適用します。.
2. セルフシール性角膜トンネルの作製
- 外科用眼鉗子を備えた角膜強膜接合部の横にある垂直正中線に上強膜を保持することにより、目を安定させます。
- 手術用顕微鏡下で、滅菌済みの0.8 mm、31 Gスティレットブレードを、垂直正中線(瞳孔の中心より上)の傍中心角膜領域に、水平にできるだけ近い角度で平坦な位置に置きます(図2)。
- この位置で、角膜を穿刺して切開し、前房の中央領域に貫通するまで長いトンネル(2〜3 mm)を作成します。レンズには触れないでください(図2)。
注:トンネルが成功しても、房水の漏れや前房の浅さは引き起こされません。 - 注射した眼に局所0.3%のオフロキサシンと0.1%のデキサメタゾンを塗布します。.
- 以下のようにスリット顕微鏡で調べます。
- 注射された眼の前房の深さを、注射されていない眼と比較して観察します。
注:深さはほぼ同じである必要があります。 - 注射された眼と非注入眼の眼の水晶体を観察します。
注意: レンズは透明である必要があります。不透明度は、外科的処置中のレンズの損傷を反映する可能性があります。
- 注射された眼の前房の深さを、注射されていない眼と比較して観察します。

Figure 2: Schematic Representation of the blade and incisition angle and position. この図の拡大版を見るには、ここをクリックしてください。
3.オプション1:前房への成功した注射を評価するためのトリパンブルーの皮内注射
- 5 μL のトリパン ブルーを、34 G の鈍い針を備えた滅菌済みの 10 μL ガラス製ハミルトン シリンジに入れます。
注: トリパン ブルーの注入は、モデルのキャリブレーションまたはセットアップ段階での注入の成功を評価する手段として説明されています。実験設定では、シリンジに選択した化合物の溶液を装填することができます。 - 装填したシリンジ針をセクション2で作成したトンネルを通して前房に挿入します。
- 注射後、すべての液体が透明になるまで2〜3秒間針を所定の位置に注入して保持します。
- 角膜トンネルからの漏れを防ぐために、針を優しくゆっくりと引き抜くようにして取り外します。
- スリット顕微鏡で観察します。前房の深さを評価して浅瀬を除外し、前房にトリパンブルーが存在することを確認します。
- 24時間後、48時間後、72時間後にスリット検査を繰り返します。
4.オプション2:内皮細胞層に注入された材料のバイオアベイラビリティを評価するためのHoechstの皮内注射
- 5 μL の Hoechst を、34 G の鈍い針を備えた滅菌済みの 10 μL ガラス製 Hamilton シリンジにロードします。
注:Hoechstの注入は、内皮細胞層への取り込みによって注入された材料のバイオアベイラビリティを評価する手段として説明されており、モデルのキャリブレーションまたはセットアップ段階で役立ちます。実験設定では、シリンジに選択した化合物の溶液を装填することができます。 - 装填したシリンジ針をセクション2で作成したトンネルを通して前房に挿入します。
- 注射後、すべての液体が透明になるまで2〜3秒間針を所定の位置に注入して保持します。
- 角膜トンネル切開部からの漏れを防ぐために、針を優しくゆっくりと引き抜くようにして取り外します。
- 注射後約15〜20分で、500 mg / kgのペントバルビトンナトリウムの腹腔内注射によりラットを安楽死させます。.
- 両眼を摘出し、角膜を分離します。注射されていない角膜をコントロールとして収集します。.
- メーカーの指示に従って、両方の角膜を0.5%アリザリンレッドSで染色し、内皮細胞を同定します。
- 光学顕微鏡で調べて内皮細胞のアリザリン赤色染色を画像化し、蛍光顕微鏡でヘキスト染色を観察します。これは、コントロールとして非注射された角膜と比較して観察されます。
結果
Sprague Dawleyラットに、上記のプロトコルに従って5μLのトリパンブルーを皮内注射しました。注入直後のスリットランプ検査では、チャンバー内にトリパンブルーが染色されており、注入された物質が前房に到達したことが示されました(図3)。さらに、前房の深さは無傷であり、注射によって房水の漏れや房の浅さを引き起こさなかったことが示唆されています。

図3:皮内注射後の無傷の前房。 トリパンブルーをラットの前房に注射しました。スリット顕微鏡検査では、前房の漏れや浅さのないトリパンブルーの存在が示されています。スケールバー = 1 mm。 この図の拡大版を表示するには、ここをクリックしてください。
次に、DNAに結合し、細胞核を染色する細胞透過性蛍光色素であるHoechstを注入して、記載された皮内注射経路によって送達される薬物のバイオアベイラビリティを評価した。内皮細胞によるヘキストの取り込みは、角膜を分離し、蛍光顕微鏡で観察することにより、注射後15分で評価されました。内皮細胞を同定するために、角膜を内皮細胞層の細胞間境界を染色するAlizarin Red Sで染色しました。 対照として、同じラットから注射されていない眼を調べました。私たちの結果は、内皮細胞層が注射後に無傷であったことを示しており、記載されている手順が内皮に損傷を引き起こさないことを裏付けています。さらに、内皮細胞はHoechst核染色に陽性であり、注射されたHoechstが前房内注射後に取り込まれることが示されました(図4)。
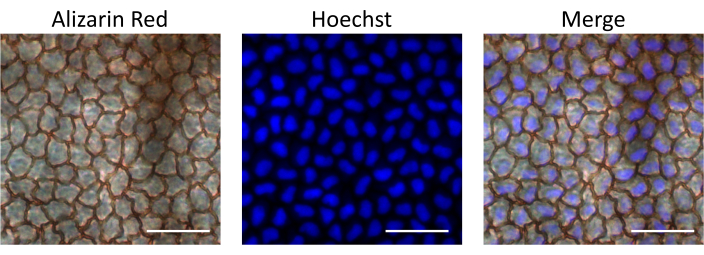
図4:内皮細胞層への皮内注射された材料のバイオアベイラビリティ。 ヘキストはラットの前房に注射されました。角膜を注射後15分で分離し、Alizarin Red Sで染色して内皮細胞を観察し、蛍光顕微鏡で画像化してHoechst染色を観察しました。重ね合わせ画像は、角膜内皮細胞における核ヘキスト染色を示しています。スケールバー = 50 μM. この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
前臨床研究モデルは、所見の信頼性と適用性を確保するために、制御された再現性のある環境を提供する必要があります。眼科研究では、疾患モデルの確立、新しい治療法の試験、組織反応や潜在的な副作用の評価など、さまざまな研究面で眼注射モデルが一般的に使用されています。
前房内注射は、実験眼科における一般的な手法として機能し、外側の眼組織バリア5を回避しながら、房水への化合物の直接送達を促進します。この前房内注射による標的型アプローチにより、最適な濃度の薬物が水晶体、海綿網、角膜内皮などの意図した作用部位に到達することが保証され、治療効果が最大化されます。
小型のげっ歯類で皮内注射を行うことには、実験の再現性と成功に影響を与える可能性のあるいくつかの技術的課題があります。まず、げっ歯類の目の寸法が小さいため、眼の構造に損傷を与えることなく、アクセスと操作が困難になります。この文脈では、ラットは目が大きいため、マウスよりもいくつかの利点があります。第二に、限られた前房内のレンズの位置は、注入部位への経路を妨げる可能性があります。ヒトを含む他の哺乳類と比較して、ラットは水晶体が突き出ているか目立つことが知られているため、目に対して比較的大きなサイズになっています(図1)。さらに、ラットの水晶体は、人間の水晶体に見られる柔軟性を欠いています。その結果、損傷を与えることなくレンズの周りを移動するには、注射針の慎重な操作が必要です。
マニピュレーション中の組織損傷は、前房の浅化、眼圧の上昇、炎症または前部ブドウ膜炎、内皮細胞の損傷、白内障の形成、その他の構造変化または変形、感染のリスクなど、さまざまな合併症を引き起こす可能性があります。これらの課題は、小さなげっ歯類モデルで皮内注射を行う際の正確な技術と解剖学的違いの慎重な考慮の必要性を浮き彫りにしています。
このプロトコルに記載されている皮内房内注射の技術は、注射プロセス中に眼組織を損傷するリスクを最小限に抑えるように設計されました。この方法では、前房にセルフシールトンネルを確立し、摩擦抵抗を最小限に抑えて侵入を容易にします。術後の低血圧や体液漏れのリスクを減らし、まぶたやまつ毛からの微生物による感染を防ぐためには、しっかりと密閉された切開が重要です。切開の角度と長さはどちらも、創傷のダイナミクス、副作用の発生、およびその後の回復にとって重要です。切開が大きすぎると視軸が不透明になり、角膜脈理や浮腫が誘発される可能性がありますが、短い切開は前房を不安定にし、虹彩脱を誘発する可能性があります。角膜面軸に近い角度で切開を行うことで、関連するリスクなしに長い一面トンネルを生成することができます。重要なことに、ガイドされた長いトンネルを介して針を前房に挿入すると、精度が向上し、誤ってレンズに触れる可能性が減少します。また、末梢切開が好まれるヒトへの注射とは対照的に、ラットでは前房が最も深い角膜中央部でトンネル化を行います。実験的検証により、この方法では、房水の漏れや前房の浅さを経験することなく、レンズに触れることなく注射できることが確認されました。
以前の研究では、ラットの前房に注射するためのさまざまな方法が説明されていました。たとえば、ローゼンスタイングループは、角膜強膜を介して前房に注射することをいくつかの研究で説明しました。20μLの液体を注入すると、チャンバーの深さが徐々に増加し、それによって針が虹彩から分離され、針とレンズの接触を回避できます。注射の副作用は、一過性の角膜浮腫と白内障の約5%の発生率として報告されました14,15,16。.Matsumotoらは、緑内障モデルを作成するためのラットへの前房内マイクロビーズ注入技術について説明しました。著者らは、シングルステップ切開を利用し、34G針を使用して強角膜トンネルを作成し、これを前房に斜めに挿入しました。著者らは、角膜や虹彩に当たらないようにしたと報告し、炎症性事故はなく、注射中に内皮層を損傷した症例はわずか(調査した動物の<7%)のみであったと報告しています。しかし、著者らは、この修正された注射だけでは、前房からの大幅な漏れと結膜下腔への逆流を防ぐのに十分ではなかったと説明しています。これを克服するために、マイクロビーズの20μL混合物と分散型眼科用粘性手術装置(OVD;Viscoat)を注入した。これにより、注射後4週間まで眼圧(IOP)レベルが有意に上昇しました17。同様に、Liuらは、輪部に沿って虹彩に平行に前房に挿入された32G針を使用して、セルフシール性角膜トンネル18を作製した上房内注射について説明した。著者らは、3 μL のヒアルロン酸ナトリウムヒドロゲルを注入し、綿棒を使用して注入部位を圧縮し、前房からの漏れを最小限に抑えました。高分子量ゲルは、前房内に保持され、海綿網18を通る房水の流出を阻止することが記載された。ここで説明した修正された前房内注射法は、粘弾性剤を使用しない注射に耐えられるため、幅広い研究用途に適用できることは注目に値します。それにもかかわらず、この研究は5μL以下の容量での液体溶液の注入に限定されていたため、最適な技術を決定するために、特定の研究目的のために注入方法と注入された材料の正確な比較を実施する必要があります。
皮内皮内注射の臨床応用は多様で広範囲に及びます。例えば、コルチコステロイドおよびセフロキシムおよびモキシフロキサシンなどの抗生物質の皮皮内投与は、術後感染および眼内炎を予防するための予防措置として、白内障手術中に一般的である19,20,21,22,23,24,25。眼内分娩は、日常的な白内障手術中の局所麻酔および散瞳にも採用されます26,27。さらに、緑内障の治療には、房水流出を増加させるプロスタグランジン類似体やムスカリンアゴニストなどの眼圧を低下させるさまざまな皮内送達薬の使用、瘢痕化や線維化を防ぐためのマイトマイシンCなどの抗線維化剤、および血管新生緑内障に対する抗血管内皮増殖因子(抗VEGF)剤の使用が含まれます28,29,30.この多様な皮内治療は、さまざまな眼科疾患に対処し、患者の転帰を向上させる上での重要な役割を反映しています。
ここで説明する皮内皮内注射の方法は、皮内注射の広範な臨床応用を進めることを目的としたさまざまな前臨床研究に有利です。例えば、ラットモデルで前房内注射を使用して、さまざまな薬剤の有効性、最適な投与量、タイミング、および長期的な結果を決定することは、臨床試験に進む前の重要な最初のステップです。このような研究では、注射技術の精度と再現性を向上させることが、成功の成果と研究の進行の鍵となります。
さらに、記載された前房内注射の方法は、ベクターまたは化学物質を前房に送達することにより、異なる眼の病状の実験モデルを生成するために採用されてもよい。このような実験モデルは、疾患のメカニズムを調査し、新しい治療法を開発するための鍵となります。例えば、フックス内皮ジストロフィー(FED)は、進行性の角膜疾患で、徐々に視力を失う病気であり、治療法がない31。一次管理には、多くの場合、一時的な浮腫の緩和や目の潤滑のための局所薬を通じて、症状の緩和を監視および提供することが含まれます。疾患の進行や重度の視力障害の場合、角膜移植(内皮角膜形成術)が必要な介入となります。FEDの新たな治療選択肢の開発を目的とした研究は、角膜移植に代わる可能性のあるものであり、非常に正当化されています。角膜または結膜を通じて送達される薬物のバイオアベイラビリティが限られていることを考えると、内皮層を治療するための有利な経路として、皮内投与が浮上しています。皮内注射の実験モデルは、FEDの新規治療アプローチの開発において重要な役割を果たします。本明細書に記載のアプローチを皮内注射に使用すると、注入された材料の角膜内皮層への取り込みを誘導することができる。この方法を皮内注射に実装することで、FED治療の実験モデルを高精度かつ再現性よく作成することができます。これは、FEDの理解を深めるだけでなく、的を絞った効果的な治療介入を開発する道を開くことにもなります。
要約すると、ここで説明するのは、副作用のリスクが低いラットでの皮内包注射の最適化された手順であり、これは前臨床眼科研究を改善し、眼の病状に対する新しい治療可能性の開発に貢献する価値があります。
開示事項
Marcovich A. L.は、Steba Biotech、Yeda Weizmann、EyeYon Medical、Mor Isumの特許を保有しており、EyeYon MedicalとJohnson & Johnsonのコンサルタントです。他のすべての著者は、競合する利益を持っていません。
謝辞
この研究は、イスラエル科学財団の助成金2670/23および1304/20によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Alizarin Red | Alpha Aesar | 042040.5 | |
| Buprenorphine | Richter pharma | 102047 | |
| Dexamethasone 0.1% | Fisher Pharmaceutical | 393102-0413 | |
| Hamilton glass syringe 10 μL | Hamilton Co. | 721711 | |
| Hoeschst | Merck | B2261 | |
| Ketamine | Bremer pharma GMBH (medimarket) | 17889 | |
| Ofloxacin 0.3% eye drops | Allergan | E92170 | |
| Oxybuprocaine Hydrochloride 0.4% | Fisher Pharmaceutical | N/A | |
| Pentobarbital sodium 200 mg/mL | CTS | N/A | |
| Slit microscope | Haag-streit bern | b-90019115 | |
| Sprague-Dawley Rats | Envigo | N/A | |
| Stiletto blade 31 G 0.8 mm | Tecfen medical (skymed) | QKN2808 | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Trypan Blue | Sartorius | 03-102-1B | |
| Xylazine | Eurovet Animal Health | 615648 |
参考文献
- Ramsay, E., et al. Corneal and conjunctival drug permeability: Systematic comparison and pharmacokinetic impact in the eye. Eur J Pharm Sci. 119, 83-89 (2018).
- Cholkar, K., Dasari, S. R., Pal, D., Mitra, A. K. Eye: Anatomy, Physiology and Barriers to Drug Delivery. Ocular Transporters and Receptors. , Elsevier, Woodhead Publishing. (2013).
- Prausnitz, M. R. Permeability of cornea, sclera, and conjunctiva: A literature analysis for drug delivery to the eye. J Pharm Sci. 87 (12), 1479-1488 (1998).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the Eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 269(2020).
- Gautam, M., et al. Intracameral drug delivery: A Review of agents, indications, and outcomes. J Ocul Pharmacol Ther. 39 (2), 102-116 (2023).
- Shah, T. J., Conway, M. D., Peyman, G. A. Intracameral dexamethasone injection in the treatment of cataract surgery induced inflammation: design, development, and place in therapy. Clin Ophthalmol. 12, 2223-2235 (2018).
- Perlman, R. L. Mouse models of human disease: An evolutionary perspective. Evol Med Public Health. 2016 (1), 170-176 (2016).
- Chawla, S., Jena, S. The Anatomy and Physiology of Laboratory Rat.Essentials of Laboratory Animal Science: Principles and Practices. , Springer. Singapore. (2021).
- Lundström, M., Wejde, G., Stenevi, U., Thorburn, W., Montan, P. Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology. 114 (5), 866-870 (2007).
- Fine, I. H. Clear corneal incisions. Int Ophthalmol Clin. 34 (2), 59-72 (1994).
- Herretes, S., Stark, W. J., Pirouzmanesh, A., Reyes, J. M. G., McDonnell, P. J., Behrens, A. Inflow of ocular surface fluid into the anterior chamber after phacoemulsification through sutureless corneal cataract wounds. Am J Ophthalmol. 140 (4), 737-740 (2005).
- Masket, S., Belani, S. Proper wound construction to prevent short-term ocular hypotony after clear corneal incision cataract surgery. J Cataract Refract Surg. 33 (3), 383-386 (2007).
- Taban, M., Rao, B., Reznik, J., Zhang, J., Chen, Z., McDonnell, P. J. Dynamic morphology of sutureless cataract wounds - Effect of incision angle and location. Surv Ophthalmol. 49, Suppl 2 S62-S72 (2004).
- Belforte, N., Sande, P. H., de Zavalía, N., Dorfman, D., Rosenstein, R. E. Therapeutic benefit of radial optic neurotomy in a rat model of glaucoma. PLoS One. 7 (3), e34574(2012).
- Moreno, M. C., et al. A new experimental model of glaucoma in rats through intracameral injections of hyaluronic acid. Exp Eye Res. 81 (1), 71-80 (2005).
- Belforte, N., Sande, P., de Zavalía, N., Knepper, P., Rosenstein, R. Effect of chondroitin sulfate on intraocular pressure in rats. Invest Ophthalmol Vis Sci. 51 (11), 5768-5775 (2010).
- Matsumoto, Y., Kanamori, A., Nakamura, M., Negi, A. Rat chronic glaucoma model induced by intracameral injection of microbeads suspended in sodium sulfate-sodium hyaluronate. Jpn J Ophthalmol. 58 (3), 290-297 (2014).
- Liu, Y., et al. A novel rat model of ocular hypertension by a single intracameral injection of cross-linked hyaluronic acid hydrogel (Healaflow® ). Basic Clin Pharmacol Toxicol. 127 (5), 361-370 (2020).
- Bowen, R. C., et al. Comparative analysis of the safety and efficacy of intracameral cefuroxime, moxifloxacin and vancomycin at the end of cataract surgery: a meta-analysis. Br J Ophthalmol. 102 (9), 1268-1276 (2018).
- Kato, A., et al. Prophylactic antibiotics for postcataract surgery endophthalmitis: a systematic review and network meta-analysis of 6.8 million eyes. Sci Rep. 12 (1), 17416(2022).
- Wang, M., Liu, Y., Dong, H. Effect of cefuroxime intracameral injection antibiotic prophylactic on postoperative endophthalmitis wound post-cataract: A meta-analysis. Int Wound J. 20 (5), 1376-1383 (2023).
- Katz, G., et al. Intracameral cefuroxime and the incidence of post-cataract endophthalmitis: an Israeli experience. Graefes Arch Clin Exp Ophthalmol. 253 (10), 1729-1733 (2015).
- Lipnitzki, I., Ben Eliahu, S., Marcovitz, A. L., Ezov, N., Kleinmann, G. Intraocular concentration of moxifloxacin after intracameral injection combined with presoaked intraocular lenses. J Cataract Refract Surg. 40 (4), 639-643 (2014).
- Colleaux, K. M., Hamilton, W. K., Morgan, R. A. Effect of prophylactic antibiotics and incision type on the incidence of endophthalmitis after cataract surgery. Can J Ophthalmol. 35 (7), 373-378 (2000).
- Libre, P. E., Della-Latta, P., Chin, N. X. Intracameral antibiotic agents for endophthalmitis prophylaxis: A pharmacokinetic model. J Cataract Refract Surg. 29 (9), 1791-1794 (2003).
- Carino, N. S., Slomovic, A. R., Chung, F., Marcovich, A. L. Topical tetracaine versus topical tetracaine plus intracameral lidocaine for cataract surgery. J Cataract Refract Surg. 24 (12), 1602-1608 (1998).
- Minakaran, N., Ezra, D. G., Allan, B. D. Topical anaesthesia plus intracameral lidocaine versus topical anaesthesia alone for phacoemulsification cataract surgery in adults. Cochrane Database Syst Rev. 7 (7), CD005276 (2020).
- Dan-Ni, W., Li-Dian, H., Zhi-Guo, P., Qiang, W., Lei, S. Intracameral anti-VEGF injection for advanced neovascular glaucoma after vitrectomy with silicone oil tamponade. Int J Ophthalmol. 14 (3), 129-135 (2021).
- Bhagat, P. R., Agrawal, K. U., Tandel, D. Study of the effect of injection bevacizumab through various routes in neovascular glaucoma. J Curr Glaucoma Pract. 10 (2), 39-48 (2016).
- Al-Qaysi, Z. K., Beadham, I. G., Schwikkard, S. L., Bear, J. C., Al-Kinani, A. A., Alany, R. G. Sustained release ocular drug delivery systems for glaucoma therapy. Expert Opin Drug Deliv. 20 (7), 905-919 (2023).
- Eghrari, A. O., Gottsch, J. D. Fuchs' corneal dystrophy. Expert Rev Ophthalmol. 5 (2), 147-159 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。