Method Article
הזרקה תוך-מצלמה בחולדות עם סיכון נמוך לתופעות לוואי
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר טכניקה להזרקה תוך-מצלמה בחולדות באמצעות חתך מרכזי בקרנית ומנהרה ארוכה לתוך החדר הקדמי. שיטת הזרקה זו ממזערת את הסיכון לגרימת נזק לא מכוון לרקמות ובכך משפרת את הדיוק והשחזור.
Abstract
הזרקה intracameral היא שגרת ניהול סטנדרטית ברפואת עיניים. היישום של הזרקה תוך-מצלמה במכרסמים למחקר מאתגר בשל הממדים והאנטומיה המגבילים של העין, כולל נפח ההומור המימי הקטן, עקמומיות העדשה ועובי העדשה. נזק פוטנציאלי במהלך הזרקות intracameral מציג תופעות לוואי ושונות הניסוי. פרוטוקול זה מתאר הליך להזרקה תוך-מצלמה בחולדות, המאפשר דיוק ושחזור.
חולדות ספראג-דולי שימשו כמודלים ניסיוניים. מכיוון שמיקום העדשה בחולדות בולט לחדר הקדמי, הזרקה מהפריפריה, כפי שנעשה בבני אדם, היא שלילית. לכן, חתך נוצר באזור הקרנית המרכזי באמצעות להב סטילטו 31 מד 0.8 מ"מ כדי ליצור מנהרה אוטמת עצמית לתוך החדר הקדמי. חתך בזווית קרובה לדירה מאפשר ליצור מנהרה ארוכה, הממזערת את אובדן ההומור המימי והרדוד של החדר הקדמי. ננו-מחט 34 מד מוחדרת למנהרה להזרקה. הדבר מאפשר חדירה עם התנגדות חיכוך מינימלית ומונע נגיעה בעדשה. הזרקה של טריפאן-כחול מאפשרת הדמיה על ידי מיקרוסקופ חריץ את נוכחות הצבע בחדר הקדמי ולא לכלול דליפה. זמינות ביולוגית לשכבת האנדותל של הקרנית מודגמת על ידי הזרקת צבע Hoechst, אשר הכתים את גרעיני תאי האנדותל של הקרנית לאחר ההזרקה.
לסיכום, פרוטוקול זה מיישם נוהל להזרקה תוך-מצלמה מדויקת בחולדות. הליך זה עשוי לשמש למסירה תוך-מצלמה של תרופות ותרכובות שונות במודלים ניסיוניים של חולדות, מה שמגביר את היעילות והשחזור של מחקר עיניים.
Introduction
הזמינות הביולוגית של תרכובות המועברות על ידי מתן מקומי לפני השטח של העין מוגבלת מאוד, בדרך כלל <5%1. תרכובות המנוהלות על ידי טיפות עיניים מסולקות בעיקר על ידי ניקוז, דמעות מושרה, תחלופת נוזל דמעות וספיגת הלחמית. בנוסף, חלחול התרכובות דרך משטח העין מוגבל מאוד על ידי מחסום הקרנית-לחמית 1,2,3. הקרנית מורכבת משלוש שכבות עיקריות: האפיתל החיצוני ביותר, סטרומה הביניים והאנדותל הפנימי ביותר. אפיתל הקרנית השטחי מחובר על ידי צמתים הדוקים חזקים ויוצר התנגדות פארא-תאית גבוהה, המהווה את המחסום העיקרי לחדירות חומרים. שכבות אפיתל מרובות מגבילות עוד יותר את החלחול של מולקולות הידרופיליות וגדולות דרך החללים הבין-תאיים של אפיתל הקרנית. במקום האפיתל, הסטרומה מורכבת מסיבי קולגן ומכילה נקבוביות מימיות. בניגוד לאפיתל הקרנית, הסטרומה מאפשרת תנועה של תרופות הידרופיליות; עם זאת, הוא אטום מאוד לתרכובות ליפופיליות 1,2,3. יחד, אפיתל הקרנית ושכבות הסטרומה מציגים מחסומי רקמות עיקריים המגבילים את ספיגת התרופות. אנדותל הקרנית אינו נחשב להגביל את העברת התרופות.
חלופה למסלול המסירה של הקרנית היא מסלול הלחמית. הלחמית היא שכבה מרובת אפיתל המכסה את הצד הפנימי של העפעפיים ואת החלק הקדמי של הסקלרה. הלחמית מאופיינת בצמתים הדוקים פחות מאשר אפיתל הקרנית, מה שמאפשר חדירות טובה יותר של תרופות הידרופיליות. עם זאת, וסקולריזציה של הלחמית גורמת לספיגה מערכתית של חלק גדול מהמולקולות המנוהלות, ושוב מגבילה מאוד את הזמינות הביולוגית של תרכובות המועברות לחדר הקדמי 1,2. דרך יעילה לעקוף את מחסומי חדירות העין החיצונית היא לספק את התרופה ישירות לאזור המעניין. לדוגמה, הזרקה intravitreal נפוץ עבור משלוח לתוך הומור הזגוגית4. כמו כן, הזרקה intracameral משמש למסירה לתוך החדר הקדמי5. קביעת ריכוז יעיל בחדר הקדמי היא קריטית למצבים קליניים שונים, כגון טיפול בזיהום על ידי הזרקה תוך-מצלמה של אנטיביוטיקה וטיפולים אנטי דלקתיים לאחר הניתוח בניתוחי קטרקט. למרות היתרון של זמינות ביולוגית משופרת של חומרים המוענקת על ידי הזרקה תוך מצלמה, ישנם חששות בטיחות עיקריים שיש לקחת בחשבון. לדוגמה, הזרקת תרופה תוך-מצלמה עלולה לגרום ללחץ תוך עיני מוגבר, תסמונת מקטע קדמי רעיל ותסמונת הרס תאי אנדותל רעילים 5,6. לכן, חיוני להעריך בזהירות במחקרים פרה-קליניים את היעילות והבטיחות של תרופות הניתנות על ידי זריקות intracameral כדי למקסם את יעילות הטיפול ולמזער תופעות לוואי פוטנציאליות בחולים.
מודלים ניסיוניים של בעלי חיים הם הכרחיים במחקרים פרה-קליניים כדי לחקור טיפולים חדשים. מכרסמים קטנים, כגון עכברים וחולדות, הם חיות המעבדה הנפוצות ביותר למטרות כאלה. בעלי חיים אלה מפגינים קווי דמיון רבים לאנטומיה ולפיזיולוגיה האנושית, ומספקים תובנות חשובות. יתר על כן, השימוש בהם הוא יתרון כלכלי בשל גודלם הקטן, קלות התחזוקה, ההריון המהיר והיכולת לייצר מספר גדול של צאצאים7.
למרות השימוש הנרחב במכרסמים קטנים במודלים של מחלות עיניים, ממדי העיניים והאנטומיה הייחודיים שלהם מציבים אתגרים משמעותיים במהלך מניפולציות ניסיוניות. לדוגמה, הליכים כמו זריקות תוך-מצלמה, שהם פשוטים יחסית בבני אדם, הופכים תובעניים מבחינה טכנית בעכברים ובחולדות. האתגרים נובעים מגורמים כמו הנפח הקטן של הומור מימי, העדשה הגדולה יחסית והלא גמישה, והמיקום והעקמומיות החסימתית של העדשה בתוך עיני המכרסמים (איור 1)8. אתגרים אלה מגבירים את הסיכון לנזק במהלך הזרקות תוך-מצלמה במכרסמים, מה שמוביל לתופעות לוואי אפשריות ומציג שונות ניסויית שיכולה להשפיע על תקפות מסקנות המחקר. במחקר שלנו, פיתחנו בהצלחה הליך להזרקה תוך-מצלמה בטוחה בחולדות. הטכניקה כוללת יצירת מנהרה ארוכה, שטוחה ואטומה עצמית בקרנית לתוך החדר הקדמי. שיטה זו לא רק מבטיחה דיוק אלא גם משפרת את יכולת השחזור הניסיונית, ומטפלת בבעיות הקשורות לטכניקות הזרקה במכרסמים קטנים.
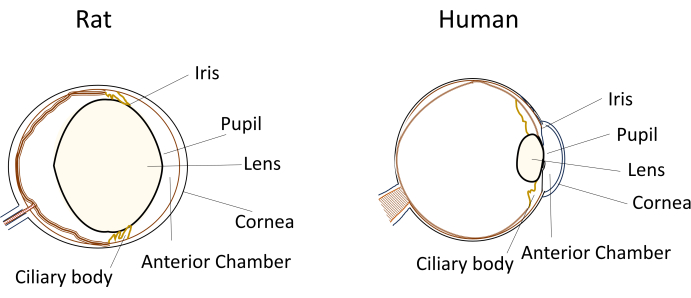
איור 1: ייצוג סכמטי של מאפייני המקטע האנטומי הקדמי של חולדה ועיניים אנושיות. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
הניסויים בפרוטוקול אושרו על ידי ועדת ההיתרים הארצית - למדעי בעלי חיים ועומדים בהצהרת ARVO לשימוש בבעלי חיים במחקר עיניים וראייה. נקבות חולדות Sprague-Dawley, בגילאי 8-10 שבועות, שימשו במחקר הנוכחי ונחשפו למחזורי אור-חושך של 12/12 שעות. בעלי החיים התקבלו ממקור מסחרי (ראו טבלת חומרים).
1. הכנת בעלי חיים
- הכינו תערובת מרדימה של קטמין (80 מ"ג/ק"ג משקל גוף ב-0.8 מ"ל) וקסילזין (4 מ"ג/ק"ג משקל גוף ב-0.2 מ"ל) והזריקו אותה תוך צפקית בזריקה אחת כדי להרדים את החולדות.
- להזריק משכך כאבים buprenorphine (0.03 מ"ג / ק"ג) intraperitoneally בזריקה אחת.
- החל הרדמה אופתלמית מקומית 0.4% oxybuprocaine על שתי העיניים.
2. יצירת תעלת קרנית אוטמת עצמה
- ייצוב העין על ידי החזקת לובן העין העליון בקו האמצע האנכי ליד הצומת הקורנאוסקרלי עם מלקחיים אופתלמיים כירורגיים.
- תחת מיקרוסקופ כירורגי, הניחו להב סטילטו סטרילי בקוטר 0.8 מ"מ, 31 G באזור הקרנית הפארא-מרכזית בקו האמצע האנכי (מעל מרכז האישון) במצב שטוח בזווית קרובה ככל האפשר לאופקית (איור 2).
- במצב זה, לנקב את הקרנית כדי לבצע חתך וליצור מנהרה ארוכה (2-3 מ"מ) עד שהיא חודרת לאזור המרכזי של החדר הקדמי. הימנעו מלגעת בעדשה (איור 2).
הערה: מנהרה מוצלחת לא תגרום לדליפה של ההומור המימי והרידוד של החדר הקדמי. - יש למרוח 0.3% ofloxacin מקומי ו-0.1% dexamethasone על העין המוזרקת.
- יש לבחון תחת מיקרוסקופ סדק באופן הבא.
- שימו לב לעומק החדר הקדמי של העין המוזרקת בהשוואה לעין שאינה מוזרקת.
הערה: העומק צריך להיות דומה. - שימו לב לעדשת העין המוזרקת בהשוואה לעין שאינה מוזרקת.
הערה: העדשה צריכה להיות ברורה. האטימות עלולה לשקף נזק לעדשה במהלך ההליך הכירורגי.
- שימו לב לעומק החדר הקדמי של העין המוזרקת בהשוואה לעין שאינה מוזרקת.

איור 2: ייצוג סכמטי של הלהב וזווית החתך ומיקומו. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. אפשרות 1: הזרקה תוך-מצלמה של טריפאן כחול להערכת הזריקה המוצלחת לחדר הקדמי
- יש להעמיס 5 μL של טריפאן כחול לתוך מזרק סטרילי של 10 μL זכוכית המילטון עם מחט קהה 34 G.
הערה: הזרקת טריפאן כחול מתוארת כאמצעי להערכת הצלחת ההזרקה במהלך שלבי כיול המודל או ההתקנה. בהגדרות הניסוי, ניתן לטעון את המזרק בתמיסה של התרכובת הנבחרת. - הכנס את מחט המזרק הטעונה דרך התעלה שנוצרה בסעיף 2 לתא הקדמי.
- יש להזריק ולהחזיק את המחט במקומה לאחר ההזרקה למשך 2-3 שניות עד שכל הנוזלים יתבהרו.
- הסר את המחט על ידי שליפתה החוצה בעדינות ובאיטיות כדי למנוע דליפה מתעלת הקרנית.
- יש לבחון תחת מיקרוסקופ חריץ. להעריך את עומק החדר הקדמי כדי למנוע רידוד ולאמת את נוכחותו של כחול טריפאן בחדר הקדמי.
- יש לחזור על בדיקת החריץ לאחר 24 שעות, 48 שעות ו-72 שעות.
4. אפשרות 2: הזרקה תוך-מצלמה של Hoechst להערכת הזמינות הביולוגית של חומר מוזרק לשכבת תאי האנדותל
- יש להעמיס 5 μL של Hoechst לתוך מזרק המילטון סטרילי זכוכית 10 μL עם מחט קהה 34 G.
הערה: הזרקת Hoechst מתוארת כאמצעי להערכת הזמינות הביולוגית של חומר מוזרק על ידי ספיגה לתוך שכבת תאי האנדותל והיא שימושית במהלך כיול המודל או שלבי ההתקנה. בהגדרות הניסוי, ניתן לטעון את המזרק בתמיסה של התרכובת הנבחרת. - הכנס את מחט המזרק הטעונה דרך התעלה שנוצרה בסעיף 2 לתא הקדמי.
- יש להזריק ולהחזיק את המחט במקומה לאחר ההזרקה למשך 2-3 שניות עד שכל הנוזלים יתבהרו.
- הסר את המחט על ידי שליפתה החוצה בעדינות ובאיטיות כדי למנוע דליפה מהחתך בתעלת הקרנית.
- כ 15-20 דקות לאחר ההזרקה, להרדים את החולדות על ידי הזרקה intraperitoneal של 500 מ"ג / ק"ג נתרן pentobarbitone.
- לחנך את שתי העיניים ולבודד קרניות. לאסוף את הקרנית שלא הוזרקה כבקרה.
- יש להכתים את שתי הקרניות ב-0.5% Alizarin Red S בהתאם להוראות היצרן לזיהוי תאי אנדותל.
- בחנו תחת מיקרוסקופ אור כדי לדמות את הצביעה האדומה-אליזרינית של תאי אנדותל ותחת מיקרוסקופ פלואורסצנטי כדי לצפות בצביעת הוכסט, בהשוואה לקרנית שלא הוזרקה כבקרה.
תוצאות
לחולדות Sprague Dawley הוזרקו 5 μL של טריפאן כחול בהתאם לפרוטוקול שתואר לעיל. בדיקת מנורת חריץ מיד לאחר ההזרקה הראתה שהחדר היה מוכתם בכחול טריפאן, מה שמעיד על כך שהחומר המוזרק הגיע לחדר הקדמי (איור 3). יתר על כן, עומק החדר הקדמי היה שלם, מה שמרמז על כך שההזרקה לא גרמה לדליפה של הומור מימי ורידוד של החדר.

איור 3: תא קדמי שלם לאחר הזרקה תוך-מצלמה. כחול טריפאן הוזרק לחדר הקדמי של החולדה. בדיקת מיקרוסקופ חריץ מדגימה נוכחות של טריפאן כחול ללא דליפה או רידוד של החדר הקדמי. סרגל קנה מידה = 1 מ"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
לאחר מכן, Hoechst, צבע פלואורסצנטי חדיר לתא הקושר DNA ומכתים גרעיני תאים, הוזרק כדי להעריך את הזמינות הביולוגית של תרופות המועברות על ידי מסלול ההזרקה התוך-קמראלי המתואר. ספיגת Hoechst על ידי תאי אנדותל הוערכה 15 דקות לאחר ההזרקה על ידי בידוד קרניות והתבוננות תחת מיקרוסקופ פלואורסצנטי. כדי לזהות תאי אנדותל, הקרניות הוכתמו ב-Alizarin Red S, אשר מכתים את הגבולות הבין-תאיים של שכבת תאי האנדותל. כביקורת, בחנו את העין שלא הוזרקה מאותה חולדה. התוצאות שלנו מראות כי שכבת תאי האנדותל הייתה שלמה לאחר ההזרקה, מה שתומך בכך שההליך המתואר אינו גורם נזק לאנדותל. יתר על כן, תאי אנדותל היו חיוביים לצביעה גרעינית של Hoechst, והדגימו את ספיגת Hoechst המוזרק לאחר הזרקה תוך-מצלמה (איור 4).
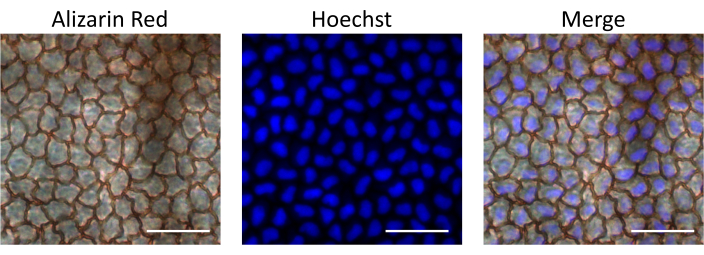
איור 4: זמינות ביולוגית של חומר מוזרק תוך-מצלמה לשכבת תאי האנדותל. הוכסט הוזרק לחדר הקדמי של החולדה. הקרנית בודדה 15 דקות לאחר ההזרקה, הוכתמה ב-Alizarin Red S כדי לצפות בתאי אנדותל, וצולמה תחת מיקרוסקופ פלואורסצנטי כדי לצפות בצביעת Hoechst. תמונות כיסוי מדגימות צביעת Hoechst גרעינית בתאי אנדותל בקרנית. פסי קנה מידה = 50 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
מודלים של מחקר פרה-קליני צריכים לספק סביבה מבוקרת וניתנת לשחזור כדי להבטיח את האמינות והישימות של הממצאים. במחקר עיניים, מודלים של הזרקת עיניים משמשים בדרך כלל בהיבטי מחקר מגוונים, החל מהקמת מודלים של מחלות, בדיקת טיפולים חדשים והערכת תגובות לרקמות ותופעות לוואי אפשריות.
הזרקות תוך מצלמה משמשות כטכניקה נפוצה ברפואת עיניים ניסיונית, ומקלות על העברה ישירה של תרכובות להומור המימי תוך עקיפת מחסומי רקמת העין החיצונית5. גישה ממוקדת זו באמצעות הזרקה תוך מצלמה מבטיחה כי ריכוז אופטימלי של התרופה מגיע לאתר הפעולה המיועד, כגון העדשה, רשת טרבקולרית, או אנדותל הקרנית, ובכך למקסם את היתרונות הטיפוליים.
ביצוע הזרקות intracameral במכרסמים קטנים מציב מספר אתגרים טכניים שיכולים להשפיע על שחזור ניסיוני והצלחה. ראשית, הממדים הקטנים של עין המכרסם מציבים קשיים בגישה ובמניפולציה מבלי לגרום נזק למבני העין. חולדות, בהקשר זה, מציעות כמה יתרונות על פני עכברים בשל עיניהן הגדולות יותר. שנית, מיקום העדשה בחדר הקדמי הסגור עלול לחסום את הדרך לאתר ההזרקה. בהשוואה ליונקים אחרים, כולל בני אדם, לחולדות יש עדשה שידועה כבולטת או בולטת, מה שתורם לגודלה הגדול יחסית לעין (איור 1). בנוסף, עדשת החולדה חסרה את הגמישות שנראית בעדשה האנושית. כתוצאה מכך, נדרש תמרון זהיר של מחט ההזרקה כדי לנווט סביב העדשה מבלי לגרום נזק.
נזק לרקמות במהלך מניפולציה יכול להוביל לסיבוכים שונים, כולל רידוד החדר הקדמי, לחץ תוך עיני מוגבר, דלקת או אובאיטיס קדמית, נזק לתאי אנדותל, היווצרות קטרקט, שינויים מבניים אחרים או עיוותים, ואת הסיכון של זיהום. אתגרים אלה מדגישים את הצורך בטכניקות מדויקות ובהתחשבות זהירה בהבדלים אנטומיים בעת ביצוע הזרקות תוך-מצלמה בדגמי מכרסמים קטנים.
טכניקת ההזרקה התוך-מצלמה המתוארת בפרוטוקול זה נועדה למזער את הסיכון לפגיעה ברקמות העין במהלך תהליך ההזרקה. השיטה כוללת הקמת מנהרה אוטמת עצמית לתוך החדר הקדמי, המאפשרת כניסה עם התנגדות חיכוך מינימלית. חתך אטום היטב חיוני כדי להפחית את הסיכון להיפוטוניה ולדליפת נוזלים לאחר הניתוח ולמנוע זיהום על ידי מיקרואורגניזמים מהעפעפיים והריסים. הזווית והאורך של החתך קריטיים לדינמיקה של הפצע, להתפתחות תופעות לוואי ולהתאוששות שלאחר מכן. חתכים גדולים מדי עלולים לערער את ציר הראייה ולגרום לבצקת או בצקת בקרנית, בעוד חתכים קצרים עלולים לערער את יציבות החדר הקדמי ולגרום לצניחת קשתית. ביצוע חתך בזווית הקרובה לציר מישור הקרנית מאפשר יצירת מנהרה חד מישורית ארוכה ללא הסיכונים הכרוכים בכך. חשוב לציין, חדירת המחט לחדר הקדמי דרך מנהרה ארוכה מונחית משפרת את הדיוק, ומפחיתה את הסבירות לגעת בשוגג בעדשה. בנוסף, בניגוד להזרקה בבני אדם, שם מעדיפים חתכים היקפיים, המנהרה בחולדות מתבצעת במרכז הקרנית, שם החדר הקדמי הוא העמוק ביותר. תיקוף ניסיוני אישר כי שיטה זו מאפשרת הזרקות מבלי לחוות דליפה של הומור מימי או רידוד של החדר הקדמי ומבלי לגעת בעדשה.
מחקרים קודמים תיארו שיטות שונות להזרקה לחדר הקדמי בחולדות. לדוגמה, קבוצת רוזנשטיין תיארה במספר מחקרים את ההזרקה לחדר הקדמי דרך הלימבוס הקורנאוסקלרלי. הזרקה של 20 μL נוזל הגדילה בהדרגה את עומק החדר ובכך הפרידה את המחט מהקשתית, התומכת בהימנעות ממגע של המחט עם העדשה. תופעות הלוואי של הזריקה דווחו כבצקת חולפת בקרנית וכ-5% שכיחות של קטרקט 14,15,16. Matsumoto et al. תיארו טכניקת הזרקת מיקרו-חרוזים תוך-מצלמה בחולדות כדי לייצר מודל גלאוקומה. החוקרים השתמשו בחתך חד-שלבי, ויצרו תעלה סקלרוקוקרנית באמצעות מחט 34 גרם, שהוחדרה בשיפוע לחדר הקדמי. החוקרים דיווחו על הימנעות מפגיעה בקרנית או בקשתית ולא ציינו אירועים דלקתיים, כאשר רק מקרים בודדים (<7% מבעלי החיים שנבדקו) פגעו בשכבת האנדותל במהלך הזרקות. עם זאת, המחברים תיארו כי הזרקה מותאמת זו לבדה לא הספיקה כדי למנוע דליפה משמעותית מהחדר הקדמי וריפלוקס לחלל התת-לחמית. כדי להתגבר על זה, תערובת של 20 μL של microbeads עם מכשיר viscosurgical אופתלמי מפוזר (OVD; ויסקואט) הוזרק. זה הביא לרמות לחץ תוך עיני גבוהות באופן משמעותי (IOP) עד 4 שבועות לאחר הזרקה17. באופן דומה, ליו ועמיתיו תיארו הזרקה תוך-מצלמה באמצעות מחט 32 G המוחדרת לחדר הקדמי במקביל לקשתית לאורך הלימבוס, ויוצרת מנהרת קרנית18 אוטמת את עצמה. החוקרים הזריקו 3 μL של הידרוג'ל חומצה היאלורונית נתרן, ונעשה שימוש במקלון צמר גפן כדי לדחוס את אתר ההזרקה כדי למזער דליפה החוצה מהחדר הקדמי. הג'ל בעל המשקל המולקולרי הגבוה תואר כנשמר בחדר הקדמי וחוסם את זרימת ההומור המימי דרך הרשת הטרבקולרית18. ראוי לציין כי שיטת הזרקת intracameral שונה המתוארת כאן סובלת הזרקה ללא סוכנים viscoelastic ולכן הוא ישים למגוון רחב של יישומי מחקר. עם זאת, מכיוון שמחקר זה הוגבל להזרקת תמיסות נוזליות בנפח של לא יותר מ -5 מיקרוליטר, יש לבצע השוואה מדויקת של שיטות הזרקה וחומרים מוזרקים למטרות מחקר ספציפיות כדי לקבוע את הטכניקה המתאימה ביותר.
היישום הקליני של זריקות intracameral הוא מגוון ונרחב. לדוגמה, מתן intracameral של סטרואידים ואנטיביוטיקה, כגון cefuroxime ו moxifloxacin, נפוץ במהלך ניתוחי קטרקט כאמצעי מניעתי למניעת זיהום לאחר הניתוח אנדופתלמיטיס 19,20,21,22,23,24,25. לידה תוך עינית משמשת גם להרדמה מקומית ומידריאזיס במהלך ניתוחי קטרקט שגרתיים26,27. יתר על כן, הטיפול בגלאוקומה כרוך בשימוש בתרופות שונות המועברות תוך camerally המפחיתות את הלחץ התוך עיני, כגון אנלוגים פרוסטגלנדינים או אגוניסטים מוסקריניים, המגבירים את זרימת ההומור המימית, סוכנים אנטי-פיברוטיים כגון מיטומיצין C למניעת הצטלקות ופיברוזיס, וגורמי גדילה אנדותל אנטי-וסקולריים (anti-VEGF) סוכני גלאוקומה ניאו-וסקולרית 28,29,30 . מגוון רחב זה של טיפולים תוך-מצלמה משקף את תפקידם המכריע בטיפול במצבים אופתלמיים שונים ובשיפור תוצאות המטופלים.
שיטת ההזרקה התוך-מצלמה המתוארת כאן תהיה יתרון למחקרים פרה-קליניים מגוונים שמטרתם לקדם את היישומים הקליניים הנרחבים של הזרקות תוך-מצלמה. לדוגמה, שימוש בהזרקה תוך-מצלמה במודלים של חולדות כדי לקבוע את היעילות, המינונים האופטימליים, העיתוי והתוצאות ארוכות הטווח של תרופות שונות הוא צעד ראשוני חיוני לפני התקדמות לניסויים קליניים. במחקרים כאלה, שיפור הדיוק והשחזור של טכניקת ההזרקה יהיה המפתח להישגים מוצלחים ולהתקדמות המחקר.
יתר על כן, השיטה המתוארת של הזרקה intracameral עשוי לשמש כדי ליצור מודלים ניסיוניים של פתולוגיות עיניים שונות על ידי העברת וקטורים או כימיקלים לחדר הקדמי. מודלים ניסיוניים כאלה הם המפתח לחקר מנגנוני המחלה ולפיתוח טיפולים חדשים. לדוגמה, ניוון אנדותל של פוקס (FED), מחלת קרנית מתקדמת הגורמת לאובדן ראייה הדרגתי, חסר תרופה31. הטיפול הראשוני כולל ניטור ומתן הקלה בתסמינים, לעתים קרובות באמצעות תרופות מקומיות להקלה זמנית על בצקת או סיכה בעיניים. במקרים של התקדמות המחלה או ליקוי ראייה חמור, השתלת קרנית (קרטופלסטיקה אנדותלית) הופכת להתערבות הכרחית. מחקר שמטרתו לפתח אפשרויות טיפול חדשות עבור FED, שעשויות להציע חלופות להשתלת קרנית, מוצדק מאוד. בהתחשב בזמינות הביולוגית המוגבלת של תרופות המועברות דרך הקרנית או הלחמית 1,2,3, מתן תוך מצלמה מתגלה כנתיב יתרון לטיפול בשכבת האנדותל. מודלים ניסיוניים של הזרקה תוך-מצלמה ממלאים תפקיד מכריע בפיתוח גישות טיפוליות חדשניות ל-FED. שימוש בגישה המתוארת כאן להזרקה תוך-מצלמה יכול לגרום לספיגה של חומר מוזרק לשכבת האנדותל של הקרנית. יישום שיטה זו בהזרקה תוך-מצלמה מאפשר יצירת מודלים ניסיוניים לטיפול ב-FED בדיוק גבוה וביכולת שחזור. זה לא רק תורם לקידום ההבנה שלנו של FED אלא גם פותח דרכים לפיתוח התערבויות טיפוליות ממוקדות ויעילות.
לסיכום, המתואר כאן הוא הליך אופטימלי להזרקה intracameral בחולדות עם סיכון נמוך של תופעות לוואי, אשר יהיה בעל ערך לשיפור מחקר עיניים טרום קליני ולתרום לפיתוח של אפשרויות טיפוליות חדשות עבור פתולוגיות עיניים.
Disclosures
מרקוביץ א.ל. מחזיק בפטנטים בחברות Steba Biotech, ידע ויצמן, EyeYon Medical ומור איסום ומשמש כיועץ לחברות EyeYon Medical ו-Johnson &Johnson. לכל שאר המחברים אין אינטרסים מתחרים.
Acknowledgements
מחקר זה נתמך על ידי מענקי הקרן הלאומית למדע 2670/23 ו-1304/20.
Materials
| Name | Company | Catalog Number | Comments |
| Alizarin Red | Alpha Aesar | 042040.5 | |
| Buprenorphine | Richter pharma | 102047 | |
| Dexamethasone 0.1% | Fisher Pharmaceutical | 393102-0413 | |
| Hamilton glass syringe 10 μL | Hamilton Co. | 721711 | |
| Hoeschst | Merck | B2261 | |
| Ketamine | Bremer pharma GMBH (medimarket) | 17889 | |
| Ofloxacin 0.3% eye drops | Allergan | E92170 | |
| Oxybuprocaine Hydrochloride 0.4% | Fisher Pharmaceutical | N/A | |
| Pentobarbital sodium 200 mg/mL | CTS | N/A | |
| Slit microscope | Haag-streit bern | b-90019115 | |
| Sprague-Dawley Rats | Envigo | N/A | |
| Stiletto blade 31 G 0.8 mm | Tecfen medical (skymed) | QKN2808 | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Trypan Blue | Sartorius | 03-102-1B | |
| Xylazine | Eurovet Animal Health | 615648 |
References
- Ramsay, E., et al. Corneal and conjunctival drug permeability: Systematic comparison and pharmacokinetic impact in the eye. Eur J Pharm Sci. 119, 83-89 (2018).
- Cholkar, K., Dasari, S. R., Pal, D., Mitra, A. K. Eye: Anatomy, Physiology and Barriers to Drug Delivery. Ocular Transporters and Receptors. , Elsevier, Woodhead Publishing. (2013).
- Prausnitz, M. R. Permeability of cornea, sclera, and conjunctiva: A literature analysis for drug delivery to the eye. J Pharm Sci. 87 (12), 1479-1488 (1998).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the Eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 269(2020).
- Gautam, M., et al. Intracameral drug delivery: A Review of agents, indications, and outcomes. J Ocul Pharmacol Ther. 39 (2), 102-116 (2023).
- Shah, T. J., Conway, M. D., Peyman, G. A. Intracameral dexamethasone injection in the treatment of cataract surgery induced inflammation: design, development, and place in therapy. Clin Ophthalmol. 12, 2223-2235 (2018).
- Perlman, R. L. Mouse models of human disease: An evolutionary perspective. Evol Med Public Health. 2016 (1), 170-176 (2016).
- Chawla, S., Jena, S. The Anatomy and Physiology of Laboratory Rat.Essentials of Laboratory Animal Science: Principles and Practices. , Springer. Singapore. (2021).
- Lundström, M., Wejde, G., Stenevi, U., Thorburn, W., Montan, P. Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology. 114 (5), 866-870 (2007).
- Fine, I. H. Clear corneal incisions. Int Ophthalmol Clin. 34 (2), 59-72 (1994).
- Herretes, S., Stark, W. J., Pirouzmanesh, A., Reyes, J. M. G., McDonnell, P. J., Behrens, A. Inflow of ocular surface fluid into the anterior chamber after phacoemulsification through sutureless corneal cataract wounds. Am J Ophthalmol. 140 (4), 737-740 (2005).
- Masket, S., Belani, S. Proper wound construction to prevent short-term ocular hypotony after clear corneal incision cataract surgery. J Cataract Refract Surg. 33 (3), 383-386 (2007).
- Taban, M., Rao, B., Reznik, J., Zhang, J., Chen, Z., McDonnell, P. J. Dynamic morphology of sutureless cataract wounds - Effect of incision angle and location. Surv Ophthalmol. 49, Suppl 2 S62-S72 (2004).
- Belforte, N., Sande, P. H., de Zavalía, N., Dorfman, D., Rosenstein, R. E. Therapeutic benefit of radial optic neurotomy in a rat model of glaucoma. PLoS One. 7 (3), e34574(2012).
- Moreno, M. C., et al. A new experimental model of glaucoma in rats through intracameral injections of hyaluronic acid. Exp Eye Res. 81 (1), 71-80 (2005).
- Belforte, N., Sande, P., de Zavalía, N., Knepper, P., Rosenstein, R. Effect of chondroitin sulfate on intraocular pressure in rats. Invest Ophthalmol Vis Sci. 51 (11), 5768-5775 (2010).
- Matsumoto, Y., Kanamori, A., Nakamura, M., Negi, A. Rat chronic glaucoma model induced by intracameral injection of microbeads suspended in sodium sulfate-sodium hyaluronate. Jpn J Ophthalmol. 58 (3), 290-297 (2014).
- Liu, Y., et al. A novel rat model of ocular hypertension by a single intracameral injection of cross-linked hyaluronic acid hydrogel (Healaflow® ). Basic Clin Pharmacol Toxicol. 127 (5), 361-370 (2020).
- Bowen, R. C., et al. Comparative analysis of the safety and efficacy of intracameral cefuroxime, moxifloxacin and vancomycin at the end of cataract surgery: a meta-analysis. Br J Ophthalmol. 102 (9), 1268-1276 (2018).
- Kato, A., et al. Prophylactic antibiotics for postcataract surgery endophthalmitis: a systematic review and network meta-analysis of 6.8 million eyes. Sci Rep. 12 (1), 17416(2022).
- Wang, M., Liu, Y., Dong, H. Effect of cefuroxime intracameral injection antibiotic prophylactic on postoperative endophthalmitis wound post-cataract: A meta-analysis. Int Wound J. 20 (5), 1376-1383 (2023).
- Katz, G., et al. Intracameral cefuroxime and the incidence of post-cataract endophthalmitis: an Israeli experience. Graefes Arch Clin Exp Ophthalmol. 253 (10), 1729-1733 (2015).
- Lipnitzki, I., Ben Eliahu, S., Marcovitz, A. L., Ezov, N., Kleinmann, G. Intraocular concentration of moxifloxacin after intracameral injection combined with presoaked intraocular lenses. J Cataract Refract Surg. 40 (4), 639-643 (2014).
- Colleaux, K. M., Hamilton, W. K., Morgan, R. A. Effect of prophylactic antibiotics and incision type on the incidence of endophthalmitis after cataract surgery. Can J Ophthalmol. 35 (7), 373-378 (2000).
- Libre, P. E., Della-Latta, P., Chin, N. X. Intracameral antibiotic agents for endophthalmitis prophylaxis: A pharmacokinetic model. J Cataract Refract Surg. 29 (9), 1791-1794 (2003).
- Carino, N. S., Slomovic, A. R., Chung, F., Marcovich, A. L. Topical tetracaine versus topical tetracaine plus intracameral lidocaine for cataract surgery. J Cataract Refract Surg. 24 (12), 1602-1608 (1998).
- Minakaran, N., Ezra, D. G., Allan, B. D. Topical anaesthesia plus intracameral lidocaine versus topical anaesthesia alone for phacoemulsification cataract surgery in adults. Cochrane Database Syst Rev. 7 (7), CD005276 (2020).
- Dan-Ni, W., Li-Dian, H., Zhi-Guo, P., Qiang, W., Lei, S. Intracameral anti-VEGF injection for advanced neovascular glaucoma after vitrectomy with silicone oil tamponade. Int J Ophthalmol. 14 (3), 129-135 (2021).
- Bhagat, P. R., Agrawal, K. U., Tandel, D. Study of the effect of injection bevacizumab through various routes in neovascular glaucoma. J Curr Glaucoma Pract. 10 (2), 39-48 (2016).
- Al-Qaysi, Z. K., Beadham, I. G., Schwikkard, S. L., Bear, J. C., Al-Kinani, A. A., Alany, R. G. Sustained release ocular drug delivery systems for glaucoma therapy. Expert Opin Drug Deliv. 20 (7), 905-919 (2023).
- Eghrari, A. O., Gottsch, J. D. Fuchs' corneal dystrophy. Expert Rev Ophthalmol. 5 (2), 147-159 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved