Method Article
Injection intracamérulaire chez le rat présentant un faible risque d’effets indésirables
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit une technique d’injection intracamérale chez le rat à l’aide d’une incision cornéenne centrale et d’un long tunnel dans la chambre antérieure. Cette méthode d’injection minimise le risque d’induire des lésions tissulaires par inadvertance et améliore ainsi la précision et la reproductibilité.
Résumé
L’injection intracamérale est une routine d’administration standard en ophtalmologie. L’application de l’injection intracamérulaire chez les rongeurs pour la recherche est difficile en raison des dimensions et de l’anatomie limites de l’œil, notamment le petit volume de l’humeur aqueuse, la courbure du cristallin et l’épaisseur du cristallin. Les dommages potentiels lors des injections intracamérulaires introduisent des effets indésirables et une variabilité expérimentale. Ce protocole décrit une procédure d’injection intracamérulaire chez le rat, permettant précision et reproductibilité.
Des rats Sprague-Dawley ont été utilisés comme modèles expérimentaux. Étant donné que la position de la lentille chez le rat fait saillie dans la chambre antérieure, l’injection à partir de la périphérie, comme chez l’homme, est défavorable. Par conséquent, une incision est créée dans la région cornéenne centrale à l’aide d’une lame aiguille de 0,8 mm de calibre 31 pour former un tunnel auto-scellant dans la chambre antérieure. Une incision à un angle proche du plat permet de créer un long tunnel, ce qui minimise la perte d’humeur aqueuse et la profondeur de la chambre antérieure. Une nano-aiguille de calibre 34 est insérée dans le tunnel pour l’injection. Cela permet une pénétration avec une résistance minimale au frottement et évite de toucher l’objectif. L’injection de trypan-blue permet de visualiser par microscopie à fente la présence du colorant dans la chambre antérieure et d’exclure les fuites. La biodisponibilité pour la couche endothéliale cornéenne est démontrée par l’injection d’un colorant Hoechst, qui a coloré les noyaux des cellules endothéliales cornéennes après l’injection.
En conclusion, ce protocole met en œuvre une procédure d’injection intracamérale précise chez le rat. Cette procédure peut être utilisée pour l’administration intracamérale de divers médicaments et composés dans des modèles expérimentaux de rats, augmentant ainsi l’efficacité et la reproductibilité de la recherche ophtalmique.
Introduction
La biodisponibilité des composés délivrés par administration topique à la surface de l’œil est considérablement limitée, généralement <5 %1. Les composés administrés par les gouttes ophtalmiques sont principalement éliminés par drainage, larmoiement induit, renouvellement du liquide lacrymal et absorption conjonctivale. De plus, la perméation des composés à travers la surface oculaire est fortement limitée par la barrière cornée-conjonctive 1,2,3. La cornée est composée de trois couches principales : l’épithélium le plus externe, le stroma intermédiaire et l’endothélium le plus interne. L’épithélium cornéen superficiel est interconnecté par des jonctions fortes et serrées et crée une résistance paracellulaire élevée, qui est le principal obstacle à la perméabilité de la substance. Les multiples couches d’épithélium limitent en outre la perméation des molécules hydrophiles et de grande taille à travers les espaces intercellulaires de l’épithélium de la cornée. Succédant à l’épithélium, le stroma est composé de fibres de collagène et contient des pores aqueux. Contrairement à l’épithélium cornéen, le stroma permet le mouvement des médicaments hydrophiles ; Cependant, il est grandement imperméable aux composés lipophiles 1,2,3. Ensemble, l’épithélium cornéen et les couches stromales présentent d’importantes barrières tissulaires qui limitent l’absorption des médicaments. L’endothélium cornéen n’est pas considéré comme limitant le transport des médicaments.
L’alternative à la voie d’administration cornéenne est la voie conjonctivale. La conjonctive est une couche multi-épithéliale qui recouvre la face interne des paupières et la partie antérieure de la sclère. La conjonctive est caractérisée par moins de jonctions serrées que l’épithélium cornéen, ce qui permet une meilleure perméabilité des médicaments hydrophiles. Cependant, la vascularisation de la conjonctive entraîne une absorption systémique d’une grande fraction des molécules administrées, limitant à nouveau considérablement la biodisponibilité des composés délivrés dans la chambre antérieure 1,2. Un moyen efficace de contourner les barrières de perméabilité oculaire externes consiste à administrer le médicament directement dans la région d’intérêt. Par exemple, l’injection intravitréenne est courante pour l’administration dans l’humeur vitrée4. De même, l’injection intracamérulaire est utilisée pour l’administration dans la chambre antérieure5. L’établissement d’une concentration efficace au niveau de la chambre antérieure est essentiel dans diverses situations cliniques, telles que le traitement de l’infection par injection intracamérale d’antibiotiques et les traitements anti-inflammatoires postopératoires dans les chirurgies de la cataracte. Malgré l’avantage de l’amélioration de la biodisponibilité de la substance accordée par l’injection intracamérale, il existe des problèmes de sécurité majeurs qui doivent être pris en compte. Par exemple, l’injection intracamérulaire de drogues peut induire une augmentation de la pression intraoculaire, un syndrome du segment antérieur toxique et un syndrome de destruction des cellules endothéliales toxiques 5,6. Il est donc essentiel d’évaluer soigneusement dans les études précliniques l’efficacité et l’innocuité des médicaments administrés par injections intracamérales afin de maximiser l’efficacité du traitement et de minimiser les effets indésirables potentiels chez les patients.
Les modèles animaux expérimentaux sont indispensables dans les études précliniques pour étudier de nouveaux traitements. Les petits rongeurs, tels que les souris et les rats, sont les animaux de laboratoire les plus couramment utilisés à ces fins. Ces animaux présentent de nombreuses similitudes avec l’anatomie et la physiologie humaines, fournissant des informations précieuses. De plus, leur utilisation est économiquement avantageuse en raison de leur petite taille, de leur facilité d’entretien, de leur gestation rapide et de leur capacité à produire un grand nombre de descendants7.
Malgré l’utilisation généralisée de petits rongeurs dans les modèles de maladies oculaires, leurs dimensions oculaires et leur anatomie uniques posent des défis importants lors des manipulations expérimentales. Par exemple, des procédures telles que les injections intracamérales, qui sont relativement simples chez l’homme, deviennent techniquement exigeantes chez les souris et les rats. Les défis découlent de facteurs tels que le faible volume d’humeur aqueuse, le cristallin relativement grand et inflexible, ainsi que le positionnement obstructif et la courbure du cristallin dans les yeux des rongeurs (Figure 1)8. Ces défis augmentent le risque de dommages lors des injections intracamérulaires chez les rongeurs, entraînant des effets indésirables potentiels et introduisant une variabilité expérimentale qui peut avoir un impact sur la validité des conclusions de l’étude. Dans nos recherches, nous avons réussi à mettre au point une procédure d’injection intracamérulaire sûre chez le rat. La technique consiste à créer un long tunnel plat et auto-obturant dans la cornée jusqu’à la chambre antérieure. Cette méthode garantit non seulement la précision, mais améliore également la reproductibilité expérimentale, en répondant aux problèmes liés aux techniques d’injection chez les petits rongeurs.
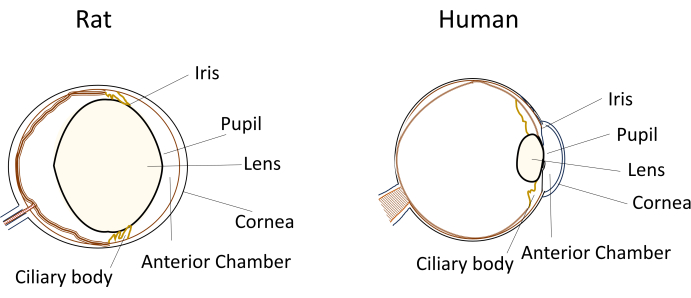
Figure 1 : Représentation schématique des caractéristiques anatomiques du segment antérieur des yeux du rat et de l’homme. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
Les expériences du protocole ont été approuvées par le Comité national des permis - pour la science animale et sont conformes à la déclaration de l’ARVO sur l’utilisation d’animaux dans la recherche ophtalmique et visuelle. Des rats Sprague-Dawley femelles, âgés de 8 à 10 semaines, ont été utilisés pour la présente étude et ont été exposés à des cycles lumière-obscurité de 12/12 h. Les animaux ont été obtenus d’une source commerciale (voir la Table des matières).
1. Préparation des animaux
- Préparez un mélange anesthésique de kétamine (80 mg/kg de poids corporel dans 0,8 ml) et de xylazine (4 mg/kg de poids corporel dans 0,2 ml) et injectez-le par voie intrapéritonéale en une seule injection pour anesthésier les rats.
- Injecter l’analgésique buprénorphine (0,03 mg/kg) par voie intrapéritonéale en une seule injection.
- Appliquez un anesthésique ophtalmique topique à 0,4 % d’oxybuprocaïne sur les deux yeux.
2. Création d’un tunnel cornéen auto-obturant
- Stabilisez l’œil en tenant la sclérotique supérieure sur la ligne médiane verticale à côté de la jonction cornéo-sclérale à l’aide d’une pince ophtalmique chirurgicale.
- Sous un microscope chirurgical, placez une lame aiguille stérile de 0,8 mm, 31 G dans la région cornéenne paracentrale sur la ligne médiane verticale (au-dessus du centre de la pupille) en position plate à un angle aussi proche que possible de l’horizontale (Figure 2).
- Dans cette position, percez la cornée pour faire une incision et créez un long tunnel (2-3 mm) jusqu’à ce qu’il pénètre dans la zone centrale de la chambre antérieure. Évitez de toucher l’objectif (Figure 2).
REMARQUE : Un tunnel réussi n’induira pas de fuite de l’humeur aqueuse et de rétrécissement de la chambre antérieure. - Appliquez localement 0,3 % de loxacine et 0,1 % de dexaméthasone dans l’œil injecté.
- Examinez au microscope à fente comme suit.
- Observez la profondeur de la chambre antérieure de l’œil injecté par rapport à l’œil non injecté.
REMARQUE : La profondeur doit être similaire. - Observez le cristallin de l’œil injecté par rapport à l’œil non injecté.
REMARQUE : L’objectif doit être clair. L’opacité peut refléter des lésions du cristallin pendant l’intervention chirurgicale.
- Observez la profondeur de la chambre antérieure de l’œil injecté par rapport à l’œil non injecté.

Figure 2 : Représentation schématique de l’angle et de la position de la lame et de l’incision. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Option 1 : Injection intracamérulaire de bleu de trypan pour évaluer la réussite de l’injection dans la chambre antérieure
- Chargez 5 μL de bleu trypan dans une seringue Hamilton en verre stérile de 10 μL avec une aiguille émoussée de 34 G.
REMARQUE : L’injection de bleu de trypan est décrite comme un moyen d’évaluer le succès de l’injection pendant les étapes d’étalonnage ou de configuration du modèle. Dans les contextes expérimentaux, la seringue peut être chargée d’une solution du composé de votre choix. - Insérez l’aiguille de la seringue chargée dans le tunnel créé à la section 2 dans la chambre antérieure.
- Injectez et maintenez l’aiguille en place après l’injection pendant 2 à 3 secondes jusqu’à ce que tout le liquide disparaisse.
- Retirez l’aiguille en la tirant doucement et lentement pour éviter les fuites du tunnel cornéen.
- Examen au microscope à fente. Évaluez la profondeur de la chambre antérieure pour exclure les eaux peu profondes et vérifiez la présence de bleu de trypan dans la chambre antérieure.
- Répéter l’examen de la fente après 24 h, 48 h et 72 h.
4. Option 2 : Injection intracamérulaire de Hoechst pour évaluer la biodisponibilité du matériau injecté dans la couche de cellules endothéliales
- Chargez 5 μL de Hoechst dans une seringue Hamilton en verre stérile de 10 μL avec une aiguille émoussée de 34 G.
REMARQUE : L’injection de Hoechst est décrite comme un moyen d’évaluer la biodisponibilité du matériau injecté par absorption dans la couche de cellules endothéliales et est utile pendant les étapes d’étalonnage ou de configuration du modèle. Dans les contextes expérimentaux, la seringue peut être chargée d’une solution du composé de votre choix. - Insérez l’aiguille de la seringue chargée dans le tunnel créé à la section 2 dans la chambre antérieure.
- Injectez et maintenez l’aiguille en place après l’injection pendant 2 à 3 secondes jusqu’à ce que tout le liquide disparaisse.
- Retirez l’aiguille en la tirant doucement et lentement pour éviter les fuites de l’incision du canal cornéen.
- Environ 15 à 20 minutes après l’injection, euthanasier les rats par injection intrapéritonéale de 500 mg/kg de pentobarbital sodique.
- Énucléer les deux yeux et isoler les cornées. Prélevez la cornée non injectée comme contrôle.
- Teindre les deux cornées avec 0,5 % de rouge d’alizarine S selon les instructions du fabricant pour identifier les cellules endothéliales.
- Examiner au microscope optique pour imager la coloration rouge d’alizarine des cellules endothéliales et au microscope fluorescent pour observer la coloration de Hoechst, par rapport à la cornée non injectée comme témoin.
Résultats
Des rats Sprague-Dawley ont reçu une injection intracamérale de 5 μL de bleu de trypan selon le protocole décrit ci-dessus. L’examen à la lampe à fente immédiatement après l’injection a montré que la chambre était colorée au bleu trypan, ce qui indique que le matériau injecté a atteint la chambre antérieure (figure 3). De plus, la profondeur de la chambre antérieure était intacte, ce qui suggère que l’injection n’a pas causé de fuite d’humeur aqueuse et de rétrécissement de la chambre.

Figure 3 : Chambre antérieure intacte suite à une injection intracamérulaire. Du bleu de trypan a été injecté dans la chambre antérieure du rat. L’examen par microscopie à fente met en évidence la présence de bleu trypan sans fuite ni bas-fond de la chambre antérieure. Barre d’échelle = 1 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Ensuite, Hoechst, un colorant fluorescent perméable aux cellules qui lie l’ADN et colore les noyaux cellulaires, a été injecté pour évaluer la biodisponibilité des médicaments délivrés par la voie d’injection intracamérulaire décrite. L’absorption de Hoechst par les cellules endothéliales a été évaluée 15 minutes après l’injection en isolant les cornées et en observant au microscope fluorescent. Pour identifier les cellules endothéliales, les cornées ont été colorées avec du rouge d’alizarine S, qui colore les bords intercellulaires de la couche de cellules endothéliales. À titre de contrôle, nous avons examiné l’œil non injecté du même rat. Nos résultats démontrent que la couche de cellules endothéliales était intacte après l’injection, ce qui confirme que la procédure décrite ne cause pas de dommages à l’endothélium. De plus, les cellules endothéliales étaient positives pour la coloration nucléaire de Hoechst, démontrant l’absorption du Hoechst injecté après injection intracamérulaire (Figure 4).
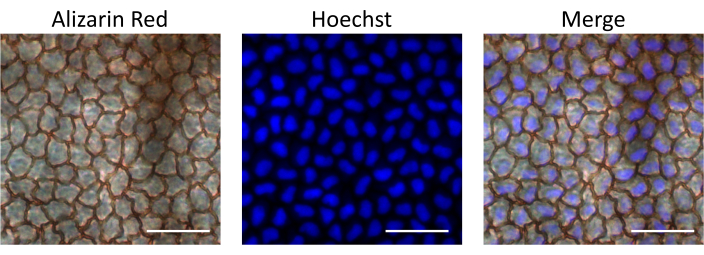
Figure 4 : Biodisponibilité du matériau injecté par voie intracamémique dans la couche de cellules endothéliales. Hoechst a été injecté dans la chambre antérieure du rat. La cornée a été isolée 15 minutes après l’injection, colorée au rouge d’alizarine S pour observer les cellules endothéliales, et imagée au microscope fluorescent pour observer la coloration de Hoechst. Les images superposées montrent la coloration nucléaire de Hoechst dans les cellules endothéliales cornéennes. Barres d’échelle = 50 μM. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les modèles de recherche préclinique doivent fournir un environnement contrôlé et reproductible pour garantir la fiabilité et l’applicabilité des résultats. Dans la recherche en ophtalmologie, les modèles d’injection oculaire sont couramment utilisés dans divers aspects de la recherche, allant de l’établissement de modèles de maladies, à la mise à l’essai de nouveaux traitements et à l’évaluation des réactions tissulaires et des effets indésirables potentiels.
Les injections intracamérulaires sont une technique courante en ophtalmologie expérimentale, facilitant l’administration directe de composés à l’humeur aqueuse tout en contournant les barrières du tissu oculaire externe5. Cette approche ciblée par injection intracamérulaire garantit qu’une concentration optimale du médicament atteint le site d’action prévu, tel que le cristallin, le réseau trabéculaire ou l’endothélium cornéen, maximisant ainsi les avantages thérapeutiques.
La réalisation d’injections intracamérulaires chez de petits rongeurs présente plusieurs défis techniques qui peuvent avoir un impact sur la reproductibilité et le succès des expériences. Tout d’abord, les petites dimensions de l’œil du rongeur posent des difficultés d’accès et de manipulation sans endommager les structures oculaires. Les rats, dans ce contexte, offrent certains avantages par rapport aux souris en raison de leurs yeux plus grands. Deuxièmement, le positionnement du cristallin dans la chambre antérieure confinée peut obstruer le chemin vers le site d’injection. Comparativement à d’autres mammifères, y compris les humains, les rats ont un cristallin connu pour être saillant ou proéminent, ce qui contribue à sa taille relativement grande par rapport à l’œil (figure 1). De plus, la lentille du rat n’a pas la flexibilité observée dans le cristallin humain. Par conséquent, une manœuvre prudente de l’aiguille d’injection est nécessaire pour naviguer autour de la lentille sans causer de dommages.
Les lésions tissulaires lors de la manipulation peuvent entraîner diverses complications, notamment la réduction de la chambre antérieure, l’augmentation de la pression intraoculaire, l’inflammation ou l’uvéite antérieure, les lésions des cellules endothéliales, la formation de cataracte, d’autres changements structurels ou déformations et le risque d’infection. Ces défis mettent en évidence la nécessité de techniques précises et d’une prise en compte minutieuse des différences anatomiques lors de la réalisation d’injections intracamérulaires dans des modèles de petits rongeurs.
La technique d’injection intracamérulaire décrite dans ce protocole a été conçue pour minimiser le risque d’endommager les tissus oculaires pendant le processus d’injection. La méthode consiste à établir un tunnel auto-obturant dans la chambre antérieure, facilitant l’entrée avec une résistance minimale au frottement. Une incision bien scellée est cruciale pour réduire le risque d’hypotonie postopératoire et de fuite de liquide et prévenir l’infection par des micro-organismes provenant des paupières et des cils. L’angle et la longueur de l’incision sont tous deux essentiels à la dynamique de la plaie, au développement d’effets indésirables et à la récupération ultérieure. Les incisions trop larges peuvent opacifier l’axe visuel et induire des stries cornéennes ou un œdème, tandis que des incisions courtes peuvent déstabiliser la chambre antérieure et induire un prolapsus de l’iris. La réalisation d’une incision à un angle proche de l’axe du plan cornéen permet de générer un long tunnel uniplanaire sans les risques associés. Il est important de noter que la pénétration de l’aiguille dans la chambre antérieure à travers un long tunnel guidé améliore la précision, réduisant ainsi la probabilité de toucher le cristallin par inadvertance. De plus, contrairement à l’injection chez l’homme, où les incisions périphériques sont préférées, le tunnel chez le rat est réalisé au niveau de la cornée centrale, là où la chambre antérieure est la plus profonde. La validation expérimentale a confirmé que cette méthode permet d’effectuer des injections sans subir de fuite d’humeur aqueuse ou de rétrécissement de la chambre antérieure et sans toucher le cristallin.
Des études antérieures ont décrit diverses méthodes d’injection dans la chambre antérieure chez le rat. Par exemple, le groupe de Rosenstein a décrit dans plusieurs études l’injection dans la chambre antérieure à travers le limbe cornéo-scléral. L’injection de 20 μL de liquide a progressivement augmenté la profondeur de la chambre et a ainsi séparé l’aiguille de l’iris, ce qui permet d’éviter le contact de l’aiguille avec le cristallin. Les effets secondaires de l’injection ont été signalés comme un œdème cornéen transitoire et une incidence d’environ 5% de cataractes 14,15,16. Matsumoto et al. ont décrit une technique d’injection intracamérulaire de microbilles chez le rat pour produire un modèle de glaucome. Les auteurs ont utilisé une incision en une seule étape, créant un tunnel sclérocornéen à l’aide d’une aiguille de 34 G, qui a été insérée biseautée dans la chambre antérieure. Les auteurs ont déclaré avoir évité de frapper la cornée ou l’iris et n’ont noté aucun incident inflammatoire, avec seulement quelques cas (<7% des animaux examinés) de dommages à la couche endothéliale lors d’injections. Cependant, les auteurs ont décrit que cette injection modifiée n’était pas suffisante à elle seule pour empêcher une fuite importante hors de la chambre antérieure et un reflux dans l’espace sous-conjonctival. Pour surmonter ce problème, un mélange de 20 μL de microbilles avec un dispositif viscochirurgical ophtalmique dispersif (OVD ; Viscoat) a été injecté. Cela a entraîné des niveaux de pression intraoculaire (PIO) significativement élevés jusqu’à 4 semaines après l’injection17. De même, Liu et al. ont décrit l’injection intracamérulaire à l’aide d’une aiguille 32 G insérée dans la chambre antérieure parallèlement à l’iris le long du limbe, créant ainsi un tunnel cornéen auto-obturant18. Les auteurs ont injecté 3 μL d’hydrogel d’acide hyaluronique sodique, et un coton-tige a été utilisé pour comprimer le site d’injection afin de minimiser les fuites hors de la chambre antérieure. Il a été décrit que le gel de haut poids moléculaire était retenu dans la chambre antérieure et bloquait l’écoulement de l’humeur aqueuse à travers le réseau trabéculaire18. Il convient de noter que la méthode d’injection intracamérulaire modifiée décrite ici tolère l’injection sans agents viscoélastiques et est donc applicable à un large éventail d’applications de recherche. Néanmoins, comme cette étude s’est limitée à l’injection de solutions liquides dans un volume ne dépassant pas 5 μL, une comparaison précise des méthodes d’injection et des matériaux injectés devrait être effectuée à des fins de recherche spécifiques afin de déterminer la technique la plus appropriée.
L’application clinique des injections intracamérulaires est diverse et étendue. Par exemple, l’administration intracaméraméricaine de corticostéroïdes et d’antibiotiques, tels que le céfuroxime et la moxifloxacine, est courante lors des opérations de la cataracte comme mesure prophylactique pour prévenir l’infection postopératoire et l’endophtalmie 19,20,21,22,23,24,25. L’administration intraoculaire est également utilisée pour l’anesthésie locale et la mydriase lors des chirurgies de routine de la cataracte26,27. De plus, le traitement du glaucome implique l’utilisation de divers médicaments administrés par voie intracaméliale qui réduisent la pression intraoculaire, tels que des analogues de la prostaglandine ou des agonistes muscariniques, qui augmentent l’écoulement de l’humeur aqueuse, des agents antifibrotiques tels que la mitomycine C pour prévenir la cicatrisation et la fibrose, et des agents anti-facteur de croissance endothéliale vasculaire (anti-VEGF) pour le glaucome néovasculaire 28,29,30. Cette gamme diversifiée de traitements intracaméraux reflète leur rôle crucial dans le traitement de diverses affections ophtalmiques et l’amélioration des résultats pour les patients.
La méthode d’injection intracamérulaire décrite ici sera avantageuse pour diverses études précliniques visant à faire progresser les applications cliniques étendues des injections intracamérales. Par exemple, l’utilisation de l’injection intracamérulaire dans des modèles de rats pour déterminer l’efficacité, les dosages optimaux, le moment et les résultats à long terme de divers médicaments est une première étape cruciale avant de passer aux essais cliniques. Dans de telles études, l’amélioration de la précision et de la reproductibilité de la technique d’injection sera la clé de la réussite et de la progression de l’étude.
De plus, la méthode décrite d’injection intracamérulaire peut être utilisée pour générer des modèles expérimentaux de différentes pathologies oculaires en délivrant des vecteurs ou des produits chimiques dans la chambre antérieure. De tels modèles expérimentaux sont essentiels pour étudier les mécanismes de la maladie et développer de nouveaux traitements. Par exemple, la dystrophie endothéliale de Fuchs (FED), une maladie cornéenne progressive entraînant une perte de vision progressive, n’a pas de remède31. La prise en charge primaire consiste à surveiller et à soulager les symptômes, souvent par le biais de médicaments topiques pour soulager temporairement l’œdème ou la lubrification oculaire. En cas de progression de la maladie ou de déficience visuelle sévère, la greffe de cornée (kératoplastie endothéliale) devient une intervention nécessaire. La recherche visant à développer de nouvelles options de traitement pour la FED, offrant potentiellement des alternatives à la transplantation de cornée, est hautement justifiée. Compte tenu de la biodisponibilité limitée des médicaments délivrés par la cornée ou la conjonctive 1,2,3, l’administration intracamérulaire apparaît comme une voie avantageuse pour traiter la couche endothélienne. Les modèles expérimentaux d’injection intracamérale jouent un rôle crucial dans le développement de nouvelles approches thérapeutiques pour la FED. L’utilisation de l’approche décrite ici pour l’injection intracamérale peut induire l’absorption du matériau injecté dans la couche endothéliale cornéenne. La mise en œuvre de cette méthode en injection intracamérulaire permet de créer des modèles expérimentaux de traitement FED avec une grande précision et reproductibilité. Cela contribue non seulement à faire progresser notre compréhension de la FED, mais ouvre également des voies pour le développement d’interventions thérapeutiques ciblées et efficaces.
En résumé, il s’agit d’une procédure optimisée pour l’injection intracamérale chez le rat à faible risque d’effets indésirables, qui serait précieuse pour améliorer la recherche préclinique en ophtalmologie et contribuer au développement de nouvelles possibilités thérapeutiques pour les pathologies oculaires.
Déclarations de divulgation
Marcovich A. L. détient des brevets chez Steba Biotech, Yeda Weizmann, EyeYon Medical et Mor Isum et est consultant pour EyeYon Medical et Johnson & Johnson. Tous les autres auteurs n’ont pas d’intérêts concurrents.
Remerciements
Cette recherche a été soutenue par les subventions 2670/23 et 1304/20 de la Fondation israélienne des sciences.
matériels
| Name | Company | Catalog Number | Comments |
| Alizarin Red | Alpha Aesar | 042040.5 | |
| Buprenorphine | Richter pharma | 102047 | |
| Dexamethasone 0.1% | Fisher Pharmaceutical | 393102-0413 | |
| Hamilton glass syringe 10 μL | Hamilton Co. | 721711 | |
| Hoeschst | Merck | B2261 | |
| Ketamine | Bremer pharma GMBH (medimarket) | 17889 | |
| Ofloxacin 0.3% eye drops | Allergan | E92170 | |
| Oxybuprocaine Hydrochloride 0.4% | Fisher Pharmaceutical | N/A | |
| Pentobarbital sodium 200 mg/mL | CTS | N/A | |
| Slit microscope | Haag-streit bern | b-90019115 | |
| Sprague-Dawley Rats | Envigo | N/A | |
| Stiletto blade 31 G 0.8 mm | Tecfen medical (skymed) | QKN2808 | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Trypan Blue | Sartorius | 03-102-1B | |
| Xylazine | Eurovet Animal Health | 615648 |
Références
- Ramsay, E., et al. Corneal and conjunctival drug permeability: Systematic comparison and pharmacokinetic impact in the eye. Eur J Pharm Sci. 119, 83-89 (2018).
- Cholkar, K., Dasari, S. R., Pal, D., Mitra, A. K. Eye: Anatomy, Physiology and Barriers to Drug Delivery. Ocular Transporters and Receptors. , Elsevier, Woodhead Publishing. (2013).
- Prausnitz, M. R. Permeability of cornea, sclera, and conjunctiva: A literature analysis for drug delivery to the eye. J Pharm Sci. 87 (12), 1479-1488 (1998).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the Eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 269(2020).
- Gautam, M., et al. Intracameral drug delivery: A Review of agents, indications, and outcomes. J Ocul Pharmacol Ther. 39 (2), 102-116 (2023).
- Shah, T. J., Conway, M. D., Peyman, G. A. Intracameral dexamethasone injection in the treatment of cataract surgery induced inflammation: design, development, and place in therapy. Clin Ophthalmol. 12, 2223-2235 (2018).
- Perlman, R. L. Mouse models of human disease: An evolutionary perspective. Evol Med Public Health. 2016 (1), 170-176 (2016).
- Chawla, S., Jena, S. The Anatomy and Physiology of Laboratory Rat.Essentials of Laboratory Animal Science: Principles and Practices. , Springer. Singapore. (2021).
- Lundström, M., Wejde, G., Stenevi, U., Thorburn, W., Montan, P. Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology. 114 (5), 866-870 (2007).
- Fine, I. H. Clear corneal incisions. Int Ophthalmol Clin. 34 (2), 59-72 (1994).
- Herretes, S., Stark, W. J., Pirouzmanesh, A., Reyes, J. M. G., McDonnell, P. J., Behrens, A. Inflow of ocular surface fluid into the anterior chamber after phacoemulsification through sutureless corneal cataract wounds. Am J Ophthalmol. 140 (4), 737-740 (2005).
- Masket, S., Belani, S. Proper wound construction to prevent short-term ocular hypotony after clear corneal incision cataract surgery. J Cataract Refract Surg. 33 (3), 383-386 (2007).
- Taban, M., Rao, B., Reznik, J., Zhang, J., Chen, Z., McDonnell, P. J. Dynamic morphology of sutureless cataract wounds - Effect of incision angle and location. Surv Ophthalmol. 49, Suppl 2 S62-S72 (2004).
- Belforte, N., Sande, P. H., de Zavalía, N., Dorfman, D., Rosenstein, R. E. Therapeutic benefit of radial optic neurotomy in a rat model of glaucoma. PLoS One. 7 (3), e34574(2012).
- Moreno, M. C., et al. A new experimental model of glaucoma in rats through intracameral injections of hyaluronic acid. Exp Eye Res. 81 (1), 71-80 (2005).
- Belforte, N., Sande, P., de Zavalía, N., Knepper, P., Rosenstein, R. Effect of chondroitin sulfate on intraocular pressure in rats. Invest Ophthalmol Vis Sci. 51 (11), 5768-5775 (2010).
- Matsumoto, Y., Kanamori, A., Nakamura, M., Negi, A. Rat chronic glaucoma model induced by intracameral injection of microbeads suspended in sodium sulfate-sodium hyaluronate. Jpn J Ophthalmol. 58 (3), 290-297 (2014).
- Liu, Y., et al. A novel rat model of ocular hypertension by a single intracameral injection of cross-linked hyaluronic acid hydrogel (Healaflow® ). Basic Clin Pharmacol Toxicol. 127 (5), 361-370 (2020).
- Bowen, R. C., et al. Comparative analysis of the safety and efficacy of intracameral cefuroxime, moxifloxacin and vancomycin at the end of cataract surgery: a meta-analysis. Br J Ophthalmol. 102 (9), 1268-1276 (2018).
- Kato, A., et al. Prophylactic antibiotics for postcataract surgery endophthalmitis: a systematic review and network meta-analysis of 6.8 million eyes. Sci Rep. 12 (1), 17416(2022).
- Wang, M., Liu, Y., Dong, H. Effect of cefuroxime intracameral injection antibiotic prophylactic on postoperative endophthalmitis wound post-cataract: A meta-analysis. Int Wound J. 20 (5), 1376-1383 (2023).
- Katz, G., et al. Intracameral cefuroxime and the incidence of post-cataract endophthalmitis: an Israeli experience. Graefes Arch Clin Exp Ophthalmol. 253 (10), 1729-1733 (2015).
- Lipnitzki, I., Ben Eliahu, S., Marcovitz, A. L., Ezov, N., Kleinmann, G. Intraocular concentration of moxifloxacin after intracameral injection combined with presoaked intraocular lenses. J Cataract Refract Surg. 40 (4), 639-643 (2014).
- Colleaux, K. M., Hamilton, W. K., Morgan, R. A. Effect of prophylactic antibiotics and incision type on the incidence of endophthalmitis after cataract surgery. Can J Ophthalmol. 35 (7), 373-378 (2000).
- Libre, P. E., Della-Latta, P., Chin, N. X. Intracameral antibiotic agents for endophthalmitis prophylaxis: A pharmacokinetic model. J Cataract Refract Surg. 29 (9), 1791-1794 (2003).
- Carino, N. S., Slomovic, A. R., Chung, F., Marcovich, A. L. Topical tetracaine versus topical tetracaine plus intracameral lidocaine for cataract surgery. J Cataract Refract Surg. 24 (12), 1602-1608 (1998).
- Minakaran, N., Ezra, D. G., Allan, B. D. Topical anaesthesia plus intracameral lidocaine versus topical anaesthesia alone for phacoemulsification cataract surgery in adults. Cochrane Database Syst Rev. 7 (7), CD005276 (2020).
- Dan-Ni, W., Li-Dian, H., Zhi-Guo, P., Qiang, W., Lei, S. Intracameral anti-VEGF injection for advanced neovascular glaucoma after vitrectomy with silicone oil tamponade. Int J Ophthalmol. 14 (3), 129-135 (2021).
- Bhagat, P. R., Agrawal, K. U., Tandel, D. Study of the effect of injection bevacizumab through various routes in neovascular glaucoma. J Curr Glaucoma Pract. 10 (2), 39-48 (2016).
- Al-Qaysi, Z. K., Beadham, I. G., Schwikkard, S. L., Bear, J. C., Al-Kinani, A. A., Alany, R. G. Sustained release ocular drug delivery systems for glaucoma therapy. Expert Opin Drug Deliv. 20 (7), 905-919 (2023).
- Eghrari, A. O., Gottsch, J. D. Fuchs' corneal dystrophy. Expert Rev Ophthalmol. 5 (2), 147-159 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon