Method Article
İnsan Embriyonik Kök Hücre Kaynaklı Retina Pigment Epitel Hücrelerinin Optimal Aşamada Dondurularak Saklanması
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu çalışma, insan kök hücresinden türetilmiş retina pigment epitel hücrelerinin etkili bir şekilde dondurularak saklanması için ayrıntılı bir protokol sunmaktadır.
Özet
İnsan embriyonik kök hücrelerinden (hESC'ler) türetilen retinal pigment epitel (RPE) hücreleri, retinal dejeneratif hastalıkları olan bireylerde hücre replasman tedavisi için üstün hücre kaynaklarıdır; Bununla birlikte, bu terapötik hücrelerin istikrarlı ve güvenli bankacılığı ile ilgili çalışmalar azdır. Kriyoprezervasyon sonrası RPE hücrelerinin oldukça değişken hücre canlılığı ve fonksiyonel geri kazanımı en sık karşılaşılan sorunlardır. Bu protokolde, orijinal deney koşullarına dayalı olarak dondurma için en uygun hücre fazını seçerek çözdürme işleminden sonra en iyi hücre geri kazanım oranını elde etmeyi amaçladık. Hücreler, çözüldükten sonra hücre canlılığını ve geri kazanım oranını artıran 5-etinil-2'-deoksiüridin etiketleme testi kullanılarak belirlenen üstel fazda donduruldu. Stabil ve fonksiyonel hücreler, uzun bir farklılaşma sürecinden bağımsız olarak, çözülmeden kısa bir süre sonra elde edildi. Burada açıklanan yöntemler, hESC'den türetilen RPE hücrelerinin basit, verimli ve ucuz bir şekilde korunmasına ve çözülmesine izin verir. Bu protokol RPE hücrelerine odaklansa da, bu dondurma stratejisi diğer birçok farklılaşmış hücre tipine uygulanabilir.
Giriş
Retina pigment epiteli (RPE), retinanın düzgün işlevini sürdürmek için gerekli olan pigmentli bir tek hücre tabakasıdır1. RPE disfonksiyonu ve ölümü, yaşa bağlı makula dejenerasyonu, retinitis pigmentosa ve Stargardt hastalığı 2,3 dahil olmak üzere birçok retinal dejeneratif hastalıkla yakından ilişkilidir. RPE replasman tedavisi, bu hastalıklar için en umut verici tedavi rejimlerinden biridir 4,5,6,7. Donör RPE hücrelerinin stabil bir şekilde tedarik edilmesi, hücre tedavisi için hayati önem taşır. İnsan embriyonik kök hücresinden (hESC) türetilen RPE hücreleri, birincil RPE hücrelerinin işlevini taklit ettikleri ve teorik olarak sınırsız bir tedarik üretebildikleri için hücre tedavisi için ideal bir hücre kaynağıdır8. Bununla birlikte, farklılaşma süreci zahmetlidir ve elde edilen RPE hücrelerinin raf ömrü, sonraki epitelyal-mezenkimal geçiş (EMT) nedeniyle nispeten kısadır. Bu nedenle, hESC'den türetilen RPE hücrelerinin dondurularak saklanması, uzun süreli depolama ve isteğe bağlı dağıtım için gerekli olan vazgeçilmez bir adımdır9.
Kriyoprezervasyonun neden olduğu hücresel hasar, yanlışlıkla terapötik etkinliği tehlikeye atabilir10,11. Bu nedenle, kriyoprezervasyon ile ilgili son çalışmalar, hücre tedavileri tasarlanırken optimal kriyojenik depolama koşullarının belirlenmesi gerektiğini önermiştir12. Başarılı kriyoprezervasyon, donma-çözülme döngüsünden sonra verimli hücre geri kazanımı, yüksek canlılık ve hücre fonksiyonunun restorasyonunu garanti eder. Bununla birlikte, memeli hücrelerinin yapışık tek tabakalarının dondurularak saklanması üzerine yapılan önceki çalışmalar, çözülmeden sonra oldukça değişken (%35-%95) sağkalım oranları bildirmiştir 13,14,15. Birçok faktör, özellikle dondurma aşamasında kriyoprezervasyonun sonuçlarını önemli ölçüde etkiler16,17. Son araştırmalar, farklı zaman noktalarında donmuş RPE hücrelerinin çözüldükten sonra çeşitli iyileşme gösterdiğini gösterdi17. Bildiğimiz kadarıyla, kök hücre kaynaklı RPE hücreleri için en uygun dondurma süresi penceresinin belirlenmesine yönelik çalışmalar eksiktir. Farklı çalışmalarda, hücreler çeşitli aşamalarda donduruldu: bazı hücreler geçişten kısa bir süre sonra veya birleşme veya pigmentasyondanönce donduruldu 8,15,18, diğerleri ise diğer zaman noktalarında 9,19,20,21 donduruldu. Ayrıca, kriyoprezervasyon için kullanılan RPE hücrelerinin fazının veya aşamasının çözüldükten sonra RPE fonksiyonunu etkileyip etkilemediğine dair net bir kanıt yoktur. Önceki çalışmamızda, hücre büyümesinin üstel fazının (P2D5), hücre canlılığı ve hücresel özelliklerin ve işlevlerin geri kazanılması açısından hESC'den türetilmiş RPE hücrelerinin dondurularak saklanması için en iyi aşama olduğunu ilk kez gösterdik17.
Burada oluşturulan yöntem, çözüldükten sonra hücre canlılığı ve işlevi açısından en iyi korumayı elde etmek için hESC'den türetilen RPE'yi optimal bir aşamada kriyoprezervasyon yapmayı amaçlamaktadır. Kriyoprezervasyondan önce DNA sentezinin üstel fazını tespit etmek için 5-etinil-2'-deoksiüridin (EdU) etiketleme testini kullanarak, çözülmüş RPE hücreleri %>80 canlılık ve bağlanma oranı, RPE'ye özgü gen ekspresyonu, polarize hücre morfolojisi, pigment epitel kaynaklı faktör sekresyonyonu, uygun transepitelyal direnç ve fagositik yetenek sergiledi 8,17,22. Bu protokol hESC'den türetilmiş RPE hücrelerine odaklanmasına ve tüm terapötik hücrelerin eşit şekilde dondurularak saklanmamasına rağmen, üstel fazda dondurma stratejisi diğer birçok terapötik hücreye uygulanabilir.
Protokol
1. Hücre ayrışması
- RPE hücrelerini daha önce tarif edildiği gibi koruyun17,22.
NOT: Tüm hücreler, protokollerin süresi boyunca% 5 CO2 atmosferinde 37 ° C'de büyütülür. - Gerekli miktarda PBS ve kültür ortamını 37 ° C'lik bir su banyosunda hazırlayın ve hücre ayrışma reaktifini oda sıcaklığına yerleştirin.
- Kültür çözeltisini atın ve plakaları oyuk başına 1 mL önceden ısıtılmış PBS ile iki kez yıkayın.
- 6 oyuklu plakalara 1 mL hücre ayrışma reaktifi ekleyin ve hücreleri 37 ° C'de 15 dakika sindirin. İnkübasyondan sonra, sindirimin sona erdiğini doğrulamak için mikroskop altında kenarlarda küçülen ve parlayan hücreleri gözlemleyin.
NOT: Tripsin bazlı ayrışma, düşük hücre canlılığı sağladığı için önerilmez. - Hücreleri ayırmak için 1 mL'lik bir pipetle 10 kat yukarı ve aşağı pipetleyin ve hücre süspansiyonunu önceden ısıtılmış kültür ortamıyla (Y-27632 olmadan) 1:10 oranında seyreltin. Daha sonra hücreleri oda sıcaklığında 3 dakika 250 × g'da santrifüjleyin.
- Santrifüjlemeden sonra süpernatanı hızlı bir şekilde dökün, hücre peletini kültür ortamının 2 mL'sinde nazikçe yeniden süspanse edin ve hücreleri bir pipetle 10-15x yeniden süspanse edin.
- Tek hücreli bir süspansiyon elde etmek ve hücre sayısını hesaplamak için hücre süspansiyonunu 40 μm'lik bir hücre süzgeci ile filtreleyin.
NOT: Çözüldükten sonra doğru hücre sayımı ve tek tip hücre tohumlama yoğunluğu için tek hücreli bir süspansiyon gereklidir.
2. Kriyoprezervasyon için en uygun hücre aşamasının belirlenmesi
NOT: Hücre durumu, farklılaşma yöntemleri ve hücre hatları arasında farklılık gösterdiğinden, farklı laboratuvarlarda kültürlenen RPE hücrelerinin üstel fazı dondurulmadan önce belirlenmelidir.
- Bir şişe bazal membran matris çözeltisini, gece boyunca 4 ° C'de buz üzerinde çözdürün. Matrisi 12 mL soğuk DMEM / F-12 ile seyreltin ve iyice karıştırın. Kuyucuk başına bir lamel ekleyin ve 24 oyuklu bir plakanın her bir oyuğuna 0.25 mL seyreltilmiş çözelti ile kaplayın. Kullanmadan önce plakayı oda sıcaklığında 1 saat veya gece boyunca 4 °C'de inkübe edin ve hücreleri kaplamadan hemen önce kaplama solüsyonunu aspire edin.
NOT: Alikot hacmi için talimatlar, protein konsantrasyonuna bağlı olarak partiye özgüdür ve ürün spesifikasyon sayfasında bulunur. - RPE tek hücrelerini, 1 mL kültür ortamında 105 /cm2 yoğunlukta bazal membran matris kaplı lameller üzerine adım 1.7'den tohumlayın. Kültür ortamını her 2-3 günde bir yenileyin.
- Belirtilen zaman noktalarında (geçişten 1, 3, 5, 7 ve 11 gün sonra), RPE hücrelerini ortamda 24 saat boyunca 10 μM EdU ile inkübe edin. Birleştirilmiş EdU'yu tespit etmek için hücreleri kılavuzda açıklandığı gibi reaksiyon kokteyli ile sabitleyin, geçirgen hale getirin ve boyayın.
- Floresan mikroskobu altında beş rastgele alandan görüntüler yakalayın ve EdU pozitif hücrelerin yüzdesini hesaplayın. Bir büyüme eğrisi oluşturmak için karşılık gelen EdU-pozitif orantı-zaman eğrilerini çizin. Ardından, büyüme eğrisine göre her hücre hattı için donma penceresini veya üstel fazı belirleyin.
NOT: Yeniden kurulan altıgen hücre morfolojisi, hücrelerin üstel fazdan çıktığını gösterir.
3. Kriyoprezervasyon
- 1.1 ila 1.7 arasındaki adımları izleyerek, sindirim süresinin 5 dakikaya düşmesi dışında, hücre süspansiyonunu oda sıcaklığında 250 × g'da 3 dakika santrifüjleyin.
- Santrifüjlemeden sonra hızlı bir şekilde dökerek süpernatanı atın ve kriyoprezervasyon ortamında hücre peletini 2 × 106 hücre / mL yoğunluğa kadar nazikçe yeniden süspanse edin ve hücre süspansiyonunun 1 mL'sini 1.2 mL kriyojenik şişelere aktarın.
- Kriyojenik şişeleri hemen bir dondurucu kabına koyun, -80 °C/dk'lık bir soğutma hızı elde etmek için gece boyunca -1 °C'de dondurun ve ardından şişeleri uzun süreli saklama için sıvı nitrojene aktarın.
4. Çözülme
- Kültür ortamını 37 ° C'lik bir su banyosunda ısıtın ve 10 mL önceden ısıtılmış kültür ortamını 15 mL'lik bir tüpe önceden doldurun.
- Otomatik bir çözdürme sistemi kullanarak doğrudan sıvı nitrojen deposundan alınan kriyojenik şişeleri hızla çözün.
- Donmuş hücrelerin yavaş yavaş yeni ortama adapte olmasını sağlamak için kriyojenik şişeye 0.5-1 mL önceden ısıtılmış kültür ortamı damlatın. Daha sonra, 15 mL'lik bir tüpte 1.5-2 mL hücre süspansiyonunu 10 mL kültür ortamına aktarın ve hücreleri oda sıcaklığında 3 dakika boyunca 250 × g'da santrifüjleyin.
- Santrifüjlemeden sonra hızlı bir şekilde dökerek süpernatanı atın, peleti 2 mL önceden ısıtılmış kültür ortamında yeniden süspanse edin ve standart tripan mavisi dışlamasını (% 0.4 tripan mavisi lekesi) kullanarak geri kazanım ve hayatta kalma oranlarını belirlemek için bir hemositometre kullanarak hücre sayısını sayın.
- Hücreleri, Y-27632 (nihai konsantrasyon: 10 μM) ile takviye edilmiş bir kültür ortamında 105 canlı hücre /cm2 yoğunlukta bazal membran matris kaplı yüzeylerde kültürleyin. 24 saat sonra Y-27632'yi çıkarın.
- Bağlanma oranını belirlemek için, hücreleri tekrar ayırın ve çözüldükten 24 saat sonra hücre sayısını sayın.
5. Optimum dondurma aşamasının doğrulanması
- Adım 2.4'te belirlenen optimal dondurma fazını doğrulamak için, farklı zaman noktalarında donmuş RPE hücrelerini çözün ve 28 gün boyunca kültürleyin. Daha önce tarif edildiği gibi RPE belirteçlerinin ekspresyonunu değerlendirmek için qPCR ve immün boyama analizi için hücreleri toplayın17.
Sonuçlar
Burada, P1D35'teki hESC'den türetilmiş RPE hücreleri pasajlandı ve 105 / cm2'lik bir yoğunlukta tohumlandı. Tohumlamadan sonraki bir hafta içinde, karakteristik altıgen morfoloji ve pigmentasyon, gecikme fazında (yaklaşık 2 gün) kayboldu. RPE hücreleri, üstel fazda (yaklaşık 5 gün, Şekil 1A) altıgen morfolojiyi kademeli olarak yeniden benimsedi ve daha poligonal bir morfoloji ile yavaşlama fazına (yaklaşık 6 gün) girdi. Hücre kültürü bir hafta daha devam ederse, hücre proliferasyonu önemli ölçüde azaldı ve hücre-hücre bağlantıları, kenarları aydınlanarak birincil bir rol oynadı; şu anda, hücreler artık üstel fazda değildi (Şekil 1A, P2D11). Hücre morfolojisine ek olarak, fazın belirlenmesine yardımcı olmak için EdU hücre proliferasyon testi yapıldı. Şekil 1B , P2D5 hücrelerinin daha yüksek bir proliferasyon oranı (üstel faz) sergilediğini, P2D11 hücrelerinin ise yavaşlama fazına girdiğini göstermektedir.
Sıvı nitrojen içinde 1-3 ay dondurulduktan sonra RPE hücreleri çözüldü. Çözüldükten sonra, bazı hücreler hücre altı döküntülere indirgendi, bazı hücreler apoptoz geçirdi ve kalan hücreler hayatta kaldı. 24 saat sonra, P2D5'te dondurulan RPE hücreleri, diğer zaman noktalarında dondurulanlardan daha yüksek bir bağlanma oranı sergiledi (Şekil 2A). Ayrıca, çözülmeden 14 gün sonra farklı hücre-hücre adezyonlarına (sıkı bağlantılar) sahip olgun RPE hücrelerinin karakteristik altıgen morfolojisini sergilediler. Buna karşılık, diğer zaman noktalarında donmuş hücreler genellikle fibroblastik bir fenotipi benimsemiştir (Şekil 2A), bu da nispeten daha uzun bir EMT geçişi döneminden geçtiklerini gösterir. Çözülmeden yirmi sekiz gün sonra, P2D5'te dondurulan RPE, qPCR (Şekil 2B) ve immünofloresan boyama (Şekil 2C, D) ile gösterildiği gibi, daha yüksek eksprese edilmiş ve daha düzgün lokalize RPE hücre belirteçleri gösterdi.
Bu protokolün farklı kriyoprezervasyon ortamlarında stabilitesini test etmek için, protokolde uygulanan iki kriyoprezervasyon ortamının performansı karşılaştırıldı. Sonuç, iki kriyoprezervasyon ortamının, çözülme sonrası yüksek hücre canlılığı ve bağlanma elde etmede eşit derecede iyi performans gösterdiğini gösterdi (Şekil 3).

Şekil 1: Dondurulmaya hazır RPE hücrelerinin temsili görüntüleri. (A) P2D5'teki RPE hücreleri, P2D11'dekilere göre daha az altıgen morfoloji ve pigmentasyon sergiledi. (B) P2D5'teki RPE hücreleri, EdU testi ile ortaya konduğu gibi, P2D11'dekilerden daha yüksek bir proliferasyon oranı sergiledi. Ölçek çubukları = 100 μm. Kısaltmalar: RPE = retina pigment epiteli; BF = parlak alan; EdU = 5-etinil-2'-deoksiuridin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
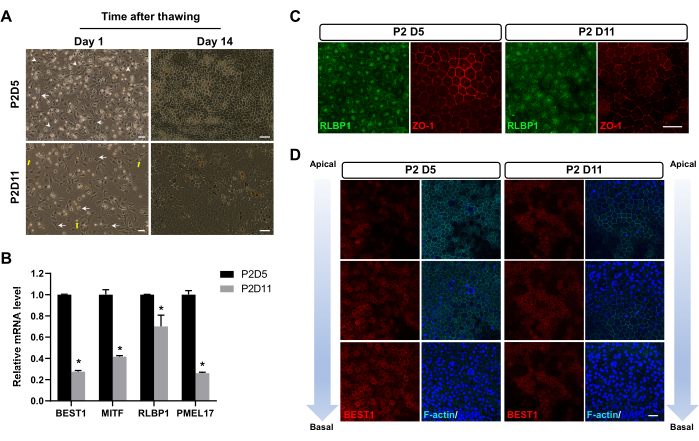
Şekil 2: Çözüldükten sonra RPE hücrelerinin temsili görüntüleri. (A) P2D5'te donmuş RPE hücreleri, çözüldükten 24 saat sonra (sol sütun) daha iyi bağlanma sergiledi ve çözülmeden 14 gün sonra (sağ sütun) altıgen morfoloji sergiledi. P2D5 grubunda sıkıştırılmış morfolojiye (ok uçları), P2D11 grubunda yetersiz fibroblast benzeri morfolojiye (oklar) ve hücre kalıntılarına (sarı oklar) sahip karakteristik RPE hücreleri vurgulanır. (B-D) Bu görüntüler Zhang ve ark.17'den değiştirilmiştir. (B,C) P2D5'te dondurulan RPE hücreleri, çözülmeden 28 gün sonra tipik RPE işaretleyici genlerinin daha yüksek mRNA ve protein ekspresyon seviyeleri sergiledi. İstatistiksel farklılıklar Bonferroni'nin post hoc testi ile iki yönlü varyans analizi ile değerlendirilmiştir. *P < 0.05. (D) Çözülmeden 28 gün sonra apikal-bazal eksen boyunca immünoboyama analizi, P2D5'te donmuş RPE hücrelerinin daha iyi polaritesini gösterdi. Çekirdekler DAPI ile karşı boyandı. Ölçek çubukları = 50 μm (A), 25 μm (C,D). Kısaltmalar: RPE = retina pigment epiteli; DAPI = 4',6-diamidino-2-fenilindol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Protokolde uygulanan iki kriyoprezervasyon ortamının performansı. (A) Hücre canlılık oranı, P2D5'te dondurulan hESC türevi RPE hücrelerinin çözülmesi üzerine ölçüldü. (B) Çözülmeden 24 saat sonra iki farklı dondurma ortamından (# 1 ve # 2) çözülen RPE hücrelerinin parlak alan görüntüleri. Ölçek çubuğu = 100 μm. Kısaltmalar: RPE = retina pigment epiteli; hESC = insan embriyonik kök hücresi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu çalışmada, araştırma ve klinik ihtiyaçlar için hESC türevi RPE hücreleri için başarılı bir donma-çözülme protokolü tanımlanmıştır. Ölümsüzleştirilmiş RPE hücre hattı ARPE-19'un aksine, kök hücre türevli RPE hücreleri gibi uygun karakteristik epitelyal fenotip ve fonksiyona sahip RPE hücreleri, kriyoprezervasyona daha duyarlıdır. Hücrelerin% 32'sinden daha azı, uygun şekilde korunmadığı takdirde, çözülmeden 24 saat sonra kaldı17. Kriyoprezervasyon zamanlaması kritik bir parametredir. Ölümsüzleştirilmiş hücre kriyoprezervasyonu için yerleşik bir görüş, hücreleri üstel büyüme aşamasında dondurmaktır. Farklılaşmış hücreler hücre döngüsünden çıkar. Bu nedenle, kriyoprezervasyon için büyüme fazının etkisi, farklılaşmış hücreler için nadiren düşünülmüştür. HESC ile farklılaşmış RPE hücrelerinin kısa bir süre için çoğalma kapasitesini geri kazandıklarını ve geçtikten sonra üstel bir evreye girdiklerini gösterdik. Üstel faz17 sırasında RPE hücrelerinin dondurularak saklanmasıyla daha iyi sonuçlar elde edilebilir.
Bu protokolün sınırlaması, yalnızca iki tür kriyoprezervasyon ortamının test edilmiş olmasıdır. Farklı kriyoprezervasyon ortamları, kriyoyaralanmayı farklı şekillerde önleyebilir23; bu nedenle, kriyoprezervasyon ortamı, RPE hücre kriyoprezervasyonunun optimal aşamasını etkileyebilir. Kriyoprezervasyon ortamının optimum dondurma süresini etkileyip etkilemediği daha fazla değerlendirilmelidir.
Bu çalışmada sunulan kriyoprezervasyon protokolü, RPE hücrelerinin dondurulmadan önce üstel fazını belirleyerek farklı laboratuvarlarda kullanım için kolayca uyarlanabilir, bu da onu belirli kültürleme dönemlerinden, farklılaşma yöntemlerinden veya hücre hatlarından daha bağımsız hale getirir. Hücre morfolojisini değerlendirmeye ek olarak, EdU testi, hücrelerin üstel fazda korunmasını sağlamak için basit bir değerlendirme sağlar.
Mevcut protokol, RPE hücrelerinin dondurularak saklanması için basit ve etkili bir yöntemdir. Bu strateji, diğer farklılaşmış hücre tiplerinin kriyoprezervasyonu için uygulanabilir.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (81970816) tarafından Mei Jiang'a finanse edildi; Çin Ulusal Doğa Bilimleri Vakfı (82201223) Xinyue Zhu'ya; ve Şanghay Bilim ve Teknoloji Komisyonu'nun (2014090067000) Bilim ve Teknoloji İnovasyon Eylem Planı'nı Haiyun Liu'ya teslim etti.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 40 μm Cell strainer | Corning | 431750 | |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 488 Dye | Thermo Fisher Scientific | C10337 | |
| Cryo freezing container | Nalgene | 5100-0001 | |
| CryoStor CS10 | Biolife Solutions | 07930 | cryopreservation medium #1 |
| DPBS, no calcium, no magnesium | Thermo Fisher Scientific | 14190144 | |
| Genxin | Selcell | YB050050 | cryopreservation medium #2 |
| Human embryonic stem cells | provided by Wicell, USA | H9 cell line | |
| Matrigel, hESC-Qualified Matrix | Corning | 354277 | basement membrane matrix |
| ThawSTAR CFT2 Automated Cell Thawing System | BioLife Solutions | AST-601 | |
| Trypan Blue solution 0.4% | Sigma | T8154 | |
| TryPLE Select | Thermo Fisher Scientific | 12563029 | cell dissociation reagent |
| XVIVO-10 medium | Lonza | BEBP04-743Q | RPE culture medium |
| Y-27632 | Selleck | S1049 |
Referanslar
- Lakkaraju, A., et al. The cell biology of the retinal pigment epithelium. Progress in Retinal and Eye Research. 78, 100846(2020).
- Mcbain, V. A., Townend, J., Lois, N. Progression of retinal pigment epithelial atrophy in stargardt disease. American Journal of Ophthamology. 154 (1), 146-154 (2012).
- George, S. M., Lu, F., Rao, M., Leach, L. L., Gross, J. M. The retinal pigment epithelium: Development, injury responses, and regenerative potential in mammalian and non-mammalian systems. Progress in Retinal and Eye Research. 85, 100969(2021).
- Rizzolo, L. J., Nasonkin, I. O., Adelman, R. A. Retinal cell transplantation, biomaterials, and in vitro models for developing next-generation therapies of age-related macular degeneration. Stem Cells Translational Medicine. 11 (3), 269-281 (2022).
- Bertolotti, E., Neri, A., Camparini, M., Macaluso, C., Marigo, V. Stem cells as source for retinal pigment epithelium transplantation. Progress in Retinal and Eye Research. 42, 130-144 (2014).
- Da Cruz,, L,, et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Mehat, M. S., et al. Transplantation of human embryonic stem cell-derived retinal pigment epithelial cells in macular degeneration. Ophthalmology. 125 (11), 1765-1775 (2018).
- Buchholz, D. E., et al. Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium. Stem Cells Translational Medicine. 2 (5), 384-393 (2013).
- Li, Q. -Y., et al. Functional assessment of cryopreserved clinical grade hESC-RPE cells as a qualified cell source for stem cell therapy of retinal degenerative diseases. Experimental Eye Research. 202, 108305(2021).
- Francois, M., et al. Cryopreserved mesenchymal stromal cells display impaired immunosuppressive properties as a result of heat-shock response and impaired interferon-gamma licensing. Cytotherapy. 14 (2), 147-152 (2012).
- Moll, G., et al. Do cryopreserved mesenchymal stromal cells display impaired immunomodulatory and therapeutic properties. Stem Cells. 32 (9), 2430-2442 (2014).
- Ekpo, M. D., et al. Incorporating cryopreservation evaluations into the design of cell-based drug delivery systems: an opinion paper. Frontiers in Immunology. 13, 967731(2022).
- Bailey, T. L., et al. Protective effects of osmolytes in cryopreserving adherent neuroblastoma (Neuro-2a) cells. Cryobiology. 71 (3), 472-480 (2015).
- Okumura, N., et al. Feasibility of a cryopreservation of cultured human corneal endothelial cells. PLoS One. 14 (6), e0218431(2019).
- Pennington, B. O., et al. Xeno-free cryopreservation of adherent retinal pigmented epithelium yields viable and functional cells in vitro and in vivo. Scientific Reports. 11 (1), 6286(2021).
- Woods, E. J., Thirumala, S., Badhe-Buchanan, S. S., Clarke, D., Mathew, A. J. Off the shelf cellular therapeutics: Factors to consider during cryopreservation and storage of human cells for clinical use. Cytotherapy. 18 (6), 697-711 (2016).
- Zhang, T., et al. Determining the optimal stage for cryopreservation of human embryonic stem cell-derived retinal pigment epithelial cells. Stem Cell Research & Therapy. 13 (1), 454(2022).
- Leach, L. L., et al. Induced pluripotent stem cell-derived retinal pigmented epithelium: a comparative study between cell lines and differentiation Methods. Journal of Ocular Pharmacology and Therapeutics. 32 (5), 317-330 (2016).
- Reichman, S., et al. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human iPS cells in Xeno-free and feeder-free conditions. Stem Cells. 35 (5), 1176-1188 (2017).
- Brandl, C., et al. In-depth characterisation of retinal pigment epithelium (RPE) cells derived from human induced pluripotent stem cells (hiPSC). Neuromolecular Medicine. 16 (3), 551-564 (2014).
- Hongisto, H., Ilmarinen, T., Vattulainen, M., Mikhailova, A., Skottman, H. Xeno- and feeder-free differentiation of human pluripotent stem cells to two distinct ocular epithelial cell types using simple modifications of one method. Stem Cell Research & Therapy. 8 (1), 291(2017).
- Foltz, L. P., Clegg, D. O. Rapid, directed differentiation of retinal pigment epithelial cells from human embryonic or induced pluripotent stem cells. Journal of Visualized Experiments: JoVE. (128), 10.3791/56274(2017).
- Marcantonini, G., et al. Natural cryoprotective and cytoprotective agents in cryopreservation: a focus on melatonin. Molecules. 27 (10), 3254(2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır