Method Article
שימור בהקפאה של תאי אפיתל פיגמנט ברשתית שמקורם בתאי גזע עובריים אנושיים בשלב האופטימלי
* These authors contributed equally
In This Article
Summary
מחקר זה מספק פרוטוקול מפורט לשימור קריוגני יעיל של תאי אפיתל פיגמנט ברשתית שמקורם בתאי גזע אנושיים.
Abstract
תאי אפיתל פיגמנט ברשתית (RPE) שמקורם בתאי גזע עובריים אנושיים (hESC) הם מקורות תאים מעולים לטיפול בתחליפי תאים אצל אנשים עם מחלות ניווניות ברשתית; עם זאת, מחקרים על הבנקאות היציבה והבטוחה של תאים טיפוליים אלה הם נדירים. כדאיות תאים משתנה מאוד והתאוששות תפקודית של תאי RPE לאחר שימור בהקפאה הן הבעיות הנפוצות ביותר. בפרוטוקול הנוכחי, שאפנו להשיג את קצב התאוששות התאים הטוב ביותר לאחר ההפשרה על ידי בחירת שלב התא האופטימלי להקפאה בהתבסס על תנאי הניסוי המקוריים. התאים הוקפאו בשלב המעריכי שנקבע על ידי שימוש בבדיקת התוויה 5-ethynyl-2′-deoxyuridine, אשר שיפרה את כדאיות התאים ואת קצב ההתאוששות לאחר ההפשרה. תאים יציבים ומתפקדים התקבלו זמן קצר לאחר ההפשרה, ללא תלות בתהליך התמיינות ארוך. השיטות המתוארות כאן מאפשרות שימור והפשרה פשוטים, יעילים וזולים של תאי RPE שמקורם בתאי תאי תאי גזע עובריים עובריים. למרות שפרוטוקול זה מתמקד בתאי RPE, אסטרטגיית הקפאה זו עשויה להיות מיושמת על סוגים רבים אחרים של תאים ממוינים.
Introduction
אפיתל פיגמנט הרשתית (RPE) הוא חד-שכבה פיגמנטית של תאים הדרושה לשמירה על תפקוד תקין של הרשתית1. תפקוד לקוי ומוות של RPE קשורים קשר הדוק למחלות ניווניות רבות ברשתית, כולל ניוון מקולרי הקשור לגיל, רטיניטיס פיגמנטוזה ומחלת סטארגרדט 2,3. טיפול חלופי RPE הוא אחד משטרי הטיפול המבטיחים ביותר עבור מחלות אלה 4,5,6,7. אספקה יציבה של תאי RPE מתורם חיונית לטיפול תאי. תאי RPE שמקורם בתאי גזע עובריים אנושיים (hESC) הם מקור תאי אידיאלי לטיפול תאי מכיוון שהם מחקים את תפקודם של תאי RPE ראשוניים ויכולים לייצר אספקה בלתי מוגבלת תיאורטית8. עם זאת, תהליך ההתמיינות מייגע וחיי המדף של תאי RPE המתקבלים קצרים יחסית בגלל מעבר אפיתל-מזנכימלי (EMT) לאחר מכן. לכן, שימור בהקפאה של תאי RPE שמקורם בתאי תאי גזע עובריים (תאי גזע עובריים) הוא צעד הכרחי הנדרש לאחסון לטווח ארוך ולהפצה לפי דרישה9.
נזק תאי הנגרם על ידי שימור בהקפאה עלול לפגוע בשוגג ביעילות הטיפולית10,11. לכן, מחקרים אחרונים על שימור קריוגני הציעו כי יש לקבוע תנאי אחסון קריוגניים אופטימליים בעת תכנון טיפולים תאיים12. שימור קריוגני מוצלח מבטיח התאוששות תאים יעילה, כדאיות גבוהה ושיקום תפקוד התא לאחר מחזור ההקפאה-הפשרה. עם זאת, מחקרים קודמים על שימור בהקפאה של חד-שכבות דבקות של תאי יונקים דיווחו על שיעורי הישרדות משתנים מאוד (35%-95%) לאחר הפשרהשל 13,14,15. גורמים רבים משפיעים במידה ניכרת על תוצאות השימור בהקפאה, במיוחד בשלב ההקפאה 16,17. מחקר שנערך לאחרונה הראה כי תאי RPE שהוקפאו בנקודות זמן שונות הציגו התאוששות מגוונת לאחר הפשרת17. למיטב ידיעתנו, חסרים מחקרים על קביעת חלון זמן הקפאה אופטימלי לתאי RPE שמקורם בתאי גזע. במחקרים שונים, התאים הוקפאו בשלבים שונים: חלק מהתאים הוקפאו זמן קצר לאחר המעבר או לפני מפגש או פיגמנטציה 8,15,18, בעוד שאחרים הוקפאו בנקודות זמן אחרות 9,19,20,21. יתר על כן, אין ראיות ברורות אם הפאזה או השלב של תאי RPE המשמשים לשימור בהקפאה משפיעים על תפקוד RPE לאחר הפשרה. במחקר הקודם שלנו, הדגמנו לראשונה שהשלב המעריכי של גדילת תאים (P2D5) הוא השלב הטוב ביותר לשימור בהקפאה של תאי RPE שמקורם בתאי תאי גזע עובריים עובריים (תאי גזע עובריים) במונחים של כדאיות התא והתאוששות התכונות והתפקודים התאיים17.
השיטה שהוקמה כאן שואפת לשמר בהקפאה RPE הנגזר מתאי גזע עובריים בשלב אופטימלי כדי להשיג את השימור הטוב ביותר מבחינת כדאיות התא ותפקודו לאחר ההפשרה. באמצעות בדיקת התיוג 5-ethynyl-2'-deoxyuridine (EdU) כדי לזהות את השלב המעריכי של סינתזת DNA לפני שימור בהקפאה, תאי RPE מופשרים הציגו >80% כדאיות ושיעור התקשרות, ביטוי גנים ספציפיים ל-RPE, מורפולוגיה של תאים מקוטבים, הפרשת גורם שמקורו באפיתל פיגמנט, עמידות טרנסאפיתל מתאימה ויכולת פגוציטית 8,17,22. למרות שפרוטוקול זה מתמקד בתאי RPE שמקורם בתאי תאי גזע עובריים (תאי גזע עובריים) ולא כל התאים הטיפוליים נשמרים בהקפאה בהקפאה בשלב המעריכי וניתן ליישם אותה על תאים טיפוליים רבים אחרים.
Protocol
1. דיסוציאציה של תאים
- שמור על תאי RPE כפי שתואר קודם לכן17,22.
הערה: כל התאים גדלים בטמפרטורה של 37°C באטמוספירה של 5% CO2 לאורך כל תקופת הפרוטוקולים. - הכינו את הכמות הנדרשת של PBS ומדיום תרבית באמבט מים של 37 מעלות צלזיוס והניחו את מגיב הדיסוציאציה של התא בטמפרטורת החדר.
- השליכו את תמיסת התרבית ושטפו את הצלחות פעמיים עם 1 מ"ל PBS שחומם מראש לכל באר.
- הוסף 1 מ"ל של מגיב דיסוציאציה התא לצלחות 6-well ולעכל את התאים ב 37 ° C במשך 15 דקות. לאחר הדגירה, להתבונן בתאים להתכווץ ולהאיר בקצוות תחת מיקרוסקופ כדי לאשר את סיום העיכול.
הערה: דיסוציאציה מבוססת טריפסין אינה מומלצת מכיוון שהיא מעניקה כדאיות תאים נמוכה. - פיפטה למעלה ולמטה בעדינות 10x עם פיפטה 1 מ"ל כדי לנתק את התאים, ולדלל את תרחיף התא עם מדיום תרבית שחומם מראש (ללא Y-27632) ביחס של 1:10. לאחר מכן, צנטריפוגה את התאים בטמפרטורת החדר במשך 3 דקות ב 250 × גרם.
- לשפוך במהירות את supernatant לאחר צנטריפוגה, בעדינות resuspend את גלולת התא ב 2 מ"ל של מדיום התרבית, ו resuspend את התאים 10-15x עם פיפטה.
- סנן את תרחיף התא עם מסננת תאים של 40 מיקרומטר כדי לקבל תרחיף של תא בודד וחשב את מספר התאים.
הערה: תרחיף חד-תאי חיוני לספירת תאים מדויקת ולצפיפות זריעת תאים אחידה לאחר ההפשרה.
2. קביעת שלב התא האופטימלי לשימור בהקפאה
הערה: מאחר שמצב התא משתנה בין שיטות התמיינות לבין קווי תאים, יש לקבוע את השלב המעריכי של תאי RPE בתרבית במעבדות שונות לפני ההקפאה.
- הפשירו בקבוקון אחד של תמיסת מטריצת קרום מרתף על קרח בטמפרטורה של 4°C למשך הלילה. לדלל את המטריצה לתוך 12 מ"ל של DMEM קר / F-12 ולערבב היטב. מוסיפים כיסוי אחד לכל באר, ומצפים כל באר של צלחת 24 בארות עם 0.25 מ"ל של תמיסה מדוללת. דוגרים על הצלחת במשך שעה בטמפרטורת החדר או לילה ב-4°C לפני השימוש ושאפו את תמיסת הציפוי ממש לפני ציפוי התאים.
הערה: ההוראות לנפח aliquot הן ספציפיות ללוט בהתבסס על ריכוז החלבון ונמצאות בגיליון מפרט המוצר. - זרעו את התאים הבודדים RPE משלב 1.7 על כיסויי המטריצה המצופים בממברנת המרתף בצפיפות של 105/cm2 ב 1 מ"ל של מדיום תרבית. רעננו את מדיום התרבות כל 2-3 ימים.
- בנקודות הזמן שצוינו (1, 3, 5, 7 ו-11 ימים לאחר המעבר), דגרו תאי RPE עם 10 מיקרומטר EdU בתווך למשך 24 שעות. תקן, חלחל והכתים את התאים עם קוקטייל התגובה כמתואר במדריך כדי לזהות EdU משולב.
- צלם תמונות מחמישה שדות אקראיים תחת מיקרוסקופ פלואורסצנטי וחשב את אחוז התאים החיוביים ל- EdU. התווה את עקומות זמן הפרופורציה החיוביות המתאימות של EdU כדי ליצור עקומת צמיחה. לאחר מכן, קבע את חלון ההקפאה או את הפאזה המעריכית עבור כל קו תא בהתאם לעקומת הצמיחה.
הערה: מורפולוגיית תאים משושים שהוקמה מחדש מציינת שתאים יוצאים מהשלב המעריכי.
3. שימור בהקפאה
- לאחר שלבים 1.1 עד 1.7, פרט לכך שזמן העיכול פוחת ל -5 דקות, צנטריפוגו את תרחיף התא בטמפרטורת החדר למשך 3 דקות ב 250 × גרם.
- יש להשליך את הסופרנאטנט על ידי מזיגה מהירה לאחר הצנטריפוגה ולהשהות בעדינות את כדורית התא בתווך ההקפאה לצפיפות של 2 × 106 תאים/מ"ל ולהעביר 1 מ"ל מתרחיף התא לבקבוקונים קריוגניים של 1.2 מ"ל.
- הניחו מיד את הבקבוקונים הקריוגניים במיכל הקפאה, הקפיאו בטמפרטורה של -80°C למשך הלילה כדי להשיג קצב קירור של -1°C/min, ולאחר מכן העבירו את הבקבוקונים לחנקן נוזלי לאחסון לטווח ארוך.
4. הפשרה
- חממו את מדיום התרבית באמבט מים של 37 מעלות צלזיוס ומלאו מראש 10 מ"ל של מדיום תרבית שחומם מראש לתוך צינור של 15 מ"ל.
- הפשיר במהירות את הבקבוקונים הקריוגניים שנלקחו ישירות מאחסון החנקן הנוזלי באמצעות מערכת הפשרה אוטומטית.
- טפטפו 0.5-1 מ"ל של מדיום תרבית שחומם מראש לתוך הבקבוקון הקריוגני כדי להבטיח שהתאים הקפואים יסתגלו בהדרגה לסביבה החדשה. לאחר מכן, להעביר 1.5-2 מ"ל של תרחיף התא ל 10 מ"ל של מדיום התרבית בצינור 15 מ"ל צנטריפוגה את התאים ב 250 × גרם במשך 3 דקות בטמפרטורת החדר.
- יש להשליך את הסופרנאטנט על ידי מזיגה מהירה לאחר הצנטריפוגה, להשהות מחדש את הגלולה ב-2 מ"ל של מדיום תרבית שחומם מראש, ולספור את מספר התאים המשתמשים בהמוציטומטר כדי לקבוע את שיעורי ההתאוששות וההישרדות באמצעות הרחקה סטנדרטית של טריפאן כחול (0.4% כתם כחול טריפאן).
- תרבית את התאים על משטחים מצופים מטריצה של קרום מרתף בצפיפות של 105 תאים ברי קיימא לסמ"ר2 בתווך תרבית בתוספת Y-27632 (ריכוז סופי: 10 מיקרומטר). הסר Y-27632 לאחר 24 שעות.
- כדי לקבוע את קצב ההתקשרות, נתק שוב את התאים וספור את מספר התאים 24 שעות לאחר ההפשרה.
5. אימות שלב ההקפאה האופטימלי
- כדי לאמת את שלב ההקפאה האופטימלי שנקבע בשלב 2.4, הפשירו תאי RPE שהוקפאו בנקודות זמן שונות ובתרבית שונות למשך 28 יום. קצור את התאים עבור ניתוח qPCR ו immunostaining כדי להעריך את הביטוי של סמני RPE כפי שתואר קודם17.
תוצאות
כאן, תאי RPE שמקורם ב-hESC ב-P1D35 עברו ונזרעו בצפיפות של 105/cm2. תוך שבוע מהזריעה, המורפולוגיה המשושה והפיגמנטציה האופייניות אבדו בשלב הפיגור (כיומיים). תאי RPE אימצו מחדש בהדרגה את המורפולוגיה המשושה בשלב המעריכי (כ-5 ימים, איור 1A) ונכנסו לשלב ההאטה (כ-6 ימים) עם מורפולוגיה מצולעת יותר. אם תרבית התאים נמשכה שבוע נוסף, התפשטות התאים פחתה באופן משמעותי, וצמתים בין תאים מילאו תפקיד עיקרי, כשהקצוות מוארים; באותו זמן, התאים כבר לא היו בשלב המעריכי (איור 1A, P2D11). בנוסף למורפולוגיה של התא, בוצעה בדיקת התפשטות תאי EdU כדי לסייע בקביעת הפאזה. איור 1B מראה שתאי P2D5 הציגו קצב התרבות גבוה יותר (שלב מעריכי), בעוד שתאי P2D11 נכנסו לשלב ההאטה.
לאחר הקפאה בחנקן נוזלי במשך 1-3 חודשים, תאי RPE הופשרו. עם ההפשרה, חלק מהתאים התפרקו לפסולת תת-תאית, חלק מהתאים עברו אפופטוזיס, והתאים הנותרים שרדו. לאחר 24 שעות, תאי RPE שהוקפאו ב-P2D5 הציגו קצב התקשרות גבוה יותר מאלה שהוקפאו בנקודות זמן אחרות (איור 2A). יתר על כן, הם הציגו את המורפולוגיה המשושה האופיינית של תאי RPE בוגרים עם הידבקויות תאים ברורות (צמתים הדוקים) כבר 14 יום לאחר ההפשרה. לעומת זאת, תאים שקפאו בנקודות זמן אחרות אימצו בדרך כלל פנוטיפ פיברובלסטי (איור 2A), מה שמצביע על כך שהם עברו תקופה ארוכה יחסית של מעבר EMT. עשרים ושמונה ימים לאחר ההפשרה, RPE שהוקפא ב-P2D5 הראה סמני תאי RPE בעלי ביטוי גבוה יותר ומיקום נכון יותר, כפי שמוצג על-ידי qPCR (איור 2B) וצביעה אימונופלואורסצנטית (איור 2C,D).
כדי לבדוק את היציבות של פרוטוקול זה באמצעי שימור הקפאה שונים, הושוו הביצועים של שני אמצעי שימור קריוגניים המיושמים בפרוטוקול. התוצאה הראתה ששני אמצעי השימור בהקפאה הפגינו ביצועים טובים באותה מידה בהשגת כדאיות גבוהה של תאים והתקשרות לאחר הפשרה (איור 3).

איור 1: תמונות מייצגות של תאי RPE מוכנים להקפאה. (A) תאי RPE ב-P2D5 הציגו פחות מורפולוגיה משושה ופיגמנטציה מאשר תאי P2D11. (B) תאי RPE ב-P2D5 הציגו קצב התפשטות גבוה יותר מאלה שב-P2D11, כפי שהתגלה בבדיקת EdU. פסי קנה מידה = 100 מיקרומטר. קיצורים: RPE = אפיתל פיגמנט ברשתית; BF = שדה בהיר; EdU = 5-ethynyl-2'-deoxyuridine. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
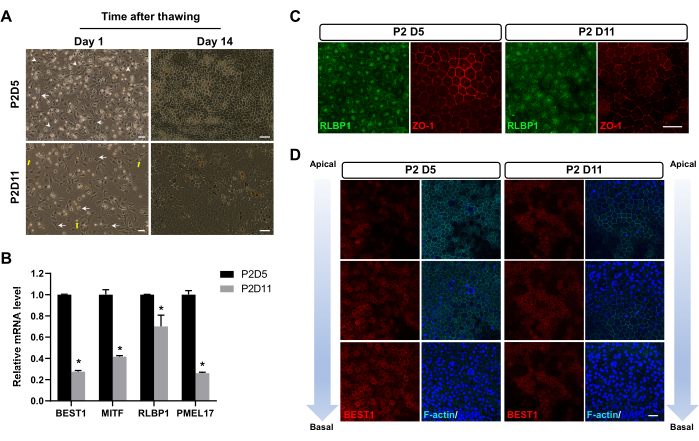
איור 2: תמונות מייצגות של תאי RPE לאחר הפשרה. (A) תאי RPE שהוקפאו ב-P2D5 הציגו התקשרות טובה יותר 24 שעות לאחר ההפשרה (עמודה שמאלית) והציגו מורפולוגיה משושה מוקדם יותר – 14 יום לאחר ההפשרה (עמודה ימנית). תאי RPE אופייניים עם מורפולוגיה דחוסה (ראשי חץ) בקבוצת P2D5, מורפולוגיה דמוית פיברובלסט לא מספקת (חצים) בקבוצת P2D11, ופסולת תאים (חצים צהובים) מודגשים. (ב-ד) תמונות אלה שונו מ Zhang et al17. (ב,ג) תאי RPE שהוקפאו ב-P2D5 הציגו רמות גבוהות יותר של mRNA וביטוי חלבונים של גנים טיפוסיים של סמן RPE 28 ימים לאחר ההפשרה. הבדלים סטטיסטיים מוערכים עם ANOVA דו-כיווני עם מבחן פוסט-הוק של Bonferroni. *P < 0.05. (D) ניתוח אימונוסטיין לאורך הציר האפיקלי-בסיסי 28 יום לאחר ההפשרה הראה קוטביות טובה יותר של תאי RPE שהוקפאו ב-P2D5. גרעינים הוכתמו ב-DAPI. פסי קנה מידה = 50 מיקרומטר (A), 25 מיקרומטר (C,D). קיצורים: RPE = אפיתל פיגמנט ברשתית; DAPI = 4',6-diamidino-2-phenylindole. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: ביצועים של שני אמצעי שימור קריוגניים המיושמים בפרוטוקול. (A) שיעור הכדאיות של התאים נמדד בעת הפשרת תאי RPE שמקורם ב-hESC שהוקפאו ב-P2D5. (B) תמונות שדה בהיר של תאי RPE מפשירים משני מדיות הקפאה שונות (#1 ו- #2) 24 שעות לאחר ההפשרה. סרגל קנה מידה = 100 מיקרומטר. קיצורים: RPE = אפיתל פיגמנט ברשתית; hESC = תא גזע עוברי אנושי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
במחקר הנוכחי מתואר פרוטוקול הקפאה-הפשרה מוצלח עבור תאי RPE שמקורם בתאי גזע עובריים עובריים (תאי גזע עובריים) לצורך מחקר וצרכים קליניים. שלא כמו קו תאי RPE אימורטלי, ARPE-19, תאי RPE עם פנוטיפ אפיתל אופייני תקין ותפקוד, כמו תאי תאי גזע נגזרים RPE, רגישים יותר להקפאה. פחות מ-32% מהתאים נשארו 24 שעות לאחר ההפשרה אם לא השתמרו כראוי17. תזמון שימור בהקפאה הוא פרמטר קריטי. השקפה מבוססת לשימור בהקפאה של תאים אימורטליים היא להקפיא תאים בשלב הגידול המעריכי. תאים ממוינים יוצאים ממחזור התא. לכן, ההשפעה של שלב הצמיחה עבור cryopreservation כבר לעתים רחוקות נחשב עבור תאים ממוינים. הראינו שתאי RPE ממוינים של תאי גזע עובריים (תאי גזע עובריים) חזרו ליכולת להתרבות לזמן קצר ונכנסו לשלב מעריכי לאחר שעברו את התהליך. ניתן להשיג תוצאות משופרות על ידי שימור קריושימור תאי RPE במהלך השלב המעריכי17.
המגבלה של פרוטוקול זה היא שנבדקו רק שני סוגים של מדיה לשימור קריוגני. אמצעי הקפאה שונים עשויים למנוע קריו-פציעה בדרכים שונות23; לכן, אמצעי שימור בהקפאה עשויים להשפיע על השלב האופטימלי של שימור תאי RPE בהקפאה. האם יש להמשיך ולהעריך אם אמצעי ההקפאה בהקפאה משפיעים על זמן ההקפאה האופטימלי.
פרוטוקול השימור הקריוגני המוצג במחקר זה יכול בקלות להיות מותאם לשימוש במעבדות שונות על ידי קביעת השלב המעריכי של תאי RPE לפני הקפאתם, מה שהופך אותו לעצמאי יותר מתקופות גידול ספציפיות, שיטות התמיינות או קווי תאים. בנוסף להערכת המורפולוגיה של התא, בדיקת EdU מספקת הערכה פשוטה כדי להבטיח שהתאים נשמרים בשלב המעריכי.
הפרוטוקול הנוכחי הוא שיטה פשוטה ויעילה לשימור תאי RPE בהקפאה. אסטרטגיה זו עשויה להיות מיושמת כדי cryopreserve סוגים אחרים של תאים ממוינים.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
עבודה זו מומנה על ידי הקרן הלאומית למדעי הטבע של סין (81970816) למיי ג'יאנג; הקרן הלאומית למדעי הטבע של סין (82201223) לשין-יואה ג'ו; ותוכנית הפעולה לחדשנות במדע וטכנולוגיה של ועדת המדע והטכנולוגיה של שנחאי (2014090067000) להאי-יון ליו.
Materials
| Name | Company | Catalog Number | Comments |
| 40 μm Cell strainer | Corning | 431750 | |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 488 Dye | Thermo Fisher Scientific | C10337 | |
| Cryo freezing container | Nalgene | 5100-0001 | |
| CryoStor CS10 | Biolife Solutions | 07930 | cryopreservation medium #1 |
| DPBS, no calcium, no magnesium | Thermo Fisher Scientific | 14190144 | |
| Genxin | Selcell | YB050050 | cryopreservation medium #2 |
| Human embryonic stem cells | provided by Wicell, USA | H9 cell line | |
| Matrigel, hESC-Qualified Matrix | Corning | 354277 | basement membrane matrix |
| ThawSTAR CFT2 Automated Cell Thawing System | BioLife Solutions | AST-601 | |
| Trypan Blue solution 0.4% | Sigma | T8154 | |
| TryPLE Select | Thermo Fisher Scientific | 12563029 | cell dissociation reagent |
| XVIVO-10 medium | Lonza | BEBP04-743Q | RPE culture medium |
| Y-27632 | Selleck | S1049 |
References
- Lakkaraju, A., et al. The cell biology of the retinal pigment epithelium. Progress in Retinal and Eye Research. 78, 100846(2020).
- Mcbain, V. A., Townend, J., Lois, N. Progression of retinal pigment epithelial atrophy in stargardt disease. American Journal of Ophthamology. 154 (1), 146-154 (2012).
- George, S. M., Lu, F., Rao, M., Leach, L. L., Gross, J. M. The retinal pigment epithelium: Development, injury responses, and regenerative potential in mammalian and non-mammalian systems. Progress in Retinal and Eye Research. 85, 100969(2021).
- Rizzolo, L. J., Nasonkin, I. O., Adelman, R. A. Retinal cell transplantation, biomaterials, and in vitro models for developing next-generation therapies of age-related macular degeneration. Stem Cells Translational Medicine. 11 (3), 269-281 (2022).
- Bertolotti, E., Neri, A., Camparini, M., Macaluso, C., Marigo, V. Stem cells as source for retinal pigment epithelium transplantation. Progress in Retinal and Eye Research. 42, 130-144 (2014).
- Da Cruz,, L,, et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Mehat, M. S., et al. Transplantation of human embryonic stem cell-derived retinal pigment epithelial cells in macular degeneration. Ophthalmology. 125 (11), 1765-1775 (2018).
- Buchholz, D. E., et al. Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium. Stem Cells Translational Medicine. 2 (5), 384-393 (2013).
- Li, Q. -Y., et al. Functional assessment of cryopreserved clinical grade hESC-RPE cells as a qualified cell source for stem cell therapy of retinal degenerative diseases. Experimental Eye Research. 202, 108305(2021).
- Francois, M., et al. Cryopreserved mesenchymal stromal cells display impaired immunosuppressive properties as a result of heat-shock response and impaired interferon-gamma licensing. Cytotherapy. 14 (2), 147-152 (2012).
- Moll, G., et al. Do cryopreserved mesenchymal stromal cells display impaired immunomodulatory and therapeutic properties. Stem Cells. 32 (9), 2430-2442 (2014).
- Ekpo, M. D., et al. Incorporating cryopreservation evaluations into the design of cell-based drug delivery systems: an opinion paper. Frontiers in Immunology. 13, 967731(2022).
- Bailey, T. L., et al. Protective effects of osmolytes in cryopreserving adherent neuroblastoma (Neuro-2a) cells. Cryobiology. 71 (3), 472-480 (2015).
- Okumura, N., et al. Feasibility of a cryopreservation of cultured human corneal endothelial cells. PLoS One. 14 (6), e0218431(2019).
- Pennington, B. O., et al. Xeno-free cryopreservation of adherent retinal pigmented epithelium yields viable and functional cells in vitro and in vivo. Scientific Reports. 11 (1), 6286(2021).
- Woods, E. J., Thirumala, S., Badhe-Buchanan, S. S., Clarke, D., Mathew, A. J. Off the shelf cellular therapeutics: Factors to consider during cryopreservation and storage of human cells for clinical use. Cytotherapy. 18 (6), 697-711 (2016).
- Zhang, T., et al. Determining the optimal stage for cryopreservation of human embryonic stem cell-derived retinal pigment epithelial cells. Stem Cell Research & Therapy. 13 (1), 454(2022).
- Leach, L. L., et al. Induced pluripotent stem cell-derived retinal pigmented epithelium: a comparative study between cell lines and differentiation Methods. Journal of Ocular Pharmacology and Therapeutics. 32 (5), 317-330 (2016).
- Reichman, S., et al. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human iPS cells in Xeno-free and feeder-free conditions. Stem Cells. 35 (5), 1176-1188 (2017).
- Brandl, C., et al. In-depth characterisation of retinal pigment epithelium (RPE) cells derived from human induced pluripotent stem cells (hiPSC). Neuromolecular Medicine. 16 (3), 551-564 (2014).
- Hongisto, H., Ilmarinen, T., Vattulainen, M., Mikhailova, A., Skottman, H. Xeno- and feeder-free differentiation of human pluripotent stem cells to two distinct ocular epithelial cell types using simple modifications of one method. Stem Cell Research & Therapy. 8 (1), 291(2017).
- Foltz, L. P., Clegg, D. O. Rapid, directed differentiation of retinal pigment epithelial cells from human embryonic or induced pluripotent stem cells. Journal of Visualized Experiments: JoVE. (128), 10.3791/56274(2017).
- Marcantonini, G., et al. Natural cryoprotective and cytoprotective agents in cryopreservation: a focus on melatonin. Molecules. 27 (10), 3254(2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved