Method Article
Criopreservación de células epiteliales pigmentarias de la retina derivadas de células madre embrionarias humanas en la etapa óptima
* Estos autores han contribuido por igual
En este artículo
Resumen
Este estudio proporciona un protocolo detallado para la criopreservación eficiente de células epiteliales pigmentarias de la retina derivadas de células madre humanas.
Resumen
Las células epiteliales pigmentarias de la retina (EPR) derivadas de células madre embrionarias humanas (hESCs) son fuentes celulares superiores para la terapia de reemplazo celular en individuos con enfermedades degenerativas de la retina; Sin embargo, los estudios sobre el almacenamiento estable y seguro de estas células terapéuticas son escasos. La viabilidad celular altamente variable y la recuperación funcional de las células EPR después de la criopreservación son los problemas más comunes. En el protocolo actual, nuestro objetivo fue lograr la mejor tasa de recuperación celular después de la descongelación seleccionando la fase celular óptima para la congelación en función de las condiciones experimentales originales. Las células se congelaron en la fase exponencial determinada mediante el ensayo de marcaje con 5-etinil-2′-desoxiuridina, que mejoró la viabilidad celular y la tasa de recuperación después de la descongelación. Las células estables y funcionales se obtuvieron poco después de la descongelación, independientemente de un largo proceso de diferenciación. Los métodos descritos aquí permiten la conservación y descongelación simples, eficientes y económicas de las células RPE derivadas de hESC. Aunque este protocolo se centra en las células EPR, esta estrategia de congelación puede aplicarse a muchos otros tipos de células diferenciadas.
Introducción
El epitelio pigmentario de la retina (EPR) es una monocapa pigmentada de células necesarias para mantener el correcto funcionamiento de la retina. La disfunción y la muerte del EPR están estrechamente asociadas con muchas enfermedades degenerativas de la retina, como la degeneración macular relacionada con la edad, la retinosis pigmentaria y la enfermedad de Stargardt 2,3. La terapia de reemplazo del EPR es uno de los esquemas de tratamiento más prometedores para estas enfermedades 4,5,6,7. Un suministro estable de células RPE del donante es vital para la terapia celular. Las células EPR derivadas de células madre embrionarias humanas (hESC) son una fuente celular ideal para la terapia celular porque imitan la función de las células primarias EPR y pueden producir un suministro teóricamente ilimitado8. Sin embargo, el proceso de diferenciación es laborioso y la vida útil de las células EPR obtenidas es relativamente corta debido a la posterior transición epitelio-mesenquimal (EMT). Por lo tanto, la criopreservación de células EPR derivadas de hESC es un paso indispensable necesario para el almacenamiento a largo plazo y la distribución bajo demanda9.
El daño celular inducido por la criopreservación puede comprometer inadvertidamente la eficacia terapéutica 10,11. Por lo tanto, estudios recientes sobre criopreservación han propuesto que las condiciones óptimas de almacenamiento criogénico deben determinarse al diseñar terapias celulares12. La criopreservación exitosa garantiza una recuperación celular eficiente, alta viabilidad y restauración de la función celular después del ciclo de congelación-descongelación. Sin embargo, estudios previos sobre la criopreservación de las monocapas adherentes de células de mamíferos han reportado tasas de supervivencia altamente variables (35%-95%) después de la descongelación 13,14,15. Muchos factores afectan considerablemente los resultados de la criopreservación, particularmente durante la etapa de congelación16,17. Investigaciones recientes mostraron que las células EPR congeladas en diferentes puntos de tiempo exhibieron una recuperación variada después de la descongelación17. Hasta donde sabemos, faltan estudios sobre la determinación de la ventana de tiempo de congelación óptima para las células RPE derivadas de células madre. En diferentes estudios, las células se congelaron en varias etapas: algunas células se congelaron poco después del paso o antes de la confluencia o pigmentación 8,15,18, mientras que otras se congelaron en otros puntosde tiempo 9,19,20,21. Además, no hay pruebas claras de si la fase o el estadio de las células EPR utilizadas para la criopreservación afectan a la función del EPR después de la descongelación. En nuestro estudio anterior, demostramos por primera vez que la fase exponencial de crecimiento celular (P2D5) es la mejor etapa para la criopreservación de células EPR derivadas de hESC en términos de viabilidad celular y recuperación de propiedades y funciones celulares17.
El método establecido aquí tiene como objetivo criopreservar el EPR derivado de hESC en una etapa óptima para lograr la mejor preservación en términos de viabilidad y función celular después de la descongelación. Utilizando el ensayo de marcaje de 5-etinil-2'-desoxiuridina (EdU) para detectar la fase exponencial de la síntesis de ADN antes de la criopreservación, las células de EPR descongeladas mostraron una tasa de viabilidad y adhesión del >80%, expresión génica específica de EPR, morfología celular polarizada, secreción de factor derivada del epitelio pigmentario, resistencia transepitelial adecuada y capacidad fagocítica 8,17,22. Aunque este protocolo se centra en las células EPR derivadas de hESC y no todas las células terapéuticas son igualmente criopreservadas, la estrategia de congelación en la fase exponencial puede aplicarse a muchas otras células terapéuticas.
Protocolo
1. Disociación celular
- Mantener las células RPE como se ha descrito anteriormente17,22.
NOTA: Todas las células se cultivan a 37 °C en una atmósfera con un 5% deCO2 durante toda la duración de los protocolos. - Prepare la cantidad requerida de PBS y medio de cultivo en un baño de agua a 37 ° C y coloque el reactivo de disociación celular a temperatura ambiente.
- Deseche la solución de cultivo y lave las placas dos veces con 1 mL de PBS precalentado por pocillo.
- Añadir 1 mL del reactivo de disociación celular a las placas de 6 pocillos y digerir las células a 37 °C durante 15 min. Después de la incubación, observe las células que se encogen y brillan en los bordes bajo un microscopio para confirmar la terminación de la digestión.
NOTA: No se recomienda la disociación basada en tripsina, ya que proporciona una baja viabilidad celular. - Pipetear hacia arriba y hacia abajo suavemente 10x con una pipeta de 1 mL para disociar las células, y diluir la suspensión celular con medio de cultivo precalentado (sin Y-27632) en una proporción de 1:10. A continuación, centrifugar las células a temperatura ambiente durante 3 minutos a 250 × g.
- Vierta rápidamente el sobrenadante después de la centrifugación, vuelva a suspender suavemente el gránulo celular en 2 mL del medio de cultivo y vuelva a suspender las células 10-15x con una pipeta.
- Filtre la suspensión celular con un filtro celular de 40 μm para obtener una suspensión celular única y calcule el número de celdas.
NOTA: Una suspensión de una sola célula es esencial para un recuento celular preciso y una densidad uniforme de siembra de células después de la descongelación.
2. Determinación del estadio celular óptimo para la criopreservación
NOTA: Debido a que el estado celular varía entre los métodos de diferenciación y las líneas celulares, la fase exponencial de las células EPR cultivadas en diferentes laboratorios debe determinarse antes de la congelación.
- Descongele un vial de solución de matriz de membrana basal en hielo a 4 °C durante la noche. Diluir la matriz en 12 mL de DMEM/F-12 frío y mezclar bien. Agregue un cubreobjetos por pocillo y cubra cada pocillo de una placa de 24 pocillos con 0,25 ml de la solución diluida. Incubar la placa durante 1 h a temperatura ambiente o toda la noche a 4 °C antes de su uso y aspirar la solución de recubrimiento justo antes de sembrar las células.
NOTA: Las instrucciones para el volumen de alícuotas son específicas del lote en función de la concentración de proteínas y se encuentran en la hoja de especificaciones del producto. - Siembre las células individuales del EPR del paso 1.7 en los cubreobjetos recubiertos de matriz de membrana basal a una densidad de 105/cm2 en 1 mL de medio de cultivo. Refresque el medio de cultivo cada 2-3 días.
- En los puntos de tiempo indicados (1, 3, 5, 7 y 11 días después del paso), incubar las células EPR con 10 μM de EdU en el medio durante 24 h. Fije, permeabilice y tiña las células con el cóctel de reacción como se describe en el manual para detectar EdU incorporado.
- Capture imágenes de cinco campos aleatorios bajo un microscopio de fluorescencia y calcule el porcentaje de células EdU positivas. Traza las curvas de proporcional-tiempo positivas para EdU correspondientes para generar una curva de crecimiento. Luego, determine la ventana de congelación o la fase exponencial para cada línea celular de acuerdo con la curva de crecimiento.
NOTA: La morfología celular hexagonal restablecida indica que las células salen de la fase exponencial.
3. Criopreservación
- Siguiendo los pasos 1.1 a 1.7, excepto que el tiempo de digestión disminuye a 5 minutos, centrifugar la suspensión celular a temperatura ambiente durante 3 minutos a 250 × g.
- Deseche el sobrenadante vertiéndolo rápidamente después de la centrifugación y vuelva a suspender suavemente el pellet celular en el medio de criopreservación a una densidad de 2 × 106 células/mL y transfiera 1 mL de la suspensión celular a viales criogénicos de 1,2 mL.
- Coloque inmediatamente los viales criogénicos en un recipiente de congelación, congele a -80 °C durante la noche para lograr una velocidad de enfriamiento de -1 °C/min y, a continuación, transfiera los viales a nitrógeno líquido para su almacenamiento a largo plazo.
4. Descongelación
- Calentar el medio de cultivo en un baño de agua a 37 °C y rellenar previamente 10 mL de medio de cultivo precalentado en un tubo de 15 mL.
- Descongele rápidamente los viales criogénicos tomados directamente del almacenamiento de nitrógeno líquido mediante un sistema de descongelación automatizado.
- Gotee 0,5-1 mL de medio de cultivo precalentado en el vial criogénico para asegurar que las células congeladas se adapten gradualmente al nuevo entorno. A continuación, transfiera 1,5-2 mL de la suspensión celular a 10 mL del medio de cultivo en un tubo de 15 mL y centrifugue las células a 250 × g durante 3 min a temperatura ambiente.
- Deseche el sobrenadante vertiéndolo rápidamente después de la centrifugación, vuelva a suspender el pellet en 2 ml de medio de cultivo precalentado y cuente el número de células con un hemocitómetro para determinar las tasas de recuperación y supervivencia utilizando la exclusión estándar de azul de tripán (tinción de azul de tripán al 0,4%).
- Cultivar las células en superficies recubiertas de matriz de membrana basal a una densidad de 105 células viables/cm2 en un medio de cultivo suplementado con Y-27632 (concentración final: 10 μM). Retire Y-27632 después de 24 h.
- Para determinar la tasa de adhesión, disocie las células nuevamente y cuente el número de células 24 h después de la descongelación.
5. Validación de la fase óptima de congelación
- Para validar la fase de congelación óptima determinada en el paso 2.4, descongele las células de EPR congeladas en diferentes puntos de tiempo y cultive durante 28 días. Recolectar las células para el análisis de qPCR e inmunotinción para evaluar la expresión de los marcadores RPE como se describió anteriormente17.
Resultados
Aquí, las células RPE derivadas de hESC en P1D35 fueron pasadas y sembradas a una densidad de 105/cm2. A la semana de la siembra, la morfología hexagonal característica y la pigmentación se perdieron durante la fase de retraso (aproximadamente 2 días). Las células EPR readoptaron gradualmente la morfología hexagonal en la fase exponencial (aproximadamente 5 días, Figura 1A) y entraron en la fase de desaceleración (aproximadamente 6 días) con una morfología más poligonal. Si el cultivo celular continuaba durante una semana más, la proliferación celular disminuía significativamente y las uniones célula-célula desempeñaban un papel principal, con los bordes iluminados; en este momento, las células ya no estaban en la fase exponencial (Figura 1A, P2D11). Además de la morfología celular, se realizó el ensayo de proliferación celular EdU para ayudar a determinar la fase. La Figura 1B demuestra que las células P2D5 exhibieron una mayor tasa de proliferación (fase exponencial), mientras que las células P2D11 habían entrado en la fase de desaceleración.
Después de congelar en nitrógeno líquido durante 1-3 meses, las células del EPR se descongelaron. Al descongelarse, algunas células se degradaron en desechos subcelulares, algunas células sufrieron apoptosis y las células restantes sobrevivieron. Después de 24 h, las células de EPR congeladas en P2D5 mostraron una tasa de unión más alta que las congeladas en otros puntos de tiempo (Figura 2A). Además, exhibieron la morfología hexagonal característica de las células EPR maduras con distintas adherencias célula-célula (uniones estrechas) tan pronto como 14 días después de la descongelación. Por el contrario, las células congeladas en otros puntos de tiempo generalmente adoptaron un fenotipo fibroblástico (Figura 2A), lo que indica que estaban pasando por un período relativamente más largo de transición de EMT. Veintiocho días después de la descongelación, el EPR congelado en P2D5 mostró marcadores celulares de EPR más expresados y localizados correctamente, como se muestra en la qPCR (Figura 2B) y la tinción con inmunofluorescencia (Figura 2C,D).
Para probar la estabilidad de este protocolo en diferentes medios de criopreservación, se comparó el rendimiento de dos medios de criopreservación aplicados en el protocolo. El resultado mostró que los dos medios de criopreservación se comportaron igual de bien para lograr una alta viabilidad celular y fijación después de la descongelación (Figura 3).

Figura 1: Imágenes representativas de células RPE listas para congelar. (A) Las células RPE en P2D5 exhibieron menos morfología y pigmentación hexagonal que las de P2D11. (B) Las células EPR en P2D5 exhibieron una tasa de proliferación más alta que las de P2D11, según lo revelado por el ensayo EdU. Barras de escala = 100 μm. Abreviaturas: RPE = epitelio pigmentario de la retina; BF = campo claro; EdU = 5-etinil-2'-desoxiuridina. Haga clic aquí para ver una versión más grande de esta figura.
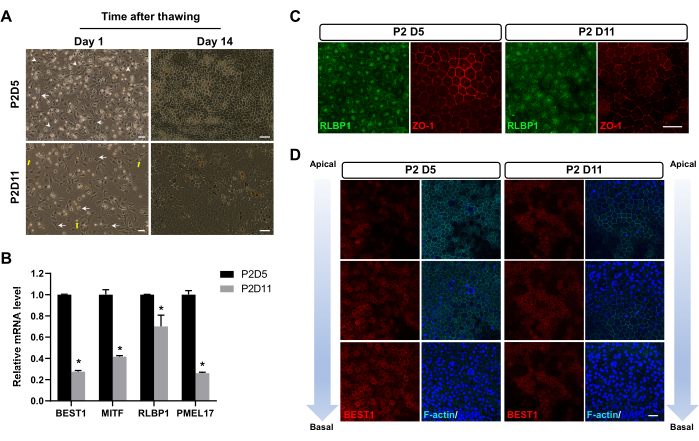
Figura 2: Imágenes representativas de las células del EPR después de la descongelación. (A) Las células del EPR congeladas en P2D5 mostraron una mejor adherencia 24 h después de la descongelación (columna izquierda) y exhibieron morfología hexagonal antes, 14 días después de la descongelación (columna derecha). Se destacan las células EPR características con morfología compactada (puntas de flecha) en el grupo P2D5, morfología insatisfactoria similar a un fibroblasto (flechas) en el grupo P2D11 y restos celulares (flechas amarillas). (B-D) Estas imágenes son modificadas de Zhang et al17. (B,C) Las células EPR congeladas en P2D5 exhibieron niveles más altos de expresión de ARNm y proteínas de genes marcadores RPE típicos 28 días después de la descongelación. Las diferencias estadísticas se evalúan con ANOVA de dos vías con la prueba post hoc de Bonferroni. *P < 0,05. (D) El análisis de inmunotinción a lo largo del eje apical-basal 28 días después de la descongelación mostró una mejor polaridad de las células EPR congeladas en P2D5. Los núcleos se contratiñeron con DAPI. Barras de escala = 50 μm (A), 25 μm (C,D). Abreviaturas: RPE = epitelio pigmentario de la retina; DAPI = 4',6-diamidino-2-fenilindol. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Rendimiento de dos medios de criopreservación aplicados en el protocolo. (A) La tasa de viabilidad celular se midió tras la descongelación de células RPE derivadas de hESC congeladas en P2D5. (B) Las imágenes de campo claro de las células del EPR descongelándose de dos medios de congelación diferentes (# 1 y # 2) 24 h después de la descongelación. Barra de escala = 100 μm. Abreviaturas: RPE = epitelio pigmentario de la retina; hESC = célula madre embrionaria humana. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En el presente estudio, se describe un protocolo exitoso de congelación-descongelación para células RPE derivadas de hESC para necesidades clínicas y de investigación. A diferencia de la línea celular de EPR inmortalizada, ARPE-19, las células EPR con el fenotipo epitelial y la función característicos adecuados, como las células EPR derivadas de células madre, son más sensibles a la criopreservación. Menos del 32% de las células permanecieron a las 24 h después de la descongelación si no se conservaban adecuadamente17. El tiempo de criopreservación es un parámetro crítico. Una visión establecida para la criopreservación de células inmortalizadas es congelar células en la fase de crecimiento exponencial. Las células diferenciadas salen del ciclo celular. Por lo tanto, el efecto de la fase de crecimiento para la criopreservación rara vez se ha considerado para las células diferenciadas. Demostramos que las células EPR diferenciadas por hESC recuperaron la capacidad de proliferar durante un corto período de tiempo y entraron en una etapa exponencial después del paso. Se pueden lograr mejores resultados criopreservando células RPE durante la fase exponencial17.
La limitación de este protocolo es que solo se probaron dos tipos de medios de criopreservación. Diferentes medios de criopreservación pueden prevenir la criolesión de diferentes maneras23; por lo tanto, los medios de criopreservación pueden afectar la etapa óptima de la criopreservación de células EPR. Se debe evaluar más a fondo si los medios de criopreservación afectan el tiempo óptimo de congelación.
El protocolo de criopreservación presentado en este estudio se puede adaptar fácilmente para su uso en diferentes laboratorios determinando la fase exponencial de las células EPR antes de congelarlas, lo que lo hace más independiente de períodos de cultivo específicos, métodos de diferenciación o líneas celulares. Además de evaluar la morfología celular, el ensayo EdU proporciona una evaluación sencilla para garantizar que las células se conserven en la fase exponencial.
El protocolo actual es un método simple y eficiente para criopreservar células EPP. Esta estrategia se puede aplicar para criopreservar otros tipos de células diferenciadas.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este trabajo fue financiado por la Fundación Nacional de Ciencias Naturales de China (81970816) a Mei Jiang; la Fundación Nacional de Ciencias Naturales de China (82201223) a Xinyue Zhu; y el Plan de Acción de Innovación Científica y Tecnológica de la Comisión de Ciencia y Tecnología de Shanghái (2014090067000) a Haiyun Liu.
Materiales
| Name | Company | Catalog Number | Comments |
| 40 μm Cell strainer | Corning | 431750 | |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 488 Dye | Thermo Fisher Scientific | C10337 | |
| Cryo freezing container | Nalgene | 5100-0001 | |
| CryoStor CS10 | Biolife Solutions | 07930 | cryopreservation medium #1 |
| DPBS, no calcium, no magnesium | Thermo Fisher Scientific | 14190144 | |
| Genxin | Selcell | YB050050 | cryopreservation medium #2 |
| Human embryonic stem cells | provided by Wicell, USA | H9 cell line | |
| Matrigel, hESC-Qualified Matrix | Corning | 354277 | basement membrane matrix |
| ThawSTAR CFT2 Automated Cell Thawing System | BioLife Solutions | AST-601 | |
| Trypan Blue solution 0.4% | Sigma | T8154 | |
| TryPLE Select | Thermo Fisher Scientific | 12563029 | cell dissociation reagent |
| XVIVO-10 medium | Lonza | BEBP04-743Q | RPE culture medium |
| Y-27632 | Selleck | S1049 |
Referencias
- Lakkaraju, A., et al. The cell biology of the retinal pigment epithelium. Progress in Retinal and Eye Research. 78, 100846(2020).
- Mcbain, V. A., Townend, J., Lois, N. Progression of retinal pigment epithelial atrophy in stargardt disease. American Journal of Ophthamology. 154 (1), 146-154 (2012).
- George, S. M., Lu, F., Rao, M., Leach, L. L., Gross, J. M. The retinal pigment epithelium: Development, injury responses, and regenerative potential in mammalian and non-mammalian systems. Progress in Retinal and Eye Research. 85, 100969(2021).
- Rizzolo, L. J., Nasonkin, I. O., Adelman, R. A. Retinal cell transplantation, biomaterials, and in vitro models for developing next-generation therapies of age-related macular degeneration. Stem Cells Translational Medicine. 11 (3), 269-281 (2022).
- Bertolotti, E., Neri, A., Camparini, M., Macaluso, C., Marigo, V. Stem cells as source for retinal pigment epithelium transplantation. Progress in Retinal and Eye Research. 42, 130-144 (2014).
- Da Cruz,, L,, et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Mehat, M. S., et al. Transplantation of human embryonic stem cell-derived retinal pigment epithelial cells in macular degeneration. Ophthalmology. 125 (11), 1765-1775 (2018).
- Buchholz, D. E., et al. Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium. Stem Cells Translational Medicine. 2 (5), 384-393 (2013).
- Li, Q. -Y., et al. Functional assessment of cryopreserved clinical grade hESC-RPE cells as a qualified cell source for stem cell therapy of retinal degenerative diseases. Experimental Eye Research. 202, 108305(2021).
- Francois, M., et al. Cryopreserved mesenchymal stromal cells display impaired immunosuppressive properties as a result of heat-shock response and impaired interferon-gamma licensing. Cytotherapy. 14 (2), 147-152 (2012).
- Moll, G., et al. Do cryopreserved mesenchymal stromal cells display impaired immunomodulatory and therapeutic properties. Stem Cells. 32 (9), 2430-2442 (2014).
- Ekpo, M. D., et al. Incorporating cryopreservation evaluations into the design of cell-based drug delivery systems: an opinion paper. Frontiers in Immunology. 13, 967731(2022).
- Bailey, T. L., et al. Protective effects of osmolytes in cryopreserving adherent neuroblastoma (Neuro-2a) cells. Cryobiology. 71 (3), 472-480 (2015).
- Okumura, N., et al. Feasibility of a cryopreservation of cultured human corneal endothelial cells. PLoS One. 14 (6), e0218431(2019).
- Pennington, B. O., et al. Xeno-free cryopreservation of adherent retinal pigmented epithelium yields viable and functional cells in vitro and in vivo. Scientific Reports. 11 (1), 6286(2021).
- Woods, E. J., Thirumala, S., Badhe-Buchanan, S. S., Clarke, D., Mathew, A. J. Off the shelf cellular therapeutics: Factors to consider during cryopreservation and storage of human cells for clinical use. Cytotherapy. 18 (6), 697-711 (2016).
- Zhang, T., et al. Determining the optimal stage for cryopreservation of human embryonic stem cell-derived retinal pigment epithelial cells. Stem Cell Research & Therapy. 13 (1), 454(2022).
- Leach, L. L., et al. Induced pluripotent stem cell-derived retinal pigmented epithelium: a comparative study between cell lines and differentiation Methods. Journal of Ocular Pharmacology and Therapeutics. 32 (5), 317-330 (2016).
- Reichman, S., et al. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human iPS cells in Xeno-free and feeder-free conditions. Stem Cells. 35 (5), 1176-1188 (2017).
- Brandl, C., et al. In-depth characterisation of retinal pigment epithelium (RPE) cells derived from human induced pluripotent stem cells (hiPSC). Neuromolecular Medicine. 16 (3), 551-564 (2014).
- Hongisto, H., Ilmarinen, T., Vattulainen, M., Mikhailova, A., Skottman, H. Xeno- and feeder-free differentiation of human pluripotent stem cells to two distinct ocular epithelial cell types using simple modifications of one method. Stem Cell Research & Therapy. 8 (1), 291(2017).
- Foltz, L. P., Clegg, D. O. Rapid, directed differentiation of retinal pigment epithelial cells from human embryonic or induced pluripotent stem cells. Journal of Visualized Experiments: JoVE. (128), 10.3791/56274(2017).
- Marcantonini, G., et al. Natural cryoprotective and cytoprotective agents in cryopreservation: a focus on melatonin. Molecules. 27 (10), 3254(2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados