Method Article
Criopreservação de células-tronco embrionárias humanas derivadas de células epiteliais pigmentares da retina no estágio ideal
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este estudo fornece um protocolo detalhado para a criopreservação eficiente de células epiteliais pigmentares da retina derivadas de células-tronco humanas.
Resumo
As células epiteliais pigmentares da retina (EPR) derivadas de células-tronco embrionárias humanas (hESCs) são fontes celulares superiores para terapia de reposição celular em indivíduos com doenças degenerativas da retina; no entanto, estudos sobre o armazenamento estável e seguro dessas células terapêuticas são escassos. A viabilidade celular altamente variável e a recuperação funcional das células RPE após a criopreservação são os problemas mais comumente encontrados. No presente protocolo, nosso objetivo foi alcançar a melhor taxa de recuperação celular após o descongelamento, selecionando a fase celular ideal para congelamento com base nas condições experimentais originais. As células foram congeladas na fase exponencial determinada usando o ensaio de marcação com 5-etinil-2'-desoxiuridina, que melhorou a viabilidade celular e a taxa de recuperação após o descongelamento. Células estáveis e funcionais foram obtidas logo após o descongelamento, independentemente de um longo processo de diferenciação. Os métodos descritos aqui permitem a preservação e descongelamento simples, eficientes e baratos de células RPE derivadas de hESC. Embora este protocolo se concentre em células RPE, essa estratégia de congelamento pode ser aplicada a muitos outros tipos de células diferenciadas.
Introdução
O epitélio pigmentar da retina (EPR) é uma monocamada pigmentada de células necessárias para manter o funcionamento adequado da retina1. A disfunção e a morte do EPR estão intimamente associadas a muitas doenças degenerativas da retina, incluindo degeneração macular relacionada à idade, retinite pigmentosa e doença de Stargardt 2,3. A terapia de reposição do EPR é um dos esquemas de tratamento mais promissores para essas doenças 4,5,6,7. Um suprimento estável de células RPE do doador é vital para a terapia celular. As células RPE derivadas de células-tronco embrionárias humanas (hESC) são uma fonte celular ideal para terapia celular porque imitam a função das células primárias de RPE e podem produzir um suprimento teoricamente ilimitado8. No entanto, o processo de diferenciação é trabalhoso e a vida útil das células RPE obtidas é relativamente curta devido à subsequente transição epitelial-mesenquimal (EMT). Portanto, a criopreservação de células RPE derivadas de hESC é uma etapa indispensável necessária para armazenamento de longo prazo e distribuição sob demanda9.
O dano celular induzido pela criopreservação pode comprometer inadvertidamente a eficácia terapêutica10,11. Portanto, estudos recentes sobre criopreservação propuseram que as condições ideais de armazenamento criogênico devem ser determinadas ao projetar terapias celulares12. A criopreservação bem-sucedida garante recuperação celular eficiente, alta viabilidade e restauração da função celular após o ciclo de congelamento e descongelamento. No entanto, estudos anteriores sobre a criopreservação das monocamadas aderentes de células de mamíferos relataram taxas de sobrevivência altamente variáveis (35%-95%) após o descongelamento 13,14,15. Muitos fatores afetam consideravelmente os resultados da criopreservação, particularmente durante o estágio de congelamento16,17. Pesquisas recentes mostraram que as células RPE congeladas em diferentes momentos exibiram recuperação variada após o descongelamento17. Até onde sabemos, faltam estudos sobre a determinação da janela de tempo de congelamento ideal para células-tronco derivadas de células-tronco. Em diferentes estudos, as células foram congeladas em vários estágios: algumas células foram congeladas logo após a passagem ou antes da confluência ou pigmentação 8,15,18, enquanto outras foram congeladas em outros momentos 9,19,20,21. Além disso, não há evidências claras de se a fase ou estágio das células RPE usadas para criopreservação afeta a função do RPE após o descongelamento. Em nosso estudo anterior, demonstramos pela primeira vez que a fase exponencial do crescimento celular (P2D5) é o melhor estágio para a criopreservação de células RPE derivadas de hESC em termos de viabilidade celular e recuperação de propriedades e funções celulares17.
O método aqui estabelecido visa criopreservar o RPE derivado de hESC em um estágio ideal para obter a melhor preservação em termos de viabilidade e função celular após o descongelamento. Usando o ensaio de marcação de 5-etinil-2'-desoxiuridina (EdU) para detectar a fase exponencial da síntese de DNA antes da criopreservação, as células RPE descongeladas exibiram viabilidade e taxa de fixação >80%, expressão gênica específica de RPE, morfologia celular polarizada, secreção de fator derivado do epitélio pigmentar, resistência transepitelial apropriada e capacidade fagocítica 8,17,22. Embora este protocolo se concentre em células RPE derivadas de hESC e nem todas as células terapêuticas sejam igualmente criopreservadas, a estratégia de congelamento na fase exponencial pode ser aplicada a muitas outras células terapêuticas.
Protocolo
1. Dissociação celular
- Manter as células EPR conforme descrito anteriormente 17,22.
NOTA: Todas as células são cultivadas a 37 ° C em uma atmosfera de 5% de CO2 durante toda a duração dos protocolos. - Prepare a quantidade necessária de PBS e meio de cultura em banho-maria a 37 ° C e coloque o reagente de dissociação celular em temperatura ambiente.
- Descarte a solução de cultura e lave as placas duas vezes com 1 mL de PBS pré-aquecido por poço.
- Adicione 1 ml do reagente de dissociação celular às placas de 6 poços e digerir as células a 37 °C durante 15 min. Após a incubação, observe as células que encolhem e brilham nas bordas sob um microscópio para confirmar o término da digestão.
NOTA: A dissociação à base de tripsina não é recomendada, pois proporciona baixa viabilidade celular. - Pipete para cima e para baixo suavemente 10x com uma pipeta de 1 mL para dissociar as células e dilua a suspensão celular com meio de cultura pré-aquecido (sem Y-27632) na proporção de 1:10. Em seguida, centrifugue as células à temperatura ambiente por 3 min a 250 × g.
- Despeje rapidamente o sobrenadante após a centrifugação, ressuspenda suavemente o pellet celular em 2 mL do meio de cultura e ressuspenda as células 10-15x com uma pipeta.
- Filtrar a suspensão celular com um filtro de células de 40 μm para obter uma suspensão unicelular e calcular o número de células.
NOTA: Uma suspensão unicelular é essencial para uma contagem precisa de células e densidade de semeadura celular uniforme após o descongelamento.
2. Determinação do estágio celular ideal para criopreservação
NOTA: Como o estado celular varia entre os métodos de diferenciação e as linhagens celulares, a fase exponencial das células RPE cultivadas em diferentes laboratórios deve ser determinada antes do congelamento.
- Descongelar um frasco para injetáveis de solução de matriz de membrana basal em gelo a 4 °C durante a noite. Dilua a matriz em 12 mL de DMEM/F-12 frio e misture bem. Adicione uma lamínula por alvéolo e cubra cada poço de uma placa de 24 poços com 0,25 mL da solução diluída. Incubar a placa durante 1 h à temperatura ambiente ou durante a noite a 4 °C antes de utilizar e aspirar a solução de revestimento imediatamente antes de plaquear as células.
NOTA: As instruções para o volume da alíquota são específicas do lote com base na concentração de proteína e são encontradas na folha de especificações do produto. - Semeie as células únicas do EPR da etapa 1.7 nas lamínulas revestidas com matriz da membrana basal a uma densidade de 105 / cm2 em 1 mL de meio de cultura. Atualize o meio de cultura a cada 2-3 dias.
- Nos pontos de tempo indicados (1, 3, 5, 7 e 11 dias após a passagem), incube células RPE com 10 μM EdU no meio por 24 h. Fixe, permeabilize e core as células com o coquetel de reação conforme descrito no manual para detectar EdU incorporada.
- Capture imagens de cinco campos aleatórios sob um microscópio de fluorescência e calcule a porcentagem de células EdU-positivas. Plote as curvas de proporção-tempo positivas para EdU correspondentes para gerar uma curva de crescimento. Em seguida, determine a janela de congelamento ou a fase exponencial para cada linha celular de acordo com a curva de crescimento.
NOTA: A morfologia celular hexagonal restabelecida indica que as células saem da fase exponencial.
3. Criopreservação
- Seguindo os passos 1.1 a 1.7, exceto que o tempo de digestão diminui para 5 min, centrifugue a suspensão celular à temperatura ambiente por 3 min a 250 × g.
- Descarte o sobrenadante despejando rapidamente após a centrifugação e ressuspenda suavemente o pellet celular no meio de criopreservação a uma densidade de 2 × 106 células / mL e transfira 1 mL da suspensão celular para frascos criogênicos de 1,2 mL.
- Coloque imediatamente os frascos criogênicos em um recipiente de congelamento, congele a -80 ° C durante a noite para atingir uma taxa de resfriamento de -1 ° C / min e, em seguida, transfira os frascos para nitrogênio líquido para armazenamento a longo prazo.
4. Descongelamento
- Aquecer o meio de cultura num banho-maria a 37 °C e encher previamente 10 ml de meio de cultura pré-aquecido num tubo de 15 ml.
- Descongele rapidamente os frascos criogênicos retirados diretamente do armazenamento de nitrogênio líquido usando um sistema de descongelamento automatizado.
- Goteje 0,5-1 mL de meio de cultura pré-aquecido no frasco criogênico para garantir que as células congeladas se adaptem gradualmente ao novo ambiente. Em seguida, transfira 1,5-2 mL da suspensão celular para 10 mL do meio de cultura em um tubo de 15 mL e centrifugue as células a 250 × g por 3 min em temperatura ambiente.
- Descarte o sobrenadante despejando rapidamente após a centrifugação, ressuspenda o pellet em 2 mL de meio de cultura pré-aquecido e conte o número de células usando um hemocitômetro para determinar as taxas de recuperação e sobrevivência usando a exclusão padrão de azul de tripano (0,4% de coloração azul de tripano).
- Cultivar as células em superfícies revestidas com matriz da membrana basal a uma densidade de 105 células viáveis / cm2 em um meio de cultura suplementado com Y-27632 (concentração final: 10 μM). Remova o Y-27632 após 24 h.
- Para determinar a taxa de fixação, dissocie as células novamente e conte o número de células 24 h após o descongelamento.
5. Validação da fase de congelação ideal
- Para validar a fase de congelamento ideal determinada na etapa 2.4, descongele as células RPE congeladas em diferentes pontos de tempo e cultura por 28 dias. Colher as células para qPCR e análise de imunocoloração para avaliar a expressão de marcadores de EPR, conforme descrito anteriormente17.
Resultados
Aqui, células RPE derivadas de hESC em P1D35 foram passadas e semeadas a uma densidade de 105 / cm2. Dentro de uma semana após a semeadura, a morfologia hexagonal característica e a pigmentação foram perdidas durante a fase de latência (aproximadamente 2 dias). As células RPE gradualmente readotaram a morfologia hexagonal na fase exponencial (aproximadamente 5 dias, Figura 1A) e entraram na fase de desaceleração (aproximadamente 6 dias) com uma morfologia mais poligonal. Se a cultura celular continuasse por mais uma semana, a proliferação celular diminuía significativamente e as junções célula-célula desempenhavam um papel primário, com as bordas iluminadas; neste momento, as células não estavam mais na fase exponencial (Figura 1A, P2D11). Além da morfologia celular, o ensaio de proliferação celular EdU foi realizado para ajudar a determinar a fase. A Figura 1B demonstra que as células P2D5 exibiram uma taxa de proliferação mais alta (fase exponencial), enquanto as células P2D11 entraram na fase de desaceleração.
Após congelamento em nitrogênio líquido por 1-3 meses, as células RPE foram descongeladas. Após o descongelamento, algumas células se degradaram em detritos subcelulares, algumas células sofreram apoptose e as células restantes sobreviveram. Após 24 h, as células RPE congeladas em P2D5 exibiram uma taxa de fixação mais alta do que aquelas congeladas em outros momentos (Figura 2A). Além disso, eles exibiram a morfologia hexagonal característica de células RPE maduras com aderências célula-célula distintas (junções apertadas) já 14 dias após o descongelamento. Em contraste, as células congeladas em outros momentos geralmente adotaram um fenótipo fibroblástico (Figura 2A), indicando que estavam passando por um período relativamente mais longo de transição EMT. Vinte e oito dias após o descongelamento, o EPR congelado em P2D5 apresentou marcadores celulares de EPR mais expressos e mais adequadamente localizados, conforme mostrado por qPCR (Figura 2B) e coloração por imunofluorescência (Figura 2C,D).
Para testar a estabilidade deste protocolo em diferentes meios de criopreservação, foi comparado o desempenho de dois meios de criopreservação aplicados no protocolo. O resultado mostrou que os dois meios de criopreservação tiveram um desempenho igualmente bom na obtenção de alta viabilidade celular e fixação pós-descongelamento (Figura 3).

Figura 1: Imagens representativas de células RPE prontas para congelar. (A) As células RPE em P2D5 exibiram menos morfologia hexagonal e pigmentação do que as de P2D11. (B) As células RPE em P2D5 exibiram uma taxa de proliferação mais alta do que as de P2D11, conforme revelado pelo ensaio EdU. Barras de escala = 100 μm. Abreviaturas: EPR = epitélio pigmentar da retina; BF = campo claro; EdU = 5-etinil-2'-desoxiuridina. Clique aqui para ver uma versão maior desta figura.
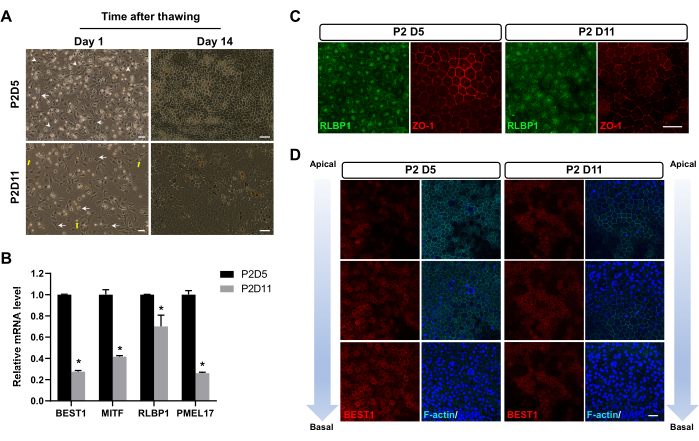
Figura 2: Imagens representativas de células RPE após o descongelamento. (A) As células RPE congeladas em P2D5 exibiram melhor fixação 24 h após o descongelamento (coluna esquerda) e exibiram morfologia hexagonal mais cedo - 14 dias após o descongelamento (coluna direita). Destacam-se células RPE características com morfologia compactada (pontas de setas) no grupo P2D5, morfologia insatisfatória semelhante a fibroblastos (setas) no grupo P2D11 e debris celulares (setas amarelas). (BD) Essas imagens são modificadas de Zhang et al17. (B, C) As células RPE congeladas em P2D5 exibiram níveis mais altos de expressão de mRNA e proteína de genes marcadores típicos de RPE 28 dias após o descongelamento. As diferenças estatísticas são avaliadas com ANOVA de duas vias com teste post hoc de Bonferroni. *P < 0,05. (D) A análise de imunocoloração ao longo do eixo apical-basal 28 dias após o descongelamento mostrou melhor polaridade das células RPE congeladas em P2D5. Os núcleos foram contracorados com DAPI. Barras de escala = 50 μm (A), 25 μm (C,D). Abreviaturas: EPR = epitélio pigmentar da retina; DAPI = 4',6-diamidino-2-fenilindo. Clique aqui para ver uma versão maior desta figura.

Figura 3: Desempenho de dois meios de criopreservação aplicados no protocolo. (A) A taxa de viabilidade celular foi medida após o descongelamento de células RPE derivadas de hESC congeladas em P2D5. (B) As imagens de campo claro de células RPE descongelando de dois meios de congelamento diferentes (# 1 e # 2) 24 h após o descongelamento. Barra de escala = 100 μm. Abreviaturas: EPR = epitélio pigmentar da retina; hESC = célula estaminais embrionárias humanas. Clique aqui para ver uma versão maior desta figura.
Discussão
No presente estudo, é descrito um protocolo de congelamento e descongelamento bem-sucedido para células RPE derivadas de hESC para pesquisa e necessidades clínicas. Ao contrário da linhagem celular RPE imortalizada, ARPE-19, as células RPE com fenótipo epitelial e função característicos adequados, como as células RPE derivadas de células-tronco, são mais sensíveis à criopreservação. Menos de 32% das células permaneceram 24 h após o descongelamento, se não forem adequadamente preservadas17. O tempo de criopreservação é um parâmetro crítico. Uma visão estabelecida para a criopreservação de células imortalizadas é congelar as células na fase de crescimento exponencial. As células diferenciadas saem do ciclo celular. Portanto, o efeito da fase de crescimento para criopreservação raramente foi considerado para células diferenciadas. Demonstramos que as células RPE diferenciadas por hESC recuperaram a capacidade de proliferar por um curto período de tempo e entraram em um estágio exponencial após a passagem. Melhores resultados podem ser alcançados pela criopreservação de células RPE durante a fase exponencial17.
A limitação deste protocolo é que apenas dois tipos de meios de criopreservação foram testados. Diferentes meios de criopreservação podem prevenir a criolesão de diferentes maneiras23; portanto, os meios de criopreservação podem afetar o estágio ideal da criopreservação de células RPE. Se os meios de criopreservação afetam o tempo ideal de congelamento, deve ser avaliado mais detalhadamente.
O protocolo de criopreservação apresentado neste estudo pode ser facilmente adaptado para uso em diferentes laboratórios, determinando a fase exponencial das células RPE antes de congelá-las, tornando-o mais independente de períodos específicos de cultura, métodos de diferenciação ou linhagens celulares. Além de avaliar a morfologia celular, o ensaio EdU fornece uma avaliação direta para garantir que as células sejam preservadas na fase exponencial.
O protocolo atual é um método simples e eficiente para criopreservar células RPE. Essa estratégia pode ser aplicada para criopreservar outros tipos de células diferenciadas.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este trabalho foi financiado pela Fundação Nacional de Ciências Naturais da China (81970816) para Mei Jiang; a Fundação Nacional de Ciências Naturais da China (82201223) para Xinyue Zhu; e o Plano de Ação de Inovação em Ciência e Tecnologia da Comissão de Ciência e Tecnologia de Xangai (2014090067000) para Haiyun Liu.
Materiais
| Name | Company | Catalog Number | Comments |
| 40 μm Cell strainer | Corning | 431750 | |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 488 Dye | Thermo Fisher Scientific | C10337 | |
| Cryo freezing container | Nalgene | 5100-0001 | |
| CryoStor CS10 | Biolife Solutions | 07930 | cryopreservation medium #1 |
| DPBS, no calcium, no magnesium | Thermo Fisher Scientific | 14190144 | |
| Genxin | Selcell | YB050050 | cryopreservation medium #2 |
| Human embryonic stem cells | provided by Wicell, USA | H9 cell line | |
| Matrigel, hESC-Qualified Matrix | Corning | 354277 | basement membrane matrix |
| ThawSTAR CFT2 Automated Cell Thawing System | BioLife Solutions | AST-601 | |
| Trypan Blue solution 0.4% | Sigma | T8154 | |
| TryPLE Select | Thermo Fisher Scientific | 12563029 | cell dissociation reagent |
| XVIVO-10 medium | Lonza | BEBP04-743Q | RPE culture medium |
| Y-27632 | Selleck | S1049 |
Referências
- Lakkaraju, A., et al. The cell biology of the retinal pigment epithelium. Progress in Retinal and Eye Research. 78, 100846(2020).
- Mcbain, V. A., Townend, J., Lois, N. Progression of retinal pigment epithelial atrophy in stargardt disease. American Journal of Ophthamology. 154 (1), 146-154 (2012).
- George, S. M., Lu, F., Rao, M., Leach, L. L., Gross, J. M. The retinal pigment epithelium: Development, injury responses, and regenerative potential in mammalian and non-mammalian systems. Progress in Retinal and Eye Research. 85, 100969(2021).
- Rizzolo, L. J., Nasonkin, I. O., Adelman, R. A. Retinal cell transplantation, biomaterials, and in vitro models for developing next-generation therapies of age-related macular degeneration. Stem Cells Translational Medicine. 11 (3), 269-281 (2022).
- Bertolotti, E., Neri, A., Camparini, M., Macaluso, C., Marigo, V. Stem cells as source for retinal pigment epithelium transplantation. Progress in Retinal and Eye Research. 42, 130-144 (2014).
- Da Cruz,, L,, et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Mehat, M. S., et al. Transplantation of human embryonic stem cell-derived retinal pigment epithelial cells in macular degeneration. Ophthalmology. 125 (11), 1765-1775 (2018).
- Buchholz, D. E., et al. Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium. Stem Cells Translational Medicine. 2 (5), 384-393 (2013).
- Li, Q. -Y., et al. Functional assessment of cryopreserved clinical grade hESC-RPE cells as a qualified cell source for stem cell therapy of retinal degenerative diseases. Experimental Eye Research. 202, 108305(2021).
- Francois, M., et al. Cryopreserved mesenchymal stromal cells display impaired immunosuppressive properties as a result of heat-shock response and impaired interferon-gamma licensing. Cytotherapy. 14 (2), 147-152 (2012).
- Moll, G., et al. Do cryopreserved mesenchymal stromal cells display impaired immunomodulatory and therapeutic properties. Stem Cells. 32 (9), 2430-2442 (2014).
- Ekpo, M. D., et al. Incorporating cryopreservation evaluations into the design of cell-based drug delivery systems: an opinion paper. Frontiers in Immunology. 13, 967731(2022).
- Bailey, T. L., et al. Protective effects of osmolytes in cryopreserving adherent neuroblastoma (Neuro-2a) cells. Cryobiology. 71 (3), 472-480 (2015).
- Okumura, N., et al. Feasibility of a cryopreservation of cultured human corneal endothelial cells. PLoS One. 14 (6), e0218431(2019).
- Pennington, B. O., et al. Xeno-free cryopreservation of adherent retinal pigmented epithelium yields viable and functional cells in vitro and in vivo. Scientific Reports. 11 (1), 6286(2021).
- Woods, E. J., Thirumala, S., Badhe-Buchanan, S. S., Clarke, D., Mathew, A. J. Off the shelf cellular therapeutics: Factors to consider during cryopreservation and storage of human cells for clinical use. Cytotherapy. 18 (6), 697-711 (2016).
- Zhang, T., et al. Determining the optimal stage for cryopreservation of human embryonic stem cell-derived retinal pigment epithelial cells. Stem Cell Research & Therapy. 13 (1), 454(2022).
- Leach, L. L., et al. Induced pluripotent stem cell-derived retinal pigmented epithelium: a comparative study between cell lines and differentiation Methods. Journal of Ocular Pharmacology and Therapeutics. 32 (5), 317-330 (2016).
- Reichman, S., et al. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human iPS cells in Xeno-free and feeder-free conditions. Stem Cells. 35 (5), 1176-1188 (2017).
- Brandl, C., et al. In-depth characterisation of retinal pigment epithelium (RPE) cells derived from human induced pluripotent stem cells (hiPSC). Neuromolecular Medicine. 16 (3), 551-564 (2014).
- Hongisto, H., Ilmarinen, T., Vattulainen, M., Mikhailova, A., Skottman, H. Xeno- and feeder-free differentiation of human pluripotent stem cells to two distinct ocular epithelial cell types using simple modifications of one method. Stem Cell Research & Therapy. 8 (1), 291(2017).
- Foltz, L. P., Clegg, D. O. Rapid, directed differentiation of retinal pigment epithelial cells from human embryonic or induced pluripotent stem cells. Journal of Visualized Experiments: JoVE. (128), 10.3791/56274(2017).
- Marcantonini, G., et al. Natural cryoprotective and cytoprotective agents in cryopreservation: a focus on melatonin. Molecules. 27 (10), 3254(2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados