Method Article
Cryoconservation de cellules épithéliales pigmentaires rétiniennes dérivées de cellules souches embryonnaires humaines au stade optimal
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cette étude fournit un protocole détaillé pour la cryoconservation efficace des cellules épithéliales pigmentaires rétiniennes dérivées de cellules souches humaines.
Résumé
Les cellules épithéliales pigmentaires rétiniennes (EPR) dérivées de cellules souches embryonnaires humaines (CSEh) sont des sources cellulaires supérieures pour la thérapie de remplacement cellulaire chez les personnes atteintes de maladies dégénératives de la rétine. Cependant, les études sur la mise en banque stable et sûre de ces cellules thérapeutiques sont rares. La viabilité cellulaire très variable et la récupération fonctionnelle des cellules EPR après cryoconservation sont les problèmes les plus fréquemment rencontrés. Dans le protocole actuel, nous avons cherché à obtenir le meilleur taux de récupération cellulaire après décongélation en sélectionnant la phase cellulaire optimale pour la congélation en fonction des conditions expérimentales d’origine. Les cellules ont été congelées dans la phase exponentielle déterminée à l’aide du test de marquage de la 5-éthynyl-2'-désoxyuridine, ce qui a amélioré la viabilité cellulaire et le taux de récupération après décongélation. Des cellules stables et fonctionnelles ont été obtenues peu de temps après la décongélation, indépendamment d’un long processus de différenciation. Les méthodes décrites ici permettent la conservation et la décongélation simples, efficaces et peu coûteuses des cellules RPE dérivées d’ESCh. Bien que ce protocole se concentre sur les cellules RPE, cette stratégie de congélation peut être appliquée à de nombreux autres types de cellules différenciées.
Introduction
L’épithélium pigmentaire rétinien (EPR) est une monocouche pigmentée de cellules nécessaires au maintien du bon fonctionnement de la rétine1. Le dysfonctionnement et la mort de l’EPR sont étroitement associés à de nombreuses maladies dégénératives de la rétine, notamment la dégénérescence maculaire liée à l’âge, la rétinite pigmentaire et la maladie de Stargardt 2,3. La thérapie de remplacement de l’EPR est l’un des schémas thérapeutiques les plus prometteurs pour ces maladies 4,5,6,7. Un approvisionnement stable en cellules EPR de donneur est essentiel pour la thérapie cellulaire. Les cellules EPR dérivées de cellules souches embryonnaires humaines (CSEh) sont une source cellulaire idéale pour la thérapie cellulaire car elles imitent la fonction des cellules EPR primaires et peuvent produire un approvisionnement théoriquement illimité8. Cependant, le processus de différenciation est laborieux et la durée de conservation des cellules EPR obtenues est relativement courte en raison de la transition épithélio-mésenchymateuse (EMT) ultérieure. Par conséquent, la cryoconservation des cellules EPR dérivées de CSEh est une étape indispensable nécessaire au stockage à long terme et à la distribution à la demande9.
Les dommages cellulaires induits par la cryoconservation peuvent compromettre par inadvertance l’efficacité thérapeutique10,11. Par conséquent, des études récentes sur la cryoconservation ont suggéré que les conditions optimales de stockage cryogénique devraient être déterminées lors de la conception de thérapies cellulaires12. Une cryoconservation réussie garantit une récupération efficace des cellules, une viabilité élevée et la restauration de la fonction cellulaire après le cycle de congélation-décongélation. Cependant, des études antérieures sur la cryoconservation des monocouches adhérentes de cellules de mammifères ont rapporté des taux de survie très variables (35%-95%) après décongélation 13,14,15. De nombreux facteurs affectent considérablement les résultats de la cryoconservation, en particulier pendant l’étape de congélation16,17. Des recherches récentes ont montré que les cellules EPR congelées à différents moments présentaient une récupération variée après décongélation17. À notre connaissance, il n’existe pas d’études sur la détermination de la fenêtre de temps de congélation optimale pour les cellules EPR dérivées de cellules souches. Dans différentes études, les cellules ont été congelées à différents stades : certaines cellules ont été congelées peu de temps après le passage ou avant la confluence ou la pigmentation 8,15,18, tandis que d’autres ont été congelées à d’autres moments 9,19,20,21. De plus, il n’existe aucune preuve claire indiquant si la phase ou l’étape des cellules EPR utilisées pour la cryoconservation affecte la fonction de l’EPR après la décongélation. Dans notre étude précédente, nous avons démontré pour la première fois que la phase exponentielle de croissance cellulaire (P2D5) est la meilleure étape pour la cryoconservation des cellules EPR dérivées de hESC en termes de viabilité cellulaire et de récupération des propriétés et fonctions cellulaires17.
La méthode établie ici vise à cryoconserver les EPR dérivés de hESC à un stade optimal pour obtenir la meilleure conservation en termes de viabilité cellulaire et de fonction après décongélation. À l’aide du test de marquage à la 5-éthynyl-2'-désoxyuridine (EdU) pour détecter la phase exponentielle de la synthèse de l’ADN avant la cryoconservation, les cellules EPR décongelées ont présenté une viabilité et un taux d’attachement de >80 %, une expression génique spécifique de l’EPR, une morphologie cellulaire polarisée, une sécrétion de facteurs dérivés de l’épithélium pigmentaire, une résistance transépithéliale appropriée et une capacité phagocytaire 8,17,22. Bien que ce protocole se concentre sur les cellules RPE dérivées de hESC et que toutes les cellules thérapeutiques ne soient pas cryopréservées de la même manière, la stratégie de congélation en phase exponentielle peut être appliquée à de nombreuses autres cellules thérapeutiques.
Protocole
1. Dissociation cellulaire
- Maintenir les cellules EPR comme décrit précédemment 17,22.
REMARQUE : Toutes les cellules sont cultivées à 37 °C dans une atmosphère à 5 % de CO2 pendant toute la durée des protocoles. - Préparez la quantité requise de PBS et de milieu de culture dans un bain-marie à 37°C et placez le réactif de dissociation cellulaire à température ambiante.
- Jeter la solution de culture et laver les plaques deux fois avec 1 mL de PBS préchauffé par puits.
- Ajouter 1 mL de réactif de dissociation cellulaire dans les plaques à 6 puits et digérer les cellules à 37 °C pendant 15 min. Après l’incubation, observez au microscope les cellules qui rétrécissent et brillent sur les bords pour confirmer la fin de la digestion.
REMARQUE : La dissociation à base de trypsine n’est pas recommandée car elle donne une faible viabilité cellulaire. - Pipeter doucement de haut en bas 10x avec une pipette de 1 mL pour dissocier les cellules, et diluer la suspension cellulaire avec un milieu de culture préchauffé (sans Y-27632) dans un rapport de 1:10. Ensuite, centrifugez les cellules à température ambiante pendant 3 min à 250 × g.
- Versez rapidement le surnageant après la centrifugation, remettez doucement en suspension la pastille cellulaire dans 2 mL de milieu de culture et remettez les cellules en suspension 10 à 15 fois à l’aide d’une pipette.
- Filtrez la suspension cellulaire à l’aide d’une crépine de 40 μm pour obtenir une suspension unicellulaire et calculez le nombre de cellules.
REMARQUE : Une suspension à cellule unique est essentielle pour un comptage précis des cellules et une densité d’ensemencement uniforme après décongélation.
2. Détermination de l’étape cellulaire optimale pour la cryoconservation
REMARQUE : Étant donné que l’état cellulaire varie entre les méthodes de différenciation et les lignées cellulaires, la phase exponentielle des cellules EPR cultivées dans différents laboratoires doit être déterminée avant la congélation.
- Décongeler un flacon de solution matricielle de membrane basale sur de la glace à 4 °C pendant la nuit. Diluer la matrice dans 12 mL de DMEM/F-12 froid et bien mélanger. Ajouter une lamelle par puits et enduire chaque puits d’une plaque de 24 puits avec 0,25 mL de solution diluée. Incuber la plaque pendant 1 h à température ambiante ou une nuit à 4 °C avant utilisation et aspirer la solution d’enrobage juste avant de plaquer les cellules.
REMARQUE : Les instructions pour le volume aliquote sont spécifiques au lot en fonction de la concentration en protéines et se trouvent dans la fiche technique du produit. - Ensemencer les cellules individuelles EPR de l’étape 1.7 sur les lamelles recouvertes d’une matrice de membrane basale à une densité de 105/cm2 dans 1 mL de milieu de culture. Rafraîchissez le milieu de culture tous les 2-3 jours.
- Aux points temporels indiqués (1, 3, 5, 7 et 11 jours après le passage), incuber des cellules EPR avec 10 μM d’EdU dans le milieu pendant 24 h. Fixez, perméabilisez et colorez les cellules avec le cocktail réactionnel comme décrit dans le manuel pour détecter l’EdU incorporé.
- Capturez des images de cinq champs aléatoires à l’aide d’un microscope à fluorescence et calculez le pourcentage de cellules EdU positives. Tracez les courbes proportionnelles-temps positives EdU correspondantes pour générer une courbe de croissance. Ensuite, déterminez la fenêtre de congélation ou la phase exponentielle pour chaque lignée cellulaire en fonction de la courbe de croissance.
REMARQUE : La morphologie cellulaire hexagonale rétablie indique que les cellules sortent de la phase exponentielle.
3. Cryoconservation
- En suivant les étapes 1.1 à 1.7, sauf que le temps de digestion diminue à 5 min, centrifuger la suspension cellulaire à température ambiante pendant 3 min à 250 × g.
- Jeter le surnageant en le versant rapidement après la centrifugation et remettre doucement en suspension la pastille cellulaire dans le milieu de cryoconservation à une densité de 2 × 106 cellules/mL et transférer 1 mL de suspension cellulaire dans des flacons cryogéniques de 1,2 mL.
- Placez immédiatement les flacons cryogéniques dans un récipient de congélation, congelez-les à −80 °C pendant la nuit pour atteindre une vitesse de refroidissement de −1 °C/min, puis transférez les flacons dans de l’azote liquide pour un stockage à long terme.
4. Décongélation
- Réchauffez le milieu de culture dans un bain-marie à 37 °C et préremplissez 10 ml de milieu de culture préchauffé dans un tube de 15 ml.
- Décongelez rapidement les flacons cryogéniques directement prélevés du stockage d’azote liquide à l’aide d’un système de décongélation automatisé.
- Verser 0,5 à 1 mL de milieu de culture préchauffé dans le flacon cryogénique pour s’assurer que les cellules congelées s’adaptent progressivement au nouvel environnement. Ensuite, transférez 1,5 à 2 ml de suspension cellulaire dans 10 ml de milieu de culture dans un tube de 15 ml et centrifugez les cellules à 250 × g pendant 3 minutes à température ambiante.
- Jeter le surnageant en le versant rapidement après la centrifugation, remettre la pastille en suspension dans 2 mL de milieu de culture préchauffé et compter le nombre de cellules à l’aide d’un hémocytomètre pour déterminer les taux de récupération et de survie à l’aide de l’exclusion standard du bleu de trypan (0,4 % de coloration au bleu de trypan).
- Cultiver les cellules sur des surfaces recouvertes d’une matrice de membrane basale à une densité de 10à 5 cellules viables/cm2 dans un milieu de culture complété par de l’Y-27632 (concentration finale : 10 μM). Retirez Y-27632 après 24 h.
- Pour déterminer le taux d’attachement, dissociez à nouveau les cellules et comptez le nombre de cellules 24 h après la décongélation.
5. Validation de la phase de congélation optimale
- Pour valider la phase de congélation optimale déterminée à l’étape 2.4, décongeler les cellules EPR congelées à différents moments et les cultiver pendant 28 jours. Récoltez les cellules pour l’analyse qPCR et l’immunocoloration afin d’évaluer l’expression des marqueurs RPE, comme décrit précédemment17.
Résultats
Ici, les cellules EPR dérivées de CSEh à P1D35 ont été passées et ensemencées à une densité de 105/cm2. Dans la semaine qui a suivi l’ensemencement, la morphologie hexagonale et la pigmentation caractéristiques ont été perdues pendant la phase de latence (environ 2 jours). Les cellules de l’EPR ont progressivement réadopté la morphologie hexagonale dans la phase exponentielle (environ 5 jours, Figure 1A) et sont entrées dans la phase de décélération (environ 6 jours) avec une morphologie plus polygonale. Si la culture cellulaire se poursuivait pendant une semaine supplémentaire, la prolifération cellulaire diminuait considérablement et les jonctions cellule-cellule jouaient un rôle primordial, les bords étant éclairés ; à ce moment-là, les cellules n’étaient plus en phase exponentielle (Figure 1A, P2D11). En plus de la morphologie cellulaire, le test de prolifération cellulaire EdU a été réalisé pour aider à déterminer la phase. La figure 1B montre que les cellules P2D5 présentaient un taux de prolifération plus élevé (phase exponentielle), alors que les cellules P2D11 étaient entrées dans la phase de décélération.
Après avoir été congelées dans de l’azote liquide pendant 1 à 3 mois, les cellules EPR ont été décongelées. Lors de la décongélation, certaines cellules se sont dégradées en débris subcellulaires, certaines cellules ont subi une apoptose et les cellules restantes ont survécu. Après 24 h, les cellules EPR congelées à P2D5 présentaient un taux d’attachement plus élevé que celles congelées à d’autres points temporels (Figure 2A). De plus, ils ont présenté la morphologie hexagonale caractéristique des cellules EPR matures avec des adhérences cellule-cellule distinctes (jonctions serrées) dès 14 jours après la décongélation. En revanche, les cellules congelées à d’autres moments ont généralement adopté un phénotype fibroblastique (Figure 2A), indiquant qu’elles subissaient une période de transition EMT relativement plus longue. Vingt-huit jours après la décongélation, l’EPR congelé à P2D5 a montré des marqueurs cellulaires EPR plus exprimés et plus correctement localisés, comme le montrent la qPCR (Figure 2B) et la coloration par immunofluorescence (Figure 2C,D).
Pour tester la stabilité de ce protocole dans différents milieux de cryoconservation, les performances de deux milieux de cryoconservation appliqués dans le protocole ont été comparées. Le résultat a montré que les deux milieux de cryoconservation ont obtenu des résultats aussi bons pour atteindre une viabilité cellulaire et une fixation élevées après décongélation (Figure 3).

Figure 1 : Images représentatives de cellules EPR prêtes à congeler. (A) Les cellules EPR à P2D5 présentaient moins de morphologie hexagonale et de pigmentation que celles à P2D11. (B) Les cellules EPR à P2D5 présentaient un taux de prolifération plus élevé que celles à P2D11, comme l’a révélé le test EdU. Barres d’échelle = 100 μm. Abréviations : EPR = épithélium pigmentaire rétinien ; BF = fond clair ; EdU = 5-éthynyl-2'-désoxyuridine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
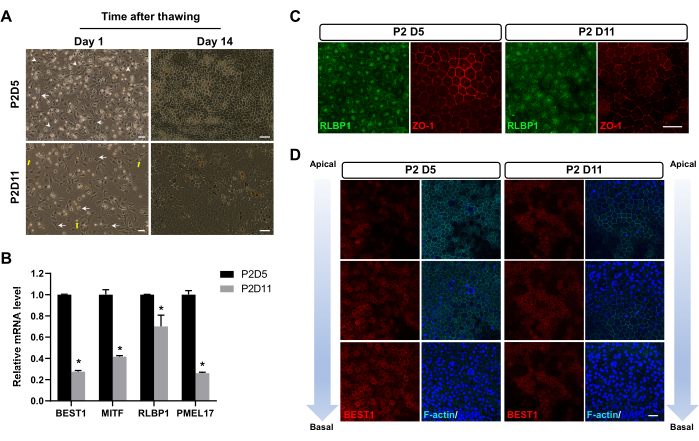
Figure 2 : Images représentatives des cellules EPR après décongélation. (A) Les cellules EPR congelées à P2D5 présentaient une meilleure fixation 24 h après la décongélation (colonne de gauche) et présentaient une morphologie hexagonale plus tôt, soit 14 jours après la décongélation (colonne de droite). Les cellules EPR caractéristiques avec une morphologie compacte (pointes de flèches) dans le groupe P2D5, une morphologie insatisfaisante de type fibroblaste (flèches) dans le groupe P2D11 et des débris cellulaires (flèches jaunes) sont mis en évidence. (B-D) Ces images sont modifiées de Zhang et al17. (B, C) Les cellules EPR congelées à P2D5 présentaient des niveaux d’expression d’ARNm et de protéines plus élevés que les gènes marqueurs RPE typiques 28 jours après la décongélation. Les différences statistiques sont évaluées par ANOVA à deux facteurs avec le test post hoc de Bonferroni. *P < 0,05. (D) L’analyse de l’immunocoloration le long de l’axe apical-basal 28 jours après la décongélation a montré une meilleure polarité des cellules EPR figées à P2D5. Les noyaux ont été contre-colorés avec du DAPI. Barres d’échelle = 50 μm (A), 25 μm (C,D). Abréviations : EPR = épithélium pigmentaire rétinien ; DAPI = 4',6-diamidino-2-phénylindole. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Performance de deux milieux de cryoconservation appliqués dans le protocole. (A) Le taux de viabilité cellulaire a été mesuré lors de la décongélation de cellules EPR dérivées de CSEh congelées à P2D5. (B) Les images en fond clair des cellules EPR dégelant de deux milieux de congélation différents (#1 et #2) 24 h après le dégel. Barre d’échelle = 100 μm. Abréviations : EPR = épithélium pigmentaire rétinien ; hESC = cellule souche embryonnaire humaine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Dans la présente étude, un protocole de congélation-décongélation efficace pour les cellules EPR dérivées de CSEh pour la recherche et les besoins cliniques est décrit. Contrairement à la lignée cellulaire APR immortalisée, ARPE-19, les cellules EPR avec un phénotype et une fonction épithéliales caractéristiques appropriés, comme les cellules EPR dérivées de cellules souches, sont plus sensibles à la cryoconservation. Moins de 32 % des cellules sont restées à 24 h après la décongélation si elles n’ont pas été correctement conservées17. Le moment de la cryoconservation est un paramètre critique. Une vision établie de la cryoconservation des cellules immortalisées est de congeler les cellules en phase de croissance exponentielle. Les cellules différenciées sortent du cycle cellulaire. Par conséquent, l’effet de la phase de croissance pour la cryoconservation a rarement été pris en compte pour les cellules différenciées. Nous avons démontré que les cellules EPR différenciées par CSEh ont retrouvé la capacité de proliférer pendant une courte période et sont entrées dans une phase exponentielle après le passage. De meilleurs résultats peuvent être obtenus en cryopréservant les cellules EPR au cours de la phase exponentielle17.
La limite de ce protocole est que seuls deux types de milieux de cryoconservation ont été testés. Différents milieux de cryoconservation peuvent prévenir les cryolésions de différentes manières23 ; par conséquent, les milieux de cryoconservation peuvent affecter l’étape optimale de la cryoconservation des cellules EPR. Il convient d’évaluer plus en détail si les milieux de cryoconservation affectent le temps de congélation optimal.
Le protocole de cryoconservation présenté dans cette étude peut facilement être adapté pour être utilisé dans différents laboratoires en déterminant la phase exponentielle des cellules EPR avant de les congeler, ce qui le rend plus indépendant des périodes de culture, des méthodes de différenciation ou des lignées cellulaires spécifiques. En plus d’évaluer la morphologie cellulaire, le test EdU fournit une évaluation simple pour s’assurer que les cellules sont préservées dans la phase exponentielle.
Le protocole actuel est une méthode simple et efficace pour cryoconserver les cellules EPR. Cette stratégie peut être appliquée à la cryoconservation d’autres types de cellules différenciées.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été financé par la Fondation nationale des sciences naturelles de Chine (81970816) à Mei Jiang ; la Fondation nationale des sciences naturelles de Chine (82201223) à Xinyue Zhu ; et le Plan d’action pour l’innovation scientifique et technologique de la Commission de Shanghai pour la science et la technologie (2014090067000) à Haiyun Liu.
matériels
| Name | Company | Catalog Number | Comments |
| 40 μm Cell strainer | Corning | 431750 | |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 488 Dye | Thermo Fisher Scientific | C10337 | |
| Cryo freezing container | Nalgene | 5100-0001 | |
| CryoStor CS10 | Biolife Solutions | 07930 | cryopreservation medium #1 |
| DPBS, no calcium, no magnesium | Thermo Fisher Scientific | 14190144 | |
| Genxin | Selcell | YB050050 | cryopreservation medium #2 |
| Human embryonic stem cells | provided by Wicell, USA | H9 cell line | |
| Matrigel, hESC-Qualified Matrix | Corning | 354277 | basement membrane matrix |
| ThawSTAR CFT2 Automated Cell Thawing System | BioLife Solutions | AST-601 | |
| Trypan Blue solution 0.4% | Sigma | T8154 | |
| TryPLE Select | Thermo Fisher Scientific | 12563029 | cell dissociation reagent |
| XVIVO-10 medium | Lonza | BEBP04-743Q | RPE culture medium |
| Y-27632 | Selleck | S1049 |
Références
- Lakkaraju, A., et al. The cell biology of the retinal pigment epithelium. Progress in Retinal and Eye Research. 78, 100846(2020).
- Mcbain, V. A., Townend, J., Lois, N. Progression of retinal pigment epithelial atrophy in stargardt disease. American Journal of Ophthamology. 154 (1), 146-154 (2012).
- George, S. M., Lu, F., Rao, M., Leach, L. L., Gross, J. M. The retinal pigment epithelium: Development, injury responses, and regenerative potential in mammalian and non-mammalian systems. Progress in Retinal and Eye Research. 85, 100969(2021).
- Rizzolo, L. J., Nasonkin, I. O., Adelman, R. A. Retinal cell transplantation, biomaterials, and in vitro models for developing next-generation therapies of age-related macular degeneration. Stem Cells Translational Medicine. 11 (3), 269-281 (2022).
- Bertolotti, E., Neri, A., Camparini, M., Macaluso, C., Marigo, V. Stem cells as source for retinal pigment epithelium transplantation. Progress in Retinal and Eye Research. 42, 130-144 (2014).
- Da Cruz,, L,, et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Mehat, M. S., et al. Transplantation of human embryonic stem cell-derived retinal pigment epithelial cells in macular degeneration. Ophthalmology. 125 (11), 1765-1775 (2018).
- Buchholz, D. E., et al. Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium. Stem Cells Translational Medicine. 2 (5), 384-393 (2013).
- Li, Q. -Y., et al. Functional assessment of cryopreserved clinical grade hESC-RPE cells as a qualified cell source for stem cell therapy of retinal degenerative diseases. Experimental Eye Research. 202, 108305(2021).
- Francois, M., et al. Cryopreserved mesenchymal stromal cells display impaired immunosuppressive properties as a result of heat-shock response and impaired interferon-gamma licensing. Cytotherapy. 14 (2), 147-152 (2012).
- Moll, G., et al. Do cryopreserved mesenchymal stromal cells display impaired immunomodulatory and therapeutic properties. Stem Cells. 32 (9), 2430-2442 (2014).
- Ekpo, M. D., et al. Incorporating cryopreservation evaluations into the design of cell-based drug delivery systems: an opinion paper. Frontiers in Immunology. 13, 967731(2022).
- Bailey, T. L., et al. Protective effects of osmolytes in cryopreserving adherent neuroblastoma (Neuro-2a) cells. Cryobiology. 71 (3), 472-480 (2015).
- Okumura, N., et al. Feasibility of a cryopreservation of cultured human corneal endothelial cells. PLoS One. 14 (6), e0218431(2019).
- Pennington, B. O., et al. Xeno-free cryopreservation of adherent retinal pigmented epithelium yields viable and functional cells in vitro and in vivo. Scientific Reports. 11 (1), 6286(2021).
- Woods, E. J., Thirumala, S., Badhe-Buchanan, S. S., Clarke, D., Mathew, A. J. Off the shelf cellular therapeutics: Factors to consider during cryopreservation and storage of human cells for clinical use. Cytotherapy. 18 (6), 697-711 (2016).
- Zhang, T., et al. Determining the optimal stage for cryopreservation of human embryonic stem cell-derived retinal pigment epithelial cells. Stem Cell Research & Therapy. 13 (1), 454(2022).
- Leach, L. L., et al. Induced pluripotent stem cell-derived retinal pigmented epithelium: a comparative study between cell lines and differentiation Methods. Journal of Ocular Pharmacology and Therapeutics. 32 (5), 317-330 (2016).
- Reichman, S., et al. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human iPS cells in Xeno-free and feeder-free conditions. Stem Cells. 35 (5), 1176-1188 (2017).
- Brandl, C., et al. In-depth characterisation of retinal pigment epithelium (RPE) cells derived from human induced pluripotent stem cells (hiPSC). Neuromolecular Medicine. 16 (3), 551-564 (2014).
- Hongisto, H., Ilmarinen, T., Vattulainen, M., Mikhailova, A., Skottman, H. Xeno- and feeder-free differentiation of human pluripotent stem cells to two distinct ocular epithelial cell types using simple modifications of one method. Stem Cell Research & Therapy. 8 (1), 291(2017).
- Foltz, L. P., Clegg, D. O. Rapid, directed differentiation of retinal pigment epithelial cells from human embryonic or induced pluripotent stem cells. Journal of Visualized Experiments: JoVE. (128), 10.3791/56274(2017).
- Marcantonini, G., et al. Natural cryoprotective and cytoprotective agents in cryopreservation: a focus on melatonin. Molecules. 27 (10), 3254(2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon