Method Article
Kryokonservierung von aus humanen embryonalen Stammzellen gewonnenen retinalen Pigmentepithelzellen im optimalen Stadium
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Diese Studie liefert ein detailliertes Protokoll für die effiziente Kryokonservierung von aus menschlichen Stammzellen gewonnenen retinalen Pigmentepithelzellen.
Zusammenfassung
Retinale Pigmentepithelzellen (RPE), die aus humanen embryonalen Stammzellen (hESCs) gewonnen werden, sind überlegene Zellquellen für die Zellersatztherapie bei Personen mit degenerativen Netzhauterkrankungen. Studien über die stabile und sichere Lagerung dieser therapeutischen Zellen gibt es jedoch kaum. Die hochvariable Zellviabilität und die funktionelle Wiederherstellung von RPE-Zellen nach der Kryokonservierung sind die am häufigsten auftretenden Probleme. Im vorliegenden Protokoll haben wir versucht, die beste Zellwiederherstellungsrate nach dem Auftauen zu erreichen, indem wir die optimale Zellphase für das Einfrieren auf der Grundlage der ursprünglichen experimentellen Bedingungen ausgewählt haben. Die Zellen wurden in der exponentiellen Phase eingefroren, die mit dem 5-Ethinyl-2′-Desoxyuridin-Markierungsassay bestimmt wurde, was die Lebensfähigkeit der Zellen und die Wiederfindungsrate nach dem Auftauen verbesserte. Kurz nach dem Auftauen wurden stabile und funktionsfähige Zellen erhalten, unabhängig von einem langen Differenzierungsprozess. Die hier beschriebenen Methoden ermöglichen die einfache, effiziente und kostengünstige Konservierung und das Auftauen von hESC-abgeleiteten RPE-Zellen. Obwohl sich dieses Protokoll auf RPE-Zellen konzentriert, kann diese Einfrierstrategie auf viele andere Arten von differenzierten Zellen angewendet werden.
Einleitung
Das retinale Pigmentepithel (RPE) ist eine pigmentierte Monoschicht von Zellen, die für die Aufrechterhaltung der ordnungsgemäßen Funktion der Netzhaut erforderlich ist1. RPE-Dysfunktion und Tod sind eng mit vielen degenerativen Erkrankungen der Netzhaut verbunden, darunter altersbedingte Makuladegeneration, Retinitis pigmentosa und Morbus Stargardt 2,3. Die RPE-Ersatztherapie ist eines der vielversprechendsten Behandlungsschemata für diese Erkrankungen 4,5,6,7. Eine stabile Versorgung mit RPE-Spenderzellen ist für die Zelltherapie unerlässlich. Aus humanen embryonalen Stammzellen (hESC) gewonnene RPE-Zellen sind eine ideale Zellquelle für die Zelltherapie, da sie die Funktion primärer RPE-Zellen nachahmen und einen theoretisch unbegrenzten Vorrat produzieren können8. Der Differenzierungsprozess ist jedoch mühsam und die Haltbarkeit der gewonnenen RPE-Zellen ist aufgrund der anschließenden epithelial-mesenchymalen Transition (EMT) relativ kurz. Daher ist die Kryokonservierung von hESC-abgeleiteten RPE-Zellen ein unverzichtbarer Schritt, der für die Langzeitlagerung und die bedarfsgerechte Verteilung erforderlichist 9.
Durch Kryokonservierung induzierte zelluläre Schäden können die therapeutische Wirksamkeit ungewollt beeinträchtigen 10,11. Neuere Studien zur Kryokonservierung haben daher vorgeschlagen, dass bei der Entwicklung von Zelltherapien optimale kryogene Lagerbedingungen bestimmt werden sollten12. Eine erfolgreiche Kryokonservierung garantiert eine effiziente Zellrückgewinnung, eine hohe Lebensfähigkeit und die Wiederherstellung der Zellfunktion nach dem Frost-Auftau-Zyklus. Frühere Studien zur Kryokonservierung der adhärenten Monoschichten von Säugetierzellen haben jedoch sehr unterschiedliche (35%-95%) Überlebensraten nach dem Auftauen berichtet 13,14,15. Viele Faktoren beeinflussen die Ergebnisse der Kryokonservierung erheblich, insbesondere während der Gefrierphase16,17. Neuere Forschungen zeigten, dass RPE-Zellen, die zu verschiedenen Zeitpunkten eingefroren wurden, nach dem Auftauen eine unterschiedliche Erholungzeigten 17. Nach bestem Wissen und Gewissen fehlen Studien zur Bestimmung des optimalen Gefrierzeitfensters für stammzellgewonnene RPE-Zellen. In verschiedenen Studien wurden die Zellen in verschiedenen Stadien eingefroren: Einige Zellen wurden kurz nach der Passage oder vor der Konfluenz oder Pigmentierungeingefroren 8,15,18, während andere zu anderen Zeitpunkteneingefroren wurden 9,19,20,21. Darüber hinaus gibt es keine eindeutigen Hinweise darauf, ob die Phase oder das Stadium von RPE-Zellen, die für die Kryokonservierung verwendet werden, die RPE-Funktion nach dem Auftauen beeinflusst. In unserer vorherigen Studie haben wir zum ersten Mal gezeigt, dass die exponentielle Phase des Zellwachstums (P2D5) das beste Stadium für die Kryokonservierung von hESC-abgeleiteten RPE-Zellen im Hinblick auf die Zellviabilität und die Wiederherstellung zellulärer Eigenschaften und Funktionen ist17.
Die hier etablierte Methode zielt darauf ab, hESC-abgeleitetes RPE in einem optimalen Stadium zu kryokonservieren, um die beste Konservierung in Bezug auf die Lebensfähigkeit und Funktion der Zellen nach dem Auftauen zu erreichen. Unter Verwendung des 5-Ethinyl-2'-Desoxyuridins (EdU)-Markierungsassays zum Nachweis der exponentiellen Phase der DNA-Synthese vor der Kryokonservierung zeigten aufgetaute RPE-Zellen eine >80%ige Lebensfähigkeit und Anheftungsrate, eine RPE-spezifische Genexpression, eine polarisierte Zellmorphologie, eine Sekretion von Pigmentepithelfaktoren, eine angemessene transepitheliale Resistenz und phagozytische Fähigkeit 8,17,22. Obwohl sich dieses Protokoll auf hESC-abgeleitete RPE-Zellen konzentriert und nicht alle therapeutischen Zellen gleichermaßen kryokonserviert sind, kann die Strategie des Einfrierens in der exponentiellen Phase auf viele andere therapeutische Zellen angewendet werden.
Protokoll
1. Dissoziation der Zellen
- Pflegen Sie die RPE-Zellen wie zuvor beschrieben17,22.
HINWEIS: Alle Zellen werden während der gesamten Dauer der Protokolle bei 37 °C in einer 5 % CO2 -Atmosphäre gezüchtet. - Bereiten Sie die erforderliche Menge PBS und Kulturmedium in einem 37 ° C warmen Wasserbad vor und stellen Sie das Zelldissoziationsreagenz auf Raumtemperatur.
- Entsorgen Sie die Kulturlösung und waschen Sie die Platten zweimal mit 1 ml vorgewärmtem PBS pro Vertiefung.
- Geben Sie 1 ml des Zelldissoziationsreagenzes in die 6-Well-Platten und verdauen Sie die Zellen 15 Minuten lang bei 37 °C. Beobachten Sie nach der Inkubation die Zellen, die schrumpfen und an den Rändern glänzen, unter einem Mikroskop, um die Beendigung der Verdauung zu bestätigen.
HINWEIS: Eine Dissoziation auf Trypsinbasis wird nicht empfohlen, da sie eine geringe Zellviabilität aufweist. - Pipettieren Sie vorsichtig 10x mit einer 1-ml-Pipette auf und ab, um die Zellen zu dissoziieren, und verdünnen Sie die Zellsuspension mit vorgewärmtem Kulturmedium (ohne Y-27632) im Verhältnis 1:10. Dann zentrifugieren Sie die Zellen bei Raumtemperatur für 3 min bei 250 × g.
- Gießen Sie den Überstand nach der Zentrifugation schnell aus, resuspendieren Sie das Zellpellet vorsichtig in 2 mL des Kulturmediums und resuspendieren Sie die Zellen 10-15x mit einer Pipette.
- Filtern Sie die Zellsuspension mit einem 40 μm Zellsieb, um eine Einzelzellsuspension zu erhalten, und berechnen Sie die Anzahl der Zellen.
HINWEIS: Eine einzelzellige Suspension ist für eine genaue Zellzählung und eine gleichmäßige Zellaussaatdichte nach dem Auftauen unerlässlich.
2. Bestimmung des optimalen Zellstadiums für die Kryokonservierung
HINWEIS: Da der Zellzustand zwischen Differenzierungsmethoden und Zelllinien variiert, sollte die exponentielle Phase von RPE-Zellen, die in verschiedenen Labors kultiviert wurden, vor dem Einfrieren bestimmt werden.
- Tauen Sie ein Fläschchen mit Basalmembran-Matrix-Lösung über Nacht bei 4 °C auf Eis auf. Die Matrix in 12 mL kaltes DMEM/F-12 verdünnen und gut mischen. Fügen Sie ein Deckglas pro Vertiefung hinzu und beschichten Sie jede Vertiefung einer 24-Well-Platte mit 0,25 ml der verdünnten Lösung. Die Platte vor Gebrauch 1 h bei Raumtemperatur oder über Nacht bei 4 °C inkubieren und die Beschichtungslösung kurz vor dem Plattieren der Zellen absaugen.
HINWEIS: Die Anweisungen für das aliquote Volumen sind chargenspezifisch basierend auf der Proteinkonzentration und finden Sie im Produktdatenblatt. - Die RPE-Einzelzellen aus Schritt 1.7 werden auf die mit Basalmembranmatrix beschichteten Deckgläser mit einer Dichte von 105/cm2 in 1 mL Kulturmedium ausgeimpft. Frischen Sie das Nährmedium alle 2-3 Tage auf.
- Zu den angegebenen Zeitpunkten (1, 3, 5, 7 und 11 Tage nach der Passage) inkubieren Sie RPE-Zellen mit 10 μM EdU im Medium für 24 Stunden. Fixieren, permeabilisieren und färben Sie die Zellen mit dem Reaktionscocktail, wie im Handbuch zum Nachweis von eingebautem EdU beschrieben.
- Nehmen Sie Bilder von fünf zufälligen Feldern unter einem Fluoreszenzmikroskop auf und berechnen Sie den Prozentsatz der EdU-positiven Zellen. Zeichnen Sie die entsprechenden EdU-positiven Verhältnis-Zeit-Kurven, um eine Wachstumskurve zu erstellen. Bestimmen Sie dann das Gefrierfenster oder die Exponentialphase für jede Zelllinie gemäß der Wachstumskurve.
HINWEIS: Die wiederhergestellte hexagonale Zellmorphologie deutet darauf hin, dass die Zellen die exponentielle Phase verlassen.
3. Kryokonservierung
- Nach den Schritten 1.1 bis 1.7 wird die Zellsuspension bei Raumtemperatur 3 Minuten lang bei 250 × g zentrifugiert, mit der Ausnahme, dass sich die Aufschlusszeit auf 5 Minuten verringert.
- Entsorgen Sie den Überstand durch schnelles Eingießen nach der Zentrifugation und resuspendieren Sie das Zellpellet vorsichtig im Kryokonservierungsmedium auf eine Dichte von 2 × 106 Zellen/ml und überführen Sie 1 ml der Zellsuspension in 1,2 mL Kryofläschchen.
- Stellen Sie die kryogenen Fläschchen sofort in einen Gefrierbehälter, frieren Sie sie über Nacht bei -80 °C ein, um eine Abkühlrate von -1 °C/min zu erreichen, und überführen Sie die Fläschchen dann zur Langzeitlagerung in flüssigen Stickstoff.
4. Auftauen
- Erwärmen Sie das Kulturmedium in einem 37 °C warmen Wasserbad und füllen Sie 10 mL vorgewärmtes Kulturmedium in ein 15 mL Röhrchen vor.
- Tauen Sie die kryogenen Fläschchen, die direkt aus dem Flüssigstickstofflager entnommen werden, mit einem automatischen Auftausystem schnell auf.
- Tropfen Sie 0,5-1 ml vorgewärmtes Kulturmedium in das kryogene Fläschchen, um sicherzustellen, dass sich die gefrorenen Zellen allmählich an die neue Umgebung anpassen. Übertragen Sie dann 1,5-2 mL der Zellsuspension auf 10 mL des Kulturmediums in ein 15-ml-Röhrchen und zentrifugieren Sie die Zellen bei 250 × g für 3 Minuten bei Raumtemperatur.
- Verwerfen Sie den Überstand durch schnelles Eingießen nach der Zentrifugation, resuspendieren Sie das Pellet in 2 ml vorgewärmtem Kulturmedium und zählen Sie die Anzahl der Zellen mit einem Hämozytometer, um die Wiederfindungs- und Überlebensraten unter Verwendung des Standard-Trypanblau-Ausschlusses (0,4 % Trypanblau-Fleck) zu bestimmen.
- Die Zellen werden auf mit Basalmembranmatrix beschichteten Oberflächen mit einer Dichte von 105 lebensfähigen Zellen/cm2 in einem mit Y-27632 (Endkonzentration: 10 μM) angereicherten Kulturmedium kultiviert. Entfernen Sie Y-27632 nach 24 h.
- Um die Anheftungsrate zu bestimmen, dissoziieren Sie die Zellen erneut und zählen Sie die Anzahl der Zellen 24 h nach dem Auftauen.
5. Validierung der optimalen Gefrierphase
- Um die in Schritt 2.4 ermittelte optimale Gefrierphase zu validieren, tauen Sie RPE-Zellen, die zu verschiedenen Zeitpunkten eingefroren wurden, auf und kulturieren Sie sie 28 Tage lang. Ernte der Zellen für qPCR- und Immunfärbeanalysen, um die Expression von RPE-Markern wie zuvor beschrieben zu bewerten17.
Ergebnisse
Hier wurden hESC-abgeleitete RPE-Zellen an P1D35 mit einer Dichte von 105/cm2 passageiert und ausgesiedelt. Innerhalb einer Woche nach der Aussaat gingen die charakteristische hexagonale Morphologie und Pigmentierung während der Verzögerungsphase (ca. 2 Tage) verloren. RPE-Zellen nahmen in der exponentiellen Phase (ca. 5 Tage, Abbildung 1A) allmählich die hexagonale Morphologie wieder an und traten mit einer polygonaleren Morphologie in die Verlangsamungsphase (ca. 6 Tage) ein. Wenn die Zellkultivierung eine weitere Woche lang fortgesetzt wurde, nahm die Zellproliferation signifikant ab, und die Zell-Zell-Verbindungen spielten eine primäre Rolle, wobei die Ränder beleuchtet wurden. Zu diesem Zeitpunkt befanden sich die Zellen nicht mehr in der exponentiellen Phase (Abbildung 1A, P2D11). Zusätzlich zur Zellmorphologie wurde der EdU-Zellproliferationsassay durchgeführt, um die Bestimmung der Phase zu unterstützen. Abbildung 1B zeigt, dass P2D5-Zellen eine höhere Proliferationsrate (exponentielle Phase) aufwiesen, während P2D11-Zellen in die Verzögerungsphase eingetreten waren.
Nach dem Einfrieren in flüssigem Stickstoff für 1-3 Monate wurden die RPE-Zellen aufgetaut. Nach dem Auftauen zerfielen einige Zellen zu subzellulären Trümmern, einige Zellen durchliefen eine Apoptose und die restlichen Zellen überlebten. Nach 24 Stunden zeigten RPE-Zellen, die an P2D5 eingefroren wurden, eine höhere Bindungsrate als solche, die zu anderen Zeitpunkten eingefroren wurden (Abbildung 2A). Darüber hinaus zeigten sie bereits 14 Tage nach dem Auftauen die charakteristische hexagonale Morphologie reifer RPE-Zellen mit ausgeprägten Zell-Zell-Adhäsionen (Tight Junctions). Im Gegensatz dazu nahmen Zellen, die zu anderen Zeitpunkten eingefroren wurden, im Allgemeinen einen fibroblastischen Phänotyp an (Abbildung 2A), was darauf hindeutet, dass sie eine relativ längere Phase des EMT-Übergangs durchliefen. Achtundzwanzig Tage nach dem Auftauen zeigte RPE, das an P2D5 eingefroren wurde, höher exprimierte und besser lokalisierte RPE-Zellmarker, wie durch qPCR (Abbildung 2B) und Immunfluoreszenzfärbung (Abbildung 2C,D) gezeigt wurde.
Um die Stabilität dieses Protokolls in verschiedenen Kryokonservierungsmedien zu testen, wurde die Leistung von zwei Kryokonservierungsmedien verglichen, die im Protokoll verwendet wurden. Das Ergebnis zeigte, dass die beiden Kryokonservierungsmedien bei der Erreichung einer hohen Zellviabilität und -bindung nach dem Auftauen gleich gut abschnitten (Abbildung 3).

Abbildung 1: Repräsentative Bilder von gefrierfertigen RPE-Zellen. (A) RPE-Zellen an P2D5 wiesen eine geringere hexagonale Morphologie und Pigmentierung auf als die an P2D11. (B) RPE-Zellen an P2D5 wiesen eine höhere Proliferationsrate auf als die an P2D11, wie der EdU-Assay zeigte. Maßstabsleisten = 100 μm. Abkürzungen: RPE = retinales Pigmentepithel; BF = Hellfeld; EdU = 5-Ethinyl-2'-desoxyuridin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
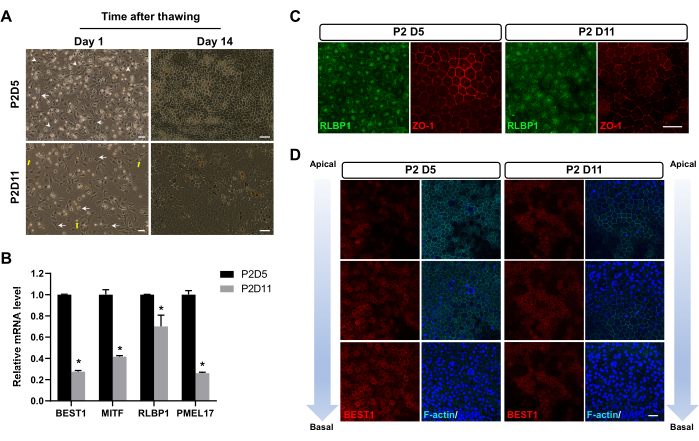
Abbildung 2: Repräsentative Bilder von RPE-Zellen nach dem Auftauen. (A) RPE-Zellen, die an P2D5 eingefroren wurden, zeigten 24 Stunden nach dem Auftauen eine bessere Bindung (linke Spalte) und zeigten eine hexagonale Morphologie früher - 14 Tage nach dem Auftauen (rechte Spalte). Charakteristische RPE-Zellen mit kompakter Morphologie (Pfeilspitzen) in der P2D5-Gruppe, unbefriedigende fibroblastenähnliche Morphologie (Pfeile) in der P2D11-Gruppe und Zelltrümmer (gelbe Pfeile) sind hervorgehoben. (B-D) Diese Bilder sind modifiziert von Zhang et al.17. (B,C) RPE-Zellen, die an P2D5 eingefroren wurden, wiesen 28 Tage nach dem Auftauen eine höhere mRNA- und Proteinexpression typischer RPE-Markergene auf. Statistische Unterschiede werden mit einer Zwei-Wege-ANOVA mit dem Post-hoc-Test von Bonferroni bewertet. *P < 0,05. (D) Die Immunfärbeanalyse entlang der apikal-basalen Achse 28 Tage nach dem Auftauen zeigte eine bessere Polarität von RPE-Zellen, die an P2D5 eingefroren wurden. Die Zellkerne wurden mit DAPI gegengefärbt. Maßstabsleisten = 50 μm (A), 25 μm (C,D). Abkürzungen: RPE = retinales Pigmentepithel; DAPI = 4',6-diamidino-2-phenylindol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Leistung von zwei Kryokonservierungsmedien, die im Protokoll verwendet wurden. (A) Die Zellviabilitätsrate wurde beim Auftauen von hESC-abgeleiteten RPE-Zellen gemessen, die bei P2D5 eingefroren wurden. (B) Die Hellfeldbilder von RPE-Zellen, die 24 Stunden nach dem Auftauen von zwei verschiedenen Gefriermedien (#1 und #2) auftauen. Maßstabsleiste = 100 μm. Abkürzungen: RPE = retinales Pigmentepithel; hESC = humane embryonale Stammzelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In der vorliegenden Studie wird ein erfolgreiches Freeze-Tau-Protokoll für hESC-abgeleitete RPE-Zellen für Forschung und klinische Zwecke beschrieben. Im Gegensatz zur immortalisierten RPE-Zelllinie ARPE-19 sind RPE-Zellen mit dem richtigen charakteristischen epithelialen Phänotyp und der richtigen Funktion, wie z. B. aus Stammzellen gewonnene RPE-Zellen, empfindlicher gegenüber der Kryokonservierung. Weniger als 32 % der Zellen blieben 24 Stunden nach dem Auftauen erhalten, wenn sie nicht richtig konserviertwurden 17. Der Zeitpunkt der Kryokonservierung ist ein kritischer Parameter. Eine etablierte Sichtweise für die Kryokonservierung immortalisierter Zellen ist das Einfrieren von Zellen in der exponentiellen Wachstumsphase. Differenzierte Zellen verlassen den Zellzyklus. Daher wurde die Wirkung der Wachstumsphase für die Kryokonservierung bei differenzierten Zellen selten berücksichtigt. Wir konnten zeigen, dass die hESC-differenzierten RPE-Zellen für kurze Zeit die Fähigkeit zur Proliferation wiedererlangten und nach dem Passieren in ein exponentielles Stadium übergingen. Verbesserte Ergebnisse können durch die Kryokonservierung von RPE-Zellen während der exponentiellen Phase17 erzielt werden.
Die Einschränkung dieses Protokolls besteht darin, dass nur zwei Arten von Kryokonservierungsmedien getestet wurden. Unterschiedliche Kryokonservierungsmedien können Kryoverletzungen auf unterschiedliche Weise verhindern23; Daher können Kryokonservierungsmedien das optimale Stadium der Kryokonservierung von RPE-Zellen beeinflussen. Ob Kryokonservierungsmedien die optimale Gefrierzeit beeinflussen, sollte weiter untersucht werden.
Das in dieser Studie vorgestellte Kryokonservierungsprotokoll kann leicht für den Einsatz in verschiedenen Labors angepasst werden, indem die exponentielle Phase von RPE-Zellen vor dem Einfrieren bestimmt wird, wodurch es unabhängiger von spezifischen Kultivierungsperioden, Differenzierungsmethoden oder Zelllinien wird. Neben der Beurteilung der Zellmorphologie bietet der EdU-Assay eine einfache Bewertung, um sicherzustellen, dass die Zellen in der exponentiellen Phase erhalten bleiben.
Das derzeitige Protokoll ist eine einfache und effiziente Methode zur Kryokonservierung von RPE-Zellen. Diese Strategie kann angewendet werden, um andere Arten von differenzierten Zellen zu kryokonservieren.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde von der National Natural Science Foundation of China (81970816) an Mei Jiang finanziert; die National Natural Science Foundation of China (82201223) an Xinyue Zhu; und der Aktionsplan für wissenschaftliche und technologische Innovation der Shanghaier Wissenschafts- und Technologiekommission (2014090067000) an Haiyun Liu.
Materialien
| Name | Company | Catalog Number | Comments |
| 40 μm Cell strainer | Corning | 431750 | |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 488 Dye | Thermo Fisher Scientific | C10337 | |
| Cryo freezing container | Nalgene | 5100-0001 | |
| CryoStor CS10 | Biolife Solutions | 07930 | cryopreservation medium #1 |
| DPBS, no calcium, no magnesium | Thermo Fisher Scientific | 14190144 | |
| Genxin | Selcell | YB050050 | cryopreservation medium #2 |
| Human embryonic stem cells | provided by Wicell, USA | H9 cell line | |
| Matrigel, hESC-Qualified Matrix | Corning | 354277 | basement membrane matrix |
| ThawSTAR CFT2 Automated Cell Thawing System | BioLife Solutions | AST-601 | |
| Trypan Blue solution 0.4% | Sigma | T8154 | |
| TryPLE Select | Thermo Fisher Scientific | 12563029 | cell dissociation reagent |
| XVIVO-10 medium | Lonza | BEBP04-743Q | RPE culture medium |
| Y-27632 | Selleck | S1049 |
Referenzen
- Lakkaraju, A., et al. The cell biology of the retinal pigment epithelium. Progress in Retinal and Eye Research. 78, 100846(2020).
- Mcbain, V. A., Townend, J., Lois, N. Progression of retinal pigment epithelial atrophy in stargardt disease. American Journal of Ophthamology. 154 (1), 146-154 (2012).
- George, S. M., Lu, F., Rao, M., Leach, L. L., Gross, J. M. The retinal pigment epithelium: Development, injury responses, and regenerative potential in mammalian and non-mammalian systems. Progress in Retinal and Eye Research. 85, 100969(2021).
- Rizzolo, L. J., Nasonkin, I. O., Adelman, R. A. Retinal cell transplantation, biomaterials, and in vitro models for developing next-generation therapies of age-related macular degeneration. Stem Cells Translational Medicine. 11 (3), 269-281 (2022).
- Bertolotti, E., Neri, A., Camparini, M., Macaluso, C., Marigo, V. Stem cells as source for retinal pigment epithelium transplantation. Progress in Retinal and Eye Research. 42, 130-144 (2014).
- Da Cruz,, L,, et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Mehat, M. S., et al. Transplantation of human embryonic stem cell-derived retinal pigment epithelial cells in macular degeneration. Ophthalmology. 125 (11), 1765-1775 (2018).
- Buchholz, D. E., et al. Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium. Stem Cells Translational Medicine. 2 (5), 384-393 (2013).
- Li, Q. -Y., et al. Functional assessment of cryopreserved clinical grade hESC-RPE cells as a qualified cell source for stem cell therapy of retinal degenerative diseases. Experimental Eye Research. 202, 108305(2021).
- Francois, M., et al. Cryopreserved mesenchymal stromal cells display impaired immunosuppressive properties as a result of heat-shock response and impaired interferon-gamma licensing. Cytotherapy. 14 (2), 147-152 (2012).
- Moll, G., et al. Do cryopreserved mesenchymal stromal cells display impaired immunomodulatory and therapeutic properties. Stem Cells. 32 (9), 2430-2442 (2014).
- Ekpo, M. D., et al. Incorporating cryopreservation evaluations into the design of cell-based drug delivery systems: an opinion paper. Frontiers in Immunology. 13, 967731(2022).
- Bailey, T. L., et al. Protective effects of osmolytes in cryopreserving adherent neuroblastoma (Neuro-2a) cells. Cryobiology. 71 (3), 472-480 (2015).
- Okumura, N., et al. Feasibility of a cryopreservation of cultured human corneal endothelial cells. PLoS One. 14 (6), e0218431(2019).
- Pennington, B. O., et al. Xeno-free cryopreservation of adherent retinal pigmented epithelium yields viable and functional cells in vitro and in vivo. Scientific Reports. 11 (1), 6286(2021).
- Woods, E. J., Thirumala, S., Badhe-Buchanan, S. S., Clarke, D., Mathew, A. J. Off the shelf cellular therapeutics: Factors to consider during cryopreservation and storage of human cells for clinical use. Cytotherapy. 18 (6), 697-711 (2016).
- Zhang, T., et al. Determining the optimal stage for cryopreservation of human embryonic stem cell-derived retinal pigment epithelial cells. Stem Cell Research & Therapy. 13 (1), 454(2022).
- Leach, L. L., et al. Induced pluripotent stem cell-derived retinal pigmented epithelium: a comparative study between cell lines and differentiation Methods. Journal of Ocular Pharmacology and Therapeutics. 32 (5), 317-330 (2016).
- Reichman, S., et al. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human iPS cells in Xeno-free and feeder-free conditions. Stem Cells. 35 (5), 1176-1188 (2017).
- Brandl, C., et al. In-depth characterisation of retinal pigment epithelium (RPE) cells derived from human induced pluripotent stem cells (hiPSC). Neuromolecular Medicine. 16 (3), 551-564 (2014).
- Hongisto, H., Ilmarinen, T., Vattulainen, M., Mikhailova, A., Skottman, H. Xeno- and feeder-free differentiation of human pluripotent stem cells to two distinct ocular epithelial cell types using simple modifications of one method. Stem Cell Research & Therapy. 8 (1), 291(2017).
- Foltz, L. P., Clegg, D. O. Rapid, directed differentiation of retinal pigment epithelial cells from human embryonic or induced pluripotent stem cells. Journal of Visualized Experiments: JoVE. (128), 10.3791/56274(2017).
- Marcantonini, G., et al. Natural cryoprotective and cytoprotective agents in cryopreservation: a focus on melatonin. Molecules. 27 (10), 3254(2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten