Method Article
Hipoksik İnsan Plasentalarından Küçük Hücre Dışı Veziküller Tarafından Fare Kan-Beyin Bariyerinin Bozulması
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Hipoksik koşullar altında kültürlenen plasental eksplantlardan izole edilen küçük EV'lerin (sEV'ler) (preeklampsinin bir yönünü modelleme) hamile olmayan yetişkin dişi farelerde kan-beyin bariyerini bozup bozmadığını değerlendirmek için bir protokol sunulmaktadır.
Özet
Serebral ödem, iskemik ve hemorajik inme gibi serebrovasküler komplikasyonlar, preeklampsi ile ilişkili maternal mortalitenin önde gelen nedenini oluşturur. Bu serebrovasküler komplikasyonların altında yatan mekanizmalar belirsizliğini korumaktadır. Bununla birlikte, plasental disfonksiyon ve kan-beyin bariyeri (BBB) bozulması ile bağlantılıdırlar. Bununla birlikte, bu iki uzak organ arasındaki bağlantı hala belirlenmektedir. Artan kanıtlar, plasentanın hücre dışı veziküller de dahil olmak üzere sinyal moleküllerini maternal dolaşıma saldığını göstermektedir. Hücre dışı veziküller, hem fizyolojik hem de patolojik koşullarda kritik sinyal parçacıkları olarak kabul edilen küçük hücre dışı veziküller (çapı 200 nm'den küçük sEV'ler) ile boyutlarına göre kategorize edilir. Preeklampside, maternal dolaşımda, sinyal fonksiyonu iyi anlaşılmamış olan dolaşımdaki sEV'lerin sayısında artış vardır. Preeklampside veya hipoksiye maruz kalan normal gebelik plasentalarından salınan plasental sEV'ler beyin endotel disfonksiyonuna ve BBB'nin bozulmasına neden olur. Bu protokolde, hipoksik koşullar altında kültürlenen plasental eksplantlardan izole edilen sEV'lerin (preeklampsinin bir yönünü modelleme) BBB'yi in vivo bozup bozmadığını değerlendiriyoruz.
Giriş
Preeklampsiye bağlı maternal ölümlerin yaklaşık% 70'i, bozulmuş plasentasyon süreçleri, maternal sistemik endotel disfonksiyonu ve ciddi vakalarda çoklu organ yetmezliği 1,2 ile karakterize hipertansif bir gebelik sendromu, akut serebrovasküler komplikasyonlarla ilişkilidir 3,4. Anne ölümlerinin çoğu düşük ve orta gelirli ülkelerde meydana gelmektedir5. Bununla birlikte, preeklampsi ile ilişkili serebrovasküler komplikasyonların klinik ve epidemiyolojik önemine rağmen altta yatan mekanizmalar hala belirsizdir.
Öte yandan, hücre dışı veziküller (EV'ler) (çap ~ 30-400 nm), maternal-plasental etkileşim de dahil olmak üzere dokular ve organlar arasındaki hücreler arası iletişimin temel aracılarıdır6. Dış yüzeydeki proteinlere ve lipitlere ek olarak, EV'ler içinde kargo taşır (proteinler, RNA ve lipitler). EV'ler (1) eksozomlar (çap ~50-150 nm, küçük EV'ler (sEV'ler) olarak da adlandırılır), (2) orta/büyük EV'ler ve (3) boyut, biyogenez, içerik ve potansiyel sinyal fonksiyonuna göre farklılık gösteren apoptotik cisimler olarak kategorize edilebilir. EV'lerin bileşimi, kaynaklandıkları hücreler ve hastalık tipi7 tarafından belirlenir. Sinsityotrofoblasttan türetilen EV'ler, gebelikte plasenta kaynaklı dolaşımdaki küçük EV'leri (PDsEV'ler) tespit eden plasental alkalen fosfataz (PLAP)8,9 eksprese eder. Ayrıca, PLAP, PDsEVs kargosundaki değişiklikleri ve bunların preeklampsi ile normotansif gebeliklerdeki etkilerini ayırt etmeye yardımcı olur 10,11,12,13,14,15.
Plasenta, preeklampsi16 patofizyolojisinde veya bu hastalıkla ilişkili serebral komplikasyonlarda gerekli bileşen olarak kabul edilmiştir 17,18,19. Bununla birlikte, bu uzak organın beyin dolaşımında değişikliklere nasıl neden olabileceği bilinmemektedir. sEV'ler, biyoaktif bileşenleri donörden alıcı hücrelere aktarma kapasiteleri nedeniyle hücreden hücreye iletişimde çok önemli roller oynadığından 6,20,21, giderek artan sayıda çalışma, plasental sEV'leri beyin endotel hücreleri21,22,23,24 dahil olmak üzere maternal endotel disfonksiyonunun oluşumu ile ilişkilendirmiştir25,26preeklampsili kadınlarda. Bu nedenle, beyin endotel fonksiyonunun tehlikeye girmesi, preeklampsi ile ilişkili serebrovasküler komplikasyonlarda kritik bir bileşen olan kan-beyin bariyerinin (BBB) bozulmasına yol açabilir 3,27.
Bununla birlikte, preeklampsi28 olan kadınların serumuna maruz kalan sıçan serebral damarları veya preeklampsi29 olan kadınların plazmasına maruz kalan insan beyni endotel hücreleri kullanılarak yapılan klinik öncesi bulgular, dolaşımdaki faktör(ler)in BBB'nin bozulmasına neden olduğunu bildirmiştir. Yüksek seviyelerde proinflamatuar sitokinler (yani tümör nekroz faktörü)18,28 veya vasküler düzenleyiciler (yani vasküler endotelyal büyüme faktörü (VEGF))29,30,31 veya oksidize lipoproteinler (okso-LDL)32,33 gibi oksidatif moleküller gibi preeklampsi sırasında maternal dolaşımda bulunan BBB'ye zarar verme potansiyeline sahip birkaç adaya rağmen, diğerleri arasında34, hiçbiri plasenta ve BBB arasında doğrudan bir bağlantı kurmaz. Son zamanlarda, hipoksik plasentalardan izole edilen sEV'ler, gebe olmayan dişi farelerde BBB'yi bozma kapasitesini göstermiştir25. Plasental sEV'ler, BBB'yi bozma kapasitesi ile listelenen dolaşım faktörlerinin çoğunu taşıyabileceğinden, sEV'ler yaralı plasentayı bağlamak, zararlı dolaşım faktörlerinin taşıyıcısı olmak ve preeklampside BBB'yi bozmak için uygun adaylar olarak kabul edilir.
Bu protokol, hipoksik koşullar altında kültürlenen plasental eksplantlardan izole edilen sEV'lerin, preeklampsi sırasında serebral komplikasyonların patofizyolojisini anlamak için bir vekil olarak gebe olmayan dişi farelerde BBB'yi bozup bozamayacağını araştırmamızı sağlar.
Protokol
Araştırma, Helsinki Bildirgesi'nde ifade edilen ilkelere uygun olarak ve ilgili Etik İnceleme Kurullarının yetkisi altında gerçekleştirilmiştir. Tüm insan katılımcılar, daha önce bildirildiği gibi, numune alınmadan önce bilgilendirilmiş onamlarını verdiler25. Ek olarak, Bío-Bío Üniversitesi Biyoetik ve Biyogüvenlik Komitesi bu projeyi onayladı (Fondecyt hibe 1200250). Hayvan çalışması, deneylerde hayvanların kullanımında üç R'nin temel ilkelerine uygun olarakve ABD Ulusal Sağlık Enstitüsü tarafından yayınlanan Laboratuvar Hayvanlarının Bakımı ve Kullanımı kılavuzlarının tavsiyelerine göre yürütülmüştür. Hayvanlar, Bío-Bío Üniversitesi'nin Vivarium'unda uygun ortamlarda tutuldu. Taze plasentalar (n=4), elektif sezaryen sonrası 1 saat içinde, term gebelikleri normal olan annelerden (28-31 yaş) (38-41 gebelik haftası) elde edildi. Sezaryen, daha önce bildirildiği gibi Şili'nin Chillan kentindeki Herminda Martin Klinik Hastanesi'nde gerçekleştirildi25. İn vivo modeli uygulamak için 4-6 aylık dişi gebe olmayan fareler (suş C57BLACK/6) kullanıldı. Üç deney grubuna ayrıldılar: (1) kontrol (tedavi olmadan), (2) normoksiden sEV'lerle tedavi edildi (sEVs-Nor) ve (3) hipoksik kültürlenmiş plasentalardan (sEVs-Hyp) sEV'lerle tedavi edildi, BBB'nin bozulmasını değerlendirmek için kullanıldı in vivo25. Enjekte edilen tüm çözeltiler sterildi. Ayrıca, sEV'lerin hazırlanması, kontaminasyonu önlemek için aseptik koşullarda ve sınıf II biyogüvenlik başlığı altında gerçekleştirildi.
1. Plasental kültür eksplantları
- Normal gebelik plasentalarının eksplantlarını çıkarmak için, Miller ve ark. 200536.
- Sterilize edilmiş forseps kullanarak pıhtıları insan plasentasının bazal plakasından dikkatlice çıkarın. 10 g'lık bir nihai doku ekstraksiyonu elde etmek için küçük eksplantları ekstrakte edin.
- Plasenta eksplantlarının plasentanın maternal kısmının dört çeyreğinden çıkarıldığından emin olun. Devitalize doku ve kalsifiye alanların dışlandığından emin olun.
- Plasenta dokusunu manipüle etmek için, bunu buz üzerinde, steril koşullar altında ve bir biyogüvenlik kabini içinde yapın.
- Mümkün olduğunca fazla kanı çıkarmak için eksplantları (en az üç kez) bol miktarda (beş hacim eksplant) soğuk (4 °C) fosfat tampon çözeltisi (PBS 1x, pH 7.4) ile yıkayın. Yıkamalar arasında oda sıcaklığında santrifüjleyin (10 dakika boyunca 252 x g ).
- % 2 fetal sığır serumu, 100 IU / mL penisilin ve 100 μg / mL streptomisin ile desteklenmiş 20 mL kültür ortamında 10 g yıkanmış eksplantı yeniden süspanse edin (bkz.
- Süspansiyonu 100 mm'lik bir kültür kabına koyun. Eksplantları 37 °C'de %21 oksijen ve %5 CO2 içeren bir inkübatörde 2 saat bekletin.
- Bundan sonra, eksplantları 1x PBS ile 37 ° C'de (üç kez) tekrar yıkayın. Yıkamalar arasında oda sıcaklığında santrifüjleyin (10 dakika boyunca 252 x g ).
- Ayrıca, dokuyu daha önce nanopartiküllerden arındırılmış 20 mL kültür ortamında yeniden süspanse edin.
NOT: Nanopartikül tükenmesi için ultrasantrifüjleme (oda sıcaklığında 18 saat boyunca 120.000 x g ) ve mikrofiltrasyon (0.22 μm filtre) gerçekleştirin. - Yeniden süspanse edilmiş eksplantları iki kültür kabına (100 mm) bölün. Her kültür kabı 10 mL resüspanse eksplant içermelidir.
- Bundan sonra, plasental eksplantlar içeren tabaklardan birini standart kültür koşullarında (% 8 oksijen ve% 5 CO2 ile 37 ° C), diğerini ise% 1O2 ile hipoksik bir odaya yerleştirin.
NOT: (İSTEĞE BAĞLI) Doku canlılığının analizi, başka bir yerde tarif edildiği gibi aynı doku ekstraksiyonları ve 3-(4,5-dimetiltiyazol-2-il)-2,5-difeniltetrazolyum bromür testi (MTT testi) kullanılarak gerçekleştirilebilir37,38. MTT değerlerini normalleştirmek için eksplant homojenatlarında ölçülen toplam protein konsantrasyonunu kullanın. - Kültürde 18 saat sonra, eksplantların şartlandırılmış ortamını yeni bir 15 mL'lik tüpe hasat edin.
NOT: Bu adımda, şartlandırılmış ortam uzun bir süre (haftalar) boyunca dondurulabilir (-80 °C).
2. Plasental kaynaklı sEV izolasyonu
- Daha önce yayınlanmış raporları25,39 izleyerek diferansiyel santrifüjleme ve mikrofiltrasyon protokolünü kullanarak sEV'leri şartlandırılmış ortamdan izole edin.
- Hasat edilen şartlandırılmış ortam için sıralı santrifüjleme gerçekleştirin. Santrifüjlerin sıralı adımları (1) 10 dakika boyunca 300 x g , (2) 10 dakika boyunca 2000 x g , (3) 30 dakika boyunca 10.000 x g ve (4) 2 saat boyunca 120.000 x g'dir . Santrifüj oda sıcaklığında gerçekleştirin.
- Tüm bu santrifüjlerde, 20-100 μL'lik bir pipet kullanarak, süpernatanı dikkatlice toplayın ve peleti atın.
- Bittiğinde, son toplanan süpernatanı 0.22 μm'lik bir filtreden geçirin (Malzeme Tablosuna bakınız). Daha sonra, oda sıcaklığında 18 saat boyunca 120.000 x g'da bir ek santrifüjleme gerçekleştirin.
- Bundan sonra, peleti (plasental sEV'ler içeren) 500 μL PBS'de (pH 7.4) yeniden süspanse ederken süpernatanı atın ve tekrar 0.22 μm'lik bir filtreden geçirin. Son olarak, oda sıcaklığında 3 saat boyunca 120.000 x g'da son bir santrifüjleme gerçekleştirin.
- Daha sonra, peleti (plasental sEV'ler içeren) 500 μL PBS'de (pH 7.4, daha önce sEV'lerden tükenmiş) yeniden süspanse edin ve 0.22 μm'lik bir filtreden geçirin.
- Numuneleri sEVs-Normoxia (sEVs-Nor) veya sEVs-Hipoksi (sEVs-Hyp) stoğu olarak etiketleyin.
NOT: Daha fazla deney için izole edilmiş sEV'lerin 50-100 μL'lik alikotlarını hazırlayın. Küçük EV'ler -80 °C'de uzun bir süre (aylar) saklanabilir. - Plasental sEV'leri daha önce bildirildiği gibi boyut, sayı ve sEV protein belirteci ile karakterize edin25. sEV'lerin ideal ortalama partikül çapı 50-150 nm'dir.
NOT: sEV karakterizasyonu, CD63, Tsg101, Alix ve HSP70'in pozitif tespitini içerir (yani, eksozomlarla zenginleştirilmiş sEV popülasyonunu karakterize etmek için). Ayrıca, PLAP'ı plasental kökenli bir belirteç olarak kullanın25. - Üreticinin talimatlarını izleyerek BCA protein tahlil kitini kullanarak sEVs çözeltisindeki toplam protein miktarını ölçün (bkz. Malzeme Tablosu).
NOT: Şekil 1 , plasental eksplant kültürüne ve hücre dışı vezikül izolasyonuna genel bir bakış göstermektedir.
3. Fare enjeksiyonu
- Hayvanı% 5 izofluran dağılımına sahip bir anestezik indüksiyon odasında uyuşturun (Malzeme Tablosuna bakınız). Anestezi seviyesini bir ayak parmağı tutamıyla doğrulayın.
- ~40 saniye sonra, fareyi bir yüz maskesi kullanarak anestezi sistemine koyun ve% 2 izofluran anestezi seviyesini koruyun.
- Ardından, hayvanı 28 °C oda sıcaklığında bir ısıtma platformuna (Malzeme Tablosuna bakın) yerleştirin. Gözleri yapay gözyaşlarıyla yağlayın.
- Enjekte etmeden önce, plasental sEV'leri (200 μg toplam protein) fosfat tamponu (pH, 7.4) ile 70 μL'lik bir nihai hacme ulaşana kadar seyreltin.
- Enjeksiyon alanını% 70 etanol ve pamuklu çubuklar kullanarak dezenfekte edin. sEV solüsyonunu enjekte etmek için 30 G iğneli bir insülin şırıngası kullandığınızdan emin olun.
NOT: Şırınga, fizyolojik bir sıcaklık elde etmek için 5 dakika boyunca ısıtma platformuna yerleştirilebilir. - Ardından, çözeltiyi dış juguler damara enjekte edin. Bu adım özel eğitim gerektirir.
NOT: Prosedür dikkatli bir şekilde yapılmalı, iğne yavaşça geri çekilmeli ve kan reflü kanıtına nazikçe aspire edilmelidir. - Enjeksiyondan sonra, enjekte edilen bölgeye kuru bir pamuklu çubukla ~15 saniye boyunca hafif basınç uygulayın. Bundan sonra, hayvanları kendi kafeslerine geri koyun.
- 15 dakika boyunca bilinç ve davranışı değerlendirdiğinizden emin olun. Bilinç başarısının bir göstergesi, toplam motor aktivitenin hayvan iyileşmesidir.
NOT: Hayvan kafeslerinde sıcaklığın sıcak tutulduğundan emin olun.
4. Hızlı murin koma ve davranış ölçeği (RMCBS)
- Hayvanların nörolojik ve refah parametrelerini değerlendirmek için RMCBS'yi kullanın40.
NOT: RMCBS, operatör müdahalesi nedeniyle minimum hayvan stresi ile hızlı bir değerlendirmeye (~ 3 dakika) izin verir. RMCBS'nin on parametresi vardır (her puan 0-2'dir). - RMCBS ölçeği ile 0 saatte (sEV'leri enjekte etmeden önce) ve enjeksiyondan 3 saat, 6 saat, 12 saat ve 24 saat sonra fare sağlığını değerlendirin.
NOT: BBB'nin bozulmasını değerlendirmek için claudin-5 (sEV enjeksiyonundan 6 saat sonra) ve Evan mavi ekstravazasyonu (sEV enjeksiyonundan 24 saat sonra) analizi yapın (Şekil 2).
5. Evan'ın mavi ekstravazasyonunun analizi
- Plasental sEV enjeksiyonundan sonra (24 saat), fareleri adım 3.1'de tarif edildiği gibi uyuşturun.
- Evan'ın Mavi çözeltisini hazırlayın (% 2, fosfat tampon çözeltisinde seyreltilmiş, 1x) (Malzeme Tablosuna bakınız).
- Retro-orbital erişim25'i kullanarak, Evan'ın Mavi çözeltisini 2 mL / kg'da enjekte edin.
- Evan'ın mavi solüsyonunun anestezi bakımı altında 20 dakika dolaşmasına izin verin.
- Daha sonra, Evan'ın mavi boyasını dolaşımdan çıkarmak için salin solüsyonu (~ 3 mL,% 0.9, w / v) ile daha önce tarif edilen protokol41'i izleyerek intrakardiyak perfüzyon gerçekleştirin. Bu adım zorunludur.
NOT: Bu prosedür için anesteziyi %5'e yükseltin ve derin bir anestezi düzlemini doğrulayın (yani, solunum hızında ciddi azalma). - Kalbi medial torakotomi ile ortayaçıkarın 41 (Şekil 3).
- Bundan sonra, tüm hayvanı intrakardiyal bir paraformaldehit çözeltisi infüzyonu ile sabitleyin (PBS'de% 4, v / v).
NOT: Uygun sabitlemeyi izlemek için kuyruğun sertliğini kontrol edin. - Ayrıca, fiksasyon tamamlandıktan sonra beyni dikkatlice çıkarın, tartın ve fotoğrafını çekin41. Tüm beyin bir cetvele yakın olacak şekilde fotoğraf çekin42.
- Sonra, beyni bir beyin faresi dilimleyicisine koyun (Malzeme Tablosuna bakın).
- Beyni, beyincik de dahil olmak üzere (her bölüm 100 μm) dokuz bölüme ayırın.
- Diseksiyondan sonra, beyin dilimlerinin görüntülerini stereo zoom mikroskobunda görselleştirin ve yakalayın (bkz.
- ImageJ yazılımını kullanarak Evan'ın mavi ekstravazasyonunu ölçmek için yakalanan görüntüleri kullanın (bkz.
NOT: Evan'ın mavi boyasının varlığını analiz etmek için, beyin bölümünün pozitif kontrolünü kullanarak Evan'ın mavi değerlerini ayarlayın (boya enjekte edilmiş ancak intrakardiyal perfüzyon olmayan bir hayvan kontrol hayvanından). Pozitif kontrolden ulaşılan Evan mavisi değerleri, mavi kanalın yoğunluk histogramında genellikle 75 ile 110 arasındadır (Şekil 4). - Gözlemci yanlılığını önlemek için beyin görüntülerinin ilgili deney grubu tarafından körü körüne analiz edildiğinden emin olun. Alternatif olarak, Evan'ın mavi ekstravazasyonunu beyin homojenizasyonu ve ardından spektroskopi43 ile ölçün.
NOT: Ayrı deneylerde, sEV'lerin enjekte edildiği farelerden (6 saat) yeni izole edilmiş beyinleri kullanarak, BBB44'ün sıkılığında yer alan kritik bir sıkı bağlantı olan claudin 5'in (CLND-5) protein seviyelerini analiz edin (bkz.
Sonuçlar
Bu protokol, hipokside kültürlenen plasentalardan türetilen sEV'lerin gebe olmayan farelerde BBB'yi bozma kapasitesini değerlendirir. Bu yöntem, normal ve patolojik koşullarda plasenta ve beyin arasındaki potansiyel bağlantının daha iyi anlaşılmasını sağlar. Özellikle, bu yöntem preeklampside serebral komplikasyonların başlangıcında plasental sEV'lerin katılımını analiz etmek için bir vekil oluşturabilir.
sEVs-Nor enjekte edilen farelerin aksine, sEVs-Hyp enjekte edilen fareler, 24 saate kadar nörolojik skorda ilerleyici bir düşüş gösterir (Tablo 1), bu da sEVs-Hyp'nin beyin fonksiyonunu bozma kapasitesini gösterir.
Ayrıca, sEVs-Hyp enjekte edilen grubun fare beyinleri, sEVs-Nor enjekte edilen farelerden veya kontrol farelerinden izole edilenlerden daha yüksek taze ağırlığa sahiptir (sırasıyla 0.51 ± 0.008; 0.46 ± 0.008; 0.47 ± 0.01 g), bu da beyin ödeminin brüt bir göstergesini oluşturabilir45.
Bu bulgu ile uyumlu olarak, bu protokol, Evan'ın mavi ekstravazasyonunu BBB'nin bozulmasının bir göstergesi olarak tanımlamaya izin verir. Bu bağlamda, sEVs-Hyp enjekte edilen farelerden alınan beyinler, sEVs-Nor grubundaki beyinlerden daha yüksek Evan'ın mavi ekstravazasyonuna sahiptir (Şekil 5A).
Her ne kadar sEVs-Hyp tarafından indüklenen BBB'nin altında yatan bozulma mekanizması bu protokolle analiz edilmemiş olsa da, sonuçlar ayrıca sEVs-Hyp enjekte edilen farelerin, BBB'nin en çok etkilendiği alanlarda (yani, arka alanlar) CLND-5'in protein miktarlarında azalma gösterdiğini göstermektedir (Şekil 5B). Bu nedenle, sEVs-hyp'nin bu kritik endotelyal sıkı bağlantı proteininin fonksiyonunun ekspresyonunu bozması mümkündür.
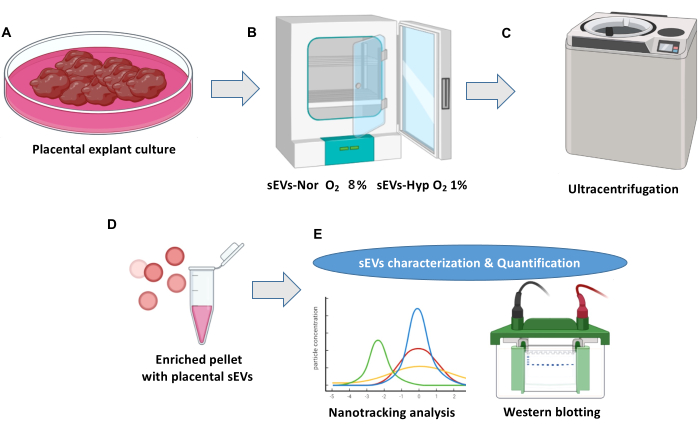
Şekil 1: Plasental eksplant kültürü ve hücre dışı vezikül izolasyon protokolü. (A) Normal plasenta eksplant kültürleri. (B) Eksplantlar, plasentalı küçük hücre dışı veziküllerin (sEV'ler) biyogenezi için iki koşula dağıtılır. 18 saat boyunca Normoksi (sEVs-Nor,% 8 O2) veya hipoksi (sEVs-Hyp,% 1 O2) (C) Hücre kalıntılarını ortadan kaldırmak için şartlandırılmış ortam hasat edilir, filtrelenir ve santrifüjlenir. (D) sEV'ler ultra santrifüjlerle izole edilir. (E) sEV'ler, nano-izleme analizi ve western blot kullanılarak karakterize edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Kan-beyin bariyeri bozulma protokolünün in vivo değerlendirmesi. 4-6 aylık gebe olmayan C57BL6/J fareler kullanılır. (A) Dış juguler ven yoluyla, hayvanlara Normoksik (sEVs-Nor,% 8 O2) veya hipoksik (sEVs-Hyp,% 1 O2) plasental kültürlerden izole edilen sEV'ler (200 μg toplam protein) verildi. RMCBS, enjeksiyondan 0-24 saat sonra izlenir. (B) sEV enjeksiyonundan 6 saat sonra, beyinler ekstrakte edilir ve protein ekstraksiyonu için dokuz bölüme ayrılır. Claudin 5 (CLDN5) bu dokuz bölümün homojenatlarında analiz edilir. (C) Evan'ın mavi ekstravazasyon analizi (sEV enjeksiyonundan 24 saat sonra), dokuz segmentin her birinde retro-orbital ponksiyon enjeksiyonundan sonra analiz edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
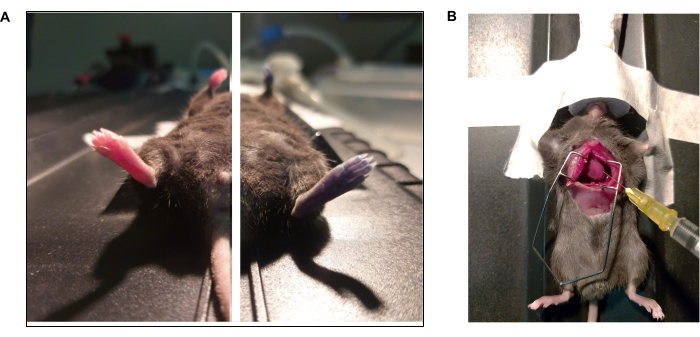
Şekil 3: Evan'ın mavi boyası ve intrakardiyal perfüzyon protokolünün fotoğraf belgeselleri. (A) Fare, Evan'ın mavisini retro-orbital enjeksiyon yoluyla aldı. (Solda) Evan mavisi enjeksiyonundan önce ve (Sağda) hayvan (15 s) enjeksiyondan sonra. (B) Fosfat tampon çözeltisi (1x PBS) ve paraformaldehitin (% 4 PFA) intrakardiyal perfüzyonunu gerçekleştirmek için torakotomi. Sol ventrikül iğnenin ucu ile işaretlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: sEV'lerin enjeksiyonundan sonra Evan'ın mavi ekstravazasyonunun analizi. (A) Evan'ın mavi ekstravazasyonunu gösteren tüm beynin temsili görüntüsü. Kesikli çizgi, tüm beyinden elde edilen dokuz bölümü temsil eder. (B) Beyin faresi dilimleyici kullanılarak incelenen beyin. (C) sEV enjeksiyonundan 24 saat sonra beyin dilimlerinin temsili görüntüleri. Kontrol (CTL), normoksik (sEVs-Nor) veya hipoksik koşullarda (sEVs-Hyp) plasenta. Ölçek çubuğu = 0,4 cm. (D) ImageJ kullanılarak beyin diliminin dijital taslağı. (E) Mavi kanaldaki histogram. 75-110 arasındaki değerler Evan'ın mavi ekstravazasyonu ile ilişkilidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Plasental eksplantlardan izole edilen sEV'ler enjekte edilen farelerde Evan'ın mavi ekstravazasyonu ve claudin-5 seviyeleri. (A) Tüm beyin bölümleri dikkate alınarak Evan'ın mavi (EB) ekstravazasyon yüzdesi. Kontrol (CTL, mavi), normoksik (sEVs-Nor, kırmızı) veya hipoksik koşullarda (sEVs-Hyp, yeşil) plasenta. (B) Dokuz beyin bölümündeki nispi claudin 5 (CLDN5) seviyeleri üç deney grubundan elde edildi. β-aktin yükleme kontrolü olarak kullanılır. Değerler ortalama ± çeyrekler arası aralıktır. Her nokta ayrı bir deney konusunu temsil eder. *p < 0.05, **p < 0.005. p < 0.0001. p < 0.001; ANOVA testi ve ardından Bonferroni son testi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Zaman (h) | Kontrol | sEVs-Normoksia | sEV'ler-Hipoksi | ANOVA |
| 0 | 18,75 ± 0,250 | 18.5 ± 0.288 | 18,75 ± 0,250 | Ns |
| 3 | 18.5 ± 0.866 | 17 ± 0,707 | 13.25 ± 1.750*α | 0.006 |
| 6 | 19,25 ± 0,750 | 17 ± 0,577 | 11.75 ± 1.250*α | 0.002 |
| 12 | 18.5 ± 0.645 | 16.75 ± 1.109 | 13 ± 0.816*α | 0.001 |
| 24 | 19.5 ± 0.288 | 17,75 ± 0,250 | 10.25 ± 0.853*α | <0.0001 |
| *P < 0.01'e karşı kontrol. αp < 0.01'e karşı sEVs-Normoxia | ||||
Tablo 1: sEV enjeksiyonundan 24 saat sonra hızlı murin koma ve davranış ölçeği (RMCBS). ±Hayvanların 20'ye en yakın puanları standart iken, puan ne kadar düşükse, CNS'nin işlev bozukluğu o kadar yüksek olur.
Tartışmalar
Bu çalışma, hipoksik koşullarda kültürlenen plasental eksplantlardan izole edilen sEV'lerin kemirgen kan-beyin bariyerinin bozulması üzerine ortaya çıkan potansiyel zararlara ilişkin yeni bilgiler ortaya koymaktadır. Patolojik mekanizma, arka beyin bölgesinde CLND-5'te bir azalmayı içerir25.
Önceki araştırmalar, preeklampsili bireylerden alınan plazma-sEV'lerin in vitro modeller kullanılarak çeşitli organlarda endotel disfonksiyonuna neden olduğunu ortaya koymuştur46,47. Bu araştırma özellikle kan-beyin bariyerini inceledi ve hipoksi ile kültürlenmiş plasentadan izole edilen ve bu hayati bariyeri bozan sEV'lere yeni bir bakış açısı sundu. Bu keşifler, sEV'lerin preeklampsi gibi hem normal hem de patolojik senaryolarda plasenta ve beyin arasında bir iletişim kanalı olarak hizmet edebileceği yeni bir araştırma alanı sunmaktadır.
Sunulan protokol basittir, ancak birkaç kritik adımdan bahsetmek gerekir. Bu protokol, doğumdan sonraki 1 saat içinde taze plasentalar gerektirir. Ayrıca doku bozulmasını önlemek için kültür periyodunun 24 saatten fazla uzatılmamasını tavsiye ediyoruz. Bu protokol, fare plasentaları tarafından üretilen sEV'lerden kaynaklanan potansiyel kontaminasyonu azaltır. Evan'ın mavi ekstravazasyonunun dijital analizi zaman alıcıdır. Ayrıca, Evan'ın mavi lekesi beyin kesitinden sonra daha az belirgindir. Bu nedenle, pozitif bir kontrol kullanarak mavi aralığı tanımlamak için bir ilk kurulum önerilir. Evan'ın mavi enjeksiyonuna maruz kalmayan bir farenin beyni gibi negatif bir kontrol de kullanılabilir. Potansiyel gözlemci yanlılığını önlemek için deney gruplarının kör analizi zorunludur.
Bu protokol sırasında çeşitli zorluklar ortaya çıkabilir. Önemli bir sınırlama, hem insan plasentalarından hem de enjekte edilen farelerden kaynaklanan biyolojik değişkenlikte yatmaktadır. Evan'ın mavi ekstravazasyon deneylerinin tekrarlanabilirliğini sağlamak için, insan plasentalarından izole edilen sEV dozlarının oluşturulması önerilmektedir. 200 μg'lık bir toplam protein dozu seçtik; bununla birlikte, bu miktar vezikül saflığına, juguler enjeksiyonun etkinliğine, Evan'ın mavi uygulamasına, dolaşım sisteminden temizlenmesine ve en azından içerikleri göz önüne alındığında sEV'lerin biyolojik etkisine bağlı olarak dalgalanabilir.
İnsan plasentasından gelen sEV'lerin kan-beyin bariyerini bozabileceği hücresel mekanizmalar, ek deneyler gerektirir. Bununla birlikte, bu yöntem, plasenta ve beyin arasındaki potansiyel iletişime işaret ederek daha fazla araştırmayı garanti eden alaka düzeyine sahiptir. Bu nedenle, sEV'lere ve bunların kan-beyin bariyeri ile etkileşimlerine ve kargolarının nöronal dokular üzerindeki etkisine odaklanan gelecekteki araştırmalar teşvik edilmektedir. Kan-beyin bariyeri bozukluğunun anne beyni için kalıcı sonuçlara yol açıp açmadığı daha fazla incelemeyi gerektirir.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, değerli katkıları için GRIVAS Health'e ait araştırmacılara teşekkür eder. Ayrıca, Kadın Hastalıkları ve Doğum Servisi'nden ebeler ve klinik personel, Şili'deki Hospital de Chillan'a aittir. Fondecyt Regular 1200250 tarafından kuruldu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Adult mice brain slecer matrice 3D printed | Open access file | Adult mice | Adult mice brain slicer. Printed in PLA filament. |
| Anti β-Actin primary antibody | Sigma-Aldrich | Clon AC-74 | Antibody for loading control (Western blot) |
| Anti-Claudin5 primary antibody | Santa cruz Biotechnology | sc-374221 | Primary antibody for tight junction protein CLDN5 of mice BBB (Western blot) |
| BCA protein kit | Thermo Scientific | 23225 | Kit for measuring protein concentration |
| Culture media #200 500 mL | Thermo Fisher Scientific | m200500 | Culture media for placental explants |
| D180 CO2 incubator | RWD Life science | D180 | Standard incubator to estabilize explants and culture sEVs-Nor |
| Evans blue dye > 75% 10 g | Sigma-Aldrich | E2129.10G | Dye to analize blood brain barrier disruption IN VIVO |
| Fetal bovine serum 500 mL | Thermo Fisher Scientific | 16000044 | Additive growth factor for culture media 200 |
| Himac Ultracentrifuge CP100NX | Himac eppendorf group | 5720410101 | Ultracentrifuge for condicioned media > 1,20,000 x g |
| ImageJ software | NIH | https://imagej.nih.gov/ij/download.html | |
| Isoflurane x 100 mL | USP Baxter | 212-094 | Volatile inhalated anaesthesia agent for mice |
| Kit CellTiter 96 Non-radioactive | Promega | 0000105232 | In vitro assay for placental explants viability |
| Mouse IgG Secondary antibody | Thermo Fisher Scientific | MO 63103 | Secondary antibody for CLDN5 (western blot) |
| NanoSight NS300 | Malvern Panalytical | 90278090 | Nanotracking analysis of particles from placental explants condicioned media |
| Paraformaldehide E 97% solution 500 mL | Thermo Fisher Scientific | A11313.22 | Fixative solution for brain tissue slices and intracardial perfusion (once diluted) |
| PBS 1 X pH 7.4 500 mL | Thermo Fisher Scientific | 10010023 | Wash solution for placenta explants |
| Peniciline-streptomicine 100x 20 mL | Thermo Fisher Scientific | 10378016 | Antiobiotics for placental explants culture media |
| ProOX C21 Cytocentric O2 and CO2 Subchamber Controller | BioSpherix | SCR_021131 | CO2 regulator to induce Hypoxia in sealed chamber for sEVs-Hyp |
| Sodium Thiopental 1 g | Chemie | 7061 | humanitarian euthanasia agent |
| Somnosuite low flow anesthesia system | Kent Scientifics | SS-01 | Isoflurane vaporizer for small rodents |
| Surgical Warming platform | Kent Scientifics | A41166 | Warming platform for mainteinance anesthesia in mice |
| Syringe Filters, Polytetrafluoroethylene (PTFE), Hydrophobic, 0.22 µm, Sterile, 25 mm | Southern labware | 10026 | Filtration of condicioned media harvested from placental explants |
| Tabletop High-Speed Micro Centrifuges HITACHI himac CT15E/CT15RE | Hitachi medical systems | 6020 | Serial centrifugations of condicioned media < 1,20, 000 x g |
| Trinocular stereomicroscope transmided and reflective light 10x-160x | Center Medical | 2597 | Stereomicroscope to register brain slices |
Referanslar
- Lisonkova, S., Joseph, K. S. Incidence of preeclampsia: risk factors and outcomes associated with early- versus late-onset disease. Am J Obstet Gynecol. 209 (544), 544.e1-544.e12 (2013).
- Sibai, B., Dekker, G., Kupferminc, M. Preeclampsia. Lancet. 365 (9461), 785-799 (2005).
- Hammer, E. S., Cipolla, M. J. Cerebrovascular dysfunction in preeclamptic pregnancies. Curr Hypertens Rep. 17 (8), 64(2015).
- Okanloma, K. A., Moodley, J. Neurological complications associated with the preeclampsia/eclampsia syndrome. Int J Gynaecol Obstet. 71, 223-225 (2000).
- Frias, A. E., Belfort, M. A. Post magpie: how should we be managing severe preeclampsia. Curr Opin Gynecol Obstet. 15 (6), 489-495 (2003).
- Familari, M., Cronqvist, T., Masoumi, Z., Hansson, S. R. Placenta-derived extracellular vesicles: Their cargo and possible functions. Reprod Fertil Dev. 29 (3), 433-447 (2017).
- Montoro-Garcia, S., Shantsila, E., Marin, F., Blann, A., Lip, G. Y. Circulating microparticles: new insights into the biochemical basis of microparticle release and activity. Basic Res Cardiol. 106, 911-923 (2011).
- Germain, S. J., Sacks, G. P., Sooranna, S. R., Sargent, I. L., Redman, C. W. Systemic inflammatory priming in normal pregnancy and preeclampsia: the role of circulating syncytiotrophoblast microparticles. J Immunol. 178 (9), 5949-5956 (2007).
- Tannetta, D., Masliukaite, I., Vatish, M., Redman, C., Sargent, I. Update of syncytiotrophoblast derived extracellular vesicles in normal pregnancy and preeclampsia. J Reprod Immunol. 119, 98-106 (2017).
- Collett, G. P., Redman, C. W., Sargent, I. L., Vatish, M. Endoplasmic reticulum stress stimulates the release of extracellular vesicles carrying danger-associated molecular pattern (DAMP) molecules. Oncotarget. 9 (6), 6707-6717 (2018).
- Cooke, W. R., et al. Maternal circulating syncytiotrophoblast-derived extracellular vesicles contain biologically active 5'-tRNA halves. Biochem Biophys Res Commun. 518 (1), 107-113 (2019).
- Gill, M., et al. Placental syncytiotrophoblast-derived extracellular vesicles carry active nep (neprilysin) and are increased in preeclampsia. Hypertension. 73 (5), 1112-1119 (2019).
- Kandzija, N., et al. Placental extracellular vesicles express active dipeptidyl peptidase IV; levels are increased in gestational diabetes mellitus. J Extracell Vesicles. 8 (1), 1617000(2019).
- Motta-Mejia, C., et al. Placental vesicles carry active endothelial nitric oxide synthase and their activity is reduced in preeclampsia. Hypertension. 70 (2), 372-381 (2017).
- Sammar, M., et al. Reduced placental protein 13 (PP13) in placental derived syncytiotrophoblast extracellular vesicles in preeclampsia - A novel tool to study the impaired cargo transmission of the placenta to the maternal organs. Placenta. 66, 17-25 (2018).
- Burton, G. J., Woods, A. W., Jauniaux, E., Kingdom, J. C. Rheological and physiological consequences of conversion of the maternal spiral arteries for uteroplacental blood flow during human pregnancy. Placenta. 30 (6), 473-482 (2009).
- Warrington, J. P., et al. Placental ischemia in pregnant rats impairs cerebral blood flow autoregulation and increases blood-brain barrier permeability. Physiological Reports. 2 (8), e12134-e12134 (2014).
- Warrington, J. P., Drummond, H. A., Granger, J. P., Ryan, M. J. Placental Ischemia-induced increases in brain water content and cerebrovascular permeability: Role of TNFα. Am J Physiol Regul Integr Comp Physiol. 309 (11), R1425-R1431 (2015).
- Johnson, A. C., et al. Magnesium sulfate treatment reverses seizure susceptibility and decreases neuroinflammation in a rat model of severe preeclampsia. PLoS ONE. 9 (11), e113670(2014).
- Escudero, C. A., et al. Role of extracellular vesicles and microRNAs on dysfunctional angiogenesis during preeclamptic pregnancies. Front Physiol. 7, 1-17 (2016).
- Salomon, C., et al. Placental exosomes as early biomarker of preeclampsia: Potential role of exosomalmicrornas across gestation. J Clin Endocrinol Metab. 102 (9), 3182-3194 (2017).
- Knight, M., Redman, C. W., Linton, E. A., Sargent, I. L. Shedding of syncytiotrophoblast microvilli into the maternal circulation in pre-eclamptic pregnancies. Br J Obstet Gynaecol. 105 (6), 632-640 (1998).
- Gilani, S. I., Weissgerber, T. L., Garovic, V. D., Jayachandran, M. Preeclampsia and extracellular vesicles. Curr Hypertens Rep. 18 (9), 68(2016).
- Dutta, S., et al. Hypoxia-induced small extracellular vesicle proteins regulate proinflammatory cytokines and systemic blood pressure in pregnant rats. Clin Sci (Lond). 134 (6), 593-607 (2020).
- Leon, J., et al. Disruption of the blood-brain barrier by extracellular vesicles from preeclampsia plasma and hypoxic placentae: attenuation by magnesium sulfate. Hypertension. 78 (5), 1423-1433 (2021).
- Han, C., et al. Placenta-derived extracellular vesicles induce preeclampsia in mouse models. Haematologica. 105 (6), 1686-1694 (2020).
- Amburgey, O. A., Chapman, A. C., May, V., Bernstein, I. M., Cipolla, M. J. Plasma from preeclamptic women increases blood-brain barrier permeability: role of vascular endothelial growth factor signaling. Hypertension. 56 (5), 1003-1008 (2010).
- Cipolla, M. J., et al. Pregnant serum induces neuroinflammation and seizure activity via TNFalpha. Exp Neurol. 234 (2), 398-404 (2012).
- Bergman, L., et al. Preeclampsia and increased permeability over the blood brain barrier - a role of vascular endothelial growth receptor 2. Am J Hypertens. 34 (1), 73-81 (2021).
- Torres-Vergara, P., et al. Dysregulation of vascular endothelial growth factor receptor 2 phosphorylation is associated with disruption of the blood-brain barrier and brain endothelial cell apoptosis induced by plasma from women with preeclampsia. Biochim Biophys Acta Mol Basis Dis. 1868 (9), 166451(2022).
- Schreurs, M. P., Houston, E. M., May, V., Cipolla, M. J. The adaptation of the blood-brain barrier to vascular endothelial growth factor and placental growth factor during pregnancy. FASEB J. 26 (1), 355-362 (2012).
- Schreurs, M. P., Cipolla, M. J. Cerebrovascular dysfunction and blood-brain barrier permeability induced by oxidized LDL are prevented by apocynin and magnesium sulfate in female rats. J Cardiovasc Pharmacol. 63 (1), 33-39 (2014).
- Schreurs, M. P. H., et al. Increased oxidized low-density lipoprotein causes blood-brain barrier disruption in early-onset preeclampsia through LOX-1. FASEB J. 27 (3), 1254-1263 (2013).
- Escudero, C., et al. Brain vascular dysfunction in mothers and their children exposed to preeclampsia. Hypertension. 80 (2), 242-256 (2023).
- Russell, W. M. S., Burch, R. L. The principles of humane experimental technique. Universities Federation of Animal Welfare. , https://awionline.org/lab-animal-search/russell-w-m-s-burch-r-l-1959-principles-humane-experimental-technique-methuen-co (1959).
- Miller, R. K., et al. Human placental explants in culture: approaches and assessments. Placenta. 26 (6), 439-448 (2005).
- Troncoso, F. A. J., Herlitz, K., Ruiz, F., Bertoglia, P., Escudero, C. Elevated pro-angiogenic phenotype in feto-placental tissue from gestational diabetes mellitus. Placenta. 36 (4), 2(2015).
- Zhang, H. C., et al. Microvesicles derived from human umbilical cord mesenchymal stem cells stimulated by hypoxia promote angiogenesis both in vitro and in vivo. Stem Cells Dev. 21 (18), 3289-3297 (2012).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. Chapter 3 (Unit 3), 22(2006).
- Carroll, R. W., et al. A rapid murine coma and behavior scale for quantitative assessment of murine cerebral malaria. PLoS One. 5 (10), e13124(2010).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio Protoc. 11 (5), e3988(2021).
- Walchli, T., et al. Quantitative assessment of angiogenesis, perfused blood vessels and endothelial tip cells in the postnatal mouse brain. Nat Protoc. 10 (1), 53-74 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Sci Rep. 4, 6588(2014).
- Morita, K., Sasaki, H., Furuse, M., Tsukita, S. Endothelial claudin: claudin-5/TMVCF constitutes tight junction strands in endothelial cells. J Cell Biol. 147 (1), 185-194 (1999).
- Lara, E., et al. Abnormal cerebral microvascular perfusion and reactivity in female offspring of reduced uterine perfusion pressure (RUPP) mice model. J Cereb Blood Flow Metab. 42 (12), 2318-2332 (2022).
- Chang, X., et al. Exosomes from women with preeclampsia induced vascular dysfunction by delivering sflt (soluble fms-like tyrosine kinase)-1 and seng (soluble endoglin) to endothelial cells. Hypertension. 72, 1381-1390 (2018).
- Smarason, A. K., Sargent, I. L., Starkey, P. M., Redman, C. W. The effect of placental syncytiotrophoblast microvillous membranes from normal and pre-eclamptic women on the growth of endothelial cells in vitro. BJOG. 100 (10), 943-949 (1993).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır