Method Article
低酸素性ヒト胎盤由来の小細胞外小胞によるマウス血液脳関門の破壊
* これらの著者は同等に貢献しました
要約
低酸素条件下で培養された胎盤外植片から単離された小型EV(sEV)が、妊娠していない成体雌マウスの血液脳関門を破壊するかどうかを評価するためのプロトコルが提示されています。
要約
脳浮腫、虚血性および出血性脳卒中などの脳血管合併症は、子癇前症に関連する妊産婦死亡率の主な原因を構成しています。これらの脳血管合併症の根本的なメカニズムは不明のままです。しかし、それらは胎盤機能障害と血液脳関門(BBB)破壊に関連しています。それにもかかわらず、これら2つの遠い器官の間の接続はまだ決定されていません。胎盤が細胞外小胞を含むシグナル伝達分子を母体循環に放出することを示唆する証拠が増えている。細胞外小胞は、その大きさによって分類され、小さな細胞外小胞(直径200 nm未満のsEV)は、生理学的および病理学的条件の両方で重要なシグナル伝達粒子と見なされます。子癇前症では、母体循環で循環するsEVの数が増加しますが、そのシグナル伝達機能はよくわかっていません。子癇前症または低酸素症に曝露された正常な妊娠胎盤から放出される胎盤sEVは、脳内皮機能障害とBBBの破壊を誘発します。このプロトコルでは、低酸素条件下で培養された胎盤外植片から単離されたsEVが(子癇前症の1つの側面をモデル化)in vivoでBBBを破壊するかどうかを評価します。
概要
胎盤形成過程の障害、母体の全身性内皮機能障害を特徴とする高血圧性妊娠症候群である子癇前症による妊産婦死亡の約70%1,2は、急性脳血管合併症と関連しています3,4。妊産婦死亡の大半は低・中所得国で発生している5。しかし、子癇前症に関連する脳血管合併症の臨床的および疫学的関連性にもかかわらず、根底にあるメカニズムはまだ不明です。
一方、細胞外小胞(EV)(直径30~400nm)は、母体と胎盤の相互作用を含む組織や臓器間の細胞間コミュニケーションの重要なメディエーターである6。EVは、外面のタンパク質や脂質に加えて、内部に(タンパク質、RNA、脂質)貨物を運びます。EVは、(1)エクソソーム(直径50~150nm、小型EV(sEV)とも呼ばれる)、(2)中型/大型EV、(3)アポトーシス小体に分類され、サイズ、生合成、内容、潜在的なシグナル伝達機能が異なります。EVの組成は、EVの発生源となる細胞と疾患タイプ7によって決まります。合胞体栄養芽細胞由来のEVは、胎盤アルカリホスファターゼ(PLAP)8,9を発現し、胎盤由来の循環小型EV(PDsEV)を検出します。また、PLAPは、子癇前症と正常血圧妊娠におけるPDsEV貨物の変化とその影響を識別するのに役立ちます10,11,12,13,14,15。
胎盤は、子癇前症16またはこの疾患に関連する脳合併症の病態生理学に必要な成分として認識されています17,18,19。しかし、この遠隔器官が脳循環の変化をどのように誘発するかは不明です。sEVは、ドナー細胞からレシピエント細胞に生理活性成分を転移する能力があるため、細胞間コミュニケーションにおいて極めて重要な役割を果たすため6,20,21、胎盤sEVを脳内皮細胞を含む母体内皮機能障害の生成と関連付ける研究が増えています21,22,23,24 25,26子癇前症の女性。したがって、脳内皮機能の低下は、子癇前症に関連する脳血管合併症の重要な要素である血液脳関門(BBB)の破壊につながる可能性があります3,27。
それにもかかわらず、子癇前症の女性の血清に曝露されたラットの脳血管28または子癇前症の女性の血漿に曝露されたヒト脳内皮細胞29を使用した前臨床所見では、循環因子がBBBの破壊を誘発することが報告されています。子癇前症中に母体循環に存在するBBBに害を及ぼす可能性のあるいくつかの候補があるにもかかわらず、炎症性サイトカイン(すなわち、腫瘍壊死因子)18,28または血管調節因子(すなわち、血管内皮増殖因子(VEGF))29,30,31、または酸化リポタンパク質(oxo-LDL)32,33などの酸化分子34、それらのどれも胎盤とBBBの間の直接的な接続を確立しません。最近、低酸素胎盤から単離されたsEVは、妊娠していない雌マウスのBBBを破壊する能力を示しました25。胎盤sEVは、BBBを破壊する能力を持つリストされた循環因子のほとんどを運ぶ可能性があるため、sEVは、損傷した胎盤を接続し、有害な循環因子のキャリアとなり、子癇前症でBBBを破壊するのに適した候補と考えられています。
このプロトコルにより、低酸素条件下で培養した胎盤外植片から単離されたsEVが、子癇前症中の脳合併症の病態生理学を理解するためのプロキシとして、妊娠していない雌マウスのBBBを破壊できるかどうかを調べることができます。
プロトコル
この研究は、ヘルシンキ宣言に明記された原則に従い、それぞれの倫理審査委員会の承認の下で実施されました。以前に報告されたように、すべての人間の参加者は、サンプル収集の前にインフォームドコンセントを行いました25。さらに、ビオビオ大学の生命倫理およびバイオセーフティ委員会は、このプロジェクトを承認しました(Fondecyt助成金1200250)。動物実験は、実験における動物の使用における3つのRの基本原則35、および米国国立衛生研究所が発行した実験動物のケアと使用に関するガイドラインの推奨事項に従って実施されました。動物はビオビオ大学のビバリウムで適切な環境で飼育されました。新鮮な胎盤(n = 4)は、正期産(妊娠38〜41週)の正常な妊娠の母親(28〜31歳)から選択的帝王切開後1時間以内に取得されました。.帝王切開は、以前に報告されたように、チリのチランにあるHerminda Martin Clinical Hospitalで実施されました25。in vivoモデルを適用するために、4-6ヶ月齢の雌の妊娠していないマウス(C57BLACK/6系統)を用いた。(1)対照群(無治療)、(2)正常酸素由来sEV(sEVs-Nor)、(3)低酸素培養胎盤由来sEV(sEVs-Hyp)の3つの実験群に分けられ、in vivoでのBBBの破壊評価に用いられた25。注入された溶液はすべて無菌でした。また、sEVの調製は、汚染を避けるために、無菌状態およびクラスIIのバイオセーフティフードの下で行われました。
1.胎盤培養外植片
- 正常な妊娠胎盤の外植片を抽出するには、Miller et al. 200536によって発表された方法を確認してください。
- 滅菌された鉗子を使用して、ヒト胎盤の基底板から血栓を慎重に取り除きます。小さな外植片を抽出して、10gの最終組織抽出を得る。
- 胎盤外植片が胎盤の母体部分の4象限から除去されていることを確認してください。活力を失った組織と石灰化した領域が除外されていることを確認してください。
- 胎盤組織を操作するには、氷上、無菌条件下、バイオセーフティキャビネット内で行います。
- 外植片を多量(5容量の外植片)の冷たい(4°C)リン酸緩衝液(PBS 1x、pH 7.4)で洗浄し(少なくとも3回)、できるだけ多くの血液を除去します。遠心分離機(252 x g で10分間)を室温で洗浄します。
- 洗浄した外植片10 gを、2%ウシ胎児血清、ペニシリン100 IU/mL、ストレプトマイシン100 μg/mLを添加した培地20 mLに再懸濁します( 材料表を参照)。
- 懸濁液を100mmの培養皿に入れます。外植片を21%の酸素と5%のCO2を含む37°Cのインキュベーターに2時間放置します。
- その後、外植片を1x PBSで37°C(3回)で再洗浄します。遠心分離機(252 x g で10分間)を室温で洗浄します。
- さらに、ナノ粒子を枯渇させた20mLの培養液に組織を再懸濁する。
注:ナノ粒子の枯渇には、超遠心分離(室温で18時間120,000 x g )および精密ろ過(0.22 μmフィルター)を行ってください。 - 再懸濁した外植片を2つの培養皿(100 mm)に分割します。各培養皿には、再懸濁した外植片を10 mL含んでいる必要があります。
- その後、胎盤外植片を含む皿の1つを標準的な培養条件(37°C、8%酸素および5%CO2)に置き、もう1つを1%O2の低酸素チャンバーに入れます。
注:(オプション)組織生存率の分析は、他の場所で説明したのと同じ組織抽出および3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロマイドアッセイ(MTTアッセイ)を使用して実行できます37,38。外植片ホモジネートで測定された総タンパク質濃度を使用して、MTT値を正規化します。 - 18時間培養した後、外植片の馴化培地を新しい15 mLチューブに収穫します。
注意: このステップでは、コンディショニングした培地を長期間(数週間)凍結(-80°C)することができます。
2. 胎盤由来sEVの単離
- 以前に発表されたレポート25,39に従って、差動遠心分離および精密ろ過プロトコルを使用して、調整された培地からsEVを分離します。
- 回収した馴化培地に対して逐次遠心分離を行います。遠心分離の連続ステップは、(1)300 x g で10分、(2)2000 x g で10分、(3)10,000 x g で30分、(4)120,000 x g で2時間です。遠心分離は室温で行います。
- これらすべての遠心分離では、20〜100μLのピペットを使用して、上清を慎重に回収し、ペレットを廃棄します。
- 完了したら、最後に採取した上清を0.22 μmフィルターに通します( 材料表を参照)。続いて、室温で120,000 x g で18時間、さらに遠心分離を1回行います。
- その後、胎盤sEVを含むペレットを500μLのPBS(pH7.4)に再懸濁させながら上清を捨て、再度0.22μmのフィルターを通します。最後に、室温で120,000 x g で3時間遠心分離を行います。
- 次に、胎盤sEVを含むペレットを500 μLのPBS(pH 7.4、以前にsEVを枯渇させたもの)に再懸濁し、0.22 μmフィルターに通します。
- サンプルに sEVs-Normoxia (sEVs-Nor) または sEVs-Hypoxia (sEVs-Hyp) のストックとしてラベルを付けます。
注:さらなる実験のために、単離されたsEVのアリコートを50〜100μL調製します。小型EVは-80°Cで長期間(数ヶ月)保管できます。 - 以前に報告されたように、胎盤のsEVをサイズ、数、およびsEVsタンパク質マーカーで特徴付けます25.sEVの理想的な平均粒子径は50〜150nmです。
注:sEVの特性評価には、CD63、Tsg101、Alix、およびHSP70の陽性検出が含まれます(つまり、エクソソームが豊富なsEV集団を特徴付けるため)。また、胎盤起源のマーカーとしてPLAPを使用する25。 - メーカーの指示に従って、BCAタンパク質アッセイキットを使用して、sEV溶液中のタンパク質の総量を測定します( 材料表を参照)。
注: 図1 は、胎盤外植片培養と細胞外小胞の単離の概要を示しています。
3.マウス注射
- 5%のイソフルラン分布の麻酔導入チャンバーで動物を麻酔します(材料表を参照)。つま先をつまんで麻酔のレベルを確認します。
- ~40秒後、フェイスマスクを使用してマウスを麻酔システムに入れ、麻酔レベルを2%イソフルランに維持します。
- 次に、動物を28°Cの室温で加熱プラットフォーム( 材料表を参照)に置きます。 人工涙液で目を滑らかにしてください。
- 注射する前に、胎盤sEV(総タンパク質200 μg)をリン酸緩衝液(pH、7.4)で最終容量が70 μLになるまで希釈します。
- 70%エタノールと綿棒を使用して注射部位を消毒します。必ず30Gの針が付いたインスリン注射器を使用して、sEVs溶液を注入してください。
注:シリンジを加熱プラットフォームに5分間配置して、生理学的温度を取得できます。 - 次に、溶液を外頸静脈に注入します。このステップには特別なトレーニングが必要です。
注意: この手順は、ゆっくりと針を引っ込め、血液逆流の証拠まで穏やかに吸引して、慎重に実行する必要があります。 - 注入後、乾いた綿棒で注入部位に~15秒間軽い圧力をかけます。その後、動物をそれぞれのケージに戻します。
- 意識と行動を15分間評価してください。意識達成の指標は、総運動活動の動物の回復です。
注意: 動物のケージ内は必ず温かい温度に保ってください。
4.急速マウス昏睡および行動スケール(RMCBS)
- RMCBSを使用して、動物の神経学的および幸福のパラメータを評価します40。
注:RMCBSは、オペレーターの介入による動物のストレスを最小限に抑えながら、迅速な評価(~3分)を可能にします。RMCBS には 10 個のパラメーターがあります (各スコアは 0 から 2)。 - RMCBS スケールで 0 時間 (sEV を注入する前) と注射後 3 時間、6 時間、12 時間、24 時間でマウスの健康状態を評価します。
注:クローディン-5(sEVs注射後6時間)およびEvanの青色血管外漏出(sEVs注射後24時間)の分析を行い、BBBの破壊を評価します(図2)。
5. エヴァンの青色血管外漏出の解析
- 胎盤sEVs注射(24時間)後、ステップ3.1の説明に従ってマウスに麻酔をかけます。
- Evan's Blue溶液(2%、リン酸緩衝液で希釈、1x)を調製します( 材料表を参照)。
- 眼窩後アクセス25を使用して、Evan's Blue溶液を2 mL/kgで注入します。
- エヴァンの青い溶液を麻酔の維持下で20分間循環させます。.
- 次に、前述のプロトコル41 に従って生理食塩水 (~3 mL、0.9%、w/v) を使用して心臓内灌流を行い、循環から Evan の青色染料を除去します。この手順は必須です。
注:この手順では、麻酔を5%に増やし、麻酔の深い平面を確認します(つまり、呼吸数の大幅な減少)。 - 内側開胸術41で心臓を露出させる(図3)。
- その後、パラホルムアルデヒド溶液(PBS中4%、v / v)の心臓内注入で動物全体を固定します。
注意: 適切な固定を監視するために、テールの剛性を確認してください。 - さらに、固定が完了したら、慎重に脳を抽出し、重量を量り、写真に収める41。脳全体を定規42に近づけて写真を撮る。
- 次に、脳を脳マウススライサーに入れます( 材料表を参照)。
- 脳を小脳を含むクレーン尾側の9つのセクション(各セクション100μm)に解剖します。
- 解剖後、ステレオズーム顕微鏡で脳スライスの画像を視覚化してキャプチャします( 材料表を参照)。
- 撮影した画像を使用して、ImageJ ソフトウェアを使用して Evan の青色外漏出を定量化します ( 材料表を参照)。
注:エヴァンの青色色素の存在を分析するには、脳切片のポジティブコントロール(色素を注射したが心臓内灌流を行わない動物対照動物から)を使用してエヴァンの青色値を設定します。ポジティブコントロールから到達したEvanの青の値は、青チャンネルの強度ヒストグラムで一般的に75〜110です(図4)。 - 観察者のバイアスを避けるために、それぞれの実験グループによって脳画像が盲目的に分析されるようにします。あるいは、脳の均質化とそれに続く分光法によって、エヴァンの青色血管外漏出を定量化する43。
注:別の実験では、sEVを注入したマウスから新たに単離した脳(6時間)を用いて、BBB44の気密性に関与する重要なタイトジャンクションであるクローディン5(CLND-5)(資料表を参照)のタンパク質レベルを分析します(図5)。
結果
このプロトコルは、低酸素状態で培養された胎盤に由来するsEVsが、妊娠していないマウスのBBBを破壊する能力を評価します。この方法により、正常状態と病理学的状態における胎盤と脳の間の潜在的な接続をよりよく理解することができます。特に、この方法は、子癇前症における脳合併症の発症における胎盤sEVの関与を分析するためのプロキシを構成する可能性があります。
sEVs-Norを注射したマウスとは対照的に、sEVs-Hypを注射したマウスは、24時間まで神経学的スコアの漸進的な低下を示し(表1)、sEVs-Hypが脳機能を損なう能力を示唆しています。
また、sEVs-Hypを注射した群のマウスの脳は、sEVs-Norを注射したマウスまたは対照マウスから単離したマウスよりも高い新鮮重量(それぞれ0.51±0.008;0.46±0.008;0.47±0.01g)を有しており、これは脳浮腫の肉眼的指標を構成する可能性がある45。
この発見と互換性があり、このプロトコルにより、エヴァンの青色の血管外漏出をBBBの破壊の指標として識別できます。この点で、sEVs-Hypを注射したマウスの脳は、sEVs-Nor群の脳よりもEvanの青色血管外漏出が高かった(図5A)。
sEVs-Hypによって誘導されるBBBの破壊の根本的なメカニズムは、このプロトコルでは分析されていませんが、結果は、sEVs-Hypを注入したマウスが、BBBが最も影響を受けた領域(すなわち、後部領域)でCLND-5のタンパク質量の減少を示したことも示しています(図5B)。したがって、sEVs-hypは、この重要な内皮タイトジャンクションタンパク質の機能発現を損なう可能性があります。
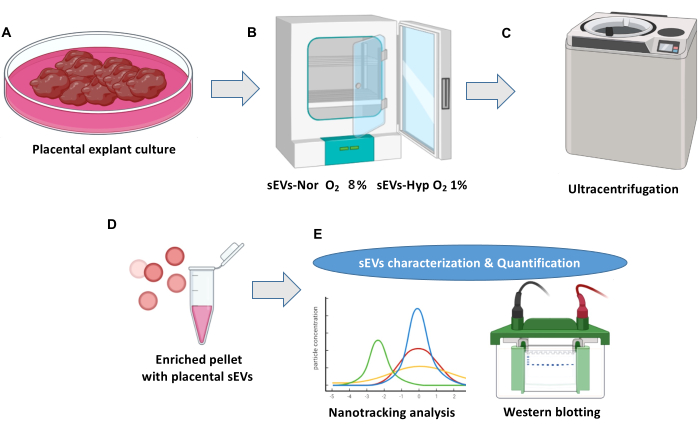
図1:胎盤外植片培養および細胞外小胞分離プロトコル。 (A)正常な胎盤外植片培養。(B)外植片は、胎盤小細胞外小胞(sEV)の生合成のために2つの条件に分布しています。ノルモキシア(sEVs-Nor、8%O2)または低酸素(sEVs-Hyp、1%O2)を18時間。 (C)馴化培地を回収し、濾過し、遠心分離して細胞破片を除去する。(D)sEVは超遠心分離によって単離されます。(E)sEVは、ナノトラッキング分析とウェスタンブロットを使用して特性評価されます。 この図の拡大版をご覧になるには、ここをクリックしてください。

図2:血液脳関門破壊プロトコルの in vivo 評価。 妊娠していないC57BL6/Jマウス(生後4〜6ヶ月)を使用します。(A)外頸静脈を介して、動物は正常酸素性(sEVs-Nor、8%O2)または低酸素性(sEVs-Hyp、1%O2)胎盤培養から単離されたsEV(総タンパク質200μg)を投与された。RMCBSは、注射後0〜24時間で監視されます。(B)sEVs注射の6時間後、脳を抽出し、タンパク質抽出のために9つのセグメントに分割します。クローディン 5(CLDN5)は、これら 9 つのセクションのホモジネートで分析されます。(C)Evanの青色血管外漏出解析(sEVs注入後24時間)は、9つのセグメントのそれぞれで眼窩後穿刺注入後に分析されました。 この図の拡大版をご覧になるには、ここをクリックしてください。
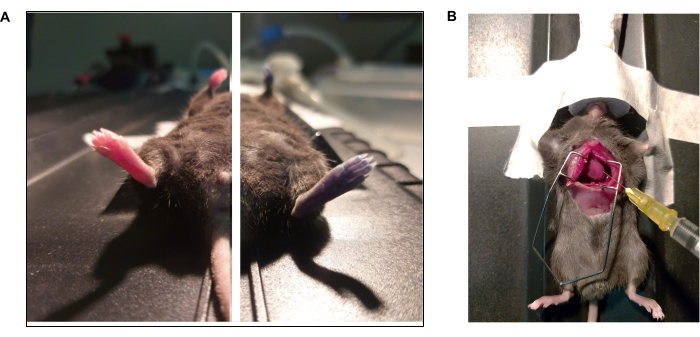
図3:Evanの青色染料と心臓内灌流プロトコルの写真ドキュメンタリー。 (A)マウスは、眼窩後注射でエヴァンの青色を投与された。(写真左)エヴァンズブルーの注射前と注射後(右)の動物(右)。(B)リン酸緩衝液(1x PBS)およびパラホルムアルデヒド(4%PFA)の心臓内灌流を実施するための開胸術。左心室は針の先で尖っています。 この図の拡大版をご覧になるには、ここをクリックしてください。

図4:sEV注入後のEvanの青色血管外漏出の解析。 (A)Evanの青色血管外漏出を示す脳全体の代表的な画像。破線は、脳全体から得られた9つのセクションを表しています。(B)脳マウススライサーを用いて解剖した脳。(C)sEVs注射後24時間における脳スライスの代表画像。コントロール(CTL)、正常酸素状態(sEVs-Nor)または低酸素状態(sEVs-Hyp)の胎盤。スケールバー = 0.4 cm。 (D) ImageJを用いた脳スライスのデジタルアウトライン。(E)青チャンネルのヒストグラム。75 から 110 の間の値は、エヴァンの青色の血管外漏出に関連しています。 この図の拡大版をご覧になるには、ここをクリックしてください。

図5:胎盤外植片から単離されたsEVを注射したマウスにおけるEvanの青色血管外漏出とクローディン-5レベル。 (A)脳切片全体を考慮したエヴァンの青色(EB)血管外漏出の割合。コントロール(CTL、青)、正常酸素状態(sEVs-Nor、赤)または低酸素状態(sEVs-Hyp、緑)の胎盤。(B)9つの脳切片におけるクローディン5(CLDN5)の相対レベルは、3つの実験グループから得られた。β-アクチンはローディングコントロールとして使用されます。値は四分位範囲±平均値です。各ドットは、個々の実験対象を表します。*p < 0.05、**p < 0.005。p < 0.0001 です。p < 0.001;ANOVA検定とそれに続くBonferroni事後検定。 この図の拡大版をご覧になるには、ここをクリックしてください。
| 時間(h) | コントロール | sEVs-ノルモクシア | sEV-低酸素症 | ANOVA(分散分析) |
| 0 | 18.75 ± 0.250 | 18.5±0.288 | 18.75 ± 0.250 | NSの |
| 3 | 18.5±0.866 | 17±0.707 | 13.25 ± 1.750*α | 0.006 |
| 6 | 19.25 ± 0.750 | 17±0.577 | 11.75 ± 1.250*α | 0.002 |
| 12 | 18.5±0.645 | 16.75±1.109 | 13 ± 0.816*α | 0.001 |
| 24 | 19.5±0.288 | 17.75 ± 0.250 | 10.25 ± 0.853*α | <0.0001 |
| *p <対照に対して0.01。αp < 0.01 対 sEVs-Normoxia | ||||
表1:sEVs注射後24時間後の急速マウス昏睡および行動スケール(RMCBS)。 スコアはSEM±平均値として表されます。 20に最も近い動物のスコアは標準であり、スコアが低いほどCNSの機能障害が高くなります。
ディスカッション
この研究は、低酸素状態で培養した胎盤外植片から分離されたsEVがげっ歯類の血液脳関門の破壊に及ぼす潜在的な害に関する新たな洞察を明らかにしています。病理学的メカニズムは、後脳領域25におけるCLND-5の減少を含む。
以前の研究では、子癇前症の個人からの血漿sEVがさまざまな臓器の内皮機能障害を誘発することが明らかになりました in vitroモデル46,47。この研究では、特に血液脳関門を精査し、この重要な障壁を破壊する低酸素培養胎盤から分離されたsEVに新しい視点を提供しました。これらの発見は、sEVが子癇前症のような正常なシナリオと病理学的シナリオの両方で胎盤と脳の間のコミュニケーションチャネルとして機能する可能性があるという新しい研究領域を導入します。
提示されたプロトコルは単純ですが、いくつかの重要なステップについて言及する必要があります。このプロトコルでは、分娩後1時間以内に新鮮な胎盤が必要です。また、組織の劣化を防ぐために、培養期間を24時間を超えて延長することはお勧めしません。このプロトコルは、マウス胎盤によって産生されるsEVからの潜在的な汚染を軽減します。Evanの青色血管外漏出のデジタル解析には時間がかかります。さらに、エヴァンの青い染色は、脳の切片化後はあまり目立ちません。したがって、ポジティブコントロールを使用して青の範囲を識別するための初期設定が推奨されます。エヴァンの青色注射を受けていないマウスの脳などのネガティブコントロールも採用できます。実験群のブラインド分析は、潜在的な観察者のバイアスを回避するために不可欠です。
このプロトコルでは、いくつかの課題が発生する可能性があります。重大な制限は、ヒト胎盤と注射マウスの両方に由来する生物学的多様性にあります。Evanの青色血管外漏出実験の再現性を確保するために、ヒト胎盤から単離されたsEV用量を確立することが提案されています。総タンパク質200μgの用量を選択しました。ただし、この量は、小胞の純度、頸静脈注射の有効性、エヴァンの青色投与、循環器系からのクリアランス、および特に、その内容物を考慮したsEVの生物学的影響に基づいて変動する可能性があります。
ヒト胎盤由来のsEVが血液脳関門を破壊する細胞メカニズムについては、さらなる実験が必要である。それにもかかわらず、この方法は関連性があり、胎盤と脳の間の潜在的なコミュニケーションを示唆しており、さらなる調査が必要です。したがって、今後の研究が奨励されており、sEVとその血液脳関門との相互作用、およびそれらの貨物が神経組織に与える影響に焦点を当てています。血液脳関門障害が母体の脳に永続的な影響をもたらすかどうかは、さらなる検討が必要である。
開示事項
著者は、宣言すべき利益相反を持っていません。
謝辞
著者らは、貴重な情報を提供してくれたGRIVAS Healthの研究者に感謝します。また、産婦人科の助産師と臨床スタッフは、チリのチヤン病院に所属しています。Fondecyt Regular 1200250によって設立されました。
資料
| Name | Company | Catalog Number | Comments |
| Adult mice brain slecer matrice 3D printed | Open access file | Adult mice | Adult mice brain slicer. Printed in PLA filament. |
| Anti β-Actin primary antibody | Sigma-Aldrich | Clon AC-74 | Antibody for loading control (Western blot) |
| Anti-Claudin5 primary antibody | Santa cruz Biotechnology | sc-374221 | Primary antibody for tight junction protein CLDN5 of mice BBB (Western blot) |
| BCA protein kit | Thermo Scientific | 23225 | Kit for measuring protein concentration |
| Culture media #200 500 mL | Thermo Fisher Scientific | m200500 | Culture media for placental explants |
| D180 CO2 incubator | RWD Life science | D180 | Standard incubator to estabilize explants and culture sEVs-Nor |
| Evans blue dye > 75% 10 g | Sigma-Aldrich | E2129.10G | Dye to analize blood brain barrier disruption IN VIVO |
| Fetal bovine serum 500 mL | Thermo Fisher Scientific | 16000044 | Additive growth factor for culture media 200 |
| Himac Ultracentrifuge CP100NX | Himac eppendorf group | 5720410101 | Ultracentrifuge for condicioned media > 1,20,000 x g |
| ImageJ software | NIH | https://imagej.nih.gov/ij/download.html | |
| Isoflurane x 100 mL | USP Baxter | 212-094 | Volatile inhalated anaesthesia agent for mice |
| Kit CellTiter 96 Non-radioactive | Promega | 0000105232 | In vitro assay for placental explants viability |
| Mouse IgG Secondary antibody | Thermo Fisher Scientific | MO 63103 | Secondary antibody for CLDN5 (western blot) |
| NanoSight NS300 | Malvern Panalytical | 90278090 | Nanotracking analysis of particles from placental explants condicioned media |
| Paraformaldehide E 97% solution 500 mL | Thermo Fisher Scientific | A11313.22 | Fixative solution for brain tissue slices and intracardial perfusion (once diluted) |
| PBS 1 X pH 7.4 500 mL | Thermo Fisher Scientific | 10010023 | Wash solution for placenta explants |
| Peniciline-streptomicine 100x 20 mL | Thermo Fisher Scientific | 10378016 | Antiobiotics for placental explants culture media |
| ProOX C21 Cytocentric O2 and CO2 Subchamber Controller | BioSpherix | SCR_021131 | CO2 regulator to induce Hypoxia in sealed chamber for sEVs-Hyp |
| Sodium Thiopental 1 g | Chemie | 7061 | humanitarian euthanasia agent |
| Somnosuite low flow anesthesia system | Kent Scientifics | SS-01 | Isoflurane vaporizer for small rodents |
| Surgical Warming platform | Kent Scientifics | A41166 | Warming platform for mainteinance anesthesia in mice |
| Syringe Filters, Polytetrafluoroethylene (PTFE), Hydrophobic, 0.22 µm, Sterile, 25 mm | Southern labware | 10026 | Filtration of condicioned media harvested from placental explants |
| Tabletop High-Speed Micro Centrifuges HITACHI himac CT15E/CT15RE | Hitachi medical systems | 6020 | Serial centrifugations of condicioned media < 1,20, 000 x g |
| Trinocular stereomicroscope transmided and reflective light 10x-160x | Center Medical | 2597 | Stereomicroscope to register brain slices |
参考文献
- Lisonkova, S., Joseph, K. S. Incidence of preeclampsia: risk factors and outcomes associated with early- versus late-onset disease. Am J Obstet Gynecol. 209 (544), 544.e1-544.e12 (2013).
- Sibai, B., Dekker, G., Kupferminc, M. Preeclampsia. Lancet. 365 (9461), 785-799 (2005).
- Hammer, E. S., Cipolla, M. J. Cerebrovascular dysfunction in preeclamptic pregnancies. Curr Hypertens Rep. 17 (8), 64(2015).
- Okanloma, K. A., Moodley, J. Neurological complications associated with the preeclampsia/eclampsia syndrome. Int J Gynaecol Obstet. 71, 223-225 (2000).
- Frias, A. E., Belfort, M. A. Post magpie: how should we be managing severe preeclampsia. Curr Opin Gynecol Obstet. 15 (6), 489-495 (2003).
- Familari, M., Cronqvist, T., Masoumi, Z., Hansson, S. R. Placenta-derived extracellular vesicles: Their cargo and possible functions. Reprod Fertil Dev. 29 (3), 433-447 (2017).
- Montoro-Garcia, S., Shantsila, E., Marin, F., Blann, A., Lip, G. Y. Circulating microparticles: new insights into the biochemical basis of microparticle release and activity. Basic Res Cardiol. 106, 911-923 (2011).
- Germain, S. J., Sacks, G. P., Sooranna, S. R., Sargent, I. L., Redman, C. W. Systemic inflammatory priming in normal pregnancy and preeclampsia: the role of circulating syncytiotrophoblast microparticles. J Immunol. 178 (9), 5949-5956 (2007).
- Tannetta, D., Masliukaite, I., Vatish, M., Redman, C., Sargent, I. Update of syncytiotrophoblast derived extracellular vesicles in normal pregnancy and preeclampsia. J Reprod Immunol. 119, 98-106 (2017).
- Collett, G. P., Redman, C. W., Sargent, I. L., Vatish, M. Endoplasmic reticulum stress stimulates the release of extracellular vesicles carrying danger-associated molecular pattern (DAMP) molecules. Oncotarget. 9 (6), 6707-6717 (2018).
- Cooke, W. R., et al. Maternal circulating syncytiotrophoblast-derived extracellular vesicles contain biologically active 5'-tRNA halves. Biochem Biophys Res Commun. 518 (1), 107-113 (2019).
- Gill, M., et al. Placental syncytiotrophoblast-derived extracellular vesicles carry active nep (neprilysin) and are increased in preeclampsia. Hypertension. 73 (5), 1112-1119 (2019).
- Kandzija, N., et al. Placental extracellular vesicles express active dipeptidyl peptidase IV; levels are increased in gestational diabetes mellitus. J Extracell Vesicles. 8 (1), 1617000(2019).
- Motta-Mejia, C., et al. Placental vesicles carry active endothelial nitric oxide synthase and their activity is reduced in preeclampsia. Hypertension. 70 (2), 372-381 (2017).
- Sammar, M., et al. Reduced placental protein 13 (PP13) in placental derived syncytiotrophoblast extracellular vesicles in preeclampsia - A novel tool to study the impaired cargo transmission of the placenta to the maternal organs. Placenta. 66, 17-25 (2018).
- Burton, G. J., Woods, A. W., Jauniaux, E., Kingdom, J. C. Rheological and physiological consequences of conversion of the maternal spiral arteries for uteroplacental blood flow during human pregnancy. Placenta. 30 (6), 473-482 (2009).
- Warrington, J. P., et al. Placental ischemia in pregnant rats impairs cerebral blood flow autoregulation and increases blood-brain barrier permeability. Physiological Reports. 2 (8), e12134-e12134 (2014).
- Warrington, J. P., Drummond, H. A., Granger, J. P., Ryan, M. J. Placental Ischemia-induced increases in brain water content and cerebrovascular permeability: Role of TNFα. Am J Physiol Regul Integr Comp Physiol. 309 (11), R1425-R1431 (2015).
- Johnson, A. C., et al. Magnesium sulfate treatment reverses seizure susceptibility and decreases neuroinflammation in a rat model of severe preeclampsia. PLoS ONE. 9 (11), e113670(2014).
- Escudero, C. A., et al. Role of extracellular vesicles and microRNAs on dysfunctional angiogenesis during preeclamptic pregnancies. Front Physiol. 7, 1-17 (2016).
- Salomon, C., et al. Placental exosomes as early biomarker of preeclampsia: Potential role of exosomalmicrornas across gestation. J Clin Endocrinol Metab. 102 (9), 3182-3194 (2017).
- Knight, M., Redman, C. W., Linton, E. A., Sargent, I. L. Shedding of syncytiotrophoblast microvilli into the maternal circulation in pre-eclamptic pregnancies. Br J Obstet Gynaecol. 105 (6), 632-640 (1998).
- Gilani, S. I., Weissgerber, T. L., Garovic, V. D., Jayachandran, M. Preeclampsia and extracellular vesicles. Curr Hypertens Rep. 18 (9), 68(2016).
- Dutta, S., et al. Hypoxia-induced small extracellular vesicle proteins regulate proinflammatory cytokines and systemic blood pressure in pregnant rats. Clin Sci (Lond). 134 (6), 593-607 (2020).
- Leon, J., et al. Disruption of the blood-brain barrier by extracellular vesicles from preeclampsia plasma and hypoxic placentae: attenuation by magnesium sulfate. Hypertension. 78 (5), 1423-1433 (2021).
- Han, C., et al. Placenta-derived extracellular vesicles induce preeclampsia in mouse models. Haematologica. 105 (6), 1686-1694 (2020).
- Amburgey, O. A., Chapman, A. C., May, V., Bernstein, I. M., Cipolla, M. J. Plasma from preeclamptic women increases blood-brain barrier permeability: role of vascular endothelial growth factor signaling. Hypertension. 56 (5), 1003-1008 (2010).
- Cipolla, M. J., et al. Pregnant serum induces neuroinflammation and seizure activity via TNFalpha. Exp Neurol. 234 (2), 398-404 (2012).
- Bergman, L., et al. Preeclampsia and increased permeability over the blood brain barrier - a role of vascular endothelial growth receptor 2. Am J Hypertens. 34 (1), 73-81 (2021).
- Torres-Vergara, P., et al. Dysregulation of vascular endothelial growth factor receptor 2 phosphorylation is associated with disruption of the blood-brain barrier and brain endothelial cell apoptosis induced by plasma from women with preeclampsia. Biochim Biophys Acta Mol Basis Dis. 1868 (9), 166451(2022).
- Schreurs, M. P., Houston, E. M., May, V., Cipolla, M. J. The adaptation of the blood-brain barrier to vascular endothelial growth factor and placental growth factor during pregnancy. FASEB J. 26 (1), 355-362 (2012).
- Schreurs, M. P., Cipolla, M. J. Cerebrovascular dysfunction and blood-brain barrier permeability induced by oxidized LDL are prevented by apocynin and magnesium sulfate in female rats. J Cardiovasc Pharmacol. 63 (1), 33-39 (2014).
- Schreurs, M. P. H., et al. Increased oxidized low-density lipoprotein causes blood-brain barrier disruption in early-onset preeclampsia through LOX-1. FASEB J. 27 (3), 1254-1263 (2013).
- Escudero, C., et al. Brain vascular dysfunction in mothers and their children exposed to preeclampsia. Hypertension. 80 (2), 242-256 (2023).
- Russell, W. M. S., Burch, R. L. The principles of humane experimental technique. Universities Federation of Animal Welfare. , https://awionline.org/lab-animal-search/russell-w-m-s-burch-r-l-1959-principles-humane-experimental-technique-methuen-co (1959).
- Miller, R. K., et al. Human placental explants in culture: approaches and assessments. Placenta. 26 (6), 439-448 (2005).
- Troncoso, F. A. J., Herlitz, K., Ruiz, F., Bertoglia, P., Escudero, C. Elevated pro-angiogenic phenotype in feto-placental tissue from gestational diabetes mellitus. Placenta. 36 (4), 2(2015).
- Zhang, H. C., et al. Microvesicles derived from human umbilical cord mesenchymal stem cells stimulated by hypoxia promote angiogenesis both in vitro and in vivo. Stem Cells Dev. 21 (18), 3289-3297 (2012).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. Chapter 3 (Unit 3), 22(2006).
- Carroll, R. W., et al. A rapid murine coma and behavior scale for quantitative assessment of murine cerebral malaria. PLoS One. 5 (10), e13124(2010).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio Protoc. 11 (5), e3988(2021).
- Walchli, T., et al. Quantitative assessment of angiogenesis, perfused blood vessels and endothelial tip cells in the postnatal mouse brain. Nat Protoc. 10 (1), 53-74 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Sci Rep. 4, 6588(2014).
- Morita, K., Sasaki, H., Furuse, M., Tsukita, S. Endothelial claudin: claudin-5/TMVCF constitutes tight junction strands in endothelial cells. J Cell Biol. 147 (1), 185-194 (1999).
- Lara, E., et al. Abnormal cerebral microvascular perfusion and reactivity in female offspring of reduced uterine perfusion pressure (RUPP) mice model. J Cereb Blood Flow Metab. 42 (12), 2318-2332 (2022).
- Chang, X., et al. Exosomes from women with preeclampsia induced vascular dysfunction by delivering sflt (soluble fms-like tyrosine kinase)-1 and seng (soluble endoglin) to endothelial cells. Hypertension. 72, 1381-1390 (2018).
- Smarason, A. K., Sargent, I. L., Starkey, P. M., Redman, C. W. The effect of placental syncytiotrophoblast microvillous membranes from normal and pre-eclamptic women on the growth of endothelial cells in vitro. BJOG. 100 (10), 943-949 (1993).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved