Method Article
Alteración de la barrera hematoencefálica del ratón por pequeñas vesículas extracelulares de placentas humanas hipóxicas
* Estos autores han contribuido por igual
En este artículo
Resumen
Se presenta un protocolo para evaluar si los pequeños VE (sEV) aislados de explantes placentarios cultivados en condiciones hipóxicas (modelando un aspecto de la preeclampsia) alteran la barrera hematoencefálica en ratones hembra adultos no preñados.
Resumen
Las complicaciones cerebrovasculares, como el edema cerebral y el accidente cerebrovascular isquémico y hemorrágico, constituyen la principal causa de mortalidad materna asociada a la preeclampsia. Los mecanismos subyacentes de estas complicaciones cerebrovasculares siguen sin estar claros. Sin embargo, están relacionados con la disfunción placentaria y la alteración de la barrera hematoencefálica (BBB). Sin embargo, la conexión entre estos dos órganos distantes aún se está determinando. Cada vez hay más pruebas que sugieren que la placenta libera moléculas de señalización, incluidas vesículas extracelulares, en la circulación materna. Las vesículas extracelulares se clasifican según su tamaño, siendo las pequeñas vesículas extracelulares (sEVs de menos de 200 nm de diámetro) consideradas partículas críticas de señalización tanto en condiciones fisiológicas como patológicas. En la preeclampsia, hay un mayor número de EV circulantes en la circulación materna, cuya función de señalización no se comprende bien. Las EV placentarias liberadas en la preeclampsia o de placentas normales del embarazo expuestas a hipoxia inducen disfunción endotelial cerebral y alteración de la BHE. En este protocolo, evaluamos si los sEV aislados de explantes placentarios cultivados en condiciones hipóxicas (modelando un aspecto de la preeclampsia) alteran la BHE in vivo.
Introducción
Aproximadamente 70% de las muertes maternas debidas a preeclampsia, un síndrome de embarazo hipertensivo caracterizado por alteración de los procesos de placentación, disfunción endotelial sistémica materna y, en casos graves, falla multiorgánica 1,2, se asocian con complicaciones cerebrovasculares agudas 3,4. La mayoría de las muertes maternas ocurren en países de ingresos bajos y medianos5. Sin embargo, los mecanismos subyacentes aún no están claros a pesar de la relevancia clínica y epidemiológica de las complicaciones cerebrovasculares asociadas con la preeclampsia.
Por otro lado, las vesículas extracelulares (VE) (diámetro ~30-400 nm) son mediadores esenciales de la comunicación intercelular entre tejidos y órganos, incluyendo la interacción madre-placenta6. Además de las proteínas y los lípidos de la superficie externa, los VE transportan carga en su interior (proteínas, ARN y lípidos). Los VE se pueden clasificar en (1) exosomas (diámetro ~50-150 nm, también llamados VE pequeños (sEV)), (2) EV medianos/grandes y (3) cuerpos apoptóticos, que difieren por tamaño, biogénesis, contenido y función de señalización potencial. La composición de las VE está determinada por las células de las que proceden y por el tipo de enfermedad7. Las VE derivadas de sincitiotrofoblastos expresan fosfatasa alcalina placentaria (PLAP)8,9, que detecta pequeñas VE circulantes derivadas de placenta (PDsEV) en el embarazo. Además, el PLAP ayuda a discernir los cambios en la carga de PDsEVs y sus efectos en la preeclampsia versus embarazos normotensos 10,11,12,13,14,15.
La placenta ha sido reconocida como el componente necesario en la fisiopatología de la preeclampsia16 o complicaciones cerebrales asociadas a esta enfermedad 17,18,19. Sin embargo, se desconoce cómo este órgano distante podría inducir alteraciones en la circulación cerebral. Dado que los sEV desempeñan un papel fundamental en la comunicación de célula a célula debido a su capacidad para transferir componentes bioactivos de las células donantes a las receptoras 6,20,21, un número creciente de estudios han asociado los sEV placentarios con la generación de disfunción endotelial materna 21,22,23,24, incluidas las células endoteliales cerebrales 25,26en mujeres con preeclampsia. Por lo tanto, el compromiso de la función endotelial cerebral puede conducir a la alteración de la barrera hematoencefálica (BHE), un componente crítico en las complicaciones cerebrovasculares asociadas a la preeclampsia 3,27.
Sin embargo, los hallazgos preclínicos utilizando vasos cerebrales de rata expuestos al suero de mujeres con preeclampsia28 o células endoteliales cerebrales humanas expuestas al plasma de mujeres con preeclampsia29 informaron que los factores circulantes inducen la alteración de la BHE. A pesar de que existen varios candidatos con potencial para dañar la BHE presente en la circulación materna durante la preeclampsia, como niveles elevados de citocinas proinflamatorias (i.e., factor de necrosis tumoral)18,28 o reguladores vasculares (i.e., factor de crecimiento endotelial vascular (VEGF))29,30,31, o moléculas oxidativas como las lipoproteínas oxidadas (oxo-LDL)32,33, entre otros34, ninguno de ellos establece una conexión directa entre la placenta y la BHE. Recientemente, los sEV aislados de placentas hipóxicas han demostrado la capacidad de alterar la barrera hematoencefálica en ratones hembra no preñados25. Dado que los SEV placentarios pueden transportar la mayoría de los factores circulantes enumerados con la capacidad de alterar la BHE, los SEV se consideran candidatos adecuados para conectar la placenta lesionada, ser portadores de factores circulantes dañinos y alterar la BHE en la preeclampsia.
Este protocolo nos permite investigar si los sEV aislados de explantes placentarios cultivados en condiciones hipóxicas pueden alterar la BHE en ratones hembra no preñados como un proxy para comprender la fisiopatología de las complicaciones cerebrales durante la preeclampsia.
Protocolo
La investigación se realizó siguiendo los principios expresados en la Declaración de Helsinki y bajo la autorización de los respectivos Comités de Revisión Ética. Todos los participantes humanos dieron su consentimiento informado antes de la recolección de la muestra, como se informó anteriormente25. Adicionalmente, el Comité de Bioética y Bioseguridad de la Universidad del Bío-Bío aprobó este proyecto (beca Fondecyt 1200250). El trabajo con animales se llevó a cabo de acuerdo con los principios cardinales de las tres R en el uso de animales en experimentación35, y de acuerdo con las recomendaciones de las guías para el Cuidado y Uso de Animales de Laboratorio publicadas por el Instituto Nacional de Salud de los Estados Unidos. Los animales fueron mantenidos en ambientes apropiados en el Vivarium de la Universidad del Bío-Bío. Las placentas frescas (n = 4) se obtuvieron dentro de 1 h después de la cesárea electiva de madres (28-31 años) con embarazos normales a término (38 a 41 semanas de gestación). Las cesáreas se realizaron en el Hospital Clínico Herminda Martín, Chillán, Chile, como se informó previamente25. Para aplicar el modelo in vivo se utilizaron ratones hembra no preñada de 4-6 meses de edad (cepa C57BLACK/6). Se dividieron en tres grupos experimentales: (1) control (sin tratamiento), (2) tratados con sEVs de normoxia (sEVs-Nor), y (3) tratados con sEVs de placentas hipóxicas cultivadas (sEVs-Hyp), que se utilizaron para evaluar la disrupción de la BHE in vivo25. Todas las soluciones inyectadas fueron estériles. Además, la preparación de los vehículos eléctricos se realizó en condiciones asépticas y bajo una campana de bioseguridad clase II para evitar la contaminación.
1. Explantes de cultivo placentario
- Para extraer explantes de placentas normales del embarazo, consulte el método publicado por Miller et al. 200536.
- Retire con cuidado los coágulos de la placa basal de la placenta humana con pinzas esterilizadas. Extraer pequeños explantes para obtener una extracción final de tejido de 10 g.
- Asegúrese de que los explantes placentarios se eliminen de los cuatro cuadrantes de la porción materna de la placenta. Asegúrese de que se excluyan los tejidos desvitalizados y las áreas calcificadas.
- Para manipular el tejido placentario, hágalo en hielo, en condiciones estériles y dentro de un gabinete de bioseguridad.
- Lavar los explantes (al menos tres veces) con grandes cantidades (cinco volúmenes de los explantes) de solución tampón fosfatada fría (4 °C) (PBS 1x, pH 7,4) para eliminar la mayor cantidad de sangre posible. Centrifugar (252 x g durante 10 min) a temperatura ambiente entre lavados.
- Resuspender 10 g de explantes lavados en 20 mL de medio de cultivo suplementado con suero fetal bovino al 2%, 100 UI/mL de penicilina y 100 μg/mL de estreptomicina (ver Tabla de Materiales).
- Coloque la suspensión en una placa de cultivo de 100 mm. Dejar los explantes durante 2 h en una incubadora a 37 °C con 21% de oxígeno y 5% de CO2.
- Después de eso, vuelva a lavar los explantes con 1x PBS a 37 °C (tres veces). Centrifugar (252 x g durante 10 min) a temperatura ambiente entre lavados.
- Además, resuspender el tejido en 20 mL de medio de cultivo previamente agotado de nanopartículas.
NOTA: Para el agotamiento de nanopartículas, realice ultracentrifugación (120.000 x g durante 18 h a temperatura ambiente) y microfiltración (filtro de 0,22 μm). - Dividir los explantes resuspendidos en dos placas de cultivo (100 mm). Cada placa de cultivo debe incluir 10 mL de explantes resuspendidos.
- A continuación, colocar una de las placas que contienen explantes placentarios en condiciones de cultivo estándar (37 °C con 8% de oxígeno y 5% de CO2), mientras se coloca la otra en una cámara hipóxica con 1% deO2.
NOTA: (OPCIONAL) El análisis de la viabilidad tisular se puede realizar utilizando las mismas extracciones tisulares y el ensayo de bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio (ensayo MTT) como se describe en otra parte37,38. Utilice la concentración total de proteína medida en los homogeneizados de explantes para normalizar los valores de MTT. - Después de 18 h en cultivo, cosechar los medios acondicionados de los explantes en un nuevo tubo de 15 mL.
NOTA: En este paso, los medios acondicionados se pueden congelar (-80 °C) durante un período prolongado (semanas).
2. Aislamiento de sEVs derivados de la placenta
- Aislar los sEV del medio acondicionado utilizando el protocolo de centrifugación diferencial y microfiltración siguiendo los informes publicados anteriormente25,39.
- Realice la centrifugación secuencial para el medio acondicionado cosechado. Los pasos secuenciales de las centrifugaciones son (1) 300 x g durante 10 min, (2) 2000 x g durante 10 min, (3) 10.000 x g durante 30 min y (4) 120.000 x g durante 2 h. Realice las centrifugaciones a temperatura ambiente.
- En todas estas centrifugaciones, utilizando una pipeta de 20-100 μL, recoja cuidadosamente el sobrenadante y deseche el gránulo.
- Una vez hecho esto, pase el último sobrenadante recolectado a través de un filtro de 0,22 μm (ver Tabla de Materiales). Posteriormente, realice una centrifugación adicional a 120.000 x g durante 18 h a temperatura ambiente.
- A continuación, deseche el sobrenadante mientras se resuspende el gránulo (que contiene sEV placentarios) en 500 μL de PBS (pH 7,4) y vuelva a pasar por un filtro de 0,22 μm. Por último, realizar una última centrifugación a 120.000 x g durante 3 h a temperatura ambiente.
- A continuación, vuelva a suspender el gránulo (que contiene sEV placentarios) en 500 μL de PBS (pH 7,4, previamente agotado de sEV) y pase a través de un filtro de 0,22 μm.
- Etiquete las muestras como stock de sEVs-Normoxia (sEVs-Nor) o sEVs-Hypoxia (sEVs-Hyp).
NOTA: Prepare 50-100 μL de alícuotas de los sEV aislados para su posterior experimentación. Los vehículos eléctricos pequeños pueden almacenarse a -80 °C durante un período prolongado (meses). - Caracterizar los sEVs placentarios por tamaño, recuento y marcador proteico de los sEVs, como se informó anteriormente25. El diámetro medio ideal de las partículas de los sEV es de 50-150 nm.
NOTA: La caracterización de los sEVs incluye la detección positiva de CD63, Tsg101, Alix y HSP70 (es decir, para caracterizar la población de sEVs enriquecidos en exosomas). Además, utilice PLAP como marcador de origen placentario25. - Mida la cantidad total de proteína en la solución de sEV utilizando el kit de ensayo de proteína BCA siguiendo las instrucciones del fabricante (consulte la Tabla de materiales).
NOTA: La Figura 1 muestra una descripción general del cultivo de explantes placentarios y el aislamiento de vesículas extracelulares.
3. Inyección de ratones
- Anestesiar al animal en una cámara de inducción anestésica con una distribución de isoflurano al 5% (ver Tabla de Materiales). Verifique el nivel de anestesia con un pellizco en el dedo del pie.
- Después de ~ 40 s, coloque el ratón en el sistema de anestesia usando una máscara facial y mantenga un nivel de anestesia de isoflurano al 2%.
- A continuación, coloque al animal en una plataforma calefactora (véase la tabla de materiales) a una temperatura ambiente de 28 °C. Mantén los ojos lubricados con lágrimas artificiales.
- Antes de inyectar, diluir los sEV placentarios (200 μg de proteína total) con tampón fosfato (pH, 7,4) hasta alcanzar un volumen final de 70 μL.
- Desinfecte el área de inyección con etanol al 70% e hisopos de algodón. Asegúrese de usar una jeringa de insulina con una aguja de 30 G para inyectar la solución de sEV.
NOTA: La jeringa se puede colocar en la plataforma de calentamiento durante 5 minutos para adquirir una temperatura fisiológica. - Luego, inyecte la solución en la vena yugular externa. Este paso necesita un entrenamiento especial.
NOTA: El procedimiento debe realizarse con precaución, retrayendo lentamente la aguja y aspirando suavemente hasta evidenciar reflujo sanguíneo. - Después de la inyección, aplique una ligera presión en el área inyectada durante ~ 15 s con un hisopo de algodón seco. Después de eso, regrese a los animales a sus respectivas jaulas.
- Asegúrese de evaluar la conciencia y el comportamiento durante 15 minutos. Un indicador del logro de la conciencia es la recuperación animal de la actividad motora total.
NOTA: Asegúrese de mantener una temperatura cálida en las jaulas de los animales.
4. Escala rápida de coma murino y comportamiento (RMCBS)
- Utilizar el RMCBS para evaluar los parámetros neurológicos y de bienestar de los animales40.
NOTA: RMCBS permite una evaluación rápida (~ 3 min) con un estrés mínimo del animal debido a la intervención del operador. RMCBS tiene diez parámetros (cada puntuación es de 0 a 2). - Evalúe el bienestar del ratón con la escala RMCBS a las 0 h (antes de inyectar sEV) y a las 3 h, 6 h, 12 h y 24 h después de la inyección.
NOTA: Realizar análisis de claudina-5 (a las 6 h después de la inyección de sEVs) y la extravasación azul de Evan (a las 24 h después de la inyección de sEVs) para evaluar la disrupción de la BHE (Figura 2).
5. Análisis de la extravasación azul de Evan
- Después de la inyección de sEVs placentarios (24 h), anestesiar a los ratones como se describe en el paso 3.1.
- Prepare la solución azul de Evan (2%, diluida en solución tampón de fosfato, 1x) (consulte la tabla de materiales).
- Utilizando el acceso retroorbital25, inyectar la solución de Evan's Blue a 2 mL/kg.
- Deje que la solución azul de Evan circule durante 20 minutos bajo el mantenimiento de la anestesia.
- A continuación, realice la perfusión intracardíaca siguiendo el protocolo41 descrito anteriormente con solución salina (~3 ml, 0,9%, p/v) para eliminar el colorante azul de Evan de la circulación. Este paso es obligatorio.
NOTA: Para este procedimiento, aumente la anestesia al 5% y verifique un plano profundo de anestesia (es decir, una reducción drástica de la frecuencia respiratoria). - Exponer el corazón mediante toracotomía medial41 (Figura 3).
- Después de eso, fije todo el animal con una infusión intracardíaca de solución de paraformaldehído (4% en PBS, v/v).
NOTA: Compruebe la rigidez de la cola para controlar la fijación adecuada. - Además, una vez completada la fijación, extrae cuidadosamente el cerebro, pésalo y fotografíalo41. Tome fotografías con todo el cerebro cerca de una regla42.
- A continuación, coloque el cerebro en una cortadora de ratón de cerebro (consulte la Tabla de materiales).
- Diseccionar el cerebro en nueve secciones, grulla-caudal, incluyendo el cerebelo (100 μm cada sección).
- Después de la disección, visualice y capture imágenes de los cortes de cerebro en un microscopio con zoom estereoscópico (ver Tabla de materiales).
- Utilice las imágenes capturadas para cuantificar la extravasación azul de Evan utilizando el software ImageJ (consulte la Tabla de materiales).
NOTA: Para analizar la presencia del colorante azul de Evan, establezca los valores de azul de Evan utilizando un control positivo de la sección del cerebro (de un animal control inyectado con tinte pero sin perfusión intracárdica). Los valores de azul de Evan alcanzados por el control positivo están generalmente entre 75 y 110 en el histograma de intensidad del canal azul (Figura 4). - Asegúrese de que las imágenes cerebrales sean analizadas a ciegas por el grupo experimental respectivo para evitar el sesgo del observador. Alternativamente, cuantifique la extravasación azul de Evan mediante homogeneización cerebral seguida de espectroscopía43.
NOTA: En experimentos separados, utilizando cerebros recién aislados de ratones inyectados en sEVs (6 h), analice los niveles de proteína de claudina 5 (CLND-5) (ver Tabla de Materiales), una unión estrecha crítica involucrada en la estrechez de la BBB44 (Figura 5).
Resultados
Este protocolo evalúa la capacidad de los sEVs derivados de placentas cultivadas en hipoxia para alterar la BHE en ratones no preñados. Este método permite comprender mejor la posible conexión entre la placenta y el cerebro en condiciones normales y patológicas. En particular, este método puede constituir un proxy para analizar la participación de los sEV placentarios en la aparición de complicaciones cerebrales en la preeclampsia.
A diferencia de los ratones inyectados con sEVs-Nor, los ratones inyectados con sEVs-Hyp muestran una disminución progresiva de la puntuación neurológica hasta las 24 h (Tabla 1), lo que sugiere la capacidad de sEVs-Hyp para alterar la función cerebral.
Además, los cerebros de los ratones del grupo inyectado con sEVs-Hyp tienen un peso fresco más alto que los aislados de ratones inyectados con sEVs-Nor o ratones control (0,51 ± 0,008; 0,46 ± 0,008; 0,47 ± 0,01 g, respectivamente), lo que puede constituir un indicador macroscópico de edema cerebral45.
Compatible con este hallazgo, este protocolo permite identificar la extravasación azul de Evan como un indicador de alteración de la BHE. En ese sentido, los cerebros de ratones inyectados con sEVs-Hyp tienen una mayor extravasación azul de Evan que los cerebros del grupo sEVs-Nor (Figura 5A).
Aunque el mecanismo subyacente de disrupción de la BHE inducida por sEVs-Hyp no se analizó con este protocolo, los resultados también indican que los ratones inyectados con sEVs-Hyp mostraron cantidades reducidas de proteína de CLND-5 en las áreas en las que la BHE estaba más afectada (es decir, áreas posteriores) (Figura 5B). Por lo tanto, es factible que sEVs-hyp perjudique la expresión de la función de esta proteína crítica de unión estrecha endotelial.
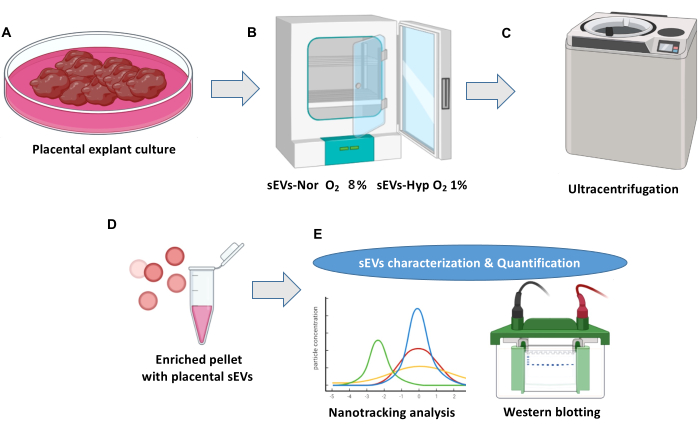
Figura 1: Cultivo de explante placentario y protocolo de aislamiento de vesículas extracelulares. (A) Cultivos normales de explantes de placenta. (B) Los explantes se distribuyen en dos condiciones para la biogénesis de las pequeñas vesículas extracelulares (sEV) placentarias. Normoxia (sEVs-Nor, 8% O2) o hipoxia (sEVs-Hyp, 1% O2) durante 18 h. (C) Los medios acondicionados se cosechan, filtran y centrifugan para eliminar los restos celulares. (D) Los sEV se aíslan mediante ultracentrifugaciones. (E) Los sEV se caracterizan mediante análisis de nanoseguimiento y Western blot. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Evaluación in vivo del protocolo de disrupción de la barrera hematoencefálica. Se utilizan ratones C57BL6/J no preñados, de 4 a 6 meses de edad. (A) A través de la vena yugular externa, los animales recibieron sEVs (200 μg de proteína total) aislados de cultivos placentarios normóxicos (sEVs-Nor, 8% O2) o hipóxicos (sEVs-Hyp, 1% O2). El RMCBS se controla a las 0-24 h después de la inyección. (B) 6 h después de la inyección de sEV, los cerebros se extraen y se seccionan en nueve segmentos para la extracción de proteínas. La claudina 5 (CLDN5) se analiza en homogeneizados de esas nueve secciones. (C) Se analizó el análisis de extravasación azul de Evan (24 h después de la inyección de sEVs) después de la inyección de punción retroorbitaria en cada uno de los nueve segmentos. Haga clic aquí para ver una versión más grande de esta figura.
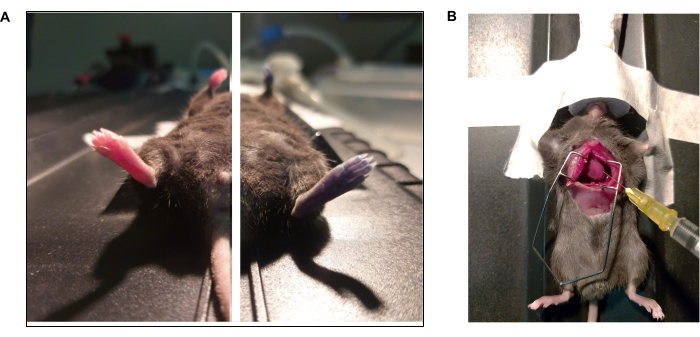
Figura 3: Documentales fotográficos del colorante azul y el protocolo de perfusión intracardíaca de Evan. (A) El ratón recibió el azul de Evan a través de una inyección retroorbital. (Izquierda) Animal antes y (derecha) después de la inyección (15 s) de azul de Evan. (B) Toracotomía para realizar perfusión intracardíaca de solución tampón de fosfato (1x PBS) y paraformaldehído (PFA al 4%). El ventrículo izquierdo se apunta con la punta de la aguja. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Análisis de la extravasación azul de Evan después de la inyección de sEVs. (A) Imagen representativa de todo el cerebro que muestra la extravasación azul de Evan. La línea discontinua representa nueve secciones obtenidas de todo el cerebro. (B) Cerebro diseccionado con una cortadora de ratones cerebrales. (C) Imágenes representativas de cortes de cerebro a las 24 h después de la inyección de sEVs. Control (CTL), placenta en condiciones normóxicas (sEVs-Nor) o hipóxicas (sEVs-Hyp). Barra de escala = 0,4 cm. (D) Contorno digital del corte de cerebro utilizando ImageJ. (E) Histograma en el canal azul. Los valores entre 75 y 110 se asocian con la extravasación azul de Evan. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Extravasación azul de Evan y niveles de claudina-5 en ratones inyectados con sEVs aislados de explantes placentarios. (A) Porcentaje de extravasación azul (EB) de Evan considerando todas las secciones cerebrales. Control (CTL, azul), placenta en condiciones normóxicas (sEVs-Nor, rojo) o hipóxicas (sEVs-Hyp, verde). (B) Los niveles relativos de claudina 5 (CLDN5) en las nueve secciones cerebrales se obtuvieron de los tres grupos experimentales. β-actina se utiliza como control de carga. Los valores son medios ± rango intercuartílico. Cada punto representa a un sujeto experimental individual. *p < 0,05, **p < 0,005. p < 0,0001. p < 0,001; Prueba de ANOVA seguida de la prueba posterior de Bonferroni. Haga clic aquí para ver una versión más grande de esta figura.
| Tiempo (h) | Control | sEVs-Normoxia | sEVs-Hipoxia | ANOVA |
| 0 | 18,75 ± 0,250 | 18,5 ± 0,288 | 18,75 ± 0,250 | Ns |
| 3 | 18,5 ± 0,866 | 17 ± 0,707 | 13.25 ± 1.750*α | 0.006 |
| 6 | 19,25 ± 0,750 | 17 ± 0,577 | 11.75 ± 1.250*α | 0.002 |
| 12 | 18,5 ± 0,645 | 16.75 ± 1.109 | 13 ± 0.816*α | 0.001 |
| 24 | 19,5 ± 0,288 | 17,75 ± 0,250 | 10.25 ± 0.853*α | <0,0001 |
| *p < 0,01 frente al control. αp < 0,01 frente a sEVs-Normoxia | ||||
Tabla 1: Escala rápida de coma murino y comportamiento (RMCBS) después de 24 h después de la inyección de sEVs. La puntuación se expresa como media ± SEM. Las puntuaciones más cercanas a 20 de los animales son estándar, mientras que cuanto más baja es la puntuación, mayor es la disfunción del SNC.
Discusión
Este estudio revela nuevos conocimientos sobre el daño potencial resultante de los sEV aislados de explantes placentarios cultivados en condiciones hipóxicas en la alteración de la barrera hematoencefálica de roedores. El mecanismo patológico implica una reducción de la CLND-5 en la región posterior del cerebro25.
Investigaciones previas han revelado que los plasma-sEVs de individuos con preeclampsia inducen disfunción endotelial en diversos órganos utilizando modelos in vitro 46,47. Esta investigación examinó particularmente la barrera hematoencefálica, ofreciendo una perspectiva novedosa sobre los SEV aislados de placenta cultivada con hipoxia, que altera esta barrera vital. Estos descubrimientos introducen un nuevo ámbito de investigación en el que los sEV pueden servir como un canal de comunicación entre la placenta y el cerebro tanto en escenarios normales como patológicos, como la preeclampsia.
El protocolo presentado es sencillo, pero hay varios pasos críticos que merecen ser mencionados. Este protocolo requiere placentas frescas dentro de 1 h después del parto. También desaconsejamos extender el período de cultivo más allá de 24 h para evitar la degradación de los tejidos. Este protocolo mitiga la posible contaminación de los sEV producidos por las placentas de los ratones. El análisis digital de la extravasación azul de Evan requiere mucho tiempo. Además, la tinción azul de Evan es menos conspicua después de la sección del cerebro. Por lo tanto, se recomienda una configuración inicial para identificar el rango azul mediante un control positivo. También se puede emplear un control negativo, como un cerebro de un ratón que no se sometió a la inyección azul de Evan. El análisis ciego de los grupos experimentales es imperativo para evitar posibles sesgos del observador.
Pueden surgir varios desafíos durante este protocolo. Una limitación importante radica en la variabilidad biológica que se origina tanto en placentas humanas como en ratones inyectados. Para garantizar la reproducibilidad de los experimentos de extravasación azul de Evan, se sugiere establecer dosis de sEV aisladas de placentas humanas. Se optó por una dosis de 200 μg de proteína total; sin embargo, esta cantidad puede fluctuar en función de la pureza de las vesículas, la eficacia de la inyección yugular, la administración de azul de Evan, su eliminación del sistema circulatorio y, no menos importante, el impacto biológico de los sEV teniendo en cuenta su contenido.
Los mecanismos celulares por los cuales los sEV de la placenta humana pueden alterar la barrera hematoencefálica requieren experimentación adicional. Sin embargo, este método tiene relevancia, insinuando una posible comunicación entre la placenta y el cerebro, lo que justifica una mayor exploración. Por lo tanto, se fomentan futuras investigaciones, concentrándose en los sEV y sus interacciones con la barrera hematoencefálica, así como el impacto de su carga en los tejidos neuronales. Si el deterioro de la barrera hematoencefálica conduce a consecuencias duraderas para el cerebro materno merece un examen más profundo.
Divulgaciones
Los autores no tienen ningún conflicto de intereses que declarar.
Agradecimientos
Los autores agradecen a los investigadores pertenecientes a GRIVAS Health su valiosa aportación. Asimismo, las parteras y el personal clínico del Servicio de Obstetricia y Ginecología pertenecen al Hospital de Chillán, Chile. Fundada por Fondecyt Regular 1200250.
Materiales
| Name | Company | Catalog Number | Comments |
| Adult mice brain slecer matrice 3D printed | Open access file | Adult mice | Adult mice brain slicer. Printed in PLA filament. |
| Anti β-Actin primary antibody | Sigma-Aldrich | Clon AC-74 | Antibody for loading control (Western blot) |
| Anti-Claudin5 primary antibody | Santa cruz Biotechnology | sc-374221 | Primary antibody for tight junction protein CLDN5 of mice BBB (Western blot) |
| BCA protein kit | Thermo Scientific | 23225 | Kit for measuring protein concentration |
| Culture media #200 500 mL | Thermo Fisher Scientific | m200500 | Culture media for placental explants |
| D180 CO2 incubator | RWD Life science | D180 | Standard incubator to estabilize explants and culture sEVs-Nor |
| Evans blue dye > 75% 10 g | Sigma-Aldrich | E2129.10G | Dye to analize blood brain barrier disruption IN VIVO |
| Fetal bovine serum 500 mL | Thermo Fisher Scientific | 16000044 | Additive growth factor for culture media 200 |
| Himac Ultracentrifuge CP100NX | Himac eppendorf group | 5720410101 | Ultracentrifuge for condicioned media > 1,20,000 x g |
| ImageJ software | NIH | https://imagej.nih.gov/ij/download.html | |
| Isoflurane x 100 mL | USP Baxter | 212-094 | Volatile inhalated anaesthesia agent for mice |
| Kit CellTiter 96 Non-radioactive | Promega | 0000105232 | In vitro assay for placental explants viability |
| Mouse IgG Secondary antibody | Thermo Fisher Scientific | MO 63103 | Secondary antibody for CLDN5 (western blot) |
| NanoSight NS300 | Malvern Panalytical | 90278090 | Nanotracking analysis of particles from placental explants condicioned media |
| Paraformaldehide E 97% solution 500 mL | Thermo Fisher Scientific | A11313.22 | Fixative solution for brain tissue slices and intracardial perfusion (once diluted) |
| PBS 1 X pH 7.4 500 mL | Thermo Fisher Scientific | 10010023 | Wash solution for placenta explants |
| Peniciline-streptomicine 100x 20 mL | Thermo Fisher Scientific | 10378016 | Antiobiotics for placental explants culture media |
| ProOX C21 Cytocentric O2 and CO2 Subchamber Controller | BioSpherix | SCR_021131 | CO2 regulator to induce Hypoxia in sealed chamber for sEVs-Hyp |
| Sodium Thiopental 1 g | Chemie | 7061 | humanitarian euthanasia agent |
| Somnosuite low flow anesthesia system | Kent Scientifics | SS-01 | Isoflurane vaporizer for small rodents |
| Surgical Warming platform | Kent Scientifics | A41166 | Warming platform for mainteinance anesthesia in mice |
| Syringe Filters, Polytetrafluoroethylene (PTFE), Hydrophobic, 0.22 µm, Sterile, 25 mm | Southern labware | 10026 | Filtration of condicioned media harvested from placental explants |
| Tabletop High-Speed Micro Centrifuges HITACHI himac CT15E/CT15RE | Hitachi medical systems | 6020 | Serial centrifugations of condicioned media < 1,20, 000 x g |
| Trinocular stereomicroscope transmided and reflective light 10x-160x | Center Medical | 2597 | Stereomicroscope to register brain slices |
Referencias
- Lisonkova, S., Joseph, K. S. Incidence of preeclampsia: risk factors and outcomes associated with early- versus late-onset disease. Am J Obstet Gynecol. 209 (544), 544.e1-544.e12 (2013).
- Sibai, B., Dekker, G., Kupferminc, M. Preeclampsia. Lancet. 365 (9461), 785-799 (2005).
- Hammer, E. S., Cipolla, M. J. Cerebrovascular dysfunction in preeclamptic pregnancies. Curr Hypertens Rep. 17 (8), 64(2015).
- Okanloma, K. A., Moodley, J. Neurological complications associated with the preeclampsia/eclampsia syndrome. Int J Gynaecol Obstet. 71, 223-225 (2000).
- Frias, A. E., Belfort, M. A. Post magpie: how should we be managing severe preeclampsia. Curr Opin Gynecol Obstet. 15 (6), 489-495 (2003).
- Familari, M., Cronqvist, T., Masoumi, Z., Hansson, S. R. Placenta-derived extracellular vesicles: Their cargo and possible functions. Reprod Fertil Dev. 29 (3), 433-447 (2017).
- Montoro-Garcia, S., Shantsila, E., Marin, F., Blann, A., Lip, G. Y. Circulating microparticles: new insights into the biochemical basis of microparticle release and activity. Basic Res Cardiol. 106, 911-923 (2011).
- Germain, S. J., Sacks, G. P., Sooranna, S. R., Sargent, I. L., Redman, C. W. Systemic inflammatory priming in normal pregnancy and preeclampsia: the role of circulating syncytiotrophoblast microparticles. J Immunol. 178 (9), 5949-5956 (2007).
- Tannetta, D., Masliukaite, I., Vatish, M., Redman, C., Sargent, I. Update of syncytiotrophoblast derived extracellular vesicles in normal pregnancy and preeclampsia. J Reprod Immunol. 119, 98-106 (2017).
- Collett, G. P., Redman, C. W., Sargent, I. L., Vatish, M. Endoplasmic reticulum stress stimulates the release of extracellular vesicles carrying danger-associated molecular pattern (DAMP) molecules. Oncotarget. 9 (6), 6707-6717 (2018).
- Cooke, W. R., et al. Maternal circulating syncytiotrophoblast-derived extracellular vesicles contain biologically active 5'-tRNA halves. Biochem Biophys Res Commun. 518 (1), 107-113 (2019).
- Gill, M., et al. Placental syncytiotrophoblast-derived extracellular vesicles carry active nep (neprilysin) and are increased in preeclampsia. Hypertension. 73 (5), 1112-1119 (2019).
- Kandzija, N., et al. Placental extracellular vesicles express active dipeptidyl peptidase IV; levels are increased in gestational diabetes mellitus. J Extracell Vesicles. 8 (1), 1617000(2019).
- Motta-Mejia, C., et al. Placental vesicles carry active endothelial nitric oxide synthase and their activity is reduced in preeclampsia. Hypertension. 70 (2), 372-381 (2017).
- Sammar, M., et al. Reduced placental protein 13 (PP13) in placental derived syncytiotrophoblast extracellular vesicles in preeclampsia - A novel tool to study the impaired cargo transmission of the placenta to the maternal organs. Placenta. 66, 17-25 (2018).
- Burton, G. J., Woods, A. W., Jauniaux, E., Kingdom, J. C. Rheological and physiological consequences of conversion of the maternal spiral arteries for uteroplacental blood flow during human pregnancy. Placenta. 30 (6), 473-482 (2009).
- Warrington, J. P., et al. Placental ischemia in pregnant rats impairs cerebral blood flow autoregulation and increases blood-brain barrier permeability. Physiological Reports. 2 (8), e12134-e12134 (2014).
- Warrington, J. P., Drummond, H. A., Granger, J. P., Ryan, M. J. Placental Ischemia-induced increases in brain water content and cerebrovascular permeability: Role of TNFα. Am J Physiol Regul Integr Comp Physiol. 309 (11), R1425-R1431 (2015).
- Johnson, A. C., et al. Magnesium sulfate treatment reverses seizure susceptibility and decreases neuroinflammation in a rat model of severe preeclampsia. PLoS ONE. 9 (11), e113670(2014).
- Escudero, C. A., et al. Role of extracellular vesicles and microRNAs on dysfunctional angiogenesis during preeclamptic pregnancies. Front Physiol. 7, 1-17 (2016).
- Salomon, C., et al. Placental exosomes as early biomarker of preeclampsia: Potential role of exosomalmicrornas across gestation. J Clin Endocrinol Metab. 102 (9), 3182-3194 (2017).
- Knight, M., Redman, C. W., Linton, E. A., Sargent, I. L. Shedding of syncytiotrophoblast microvilli into the maternal circulation in pre-eclamptic pregnancies. Br J Obstet Gynaecol. 105 (6), 632-640 (1998).
- Gilani, S. I., Weissgerber, T. L., Garovic, V. D., Jayachandran, M. Preeclampsia and extracellular vesicles. Curr Hypertens Rep. 18 (9), 68(2016).
- Dutta, S., et al. Hypoxia-induced small extracellular vesicle proteins regulate proinflammatory cytokines and systemic blood pressure in pregnant rats. Clin Sci (Lond). 134 (6), 593-607 (2020).
- Leon, J., et al. Disruption of the blood-brain barrier by extracellular vesicles from preeclampsia plasma and hypoxic placentae: attenuation by magnesium sulfate. Hypertension. 78 (5), 1423-1433 (2021).
- Han, C., et al. Placenta-derived extracellular vesicles induce preeclampsia in mouse models. Haematologica. 105 (6), 1686-1694 (2020).
- Amburgey, O. A., Chapman, A. C., May, V., Bernstein, I. M., Cipolla, M. J. Plasma from preeclamptic women increases blood-brain barrier permeability: role of vascular endothelial growth factor signaling. Hypertension. 56 (5), 1003-1008 (2010).
- Cipolla, M. J., et al. Pregnant serum induces neuroinflammation and seizure activity via TNFalpha. Exp Neurol. 234 (2), 398-404 (2012).
- Bergman, L., et al. Preeclampsia and increased permeability over the blood brain barrier - a role of vascular endothelial growth receptor 2. Am J Hypertens. 34 (1), 73-81 (2021).
- Torres-Vergara, P., et al. Dysregulation of vascular endothelial growth factor receptor 2 phosphorylation is associated with disruption of the blood-brain barrier and brain endothelial cell apoptosis induced by plasma from women with preeclampsia. Biochim Biophys Acta Mol Basis Dis. 1868 (9), 166451(2022).
- Schreurs, M. P., Houston, E. M., May, V., Cipolla, M. J. The adaptation of the blood-brain barrier to vascular endothelial growth factor and placental growth factor during pregnancy. FASEB J. 26 (1), 355-362 (2012).
- Schreurs, M. P., Cipolla, M. J. Cerebrovascular dysfunction and blood-brain barrier permeability induced by oxidized LDL are prevented by apocynin and magnesium sulfate in female rats. J Cardiovasc Pharmacol. 63 (1), 33-39 (2014).
- Schreurs, M. P. H., et al. Increased oxidized low-density lipoprotein causes blood-brain barrier disruption in early-onset preeclampsia through LOX-1. FASEB J. 27 (3), 1254-1263 (2013).
- Escudero, C., et al. Brain vascular dysfunction in mothers and their children exposed to preeclampsia. Hypertension. 80 (2), 242-256 (2023).
- Russell, W. M. S., Burch, R. L. The principles of humane experimental technique. Universities Federation of Animal Welfare. , https://awionline.org/lab-animal-search/russell-w-m-s-burch-r-l-1959-principles-humane-experimental-technique-methuen-co (1959).
- Miller, R. K., et al. Human placental explants in culture: approaches and assessments. Placenta. 26 (6), 439-448 (2005).
- Troncoso, F. A. J., Herlitz, K., Ruiz, F., Bertoglia, P., Escudero, C. Elevated pro-angiogenic phenotype in feto-placental tissue from gestational diabetes mellitus. Placenta. 36 (4), 2(2015).
- Zhang, H. C., et al. Microvesicles derived from human umbilical cord mesenchymal stem cells stimulated by hypoxia promote angiogenesis both in vitro and in vivo. Stem Cells Dev. 21 (18), 3289-3297 (2012).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. Chapter 3 (Unit 3), 22(2006).
- Carroll, R. W., et al. A rapid murine coma and behavior scale for quantitative assessment of murine cerebral malaria. PLoS One. 5 (10), e13124(2010).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio Protoc. 11 (5), e3988(2021).
- Walchli, T., et al. Quantitative assessment of angiogenesis, perfused blood vessels and endothelial tip cells in the postnatal mouse brain. Nat Protoc. 10 (1), 53-74 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Sci Rep. 4, 6588(2014).
- Morita, K., Sasaki, H., Furuse, M., Tsukita, S. Endothelial claudin: claudin-5/TMVCF constitutes tight junction strands in endothelial cells. J Cell Biol. 147 (1), 185-194 (1999).
- Lara, E., et al. Abnormal cerebral microvascular perfusion and reactivity in female offspring of reduced uterine perfusion pressure (RUPP) mice model. J Cereb Blood Flow Metab. 42 (12), 2318-2332 (2022).
- Chang, X., et al. Exosomes from women with preeclampsia induced vascular dysfunction by delivering sflt (soluble fms-like tyrosine kinase)-1 and seng (soluble endoglin) to endothelial cells. Hypertension. 72, 1381-1390 (2018).
- Smarason, A. K., Sargent, I. L., Starkey, P. M., Redman, C. W. The effect of placental syncytiotrophoblast microvillous membranes from normal and pre-eclamptic women on the growth of endothelial cells in vitro. BJOG. 100 (10), 943-949 (1993).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados